Method Article
Um ensaio de fluorescência para avaliar a permeabilidade de uma barreira endotelial microvascular cardíaca em um modelo de isquemia/reperfusão de ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Descrevemos aqui um método para avaliar funcionalmente a barreira endotelial dos microvasos cardíacos após lesão de isquemia/reperfusão por meio da medição da intensidade média de fluorescência de 70.000 Da FITC-dextrano extravasado em comparação com Evans Blue.
Resumo
As terapias de revascularização das artérias culpadas, independentemente da intervenção coronária percutânea e da cirurgia de revascularização do miocárdio, são consideradas a melhor estratégia para melhorar o prognóstico clínico de pacientes com síndrome coronariana aguda (SCA). No entanto, a reperfusão miocárdica após revascularização efetiva pode desencadear morte significativa de cardiomiócitos e colapso endotelial coronariano, conhecido como lesão de isquemia/reperfusão miocárdica (MIRI). Normalmente, as células endoteliais e suas junções intercelulares mantêm cooperativamente a barreira endotelial microvascular e sua permeabilidade relativamente baixa, mas falham nas áreas de reperfusão.
A hiperpermeabilidade endotelial microvascular induzida por isquemia/reperfusão (RI) contribui para edema miocárdico, aumento da infiltração de células pró-inflamatórias e agravamento da hemorragia intramiocárdica, o que pode piorar o prognóstico da SCA. O marcador usado neste estudo - 70.000 Da FITC-dextrana, uma molécula de glicose ramificada marcada por isotiocianato de fluoresceína (FITC) - parece muito grande para se infiltrar no endotélio microvascular cardíaco em condições normais. No entanto, é capaz de se infiltrar em uma barreira quebrada após o MIRI. Assim, quanto maior a permeabilidade endotelial, mais FITC-dextrana se acumula no espaço intercelular extravascular. Assim, a intensidade da fluorescência do FITC pode indicar a permeabilidade da barreira endotelial microvascular. Este protocolo aproveita o FITC-dextrano para avaliar funcionalmente a barreira endotelial microvascular cardíaca, que é detectada por um sistema automatizado de imagem patológica quantitativa.
Introdução
O fato de um número crescente de pacientes com doenças coronarianas ter se beneficiado de terapias de revascularização por décadas não nega as consequências fatais do MIRI. Conforme descrito por Yellon e Hausenloy, aproximadamente 30% do tamanho final do infarto pode ser atribuído ao MIRI1. A disfunção endotelial microvascular cardíaca é o mecanismo central subjacente ao MIRI e ao fenômeno "no-reflow" e é alvo de muitos agentes cardioprotetores e vias cardioprotetoras clássicas2. Além disso, a hiperpermeabilidade endotelial dos microvasos pode desencadear edema miocárdico3 e infiltração excessiva de células pró-inflamatórias, incluindo neutrófilos4, macrófagos e ertrócitos5.
O estresse oxidativo induzido por MIRI e citocinas pró-inflamatórias superexpressas, como os membros da família6 do fator de necrose tumoral ea família 7 da interleucina, ativam vias de sinalização da apoptose celular para acelerar a morte do miocárdio isquêmico. Os eritrócitos penetram na barreira endotelial vulnerável e se acumulam na matriz extracelular (MEC) para formar hematoma intramiocárdico8. As metaloproteinases da matriz derivadas de macrófagos e neutrófilos desmontam o colágeno na MEC, o que aumenta o risco de complicações mecânicas e aneurisma ventricular pós-infarto9. Assim, a permeabilidade da barreira endotelial é um sinal crucial para a avaliação prognóstica do infarto agudo do miocárdio e marca a gravidade do MIRI em algum grau.
O FITC-dextrano é uma matriz de polissacarídeos composta por diferentes comprimentos de moléculas ramificadas de glicose de peso molecular variando de 4.000 Da a 70.000 Da. É amplamente utilizado como traçador padrão para demonstrar a permeabilidade das membranas celulares, barreiras fisiológicas funcionais, como a barreira hematoencefálica10, e membranas mucosas11 sob tratamentos específicos e condições patológicas. A permeabilidade de uma membrana específica varia para diferentes substâncias de acordo com seus pesos moleculares. Normalmente, a albumina é restrita aos microvasos cardíacos; no entanto, pode penetrar no endotélio no estágio inicial da RI, causando edema miocárdico. Como o peso molecular da albumina é de aproximadamente 68.000 Da, 70.000 Da FITC-dextrano seria um agente adequado para demonstrar hiperpermeabilidade endotelial após IR. Além disso, o dextrano tem sido amplamente adotado para manter o volume sanguíneo e a pressão osmótica coloidal de pacientes em choque, e os traçadores marcados com FITC são usados em vários estudos in vivo ou in vitro com poucos efeitos adversos.
Além do FITC-dextrano, a permeabilidade endotelial foi medida com a coloração Evans Blue (EB). Após a injeção na circulação sanguínea, a EB se liga firmemente à albumina sérica e forma um complexo12. Assim, este complexo EB-albumina, não apenas EB, pode ser usado para a medição da permeabilidade, o que significa que a precisão de tal método baseado em EB pode ser influenciada por diferentes concentrações de albumina sérica em sujeitos experimentais. Além disso, foi relatado que a EB envenena os órgãos de animais experimentais, especialmente o coração, fígado e pulmões, por meio de degeneração celular e aumento da permeabilidade vascular13. O endotélio submetido a isquemia/reperfusão seria mais sensível a esses efeitos prejudiciais do que o endotélio normal, o que pode confundir a significância dos resultados experimentais.
Comparado ao corante EB, o FITC-dextrano é exógeno e a afinidade de ligação à albumina é insignificante. Portanto, o FITC-dextrano permanece no estado livre e não está ligado a macromoléculas, como albumina e proteínas teciduais. Assim, se administrado de acordo com o peso corporal, o FITC-dextrano pode funcionar em igual concentração sanguínea e não é afetado por diferenças individuais na concentração sérica de albumina e no volume sanguíneo. Tongxinluo (TXL), uma medicina tradicional chinesa, foi usada para testar a sensibilidade diagnóstica desse método. O TXL reduz o IRMI, mantendo a ultraestrutura celular endotelial e a integridade da barreira endotelial14. O TXL também é usado para curar angina pectoris e melhorar clinicamente o no-reflow do miocárdio após o infarto15. Contém Radix ginseng, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi e Borneolum syntheticum. Demonstrou-se que o TXL protege o endotélio microvascular por meio da via MEK/ERK16 e dos mecanismos mediados pela óxido nítrico sintaseendotelial 5,17 e alivia a lesão de isquemia/reperfusão (IRI) de órgãos18, especialmente o coração, de maneira dose-dependente. Aqui, os ratos foram alimentados com 0,5 g / kg de pó de TXL (uma dose equivalente à usada clinicamente em humanos), conforme descrito19. Este artigo fornece um método para avaliar funcionalmente a barreira endotelial de microvasos cardíacos após IR por meio da medição da intensidade de fluorescência total de 70.000 Da extravasado FITC-dextrano em comparação com EB.
Protocolo
Os experimentos com animais foram realizados de acordo com o "Guia para o Cuidado e Uso de Animais de Laboratório" emitido pelos Institutos Nacionais de Saúde dos EUA (Bethesda, MD, EUA, Publicação NIH nº 85-23, revisada em 1996) e o "Regulamento para o Cuidado e Uso de Animais Experimentais" do Conselho de Cuidados com Animais de Pequim (1996). O protocolo do estudo foi aprovado pelo Comitê de Cuidados com Animais Experimentais do Hospital Fuwai. Ratos Sprague-Dawley machos da classe SPF (ratos SD) pesando 150-180 g foram usados neste estudo.
1. Preparação de reagentes, materiais e equipamentos
- Prepare reagentes e soluções, incluindo etanol a 70%, FITC-dextrano (70.000 Da, dissolvido em solução salina gelada para fazer solução a 10% p/v para uso), creme depilatório, meio de montagem com 4',6-diamidino-2-fenilindol (DAPI, 0,5-10 μg/mL), 1% p/v EB/solução salina e 5% p/v pentobarbital sódico/solução salina (armazenado a 4 °C no escuro).
- Esterilize todas as ferramentas e materiais cirúrgicos com antecedência, incluindo fita cirúrgica; compressas de gaze; luvas cirúrgicas; Tubo endotraqueal 16 G; seringa de insulina; tesouras de operação; pinça de dissecação grande e curva; pinça dissecante reta; pinça de mosquito reta; pinça de mosquito curva; afastadores (30 mm Spread); Porta-microagulhas de 5 cm; sutura de polipropileno 3-0 (agulha cônica); e sutura de polipropileno 6-0 (agulha redonda).
- Verifique e certifique-se de que todos os equipamentos, incluindo o sistema de aquecimento de temperatura constante, sistema de iluminação, ventilador, sistema automatizado de imagem de patologia quantitativa e cortador de congelamento ultravioleta, estejam em boas condições.
2. Preparando os ratos para os procedimentos cirúrgicos
- Divida todos os ratos SD em grupo Sham, grupo IR e grupo TXL (grupo IR+TXL) aleatoriamente.
NOTA: Neste protocolo, seis ratos foram aleatoriamente designados para cada grupo, n=6. - Pese cada rato SD, registre o peso e calcule a dose de TXL a ser administrada para cada rato.
- Administre ibuprofeno na dose de 30 mg / kg por gavagem a cada rato pelo menos 12 h antes da toracotomia para aliviar a dor e o sofrimento pré-operatórios.
- Administrar um pó superfino de TXL na dose de 0,5 g/kg por gavagem 12 h e 1 h a cada rato SD do grupo IR+TXL antes da anestesia, conforme descrito19.
- Desinfete a mesa cirúrgica com etanol 70% e coloque as ferramentas e materiais cirúrgicos esterilizados na superfície desinfetada.
- Ajustar a temperatura do sistema de aquecimento a temperatura constante para manter a temperatura corporal dos ratos a 37 ± 1 °C.
3. Estabelecer um modelo de isquemia/reperfusão cardíaca em ratos
- Injete 5% p / v de solução salina tamponada com pentobarbital sódico / fosfato (PBS) na dose de 50 mg / kg (0,1 mL / 100 g de peso corporal) na cavidade abdominal para anestesiar o rato. Prepare o local da cirurgia removendo cuidadosamente o pelo do pescoço ao peito, barbeando ou usando um creme depilatório.
- Ajuste suavemente a posição da língua conforme necessário com uma pinça esterilizada e limpe a secreção respiratória com bolas de algodão esterilizadas. Mantenha a glote claramente à vista e insira um tubo endotraqueal na traqueia suavemente.
- Conecte o tubo endotraqueal a um ventilador circulando a 65-80 respirações por minuto e ajuste o volume corrente em 4-5 mL fixando a cabeça e os membros do rato.
- Coloque uma cortina estéril sobre o rato, desinfete a área de operação com tintura de iodo seguida de etanol a 70% e repita este procedimento três vezes.
- Faça uma incisão paraesternal esquerda ao nível do quarto espaço intercostal para expor o músculo peitoral maior e o peitoral menor esquerdos.
- Dissecar a fáscia entre o músculo peitoral maior e o peitoral menor usando uma técnica de dissecção romba para expor o quarto espaço intercostal esquerdo.
NOTA: Evite danos excessivos aos tecidos e lesões vasculares que causarão sangramento grave e morte pós-operatória. - Disseque os músculos intercostais, posicione um afastador de tórax dentro do quarto espaço intercostal e, em seguida, espalhe as costelas.
- Rasgue o pericárdio e remova o tecido adiposo aderido.
NOTA: Evite danificar outros órgãos com instrumentos cirúrgicos pontiagudos, especialmente os pulmões. Danos aos pulmões podem resultar no desenvolvimento de pneumotórax e hemopneumotórax durante a operação, causando consequências cacoéticas que vão desde distúrbios hemodinâmicos até redução da sobrevida animal. - Manipule a posição do timo e exponha suavemente a aorta ascendente e os átrios esquerdos. Identifique e ligue a artéria descendente anterior anterior (DA) proximal transitoriamente por 45 min com uma sutura de polipropileno 6-0 (ver Figura 1 A-D).
NOTA: Este procedimento é idêntico para ratos de controle simulado, exceto que o LAD não é ligado. - Remova o afastador de tórax e junte as costelas em um padrão de sutura interrompido com uma sutura de polipropileno 3-0.
- Restaure a pressão intratorácica negativa para garantir uma respiração eficaz.
NOTA: Dois métodos podem ser usados para restaurar a pressão intratorácica negativa: i) antes de fechar a cavidade torácica, os pesquisadores podem obstruir a saída de ar do ventilador por 2 ciclos para inflar os pulmões. ii) O ar restante na cavidade torácica pode ser aspirado com uma seringa após o fechamento do espaço intercostal. - Após a depilação e desinfecção, faça uma incisão no membro inferior direito e disseque a fáscia superficial da veia femoral direita.
- Afrouxar a ligadura e verificar as condições de respiração e circulação após induzir isquemia miocárdica por 45 min.
- Injete 10% (p / v) de solução salina FITC-dextrana na veia femoral a 0,15 mL / 100 g de peso corporal e pressione a veia femoral por 1 min com bolas de algodão estéreis para estancar o sangramento ( Figura 2A , B ).
NOTA: Alternativamente, injete 1% p / v EB / solução salina na veia femoral na dose de 0,5 mL / 100 g de peso corporal. - Costure as incisões com uma sutura de polipropileno 3-0 e desinfete as incisões, seguida de analgesia pós-operatória com ibuprofeno, conforme descrito acima.
4. Preparação de fatias de tecido congelado para medição de fluorescência
- Injete 5% p / v de solução de pentobarbital sódico / PBS na dose de 150 mg / kg (0,3 mL / 100 g de peso corporal) por via intraperitoneal para anestesiar profundamente os ratos após 3 h de reperfusão miocárdica.
- Corte a cavidade abdominal e exponha a aorta abdominal e a veia cava (ver Figura 3A).
- Injete 50 mL de PBS gelado na veia cava de forma constante, corte a aorta abdominal para liberar o sangue do miocárdio e colha o coração.
NOTA: Observe alterações nos pulmões e no fígado. Um fígado suando sugere que a solução salina é injetada com precisão na veia cava (veja na Figura 3C), e um pulmão pálido é considerado um sinal de um miocárdio bem perfundido (veja na Figura 3B). - Em uma sala escura, enxágue o coração em solução salina gelada ou PBS suavemente para remover qualquer sangue restante e FITC-dextrano (ou EB) das câmaras do coração.
- Corte o coração da ligadura e descarte o miocárdio acima da ligadura.
- Incorpore o coração em moldes com composto de incorporação seguido de armazenamento a -80 °C.
- Descarregue os tecidos congelados dos moldes de incorporação e coloque-os em porta-amostras em uma câmara pré-resfriada a -20 °C de um cortador de congelamento.
- Ajuste a espessura de um único corte para 5-8 μm e corte o tecido aproximadamente no ponto médio do eixo base-ápice (por exemplo, o meio da isquemia).
- Carregue o tecido fatiado em lâminas adesivas de microscópio e sele cada fatia com uma gota (aproximadamente 40 μL) de meio de montagem fluorescente contendo DAPI.
- Mantenha as lâminas em uma caixa seca e escura.
NOTA: Se as lâminas não puderem ser digitalizadas imediatamente, guarde-as em local seco, fresco e escuro para evitar a formação de água condensada e extinção de fluorescência.
5. Medição de fluorescência e análise de dados
- Configure o sistema de imagem e verifique o software conectado ao scanner.
- Coloque as lâminas nas prateleiras de lâminas e insira-as no scanner.
- Abra o software do scanner de slides (consulte a Tabela de Materiais) e configure um novo protocolo de exposição clicando em Editar Protocolo | Novo....
NOTA: Se o scanner ou seu software afiliado não estiver disponível, um microscópio confocal a laser (consulte a Tabela de Materiais) ou outros scanners de lâminas comuns com o modo de fluorescência (consulte a Tabela de Materiais) podem ser uma alternativa ao scanner de fluorescência quantitativo automatizado. - Renomeie o protocolo e o estudo e selecione o modo de fluorescência .
- Definir digitalização de slide inteiro | Resolução de pixels e regiões multiespectrais | Resolução de pixel de 0,25 μm (40x), respectivamente.
- Clique em Editar filtros e bandas... para selecionar a coluna Filtros de varredura de slides inteiros e a coluna Bandas de região multiespectral .
NOTA: Se EB for usado, selecione Filtros de varredura de lâmina inteira | DAPI e Texas Red ou AF495. Se o FITC-dextrano for usado, selecione Bandas de região multiespectral | DAPI e FITC ou AF488. - Clique em Editar exposições... e carregue a transportadora.
- Selecione o slot de destino e clique em Obter visão geral.
NOTA: Isso faz uma varredura de campo claro de cada seção do coração. Selecione o miocárdio para focar ou selecione a área às cegas. - Selecione o slide de destino, ajuste a altura do palco para aproximadamente -50 μm e clique em Foco automático.
- Clique em Exposição de varredura completa (ms) -DAPI | Autoexpose.
NOTA: O tempo de exposição do DAPI para cada lâmina não precisa ser o mesmo porque as imagens com DAPI são usadas para ilustrar seções transversais do coração, que são convenientes para delinear a área do miocárdio, mas não para calcular a densidade de fluorescência. - Clique em Exposição de varredura total (ms) -FITC | Autoexpose.
NOTA: Clique em Exposição de varredura completa (ms) - Texas Red | Autoexpor se estiver usando EB. É importante lembrar e garantir que o tempo de exposição do FITC ou Texas Red seja o mesmo em todas as varreduras de lâminas. - Clique em Foco automático novamente e certifique-se de que o slide esteja em foco.
- Clique em Voltar e salve o protocolo.
- Repita as etapas 5.7 a 5.14 para cada slide.
- Retorne à página inicial e clique em Digitalizar slides.
- Selecione um slot, renomeie todos os slides e selecione o protocolo de exposição correspondente para cada slide.
- Digitalize os slides e capture as imagens.
- Abra as imagens com o software visualizador de slides para as digitalizações (consulte a Tabela de Materiais).
- Amplie todas as imagens em uma extensão relativamente igual.
- Instantâneo e salve imagens como .tiff.
NOTA: É melhor salvar as imagens com e sem barras de escala ao mesmo tempo. Imagens com barras de escala podem ser usadas para publicação, enquanto aquelas sem barras de escala podem ser usadas para análise estatística. - Abra o software ImageJ, clique em Analisar e selecione Definir medição.
- Selecione a área | Densidade integrada.
- Abra a imagem no canal FITC com a Imagem J.
- Clique em Analisar novamente e registre o valor numérico de densidade integrada (IntDen) que aparece.
NOTA: Como as barras de escala nas imagens podem ser confundidas com a escala de cinza de fluorescência por computadores, use imagens sem barras de escala para medir IntDen. - Feche a imagem FITC e abra a imagem no canal DAPI.
- Delineie uma seção transversal do miocárdio.
- Clique em Analisar e coletar dados da área .
- Calcule as proporções de IntDen/Area (média de fluorescência) para cada coração.
- Insira todas as proporções no software de análise estatística.
Resultados
Antes de realizar o ensaio FITC-dextrana para avaliar as alterações na permeabilidade endotelial cardíaca após a RI, recomendamos fortemente que os experimentos sejam conduzidos pelo mesmo pesquisador especializado no estabelecimento do modelo de RI do miocárdio em ratos para confirmar que as artérias coronárias estão ocluídas na mesma posição com sucesso, e as relações área isquêmica/área total são constantes entre todos os ratos. Conforme mostrado na Figura 1A,B, o coração (indicado pela seta amarela) foi exposto, e uma alça (indicada pela seta verde) foi formada no miocárdio localizado na parede anterior do ventrículo esquerdo, aproximadamente 2 mm abaixo da borda do apêndice atrial esquerdo com tubo capilar de silicone de 0,5 mm (diâmetro interno) e sutura 6-0. Como visto na Figura 1C, quando a alça foi presa, o miocárdio isquêmico passou de rosa para rosa acinzentado (indicado pela seta branca) imediatamente.
Além disso, o miocárdio reperfundiu e recuperou sua cor rosada imediatamente após o afrouxamento da alça, conforme ilustrado na Figura 1D. Após afrouxar a alça, foi feita uma incisão paralela ao longo eixo do fêmur na parte interna da coxa. A veia femoral foi exposta e puncionada com seringa de insulina, conforme mostrado na Figura 2A,B. Após uma reperfusão de 3 h, foi feita uma incisão em "V" no abdome inferior, e a aorta abdominal e a veia cava foram dissecadas do peritônio (Figura 3A). A solução salina fria foi injetada suavemente na veia cava e a aorta abdominal foi cortada para evitar que a parede ventricular fosse esticada excessivamente devido à pressão intraventricular que afetaria sua estrutura histopatológica. Pulmões branqueados (seta vermelha na Figura 3B) e fígado na Figura 3C indicam que o tecido foi bem reperfundido com solução salina.
Consequentemente, não houve diferença significativa na área de secção transversa entre os três grupos: 1,00 ± 0,08 no grupo Sham vs. 0,97 ± 0,08 no grupo IR vs. 1,02 ± 0,04 no grupo IR+TXL (Figura 4A, n = 6 em cada grupo, p > 0,05 entre dois grupos). Como mostrado na Figura 4B, C, a intensidade média da fluorescência verde em todas as seções de ratos Sham foi extremamente baixa. Em contraste, a fluorescência emitida pelo FITC-dextrano extravasado aumentou acentuadamente no grupo IR, normalizada para o grupo Sham (5,52 ± 0,85 no grupo IR vs. 1,00 ± 0,19 no grupo Sham, n = 6, p < 0,05). Além disso, o pó superfino TXL, conhecido por proteger o endotélio microvascular cardíaco14,16, reverteu notavelmente a maior intensidade de fluorescência induzida por IR (2,87 ± 0,52 no grupo IR + TXL vs. 5,52 ± 0,85 no grupo IR, n = 6, p < 0,05). As imagens do miocárdio regional indicaram que o FITC-dextrano se acumulou esmagadoramente na matriz extracelular, mas não nos microvasos, e que o TXL melhorou a função da barreira endotelial (Figura 5).
Comparado com o FITC-dextrano, o EB pode ser uma alternativa subótima porque o EB é inferior a 70.000 Da FITC-dextrano tanto na qualidade da imagem quanto na sensibilidade. Da mesma forma, não houve diferença significativa na área de secção transversa entre os três grupos: 1,00 ± 0,08 no grupo Sham vs. 0,97 ± 0,08 no grupo IR vs. 0,98 ± 0,05 no grupo IR+TXL (Figura Suplementar S1A, n = 6 em cada grupo, p > 0,05 entre quaisquer dois grupos). Conforme mostrado na Figura Suplementar S1B,C, a intensidade média da fluorescência vermelha em seções transversais inteiras de ratos Sham foi relativamente maior, especialmente no endocárdio e no epicárdio. Embora a fluorescência vermelha emitida pela EB tenha aumentado acentuadamente no grupo IR (4,41 ± 0,66 no grupo IR vs. 1,00 ± 0,22 no grupo Sham, n = 6, p < 0,05), a diferença entre os grupos IR+TXL e IR não foi significativa (3,73 ± 0,47 no grupo IR+TXL vs. 4,41 ± 0,66 no grupo IR, n = 6, p = 0,0956).
Além disso, esse método foi testado em um modelo de infarto do miocárdio (IM) (Figura Suplementar S2). No grupo Myocárdico Infarction Injection first (MII), a solução de FITC-dextrana (na mesma concentração mencionada anteriormente) foi injetada na circulação 5 min antes da ligadura do LAD. Isso contrastou com a solução de FITC-dextrana injetada imediatamente após a ligadura nos ratos MIL (Myocardial Infarction Ligation first) descrita anteriormente neste protocolo. Curiosamente, apenas pequenas quantidades de FITC-dextrano extravasaram para a ECM do miocárdio lesado em ratos com infarto do miocárdio de ambos os grupos, indicadas pela fraca intensidade de fluorescência verde na Figura Suplementar S2.
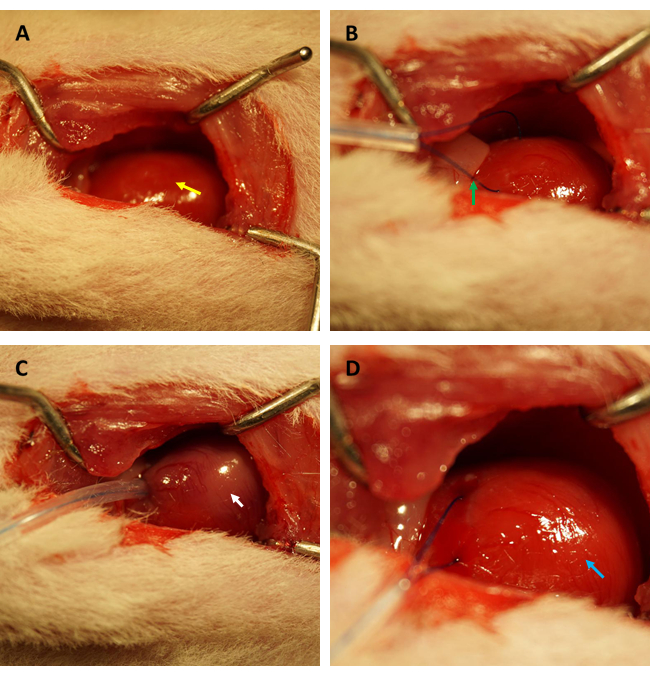
Figura 1: Campo visual da toracotomia e estabelecimento da isquemia/reperfusão em modelo de rato. (A) Exposição do coração do rato (indicado pela seta amarela); (B) formando uma alça para circundar a artéria coronária (indicada pela seta verde); (C) fixação da alça e indução de isquemia miocárdica por 45 min (indicada por seta branca); (D) afrouxar a alça e permitir a reperfusão miocárdica por 3 h (indicado pela seta azul). Clique aqui para ver uma versão maior desta figura.
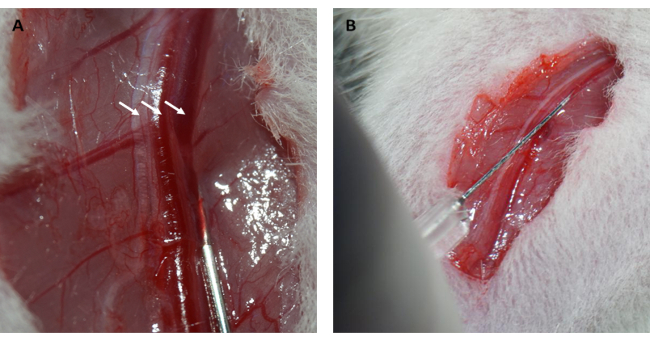
Figura 2: Dissecção da veia femoral e injeção intravenosa. (A) Exposição da veia femoral (o nervo femoral é indicado pela seta à esquerda; a artéria femoral é indicada pela seta no meio; a veia femoral é indicada pela seta à direita). (B) Injetar solução de FITC-dextrana na veia femoral com uma seringa de insulina. Abreviatura: FITC = isotiocianato de fluoresceína. Clique aqui para ver uma versão maior desta figura.
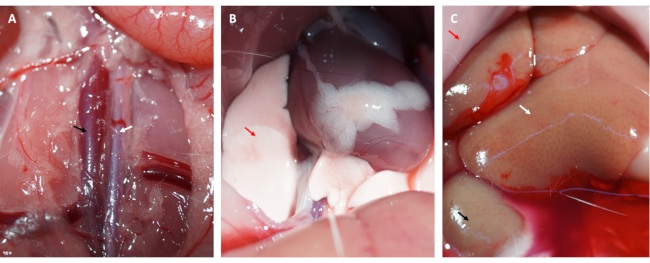
Figura 3: Perfusão tecidual e sintomas de perfusão eficiente. (A) Dissecção da aorta abdominal e da veia cava (a aorta abdominal é indicada pela seta branca; a veia cava é indicada pela seta preta). (B) Pulmões branqueados são um sintoma de perfusão adequada; (C) mucosa branqueada, rim branqueado e fígado sudorese são sintomas de perfusão adequada (seta vermelha: mucosa; seta branca: fígado; seta preta: rim). Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens representativas e análise da intensidade média de fluorescência pela coloração FITC-dextrana. (A) Área de secção transversal relativa de cada grupo normalizada para a do grupo Sham (p > 0,05); (B) intensidade relativa de fluorescência no canal FITC de cada grupo normalizada para a do grupo Sham; (C) imagens representativas com ampliação de 9,5x em cada grupo. Barras de escala = 800 μm. ANOVA unidirecional com comparações post-hoc de múltiplos grupos de Tukey. * vs. grupo Sham, p < 0,05; # vs. grupo RI, p < 0,05. Os gráficos de barras mostram a média ± DP do grupo. Abreviaturas: IR = isquemia/reperfusão; TXL = Tongxinluo; FITC = isotiocianato de fluoresceína; DAPI = 4',6-diamidino-2-fenilindol; ANOVA = análise de variância; DP = desvio-padrão. Clique aqui para ver uma versão maior desta figura.

Figura 5: Imagens representativas de áreas de interesse com aumento de 200x de cada grupo após a coloração FITC-dextrana. Barras de escala = 50 μm. Abreviaturas: FITC = isotiocianato de fluoresceína; DAPI = 4',6-diamidino-2-fenilindo. Clique aqui para ver uma versão maior desta figura.
Figura Suplementar S1: Imagens representativas e análise da intensidade média de fluorescência pela coloração com Azul de Evans. (A) Área de secção transversal relativa de cada grupo normalizada para a do grupo Sham (p > 0,05); (B) intensidade relativa de fluorescência no canal vermelho do Texas de cada grupo normalizada para a do grupo Sham; (C) imagens representativas em cada grupo. ANOVA unidirecional com comparações post-hoc de múltiplos grupos de Tukey. Barras de escala = 800 μm. * vs. grupo simulado, p < 0,05. Os gráficos de barras mostram a média ± DP do grupo. Abreviaturas: IR = isquemia/reperfusão; TXL = Tongxinluo; DAPI = 4',6-diamidino-2-fenilindol; ANOVA = análise de variância; DP = desvio-padrão. Clique aqui para baixar este arquivo.
Figura suplementar S2: Imagens representativas com ampliação de 9,5x da coloração FITC-dextrana em um modelo de infarto do miocárdio. Barras de escala = 800 μm. Abreviaturas: MII = injeção de infarto do miocárdio primeiro (injetar FITC-dextrana antes do infarto do miocárdio); MIL = ligadura do infarto do miocárdio primeiro (injetar FITC-dextrana imediatamente após o infarto do miocárdio); FITC = isotiocianato de fluoresceína; DAPI = 4',6-diamidino-2-fenilindo. Clique aqui para baixar este arquivo.
Discussão
Este trabalho apresenta um protocolo para avaliar a disfunção da barreira endotelial cardíaca após exposição ao MIRI. Deve-se notar que existem várias etapas cruciais neste protocolo que determinam a confiabilidade e precisão dos resultados. Todas as etapas envolvendo FITC-dextrano devem ser realizadas em uma sala escura. As soluções de FITC-dextrano/solução salina devem ser conservadas a 4 °C e embrulhadas com folha de estanho. Além disso, as artérias coronárias devem ser ligadas, conforme ilustrado na Figura 1, para que o miocárdio possa ser reperfundido imediatamente após o afrouxamento da alça. Os pesquisadores podem escolher suturas de polietileno 5-0 ou 6-0 porque cordas mais finas abaixo de 7-0 são mais propensas a cortar fibras e vasos miocárdicos. É importante ressaltar que a solução traçadora deve ser injetada nas veias femorais e não nas veias da cauda. Cada coração deve ser bem perfundido e bem enxaguado com solução salina gelada antes e depois de ser sacrificado, respectivamente.
Muitos pesquisadores especializados em MIRI estão inclinados a estudar a estrutura subcelular interrompida do endotélio no estágio inicial da reperfusão miocárdica - a formação de corpos apoptóticos, mitocôndrias inchadas e junções intercelulares anormais - para provar a hiperpermeabilidade do endotélio por meio de exame microscópico eletrônico. O immunoblotting também tem sido usado para medir a permeabilidade microvascular porque a diminuição dos níveis de proteínas de conjunção apertada é considerada o mecanismo central da lesão endotelial e do mau funcionamento da barreira endotelial ao longo do tempo. Por exemplo, VE-caderina20 e β-catenina21 são elementos-chave das junções de adesão endotelial célula a célula, e essas conexões contribuem para a manutenção da integridade vascular22. Junções apertadas, como JAM-A23,24 e oclusina25, também participam cooperativamente da construção da barreira endotelial no sistema circulatório.
Atualmente, um número crescente de estudos sugere que a função mitocondrial e a homeostase mitocondrial podem ser os principais alvos das vias de proteção contra a lesão de reperfusão. Conforme relatado em estudos fisiopatológicos e farmacológicos, a mitofagia pode desempenhar um papel importante na morte celular do endotélio e do miocárdio induzida pela RI26. Além disso, a fissão mitocondrial, a proteostase mitocondrial e o controle de qualidade mitocondrial podem proteger o miocárdio de alto risco em áreas reperfundidas 27,28. Os métodos acima se concentram mais em demonstrar diferentes mecanismos ou causas de hiperpermeabilidade do que em exibir a permeabilidade endotelial direta e visualmente. Além disso, a preparação da amostra para exame microscópico eletrônico é complicada e perigosa. As soluções de glutaraldeído, acetona e ácido ósmico usadas em microscopia eletrônica provavelmente volatilizam e corroem a mucosa, a conjuntiva e a pele, ameaçando até mesmo vidas se usadas em ambientes não controlados.
Comparado a esses métodos indiretos e com risco de vida, esse método, que mede a intensidade de fluorescência emitida pelo extravasamento de dextrana FITC, é ideal para avaliar a permeabilidade microvascular cardíaca. Primeiro, 70.000 Da FITC-dextrano não pode penetrar através do endotélio em condições fisiológicas normais, mas pode entrar no espaço intersticial miocárdico sob IR, o que permite uma clara diferenciação entre ratos sob diferentes tratamentos. Além disso, a solução de FITC-dextrana é injetada no sangue através das veias femorais, o que garante que todo o fluido seja injetado na circulação do rato. Em contraste, a injeção da veia da cauda é mais difícil em ratos porque a veia da cauda é indistinta e coberta por um estrato espesso. Além disso, ao contrário da fixação regular de paraformaldeído e da inclusão de parafina, o tratamento do tecido miocárdico é simplificado e otimizado usando a técnica de corte patológico de congelamento rápido usada neste estudo. O curto tempo de armazenamento, o ambiente à prova de luz e a criopreservação podem, juntos, aliviar a extinção da fluorescência do FITC.
Mais importante, esse método pode minimizar o viés de seleção durante a análise estatística. Realizamos perfusão cardíaca suficiente com solução salina para garantir que quase todo o sangue misturado com FITC-dextrano seja extraído do miocárdio e das câmaras cardíacas, o que pode eliminar a fluorescência emitida por qualquer FITC remanescente nos vasos. Se não for esse o caso, a fluorescência fundida com os capilares deve ser excluída e aparada artificialmente. Durante a coleta de tecido de áreas de interesse, nenhum limite visual foi observado entre o miocárdio isquêmico e o miocárdio remoto, especialmente após a coloração com corante EB. Isso dificultou a coleta de amostras dessas áreas representativas. Usando o método aqui descrito, os pesquisadores podem obter imagens de seções inteiras e analisar a intensidade da fluorescência usando um scanner deslizante quantitativo.
Curiosamente, o corante EB pode ser uma alternativa, embora abaixo do ideal, ao FITC-dextrano. Comparado com as condições de armazenamento relativamente adversas do FITC-dextrano, o pó EB ou sua solução podem permanecer estáveis à temperatura ambiente por um longo tempo. Além disso, o EB é relativamente barato para a maioria das instituições. No entanto, certas desvantagens podem limitar sua aplicação. Primeiro, a coloração EB mostra menor sensibilidade do que o FITC-dextrano, o que pode subestimar as diferenças entre os grupos e aumentar o tamanho da amostra de cada grupo. Além disso, o EB mostra maior adesão às proteínas. O endocárdio e o epicárdio são mais facilmente corados pela EB, o que pode influenciar os resultados da densidade de fluorescência. Além disso, defeitos óbvios de enchimento na área de reperfusão reduzem notavelmente a qualidade da imagem, o que pode limitar o uso de EB.
Para estender a aplicação deste método em um modelo MI, o método foi testado em um modelo MI. Primeiro, o FITC-dextrano foi injetado nos vasos sanguíneos após a ligadura do LAD. Como esperado, um baixo nível de fluorescência foi emitido a partir do corte porque o FITC-dextrano no fluxo sanguíneo não pode passar pelo local ligado e nenhum FITC-dextrano entrou na área isquêmica. O FITC-dextrano também foi aplicado 5 min antes da ligadura para garantir a passagem do FITC-dextrano para todos os órgãos. Consequentemente, o FITC-dextrano não conseguiu penetrar no endotélio microvascular, provavelmente porque nenhuma pressão de perfusão nos vasos sanguíneos ligados pode conduzir o FITC-dextrano através do endotélio. Geralmente, esse método provavelmente requer significativamente mais modificações para satisfazer sua aplicação no modelo MI.
Apesar das vantagens acima, existem limitações para este método. Primeiro, este protocolo não foi testado em modelos de RI de outros animais, o que pode limitar sua aplicação em estudos pré-clínicos e clínicos. Em segundo lugar, os corantes marcados com FITC são mais caros do que outros corantes comuns, como o EB. No entanto, ao contrário do EB, como a solução de FITC-dextrano a 10% p/v, diluída com soro, raramente altera a cor do miocárdio, a coloração com FITC-dextrano e a coloração dupla com cloreto de 2,3,5-trifeniltetrazol (TTC) EB/2,3,5-tripeniltetrazol (TTC) podem ser realizadas no mesmo coração, o que pode reduzir o orçamento em relação ao número de animais e aos corantes utilizados. Por último, o scanner de lâminas usado neste estudo - o Quantitative Slide Scanner e instrumentos semelhantes - pode não estar disponível em alguns laboratórios. Em resumo, este protocolo apresenta um método simplificado, confiável e visual para a detecção da permeabilidade endotelial microvascular cardíaca em um modelo de IR em ratos usando um ensaio de fluorescência baseado em um sistema automatizado de imagem patológica quantitativa. Este protocolo demonstra que 70.000 Da FITC-dextrana apresenta melhor desempenho do que EB na avaliação funcional da barreira endotelial dos microvasos cardíacos após lesão de IR.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo foi apoiado por doações do Programa Nacional de Pesquisa e Desenvolvimento da China (nº 2017YFC1700503) e da Fundação Nacional de Ciências Naturais da China (nº 81874461 e nº 81774292).
Materiais
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
Referências
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados