Method Article
Bir Sıçan İskemi/Reperfüzyon Modelinde Kardiyak Mikrovasküler Endotel Bariyerinin Geçirgenliğini Değerlendirmek İçin Bir Floresan Testi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, Evans Blue ile karşılaştırıldığında, ekstravaze 70.000 Da FITC-dekstran'ın ortalama floresan yoğunluğunun ölçümü yoluyla iskemi / reperfüzyon hasarından sonra kardiyak mikrodamarların endotel bariyerini fonksiyonel olarak değerlendirmek için bir yöntem açıklıyoruz.
Özet
Akut koroner sendromlu (AKS) hastaların klinik prognozunu iyileştirmek için perkütan koroner girişim ve koroner arter baypas greftlemeden bağımsız olarak suçlu arterler için revaskülarizasyon tedavileri en iyi strateji olarak kabul edilir. Bununla birlikte, etkili revaskülarizasyonu takiben miyokard reperfüzyonu, miyokard iskemisi/reperfüzyon hasarı (MIRI) olarak bilinen önemli kardiyomiyosit ölümünü ve koroner endotel kollapsını tetikleyebilir. Genellikle, endotel hücreleri ve hücreler arası sıkı bağlantıları, mikrovasküler endotel bariyerini ve nispeten düşük geçirgenliğini işbirliği içinde korur, ancak reperfüzyon alanlarında başarısız olur.
İskemi / reperfüzyonun (IR) neden olduğu mikrovasküler endotelyal hiperpermeabilite, miyokardiyal ödeme, proinflamatuar hücrelerin artmış infiltrasyonuna ve ACS'nin prognozunu kötüleştirebilecek ağırlaştırılmış intramiyokardiyal kanamaya katkıda bulunur. Bu çalışmada kullanılan izleyici - floresein izotiyosiyanat (FITC) ile işaretlenmiş dallı bir glikoz molekülü olan 70.000 Da FITC-dekstran - normal koşullarda kardiyak mikrovasküler endotelyuma sızmak için çok büyük görünmektedir. Bununla birlikte, MIRI'den sonra kırık bir bariyere sızma yeteneğine sahiptir. Bu nedenle, endotel geçirgenliği ne kadar yüksek olursa, ekstravasküler hücreler arası boşlukta o kadar fazla FITC-dekstran birikir. Bu nedenle, FITC'den gelen floresan yoğunluğu, mikrovasküler endotel bariyerinin geçirgenliğini gösterebilir. Bu protokol, otomatik bir kantitatif patoloji görüntüleme sistemi tarafından tespit edilen kardiyak mikrovasküler endotel bariyerini fonksiyonel olarak değerlendirmek için FITC-dekstran'den yararlanır.
Giriş
Giderek artan sayıda koroner kalp hastalığı olan hastanın on yıllardır revaskülarizasyon tedavilerinden fayda görmesi, MIRI'nin ölümcül sonuçlarını ortadan kaldırmaz. Yellon ve Hausenloy tarafından tanımlandığı gibi, son enfarktüs boyutunun yaklaşık% 30'u MIRI1'e atfedilebilir. Kardiyak mikrovasküler endotel disfonksiyonu, MIRI'nin ve "no-reflow" fenomeninin altında yatan temel mekanizmadır ve birçok kardiyoprotektif ajanın ve klasik kardiyoprotektif yolların hedefidir2. Ayrıca, mikrodamarların endotelyal hiperpermeabilitesi, miyokardiyal ödemi3 ve nötrofiller4, makrofajlar ve ertrositler5 dahil olmak üzere pro-inflamatuar hücrelerin aşırı infiltrasyonunu tetikleyebilir.
MIRI'nin neden olduğu oksidatif stres ve tümör nekroz faktörü ailesi6 ve interlökin ailesi7'nin üyeleri gibi aşırı eksprese edilen proinflamatuar sitokinler, iskemik miyokardın ölümünü hızlandırmak için hücre apoptozunun sinyal yollarını aktive eder. Eritrositler hassas endotel bariyerine nüfuz eder ve intramiyokardiyal hematom8 oluşturmak için hücre dışı matrikste (ECM) birikir. Makrofaj ve nötrofil türevi matriks metalloproteinazlar, ECM'deki kollajeni söker, bu da mekanik komplikasyon ve enfarktüs sonrası ventriküler anevrizmariskini artırır 9. Bu nedenle, endotel bariyerinin geçirgenliği, akut miyokard enfarktüsünün prognostik değerlendirmesi için çok önemli bir işarettir ve MIRI'nin şiddetini bir dereceye kadar işaretler.
FITC-dekstran, moleküler ağırlığı 4.000 Da ila 70.000 Da arasında değişen farklı uzunluklarda dallı glikoz moleküllerinden oluşan bir polisakkarit dizisidir. Spesifik tedaviler ve patolojik koşullar altında hücre zarlarının, kan-beyin bariyeri10 gibi fonksiyonel fizyolojik engellerin ve mukozal zarların11 geçirgenliğini göstermek için standart izleyici olarak yaygın olarak kullanılır. Belirli bir zarın geçirgenliği, moleküler ağırlıklarına göre farklı maddeler için değişir. Genellikle, albümin kardiyak mikrodamarlarla sınırlıdır; bununla birlikte, IR'nin erken evresinde endotelyuma nüfuz ederek miyokard ödemine neden olabilir. Albüminin moleküler ağırlığı yaklaşık 68.000 Da olduğundan, 70.000 Da FITC-dekstran, IR sonrası endotelyal hiperpermeabiliteyi göstermek için uygun bir ajan olacaktır. Ayrıca, dekstran, şok hastalarının kan hacmini ve kolloid ozmotik basıncını korumak için yaygın olarak benimsenmiştir ve FITC etiketli izleyiciler, az sayıda yan etki ile çok sayıda in vivo veya in vitro çalışmada kullanılmaktadır.
FITC-dekstrana ek olarak, Evans Blue (EB) boyama ile endotel geçirgenliği ölçülmüştür. Kan dolaşımına enjeksiyondan sonra, EB serum albüminine sıkıca bağlanır ve kompleks bir12 oluşturur. Bu nedenle, bu EB-albümin kompleksi, tek başına EB değil, geçirgenliğin ölçümü için kullanılabilir, bu da böyle bir EB bazlı yöntemin doğruluğunun deneysel deneklerde farklı serum albümin konsantrasyonlarından etkilenebileceği anlamına gelir. Ek olarak, EB'nin deney hayvanlarının organlarını, özellikle kalp, karaciğer ve akciğerleri, hücresel dejenerasyon ve artan vasküler geçirgenlik yoluyla zehirlediği bildirilmiştir13. İskemi / reperfüzyon geçiren endotel, bu tür zararlı etkilere normal endotelden daha duyarlı olacaktır, bu da deneysel sonuçların önemini karıştırabilir.
EB boyası ile karşılaştırıldığında, FITC-dekstran eksojendir ve albümine bağlanma afinitesi ihmal edilebilir düzeydedir. Bu nedenle, FITC-dekstran serbest halde kalır ve albümin ve doku proteinleri gibi makromoleküller tarafından bağlanmaz. Bu nedenle, vücut ağırlığına göre uygulanırsa, FITC-dekstran eşit kan konsantrasyonunda çalışabilir ve serum albümin konsantrasyonu ve kan hacmindeki bireysel farklılıklardan etkilenmez. Bu yöntemin tanısal duyarlılığını test etmek için geleneksel bir Çin tıbbı olan Tongxinluo (TXL) kullanıldı. TXL, endotelyal hücresel üst yapıyı ve endotel bariyeri bütünlüğünü koruyarak MIRI'yi azaltır14. TXL ayrıca anjina pektorisi tedavi etmek ve enfarktüsten sonra miyokardiyal no-reflow'u klinik olarak iyileştirmek için kullanılır15. Radix ginseng, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi ve Borneolum syntheticum içerir. TXL'nin MEK/ERK yolu16 ve endotelyal nitrik oksit sentaz aracılı mekanizmalar 5,17 yoluyla mikrovasküler endotelyumu koruduğu ve organların18, özellikle kalbin iskemi/reperfüzyon hasarını (IRI) doza bağlı bir şekilde hafiflettiği gösterilmiştir. Burada, sıçanlar tarif edildiği gibi 0.5 g / kg TXL tozu (insanlarda klinik olarak kullanılana eşdeğer bir doz) ile beslendi19. Bu makale, EB'ye kıyasla ekstravaze 70.000 Da FITC-dekstran'ın toplam floresan yoğunluğunun ölçümü yoluyla IR sonrası kardiyak mikrodamarların endotel bariyerini fonksiyonel olarak değerlendirmek için bir yöntem sağlar.
Protokol
Hayvan deneyleri, ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan "Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu" (Bethesda, MD, ABD, NIH Yayın No. 85-23, 1996'da revize edilmiştir) ve Pekin Hayvan Bakımı Konseyi'nin "Deney Hayvanlarının Bakımı ve Kullanımına İlişkin Yönetmelik" (1996) hükümlerine uygun olarak gerçekleştirilmiştir. Çalışma protokolü Fuwai Hastanesi Deney Hayvanları Bakım Komitesi tarafından onaylandı. Bu çalışmada 150-180 g ağırlığındaki erkek SPF sınıfı Sprague-Dawley sıçanları (SD sıçanlar) kullanıldı.
1. Reaktiflerin, malzemelerin ve ekipmanların hazırlanması
- % 70 etanol, FITC-dekstran (70.000 Da, kullanım için% 10 w / v çözeltisi yapmak üzere buz gibi soğuk tuzlu su içinde çözülmüş), epilasyon kremi, 4 ', 6-diamidino-2-fenilindol (DAPI, 0.5-10 μg / mL), 1% w / v EB / salin çözeltisi ve% 5 w / v pentobarbital sodyum / salin çözeltisi (karanlıkta 4 ° C'de saklanır) içeren reaktifler ve çözeltiler hazırlayın.
- Cerrahi bant da dahil olmak üzere tüm cerrahi alet ve malzemeleri önceden sterilize edin; gazlı bez pedleri; cerrahi eldivenler; 16 G endotrakeal tüp; insülin şırıngası; işletme makası; büyük, kavisli diseksiyon forsepsleri; düz diseksiyon forsepsleri; düz sivrisinek forseps; kavisli sivrisinek forseps; ekartörler (30 mm Yayılmış); 5 cm mikro iğne tutucular; 3-0 polipropilen sütür (konik iğne); ve 6-0 polipropilen sütür (yuvarlak iğne).
- Sabit sıcaklık ısıtma sistemi, aydınlatma sistemi, ventilatör, otomatik kantitatif patoloji görüntüleme sistemi ve ultraviyole dondurma dilimleyici dahil olmak üzere tüm ekipmanın iyi durumda olduğunu kontrol edin ve emin olun.
2. Sıçanların cerrahi prosedürler için hazırlanması
- Tüm SD farelerini rastgele Sham grubuna, IR grubuna ve TXL grubuna (IR + TXL grubu) bölün.
NOT: Bu protokolde, her gruba rastgele altı sıçan atandı, n=6. - Her bir SD sıçanını tartın, ağırlığı kaydedin ve her sıçan için uygulanacak TXL dozunu hesaplayın.
- Preoperatif ağrı ve sıkıntıyı hafifletmek için torakotomiden en az 12 saat önce her sıçana gavaj yoluyla 30 mg / kg'lık bir dozda ibuprofen uygulayın.
- Anesteziden önce IR + TXL grubundaki her bir SD sıçanına 12 saat ve 1 saat gavaj ile 0.5 g / kg'lık bir dozda çok ince bir TXL tozu uygulayın, tarif edildiği gibi19.
- Ameliyat masasını %70'lik etanol ile dezenfekte edin ve sterilize edilmiş cerrahi alet ve malzemeleri dezenfekte edilmiş yüzeye yerleştirin.
- Sıçanların vücut sıcaklığını 37 ± 1 °C'de tutmak için sabit sıcaklık ısıtma sisteminin sıcaklığını ayarlayın.
3. Kardiyak iskemi / reperfüzyon için bir sıçan modeli oluşturun
- Sıçanı anestezi altına almak için karın boşluğuna 50 mg / kg (0.1 mL / 100 g vücut ağırlığı) dozunda% 5 w / v pentobarbital sodyum / fosfat tamponlu salin (PBS) çözeltisi enjekte edin. Tıraş ederek veya tüy dökücü bir krem kullanarak kürkü boyundan göğse dikkatlice çıkararak ameliyat bölgesini hazırlayın.
- Sterilize edilmiş cımbızla dilin konumunu gerektiği gibi nazikçe ayarlayın ve solunum salgısını sterilize edilmiş pamuk toplarıyla silin. Glottis'i net bir şekilde görün ve trakeaya nazikçe bir endotrakeal tüp yerleştirin.
- Endotrakeal tüpü dakikada 65-80 nefeste dönen bir ventilatöre bağlayın ve sıçanın başını ve uzuvlarını sabitleyerek tidal hacmi 4-5 mL'de ayarlayın.
- Farenin üzerine steril bir örtü yerleştirin, çalışma alanını iyot tentürü ve ardından% 70 etanol ile dezenfekte edin ve bu işlemi üç kez tekrarlayın.
- Sol musculus pectoralis major ve pectoralis minor'u ortaya çıkarmak için dördüncü interkostal boşluk seviyesinde bir sol parasternal insizyon yapın.
- Sol dördüncü interkostal boşluğu ortaya çıkarmak için künt bir diseksiyon tekniği kullanarak musculus pectoralis major ve pectoralis minor arasındaki fasyayı inceleyin.
NOT: Ciddi kanama ve ameliyat sonrası ölüme neden olacak aşırı doku hasarı ve vasküler yaralanmadan kaçının. - İnterkostal kasları inceleyin, dördüncü interkostal boşluğa bir göğüs ekartörü yerleştirin ve ardından kaburgaları yayın.
- Perikardı yırtın ve bağlı yağ dokusunu çıkarın.
NOT: Başta akciğerler olmak üzere diğer organlara keskin cerrahi aletlerle zarar vermekten kaçının. Akciğerlerin hasar görmesi, operasyon sırasında pnömotoraks ve hemopnömotoraks gelişmesine neden olabilir ve hemodinamik bozukluklardan hayvan sağkalımının azalmasına kadar değişen kakoetik sonuçlara neden olabilir. - Timusun pozisyonunu manipüle edin ve çıkan aortu ve sol atriyumu nazikçe ortaya çıkarın. Proksimal sol ön inen (LAD) arteri 6-0 polipropilen sütür ile 45 dakika boyunca geçici olarak tanımlayın ve bağlayın (bkz. Şekil 1 AD).
NOT: Bu prosedür, LAD'nin bağlanmaması dışında sahte kontrol fareleri için aynıdır. - Göğüs ekartörünü çıkarın ve kaburgaları 3-0 polipropilen sütür ile kesintili bir dikiş şeklinde birleştirin.
- Etkili nefes almayı sağlamak için negatif intratorasik basıncı geri yükleyin.
NOT: Negatif intratorasik basıncı eski haline getirmek için iki yöntem kullanılabilir: i) göğüs boşluğunu kapatmadan önce, araştırmacılar akciğerleri şişirmek için ventilatörün hava çıkışını 2 döngü boyunca tıkayabilirler. ii) Göğüs boşluğunda kalan hava, interkostal boşluk kapatıldıktan sonra bir şırınga ile dışarı çekilebilir. - Epilasyon ve dezenfeksiyondan sonra, sağ alt ekstremitede bir kesi yapın ve yüzeysel fasyayı sağ femoral damardan inceleyin.
- Miyokard iskemisini 45 dakika indükledikten sonra ligasyonu gevşetin ve solunum ve dolaşım koşullarını kontrol edin.
- 0.15 mL / 100 g vücut ağırlığında femoral vene% 10 (a / h) FITC-dekstran / salin solüsyonu enjekte edin ve kanamayı durdurmak için femoral veni steril pamuk topları ile 1 dakika boyunca bastırın (Şekil 2A, B).
NOT: Alternatif olarak, 0.5 mL / 100 g vücut ağırlığı dozunda femoral vene% 1 w / v EB / salin solüsyonu enjekte edin. - Kesileri 3-0 polipropilen sütür ile dikin ve kesileri dezenfekte edin, ardından yukarıda tarif edildiği gibi ibuprofen ile ameliyat sonrası analjezi yapın.
4. Floresan ölçümü için donmuş doku dilimlerinin hazırlanması
- 3 saatlik miyokard reperfüzyonundan sonra sıçanları derinlemesine anestezi altına almak için intraperitoneal olarak 150 mg / kg (0.3 mL / 100 g vücut ağırlığı) dozunda% 5 w / v pentobarbital sodyum / PBS çözeltisi enjekte edin.
- Karın boşluğunu kesin ve aort abdominalis ve vena kava'yı ortaya çıkarın ( bkz. Şekil 3A).
- Vena kavaya düzenli olarak 50 mL buz gibi PBS enjekte edin, miyokardan kanı temizlemek için aort abdominalis'i kesin ve kalbi alın.
NOT: Akciğerlerdeki ve karaciğerdeki değişiklikleri gözlemleyin. Terleyen bir karaciğer, salinin vena kavaya doğru bir şekilde enjekte edildiğini gösterir (bkz. Şekil 3C) ve soluk bir akciğer, iyi perfüze edilmiş bir miyokardın işareti olarak kabul edilir ( bkz. Şekil 3B). - Karanlık bir odada, kalbin odacıklarından kalan kanı ve FITC-dekstran'ı (veya EB) çıkarmak için kalbi buz gibi soğuk tuzlu su veya PBS'de nazikçe durulayın.
- Kalbi ligasyondan kesin ve ligasyonun üzerindeki miyokardiyumu atın.
- Kalbi gömme bileşiği ile kalıplara gömün ve ardından -80 ° C'de saklayın.
- Dondurulmuş dokuları gömme kalıplarından boşaltın ve bunları bir dondurucu dilimleyicinin önceden soğutulmuş -20 °C haznesinde numune tutuculara yükleyin.
- Tek bir dilimin kalınlığını 5-8 μm'ye ayarlayın ve dokuyu yaklaşık olarak taban-apeks ekseninin orta noktasında (örneğin, iskeminin ortası) dilimleyin.
- Dilimlenmiş dokuyu yapışkan mikroskop slaytlarına yükleyin ve her dilimi DAPI içeren bir damla (yaklaşık 40 μL) floresan montaj ortamı ile kapatın.
- Slaytları kuru ve karanlık bir kutuda saklayın.
NOT: Slaytlar hemen taranamıyorsa, yoğuşma suyu oluşumunu ve floresan söndürmeyi önlemek için kuru, serin ve karanlık bir yerde saklayın.
5. Floresan ölçümü ve veri analizi
- Görüntüleme sistemini kurun ve tarayıcıya bağlı yazılımı kontrol edin.
- Slaytları slayt raflarına yerleştirin ve tarayıcıya yerleştirin.
- Slayt tarayıcı yazılımını açın ( Malzeme Tablosuna bakın) ve Protokolü Düzenle | Yeni....
NOT: Tarayıcı veya bağlı yazılımı mevcut değilse, bir lazer konfokal mikroskop ( Malzeme Tablosuna bakın) veya floresan moduna sahip diğer sıradan slayt tarayıcılar ( Malzeme Tablosuna bakın) otomatik kantitatif floresan tarayıcıya bir alternatif olabilir. - Protokolü ve etüdü yeniden adlandırın ve floresan modunu seçin.
- Tüm Slayt Taramasını Tanımlayın | Piksel Çözünürlüğü ve Multispektral Bölgeler | Piksel Çözünürlüğü sırasıyla 0.25 μm (40x).
- Tüm Slayt Tarama Filtreleri sütununu ve Multispektral Bölge Bantları sütununu seçmek için Filtreleri ve Bantları Düzenle'ye tıklayın.
NOT: EB kullanılıyorsa, Tüm Slayt Tarama Filtreleri | DAPI ve Teksas Kırmızısı veya AF495. FITC-dekstran kullanılıyorsa, Multispektral Bölge Bantları | DAPI ve FITC veya AF488. - Pozlamaları Düzenle'ye tıklayın... ve taşıyıcıyı yükleyin.
- Hedef yuvayı seçin ve Genel bakış al'a tıklayın.
NOT: Bu, her kalp bölümünün parlak alan taramasını gerektirir. Odaklanmak için miyokard'ı seçin veya alanı körü körüne seçin. - Hedef slaytı seçin, Stage Yüksekliğini yaklaşık -50 μm olarak ayarlayın ve Otomatik Odaklama'ya tıklayın.
- Tüm Tarama Pozlaması (ms) -DAPI'ye tıklayın | Otomatik pozlama.
NOT: DAPI'nin her slayt için maruz kalma süresi aynı olmak zorunda değildir, çünkü DAPI'li görüntüler, miyokard alanının ana hatlarını çizmek için uygun olan ancak floresan yoğunluğunu hesaplamak için uygun olmayan kalbin enine kesitlerini göstermek için kullanılır. - Tüm Tarama Pozlaması (ms) -FITC'ye tıklayın | Otomatik pozlama.
NOT: Tüm Tarama Pozlaması (ms)-Texas Red | EB kullanılıyorsa otomatik pozlama . FITC veya Texas Red'in maruz kalma süresinin tüm slayt taramalarında aynı olduğunu hatırlamak ve emin olmak önemlidir. - Otomatik Odaklama'ya tekrar tıklayın ve slaytın odakta olduğundan emin olun.
- Geri'ye tıklayın ve protokolü kaydedin.
- Her slayt için 5.7-5.14 adımlarını tekrarlayın.
- Ana sayfaya dönün ve Slaytları Tara'ya tıklayın.
- Bir yuva seçin, tüm slaytları yeniden adlandırın ve her slayt için ilgili pozlama protokolünü seçin.
- Slaytları tarayın ve görüntüleri yakalayın.
- Taramalar için görüntüleri slayt görüntüleyici yazılımıyla açın (Malzeme Tablosuna bakın).
- Tüm görüntüleri nispeten eşit ölçüde büyütün.
- Anlık görüntü alın ve görüntüleri .tiff olarak kaydedin.
NOT: Görüntüleri ölçek çubukları ile ve ölçek çubukları olmadan aynı anda kaydetmek daha iyidir. Ölçek çubuklu görüntüler yayın için kullanılabilirken, ölçek çubukları olmayan görüntüler istatistiksel analiz için kullanılabilir. - ImageJ yazılımını açın, Analiz Et'e tıklayın ve Ölçümü Ayarla'yı seçin.
- Alan Seç | Entegre yoğunluk.
- Görüntüyü Image J ile FITC kanalında açın.
- Tekrar Analiz Et'e tıklayın ve görünen entegre yoğunluğun (IntDen) sayısal değerini kaydedin.
NOT: Görüntülerdeki ölçek çubukları bilgisayarlar tarafından gri tonlamalı floresan ile karıştırılabileceğinden, IntDen'i ölçmek için ölçek çubukları olmayan görüntüler kullanın. - FITC görüntüsünü kapatın ve görüntüyü DAPI kanalında açın.
- Miyokardın bir kesitini ana hatlarıyla belirtin.
- Alan verilerini analiz et ve topla'ya tıklayın.
- Her kalp için IntDen/Area (floresan ortalaması) oranlarını hesaplayın.
- Tüm oranları istatistiksel analiz yazılımına girin.
Sonuçlar
IR sonrası kardiyak endotel geçirgenliğindeki değişiklikleri değerlendirmek için FITC-dekstran testini gerçekleştirmeden önce, koroner arterlerin aynı pozisyonda başarılı bir şekilde tıkandığını doğrulamak için sıçanlarda miyokardiyal IR modelinin kurulmasında uzmanlaşmış aynı araştırmacı tarafından deneylerin yapılmasını şiddetle tavsiye ederiz ve iskemik alan / toplam alan oranları tüm sıçanlar arasında sabittir. Şekil 1A,B'de görüldüğü gibi kalp (sarı okla gösterilen) açığa çıkarılmış ve sol ventrikül ön duvarında, sol atriyal apendiks kenarının yaklaşık 2 mm altında yer alan miyokardda 0.5 mm (iç çaplı) kılcal silikon tüp ve 6-0 sütür ile bir halka (yeşil okla gösterilen) oluşturulmuştur. Şekil 1C'de görüldüğü gibi, halka bağlandığında, iskemik miyokard hemen pembeden grimsi pembeye (beyaz okla gösterilir) döndü.
Ayrıca, miyokard, Şekil 1D'de gösterildiği gibi, halka gevşetildikten hemen sonra yeniden perfüze oldu ve pembe rengini geri kazandı. Halkayı gevşettikten sonra, uyluğun iç kısmında uyluk kemiğinin uzun eksenine paralel bir kesi yapıldı. Femoral ven açığa çıkarıldı ve Şekil 2A,B'de gösterildiği gibi bir insülin şırıngası ile delindi. 3 saatlik reperfüzyonu takiben alt karın bölgesinde "V" şeklinde insizyon yapılarak aort abdominalis ve vena kava peritondan diseke edildi (Şekil 3A). Vena kava içine nazikçe soğuk salin enjekte edildi ve histopatolojik yapısını etkileyecek intraventriküler basınç nedeniyle ventriküler duvarın aşırı gerilmesini önlemek için aort abdominalis kesildi. Ağartılmış akciğerler (Şekil 3B'deki kırmızı ok) ve Şekil 3C'deki karaciğer, dokunun salin ile iyi bir şekilde reperfüze edildiğini gösterir.
Sonuç olarak, üç grup arasında kesit alanında anlamlı bir fark yoktu: Sham grubunda 1.00 ± 0.08, IR grubunda 0.97 ± 0.08, IR + TXL grubunda 1.02 ± 0.04 (Şekil 4A, her grupta n = 6, p > herhangi iki grup arasında 0.05). Şekil 4B,C'de gösterildiği gibi, Sham sıçanlarından alınan tüm bölümlerdeki yeşil floresanın ortalama yoğunluğu son derece düşüktü. Buna karşılık, ekstravaze FITC-dekstran tarafından yayılan floresan, IR grubunda belirgin şekilde artmış, Sham grubuna normalize edilmiştir (IR grubunda 5.52 ± 0.85 vs. Sham grubunda 1.00 ± 0.19, n = 6, p < 0.05). Ayrıca, kardiyak mikrovasküler endotelyumu14,16 koruduğu bilinen TXL süper ince tozu, IR tarafından indüklenen daha yüksek floresan yoğunluğunu önemli ölçüde tersine çevirdi (IR + TXL grubunda 2.87 ± 0.52 vs. IR grubunda 5.52 ± 0.85, n = 6, p < 0.05). Rejyonel miyokard görüntüleri, FITC-dekstranın ezici bir şekilde ekstraselüler matrikste biriktiğini, ancak mikrodamarlarda birikmediğini ve TXL'nin endotel bariyer fonksiyonunu iyileştirdiğini gösterdi (Şekil 5).
FITC-dekstran ile karşılaştırıldığında, EB hem görüntü kalitesi hem de hassasiyet açısından 70.000 Da FITC-dekstran'den daha düşük olduğu için EB yetersiz bir alternatif olabilir. Benzer şekilde, üç grup arasında kesit alanında anlamlı bir fark yoktu: Sham grubunda 1.00 ± 0.08, IR grubunda 0.97 ± 0.08, IR + TXL grubunda 0.98 ± 0.05 (Ek Şekil S1A, her grupta n = 6, p > herhangi iki grup arasında 0.05). Ek Şekil S1B, C'de gösterildiği gibi, Sham sıçanlarından alınan tüm kesitlerdeki kırmızı floresanın ortalama yoğunluğu, özellikle endokard ve epikardda nispeten daha yüksekti. EB tarafından yayılan kırmızı floresan IR grubunda keskin bir şekilde artmasına rağmen (IR grubunda 4.41 ± 0.66 vs. Sham grubunda 1.00 ± 0.22, n = 6, p < 0.05), IR + TXL ve IR grupları arasındaki fark anlamlı değildi (IR + TXL grubunda 3.73 ± 0.47 vs. IR grubunda 4.41 ± 0.66, n = 6, p = 0.0956).
Ayrıca, bu yöntem bir miyokard enfarktüsü (MI) modelinde test edildi (Ek Şekil S2). Myokardiyal Infarktüs Ienjeksiyon ilk (MII) grubunda, FITC-dekstran solüsyonu (daha önce bahsedilen aynı konsantrasyonda) LAD ligasyonundan 5 dakika önce dolaşıma enjekte edildi. Bu, bu protokolde daha önce tarif edilen MIL sıçanlarında ligasyondan hemen sonra enjekte edilen FITC-dekstran çözeltisinin (önce Myokardiyal Infarktüs Ligasyonu) aksineydi. İlginç bir şekilde, her iki grubun MI sıçanlarında yaralı miyokardın ECM'sine sadece düşük miktarlarda FITC-dekstran ekstravaze edildi, Ek Şekil S2'de zayıf yeşil floresan yoğunluğu ile gösterildi.
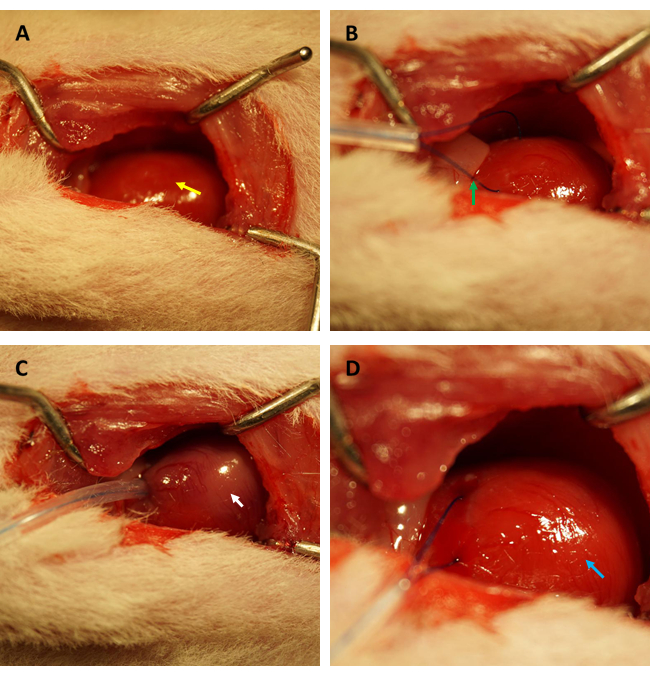
Şekil 1: Bir sıçan modelinde torakotominin görme alanı ve iskemi/reperfüzyon kurulması. (A) Sıçanın kalbini açığa çıkarmak (sarı okla gösterilir); (B) koroner arteri çevrelemek için bir halka oluşturmak (yeşil okla gösterilir); (C) halkanın sabitlenmesi ve 45 dakika boyunca miyokard iskemisi indüklenmesi (beyaz okla gösterilir); (D) halkayı gevşetmek ve 3 saat boyunca miyokardiyal reperfüzyona izin vermek (mavi okla gösterilir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
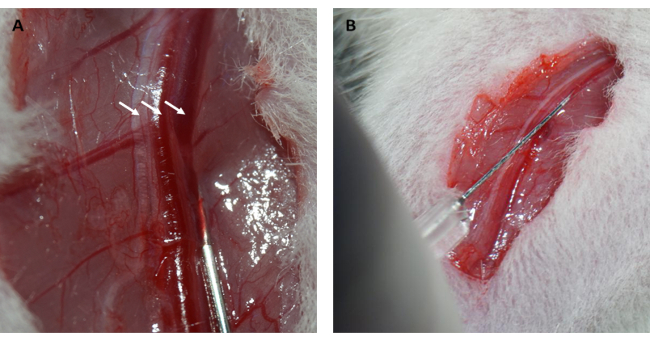
Şekil 2: Femoral ven diseksiyonu ve intravenöz enjeksiyon. (A) Femoral venin açığa çıkarılması (femoral sinir soldaki okla gösterilir; femoral arter ortadaki okla gösterilir; femoral ven sağdaki okla gösterilir). (B) FITC-dekstran çözeltisinin bir insülin şırıngası ile femoral ven içine enjekte edilmesi. Kısaltma: FITC = floresein izotiyosiyanat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
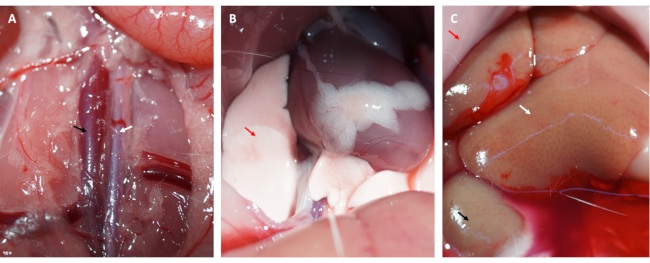
Şekil 3: Doku perfüzyonu ve etkili perfüzyon semptomları. (A) Abdominal aort ve vena kavanın diseksiyonu (abdominal aort beyaz okla gösterilir; vena kava siyah okla gösterilir). (B) Ağartılmış akciğerler yeterli perfüzyonun bir belirtisidir; (C) ağartılmış mukoza, ağartılmış böbrek ve terleme karaciğeri yeterli perfüzyonun belirtileridir (kırmızı ok: mukoza; beyaz ok: karaciğer; siyah ok: böbrek). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: FITC-dekstran boyama ile ortalama floresan yoğunluğunun temsili görüntüleri ve analizi. (A) Her grubun nispi kesit alanı Sham grubununkine normalize edilmiştir (p > 0.05); (B) Sham grubununkine normalize edilmiş her grubun FITC kanalındaki nispi floresan yoğunluğu; (C) her grupta 9,5x büyütme ile temsili görüntüler. Ölçek çubukları = 800 μm. Tukey'in post-hoc çoklu grup karşılaştırmaları ile tek yönlü ANOVA. * Sham grubuna karşı, p < 0.05; # IR grubuna karşı, p < 0.05. Çubuk grafikler grup ortalamasını ± SD'yi gösterir. Kısaltmalar: IR = iskemi / reperfüzyon; TXL = Tongxinluo; FITC = floresein izotiyosiyanat; DAPI = 4',6-diamidino-2-fenilindol; ANOVA = varyans analizi; SD = standart sapma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: FITC-dekstran boyamadan sonra her grubun 200x büyütmesinde ilgi alanlarının temsili görüntüleri. Ölçek çubukları = 50 μm. Kısaltmalar: FITC = floresein izotiyosiyanat; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Evans Blue boyama ile ortalama floresan yoğunluğunun temsili görüntüleri ve analizi. (A) Her grubun nispi kesit alanı Sham grubununkine normalize edilmiştir (p > 0.05); (B) Sham grubununkine normalize edilmiş her grubun Teksas kırmızı kanalındaki nispi floresan yoğunluğu; (C) her gruptaki temsili resimler. Tukey'in post-hoc çoklu grup karşılaştırmaları ile tek yönlü ANOVA. Ölçek çubukları = 800 μm. * Sham grubuna karşı, p < 0.05. Çubuk grafikler grup ortalamasını ± SD'yi gösterir. Kısaltmalar: IR = iskemi / reperfüzyon; TXL = Tongxinluo; DAPI = 4',6-diamidino-2-fenilindol; ANOVA = varyans analizi; SD = standart sapma. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S2: Miyokard enfarktüsü modelinde FITC-dekstran boyamanın 9.5x büyütmesinde temsili görüntüler. Ölçek çubukları = 800 μm. Kısaltmalar: MII = önce miyokard enfarktüsü enjeksiyonu (miyokard enfarktüsünden önce FITC-dekstran enjekte edin); MIL = önce miyokard enfarktüsü ligasyonu (miyokard enfarktüsünden hemen sonra FITC-dekstran enjekte edin); FITC = floresein izotiyosiyanat; DAPI = 4',6-diamidino-2-fenilindol. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, MIRI'ye maruz kaldıktan sonra kardiyak endotel bariyerinin disfonksiyonunu değerlendirmek için bir protokol sunmaktadır. Bu protokolde sonuçların güvenilirliğini ve doğruluğunu belirleyen birkaç önemli adım olduğu unutulmamalıdır. FITC-dekstran içeren tüm adımlar karanlık bir odada gerçekleştirilmelidir. FITC-dekstran / tuzlu su çözeltileri 4 ° C'de saklanmalı ve kalay folyo ile sarılmalıdır. Ek olarak, Şekil 1'de gösterildiği gibi koroner arterler bağlanmalıdır, böylece miyokard döngü gevşetildikten hemen sonra yeniden perfüze edilebilir. Araştırmacılar 5-0 veya 6-0 polietilen sütürleri seçebilirler çünkü 7-0'ın altındaki daha ince tellerin miyokard liflerini ve damarlarını kesme olasılığı daha yüksektir. Daha da önemlisi, izleyici solüsyon kuyruk damarlarına değil femoral damarlara enjekte edilmelidir. Her kalp, kurban edilmeden önce ve sonra sırasıyla iyi perfüze edilmeli ve buz gibi tuzlu su ile iyice durulanmalıdır.
MIRI'de uzmanlaşmış birçok araştırmacı, elektron mikroskobik inceleme yoluyla endotelin hiper geçirgenliğini kanıtlamak için miyokard reperfüzyonunun erken evresinde (apoptotik cisimlerin oluşumu, şişme mitokondri ve anormal hücreler arası bağlantılar) endotelin bozulmuş hücre altı yapısını incelemeye meyillidir. İmmünoblotlama ayrıca mikrovasküler geçirgenliği ölçmek için de kullanılmıştır, çünkü sıkı bağlantı proteinlerinin seviyelerindeki azalma, endotel hasarının ve zaman içinde endotel bariyerinin arızalanmasının temel mekanizması olarak kabul edilir. Örneğin, VE-cadherin20 ve β-katenin21, endotelyal hücreden hücreye yapışma bağlantılarının temel unsurlarıdır ve bu bağlantılar vasküler bütünlüğün22 korunmasına katkıda bulunur. JAM-A23,24 ve oklüdin25 gibi sıkı bağlantılar da dolaşım sistemindeki endotel bariyerinin inşasına işbirliği içinde katılır.
Şu anda, artan sayıda çalışma, mitokondriyal fonksiyon ve mitokondriyal homeostazın reperfüzyon hasarına karşı koruyucu yolların anahtar hedefleri olabileceğini düşündürmektedir. Patofizyolojik ve farmakolojik çalışmalarda bildirildiği gibi, mitofaji, IR26'nın neden olduğu endotel ve miyokardın hücresel ölümünde önemli bir rol oynayabilir. Ek olarak, mitokondriyal fisyon, mitokondriyal proteostaz ve mitokondriyal kalite kontrolü, reperfüze alanlarda yüksek riskli miyokardları koruyabilir27,28. Yukarıdaki yöntemler, endotel geçirgenliğini doğrudan ve görsel olarak göstermekten ziyade, hiper geçirgenliğin farklı mekanizmalarını veya nedenlerini göstermeye daha fazla odaklanmaktadır. Ayrıca, elektron mikroskobik incelemesi için numune hazırlama karmaşık ve tehlikelidir. Elektron mikroskobunda kullanılan gluteraldehit, aseton ve osmik asit çözeltileri muhtemelen mukoza, konjonktiva ve cildi buharlaştırır ve aşındırır, hatta kontrolsüz ortamlarda kullanılırsa yaşamları tehdit eder.
Bu dolaylı ve yaşamı tehdit eden yöntemlerle karşılaştırıldığında, FITC-dekstran ekstravazasyonu ile yayılan floresan yoğunluğunu ölçen bu yöntem, kardiyak mikrovasküler geçirgenliği değerlendirmek için idealdir. İlk olarak, 70.000 Da FITC-dekstran normal fizyolojik koşullar altında endotelyumdan nüfuz edemez, ancak IR altında miyokardiyal interstisyel boşluğa girebilir, bu da farklı tedaviler altındaki sıçanlar arasında net bir ayrım yapılmasına izin verir. Ek olarak, FITC-dekstran çözeltisi femoral damarlar yoluyla kana enjekte edilir, bu da sıvının tamamının sıçanın dolaşımına enjekte edilmesini garanti eder. Buna karşılık, kuyruk damarı enjeksiyonu sıçanlarda daha zordur çünkü kuyruk damarı belirsizdir ve kalın bir tabaka ile kaplıdır. Ayrıca, düzenli paraformaldehit fiksasyonu ve parafin gömülmesinden farklı olarak, miyokardiyal doku tedavisi, bu çalışmada kullanılan hızlı dondurma patolojik kesit tekniği kullanılarak basitleştirilir ve optimize edilir. Kısa saklama süresi, ışık geçirmez ortam ve kriyoprezervasyon birlikte FITC'nin floresan söndürmesini hafifletebilir.
Daha da önemlisi, bu yöntem istatistiksel analiz sırasında seçim yanlılığını en aza indirebilir. FITC-dekstran ile karıştırılan kanın neredeyse tamamının miyokard ve kalp odacıklarından dışarı atılmasını sağlamak için salin ile yeterli kalp perfüzyonu gerçekleştiriyoruz, bu da damarlarda kalan herhangi bir FITC'nin yaydığı floresansı ortadan kaldırabilir. Aksi takdirde, kılcal damarlarla birleşen floresan dışlanmalı ve yapay olarak kesilmelidir. İlgi alanlarından doku toplanırken, özellikle EB boya boyaması sonrası iskemik miyokard ile uzak miyokard arasında herhangi bir görsel sınır gözlenmedi. Bu, bu temsili alanlardan örneklerin toplanmasını engelledi. Araştırmacılar, burada açıklanan yöntemi kullanarak tüm bölümlerin görüntülerini elde edebilir ve kantitatif bir kaydırıcı tarayıcı kullanarak floresan yoğunluğunu analiz edebilir.
İlginç bir şekilde, EB boyası, FITC-dekstran'e yetersiz de olsa bir alternatif olabilir. FITC-dekstran'in nispeten zorlu saklama koşulları ile karşılaştırıldığında, EB tozu veya çözeltisi oda sıcaklığında uzun süre stabil kalabilir. Ek olarak, EB çoğu kurum için nispeten ucuzdur. Bununla birlikte, bazı dezavantajlar uygulamasını sınırlayabilir. İlk olarak, EB boyama, gruplar arasındaki farklılıkları hafife alabilen ve her grubun örneklem büyüklüğünü artırabilen FITC-dekstran'dan daha düşük duyarlılık gösterir. Ayrıca, EB proteinlere daha güçlü yapışma gösterir. Endokard ve epikardium, floresan yoğunluğunun sonuçlarını etkileyebilen EB tarafından daha kolay boyanır. Ayrıca, reperfüzyon alanındaki belirgin doldurma kusurları, görüntü kalitesini önemli ölçüde düşürür ve bu da EB kullanımını sınırlayabilir.
Bu yöntemin bir MI modelinde uygulanmasını genişletmek için, yöntem bir MI modelinde test edilmiştir. İlk olarak, LAD ligasyonundan sonra kan damarlarına FITC-dekstran enjekte edildi. Beklendiği gibi, dilimden düşük bir floresan seviyesi yayıldı, çünkü kan akışındaki FITC-dekstran bağlanmış bölgeden geçemedi ve hiçbir FITC-dekstran iskemik alana girmedi. FITC-dekstran ayrıca ligasyondan 5 dakika önce FITC-dekstran'ın tüm organlara geçişini sağlamak için uygulandı. Sonuç olarak, FITC-dekstran muhtemelen mikrovasküler endotelyuma nüfuz edemedi, çünkü bağlanmış kan damarlarındaki hiçbir perfüzyon basıncı FITC-dekstran'ı endotelyumdan geçiremez. Genel olarak, bu yöntem muhtemelen MI modelindeki uygulamasını karşılamak için önemli ölçüde daha fazla değişiklik gerektirir.
Yukarıdaki avantajlara rağmen, bu yöntemin sınırlamaları vardır. İlk olarak, bu protokol diğer hayvanların IR modellerinde test edilmemiştir, bu da klinik öncesi ve klinik çalışmalarda uygulanmasını sınırlayabilir. İkincisi, FITC etiketli boyalar, EB gibi diğer yaygın boyalardan daha pahalıdır. Bununla birlikte, EB'den farklı olarak, serumla seyreltilmiş% 10 w / v FITC-dekstran çözeltisi, miyokardın rengini nadiren değiştirir, FITC-dekstran boyama ve EB / 2,3,5-trifeniltetrazol klorür (TTC) ikili boyama aynı kalpte yapılabilir, bu da hayvan sayısı ve kullanılan boyalara göre bütçeyi azaltabilir. Son olarak, bu çalışmada kullanılan slayt tarayıcı - Kantitatif Slayt Tarayıcı ve benzeri araçlar - bazı laboratuvarlarda bulunmayabilir. Özetle, bu protokol, otomatik bir kantitatif patoloji görüntüleme sistemine dayalı bir floresan testi kullanılarak sıçanlarda bir IR modelinde kardiyak mikrovasküler endotel geçirgenliğinin tespiti için basitleştirilmiş, güvenilir ve görsel bir yöntem sunar. Bu protokol, 70.000 Da FITC-dekstranin, IR hasarından sonra kardiyak mikrodamarların endotel bariyerinin fonksiyonel değerlendirmesinde EB'den daha iyi performans gösterdiğini göstermektedir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Çin Ulusal Anahtar Araştırma ve Geliştirme Programı (No. 2017YFC1700503) ve Çin Ulusal Doğa Bilimleri Vakfı (No. 81874461 ve No. 81774292) tarafından sağlanan hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
Referanslar
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır