Method Article
Ein Fluoreszenzassay zur Beurteilung der Permeabilität einer kardialen mikrovaskulären Endothelbarriere in einem Rattenmodell für Ischämie/Reperfusion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit beschreiben wir eine Methode zur funktionellen Beurteilung der Endothelbarriere von kardialen Mikrogefäßen nach Ischämie/Reperfusionsverletzung durch Messung der mittleren Fluoreszenzintensität von extravasiertem 70.000 Da FITC-Dextran im Vergleich zu Evans Blue.
Zusammenfassung
Revaskularisationstherapien für schuldige Arterien, unabhängig von der perkutanen Koronarintervention und der Bypass-Transplantation der Koronararterien, gelten als die beste Strategie zur Verbesserung der klinischen Prognose von Patienten mit akutem Koronarsyndrom (ACS). Nichtsdestotrotz kann eine myokardiale Reperfusion nach effektiver Revaskularisierung einen signifikanten Tod der Kardiomyozyten und einen koronaren Endothelkollaps auslösen, der als myokardiale Ischämie/Reperfusionsverletzung (MIRI) bekannt ist. In der Regel halten Endothelzellen und ihre interzellulären Tight Junctions die mikrovaskuläre Endothelbarriere und ihre relativ geringe Permeabilität kooperativ aufrecht, versagen jedoch in den Reperfusionsbereichen.
Die durch Ischämie/Reperfusion (IR) induzierte mikrovaskuläre endotheliale Hyperpermeabilität trägt zu Myokardödemen, einer vermehrten Infiltration entzündungsfördernder Zellen und einer verschlimmerten intramyokardialen Blutung bei, die die Prognose von ACS verschlechtern kann. Der in dieser Studie verwendete Tracer - 70.000 Da FITC-Dextran, ein verzweigtes Glukosemolekül, das mit Fluorescein-Isothiocyanat (FITC) markiert ist - scheint zu groß zu sein, um das mikrovaskuläre Endothel des Herzens unter normalen Bedingungen zu infiltrieren. Es ist jedoch in der Lage, eine durchbrochene Barriere nach MIRI zu infiltrieren. Je höher also die endotheliale Permeabilität ist, desto mehr FITC-Dextran reichert sich im extravaskulären Interzellularraum an. Somit kann die Intensität der Fluoreszenz von FITC auf die Permeabilität der mikrovaskulären Endothelbarriere hinweisen. Dieses Protokoll nutzt die Vorteile von FITC-Dextran, um die kardiale mikrovaskuläre Endothelbarriere funktionell zu bewerten, die durch ein automatisiertes quantitatives Bildgebungssystem für die Pathologie erfasst wird.
Einleitung
Die Tatsache, dass immer mehr Patienten mit koronaren Herzkrankheiten seit Jahrzehnten von Revaskularisationstherapien profitieren, negiert nicht die fatalen Folgen von MIRI. Wie von Yellon und Hausenloy beschrieben, können etwa 30% der endgültigen Infarktgröße auf MIRI1 zurückgeführt werden. Die kardiale mikrovaskuläre endotheliale Dysfunktion ist der zentrale Mechanismus, der der MIRI und dem "No-Reflow"-Phänomen zugrunde liegt, und ist das Ziel vieler kardioprotektiver Wirkstoffe und klassischer kardioprotektiver Signalwege2. Darüber hinaus kann die endotheliale Hyperpermeabilität von Mikrogefäßen ein Myokardödemauslösen 3 und die Überinfiltration von proinflammatorischen Zellen, einschließlich Neutrophilen4, Makrophagen und Entertrozyten5.
MIRI-induzierter oxidativer Stress und überexprimierte proinflammatorische Zytokine, wie z. B. die Mitglieder der Tumornekrosefaktor-Familie6 und der Interleukin-Familie7, aktivieren Signalwege der Zellapoptose, um den Tod des ischämischen Myokards zu beschleunigen. Erythrozyten durchdringen die anfällige Endothelbarriere und reichern sich in der extrazellulären Matrix (EZM) an, um ein intramyokardiales Hämatomzu bilden 8. Makrophagen- und Neutrophilen-abgeleitete Matrix-Metalloproteinasen zersetzen Kollagen in der EZM, was das Risiko für mechanische Komplikationen und ventrikuläre Aneurysmen nach einem Infarkt erhöht9. Die Permeabilität der Endothelbarriere ist somit ein entscheidendes Zeichen für die prognostische Beurteilung des akuten Myokardinfarkts und markiert bis zu einem gewissen Grad den Schweregrad der MIRI.
FITC-Dextran ist ein Array von Polysacchariden, das aus unterschiedlich langen verzweigten Glukosemolekülen mit einem Molekulargewicht von 4.000 Da bis 70.000 Da besteht. Es wird häufig als Standardtracer verwendet, um die Permeabilität von Zellmembranen, funktionellen physiologischen Barrieren wie der Blut-Hirn-Schranke10 und den Schleimhäuten11 unter spezifischen Behandlungen und pathologischen Bedingungen nachzuweisen. Die Permeabilität einer bestimmten Membran variiert für verschiedene Substanzen je nach ihrem Molekulargewicht. Normalerweise ist Albumin auf Herzmikrogefäße beschränkt; Es kann jedoch im Frühstadium der IR das Endothel durchdringen und ein Myokardödem verursachen. Da das Molekulargewicht von Albumin etwa 68.000 Da beträgt, wären 70.000 Da FITC-Dextran ein geeignetes Mittel, um die endotheliale Hyperpermeabilität nach IR nachzuweisen. Darüber hinaus wurde Dextran häufig eingesetzt, um das Blutvolumen und den kolloidosmotischen Druck von Schockpatienten aufrechtzuerhalten, und FITC-markierte Tracer werden in zahlreichen In-vivo - oder In-vitro-Studien mit wenigen Nebenwirkungen eingesetzt.
Zusätzlich zu FITC-Dextran wurde die endotheliale Permeabilität mit Evans-Blue (EB)-Färbung gemessen. Nach der Injektion in den Blutkreislauf bindet EB fest an das Serumalbumin und bildet einen Komplex12. Somit kann dieser EB-Albumin-Komplex, nicht EB allein, zur Messung der Permeabilität verwendet werden, was bedeutet, dass die Genauigkeit einer solchen EB-basierten Methode durch unterschiedliche Konzentrationen von Serumalbumin bei Versuchspersonen beeinflusst werden kann. Darüber hinaus wurde berichtet, dass EB die Organe von Versuchstieren, insbesondere Herz, Leber und Lunge, durch zelluläre Degeneration und erhöhte Gefäßpermeabilität vergiftet13. Endothel, das sich einer Ischämie/Reperfusion unterzieht, wäre empfindlicher gegenüber solchen schädlichen Effekten als normales Endothel, was die Bedeutung der experimentellen Ergebnisse verwirren kann.
Im Vergleich zum EB-Farbstoff ist FITC-Dextran exogen, und die Bindungsaffinität zu Albumin ist vernachlässigbar. Daher bleibt FITC-Dextran im freien Zustand und wird nicht durch Makromoleküle wie Albumin und Gewebeproteine gebunden. Wenn es also entsprechend dem Körpergewicht verabreicht wird, kann FITC-Dextran bei gleicher Blutkonzentration wirken und wird nicht durch individuelle Unterschiede in der Serumalbuminkonzentration und dem Blutvolumen beeinflusst. Tongxinluo (TXL), ein traditionelles chinesisches Arzneimittel, wurde verwendet, um die diagnostische Sensitivität dieser Methode zu testen. TXL reduziert die MIRI, indem es die endotheliale zelluläre Ultrastruktur und die Integrität der Endothelbarriere aufrechterhält14. TXL wird auch zur Heilung von Angina pectoris und zur klinischen Verbesserung des Myokard-No-Reflow-Effekts nach einem Infarkt eingesetzt15. Es enthält Radix ginseng, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi und Borneolum syntheticum. Es wurde gezeigt, dass TXL das mikrovaskuläre Endothel über den MEK/ERK-Signalweg16 und endotheliale Stickstoffmonoxid-Synthase-vermittelte Mechanismen 5,17 schützt und Ischämie/Reperfusionsschäden (IRI) der Organe18, insbesondere des Herzens, dosisabhängig lindert. Hier wurden Ratten mit 0,5 g/kg TXL-Pulver gefüttert (eine äquivalente Dosis zu der klinisch beim Menschen angewendeten), wie beschrieben19. In dieser Arbeit wird eine Methode zur funktionellen Beurteilung der Endothelbarriere von kardialen Mikrogefäßen nach IR durch Messung der Gesamtfluoreszenzintensität von extravasiertem 70.000 Da FITC-Dextran im Vergleich zu EB vorgestellt.
Protokoll
Tierversuche wurden in Übereinstimmung mit dem "Guide for the Care and Use of Laboratory Animals" der US-amerikanischen National Institutes of Health (Bethesda, MD, USA, NIH Publication No. 85-23, revised 1996) und der "Regulation to the Care and Use of Experimental Animals" des Beijing Council on Animal Care (1996) durchgeführt. Das Studienprotokoll wurde vom Care of Experimental Animals Committee des Fuwai Hospital genehmigt. In dieser Studie wurden männliche Sprague-Dawley-Ratten der SPF-Klasse (SD-Ratten) mit einem Gewicht von 150-180 g verwendet.
1. Vorbereitung von Reagenzien, Materialien und Geräten
- Bereiten Sie Reagenzien und Lösungen vor, einschließlich 70 % Ethanol, FITC-Dextran (70.000 Da, gelöst in eiskalter Kochsalzlösung, um eine 10 %ige w/v-Lösung für den Gebrauch herzustellen), Haarentfernungscreme, Eindeckmedium mit 4',6-Diamidino-2-phenylindol (DAPI, 0,5-10 μg/ml), 1 % w/v EB/Kochsalzlösung und 5 % w/v Pentobarbital-Natrium/Kochsalzlösung (bei 4 °C im Dunkeln gelagert).
- Sterilisieren Sie alle chirurgischen Instrumente und Materialien im Voraus, einschließlich des chirurgischen Klebebandes. Mull-Pads; OP-Handschuhe; 16 G Endotrachealtubus; Insulinspritze; Bedienung der Schere; große, gebogene Präparierzange; gerade Präparierzange; gerade Mückenzange; gebogene Mückenzange; Aufrolleinrichtungen (30 mm Spreizung); 5 cm Mikronadelhalter; 3-0 Polypropylen-Naht (Kegelnadel); und 6-0 Polypropylen-Naht (Rundnadel).
- Überprüfen und stellen Sie sicher, dass alle Geräte, einschließlich des Konstanttemperatur-Heizsystems, des Beleuchtungssystems, des Beatmungsgeräts, des automatisierten quantitativen Bildgebungssystems für die Pathologie und des UV-Gefrierschneiders, in gutem Zustand sind.
2. Vorbereitung der Ratten auf die chirurgischen Eingriffe
- Teilen Sie alle SD-Ratten nach dem Zufallsprinzip in Sham-Gruppe, IR-Gruppe und TXL-Gruppe (IR+TXL-Gruppe) ein.
HINWEIS: In diesem Protokoll wurden jeder Gruppe sechs Ratten nach dem Zufallsprinzip zugeordnet, n=6. - Wiegen Sie jede SD-Ratte, notieren Sie das Gewicht und berechnen Sie die TXL-Dosis, die jeder Ratte verabreicht werden soll.
- Ibuprofen in einer Dosis von 30 mg/kg per Sonde an jede Ratte mindestens 12 Stunden vor der Thorakotomie verabreichen, um präoperative Schmerzen und Beschwerden zu lindern.
- Verabreichen Sie jeder SD-Ratte in der IR+TXL-Gruppe vor der Anästhesation ein superfeines Pulver TXL in einer Dosis von 0,5 g/kg durch Sonde 12 h und 1 h, wie beschrieben19.
- Desinfizieren Sie den Operationstisch mit 70% Ethanol und legen Sie die sterilisierten chirurgischen Instrumente und Materialien auf die desinfizierte Oberfläche.
- Passen Sie die Temperatur des Konstanttemperatur-Erwärmungssystems an, um die Körpertemperatur der Ratten auf 37 ± 1 °C zu halten.
3. Etablierung eines Rattenmodells für kardiale Ischämie/Reperfusion
- Injizieren Sie 5% w/v Pentobarbital-Natrium/Phosphat-gepufferte Kochsalzlösung (PBS) in einer Dosis von 50 mg/kg (0,1 ml/100 g Körpergewicht) in die Bauchhöhle, um die Ratte zu betäuben. Bereiten Sie das Operationsfeld vor, indem Sie das Fell vom Hals bis zur Brust vorsichtig entfernen, indem Sie sich rasieren oder eine Enthaarungscreme verwenden.
- Passen Sie die Position der Zunge vorsichtig mit einer sterilisierten Pinzette an und wischen Sie das Atemwegssekret mit sterilisierten Wattebällchen ab. Behalten Sie die Stimmritze gut im Blick und führen Sie einen Endotrachealtubus vorsichtig in die Luftröhre ein.
- Schließen Sie den Endotrachealtubus an ein Beatmungsgerät an, das mit 65-80 Atemzügen pro Minute kreist, und stellen Sie das Atemzugvolumen auf 4-5 ml ein, indem Sie den Kopf und die Gliedmaßen der Ratte fixieren.
- Legen Sie ein steriles Tuch über die Ratte, desinfizieren Sie den Operationsbereich mit einer Tinktur aus Jod, gefolgt von 70 % Ethanol, und wiederholen Sie diesen Vorgang dreimal.
- Machen Sie einen linken parasternalen Schnitt auf Höhe des vierten Interkostalraums, um den linken Musculus pectoralis major und den Pectoralis minor freizulegen.
- Präparieren Sie die Faszie zwischen dem Musculus pectoralis major und dem pectoralis minor mit einer stumpfen Dissektionstechnik, um den linken vierten Interkostalraum freizulegen.
HINWEIS: Vermeiden Sie übermäßige Gewebeschäden und Gefäßverletzungen, die zu schweren Blutungen und postoperativem Tod führen. - Präparieren Sie die Interkostalmuskulatur, positionieren Sie einen Brustretraktor im vierten Interkostalraum und spreizen Sie dann die Rippen.
- Reißen Sie das Perikard ab und entfernen Sie das anhaftende Fettgewebe.
HINWEIS: Vermeiden Sie es, andere Organe mit scharfen chirurgischen Instrumenten zu beschädigen, insbesondere die Lunge. Eine Schädigung der Lunge kann während der Operation zur Entwicklung von Pneumothorax und Hämopneumothorax führen, was zu kakoethischen Folgen führt, die von hämodynamischen Störungen bis hin zu verminderten Überlebenschancen der Tiere reichen. - Manipulieren Sie die Position des Thymus und legen Sie die aufsteigende Aorta und die linken Vorhöfe sanft frei. Identifizieren und ligieren Sie die proximale linke anteriore absteigende Arterie (LAD) vorübergehend für 45 Minuten mit einer 6-0-Polypropylen-Naht (siehe Abbildung 1 A-D).
HINWEIS: Dieses Verfahren ist für Scheinkontrollratten identisch, mit der Ausnahme, dass der LAD nicht ligiert wird. - Entfernen Sie den Brustretraktor und ziehen Sie die Rippen in einem unterbrochenen Nahtmuster mit einer 3-0-Polypropylen-Naht zusammen.
- Stellen Sie den negativen intrathorakalen Druck wieder her, um eine effektive Atmung zu gewährleisten.
HINWEIS: Zwei Methoden können verwendet werden, um den negativen intrathorakalen Druck wiederherzustellen: i) Vor dem Schließen der Brusthöhle können die Forscher den Luftauslass des Beatmungsgeräts für 2 Zyklen verstopfen, um die Lunge aufzublasen. ii) Die in der Brusthöhle verbleibende Luft kann nach dem Schließen des Interkostalraums mit einer Spritze abgesaugt werden. - Machen Sie nach der Haarentfernung und Desinfektion einen Schnitt in der rechten unteren Extremität und präparieren Sie die oberflächliche Faszie von der rechten Oberschenkelvene.
- Lockern Sie die Ligatur und überprüfen Sie die Atmungs- und Durchblutungsbedingungen nach Induktion einer Myokardischämie für 45 Minuten.
- Injizieren Sie 10% (w/v) FITC-Dextran/Kochsalzlösung mit 0,15 ml/100 g Körpergewicht in die Oberschenkelvene und drücken Sie die Oberschenkelvene 1 Minute lang mit sterilen Wattebällchen, um die Blutung zu stillen (Abbildung 2A,B).
HINWEIS: Alternativ können Sie 1% w/v EB/Kochsalzlösung in einer Dosis von 0,5 ml/100 g Körpergewicht in die Oberschenkelvene injizieren. - Nähen Sie die Schnitte mit einer 3-0 Polypropylen-Naht zusammen und desinfizieren Sie die Schnitte, gefolgt von einer postoperativen Analgesie mit Ibuprofen, wie oben beschrieben.
4. Vorbereitung von gefrorenen Gewebeschnitten für die Fluoreszenzmessung
- Injizieren Sie 5% w/v Pentobarbital-Natrium/PBS-Lösung in einer Dosis von 150 mg/kg (0,3 ml/100 g Körpergewicht) intraperitoneal, um die Ratten nach 3 h myokardialer Reperfusion tief zu betäuben.
- Die Bauchhöhle aufschlitzen und die Aorta abdominalis und die Hohlvene freilegen (siehe Abbildung 3A).
- Injizieren Sie stetig 50 ml eiskaltes PBS in die Hohlvene, schneiden Sie die Aorta abdominalis auf, um Blut aus dem Myokard zu spülen, und entnehmen Sie das Herz.
HINWEIS: Beobachten Sie Veränderungen in Lunge und Leber. Eine schwitzende Leber deutet darauf hin, dass Kochsalzlösung genau in die Hohlvene injiziert wird (siehe Abbildung 3C), und eine blasse Lunge gilt als Zeichen für ein gut durchblutetes Myokard (siehe Abbildung 3B). - Spülen Sie das Herz in einem dunklen Raum vorsichtig mit eiskalter Kochsalzlösung oder PBS, um das restliche Blut und FITC-Dextran (oder EB) aus den Herzkammern zu entfernen.
- Schneiden Sie das Herz von der Ligatur ab und entsorgen Sie das Myokard über der Ligatur.
- Das Herz mit Einbettmasse in Formen einbetten und anschließend bei -80 °C lagern.
- Entladen Sie das gefrorene Gewebe aus den Einbettformen und laden Sie es auf Probenhalter in einer vorgekühlten -20 °C-Kammer eines Gefrierschneiders.
- Stellen Sie die Dicke einer einzelnen Scheibe auf 5-8 μm ein und schneiden Sie das Gewebe ungefähr in der Mitte der Basis-Apex-Achse (z. B. in der Mitte der Ischämie).
- Laden Sie das geschnittene Gewebe auf selbstklebende Objektträger und versiegeln Sie jede Scheibe mit einem Tropfen (ca. 40 μl) fluoreszierendem Eindeckmedium, das DAPI enthält.
- Bewahren Sie die Objektträger in einer trockenen und dunklen Box auf.
HINWEIS: Wenn die Objektträger nicht sofort gescannt werden können, lagern Sie sie an einem trockenen, kühlen und dunklen Ort, um die Bildung von Kondensatwasser und Fluoreszenzlöschung zu verhindern.
5. Fluoreszenzmessung und Datenanalyse
- Richten Sie das Imaging-System ein und überprüfen Sie die mit dem Scanner verbundene Software.
- Legen Sie die Dias in die Diaablagen ein und legen Sie sie in den Scanner ein.
- Öffnen Sie die Dia-Scanner-Software (siehe Materialtabelle) und richten Sie ein neues Belichtungsprotokoll ein, indem Sie auf Protokoll bearbeiten | Neu....
HINWEIS: Wenn der Scanner oder die zugehörige Software nicht verfügbar ist, kann ein konfokales Lasermikroskop (siehe Materialtabelle) oder andere gewöhnliche Objektträgerscanner mit dem Fluoreszenzmodus (siehe Materialtabelle) eine Alternative zum automatisierten quantitativen Fluoreszenzscanner sein. - Benennen Sie das Protokoll und die Studie um und wählen Sie den Fluoreszenzmodus aus.
- Definieren des Scans des gesamten Objektträgers | Pixelauflösung und multispektrale Bereiche | Pixelauflösung jeweils 0,25 μm (40x).
- Klicken Sie auf Filter und Bänder bearbeiten... , um die Spalten Filter für den gesamten Objektträger und die Spalte Bänder für den multispektralen Bereich auszuwählen.
HINWEIS: Wenn EB verwendet wird, wählen Sie Filter für ganze Objektträger | DAPI und Texas Red oder AF495. Wenn FITC-Dextran verwendet wird, wählen Sie Multispektrale Bereichsbänder | DAPI und FITC oder AF488. - Klicken Sie auf Edit Exposures... und laden Sie den Carrier.
- Wählen Sie den Zielslot aus und klicken Sie auf Übersicht übernehmen.
HINWEIS: Dies macht einen Hellfeld-Scan jedes Herzabschnitts. Wählen Sie das Myokard für die Fokussierung aus oder wählen Sie den Bereich blind aus. - Wählen Sie die Zielfolie aus, stellen Sie die Tischhöhe auf ca. -50 μm ein und klicken Sie auf Autofokus.
- Klicken Sie auf Gesamtscan-Belichtung(s)-DAPI | Automatisch belichten.
HINWEIS: Die Belichtungszeit von DAPI muss nicht für jeden Objektträger gleich sein, da Bilder mit DAPI zur Veranschaulichung von Querschnitten des Herzens verwendet werden, die für die Umrissung des Bereichs des Myokards, aber nicht für die Berechnung der Fluoreszenzdichte geeignet sind. - Klicken Sie auf Gesamtscan-Belichtung(s)-FITC | Automatisch belichten.
HINWEIS: Klicken Sie auf Gesamte Scan-Belichtung(en)-Texas Rot | Bei Verwendung von EB automatisch exponieren . Es ist wichtig, sich daran zu erinnern und sicherzustellen, dass die Belichtungszeit von FITC oder Texas Red bei allen Objektträgerscans gleich ist. - Klicken Sie erneut auf Autofokus und stellen Sie sicher, dass die Folie scharf ist.
- Klicken Sie auf Zurück und speichern Sie das Protokoll.
- Wiederholen Sie die Schritte 5.7-5.14 für jede Folie.
- Kehren Sie zur Startseite zurück und klicken Sie auf Folien scannen.
- Wählen Sie einen Slot aus, benennen Sie alle Objektträger um und wählen Sie für jeden Objektträger das entsprechende Belichtungsprotokoll aus.
- Scannen Sie die Folien und nehmen Sie die Bilder auf.
- Öffnen Sie die Bilder mit der Diabetrachter-Software für die Scans (siehe Materialtabelle).
- Vergrößern Sie alle Bilder in relativ gleichem Maße.
- Erstellen Sie Schnappschüsse und speichern Sie Bilder als .tiff.
HINWEIS: Es ist besser, die Bilder gleichzeitig mit und ohne Maßstabsleisten zu speichern. Bilder mit Maßstabsbalken können für die Veröffentlichung verwendet werden, während Bilder ohne Maßstabsbalken für statistische Analysen verwendet werden können. - Öffnen Sie die ImageJ-Software, klicken Sie auf Analysieren und wählen Sie Messung einstellen.
- Bereich auswählen | Integrierte Dichte.
- Öffnen Sie das Bild im FITC-Kanal mit Bild J.
- Klicken Sie erneut auf Analysieren und notieren Sie den angezeigten numerischen Wert der integrierten Dichte (IntDen).
HINWEIS: Da Maßstabsbalken in den Bildern von Computern mit Graustufen der Fluoreszenz verwechselt werden können, verwenden Sie Bilder ohne Maßstabsleisten, um IntDen zu messen. - Schließen Sie das FITC-Abbild, und öffnen Sie das Abbild im DAPI-Kanal.
- Skizzieren Sie einen Querschnitt durch das Myokard.
- Klicken Sie auf Bereichsdaten analysieren und sammeln.
- Berechnen Sie das Verhältnis von IntDen/Fläche (Mittelwert der Fluoreszenz) für jedes Herz.
- Geben Sie alle Kennzahlen in eine statistische Analysesoftware ein.
Ergebnisse
Vor der Durchführung des FITC-Dextran-Assays zur Bewertung der Veränderungen der kardialen Endothelpermeabilität nach IR empfehlen wir dringend, dass Experimente von demselben Forscher durchgeführt werden, der sich auf die Etablierung eines myokardialen IR-Modells bei Ratten spezialisiert hat, um zu bestätigen, dass die Koronararterien in der gleichen Position erfolgreich verschlossen sind und das Verhältnis von ischämischer Fläche zu Gesamtfläche bei allen Ratten konstant ist. Wie in Abbildung 1A, B gezeigt, wurde das Herz (gekennzeichnet durch einen gelben Pfeil) freigelegt, und im Myokard, das sich in der Vorderwand des linken Ventrikels befindet, etwa 2 mm unter dem Rand des linken Vorhofohrs, bildete sich eine Schlinge (gekennzeichnet durch einen grünen Pfeil) mit einem Kapillarsilikonschlauch von 0,5 mm (Innendurchmesser) und einer 6-0-Naht. Wie in Abbildung 1C zu sehen ist, verfärbte sich das ischämische Myokard beim Befestigen der Schlaufe sofort von rosa zu graurosa (gekennzeichnet durch den weißen Pfeil).
Darüber hinaus perfusionierte das Myokard sofort nach dem Lösen der Schlaufe wieder und erhielt seine rosa Farbe zurück, wie in Abbildung 1D dargestellt. Nach dem Lösen der Schlaufe wurde ein Schnitt parallel zur Längsachse des Oberschenkelknochens im inneren Oberschenkel gesetzt. Die Vena femoralis wurde freigelegt und mit einer Insulinspritze punktiert, wie in Abbildung 2A,B gezeigt. Nach einer 3-stündigen Reperfusion wurde ein "V"-Schnitt im Unterbauch gemacht und die Aorta abdominalis und die Vena cava wurden vom Peritoneum aus präpariert (Abbildung 3A). Kalte Kochsalzlösung wurde sanft in die Hohlvene injiziert und die Aorta abdominalis durchtrennt, um zu verhindern, dass die Ventrikelwand aufgrund des intraventrikulären Drucks, der ihre histopathologische Struktur beeinträchtigen würde, übermäßig gedehnt wird. Gebleichte Lungen (roter Pfeil in Abbildung 3B) und Leber in Abbildung 3C deuten darauf hin, dass das Gewebe gut mit Kochsalzlösung durchblutet wurde.
Folglich gab es keinen signifikanten Unterschied in der Querschnittsfläche zwischen den drei Gruppen: 1,00 ± 0,08 in der Scheingruppe gegenüber 0,97 ± 0,08 in der IR-Gruppe gegenüber 1,02 ± 0,04 in der IR+TXL-Gruppe (Abbildung 4A, n = 6 in jeder Gruppe, p > 0,05 zwischen zwei beliebigen Gruppen). Wie in Abbildung 4B,C gezeigt, war die mittlere Intensität der grünen Fluoreszenz in den gesamten Schnitten von Scheinratten extrem niedrig. Im Gegensatz dazu stieg die durch extravasiertes FITC-Dextran emittierte Fluoreszenz in der IR-Gruppe, normiert auf die Sham-Gruppe, deutlich an (5,52 ± 0,85 in der IR-Gruppe vs. 1,00 ± 0,19 in der Sham-Gruppe, n = 6, p < 0,05). Darüber hinaus kehrte das superfeine TXL-Pulver, von dem bekannt ist, dass es das kardiale mikrovaskuläre Endothel14,16 schützt, die durch IR induzierte höhere Fluoreszenzintensität bemerkenswert um (2,87 ± 0,52 in der IR+TXL-Gruppe vs. 5,52 ± 0,85 in der IR-Gruppe, n = 6, p < 0,05). Die Bilder des regionalen Myokards zeigten, dass sich FITC-Dextran überwiegend in der extrazellulären Matrix, nicht aber in den Mikrogefäßen anreicherte, und dass TXL die endotheliale Barrierefunktion verbesserte (Abbildung 5).
Im Vergleich zu FITC-Dextran kann EB eine suboptimale Alternative sein, da EB 70.000 Da FITC-Dextran sowohl in der Bildqualität als auch in der Empfindlichkeit unterlegen ist. Ebenso gab es keinen signifikanten Unterschied in der Querschnittsfläche zwischen den drei Gruppen: 1,00 ± 0,08 in der Scheingruppe gegenüber 0,97 ± 0,08 in der IR-Gruppe gegenüber 0,98 ± 0,05 in der IR+TXL-Gruppe (Ergänzende Abbildung S1A, n = 6 in jeder Gruppe, p > 0,05 zwischen zwei beliebigen Gruppen). Wie in der ergänzenden Abbildung S1B,C gezeigt, war die mittlere Intensität der roten Fluoreszenz in ganzen Querschnitten von Scheinratten relativ höher, insbesondere im Endokard und Epikard. Obwohl die von EB emittierte rote Fluoreszenz in der IR-Gruppe stark anstieg (4,41 ± 0,66 in der IR-Gruppe vs. 1,00 ± 0,22 in der Sham-Gruppe, n = 6, p < 0,05), war der Unterschied zwischen der IR+TXL- und der IR-Gruppe nicht signifikant (3,73 ± 0,47 in der IR+TXL-Gruppe vs. 4,41 ± 0,66 in der IR-Gruppe, n = 6, p = 0,0956).
Darüber hinaus wurde diese Methode in einem Myokardinfarktmodell (MI) getestet (Ergänzende Abbildung S2). In der MII-Gruppe(M yocardial Infarction Injection first) wurde FITC-Dextran-Lösung (in der gleichen Konzentration, die bereits erwähnt wurde) 5 min vor der LAD-Ligation in den Blutkreislauf injiziert. Dies stand im Gegensatz zu der FITC-Dextran-Lösung, die unmittelbar nach der Ligation bei den MIL-Ratten injiziert wurde (Myocardial Infarction Ligation first), die zuvor in diesem Protokoll beschrieben wurde. Interessanterweise wurden bei MI-Ratten beider Gruppen nur geringe Mengen an FITC-Dextran in die EZM des verletzten Myokards extravasiert, was durch eine schwache grüne Fluoreszenzintensität in der ergänzenden Abbildung S2 angezeigt wird.
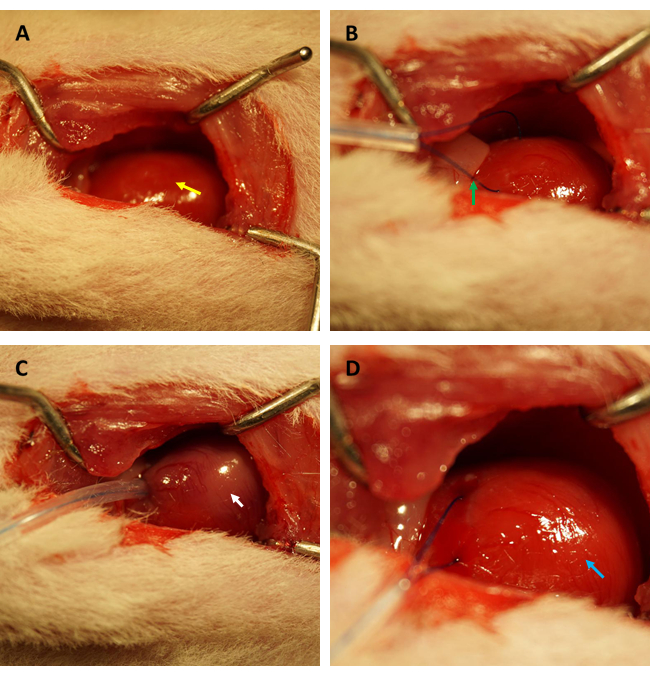
Abbildung 1: Gesichtsfeld der Thorakotomie und Etablierung von Ischämie/Reperfusion in einem Rattenmodell. (A) Freilegen des Herzens der Ratte (gekennzeichnet durch einen gelben Pfeil); (B) Bildung einer Schleife, um die Koronararterie zu umschließen (gekennzeichnet durch grünen Pfeil); (C) Befestigen der Schlaufe und Induktion einer myokardialen Ischämie für 45 Minuten (gekennzeichnet durch einen weißen Pfeil); (D) Lockerung der Schlaufe und Ermöglichung einer myokardialen Reperfusion für 3 Stunden (gekennzeichnet durch den blauen Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
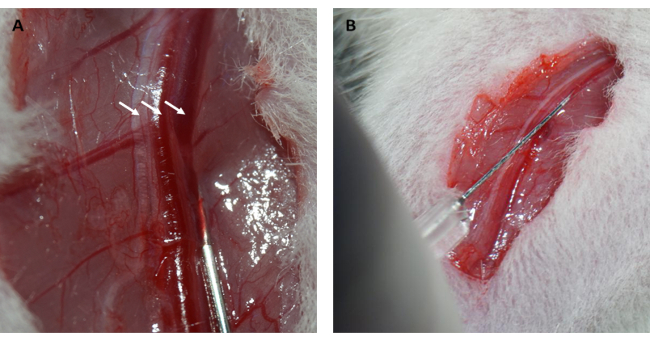
Abbildung 2: Dissektion der Oberschenkelvene und intravenöse Injektion. (A) Freilegung der Vena femoralis (der Nervus femoralis ist durch den Pfeil links gekennzeichnet; die Arteria femoralis ist durch den Pfeil in der Mitte gekennzeichnet; die Vena femoralis ist durch den Pfeil rechts gekennzeichnet). (B) Injektion von FITC-Dextran-Lösung in die Oberschenkelvene mit einer Insulinspritze. Abkürzung: FITC = Fluorescein-Isothiocyanat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
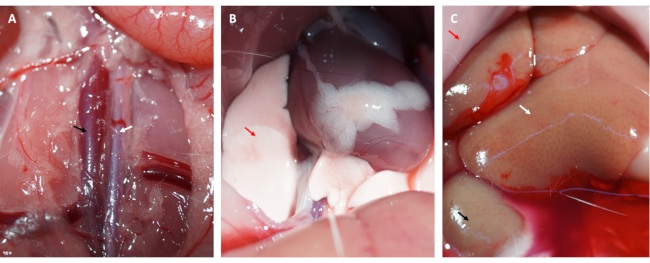
Abbildung 3: Gewebeperfusion und Symptome einer effizienten Durchblutung. (A) Präparierung der Bauchschlagader und der Hohlvene (die Bauchschlagader ist durch den weißen Pfeil gekennzeichnet, die Hohlvene ist durch den schwarzen Pfeil gekennzeichnet). (B) Gebleichte Lungen sind ein Symptom für eine ausreichende Durchblutung; (C) gebleichte Schleimhaut, gebleichte Niere und schwitzende Leber sind Symptome einer ausreichenden Durchblutung (roter Pfeil: Schleimhaut; weißer Pfeil: Leber; schwarzer Pfeil: Niere). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Bilder und Analyse der mittleren Fluoreszenzintensität durch FITC-Dextran-Färbung. (A) Relative Querschnittsfläche jeder Gruppe, normiert auf die der Sham-Gruppe (p > 0,05); (B) relative Fluoreszenzintensität im FITC-Kanal jeder Gruppe, normiert auf die der Scheingruppe; (C) repräsentative Bilder mit 9,5-facher Vergrößerung in jeder Gruppe. Maßstabsleisten = 800 μm. Einseitige ANOVA mit Tukeys Post-hoc-Vergleichen mit mehreren Gruppen. * gegen die Scheingruppe, S. < 0,05; # vs. IR-Gruppe, p < 0,05. Balkendiagramme zeigen den Gruppenmittelwert ± SD. Abkürzungen: IR = Ischämie/Reperfusion; TXL = Tongxinluo; FITC = Fluorescein-Isothiocyanat; DAPI = 4',6-Diamidino-2-phenylindol; ANOVA = Varianzanalyse; SD = Standardabweichung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Bilder der interessierenden Bereiche bei 200-facher Vergrößerung jeder Gruppe nach FITC-Dextran-Färbung. Maßstabsleisten = 50 μm. Abkürzungen: FITC = Fluorescein-Isothiocyanat; DAPI = 4',6-diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung S1: Repräsentative Bilder und Analyse der mittleren Fluoreszenzintensität durch Evans-Blue-Färbung. (A) Relative Querschnittsfläche jeder Gruppe, normiert auf die der Scheingruppe (p > 0,05); (B) relative Fluoreszenzintensität im texanischen roten Kanal jeder Gruppe, normiert auf die der Scheingruppe; (C) repräsentative Bilder in jeder Gruppe. Einseitige ANOVA mit Tukeys Post-hoc-Vergleichen mit mehreren Gruppen. Maßstabsbalken = 800 μm. * vs. Scheingruppe, p < 0,05. Balkendiagramme zeigen den Gruppenmittelwert ± SD. Abkürzungen: IR = Ischämie/Reperfusion; TXL = Tongxinluo; DAPI = 4',6-Diamidino-2-phenylindol; ANOVA = Varianzanalyse; SD = Standardabweichung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S2: Repräsentative Bilder bei 9,5-facher Vergrößerung der FITC-Dextran-Färbung in einem Myokardinfarktmodell. Maßstabsleisten = 800 μm. Abkürzungen: MII = Myokardinfarkt-Injektion zuerst (Injektion von FITC-Dextran vor dem Myokardinfarkt); MIL = Myokardinfarkt-Ligatur zuerst (Injektion von FITC-Dextran unmittelbar nach dem Myokardinfarkt); FITC = Fluorescein-Isothiocyanat; DAPI = 4',6-diamidino-2-phenylindol. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In dieser Arbeit wird ein Protokoll zur Beurteilung der Dysfunktion der kardialen Endothelschranke nach Exposition gegenüber MIRI vorgestellt. Es sollte beachtet werden, dass es mehrere entscheidende Schritte in diesem Protokoll gibt, die die Zuverlässigkeit und Genauigkeit der Ergebnisse bestimmen. Alle Schritte, bei denen FITC-Dextran zum Einsatz kommt, sind in einem dunklen Raum durchzuführen. Die FITC-Dextran/Kochsalzlösungen müssen bei 4 °C gelagert und mit Alufolie umwickelt werden. Zusätzlich müssen die Koronararterien ligiert werden, wie in Abbildung 1 dargestellt, damit das Myokard sofort nach dem Lösen der Schlinge wieder perfundiert werden kann. Forscher können 5-0- oder 6-0-Polyethylen-Nähte wählen, da dünnere Fäden unter 7-0 mit größerer Wahrscheinlichkeit Myokardfasern und -gefäße durchtrennen. Wichtig ist, dass die Tracer-Lösung in die Oberschenkelvenen und nicht in die Schwanzvenen injiziert werden sollte. Jedes Herz sollte vor bzw. nach dem Opfer gut durchblutet und gut mit eiskalter Kochsalzlösung gespült werden.
Viele Forscher, die sich auf MIRI spezialisiert haben, neigen dazu, die gestörte subzelluläre Struktur des Endothels im frühen Stadium der myokardialen Reperfusion zu untersuchen - die Bildung von apoptotischen Körpern, anschwellenden Mitochondrien und abnormalen interzellulären Verbindungen -, um die Hyperpermeabilität des Endothels durch elektronenmikroskopische Untersuchungen zu beweisen. Immunoblotting wurde auch zur Messung der mikrovaskulären Permeabilität eingesetzt, da die Abnahme der Spiegel von Tight-Junction-Proteinen als Kernmechanismus der Endothelverletzung und der Fehlfunktion der Endothelbarriere im Laufe der Zeit angesehen wird. Zum Beispiel sind VE-Cadherin20 und β-Catenin21 Schlüsselelemente von Endothelzell-zu-Zell-Adhäsionsverbindungen, und diese Verbindungen tragen zur Aufrechterhaltung der vaskulären Integritätbei 22. Tight Junctions, wie JAM-A23,24 und Occludin25, beteiligen sich ebenfalls kooperativ am Aufbau der Endothelbarriere im Kreislaufsystem.
Derzeit deutet eine zunehmende Anzahl von Studien darauf hin, dass die mitochondriale Funktion und die mitochondriale Homöostase wichtige Ziele für Schutzwege gegen Reperfusionsschäden sein könnten. Wie in pathophysiologischen und pharmakologischen Studien berichtet, kann die Mitophagie eine wichtige Rolle beim zellulären Tod des Endothels und des Myokards spielen, der durch IR26 induziert wird. Darüber hinaus können die mitochondriale Spaltung, die mitochondriale Proteostase und die mitochondriale Qualitätskontrolle das Hochrisiko-Myokard in reperfundierten Bereichen schützen 27,28. Die oben genannten Methoden konzentrieren sich mehr auf den Nachweis verschiedener Mechanismen oder Ursachen der Hyperpermeabilität als auf die direkte und visuelle Darstellung der endothelialen Permeabilität. Darüber hinaus ist die Probenvorbereitung für die elektronenmikroskopische Untersuchung kompliziert und gefährlich. Glutaraldehyd-, Aceton- und Osmsäurelösungen, die in der Elektronenmikroskopie verwendet werden, verflüchtigen und erodieren wahrscheinlich die Schleimhaut, die Bindehaut und die Haut und bedrohen sogar Leben, wenn sie in unkontrollierten Umgebungen verwendet werden.
Im Vergleich zu diesen indirekten und lebensbedrohlichen Methoden ist diese Methode, die die durch die FITC-Dextran-Extravasation emittierte Fluoreszenzintensität misst, ideal für die Beurteilung der kardialen mikrovaskulären Permeabilität. Erstens können 70.000 Da FITC-Dextran unter normalen physiologischen Bedingungen nicht durch das Endothel dringen, sondern unter IR in den interstitiellen Raum des Myokards, was eine klare Unterscheidung zwischen Ratten unter verschiedenen Behandlungen ermöglicht. Zusätzlich wird die FITC-Dextran-Lösung über die Oberschenkelvenen in das Blut injiziert, wodurch sichergestellt wird, dass die gesamte Flüssigkeit in den Kreislauf der Ratte injiziert wird. Im Gegensatz dazu ist die Injektion der Schwanzvene bei Ratten schwieriger, da die Schwanzvene undeutlich und mit einer dicken Schicht bedeckt ist. Darüber hinaus wird die Behandlung des Myokardgewebes im Gegensatz zur regulären Paraformaldehyd-Fixierung und Paraffin-Einbettung mit der in dieser Studie verwendeten Schnellgefriertechnik des pathologischen Schnitts vereinfacht und optimiert. Kurze Lagerzeit, lichtdichte Umgebung und Kryokonservierung können zusammen die Fluoreszenzlöschung von FITC verringern.
Noch wichtiger ist, dass diese Methode die Selektionsverzerrung während der statistischen Analyse minimieren kann. Wir führen eine ausreichende Herzperfusion mit Kochsalzlösung durch, um sicherzustellen, dass fast das gesamte mit FITC-Dextran vermischte Blut aus dem Myokard und den Herzkammern ausgeschieden wird, wodurch die Fluoreszenz eliminiert werden kann, die von den in den Gefäßen verbleibenden FITC abgegeben wird. Ist dies nicht der Fall, sollte die mit Kapillaren verschmolzene Fluoreszenz ausgeschlossen und künstlich beschnitten werden. Bei der Entnahme von Gewebe aus interessierenden Bereichen wurde keine visuelle Grenze zwischen dem ischämischen Myokard und dem entfernten Myokard beobachtet, insbesondere nach EB-Farbstofffärbung. Dies erschwerte die Entnahme von Proben aus diesen repräsentativen Gebieten. Unter Verwendung des hierin beschriebenen Verfahrens können Forscher Bilder ganzer Abschnitte erhalten und die Fluoreszenzintensität unter Verwendung eines quantitativen Schiebereglers analysieren.
Interessanterweise kann EB-Farbstoff eine Alternative, wenn auch suboptimal, zu FITC-Dextran sein. Verglichen mit den relativ rauen Lagerbedingungen von FITC-Dextran kann EB-Pulver oder seine Lösung bei Raumtemperatur lange Zeit stabil bleiben. Darüber hinaus ist EB für die meisten Institutionen relativ kostengünstig. Dennoch könnten bestimmte Nachteile die Anwendung einschränken. Erstens zeigt die EB-Färbung eine geringere Sensitivität als FITC-Dextran, was die Unterschiede zwischen den Gruppen unterschätzen und die Stichprobengröße jeder Gruppe erhöhen könnte. Außerdem zeigt EB eine stärkere Adhäsion an Proteine. Das Endokard und das Epikard werden leichter durch EB gefärbt, was die Ergebnisse der Fluoreszenzdichte beeinflussen kann. Darüber hinaus verringern offensichtliche Füllfehler im Reperfusionsbereich die Bildqualität deutlich, was den Einsatz von EB einschränken kann.
Um die Anwendung dieser Methode in einem MI-Modell zu erweitern, wurde die Methode in einem MI-Modell getestet. Zunächst wurde FITC-Dextran nach der LAD-Ligatur in die Blutgefäße injiziert. Wie erwartet wurde eine geringe Fluoreszenz von der Scheibe emittiert, da FITC-Dextran im Blutfluss die ligierte Stelle nicht passieren kann und kein FITC-Dextran in den ischämischen Bereich gelangte. FITC-Dextran wurde ebenfalls 5 Minuten vor der Ligatur appliziert, um die Passage von FITC-Dextran in alle Organe zu gewährleisten. Folglich konnte FITC-Dextran das mikrovaskuläre Endothel nicht durchdringen, wahrscheinlich weil kein Perfusionsdruck in ligierten Blutgefäßen FITC-Dextran durch das Endothel treiben kann. Im Allgemeinen erfordert diese Methode wahrscheinlich deutlich mehr Modifikationen, um ihre Anwendung im MI-Modell zu erfüllen.
Trotz der oben genannten Vorteile gibt es bei dieser Methode Einschränkungen. Erstens wurde dieses Protokoll nicht in IR-Modellen anderer Tiere getestet, was seine Anwendung in präklinischen und klinischen Studien einschränken könnte. Zweitens sind FITC-markierte Farbstoffe teurer als andere gängige Farbstoffe wie EB. Im Gegensatz zu EB können jedoch die 10%ige W/V-FITC-Dextran-Lösung, verdünnt mit Serum, die Farbe des Myokards nur selten verändert, die FITC-Dextran-Färbung und die EB/2,3,5-Triphenyltetrazolchlorid (TTC)-Doppelfärbung im selben Herzen durchgeführt werden, was das Budget in Bezug auf die Anzahl der Tiere und die verwendeten Farbstoffe kürzen kann. Zu guter Letzt ist der in dieser Studie verwendete Objektträgerscanner - der quantitative Objektträgerscanner und ähnliche Instrumente - in einigen Laboratorien möglicherweise nicht verfügbar. Zusammenfassend stellt dieses Protokoll eine vereinfachte, zuverlässige und visuelle Methode zum Nachweis der kardialen mikrovaskulären endothelialen Permeabilität in einem IR-Modell bei Ratten unter Verwendung eines Fluoreszenzassays dar, der auf einem automatisierten quantitativen Bildgebungssystem für die Pathologie basiert. Dieses Protokoll zeigt, dass 70.000 Da FITC-Dextran bei der funktionellen Beurteilung der Endothelbarriere von kardialen Mikrogefäßen nach IR-Verletzung besser abschneidet als EB.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Studie wurde durch Zuschüsse des National Key Research and Development Program of China (Nr. 2017YFC1700503) und der National Natural Science Foundation of China (Nr. 81874461 und Nr. 81774292) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
Referenzen
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59(2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349(2019).
- Li, B. -R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032(2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037(2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403(2018).
- Zhang, H. -T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775(2017).
- Yu, Z. -H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -X., Wang, P., Wang, N. -N., Li, S. -D., Yang, M. -H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485(2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23(2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156(2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten