A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نظام زراعة آلي للاستخدام في الاختبارات قبل السريرية للعلاجات الموجهة للمضيف لمرض السل
In This Article
Summary
يعد القياس الكمي السريع والفعال لنمو المتفطرة السلية داخل الخلايا أمرا بالغ الأهمية لمتابعة العلاجات المحسنة ضد السل (TB). يصف هذا البروتوكول مقايسة الكشف اللوني القائمة على المرق باستخدام نظام زراعة سائل آلي لتحديد نمو MTB في الضامة المعالجة بالعلاجات الموجهة للمضيف المرشح.
Abstract
كانت المتفطرة السلية (Mtb) ، العامل المسبب لمرض السل (TB) ، أهم قاتل للأمراض المعدية على مستوى العالم حتى ظهور COVID-19. تطور MTB ليستمر في بيئته داخل الخلايا ، ويتهرب من دفاعات المضيف ، وقد طور مقاومة للعديد من الأدوية المضادة للسل. تتمثل إحدى طرق حل المقاومة في تحديد الأدوية المعتمدة الحالية التي ستعزز الاستجابة المناعية للمضيف ل MTB. يمكن بعد ذلك إعادة استخدام هذه الأدوية كعلاجات مساعدة موجهة للمضيف (HDT) لتقصير وقت العلاج والمساعدة في التغلب على مقاومة المضادات الحيوية.
يعد القياس الكمي لنمو MTB داخل الخلايا في الضامة جانبا حاسما في تقييم HDT المحتمل. المعيار الذهبي لقياس نمو MTB هو حساب وحدات تشكيل المستعمرات (CFU) على ألواح أجار. هذا اختبار بطيء كثيف العمالة لا يصلح للفحص السريع للأدوية. في هذا البروتوكول ، تم تكييف نظام استزراع آلي قائم على المرق ، والذي يستخدم بشكل أكثر شيوعا للكشف عن Mtb في العينات السريرية ، للفحص قبل السريري للعلاجات الموجهة للمضيف. تم تقييم قدرة نظام مقايسة الاستزراع السائل على التحقيق في نمو MTB داخل الخلايا في البلاعم المعالجة ب HDT. كانت HDTs التي تم اختبارها لقدرتها على تثبيط نمو Mtb عبارة عن حمض الريتينويك المتحول بالكامل (AtRA) ، سواء في المحلول أو المغلف في الجسيمات الدقيقة المتعددة (حمض اللاكتيك - كو - الجليكوليك) (PLGA) ومزيج من إنترفيرون جاما ولينيزوليد. تشمل مزايا هذه التقنية الآلية القائمة على الاستزراع السائل على طريقة CFU بساطة الإعداد ، وإعداد أقل كثافة في العمل ، ووقت أسرع للنتائج (5-12 يوما مقارنة ب 21 يوما أو أكثر لألواح الآجار).
Introduction
كانت المتفطرة السلية (Mtb) ، العامل المسبب للسل ، أهم قاتل للأمراض المعدية على مستوى العالم في عام 20191. للتهرب من دفاعات المضيف ، يخرب Mtb نشاط المتفطرات للخلايا المناعية الفطرية مثل الضامة والخلايا المتغصنة (DCs) ، مما يسمح لها بالاستمرار داخل الخلايا وتكرار2. إن عدم وجود لقاح فعال للوقاية من السل الرئوي لدى البالغين والظهور المتزايد للسلالات المقاومة للأدوية يسلط الضوء على الحاجة الملحة إلى علاجات جديدة.
يمكن للعلاجات المساعدة الموجهة للمضيف (HDT) تقصير وقت العلاج والمساعدة في التغلب على المقاومة3. غالبا ما يعتمد التقييم قبل السريري لمرشحي HDT في المختبر لتحديد نشاط مبيدات الفطريات داخل البلاعم على القياس الكمي لنمو Mtb بواسطة وحدات تشكيل المستعمرة (CFU) على ألواح أجار صلبة. هذا اختبار بطيء كثيف العمالة لا يصلح للفحص السريع للأدوية. تستخدم أنظمة الكشف عن الميكروبات الآلية القائمة على المرق المتاحة تجاريا بشكل أكثر شيوعا في مختبرات علم الأحياء الدقيقة السريرية للكشف واختبار حساسية الأدوية ل Mtb وأنواع المتفطرات الأخرى في العينات السريرية4. تقيس هذه الأدوات النمو بشكل غير مباشر بناء على النشاط الأيضي البكتيري الذي يؤدي إلى تغيرات فيزيائية في وسائط الاستزراع (التغير في مستويات أو ضغط ثاني أكسيد الكربون 2 أو O2) الذي يتم رصده بمرور الوقت5. القراءة هي حان الوقت للإيجابية (TPP) ، والتي ثبت سابقا أنها ترتبط ب Mtb CFU في عينات البلغم لمرضى السل استجابة للعلاج 6,7 وفي محللات رئة الفئران المصابة والطحال8. بالإضافة إلى ذلك ، تم استخدام أنظمة الكشف عن الاستزراع السائل لقياس تأثير العلاجات التقليدية الموجهة لمسببات الأمراض على نمو المتفطرات في الثقافة المحورية والبلاعم المستزرعة9،10. كما تم استخدام الأداة للتحقيق في القدرة الفطرية للخلايا المتغصنة والبلاعم السنخية للتحكم في النمو داخل الخلايا ل Mtb11,12. يوضح هذا البروتوكول التجريبي أنه يمكن تكييف نظام تشخيص المزرعة السائلة لإجراء الفحص قبل السريري ل HDT لمرض السل في الضامة المستزرعة. بالمقارنة مع تعداد CFU ، فإن الميزة الرئيسية لهذه التقنية هي أنها تقلل بشكل كبير من العمل التجريبي والوقت اللازم لتحديد نمو / بقاء المتفطرات داخل الخلايا. تعتمد هذه التقنية على الوصول إلى أداة زراعة آلية يمكن استخدامها لتقييم بقاء المتفطرات داخل الخلايا في الخلايا المناعية المعالجة بمجموعة واسعة من الكواشف الدوائية التي تستهدف الوظائف الخلوية لتعزيز مناعة المضيف.
Protocol
تم إجراء التجارب الموضحة في هذا البروتوكول باستخدام سلالة H37Ra الموهنة من MTB ، والتي يمكن التعامل معها في مختبر مستوى الاحتواء 2. تم تنفيذ جميع عمليات التلاعب بالمتفطرات الحية في خزانة السلامة البيولوجية من الفئة الثانية (BSC). تم تصميم الإجراءات التجريبية لتقليل توليد الهباء الجوي. كما تم إجراء زراعة الخلايا حقيقية النواة (خلايا THP-1) في الفئة الثانية BSC. وأجرى المختبر تقييما للمخاطر وتأكد من تنفيذ جميع الإجراءات بما يتماشى مع اللوائح المؤسسية والوطنية للسلامة البيولوجية. تم استخدام خط خلية THP-1 أحادي الخلية البشرية لتنفيذ الطريقة كما هو موضح (الخطوة 1). يتم تمييز الخلايا إلى بلاعم بعد التحفيز باستخدام phorbol 12-myristate 13-acetate (PMA) قبل الإصابة بالمتفطرات.
1. ثقافة الخلية
- نشر مخزون بذور H37Ra لتسجيل المرحلة في مرق ميدلبروك 7H9 (MB) المكمل بإثراء الألبومين - سكر العنب - الكاتلاز (ADC) (10٪) و 0.05٪ بوليسوربات 80. قم بتخزين مخزون H37Ra في 1 مل في فريزر -80 درجة مئوية لمدة تصل إلى عام واحد.
- قم بإذابة قارورة 1 مل من Mtb-H37Ra وانقلها إلى قارورة T25 مع غطاء مرشح يحتوي على 9 مل من مرق MB المكمل قبل أسبوع تقريبا من التجربة المخطط لها. احتضان عند 37 درجة مئوية لمدة 5-7 أيام في حاضنة ثابتة.
- تنمو خلايا THP-1 في RPMI-1640 مكملة بمصل عجل جنيني غير مقتول بالحرارة بنسبة 10٪ (كاملة (c) RPMI) في قارورة T75 في حاضنة مرطبة CO 2 عند 5٪ CO2/37 °C وزراعة فرعية مرتين في الأسبوع للحفاظ على كثافة أقل من 1 × 106 خلايا / مل.
- قم بتفريق خلايا THP-1 إلى بلاعم قبل 3 أيام من الإصابة عن طريق سحب الخلايا برفق عدة مرات باستخدام ماصة مصلية في قوارير T75 لتفريق أي كتل ووضعها في أنبوب مخروطي سعة 50 مل.
- خلايا الطرد المركزي في 300 × غرام لمدة 10 دقائق في درجة حرارة الغرفة ، صب قبالة الطافي ، وإعادة تعليق بلطف بيليه في 2 مل من RPMI. قم بإجراء عدد الخلايا لتقدير الخلايا / مل.
- بذرة 2 مل من البلاعم THP-1 في ألواح زراعة الأنسجة ذات 12 بئرا بكثافة 100000 خلية / مل في cRPMI مع 100 نانوغرام / مل PMA لمدة 72 ساعة. قم بإزالة الوسط المحتوي على PMA من الخلايا وقم بتجديده باستخدام cRPMI الطازج قبل الإصابة ب MTB.
- قم بإعداد لوحات فردية لكل نقطة زمنية مطلوبة.
- خلايا البذور بنفس الكثافة (100000 خلية / مل) في منزلقات زجاجية ذات 2 بئر لتحديد تعدد العدوى (MOI).
- ضعه في حاضنة مرطبة بنسبة 5٪ CO2 لمدة 3 أيام عند 37 درجة مئوية.
2. القياس الكمي لامتصاص MTB
- تحديد امتصاص البلاعم ل MTB (MOI)
- قم بإعداد خزانة السلامة البيولوجية من الفئة الثانية (BSC) في يوم الإصابة واعمل على طبقتين من المناديل الورقية لالتقاط أي انسكابات. قم بإعداد حاويات التخلص من النفايات وفقا للوائح المحلية.
- قم بإزالة 6-8 مل من مزرعة المتفطرات من قارورة T25 وانقلها إلى أنبوب بولي بروبيلين سعة 15 مل.
ملاحظة: يمكن استخدام أنابيب أصغر حجما للتجارب الأصغر. - جهاز طرد مركزي للأنبوب في جهاز طرد مركزي منضدة في درجة حرارة الغرفة لمدة 10 دقائق عند 2890 × جم.
- قم بإزالة الأنبوب بعناية من جهاز الطرد المركزي ونقله إلى خزانة السلامة البيولوجية. انتظر 1 دقيقة للسماح للبكتيريا بالاستقرار.
- اسكب المادة الطافية في حاوية التخلص من المطهر ، وقم بتغليف الأنبوب ، وأعد تعليق البكتيريا في الوسط المتبقي عن طريق النقر على جانب الأنبوب. انتظر 1 دقيقة للسماح للبكتيريا بالاستقرار.
- أضف 2 مل من cRPMI الدافئ مسبقا ، واخلطه برفق ، وانقله إلى أنبوب مخروطي سعة 50 مل.
- أعد تعليق المتفطرات بعناية فائقة باستخدام إبرة 25 جم وحقنة 5 مل. للإنعاش ، ارسم تعليق المتفطرات في المحقنة وأخرجه برفق شديد أسفل الجدار الجانبي للأنبوب لتقليل إنتاج الهباء الجوي. كرر 6-8 مرات.
ملاحظة: توخي أقصى درجات الحذر لأن هذه ثقافة عالية الكثافة من المتفطرات. لتجنب خطر إصابة وخز الإبر ، استخدم الإبر الحادة حيثما أمكن ، ومحاقن قفل Luer. - تخلص من الإبرة والمحقنة في حاوية الأدوات الحادة في BSC.
- انقل التعليق إلى أنبوب ميكروفوج سعة 2 مل (مع غطاء لولبي) وأجهزة طرد مركزي في درجة حرارة الغرفة لمدة 3 دقائق عند 100 × جم لحبيبات أي كتل متبقية. أعد الأنبوب إلى خزانة الأمان وانتظر 1 دقيقة للسماح للبكتيريا بالاستقرار.
- انقل الجزء العلوي 1-1.5 مل من المادة الطافية إلى أنبوب جديد. تخلص من الأنبوب الأصلي في دلو النفايات الذي يحتوي على مطهر. تخلط جيدا وتضاف كميات مختلفة من تعليق المتفطرات (على سبيل المثال ، 5 ، 25 ، 50 ، 150 ميكرولتر) إلى منزلقات الغرفة الزجاجية ذات البئرين وتحتضنها لمدة 3 ساعات في حاضنة CO2 عند 37 درجة مئوية.
- تلطيخ للبكتيريا الحمضية السريعة (AFB)
ملاحظة: بعد 3 ساعات من الحضانة ، يتم غسل الضامة وتثبيتها باستخدام بارافورمالدهيد لتعطيل المتفطرات. ثم يتم تلطيخ الشرائح باستخدام مجموعة Auramine O المعدلة (انظر جدول المواد) لتقدير المتفطرات البلعمية لكل خلية. بسبب جدار الخلية الشمعي ، تحتفظ المتفطرات بصبغة Auramine بعد غسل الكحول الحمضي. ثم يتم تلطيخ نوى البلاعم ب Hoechst. تسمح هذه الطريقة بحساب عدد البكتيريا البلعمية لكل خلية وتستخدم لتحديد تعدد العدوى (MOI) للبلاعم.- قم بإزالة الوسط من الحجرة الزجاجية المنزلق بعد السحب لأعلى ولأسفل ثلاث مرات لإزاحة البكتيريا التي لم يتم البلعمة.
- يغسل مرة واحدة مع 2 مل من PBS درجة حرارة الغرفة.
- تخزين مخزون من 4 ٪ بارافورمالدهيد ، يذوب في PBS في القسمة في -20 درجة مئوية لمدة تصل إلى 6 أشهر. قم بإذابة حصة 4٪ بارافورمالدهيد مباشرة قبل الاستخدام. تمييع إلى 2 ٪ بارافورمالدهيد مع PBS وإضافة 2 مل لكل بئر.
- احتضان لمدة 10 دقائق في درجة حرارة الغرفة. يمكن إزالة شريحة الغرفة الزجاجية من خزانة الأمان في هذه المرحلة للتلطيخ.
- اغسل الشريحة تحت تيار لطيف من ماء الصنبور.
- الاستغناء عن ما يكفي من Auramine على الشريحة لتغطية الخلايا باستخدام ماصة نقل بلاستيكية واحتضانها لمدة 1 دقيقة في درجة حرارة الغرفة في الظلام (مع تغطية رقائق الألومنيوم).
- اغسل الصبغة الزائدة من الشريحة بماء الصنبور وأضف مزيل اللون / المروي لمدة 1 دقيقة في الظلام.
- اغسل الفائض بماء الصنبور واحتضنه لمدة 15 دقيقة في درجة حرارة الغرفة باستخدام Hoechst 33342 (10 ميكروغرام / مل في برنامج تلفزيوني) في الظلام.
- اغسل بقعة Hoechst بماء الصنبور ، وقم بإزالة الغرف ، واستنزاف المياه الزائدة من الشريحة ، وإضافة قطرة من مانع التلاشي والغطاء ، وجفف في الهواء.
- افحص الشريحة تحت المجهر الفلوري باستخدام هدف الزيت 100x. سوف تتألق المتفطرات باللون الأخضر تحت مرشح FITC. تتألق النوى باللون الأزرق تحت مرشح DAPI (الشكل 1C).
- أوجد MOI عن طريق حساب عدد المتفطرات البلعمية لكل خلية والنسبة المئوية للخلايا المصابة.
- حساب حجم تعليق المتفطرات اللازمة لتحقيق MOI المطلوب بناء على مساحة سطح البئر في اللوحة ؛ على سبيل المثال، مساحة سطح شرائح الغرفة الزجاجية المستخدمة في هذه التجربة هي ٤سم٢. انخفاض MOI (حوالي 1-2 عصيات / خلية) أمر مرغوب فيه للتجارب التي أجريت على مدى عدة أيام (على سبيل المثال ، 5 أيام).
- عدوى البلاعم
- امزج معلق المتفطرات جيدا وأضف الكمية اللازمة للخلايا على ألواح 12 بئرا بمجرد تحديد الحجم المطلوب لتحقيق MOI المطلوب.
- احتضان عند 37 درجة مئوية لمدة 3 ساعات للسماح للبكتيريا بالبلعمة.
- قم بإزالة البكتيريا خارج الخلية عن طريق غسل الآبار إما باستخدام RPMI الدافئ أو HBSS عدة مرات.
- قم بتحليل البلاعم في بئر واحد (عينة 3 ساعات) لتحديد النسبة المئوية لوقت الإيجابية (TTP) لللقاح الأولي (عينة 3 ساعات) كما هو موضح في الخطوة 3 أدناه.
- أضف cRPMI الطازج وجرعات الدواء المطلوبة أو التحكم في السيارة إلى الآبار المتبقية ، واحتضان الألواح في حاضنة CO2 عند 37 درجة مئوية للوقت اللازم (يعتمد على التصميم التجريبي ولكن عادة على عدة فترات بين 1 إلى 8 أيام).
3. حصاد العينات لنظام الكشف عن الاستزراع السائل
ملاحظة: في يوم الإصابة ، تتم إزالة المتفطرات خارج الخلية عن طريق الغسيل ، ويتم حصاد المتفطرات داخل الخلايا عن طريق تحلل بئر واحد من الضامة (عينة 3 ساعات) لتحديد الكمية الأولية البلعمية كخط أساس للتحكم في العدوى. في أوقات لاحقة ، يتم الجمع بين كل من الوسط ، وتحلل الخلية ، والغسول لقياس النمو الكلي للبكتيريا. يمكن أيضا تقييم النمو خارج الخلية وداخل الخلايا بشكل منفصل إذا رغبت في ذلك.
- حصاد عينة 3 ساعات لتحديد TTP
- اغسل المتفطرات خارج الخلية من جميع الآبار بعد 3 ساعات الأولى من العدوى كما هو موضح في الخطوة 2.3.3. أضف 1 مل من الوسائط الطازجة إلى بئر التحكم لمدة 3 ساعات لمعادلة حجم المحللة مع تلك الموجودة في النقاط الزمنية اللاحقة.
ملاحظة: انظر الخطوة 3.2.7 إذا كان سيتم استبعاد المتفطرات خارج الخلية من التحليل.
- اغسل المتفطرات خارج الخلية من جميع الآبار بعد 3 ساعات الأولى من العدوى كما هو موضح في الخطوة 2.3.3. أضف 1 مل من الوسائط الطازجة إلى بئر التحكم لمدة 3 ساعات لمعادلة حجم المحللة مع تلك الموجودة في النقاط الزمنية اللاحقة.
- جمع العينات
- قم بتسخين مرق MB وزجاجات ثقافة الأدوات لإحضارها إلى درجة حرارة الغرفة.
- انقل الوسيط من اللوحة المكونة من 12 بئرا إلى الأنابيب المخروطية ذات العلامات المقابلة.
- أضف 500 ميكرولتر من محلول التحلل المعقم (0.1٪ Triton x-100 في PBS تمت تصفيته من خلال مرشح معقم 0.2 ميكرومتر) إلى كل بئر لمدة 10 دقائق.
- كشط الخلايا برفق من البئر باستخدام مكشطة معقمة ودمجها مع الوسط في الأنبوب المخروطي المناسب.
- اغسل البئر ب 0.5 مل من PBS المعقم وانقله إلى الأنبوب المناسب.
- مرر كل عينة برفق من خلال إبرة ومحقنة (25 جم) 6-8 مرات لتفتيت الكتل. تمييع عينات 1:10 في مرق MB ؛ عينة 100 ميكرولتر + 900 ميكرولتر ميجابايت متوسطة.
- في الأوقات / الأيام المطلوبة (عادة ما بين 1 إلى 8 أيام) ، احصد العينات المتبقية باتباع الخطوات 3.2.1 إلى 3.2.6 أعلاه.
ملاحظة: قد يفضل الباحثون استبعاد المتفطرات خارج الخلية من تحليلهم ، وفي هذه الحالة ، في الخطوة 3.2.2 أعلاه ، يتم التخلص من الوسط من كل بئر ، ويتم غسل البلاعم عدة مرات قبل إضافة محلول التحلل.
- تلقيح وتحميل زجاجات ثقافة الأدوات
ملاحظة: يتم توفير تفاصيل أداة الاستزراع السائل والمواد الاستهلاكية ذات الصلة في جدول المواد.- قم بتعقيم الغطاء المطاطي لزجاجة ثقافة الأداة بمناديل ورقية مبللة بنسبة 70٪ كحول واتركها تجف في الهواء.
ملاحظة: يجب تنفيذ هذه الخطوة في BSC. - تحضير الزجاجات عن طريق نقل ما يكفي من المكملات الغذائية لجميع العينات إلى أنبوب مخروطي (0.5 مل / زجاجة). استخدم إبرة ومحقنة لحقن 0.5 مل من مكمل المغذيات في زجاجة ثقافة الأداة.
- ماصة 500 ميكرولتر من العينة المخففة (1:10) في أنبوب 1 مل ذو قاع V.
- استخدم إبرة ومحقنة لحقن 500 ميكرولتر من العينة في زجاجة ثقافة الأدوات المخصصة.
- قم بتعقيم الغطاء المطاطي لزجاجة ثقافة الأداة بمناديل ورقية مبللة بنسبة 70٪ كحول واتركها تجف في الهواء. امسح الزجاجات بالمناديل الورقية المنقوعة في 70٪ كحول قبل إزالتها من BSC.
- نقل الزجاجات بعناية من خزانة السلامة الحيوية إلى أداة التحميل.
- اضغط على زر التحميل في نظام الكشف الآلي عن الميكروبات.
- امسح الرموز الشريطية الموجودة على زجاجات ثقافة الأجهزة وضع الزجاجات في حاضنة نظام الكشف عند 37 درجة مئوية لمدة تصل إلى 42 يوما. اقرأ وسجل الوقت المستغرق للوصول إلى الإيجابية من شاشة العدادات.
ملاحظة: يسمح الرمز الشريطي للأداة بتحديد الزجاجة وربط قراءات الانعكاس بزجاجة معينة. - احسب النسبة المئوية للوقت إلى الإيجابية (TTP) من خلال مقارنة TTP للقاح الأولي داخل الخلايا (اليوم 0) مع تلك الخاصة بالبلاعم المستزرعة في الأوقات المشار إليها. التغيير الإيجابي في النسبة المئوية TTP يعني نمو المتفطرات13.
على سبيل المثال ، لليوم 3:
النسبة المئوية للتغير في الوقت المناسب للإيجابية =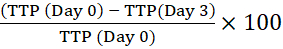
- قم بتعقيم الغطاء المطاطي لزجاجة ثقافة الأداة بمناديل ورقية مبللة بنسبة 70٪ كحول واتركها تجف في الهواء.
النتائج
تراقب أداة الاستزراع السائل الآلية المستخدمة في هذه الدراسة مستويات CO2 كل 10 دقائق. يتم قياس تغير اللون في المستشعر الموجود أسفل زجاجة الجهاز بالألوان ويتم التعبير عنه كوحدات انعكاس. ثم يطبق برنامج الأداة خوارزميات الكشف لحساب الوقت إلى الإيجابية (TTP) ، أي عدد الأيام من التلقيح حتى يت?...
Discussion
استخدم المؤلفون طريقة الاستزراع السائل الموصوفة في هذا البروتوكول لمراقبة نمو MTB في الضامة المشتقة من الخلايا الوحيدة والبلاعم السنخية وخلايا THP-1 المتمايزة مع PMA11،16،17. يمكن أيضا تعديل هذه التقنية للاستخدام مع الخلايا غير الملتصقة
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل مؤسسة العلوم في أيرلندا (SFI 08 / RFP / BMT1689) ، ومجلس البحوث الصحية في أيرلندا [HRA-POR / 2012/4 و HRA-POR-2015-1145] وصندوق مستشفى مدينة دبلن الملكية.
Materials
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
References
- WHO. Global Tuberculosis Report. World Health Organization. , (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184 (2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237 (2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588 (2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151 (2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645 (2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), 453-488 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved