Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un sistema de cultivo automatizado para su uso en pruebas preclínicas de terapias dirigidas al huésped para la tuberculosis
En este artículo
Resumen
La cuantificación rápida y eficiente del crecimiento intracelular de M. tuberculosis es crucial para buscar mejores terapias contra la tuberculosis (TB). Este protocolo describe un ensayo de detección colorimétrica basado en caldo utilizando un sistema automatizado de cultivo líquido para cuantificar el crecimiento de Mtb en macrófagos tratados con terapias candidatas dirigidas al huésped.
Resumen
Mycobacterium tuberculosis (Mtb), el agente causal de la tuberculosis (TB), fue la enfermedad infecciosa más importante a nivel mundial hasta la llegada de COVID-19. Mtb ha evolucionado para persistir en su entorno intracelular, evadir las defensas del huésped y ha desarrollado resistencia a muchos medicamentos antituberculosos. Un enfoque para resolver la resistencia es identificar los medicamentos aprobados existentes que aumentarán la respuesta inmune del huésped a Mtb. Estos medicamentos podrían reutilizarse como terapias complementarias dirigidas al huésped (HDT) para acortar el tiempo de tratamiento y ayudar a superar la resistencia a los antibióticos.
La cuantificación del crecimiento intracelular de Mtb en macrófagos es un aspecto crucial de la evaluación del HDT potencial. El estándar de oro para medir el crecimiento de Mtb es contar unidades formadoras de colonias (UFC) en placas de agar. Este es un ensayo lento y laborioso que no se presta a la detección rápida de medicamentos. En este protocolo, se ha adaptado un sistema de cultivo automatizado basado en caldo, que se usa más comúnmente para detectar Mtb en muestras clínicas, para la detección preclínica de terapias dirigidas al huésped. Se evaluó la capacidad del sistema de ensayo de cultivo líquido para investigar el crecimiento intracelular de Mtb en macrófagos tratados con HDT. Los HDT probados por su capacidad para inhibir el crecimiento de Mtb fueron ácido retinoico todo-trans (AtRA), tanto en solución como encapsulado en micropartículas de poli(ácido láctico-co-glicólico) (PLGA) y la combinación de interferón-gamma y linezolid. Las ventajas de esta técnica automatizada basada en el cultivo líquido sobre el método CFU incluyen simplicidad de configuración, preparación menos laboriosa y un tiempo de obtención de resultados más rápido (5-12 días en comparación con 21 días o más para las placas de agar).
Introducción
Mycobacterium tuberculosis (Mtb), el agente causal de la tuberculosis, fue la enfermedad infecciosa más importante a nivel mundial en 20191. Para evadir las defensas del huésped, Mtb subvierte la actividad micobactericida de las células inmunes innatas como los macrófagos y las células dendríticas (DC), lo que le permite persistir intracelularmente y replicarse2. La falta de una vacuna eficaz para prevenir la tuberculosis pulmonar en adultos y la creciente aparición de cepas resistentes a los medicamentos ponen de relieve la necesidad urgente de nuevas terapias.
Las terapias complementarias dirigidas al huésped (HDT) podrían acortar el tiempo de tratamiento y ayudar a superar la resistencia3. La evaluación preclínica de los candidatos a HDT in vitro para determinar la actividad micobactericida dentro de los macrófagos a menudo se basa en la cuantificación del crecimiento de Mtb por unidades formadoras de colonias (UFC) en placas sólidas de agar. Este es un ensayo lento y laborioso que no se presta a la detección rápida de medicamentos. Los sistemas automatizados de detección microbiana basados en caldos disponibles comercialmente se utilizan más comúnmente en los laboratorios de microbiología clínica para la detección y las pruebas de susceptibilidad a los medicamentos de Mtb y otras especies micobacterianas en muestras clínicas4. Estos instrumentos miden el crecimiento indirectamente en función de la actividad metabólica bacteriana que conduce a cambios físicos en los medios de cultivo (cambio en los niveles o presión de CO2 uO2) monitoreados a lo largo del tiempo5. La lectura es el tiempo de positividad (TPP), que previamente se ha demostrado que se correlaciona con Mtb CFU en muestras de esputo de pacientes con TB en respuesta al tratamiento 6,7 y en lisados de pulmón y bazo murinos infectados8. Además, se han utilizado sistemas de detección de cultivos líquidos para medir el efecto de las terapias convencionales dirigidas a patógenos sobre el crecimiento de micobacterias en cultivo axénico y macrófagos cultivados 9,10. El instrumento también se ha utilizado para investigar la capacidad innata de las células dendríticas y de los macrófagos alveolares para controlar el crecimiento intracelular de Mtb11,12. Este protocolo experimental demuestra que se puede adaptar un sistema de diagnóstico de cultivo líquido para realizar el cribado preclínico de HDT para TB en macrófagos cultivados. En comparación con la enumeración de UFC, la principal ventaja de esta técnica es que reduce considerablemente el trabajo experimental y el tiempo requerido para cuantificar el crecimiento/supervivencia micobacteriana intracelular. Esta técnica se basa en el acceso a un instrumento de cultivo automatizado que se puede utilizar para evaluar la supervivencia micobacteriana intracelular en células inmunes tratadas con una amplia gama de reactivos farmacológicos dirigidos a las funciones celulares para aumentar la inmunidad del huésped.
Protocolo
Los experimentos descritos en este protocolo se llevaron a cabo utilizando la cepa atenuada H37Ra de Mtb, que se puede manejar en un laboratorio de Contención de Nivel 2. Todas las manipulaciones de micobacterias vivas se llevaron a cabo en un gabinete de seguridad biológica (BSC) de Clase II. Se diseñaron procedimientos experimentales para minimizar la generación de aerosoles. El cultivo de células eucariotas (células THP-1) también se llevó a cabo en un BSC de Clase II. El laboratorio llevó a cabo una evaluación de riesgos y se aseguró de que todos los procedimientos se llevaran a cabo de conformidad con las normas institucionales y nacionales de seguridad biológica. Se utilizó la línea celular monocítica humana THP-1 para realizar el método descrito (paso 1). Las células se diferencian en macrófagos después de la estimulación con forbol 12-miristato 13-acetato (PMA) antes de la infección con micobacterias.
1. Cultivo celular
- Propague el stock de semillas de H37Ra a la fase logarítmica en caldo Middlebrook 7H9 (MB) suplementado con enriquecimiento de albúmina-dextrosa-catalasa (ADC) (10%) y polisorbato al 0,05% 80. Almacene las existencias de H37Ra en alícuotas de 1 ml en un congelador a -80 °C durante un máximo de 1 año.
- Descongele un vial de 1 ml de Mtb-H37Ra y transfiéralo a un matraz T25 con una tapa filtrante que contenga 9 ml de caldo suplementado con MB aproximadamente 1 semana antes del experimento planificado. Incubar a 37 °C durante 5-7 días en una incubadora estática.
- Cultivar células THP-1 en RPMI-1640 suplementadas con suero fetal de ternera al 10% sin muerte por calor (RPMI (c)completo) en un matraz T75 en una incubadora humidificada con CO2 al 5% y subcultivo dos veces por semana para mantener una densidad de menos de 1 x 106 células/ml.
- Diferenciar las células THP-1 en macrófagos 3 días antes de la infección pipeteando suavemente las células varias veces con una pipeta serológica en matraces T75 para dispersar cualquier grupo y colocarlos en un tubo cónico de 50 ml.
- Centrifugar las células a 300 x g durante 10 min a temperatura ambiente, decantar el sobrenadante y resuspender suavemente el pellet en 2 ml de RPMI. Realizar el recuento de células para estimar células/ml.
- Seembrar 2 mL de macrófagos THP-1 en placas de cultivo tisular de 12 pocillos a una densidad de 100.000 células/mL en cRPMI con 100 ng/mL PMA durante 72 h. Retire el medio que contiene PMA de las células y reponga con cRPMI fresco antes de la infección por Mtb.
- Configure placas individuales para cada punto de tiempo requerido.
- Células semilla con la misma densidad (100.000 células/ml) en portaobjetos de cámara de vidrio de 2 pocillos para determinar la multiplicidad de la infección (MOI).
- Colocar en una incubadora humidificada deCO2 al 5% durante 3 días a 37 °C.
2. Cuantificación de la captación de Mtb
- Determinación de la captación de Mtb por macrófagos (MOI)
- Instale el gabinete de seguridad biológica (BSC) de clase II el día de la infección y trabaje en dos capas de papel de seda para detectar cualquier derrame. Configure contenedores de desecho de residuos de acuerdo con las regulaciones locales.
- Extraer 6-8 ml de cultivo micobacteriano del matraz T25 y transferirlo a un tubo de polipropileno de 15 ml.
NOTA: Los tubos de menor volumen se pueden utilizar para experimentos más pequeños. - Centrifugar el tubo en una centrífuga de sobremesa a temperatura ambiente durante 10 min a 2890 x g.
- Retire con cuidado el tubo de la centrífuga y transfiéralo al gabinete de seguridad biológica. Espere 1 minuto para permitir que las bacterias se asienten.
- Vierta el sobrenadante en el recipiente de desecho del desinfectante, vuelva a tapar el tubo y resuspenda las bacterias en el medio restante golpeando el costado del tubo. Espere 1 minuto para permitir que las bacterias se asienten.
- Agregue 2 ml de cRPMI precalentado, mezcle suavemente y transfiera a un tubo cónico de 50 ml.
- Resuspender las micobacterias con mucho cuidado con una aguja de 25 G y una jeringa de 5 ml. Para resuspender, extraiga la suspensión de micobacterias en la jeringa y expulse muy suavemente por la pared lateral del tubo para minimizar la producción de aerosol. Repita 6-8 veces.
NOTA: Tenga la máxima precaución ya que se trata de un cultivo de micobacterias de alta densidad. Para evitar el riesgo de lesiones por pinchazo de aguja, use agujas romas siempre que sea posible y jeringas Luer lock. - Deseche la aguja y la jeringa en un recipiente para objetos punzantes en el BSC.
- Transfiera la suspensión a un tubo de microfuga de 2 ml (con tapón roscado) y centrifugar a temperatura ambiente durante 3 minutos a 100 x g para granular cualquier grumo restante. Devuelva el tubo al gabinete de seguridad y espere 1 minuto para permitir que las bacterias se asienten.
- Transfiera la parte superior de 1-1.5 ml del sobrenadante a un tubo nuevo. Deseche el tubo original en el cubo de basura que contiene desinfectante. Mezclar bien y añadir varias cantidades de la suspensión micobacteriana (por ejemplo, 5, 25, 50, 150 μL) a los portaobjetos de la cámara de vidrio de 2 pocillos e incubar durante 3 h en una incubadora deCO2 a 37 °C.
- Tinción para bacterias ácido-alcohol resistentes (BAAR)
NOTA: Después de 3 h de incubación, los macrófagos se lavan y se fijan con paraformaldehído para inactivar las micobacterias. Luego, los portaobjetos se tiñen con un kit de auramina O modificada (consulte la Tabla de materiales) para estimar las micobacterias fagocitadas por célula. Debido a su pared celular cerosa, las micobacterias retienen el colorante Auramine después de un lavado ácido-alcohol. Los núcleos de macrófagos se contra-tiñen con Hoechst. Este método permite contar el número de bacterias fagocitadas por célula y se utiliza para determinar la multiplicidad de la infección (MOI) de los macrófagos.- Retire el medio del portaobjetos de la cámara de vidrio después de pipetear hacia arriba y hacia abajo tres veces para desalojar las bacterias que no han sido fagocitadas.
- Lavar una vez con 2 ml de PBS a temperatura ambiente.
- Almacenar existencias de paraformaldehído al 4%, disueltas en PBS en alícuotas a -20 °C durante un máximo de 6 meses. Descongelar una alícuota de paraformaldehído al 4% inmediatamente antes de su uso. Diluir a 2% de paraformaldehído con PBS y añadir 2 ml por pocillo.
- Incubar durante 10 min a temperatura ambiente. El portaobjetos de la cámara de vidrio se puede quitar del gabinete de seguridad en esta etapa para teñirlo.
- Lave el tobogán bajo un suave chorro de agua del grifo.
- Dispense suficiente auramina en el portaobjetos para cubrir las células con una pipeta de transferencia de plástico e incube durante 1 minuto a temperatura ambiente en la oscuridad (cubra con papel de aluminio).
- Lave el exceso de tinte del portaobjetos con agua del grifo y agregue el decolorante/enfriador durante 1 minuto en la oscuridad.
- Lave el exceso con agua del grifo e incube durante 15 minutos a temperatura ambiente con Hoechst 33342 (10 μg/ml en PBS) en la oscuridad.
- Lave la mancha de Hoechst con agua del grifo, retire las cámaras, drene el exceso de agua del portaobjetos, agregue una gota de antidecoloración y cubreobjetos, y seque al aire.
- Examine el portaobjetos bajo el microscopio fluorescente utilizando el objetivo de aceite 100x. Las micobacterias emitirán fluorescencia verde bajo el filtro FIFC. Los núcleos fluorescen de color azul bajo el filtro DAPI (Figura 1C).
- Determinar el MOI contando el número de micobacterias fagocitadas por célula y el porcentaje de células infectadas.
- Calcular el volumen de suspensión micobacteriana necesaria para lograr el MOI requerido basado en el área de superficie de un pozo en la placa; Por ejemplo, el área de superficie de las diapositivas de la cámara de vidrio utilizadas en este experimento es de 4 cm2. El MOI bajo (aproximadamente 1-2 bacilos / célula) es deseable para experimentos realizados durante varios días (por ejemplo, 5 días).
- Infección de macrófagos
- Mezcle bien la suspensión de micobacterias y agregue la cantidad necesaria a las células en placas de 12 pocillos una vez que se haya determinado el volumen requerido para lograr el MOI deseado.
- Incubar a 37 °C durante 3 h para permitir que las micobacterias sean fagocitadas.
- Elimine las bacterias extracelulares lavando los pocillos con RPMI caliente o HBSS varias veces.
- Lisar los macrófagos en un pocillo (muestra de 3 h) para determinar el porcentaje de tiempo hasta la positividad (TTP) del inóculo inicial (muestra de 3 h) como se describe en el paso 3 a continuación.
- Añadir cRPMI fresco y las dosis de fármaco requeridas o control del vehículo a los pocillos restantes, incubar las placas en la incubadora deCO2 a 37 °C durante el tiempo necesario (dependiendo del diseño experimental, pero generalmente a varios intervalos entre 1 y 8 días).
3. Recolección de muestras para el sistema de detección de cultivo líquido
NOTA: El día de la infección, las micobacterias extracelulares se eliminan mediante lavado, y las micobacterias intracelulares se cosechan mediante lisis de un pocillo de macrófagos (muestra de 3 h) para determinar la cantidad inicial fagocitada como control basal de la infección. En momentos posteriores, tanto el medio, el lisado celular y los lavados se combinan para medir el crecimiento micobacteriano total. El crecimiento extracelular e intracelular también se puede evaluar por separado si se desea.
- Recolección de muestra de 3 h para determinar TTP
- Lavar las micobacterias extracelulares de todos los pocillos después de las 3 h iniciales de la infección, tal como se describe en el paso 2.3.3. Agregue 1 ml de medios frescos al pozo de control de 3 h para igualar el volumen de lisado con los de los puntos de tiempo posteriores.
NOTA: Ver paso 3.2.7 si las micobacterias extracelulares deben excluirse del análisis.
- Lavar las micobacterias extracelulares de todos los pocillos después de las 3 h iniciales de la infección, tal como se describe en el paso 2.3.3. Agregue 1 ml de medios frescos al pozo de control de 3 h para igualar el volumen de lisado con los de los puntos de tiempo posteriores.
- Recogida de muestras
- Caldo de MB caliente y botellas de cultivo de instrumentos para llevarlas a temperatura ambiente.
- Transfiera el medio de la placa de 12 pocillos a los tubos cónicos etiquetados correspondientes.
- Agregue 500 μL de tampón de lisis estéril (0.1% Triton x-100 en PBS filtrado a través de un filtro estéril de 0.2 μm) a cada pocillo durante 10 min.
- Raspa suavemente las células del pozo con un raspador estéril y combínalas con el medio en el tubo cónico apropiado.
- Lave el pozo con 0,5 ml de PBS estéril y transfiéralo al tubo apropiado.
- Pase suavemente cada muestra a través de una aguja y una jeringa (25 G) 6-8 veces para romper los grumos. Diluir las muestras 1:10 en caldo MB; 100 μL de muestra + 900 μL MB de medio.
- En los momentos/días requeridos (generalmente entre 1 y 8 días), cosechar las muestras restantes siguiendo los pasos 3.2.1-3.2.6 anteriores.
NOTA: Los investigadores pueden preferir excluir las micobacterias extracelulares de su análisis, en cuyo caso, en el paso 3.2.2 anterior, se descarta el medio de cada pocillo y los macrófagos se lavan varias veces antes de agregar tampón de lisis.
- Inocular y cargar botellas de cultivo de instrumentos
NOTA: Los detalles del instrumento de cultivo líquido y los consumibles relacionados se proporcionan en la Tabla de materiales.- Esterilice la tapa de goma del frasco de cultivo del instrumento con papel de seda empapado en alcohol al 70% y deje que se seque al aire.
NOTA: Este paso debe llevarse a cabo en el BSC. - Prepare los frascos transfiriendo suficientes suplementos nutricionales para todas las muestras en un tubo cónico (0,5 ml / botella). Use una aguja y una jeringa para inyectar 0,5 ml de suplemento nutricional en el frasco de cultivo del instrumento.
- Pipetear 500 μL de la muestra diluida (1:10) en un tubo con fondo en V de 1 ml.
- Utilice una aguja y una jeringa para inyectar los 500 μL de muestra en el frasco de cultivo del instrumento asignado.
- Esterilice la tapa de goma del frasco de cultivo del instrumento con papel de seda empapado en alcohol al 70% y deje que se seque al aire. Limpie las botellas con papel de seda empapado en alcohol al 70% antes de retirarlas del BSC.
- Transporte cuidadosamente las botellas desde el gabinete de bioseguridad hasta el instrumento para cargar.
- Pulse el botón de carga del sistema automatizado de detección microbiana.
- Escanee los códigos de barras de las botellas de cultivo de instrumentos y coloque las botellas en la incubadora del sistema de detección a 37 °C durante un máximo de 42 días. Lea y registre el tiempo necesario para alcanzar la positividad desde la pantalla del instrumento.
NOTA: El código de barras permite que el instrumento identifique la botella y vincule las lecturas de reflectancia con una botella en particular. - Calcular el porcentaje de tiempo hasta la positividad (TTP) comparando el TTP del inóculo intracelular inicial (Día 0) con el de los macrófagos cultivados durante los tiempos indicados. Un cambio positivo en el porcentaje de TTP significa crecimiento micobacteriano13.
Por ejemplo, para el día 3:
Cambio porcentual en el tiempo hasta la positividad =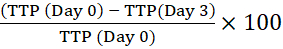
- Esterilice la tapa de goma del frasco de cultivo del instrumento con papel de seda empapado en alcohol al 70% y deje que se seque al aire.
Resultados
El instrumento automatizado de cultivo líquido utilizado en este estudio monitorea los niveles deCO2 cada 10 min. Un cambio de color en el sensor en la parte inferior de la botella del instrumento se mide colorimétricamente y se expresa como unidades de reflectancia. Luego, el software del instrumento aplica algoritmos de detección para calcular el tiempo de positividad (TTP), es decir, el número de días desde la inoculación hasta que los cultivos se marcan como positivos (Figura 1A<...
Discusión
Los autores han utilizado el método de cultivo líquido descrito en este protocolo para monitorizar el crecimiento de Mtb en macrófagos derivados de monocitos y macrófagos alveolares y células THP-1 diferenciadas con PMA11,16,17. Esta técnica también puede ser modificada para su uso con células no adherentes12. Más recientemente, el instrumento también se utilizó en estudios preclínicos para ev...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por Science Foundation Ireland (SFI 08 / RFP / BMT1689), la Junta de Investigación de Salud en Irlanda [HRA-POR / 2012 / 4 y HRA-POR-2015-1145] y Royal City of Dublin Hospital Trust.
Materiales
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
Referencias
- WHO. Global Tuberculosis Report. World Health Organization. , (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184 (2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237 (2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588 (2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151 (2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645 (2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), 453-488 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados