このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
結核の宿主向け治療の前臨床試験に使用する自動培養システム
要約
結核菌の細胞内増殖を迅速かつ効率的に定量することは 、結核( TB)に対する改善された治療法を追求するために不可欠です。このプロトコルは、候補宿主指向療法で処理されたマクロファージのMtb増殖を定量するための自動液体培養システムを使用したブロスベースの比色検出アッセイについて説明しています。
要約
結核(TB)の原因物質である結核菌(Mtb)は、COVID-19の出現まで、世界で最も重要な感染症のキラーでした。Mtbは、細胞内環境で持続し、宿主防御を回避し、多くの抗結核薬に対する耐性を発達させるように進化してきました。耐性を解決するための1つのアプローチは、Mtbに対する宿主の免疫応答を高める既存の承認薬を特定することです。これらの薬剤は、治療時間を短縮し、抗生物質耐性を克服するのに役立つ補助的な宿主指向性療法(HDT)として再利用することができます。
マクロファージにおける細胞内Mtb増殖の定量化は、潜在的なHDTを評価する上で重要な側面です。Mtbの成長を測定するためのゴールドスタンダードは、寒天プレート上のコロニー形成単位(CFU)をカウントすることです。これは、薬物の迅速なスクリーニングには適さない、遅く、労働集約的なアッセイです。このプロトコルでは、臨床検体中のMtbを検出するためにより一般的に使用される自動化されたブロスベースの培養システムが、宿主向け療法の前臨床スクリーニングに適合しています。HDTで処理したマクロファージにおける細胞内Mtb増殖を調べるための液体培養アッセイシステムの能力を評価した。Mtbの成長を阻害する能力についてテストされたHDTは、溶液中およびポリ(乳酸-co-グリコール酸)(PLGA)微粒子にカプセル化されたオールトランスレチノイン酸(AtRA)、およびインターフェロンガンマとリネゾリドの組み合わせでした。CFU法に対するこの自動液体培養ベースの技術の利点には、セットアップの単純さ、労働集約的な準備の軽減、および結果までの時間の短縮が含まれます(寒天プレートの21日以上と比較して5〜12日)。
概要
結核の原因物質である結核菌(Mtb)は、2019年に世界で最も重要な感染症キラーでした1。宿主防御を回避するために、Mtbはマクロファージや樹状細胞(DC)などの自然免疫細胞のマイコバクテリア活性を覆し、細胞内で持続して複製できるようにします2。成人の肺結核を予防するための効果的なワクチンの欠如と薬剤耐性株の出現の増加は、新しい治療法の緊急の必要性を浮き彫りにしています。
補助的な宿主指向療法(HDT)は、治療時間を短縮し、耐性を克服するのに役立つ可能性があります3。マクロファージ内のマイコバクテリア活性を決定するためのHDT候補のin vitroでの前臨床評価は、多くの場合、固体寒天プレート上のコロニー形成ユニット(CFU)によるMtb増殖の定量に依存しています。これは、薬物の迅速なスクリーニングには適さない、遅く、労働集約的なアッセイです。市販の自動ブロスベースの微生物検出システムは、臨床微生物学ラボで、臨床検体中のMtbおよびその他のマイコバクテリア種の検出および薬剤感受性試験に一般的に使用されています4。これらの機器は、培養培地の物理的変化(CO2またはO2レベルまたは圧力の変化)をもたらす細菌代謝活性に基づいて間接的に増殖を測定し、経時的に監視する5。測定値は陽性になるまでの時間(TPP)であり、これは治療に反応した結核患者の喀痰標本6,7および感染したマウス肺および脾臓の溶解物8のMtb CFUと相関することが以前に示されています。さらに、液体培養検出システムは、アクセニック培養および培養マクロファージにおけるマイコバクテリアの増殖に対する従来の病原体指向療法の効果を測定するために使用されてきた9,10。この装置は、樹状細胞および肺胞マクロファージがMtb11,12の細胞内増殖を制御する生来の能力を調べるためにも使用されています。この実験プロトコルは、液体培養診断システムが、培養マクロファージにおける結核に対するHDTの前臨床スクリーニングを実行するように適合できることを示しています。CFU列挙と比較して、この技術の主な利点は、細胞内マイコバクテリアの増殖/生存を定量化するために必要な実験労力と時間を大幅に削減できることです。この技術は、宿主の免疫を高めるために細胞機能を標的とする幅広い薬理学的試薬で処理された免疫細胞における細胞内マイコバクテリアの生存を評価するために使用できる自動培養装置へのアクセスに依存しています。
プロトコル
このプロトコルで概説されている実験は、封じ込めレベル2の実験室で処理できるMtbの弱毒化H37Ra株を使用して実施されました。生きたマイコバクテリアのすべての操作は、クラスII生物学的安全キャビネット(BSC)で行われました。実験手順は、エアロゾルの発生を最小限に抑えるように設計されました。真核細胞培養(THP-1細胞)もクラスII BSCで行った。研究所はリスク評価を実施し、すべての手順が制度的および国の生物学的安全規制に沿って実施されていることを確認しました。ヒト単球性THP-1細胞株を、記載された方法を実行するために使用した(ステップ1)。細胞は、マイコバクテリアに感染する前に、ホルボール12-ミリスチン酸13-アセテート(PMA)による刺激後にマクロファージに分化します。
1. 細胞培養
- H37Raシードストックを、アルブミン-デキストロース-カタラーゼ(ADC)濃縮(10%)および0.05%ポリソルベート80を添加したミドルブルック7H9(MB)ブロスでログフェーズに増殖させます。H37Raストックを1 mLアリコートに入れて-80°Cの冷凍庫に最長1年間保管します。
- Mtb-H37Raの1 mLバイアルを解凍し、計画された実験の約1週間前に、9 mLのMB添加ブロスを含むフィルターキャップ付きのT25フラスコに移します。静的インキュベーター内で37°Cで5〜7日間インキュベートします。
- 非加熱死体10%ウシ胎児血清(完全(c)RPMI)を添加したRPMI-1640でTHP-1細胞を、5%CO2/37°CのCO2加湿インキュベーター内のT75フラスコ内で増殖させ、継代培養を週に2回、1 x 106細胞/mL未満の密度を維持します。
- 感染の3日前に、T75フラスコ内の血清学的ピペットを使用して細胞を数回穏やかにピペッティングし、塊を分散させ、50 mLのコニカルチューブに入れて、THP-1細胞をマクロファージに分化させます。
- 細胞を室温で300 x g で10分間遠心分離し、上清をデカントオフし、ペレットを2 mLのRPMIに静かに再懸濁します。細胞数を実行して細胞/mLを推定します。
- 2 mLのTHP-1マクロファージを12ウェル組織培養プレートに100,000細胞/mLの密度でcRPMI溶液に100 ng/mL PMAで72時間播種します。細胞からPMA含有培地を除去し、Mtb感染前に新鮮なcRPMIを補充します。
- 必要な時点ごとに個別のプレートを設定します。
- 2ウェルガラスチャンバースライドに同じ密度(100,000細胞/mL)の細胞を播種し、感染多重度(MOI)を測定します。
- 5%CO2 加湿インキュベーターに37°Cで3日間入れます。
2. Mtb取り込み量の定量化
- マクロファージによるMtb取り込み量(MOI)の測定
- 感染当日にクラスII生物学的安全キャビネット(BSC)を設置し、こぼれたものをキャッチするために2層のティッシュペーパーで作業します。地域の規制に従って廃棄物廃棄コンテナを設定します。
- T25フラスコから6〜8 mLのマイコバクテリア培養物を取り出し、15 mLのポリプロピレンチューブに移します。
注:より小さな実験には、より小さな体積のチューブを使用できます。 - ベンチトップ遠心分離機でチューブを室温で2890 x gで10分間遠心分離します。
- チューブを遠心分離機から慎重に取り外し、生物学的安全キャビネットに移します。バクテリアが落ち着くまで1分待ちます。
- 上清を消毒剤廃棄容器、リキャップチューブに注ぎ、チューブの側面を軽くたたいて残りの培地に細菌を再懸濁します。バクテリアが落ち着くまで1分待ちます。
- 2 mLの予熱したcRPMIを加え、穏やかに混合し、50 mLのコニカルチューブに移します。
- 25 Gの針と5 mLの注射器を使用して、マイコバクテリアを非常に注意深く再懸濁します。.再懸濁するには、マイコバクテリア懸濁液をシリンジに引き込み、エアロゾルの生成を最小限に抑えるためにチューブの側壁を非常に穏やかに排出します。6〜8回繰り返します。
注:これはマイコバクテリアの高密度培養であるため、細心の注意を払ってください。針刺しによる怪我のリスクを回避するために、可能な限り鈍い針を使用し、ルアーロックシリンジを使用してください。 - 針とシリンジをBSCの鋭利な容器に廃棄します。
- 懸濁液を2 mLマイクロフュージチューブ(ねじ込み式キャップ付き)に移し、室温で100 x g で3分間遠心分離して、残りの塊をペレット化します。チューブを安全キャビネットに戻し、バクテリアが落ち着くまで1分間待ちます。
- 上清の上部1〜1.5 mLを新しいチューブに移します。消毒剤の入った廃液バケツに元のチューブを廃棄します。よく混合し、さまざまな量のマイコバクテリア懸濁液(5、25、50、150μLなど)を2ウェルガラスチャンバースライドに加え、37°CのCO2 インキュベーターで3時間インキュベートします。
- 抗速菌(AFB)の染色
注:3時間のインキュベーション後、マクロファージを洗浄し、パラホルムアルデヒドで固定してマイコバクテリアを不活性化します。次に、修飾オーラミンOキット( 材料の表を参照)を使用してスライドを染色し、細胞あたりのマイコバクテリアの食作用を推定します。それらのワックス状の細胞壁のために、マイコバクテリアは酸 - アルコール洗浄後にオーラミン染料を保持する。次に、マクロファージ核をヘキストで対比染色します。この方法は、細胞あたりの食作用細菌の数をカウントすることを可能にし、マクロファージの感染多重度(MOI)を決定するために使用されます。- 上下に3回ピペッティングした後、ガラスチャンバースライドから培地を取り除き、食作用していない細菌を取り除きます。
- 2 mLの室温PBSで1回洗浄します。
- 4%パラホルムアルデヒドのストックを、PBSにアリコートで溶解し、-20°Cで最大6か月間保管します。使用直前に4%パラホルムアルデヒドのアリコートを解凍してください。.PBSで2%パラホルムアルデヒドに希釈し、ウェルあたり2 mLを加えます。
- 室温で10分間インキュベートします。ガラスチャンバースライドは、この段階で安全キャビネットから取り外して染色することができます。
- 穏やかな水道水でスライドを洗います。
- プラスチック製トランスファーピペットを使用して細胞を覆うのに十分なオーラミンをスライドに分注し、暗所で室温で1分間インキュベートします(アルミホイルで覆います)。
- スライドから余分な染料を水道水で洗い流し、暗所で脱色剤/クエンチャーを1分間加えます。
- 余分なものを水道水で洗い流し、暗所でヘキスト33342(10 μg/mL PBS溶液)を使用して室温で15分間インキュベートします。
- 水道水でヘキストの汚れを洗い流し、チャンバーを取り外し、スライドから余分な水を排出し、退色防止とカバーガラスを一滴加え、風乾します。
- 100倍のオイル対物レンズを使用して、蛍光顕微鏡下でスライドを調べます。マイコバクテリアはFITCフィルターの下で緑色に蛍光を発します。核はDAPIフィルターの下で青色に蛍光を発します(図1C)。
- 細胞あたりの食作用されたマイコバクテリアの数と感染した細胞の割合を数えることによってMOIを決定します。
- プレート内のウェルの表面積に基づいて、必要なMOIを達成するために必要なマイコバクテリア懸濁液の量を計算します。例えば、本実験で用いたガラスチャンバースライドの表面積は4cm2である。低MOI(約1〜2バチル/細胞)は、数日間(例えば、5日間)にわたって実施される実験には望ましい。
- マクロファージの感染
- マイコバクテリア懸濁液をよく混合し、目的のMOIを達成するために必要な量が決定されたら、12ウェルプレート上の細胞に必要な量を追加します。
- 37°Cで3時間インキュベートして、マイコバクテリアを貪食させます。
- 温かいRPMIまたはHBSSのいずれかでウェルを数回洗浄することにより、細胞外細菌を除去します。
- 1つのウェル(3時間サンプル)でマクロファージを溶解し、以下のステップ3で概説するように、最初の接種材料(3時間サンプル)の陽性までの時間(TTP)の割合を決定します。
- 新鮮なcRPMIと必要な薬物用量またはビヒクルコントロールを残りのウェルに加え、CO2 インキュベーター内のプレートを37°Cで必要な時間インキュベートします(実験デザインによって異なりますが、通常は1〜8日間のいくつかの間隔で)。
3. 液体培養検出システム用サンプル採取
注:感染当日、細胞外抗酸菌を洗浄により除去し、マクロファージの1ウェル(3時間サンプル)を溶解して細胞内抗酸菌を回収し、感染のベースラインコントロールとして貪食された初期量を決定します。その後、培地、細胞溶解液、および洗浄液の両方を組み合わせて、マイコバクテリアの総増殖を測定します。細胞外および細胞内増殖も、必要に応じて別々に評価することができる。
- TTPを決定するための3時間サンプルの収穫
- ステップ2.3.3で概説されているように、感染の最初の3時間後にすべてのウェルから細胞外マイコバクテリアを洗い流します。1 mLの新鮮な培地を3時間コントロールウェルに追加して、ライセート量を後の時点のものと均等にします。
注:細胞外マイコバクテリアを分析から除外する場合は、ステップ3.2.7を参照してください。
- ステップ2.3.3で概説されているように、感染の最初の3時間後にすべてのウェルから細胞外マイコバクテリアを洗い流します。1 mLの新鮮な培地を3時間コントロールウェルに追加して、ライセート量を後の時点のものと均等にします。
- サンプル収集
- MBブロスと器具培養ボトルを温めて室温にします。
- 培地を12ウェルプレートから対応するラベル付きコニカルチューブに移します。
- 500 μLの滅菌溶解バッファー(滅菌0.2 μmフィルターでろ過したPBS中の0.1%Triton x-100)を各ウェルに10分間加えます。
- 滅菌スクレーパーでウェルから細胞を静かにこすり落とし、適切な円錐形チューブ内の培地と混ぜ合わせます。
- ウェルを0.5 mLの滅菌PBSで洗浄し、適切なチューブに移します。
- 各サンプルを針とシリンジ(25 G)に6〜8回静かに通して、塊を砕きます。サンプルをMBブロスで1:10に希釈します。100 μL サンプル + 900 μL MB 培地。
- 必要な時間/日(通常は1〜8日)で、上記の手順3.2.1〜3.2.6に従って残りのサンプルを収集します。
注:研究者は、細胞外マイコバクテリアを分析から除外することを好む場合があり、その場合、上記のステップ3.2.2では、各ウェルからの培地を廃棄し、マクロファージを数回洗浄してから溶解バッファーを追加します。
- 器具培養ボトルの接種と装填
注意: 液体培養装置および関連する消耗品の詳細は、 材料の表に記載されています。- 器具培養瓶のゴムキャップを70%アルコールに浸したティッシュペーパーで滅菌し、風乾させます。
注: この手順は BSC で実行する必要があります。 - すべてのサンプルに十分な栄養補助食品を円錐形のチューブ(0.5 mL /ボトル)に移してボトルを準備します。針と注射器を使用して、0.5 mLの栄養補助食品を機器培養ボトルに注入します。
- 希釈したサンプル500 μL(1:10)を1 mLのV底チューブにピペットで入れます。
- 針とシリンジを使用して、500 μLのサンプルを割り当てられた機器培養ボトルに注入します。
- 器具培養瓶のゴムキャップを70%アルコールに浸したティッシュペーパーで滅菌し、風乾させます。BSCから取り出す前に、70%アルコールに浸したティッシュペーパーでボトルを拭いてください。
- ボトルをバイオセーフティキャビネットから機器に慎重に輸送して積み込みます。
- 自動微生物検出システムのローディングボタンを押します。
- 機器培養ボトルのバーコードをスキャンし、ボトルを37°Cの検出システムインキュベーターに最大42日間入れます。機器の画面から陽性に達するのにかかった時間を読んで記録します。
注意: バーコードを使用すると、機器はボトルを識別し、反射率の読み取り値を特定のボトルにリンクできます。 - 最初の細胞内接種源(0日目)のTTPを、指定された時間培養されたマクロファージのTTPと比較することにより、陽性になるまでの時間(TTP)を計算します。TTP率の正の変化は、マイコバクテリアの増殖を意味します13。
たとえば、3 日目の場合:
陽性になるまでの時間の変化率=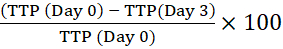
- 器具培養瓶のゴムキャップを70%アルコールに浸したティッシュペーパーで滅菌し、風乾させます。
結果
この研究で使用された自動液体培養装置は、10分ごとにCO2 レベルを監視します。計器ボトルの下部にあるセンサーの色の変化は比色で測定され、反射率単位で表されます。次に、機器ソフトウェアは検出アルゴリズムを適用して、陽性になるまでの時間(TTP)、つまり接種から培養物が陽性としてフラグが立てられるまでの日数を計算します(図1A)。初期接種材料?...
ディスカッション
著者らは、このプロトコルに記載されている液体培養法を使用して、単球由来のマクロファージと肺胞マクロファージ、およびPMA11、16、17で分化したTHP-1細胞のMtb増殖を監視しました。この技術は、非接着性細胞12と共に使用するために改変することもできる。最近では、この装置は、TB17
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、アイルランド科学財団(SFI 08 / RFP / BMT1689)、アイルランドの健康研究委員会[HRA-POR/2012/4およびHRA-POR-2015-1145]およびダブリン王立病院トラストによって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
参考文献
- WHO. Global Tuberculosis Report. World Health Organization. , (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184 (2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237 (2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588 (2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151 (2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645 (2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), 453-488 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved