JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
결핵에 대한 숙주 유도 요법의 전임상 테스트에 사용하기 위한 자동화된 배양 시스템
요약
세포 내 M. 결핵 성장의 신속하고 효율적인 정량화는 결핵(TB)에 대한 개선된 치료법을 추구하는 데 중요합니다 . 이 프로토콜은 후보 숙주 지시 요법으로 처리된 대식세포에서 Mtb 성장을 정량화하기 위해 자동화된 액체 배양 시스템을 사용하는 브로스 기반 비색 검출 분석을 설명합니다.
초록
결핵(TB)의 원인균인 결핵균(Mtb)은 COVID-19가 출현하기 전까지 전 세계적으로 가장 심각한 전염병 사망자였습니다. Mtb는 세포 내 환경에서 지속되고 숙주 방어를 피하며 많은 항 결핵 약물에 대한 내성을 개발하도록 진화했습니다. 내성을 해결하는 한 가지 접근법은 Mtb에 대한 숙주 면역 반응을 증가시키는 기존의 승인 된 약물을 식별하는 것입니다. 그런 다음 이러한 약물을 보조 숙주 유도 요법(HDT)으로 용도를 변경하여 치료 시간을 단축하고 항생제 내성을 극복하는 데 도움이 될 수 있습니다.
대식세포에서 세포내 Mtb 성장의 정량화는 잠재적인 HDT를 평가하는 중요한 측면입니다. Mtb 성장을 측정하기 위한 황금 표준은 한천 플레이트에서 집락 형성 단위(CFU)를 계산하는 것입니다. 이것은 약물의 신속한 스크리닝에 적합하지 않은 느리고 노동 집약적 인 분석입니다. 이 프로토콜에서는 임상 표본에서 Mtb를 검출하는 데 더 일반적으로 사용되는 자동화된 브로스 기반 배양 시스템이 숙주 지시 요법의 전임상 스크리닝에 맞게 조정되었습니다. HDT로 처리된 대식세포에서 세포내 Mtb 성장을 조사하기 위한 액체 배양 분석 시스템의 용량을 평가하였다. Mtb 성장을 억제하는 능력에 대해 테스트된 HDT는 용액에 담겨 있고 폴리(락틱-코-글리콜산)(PLGA) 미립자와 인터페론-감마와 리네졸리드의 조합으로 캡슐화된 올-트랜스 레티노산(AtRA)이었습니다. CFU 방법에 비해 이 자동화된 액체 배양 기반 기술의 장점은 설정이 간단하고, 노동 집약적인 준비가 적고, 결과 도출 시간이 더 빠르다는 것입니다(한천 플레이트의 경우 21일 이상에 비해 5-12일).
서문
결핵의 원인균인 결핵균(Mtb)은 2019년 전 세계적으로 가장 심각한 전염병 사망자였습니다1. 숙주 방어를 피하기 위해 Mtb는 대식세포 및 수지상 세포(DC)와 같은 선천성 면역 세포의 진균 살균 활성을 파괴하여 세포 내에서 지속되고 복제할 수 있도록합니다2. 성인 폐결핵을 예방하는 효과적인 백신의 부족과 약물 내성 균주의 출현 증가는 새로운 치료법의 긴급한 필요성을 강조합니다.
보조 숙주 지시 요법(HDT)은 치료 시간을 단축하고 내성을 극복하는 데 도움이 될 수 있습니다3. 대식세포 내에서 진균살균 활성을 결정하기 위한 시험관 내 HDT 후보의 전임상 평가는 종종 고체 한천 플레이트에서 콜로니 형성 단위(CFU)에 의한 Mtb 성장의 정량화에 의존합니다. 이것은 약물의 신속한 스크리닝에 적합하지 않은 느리고 노동 집약적 인 분석입니다. 상업적으로 이용 가능한 자동화된 브로스 기반 미생물 검출 시스템은 임상 표본에서 Mtb 및 기타 마이코박테리아 종의 검출 및 약물 감수성 테스트를 위해 임상 미생물학 실험실에서 더 일반적으로사용됩니다4. 이러한 기기는 시간 경과에 따라 모니터링되는 배양 배지의 물리적 변화(CO2 또는O2 수준 또는 압력의 변화)로 이어지는 박테리아 대사 활동을 기반으로 간접적으로 성장을 측정합니다5. 판독은 이전에 치료 6,7에 대한 반응으로 결핵 환자의 객담 표본과 감염된 쥐 폐 및 비장의 용해물8에서 Mtb CFU와 상관관계가 있는 것으로 나타난 양성 시간(TPP)입니다. 또한, 액체 배양 검출 시스템은 축삭 배양 및 배양된 대식세포에서 마이코박테리아의 성장에 대한 종래의 병원체 지시 요법의 효과를 측정하기 위해 사용되었다 9,10. 이 기기는 또한 Mtb11,12의 세포 내 성장을 제어하는 수지상 세포 및 폐포 대 식세포의 타고난 능력을 조사하는 데 사용되었습니다. 이 실험 프로토콜은 액체 배양 진단 시스템이 배양된 대식세포에서 결핵에 대한 HDT의 전임상 스크리닝을 수행하도록 조정될 수 있음을 보여줍니다. CFU 열거와 비교할 때 이 기술의 주요 장점은 세포 내 마이코박테리아 성장/생존을 정량화하는 데 필요한 실험 노동력과 시간을 상당히 줄인다는 것입니다. 이 기술은 숙주 면역을 강화하기 위해 세포 기능을 표적으로 하는 광범위한 약리학적 시약으로 처리된 면역 세포에서 세포 내 마이코박테리아 생존을 평가하는 데 사용할 수 있는 자동화된 배양 기기에 대한 액세스에 의존합니다.
프로토콜
이 프로토콜에 설명된 실험은 봉쇄 레벨 37 실험실에서 처리할 수 있는 Mtb의 약독화된 H2Ra 균주를 사용하여 수행되었습니다. 살아있는 마이코 박테리아의 모든 조작은 클래스 II 생물학적 안전 캐비닛 (BSC)에서 수행되었습니다. 실험 절차는 에어로졸 생성을 최소화하도록 설계되었습니다. 진핵 세포 배양 (THP-1 세포)은 또한 클래스 II BSC에서 수행되었다. 실험실은 위험 평가를 수행하고 모든 절차가 기관 및 국가 생물 안전 규정에 따라 수행되었는지 확인했습니다. 인간 단핵구 THP-1 세포주를 사용하여 기재된 바와 같은 방법을 수행하였다(단계 1). 세포는 마이코박테리아에 감염되기 전에 포볼 12-미리스테이트 13-아세테이트(PMA)로 자극한 후 대식세포로 분화됩니다.
1. 세포 배양
- 알부민-덱스트로스-카탈라아제(ADC) 농축(10%) 및 0.05% 폴리소르베이트 80이 보충된 미들브룩 7H9(MB) 브로쓰에서 H37Ra 종자 스톡을 로그 단계로 전파합니다. H37Ra 재고를 1mL 분취량에 담아 -80°C 냉동고에 최대 1년 동안 보관하십시오.
- Mtb-H37Ra 1mL 바이알을 해동하고 계획된 실험 약 25주 전에 MB 보충 국물 9mL가 들어 있는 필터 캡이 있는 T1 플라스크로 옮깁니다. 정적 인큐베이터에서 5-7일 동안 37°C에서 배양합니다.
- 5% CO2/37°C의CO2 가습 인큐베이터의 T75 플라스크에서 비열 사멸 10% 태아 송아지 혈청(완전한 (c)RPMI)이 보충된 RPMI-1640에서 THP-1 세포를 성장시키고 1 x 106 cells/mL 미만의 밀도를 유지하기 위해 일주일에 두 번 계대 배양합니다.
- 감염 3일 전에 T75 플라스크에 혈청학적 피펫을 사용하여 세포를 여러 번 부드럽게 피펫팅하여 THP-1 세포를 대식세포로 분화시켜 덩어리를 분산시키고 50mL 원뿔형 튜브에 넣습니다.
- 실온에서 10분 동안 300 x g 에서 세포를 원심분리하고, 상청액을 디캔트하고, 펠릿을 2mL의 RPMI에 부드럽게 재현탁시킵니다. 세포 수를 수행하여 세포/mL를 추정합니다.
- 100 ng/mL PMA를 사용하여 cRPMI에서 100,000 세포/mL의 밀도로 12웰 조직 배양 플레이트에 THP-1 대식세포 2mL를 72시간 동안 시드합니다. 세포에서 PMA 함유 배지를 제거하고 Mtb 감염 전에 새로운 cRPMI로 보충합니다.
- 필요한 각 시점에 대해 개별 플레이트를 설정합니다.
- 2웰 유리 챔버 슬라이드에서 동일한 밀도(100,000개 세포/mL)의 종자 세포를 사용하여 감염의 다양성(MOI)을 결정합니다.
- 5%CO2 가습 인큐베이터에 37°C에서 3일 동안 두었다.
2. Mtb 흡수의 정량화
- 대식세포(MOI)에 의한 Mtb 흡수 측정
- 감염 당일에 클래스 II 생물 안전 캐비닛 (BSC)을 설치하고 두 겹의 티슈 페이퍼에서 작업하여 유출을 포착하십시오. 현지 규정에 따라 폐기물 폐기 용기를 설치하십시오.
- T25 플라스크에서 6-8mL의 마이코박테리아 배양액을 제거하고 15mL 폴리프로필렌 튜브로 옮깁니다.
참고: 더 작은 부피의 튜브는 더 작은 실험에 사용할 수 있습니다. - 튜브를 실온에서 2890 x g에서 10분 동안 벤치탑 원심분리기로 원심분리합니다.
- 원심 분리기에서 튜브를 조심스럽게 제거하고 생물학적 안전 캐비닛으로 옮깁니다. 박테리아가 가라앉을 때까지 1분 정도 기다립니다.
- 상청액을 소독제 폐기 용기에 붓고 튜브를 다시 덮고 튜브의 측면을 두드려 나머지 배지에 박테리아를 재현탁합니다. 박테리아가 가라앉을 때까지 1분 정도 기다립니다.
- 예열된 cRPMI 2mL를 넣고 부드럽게 혼합한 다음 50mL 원뿔형 튜브로 옮깁니다.
- 25G 바늘과 5mL 주사기를 사용하여 마이코박테리아를 매우 조심스럽게 재현탁시킵니다. 다시 부유하려면 마이코박테리아 현탁액을 주사기에 넣고 튜브의 측벽 아래로 매우 부드럽게 배출하여 에어로졸 생성을 최소화합니다. 6-8 번 반복하십시오.
알림: 이것은 마이코박테리아의 고밀도 배양이므로 최대한 주의하십시오. 바늘 스틱 부상의 위험을 방지하려면 가능하면 무딘 바늘을 사용하고 루어 잠금 주사기를 사용하십시오. - 바늘과 주사기를 BSC의 날카로운 물건 용기에 폐기하십시오.
- 현탁액을 2mL 미세원심분리 튜브(나사식 캡 포함)로 옮기고 실온에서 100 x g 에서 3분 동안 원심분리하여 남은 덩어리를 펠릿화합니다. 튜브를 안전 캐비닛에 다시 넣고 박테리아가 정착할 때까지 1분 동안 기다립니다.
- 상청액의 상단 1-1.5mL를 새 튜브로 옮깁니다. 소독제가 들어있는 쓰레기통에 원래 튜브를 폐기하십시오. 잘 혼합하고, 다양한 양의 마이코박테리아 현탁액(예를 들어, 5, 25, 50, 150 μL)을 2-웰 유리 챔버 슬라이드에 첨가하고, 37°C의CO2 인큐베이터에서 3시간 동안 인큐베이션한다.
- 산성 패스트 박테리아(AFB)에 대한 염색
참고: 3시간 배양 후, 대식세포를 세척하고 파라포름알데히드로 고정하여 마이코박테리아를 비활성화합니다. 그런 다음 슬라이드는 변형된 Auramine O 키트( 재료 표 참조)를 사용하여 염색되어 세포당 식균된 마이코박테리아를 추정합니다. 밀랍 세포벽으로 인해 마이코박테리아는 산-알코올 세척 후에도 오라민 염료를 유지합니다. 그런 다음 대식세포 핵을 Hoechst로 대조 염색합니다. 이 방법을 사용하면 세포당 식균 박테리아의 수를 계산할 수 있으며 대식세포의 감염 다양성(MOI)을 결정하는 데 사용됩니다.- 피펫팅을 위아래로 3회 한 후 유리 챔버 슬라이드에서 배지를 제거하여 식균되지 않은 박테리아를 제거합니다.
- 2mL의 실온 PBS로 한 번 세척하십시오.
- PBS에 용해된 4% 파라포름알데히드의 재고를 -20°C에서 최대 6개월 동안 분취량으로 저장합니다. 사용 직전에 4% 파라포름알데히드의 분취량을 해동합니다. PBS로 2% 파라포름알데히드로 희석하고 웰당 2mL를 추가합니다.
- 실온에서 10분 동안 배양합니다. 유리 챔버 슬라이드는이 단계에서 염색을 위해 안전 캐비닛에서 제거 할 수 있습니다.
- 부드러운 수돗물로 슬라이드를 씻으십시오.
- 플라스틱 전사 피펫을 사용하여 세포를 덮을 수 있도록 슬라이드에 충분한 Auramine을 분배하고 어두운 곳에서 실온에서 1분 동안 배양합니다(알루미늄 호일로 덮음).
- 슬라이드에서 과도한 염료를 수돗물로 씻어내고 탈색제/담금질을 어두운 곳에서 1분 동안 추가합니다.
- 여분을 수돗물로 씻어 내고 어두운 곳에서 Hoechst 33342 (PBS에서 10 μg / mL)로 실온에서 15 분 동안 배양하십시오.
- Hoechst 얼룩을 수돗물로 씻어 내고 챔버를 제거하고 슬라이드에서 과도한 물을 배출하고 페이드 방지 및 커버 슬립 한 방울을 추가하고 자연 건조하십시오.
- 100x 오일 대물렌즈를 사용하여 형광 현미경으로 슬라이드를 검사합니다. 마이코박테리아는 FITC 필터 아래에서 녹색 형광을 발합니다. 핵은 DAPI 필터 아래에서 파란색 형광을 발합니다(그림 1C).
- 세포당 식균된 마이코박테리아의 수와 감염된 세포의 백분율을 계산하여 MOI를 결정합니다.
- 플레이트에 있는 웰의 표면적을 기준으로 필요한 MOI를 달성하는 데 필요한 마이코박테리아 현탁액의 부피를 계산합니다. 예를 들어, 본 실험에 사용된 유리 챔버 슬라이드의 표면적은 4cm2이다. 낮은 MOI (약 1-2 간균 / 세포)는 며칠 (예 : 5 일)에 걸쳐 수행 된 실험에 바람직합니다.
- 대 식세포의 감염
- 마이코박테리아 현탁액을 잘 혼합하고 원하는 MOI를 달성하는 데 필요한 부피가 결정되면 12웰 플레이트의 세포에 필요한 양을 추가합니다.
- 마이코박테리아가 식균될 수 있도록 37°C에서 3시간 동안 배양합니다.
- 따뜻한 RPMI 또는 HBSS로 우물을 여러 번 씻어 세포 외 박테리아를 제거하십시오.
- 하나의 웰(3시간 샘플)에서 대식세포를 용해시켜 아래 3단계에 요약된 바와 같이 초기 접종물(3시간 샘플)의 양성 시간(TTP)까지의 백분율을 결정합니다.
- 새로운 cRPMI 및 필요한 약물 용량 또는 비히클 대조군을 나머지 웰에 추가하고, 플레이트를 필요한 시간 동안 37°C의CO2 인큐베이터에서 인큐베이션합니다(실험 설계에 따라 다르지만 일반적으로 1 내지 8일 사이의 여러 간격으로).
3. 액체 배양 검출 시스템을위한 샘플 수확
참고: 감염 당일, 세포외 마이코박테리아는 세척에 의해 제거되고, 세포내 마이코박테리아는 대식세포의 한 웰(3시간 샘플)의 용해에 의해 수확되어 감염의 기준선 대조군으로 식균된 초기 양을 결정합니다. 후속 시간에 배지, 세포 용해물 및 세척물을 결합하여 총 마이코박테리아 성장을 측정합니다. 원하는 경우 세포외 및 세포내 성장도 별도로 평가할 수 있습니다.
- TTP를 결정하기 위해 3시간 샘플 수확
- 2.3.3단계에 설명된 대로 감염 초기 3시간 후에 모든 웰에서 세포외 마이코박테리아를 씻어냅니다. 1mL의 새 배지를 3시간 대조군 웰에 추가하여 용해물 부피를 나중 시점의 용해물 부피와 균등하게 합니다.
알림: 세포 외 마이코 박테리아를 분석에서 제외해야하는 경우 3.2.7 단계를 참조하십시오.
- 2.3.3단계에 설명된 대로 감염 초기 3시간 후에 모든 웰에서 세포외 마이코박테리아를 씻어냅니다. 1mL의 새 배지를 3시간 대조군 웰에 추가하여 용해물 부피를 나중 시점의 용해물 부피와 균등하게 합니다.
- 샘플 수집
- MB 국물과 악기 배양 병을 따뜻하게하여 실온으로 가져옵니다.
- 배지를 12웰 플레이트에서 해당 라벨이 붙은 원추형 튜브로 옮깁니다.
- 500μL의 멸균 용해 완충액(멸균 0.2μm 필터를 통해 여과된 PBS 중 0.1% Triton x-100)을 각 웰에 10분 동안 추가합니다.
- 멸균 스크레이퍼로 웰에서 세포를 부드럽게 긁어 내고 적절한 원추형 튜브의 배지와 결합하십시오.
- 0.5mL의 멸균 PBS로 웰을 세척하고 적절한 튜브로 옮깁니다.
- 각 샘플을 바늘과 주사기 (25G)에 6-8 번 부드럽게 통과시켜 덩어리를 분해합니다. MB 국물에 샘플을 1:10으로 희석하십시오. 100 μL 샘플 + 900 μL MB 배지.
- 필요한 시간/일(보통 1일에서 8일 사이)에 위의 3.2.1-3.2.6단계에 따라 나머지 샘플을 수확합니다.
참고: 조사자는 세포외 마이코박테리아를 분석에서 제외하는 것을 선호할 수 있으며, 이 경우 위의 3.2.2단계에서 각 웰의 배지를 버리고 용해 완충액을 추가하기 전에 대식세포를 여러 번 세척합니다.
- 기구 배양 병 접종 및 적재
알림: 액체 배양 기기 및 관련 소모품에 대한 자세한 내용은 재료 표에 나와 있습니다.- 기구 배양 병의 고무 캡을 70 % 알코올에 적신 티슈 페이퍼로 소독하고 자연 건조시킵니다.
알림: 이 단계는 BSC에서 수행해야 합니다. - 모든 샘플에 대해 충분한 영양 보충제를 원추형 튜브(0.5mL/병)에 옮겨 병을 준비합니다. 바늘과 주사기를 사용하여 0.5mL의 영양소 보충제를 기기 배양 병에 주입합니다.
- 희석된 샘플 500μL(1:10)를 1mL V 바닥 튜브에 피펫팅합니다.
- 바늘과 주사기를 사용하여 500μL의 샘플을 지정된 기기 배양 병에 주입합니다.
- 기구 배양 병의 고무 캡을 70 % 알코올에 적신 티슈 페이퍼로 소독하고 자연 건조시킵니다. BSC에서 제거하기 전에 70% 알코올에 적신 티슈 페이퍼로 병을 닦으십시오.
- 적재를 위해 생물 안전 캐비닛에서 기기로 병을 조심스럽게 운반하십시오.
- 자동 미생물 검출 시스템의 로딩 버튼을 누릅니다.
- 기기 배양 병의 바코드를 스캔하고 병을 37°C의 검출 시스템 인큐베이터에 최대 42일 동안 두십시오. 기기 화면에서 양성에 도달하는 데 걸린 시간을 읽고 기록합니다.
알림: 바코드를 사용하면 기기가 병을 식별하고 반사율 판독값을 특정 병과 연결할 수 있습니다. - 초기 세포내 접종물(Day 0)의 TTP를 표시된 시간 동안 배양된 대식세포의 TTP와 비교하여 양성까지의 시간(TTP)을 백분율로 계산합니다. 백분율 TTP의 긍정적 인 변화는 마이코 박테리아 성장을 의미합니다13.
예를 들어, 3일차의 경우:
양성 시간의 백분율 변화 =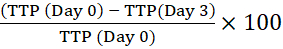
- 기구 배양 병의 고무 캡을 70 % 알코올에 적신 티슈 페이퍼로 소독하고 자연 건조시킵니다.
결과
이 연구에 사용 된 자동화 된 액체 배양 기기는 10 분마다 CO2 수준을 모니터링합니다. 계기 병 바닥에 있는 센서의 색상 변화는 비색으로 측정되고 반사율 단위로 표시됩니다. 그런 다음 기기 소프트웨어는 검출 알고리즘을 적용하여 양성까지의 시간(TTP), 즉 접종 후 배양이 양성으로 플래그가 지정될 때까지의 일수를 계산합니다(그림 1A). 초기 접종물에서 TTP와 log
토론
저자들은 이 프로토콜에 설명된 액체 배양 방법을 사용하여 PMA11,16,17로 분화된 단핵구 유래 대식세포 및 폐포 대식세포 및 THP-1 세포에서 Mtb 성장을 모니터링했습니다. 이 기술은 또한 비부착성 세포(12)와 함께 사용하기 위해 변형될 수 있다. 보다 최근에이 기기는 TB17에 대한 HDT로서 흡입 된...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 Science Foundation Ireland (SFI 08 / RFP / BMT1689), 아일랜드의 Health Research Board [HRA-POR / 2012 / 4 및 HRA-POR-2015-1145] 및 Royal City of Dublin Hospital Trust가 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
참고문헌
- WHO. Global Tuberculosis Report. World Health Organization. , (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184 (2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237 (2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588 (2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151 (2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645 (2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), 453-488 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유