需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于宿主靶向治疗结核病临床前检测的自动化培养系统
摘要
快速有效地定量细胞内 结核分枝杆菌 的生长对于寻求改进的结核病(TB)疗法至关重要。该协议描述了一种基于肉汤的比色检测测定,使用自动液体培养系统来量化用候选宿主定向疗法处理的巨噬细胞中的Mtb生长。
摘要
结核分枝杆菌 (Mtb)是结核病(TB)的病原体,在COVID-19出现之前是全球最重要的传染病杀手。Mtb已经进化到在其细胞内环境中持续存在,逃避宿主防御,并且已经对许多抗结核药物产生了耐药性。解决耐药性的一种方法是确定现有的批准药物,这些药物将增强宿主对Mtb的免疫反应。然后,这些药物可以重新用作辅助宿主定向疗法(HDT),以缩短治疗时间并帮助克服抗生素耐药性。
巨噬细胞中细胞内Mtb生长的定量是评估潜在HDT的一个关键方面。测量Mtb生长的黄金标准是计数琼脂平板上的菌落形成单位(CFU)。这是一种缓慢、劳动密集型的检测方法,不适合药物的快速筛选。在该协议中,一种自动化的、基于肉汤的培养系统(更常用于检测临床标本中的 Mtb)已被适用于宿主定向疗法的临床前筛选。评估了液体培养测定系统研究用HDT处理的巨噬细胞中细胞内Mtb生长的能力。测试其抑制Mtb生长能力的HDT是全反式维甲酸(AtRA),包括溶液和封装在聚(乳酸-乙醇酸)(PLGA)微粒中以及干扰素-γ和利奈唑胺的组合。与CFU方法相比,这种基于液体培养的自动化技术的优点包括设置简单、劳动密集型制备更少以及获得结果的时间更快(5-12天,而琼脂平板为21天或更长时间)。
引言
结核分枝杆菌 (Mtb)是结核病的病原体,是2019年全球最重要的传染病杀手1。为了逃避宿主的防御,Mtb破坏了巨噬细胞和树突状细胞(DC)等先天免疫细胞的分枝杆菌杀活性,使其能够在细胞内持续存在并复制2。缺乏预防成人肺结核的有效疫苗以及耐药菌株的日益出现突出了对新疗法的迫切需要。
辅助宿主导向治疗(HDT)可以缩短治疗时间并帮助克服耐药性3。HDT候选药物的体外临床前评估以确定巨噬细胞内的分枝杆菌活性通常依赖于通过固体琼脂平板上的菌落形成单位(CFU)对Mtb生长的定量。这是一种缓慢、劳动密集型的检测方法,不适合药物的快速筛选。市售的基于肉汤的自动化微生物检测系统更常用于临床微生物学实验室,用于临床标本中Mtb和其他分枝杆菌物种的检测和药敏性测试4。这些仪器根据细菌代谢活性间接测量生长,导致培养基随时间监测的物理变化(CO2 或 O2 水平或压力的变化)5。读数是阳性时间 (TPP),先前已证明与 TB 患者痰标本中的 Mtb CFU 相关,以响应治疗6,7 和感染的鼠肺和脾脏8 的裂解物。此外,液体培养检测系统已被用于测量常规病原体定向疗法对轴化培养和培养巨噬细胞中分枝杆菌生长的影响9,10。该仪器还用于研究树突状细胞和肺泡巨噬细胞控制Mtb11,12细胞内生长的先天能力。该实验方案表明,液体培养诊断系统可以适用于在培养的巨噬细胞中进行HDT的临床前筛查。与CFU计数相比,该技术的主要优点是它大大减少了量化细胞内分枝杆菌生长/存活所需的实验劳动和时间。该技术依赖于对自动化培养仪器的访问,该仪器可用于评估用针对细胞功能的各种药理学试剂处理的免疫细胞中的细胞内分枝杆菌存活率,以提高宿主免疫力。
研究方案
该协议中概述的实验是使用Mtb的减毒H37Ra菌株进行的,该菌株可以在遏制2级实验室中处理。活分枝杆菌的所有操作均在II类生物安全柜(BSC)中进行。实验程序旨在最大限度地减少气溶胶的产生。真核细胞培养(THP-1细胞)也在II类BSC中进行。实验室进行了风险评估,并确保所有程序的执行符合机构和国家生物安全条例。使用人单核细胞THP-1细胞系执行所述方法(步骤1)。在感染分枝杆菌之前,用佛波醇 12-肉豆蔻酸 13-乙酸酯 (PMA) 刺激后,细胞分化为巨噬细胞。
1. 细胞培养
- 在补充有白蛋白-葡萄糖-过氧化氢酶 (ADC) 富集 (10%) 和 0.05% 聚山梨酯 80 的 Middlebrook 7H9 (MB) 肉汤中将 H37Ra 种子原液传播到对数阶段。将 H37Ra 原液以 1 mL 等分试样储存在 -80 °C 冰箱中长达 1 年。
- 解冻 1 mL 小瓶 Mtb-H37Ra,并在计划实验前约 1 周将其转移到带有过滤盖的 T25 烧瓶中,该烧瓶含有 9 mL 补充 MB 的肉汤。在静态培养箱中在37°C孵育5-7天。
- 在补充有非热杀死的10%胎牛血清(完全(c)RPMI)的RPMI-1640中生长THP-1细胞,在CO 2加湿培养箱中的T75 烧瓶中以5%CO2 / 37°C进行传代培养,每周传代培养两次以保持密度小于1 x 106 细胞/ mL。
- 在感染前 3 天,使用 T75 烧瓶中的血清移液管轻轻移液细胞数次,分散任何团块并将其放入 50 mL 锥形管中,从而将 THP-1 细胞分化为巨噬细胞。
- 在室温下以300× g 离心细胞10分钟,倒出上清液,然后将沉淀轻轻重悬于2mL RPMI中。进行细胞计数以估计细胞/mL。
- 在 12 孔组织培养板中以 100,000 个细胞/mL 的密度在 cRPMI 中接种 2 mL THP-1 巨噬细胞,用 100 ng/mL PMA 接种 72 小时。从细胞中取出含PMA的培养基,并在Mtb感染前补充新鲜的cRPMI。
- 为所需的每个时间点设置单独的板。
- 在 2 孔玻璃室载玻片中以相同密度 (100,000 个细胞/mL) 接种细胞,以确定感染的多重性 (MOI)。
- 置于37°C的5%CO2 加湿培养箱中3天。
2. Mtb吸收量的量化
- 巨噬细胞(MOI)对Mtb摄取的测定
- 在感染当天设置II类生物安全柜(BSC),并在两层薄纸上工作以捕捉任何溢出物。根据当地法规设置废物丢弃容器。
- 从 T25 烧瓶中取出 6-8 mL 分枝杆菌培养物,并将其转移到 15 mL 聚丙烯管中。
注意:较小体积的试管可用于较小的实验。 - 将管在室温下在台式离心机中以2890× g离心10分钟。
- 小心地从离心机中取出试管并将其转移到生物安全柜中。等待1分钟,让细菌沉淀。
- 将上清液倒入消毒剂丢弃容器中,重新盖管,并通过敲击管的侧面将细菌重悬于剩余培养基中。等待1分钟,让细菌沉淀。
- 加入 2 mL 预热的 cRPMI,轻轻混合,然后转移到 50 mL 锥形管中。
- 使用 25 G 针头和 5 mL 注射器非常小心地重悬分枝杆菌。要重新悬浮,请将分枝杆菌悬浮液吸入注射器中,然后非常轻柔地沿着管子的侧壁喷射,以尽量减少气溶胶的产生。重复6-8次。
注意:请格外小心,因为这是分枝杆菌的高密度培养。为避免针刺伤的风险,请尽可能使用钝针和鲁尔锁注射器。 - 将针头和注射器丢弃在平衡计分卡的锐器容器中。
- 将悬浮液转移到 2 mL 微量离心管(带旋入式盖)中,并在室温下以 100 x g 离心 3 分钟以沉淀任何剩余的团块。将管子放回安全柜并等待 1 分钟以使细菌沉淀。
- 将顶部 1-1.5 mL 的上清液转移到新管中。将原始管丢弃在装有消毒剂的废物桶中。充分混合并将各种量的分枝杆菌悬浮液(例如,5,25,50,150μL)添加到2孔玻璃室载玻片中,并在37°C的CO2 培养箱中孵育3小时。
- 抗酸细菌染色 (AFB)
注意:孵育3小时后,洗涤巨噬细胞并用多聚甲醛固定以灭活分枝杆菌。然后使用改良的Auramine O试剂盒(参见 材料表)对载玻片进行染色,以估计每个细胞吞噬的分枝杆菌。由于其蜡质细胞壁,分枝杆菌在酸醇洗涤后保留了金胺染料。然后用Hoechst对巨噬细胞核进行复染。该方法允许对每个细胞的吞噬细菌数量进行计数,并用于确定巨噬细胞的感染多样性(MOI)。- 上下移液三次后,从玻璃室载玻片中取出培养基,以去除未被吞噬的细菌。
- 用 2 mL 室温 PBS 洗涤一次。
- 储存4%多聚甲醛的库存,在-20°C下等分溶解在PBS中长达6个月。使用前立即解冻4%多聚甲醛的等分试样。用PBS稀释至2%多聚甲醛,每孔加入2 mL。
- 在室温下孵育10分钟。在此阶段,可以从安全柜中取出玻璃室载玻片进行染色。
- 在温和的自来水下清洗滑梯。
- 将足够的金胺分配到载玻片上,使用塑料移液管覆盖细胞,并在室温下在黑暗中孵育1分钟(用铝箔覆盖)。
- 用自来水洗掉载玻片上多余的染料,并在黑暗中加入脱色剂/淬火剂1分钟。
- 用自来水洗掉多余的,并在室温下用Hoechst 33342(PBS中的10μg/ mL)在黑暗中孵育15分钟。
- 用自来水洗掉Hoechst污渍,取出腔室,从载玻片中排出多余的水,加入一滴防淬灭剂和盖玻片,然后风干。
- 使用100倍油物镜在荧光显微镜下检查载玻片。分枝杆菌在FITC过滤器下会发出绿色荧光。细胞核在DAPI过滤器下发出蓝色荧光(图1C)。
- 通过计算每个细胞吞噬的分枝杆菌数量和感染细胞的百分比来确定MOI。
- 根据板中孔的表面积计算达到所需MOI所需的分枝杆菌悬浮液体积;例如,本实验中使用的玻璃室载玻片的表面积为4cm2。低MOI(约1-2杆菌/细胞)对于在几天(例如5天)进行的实验是理想的。
- 巨噬细胞感染
- 充分混合分枝杆菌悬浮液,并在确定达到所需MOI所需的体积后,将所需的量添加到12孔板上的细胞中。
- 在37°C孵育3小时以使分枝杆菌被吞噬。
- 通过用温热的RPMI或HBSS洗涤孔几次来去除细胞外细菌。
- 在一个孔(3小时样品)中裂解巨噬细胞,以确定初始接种物(3小时样品)的阳性时间百分比(TTP),如下步骤3所述。
- 向剩余孔中加入新鲜的cRPMI和所需的药物剂量或载体对照,将板在CO2 培养箱中于37°C孵育所需的时间(取决于实验设计,但通常在1至8天之间的几个间隔)。
3. 液体培养物检测系统的采集样品
注意:在感染当天,通过洗涤去除细胞外分枝杆菌,并通过裂解一个巨噬细胞孔(3小时样品)收获细胞内分枝杆菌,以确定吞噬作为感染基线对照的初始量。在随后的时间,将培养基、细胞裂解物和洗涤液结合起来以测量分枝杆菌的总生长。如果需要,也可以单独评估细胞外和细胞内生长。
- 收获3小时样品以确定TTP
- 如步骤2.3.3所述,在感染的初始3小时后从所有孔中洗去细胞外分枝杆菌。向3小时对照孔中加入1 mL新鲜培养基,以使裂解物体积与以后时间点的体积相等。
注意:如果要从分析中排除细胞外分枝杆菌,请参阅步骤3.2.7。
- 如步骤2.3.3所述,在感染的初始3小时后从所有孔中洗去细胞外分枝杆菌。向3小时对照孔中加入1 mL新鲜培养基,以使裂解物体积与以后时间点的体积相等。
- 样品采集
- 加热MB肉汤和仪器培养瓶,使其达到室温。
- 将培养基从 12 孔板转移到相应的标记锥形管中。
- 向每个孔中加入 500 μL 无菌裂解缓冲液(通过无菌 0.2 μm 过滤器过滤的 PBS 中的 0.1% Triton x-100)10 分钟。
- 用无菌刮刀轻轻地从孔中刮出细胞,并在适当的锥形管中与培养基结合。
- 用 0.5 mL 无菌 PBS 洗涤孔并转移到适当的管中。
- 轻轻地将每个样品通过针头和注射器(25 G)6-8次以分解团块。将样品在MB肉汤中以1:10的比例稀释;100 μL 样品 + 900 μL MB 培养基。
- 在所需的时间/天(通常在1至8天之间),按照上述步骤3.2.1-3.2.6收获剩余的样品。
注意:研究人员可能更愿意从他们的分析中排除细胞外分枝杆菌,在这种情况下,在上面的步骤3.2.2中,丢弃每个孔的培养基,并在加入裂解缓冲液之前洗涤巨噬细胞几次。
- 接种和装载仪器培养瓶
注意: 材料表中提供了液体培养仪器和相关耗材的详细信息。- 用浸泡在70%酒精中的薄纸对仪器培养瓶的橡胶盖进行消毒,并使其风干。
注意:此步骤需要在平衡计分卡中执行。 - 将所有样品的营养补充剂转移到锥形管(0.5 mL/瓶)中来制备瓶子。使用针头和注射器将 0.5 mL 营养补充剂注入器械培养瓶中。
- 将 500 μL 稀释样品 (1:10) 移液到 1 mL V 底管中。
- 使用针头和注射器将 500 μL 样品注入指定的仪器培养瓶中。
- 用浸泡在70%酒精中的薄纸对仪器培养瓶的橡胶盖进行消毒,并使其风干。从平衡计分卡中取出之前,用浸有 70% 酒精的薄纸擦拭瓶子。
- 小心地将瓶子从生物安全柜运送到仪器进行装载。
- 按下自动微生物检测系统上的加载按钮。
- 扫描仪器培养瓶上的条形码,并将瓶子放入37°C的检测系统培养箱中长达42天。从仪器屏幕上读取并记录达到阳性所需的时间。
注意: 条形码允许仪器识别瓶子并将反射率读数与特定瓶子联系起来。 - 通过将初始细胞内接种物(第 0 天)的 TTP 与在指定时间内培养的巨噬细胞的 TTP 进行比较,计算阳性百分比时间 (TTP)。TTP百分比的积极变化意味着分枝杆菌生长13。
例如,对于第 3 天:
阳性时间变化百分比 =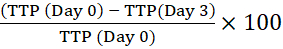
- 用浸泡在70%酒精中的薄纸对仪器培养瓶的橡胶盖进行消毒,并使其风干。
结果
本研究中使用的自动液体培养仪器每10分钟监测一次CO2水平。仪器瓶底部传感器的颜色变化以比色法测量,并以反射率单位表示。然后,仪器软件应用检测算法来计算阳性时间(TTP),即从接种到培养物被标记为阳性的天数(图1A)。TTP与初始接种物中log 10 CFU(通过琼脂平板法确定)12之间的反比关系如图1B所示。当通...
讨论
作者使用本协议中描述的液体培养方法来监测单核细胞来源的巨噬细胞和肺泡巨噬细胞以及用PMA11,16,17分化的THP-1细胞中的Mtb生长。该技术也可以修改以用于非贴壁细胞12。最近,该仪器还用于临床前研究,以评估吸入全反式维甲酸(AtRA)作为结核病17的HDT。协议中的关键步骤包括(1)通?...
披露声明
作者没有什么可透露的。
致谢
这项工作由爱尔兰科学基金会(SFI 08 / RFP / BMT1689),爱尔兰健康研究委员会[HRA-POR/2012 / 4和HRA-POR-2015-1145]和都柏林皇家医院信托基金资助。
材料
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
参考文献
- WHO. Global Tuberculosis Report. World Health Organization. , (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184 (2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237 (2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588 (2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151 (2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645 (2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), 453-488 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。