Method Article
جيل من وحدات السيارات البشرية مع تقاطعات العصبية والعضلية الوظيفية في الأجهزة Microfluidic
In This Article
Summary
نحن نصف طريقة لتوليد وحدات المحركات البشرية في الأجهزة الدقيقة المتاحة تجاريا عن طريق المشاركة في زراعة الخلايا العصبية الحركية المستمدة من الخلايا الجذعية المستحثة من الخلايا الجذعية المستحثة بالخلايا الجذعية مع الميوتوبات المشتقة من الميوتيوم الأساسي البشري مما يؤدي إلى تشكيل تقاطعات عصبية عضلية نشطة وظيفيا.
Abstract
تقاطعات العصبية والعضلية (NMJs) هي نقاط الاشتباك العصبي المتخصصة بين محور عصبي من الخلايا العصبية الحركية السفلية والعضلات تسهيل مشاركة تقلص العضلات. في اضطرابات الخلايا العصبية الحركية، مثل التصلب الجانبي الضموري (ALS) وضمور العضلات الشوكي (SMA)، تنحط NMJs، مما يؤدي إلى ضمور العضلات والشلل التدريجي. الآلية الأساسية لانحطاط NMJ غير معروفة ، ويرجع ذلك إلى حد كبير إلى عدم وجود نماذج بحثية قابلة للترجمة. هدفت هذه الدراسة إلى إنشاء نموذج متعدد الاستخدامات وقابل للاستنساخ في المختبر لوحدة محرك بشري مع NMJs وظيفية. لذلك ، تم استزراع الخلايا الجذعية المتعددة القدرات المستحثة البشرية (hiPSC) المشتقة من الخلايا العصبية الحركية وخلايا الميوجيوبلاست الأولية البشرية (MAB) المشتقة من الميوتوب في الأجهزة الدقيقة المتاحة تجاريا. يسمح استخدام المقصورات الصغيرة المعزولة بشكل سلس بالحفاظ على البيئات الدقيقة الخاصة بالخلايا مع السماح بالاتصال من خلية إلى خلية من خلال الميكروبات. من خلال تطبيق التدرج الكيميائي والحجمي ، تم تحفيز نمو الخلايا العصبية الحركية - neurites من خلال microgrooves تعزيز التفاعل myotube وتشكيل NMJs. تم تحديد هذه NMJs المناعي كيميائيا من خلال التوطين المشترك للخلايا العصبية الحركية علامة presynaptophysin (SYP) ومستقبلات أستيل postynaptic (AChR) علامة α-bungarotoxin (Btx) على الميوتوب وتتميز مورفولوجيا باستخدام المسح المجهري الإلكتروني (SEM). تم تأكيد وظيفة NMJs من خلال قياس استجابات الكالسيوم في الميوتوب عند إزالة الاستقطاب من الخلايا العصبية الحركية. يمكن للوحدة الحركية التي تم إنشاؤها باستخدام أجهزة microfluidic القياسية وتكنولوجيا الخلايا الجذعية أن تساعد الأبحاث المستقبلية التي تركز على NMJs في الصحة والمرض.
Introduction
NMJs تسهيل الاتصال بين الخلايا العصبية الحركية السفلية الشوكية وألياف العضلات الهيكلية من خلال الإفراج عن الناقلات العصبية1. في اضطرابات الخلايا العصبية الحركية مثل ALS وSMA، وNMJs المنحطة، مما يسبب اضطرابا في الاتصال مع العضلات2،3،4،5،6،7. وهذا يؤدي إلى فقدان المرضى تدريجيا لوظائف العضلات، مما يؤدي إلى أن تكون مقيدة بكرسي متحرك وتعتمد في نهاية المطاف على دعم الحياة التنفسية بسبب ضمور التدريجي لمجموعات العضلات الحيوية مثل الحجاب الحاجز. الآليات الكامنة وراء الدقيق المسؤول عن هذا فقدان عميق من NMJs في هذه الاضطرابات غير معروفة. وقد أجريت العديد من الدراسات على نماذج الحيوانات المعدلة وراثيا، والتي أعطتنا بعض الأفكار حول الإمراض من انحطاط NMJ5،6،8،9،10،11. ومع ذلك ، لفهم علم الأمراض بشكل كامل ومواجهة الحرمان ، من المهم أن يكون هناك نظام بشري ، والذي يسمح بإمكانية الوصول الكامل.
هنا، يصف البروتوكول طريقة بسيطة نسبيا لتوليد NMJs الإنسان من خلال التجريب المشترك للخلايا العصبية الحركية المشتقة من hiPSC والأنابيب العضلية الأساسية البشرية المشتقة من MAB باستخدام الأجهزة الدقيقة المتاحة تجاريا. وقد عرف استخدام microfluidics لاستقطاب وعزل السوائل سوماس وماكسونات الخلايا العصبية منذ الوصف الأول للغرف 'Campenot'12 في أواخر 1970s. ومنذ ذلك الحين، تم تصنيع المزيد من التصاميم الدقيقة، بما في ذلك الخيارات التجارية. تحتوي الأجهزة المستخدمة في هذا البروتوكول على مقصورتين، وتتكون كل مقصورة من بئرين متصلين بقناة 13. يتم عكس المقصورتين وتوصيلها مع العديد من microgrooves. هذه microgrooves لها حجم يسهل نمو neurite مع الحفاظ على عزلة السوائل بين المقصورتين من خلال الضغط الهيدروستاتيكي الشعرية13,14. باستخدام هذا النظام، فمن الممكن لثقافة الخلايا العصبية الحركية في مقصورة واحدة وخلايا العضلات في الآخر، كل في المتوسط ثقافة محددة، في حين لا يزال تسهيل اتصال مادي من خلال neurites تمر عبر microgrooves والانخراط مع خلايا العضلات. يوفر هذا النموذج نظاما قابلا للوصول الكامل وقابلا للتكيف في المختبر لوحدة محرك بشري ، والتي يمكن استخدامها لدراسة أمراض NMJ المبكرة في أمراض مثل ALS و SMA.
Protocol
وتم الحصول على موافقة خطية مستنيرة من جميع الأشخاص الذين قدموا عيناتهم لتوليد iPSC وحصاد MAB. تمت الموافقة على الإجراء من قبل لجنة الأخلاقيات الطبية في المستشفى الجامعي لوفين (n° S5732-ML11268) ولجنة أخلاقيات البحوث الرئيسية في المملكة المتحدة كجزء من مشروع StemBANCC. جميع الكواشف والمعدات المستخدمة في هذا البروتوكول مدرجة في جدول المواد وينبغي استخدامها عقيمة. يجب تسخين الوسائط إلى درجة حرارة الغرفة (RT) قبل الاستخدام ما لم يتم تحديد خلاف ذلك. للحصول على نظرة عامة حول بروتوكول الثقافة المشتركة، يرجى الاطلاع على الشكل 1.
1. التمايز من السلف العصبية الحركية من iPSCs
- اتبع بروتوكول تمايز الخلايا العصبية الحركية15، مقتبس من دراسة سابقة16، حتى الوصول إلى اليوم 10 السلف العصبي (NPCs) الدولة. وفقا للفترة الزمنية للبروتوكول، يتم بدء التفريق يوم الاثنين (اليوم 0)، والذي ينتج عنه يوم 10 NPCs يوم الخميس.
- يوم التبريد 10 NPCs في استبدال المصل خروج المغلوب مع 10٪ ثنائي ميثيل سلفوإكسيد (DMSO) في كثافة 2 × 106- 4 × 106 خلايا لكل قارورة.
تنبيه: DMSO سام: مقبض في غطاء الدخان مع معدات الحماية الشخصية.
ملاحظة: من المتوقع أن يكون ما يقرب من 50٪ من اليوم 10 NPCs حيويا عند ذوبان الجليد. وقف بروتوكول التمايز العصبي الحركي في هذه الدولة "اليوم 10 المجلس الوطني للصحافه" والتبريد NPCs لتوليد عدد كبير من الشخصيات، والتي يمكن أن تكون مصرفية واستخدامها في وقت لاحق، والحد من طول الجدول الزمني العام للبروتوكول الثقافة المشتركة من 28 يوما إلى 19 يوما المجموع.
2. اشتقاق وصيانة MABs الإنسان
ملاحظة: MABs هي خلايا جذعية ميسنشيمال مرتبطة بالسفينة، والتي تم حصادها في هذه الحالة من الخزعات التي تم الحصول عليها من متبرع سليم يبلغ من العمر 58 عاما. وتتوفر مصادر تجارية بديلة. يتم شرح البروتوكول للحصول على MABs بإيجاز. لمزيد من المعلومات، راجع البروتوكول المفصل17. يجب تسخين جميع وسائط MAB إلى 37 درجة مئوية قبل الاستخدام.
- فرم أنسجة الخزعة واحتضان على الكولاجين (من جلد العجل) المغلفة 6 سم أطباق في المتوسط النمو (الجدول 1) لمدة 2 أسابيع. تغيير المتوسطة كل 4 أيام.
- لإعداد طلاء الكولاجين، حل 100 ملغ من الكولاجين في 20 مل من حمض الخليك 0.1 M. الكولاجين يستغرق وقتا طويلا لتذوب، لذلك وضع الخليط على منصة هزاز بين عشية وضحاها في RT. في اليوم التالي، أعلى مع 80 مل من ddH2O إلى حجم نهائي من 100 مل.
تنبيه: حمض الخليك سام. التعامل مع غطاء الدخان مع معدات الحماية الشخصية.
ملاحظة: الكولاجين من طلاء جلد العجل يمكن إعادة استخدامها تصل إلى 5x. يخزن عند درجة حرارة 4 درجات مئوية. - معطف كامل سطح الطبق أو قارورة مع الكولاجين، وإغلاق واحتضان لمدة 20 دقيقة في RT داخل تدفق صفح. بعد 20 دقيقة، واستعادة الكولاجين في وعاء جديد، وإغلاق الطبق فارغة / قارورة وترك لمدة 10 دقيقة في RT في تدفق صفح.
- نقل الطبق / القارورة إلى الحاضنة لليلة واحدة (أو على الأقل 6 ساعة) حضانة (37 درجة مئوية، 5٪ CO2). اغسل 5x مع ملحية دولبيكو العازلة بالفوسفات دون الكالسيوم أو المغنيسيوم (DPBS) قبل طلاء الخلايا.
- لإعداد طلاء الكولاجين، حل 100 ملغ من الكولاجين في 20 مل من حمض الخليك 0.1 M. الكولاجين يستغرق وقتا طويلا لتذوب، لذلك وضع الخليط على منصة هزاز بين عشية وضحاها في RT. في اليوم التالي، أعلى مع 80 مل من ddH2O إلى حجم نهائي من 100 مل.
- بعد 14 يوما، يقوم FACS (فرز الخلايا المنشطة الفلورية) بفرز MABs للفوسفاتاز القلوية البشرية17 يليه المزيد من التوسع. الحفاظ على MABs على قوارير T75 المغلفة بالكولاجين في متوسط النمو وتغيير متوسط النمو كل يومين (10 مل لكل قارورة).
- حفظ التبريد، مرور، أو MABs البذور في الأجهزة عند الوصول إلى التقاء 70٪.
ملاحظة: تفقد MABs إمكاناتها الميوجينية بسبب الاندماجات التلقائية عند الاتصال من خلية إلى خلية. تأكد من عدم تجاوز التقاء 70٪ عند توسيع MABs. قارورة T75 التقاء واحد 70٪ يحتوي على ما يقرب من 600،000-800،000 الخلايا، والتي يمكن أن تكون cryopreserved في 100،000 خلية لكل قارورة. ويمكن فيما بعد إذابة كل قارورة وزرعها في قارورة T75 للتوسع. - لتمرير MABs، غسلها بلطف مرة واحدة مع 7 مل من DPBS ومن ثم احتضان في 7 مل من محلول تفكك MAB لمدة 3 دقائق في 37 درجة مئوية في 5٪ CO2 يفكك الخلايا.
- تحييد محلول تفكك MAB مع 7 مل من متوسط النمو، كشط بلطف الخلايا، ونقل تعليق الخلية إلى أنبوب الطرد المركزي 50 مل. غسل بلطف قارورة مع 5 مل إضافية من متوسط النمو لجمع MABs يحتمل أن تبقى.
- الطرد المركزي تعليق الخلية لمدة 3 دقائق في 300 × ز، ثم مرور مباشرة إلى قارورة T75 المغلفة بالكولاجين جديدة للتوسع، والتبريد في استبدال المصل بالضربة القاضية مع DMSO 10٪ أو العد إلى البذور في جهاز microfluidic.
ملاحظة: يتم تنفيذ المقاطع 1x-2x في الأسبوع لتوسيع الخلية حتى الحد الأقصى لعدد المرور من 13. عند الانفصال ، تظهر MABs كروية وكبيرة في الشكل عند فحصها تحت المجهر.
3. إعداد أجهزة ميكروفلويديك مجمعة مسبقا - اليوم التاسع
ملاحظة: تم تكييف البروتوكول من بروتوكول الجهاز العصبي للشركة المصنعة للجهاز microfluidic وتم تعديله لاستخدام كل من أجهزة ما قبل التجميع والسيليكون. هنا، يتم استخدام الأجهزة المجمعة مسبقا للكيمياء المناعية (ICC) والتسجيلات العابرة للكالسيوم بالخلايا الحية، في حين يتم استخدام أجهزة السيليكون ل SEM. الجدول الزمني للبروتوكول يتبع الجدول الزمني لبروتوكول تمايز الخلايا العصبية الحركية.
- إعداد الأجهزة microfluidic في اليوم السابق لخلايا البذر، والطلاء يحتاج إلى احتضان بين عشية وضحاها. وفقا لبروتوكول الخلايا العصبية الحركية، سيكون هذا يوم الأربعاء. إضافة ~ 10 مل من الإيثانول 70٪ -100٪ إلى طبق بيتري 10 سم. استخدام ملقط لنقل الجهاز من حاوية الشحن إلى طبق بيتري للتعقيم.
- غمر الجهاز في الإيثانول لمدة 10 ق ونقل الجهاز مع ملقط إلى قطعة من الورق لتجف الهواء في تدفق صفح ل ~ 30 دقيقة. قم بقلب الجهاز عدة مرات للسماح لكلا الجانبين بالجفاف. عندما يكون الجهاز جافا، استخدم ملقط لنقل كل جهاز إلى طبق بيتري فردي طوله 10 سم لسهولة التعامل معه
تنبيه: الإيثانول سام؛ التعامل مع غطاء الدخان مع معدات الحماية الشخصية - قم بتغليف الجهاز ببولي-إل-أورنيثين (PLO) (100 ميكروغرام/مل) في DPBS واحتضنه عند 37 درجة مئوية، و5٪ ثاني أكسيد الكربون لمدة 3 ساعة.
- استخدام ماصة P200 لإضافة 100 ميكرولتر من منظمة التحرير الفلسطينية في DPBS في أعلى وكذلك على مقربة من افتتاح القناة ممكن ومراقبة السائل يمر من أعلى جيدا من خلال القناة إلى أسفل جيدا. بعد ذلك، أضف 100 ميكرولتر من منظمة التحرير الفلسطينية في DPBS إلى البئر السفلي.
- كرر على الجانب الآخر من microgrooves والانتهاء من خلال إضافة 100 ميكرولتر على جانب واحد من الجهاز لخلق تدرج حجم بين الجانبين معكوسة من الجهاز لمعطف microgrooves (على سبيل المثال، الجانب الأيمن 200 ميكرولتر، الجانب الأيسر 300 ميكرولتر). بعد 3 ساعة، اغسل الجهاز 3x لمدة 5 دقائق مع DPBS. استخدم نظام الشفط إذا لزم الأمر.
ملاحظة: تأكد من تجنب أي تشكيل فقاعة الهواء في القنوات في أي نقطة أثناء طلاء أو زراعة الخلايا. حتى الفقاعات الصغيرة ستتوسع على مدى فترة قصيرة ، وبالتالي تمنع الطلاء أو بذر الخلايا أو تدفق الوسائط عبر القناة. إذا توقف السائل في القناة أثناء الطلاء ، إعادة إنفاق حل منظمة التحرير الفلسطينية مباشرة في القناة من كلا الجانبين. إذا كانت الفقاعات لا تزال موجودة، استخدم 200 ميكرولتر من DPBS لطرد القناة وتكرار عملية الطلاء كما هو مذكور أعلاه في الخطوات 3.3.1-3.3.2. إذا ظهرت فقاعات بعد بذر الخلية، فمن المستحيل لاستعادة الجهاز، كما مسح القناة سوف تلحق الضرر الخلايا.
- معطف الجهاز مع اللامينين (20 ميكروغرام / مل) في المتوسط العصبي واحتضان بين عشية وضحاها في 37 درجة مئوية، 5٪ CO2. اتبع نفس التعليمات لطلاء منظمة التحرير الفلسطينية من الخطوات 3.3.1-3.3.2.
- في اليوم التالي، استخدم ماصة P200 ووضع طرف في المقابل تماما لفتح القناة لإزالة طلاء صفح من الآبار. إضافة DPBS إلى جميع الآبار وترك الأجهزة مع DPBS في تدفق صفح في RT لزرع الخلايا.
ملاحظة: من هذه النقطة فصاعدا، من المهم عدم إزالة السائل (طلاء صفح، DPBS، وسائل الإعلام، حل التثبيت، الخ) مباشرة من القنوات، لأن هذا قد يسبب تشكيل فقاعة الهواء. فحص الأجهزة تحت المجهر دائما قبل بذر الخلايا.
4. إعداد أجهزة السيليكون microfluidic - اليوم 9
- إعداد أجهزة السيليكون microfluidic في اليوم السابق لخلايا البذر، كما طلاء يحتاج إلى احتضان بين عشية وضحاها. وفقا لبروتوكول الخلايا العصبية الحركية، سيكون هذا يوم الأربعاء.
- إضافة ~ 10 مل من الإيثانول 70٪ -100٪ إلى طبق بيتري 10 سم. استخدام ملقط لنقل الجهاز من حاوية الشحن إلى طبق بيتري للتعقيم. غمر الجهاز في الإيثانول لمدة 10 ق ونقل مع ملقط إلى بئر في لوحة 6-جيدا للهواء الجاف في تدفق صفح ل ~ 30 دقيقة. ضع الجهاز على جانبه للسماح لجميع الجوانب بالجفاف.
- خفض أوراق SEM إلى حجم الجهاز (ترك بضعة ملم على كل جانب). كرر التعقيم كما هو مذكور أعلاه في الخطوة 4.1.1. ثم، نقل مع ملقط إلى طبق بيتري 10 سم لتجف. ستتلاءم أوراق SEM من اثنين إلى ثلاثة في طبق واحد.
- غط الأجهزة وأوراق SEM مع PLO (100 ميكروغرام /مل) في DPBS واحتضانها عند 37 درجة مئوية ، 5٪ CO2 لمدة 3 ساعة.
- أضف 1 مل من PLO في DPBS لكل بئر إلى كل جهاز في لوحة 6-well. تأكد من أن الجهاز يطفو فوق حل منظمة التحرير الفلسطينية مع القناة والجانب microgroove التي تواجه أسفل إلى السائل. إضافة 10 مل من منظمة التحرير الفلسطينية في DPBS لكل 10 سم طبق بيتري واستخدام ملقط لدفع أسفل أوراق SEM في السائل.
ملاحظة: أوراق SEM عادة ما تطفو على رأس الحل الطلاء. قبل تجميع الجهاز والصحيفة، قم بتشغيل ورقة SEM بحيث يتصل السطح، الذي كان على اتصال بمنظمة التحرير الفلسطينية، بالقناة وسطح الجهاز microgroove. - بعد 3 ساعة، اغسل الجهاز وصفائح SEM 2x لمدة 5 دقائق مع DPBS تليها غسل آخر لمدة 5 دقائق بالماء العقيم. استخدم نظام الشفط إذا لزم الأمر. نقل كل ورقة SEM إلى طبق بيتري 10 سم الفردية لسهولة التعامل معها.
ملاحظة: يجب أن تكون كل من الأجهزة وأوراق SEM جافة تماما قبل التجميع. يغسل النهائي مع الماء العقيم يزيل بلورات الملح المحتملة من DPBS، والتي قد تمنع خلاف ذلك التجمع.
- أضف 1 مل من PLO في DPBS لكل بئر إلى كل جهاز في لوحة 6-well. تأكد من أن الجهاز يطفو فوق حل منظمة التحرير الفلسطينية مع القناة والجانب microgroove التي تواجه أسفل إلى السائل. إضافة 10 مل من منظمة التحرير الفلسطينية في DPBS لكل 10 سم طبق بيتري واستخدام ملقط لدفع أسفل أوراق SEM في السائل.
- العمل تحت المجهر في تدفق صفح. استخدم ملقط لتركيب جهاز السيليكون مع القناة والجانب microgroove أسفل بزاوية 90 درجة على ورقة SEM، وضمان أن جميع الجوانب هي محاذاة. اضغط بخفة على الجهاز للتأكد من ختم الحواف الخارجية ليس فقط ولكن أيضا حول الآبار والقنوات والميكروجروف.
ملاحظة: ستظهر المناطق المستعبدة باللون الرمادي، بينما ستظهر المناطق غير المثبتة بعد واضحة تحت المجهر. تأكد من أن جميع المناطق مغلقة بشكل جيد دون فقاعات الهواء لتجنب انفصال الجهاز أثناء الاستزراع. في حالة الحطام أو بلورات الملح عرقلة تصاعد، إعادة غسل كل من ورقة SEM والجهاز في الماء العقيم والجاف قبل إعادة محاولة الإجراء تصاعد. إذا ظهرت microgrooves مشوهة من الضغط بشدة على الجهاز، قم بإزالة الجهاز تماما من ورقة SEM وحاول التركيب مرة أخرى. كن حذرا عند طلاء وتغيير الوسائط بمجرد تركيب الجهاز. - العمل تحت المجهر في تدفق صفح. معطف الجهاز مع اللامينين (20 ميكروغرام / مل) في المتوسط العصبي واحتضان بين عشية وضحاها في 37 درجة مئوية، 5٪ CO2.
ملاحظة: الحضانة بين عشية وضحاها تصلب جهاز السيليكون والمزيد من الأختام على ورقة SEM.- استخدام ماصة P200 لإضافة 100 ميكرولتر من محلول صفمين في أعلى وكذلك على مقربة من افتتاح القناة ممكن ومراقبة السائل يمر من أعلى جيدا من خلال القناة إلى أسفل جيدا. التحقق من وجود تسرب حول البئر والقناة.
- في وقت لاحق، إضافة 100 ميكرولتر من محلول صفمين إلى البئر السفلي والتحقق من وجود تسرب. كرر على الجانب الآخر من microgrooves والانتهاء مع 100 ميكرولتر إضافية على جانب واحد من الجهاز لخلق تدرج حجم بين الجانبين معكوسة من الجهاز لمعطف microgrooves (على سبيل المثال، الجانب الأيمن 200 ميكرولتر، الجانب الأيسر 300 ميكرولتر).
ملاحظة: في حالة التسرب، قم بإزالة طلاء صفح، تفكيك الجهاز وصحائف SEM وغسل كليهما في الماء العقيم. دعهم يجفون ويكرروا من الخطوة 4.3 فصاعدا. - في اليوم التالي، قم بإزالة الطلاء من الآبار مع ماصة P200 عن طريق وضع الطرف في الجهة المقابلة لفتح القناة. إضافة DPBS إلى جميع الآبار وترك الأجهزة مع DPBS في تدفق صفح في RT لزرع الخلايا.
ملاحظة: من هذه النقطة فصاعدا، لا لإزالة السائل (طلاء صفح، DPBS، وسائل الإعلام، حل التثبيت، الخ) مباشرة من القنوات، لأن هذا قد يسبب تشكيل فقاعة الهواء. فحص الأجهزة تحت المجهر دائما قبل بذر الخلايا.
5. الطلاء من الشخصيات في أجهزة microfluidic -- يوم 10
ملاحظة: وفقا لبروتوكول تمايز الخلايا العصبية الحركية15، الطلاء من اليوم 10 NPCs يحدث يوم الخميس.
- استخدام فصل حديثا اليوم 10 NPCs15، أو إذابة 1-2 قوارير من الNPCs المصرفية لكل 10 مل من اليوم 10 الخلايا العصبية الحركية المتوسطة (الجدول 2 والجدول 3) مع مثبط روك (10 ميكرولتر / مل) الحل، والطرد المركزي تعليق الخلية في 100 × ز لمدة 4 دقائق.
- Resuspend بيليه الخلية في 500-1000 ميكرولتر من اليوم 10 الخلايا العصبية الحركية المتوسطة مع مثبط ROCK (10 ميكرولتر / مل) حل وعد الخلايا الحية باستخدام أي طريقة العد المفضل.
ملاحظة: كما هو مذكور أدناه، تأكد من إعادة إنفاق NPCs في كمية الوسائط الصحيحة لاستيعاب حجم البذر الأمثل. - إزالة DPBS من بئرين على جانب واحد من microgrooves في الجهاز مع ماصة P200 والبذور 250،000 الشخصيات لكل جهاز في 60-100 ميكرولتر من وسائل الإعلام العصبية الحركية اليوم 10.
- في أعلى البئر الأيمن، البذور 30-50 ميكرولتر من تعليق الخلية (125،000 خلية) على مقربة من فتح القناة بزاوية 45 درجة وسحب السائل المتبقي بلطف على طول أرضية البئر نحو وسط البئر مع طرف ماصة.
- توقف لبضع ثوان للسماح لتعليق الخلية بالتدفق عبر القناة قبل تكرار ذلك في البئر السفلي (125,000 خلية في 30-50 ميكرولتر). استخدام القلم لوضع علامة على الجانب المصنف "NPC" أو ما يعادلها لتوجيه سهل للجهاز دون المجهر.
- احتضان الجهاز في 37 درجة مئوية، 5٪ CO2 لمدة 5 دقائق للسماح مرفق الخلية قبل تتصدر الآبار ذات البذرتين مع يوم إضافي 10 الخلايا العصبية الحركية المتوسطة (مجموع 200 ميكرولتر / جيد) واحتضان مرة أخرى في 37 درجة مئوية، 5٪ CO2.
ملاحظة: يمكن أن يحتوي كل بئر على 200 ميكرولتر. فمن الممكن لزرع عدد أقل من الخلايا في القناة فقط. ومع ذلك، هذا سيجعل الثقافة أكثر عرضة لوحدة التخزين الحالية من خلال القنوات أثناء كل تغيير متوسط.
- استخدام ماصة P200 لإزالة DPBS من البئرين على الجانب الآخر من microgrooves مقابل NPCs المصنف حديثا. ثم، إضافة 6 مل من DPBS لكل طبق 10 سم حول الجهاز لمنع تبخر المتوسطة أثناء الحضانة.
ملاحظة: إضافة DPBS إضافية حول الجهاز أثناء فترة الثقافة إذا لزم الأمر. - إجراء تغيير متوسط كامل للخلايا العصبية الحركية في كل من مقصورات الجهاز في اليوم 11 (الجمعة) واليوم 14 (الاثنين) واليوم 16 (الأربعاء) (الجدول 2 والجدول 3). إضافة مكملات الوسائط الطازجة في يوم التغيير المتوسط.
ملاحظة: من هذه النقطة على إجراء كافة التغييرات المتوسطة مع ماصة P200. ضع دائما طرف ماصة بعيدا عن القناة على حافة البئر ولا تزيل السائل مباشرة من القناة. يجب الحرص على عدم فصل أجهزة السيليكون. إزالة وإضافة المتوسطة ينبغي أن يتم ببطء لمنع انفصال الخلية.- إزالة بعناية جميع وسائل الإعلام في كلا البئرين مع NPCs عن طريق وضع تلميح ماصة P200 في الحافة السفلية من جدار البئر مقابل فتح القناة. إضافة ببطء 50-100 ميكرولتر من الخلايا العصبية الحركية الطازجة المتوسطة إلى أعلى جيدا عن طريق وضع تلميح ماصة P200 في الحافة العليا من جدار البئر مقابل افتتاح القناة.
- وقفة لبضع ثوان للسماح للوسط لتدفق من خلال القناة قبل إضافة 50-100 ميكرولتر من الخلايا العصبية الحركية المتوسطة إلى أسفل جيدا. كرر هذه العملية بعناية حتى كلا البئرين تحتوي على 200 ميكرولتر / جيدا. كرر على الجانب دون خلايا.
6. طلاء MAB في الأجهزة microfluidic - اليوم 17
- ما يقرب من 7 أيام قبل البذر MABs في الأجهزة microfluidic (اليوم 10 من التمايز العصبي الحركي)، إذابة MABs والبذور لهم في المتوسط النمو (الجدول 1) في قارورة T75 المغلفة مع الكولاجين للسماح لتوسيع الخلايا كافية. انظر القسم 2- الاطلاع على الأقسام 2 من هذا البند
- في اليوم 17 من التمايز العصبي الحركي (الخميس) ، فصام MABs كما هو موضح في الخطوة 2.4 ، وإعادة إنفاق بيليه الخلية في ~ 500 ميكرولتر من متوسط النمو وحساب الخلايا الحية باستخدام أي طريقة العد المفضل.
ملاحظة: كما هو مذكور أدناه، تأكد من إعادة إنفاق MABs في كمية الوسائط الصحيحة لاستيعاب حجم البذر الأمثل. - إزالة المتوسطة العصبية الحركية على الجانب غير المصنف من microgrooves في الجهاز مع ماصة P200، يغسل بلطف مع DPBS، والبذور 200،000 MABs لكل جهاز في 60-100 ميكرولتر من متوسط النمو.
- في أعلى البئر الأيمن، البذور 30-50 ميكرولتر من تعليق الخلية (100،000 خلية) على مقربة من فتح القناة بزاوية 45 درجة وسحب السائل المتبقي بلطف على طول أرضية البئر نحو وسط البئر مع طرف ماصة. وقفة لبضع ثوان للسماح لتدفق الخلايا من خلال القناة قبل تكرار في البئر السفلي (100،000 خلية في 30-50 ميكرولتر).
- احتضان الجهاز عند 37 درجة مئوية، 5٪ CO2 لمدة 5 دقائق للسماح مرفق الخلية قبل تتصدر اثنين من الآبار الطازجة MAB البذور مع متوسط نمو إضافي (مجموع 200 ميكرولتر / جيد). احتضان مرة أخرى في 37 درجة مئوية، 5٪ CO2.
ملاحظة: لا حاجة إلى تغيير متوسط في اليوم 17 على جانب الخلايا العصبية الحركية للجهاز. اليوم 17 تغيير متوسط وفقا لطريقة التمايز العصبي الحركية المنشورة سابقا15 بدلا من ذلك يتم تنفيذها في اليوم 18 (الجمعة).
7. تنفيذ تدرج الحجمي وchemtactic لتعزيز نمو الخلايا العصبية الحركية neurites نحو مقصورة MAB
- في اليوم 18، إجراء تغيير متوسط كامل على الجانب العصبي الحركي مع يوم 18 الخلايا العصبية الحركية المتوسطة (200 ميكرولتر / حسنا). اتبع الإرشادات الخاصة بالتغييرات المتوسطة المذكورة في الخطوات 5.5.1-5.5.2. بدء التمايز MAB في مقصورة MAB للجهاز (الجدول 2 والجدول 4).
- اغسل مقصورات MAB بعناية مرة واحدة مع DPBS قبل إضافة وسيط تمايز MAB مسخن (الجدول 4) مكملا ب 0.01 ميكروغرام / مل من الأغرين البشري (200 ميكرولتر / بئر).
ملاحظة: سوف MABs دمج وتشكيل myotubes متعددة النوى على مدى فترة زمنية من أسبوع واحد.
- اغسل مقصورات MAB بعناية مرة واحدة مع DPBS قبل إضافة وسيط تمايز MAB مسخن (الجدول 4) مكملا ب 0.01 ميكروغرام / مل من الأغرين البشري (200 ميكرولتر / بئر).
- في اليوم 21، وفقا لبروتوكول التمايز العصبي الحركي (الاثنين)، بدء التدرج الكيميائي والحجمي (الجدول 2 والجدول 3).
- إضافة 200 ميكرولتر / بئر من الخلايا العصبية الحركية المتوسطة القاعدية مع 30 نانوغرام / مل من عامل الأعصاب المشتقة من الدماغ (BDNF) ، والخلية الدبقية المستمدة من خط العصبية (GDNF) وج عامل الخلايا العصبية (CNTF)، والأغرين البشري (0.01 ميكروغرام/مل)، واللامينين (20 ميكروغرام/مل) إلى مقصورة الميوتوب (التي كانت تعرف سابقا باسم مقصورة MAB). إضافة الخلايا العصبية الحركية المتوسط القاعدية (100 ميكرولتر / جيد) دون عوامل النمو إلى مقصورة الخلايا العصبية الحركية.
- كرر الخطوة 7.2 كل يوم ثاني حتى اليوم 28 من التمايز العصبي الحركي. لا حاجة إلى تغيير وسائل الإعلام خلال عطلة نهاية الأسبوع.
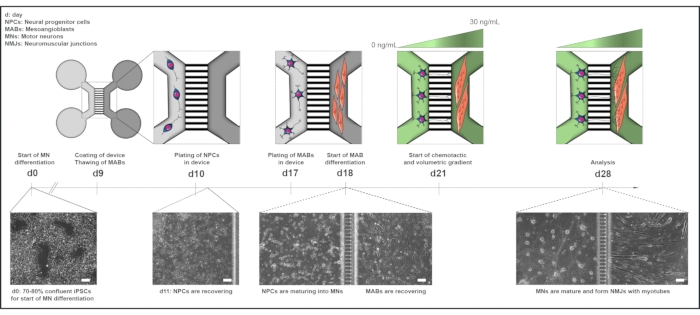
الشكل 1: نظرة عامة تخطيطية لبروتوكول وحدة المحرك في الأجهزة الدقيقة. الجدول الزمني للتمايز ونظرة عامة على الثقافة المشتركة من اليوم 0 إلى اليوم 28 وفقا للجدول الزمني لبروتوكول تمايز الخلايا العصبية الحركية22. يبدأ التمايز العصبي الحركي من iPSCs في اليوم 0 ويتم تنفيذه كما ذكر سابقا للأيام ال 10 التالية15. في اليوم التاسع، يتم تعقيم الجهاز وتغليفه بطبقة منظمة التحرير الفلسطينية. يتم إذابة MABs للتوسع في قوارير T75. في اليوم العاشر، يتم صفيحة الخلايا العصبية الحركية-الخلايا العصبية في كل من الآبار وقناة مقصورة واحدة (رمادية فاتحة) للجهاز، حيث يستمر تمييزها في الخلايا العصبية الحركية لمدة أسبوع. مطلية MABs في كل من الآبار وقناة المقصورة المقابلة (رمادي داكن) في اليوم 17. في اليوم 18 ، بدأ تمايز MABs في myotubes. في اليوم 21 ، يتم إنشاء تدرج حجمي وكيموتايك لتعزيز الاستقطاب العصبي العصبي الحركي من خلال الغروفيات الدقيقة للجهاز. تلقت مقصورة الخلايا العصبية الحركية 100 ميكرولتر / بئر من الوسط القاعدي للخلايا العصبية الحركية دون عوامل نمو (المقصورة الخضراء الخفيفة) ، في حين تلقت مقصورة الميوتوب 200 ميكرولتر / بئر من الوسط القاعدي للخلايا العصبية الحركية مع 30 نانوغرام / مل من عوامل النمو (المقصورة الخضراء الداكنة) (الجدول 2 والجدول 3). تستمر الثقافة مع التدرج الحجمي والعلاج الكيميائي لمدة 7 أيام إضافية حتى التحليل في اليوم 28. تظهر صور المجال الساطع مورفولوجيا الخلايا في اليوم 0، واليوم 11، واليوم 18، واليوم 28 المستزرع في أجهزة ميكروفلويديك مجمعة مسبقا. شريط المقياس، 100 ميكرومتر. وقد تم تعديل هذا الرقم من ستوكلوند ديتلاو، ك. وآخرون.18. تم تعديل الرسوم التوضيحية للخلايا من Smart Server الطبي Art22. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. التثبيت و المحكمة الجنائية الدولية
ملاحظة: يجب أن يتم كل الخطوات بعناية لمنع انفصال الثقافات العصبية. لا تقم بإزالة السائل من القنوات أثناء الخطوات التالية.
- إجراء التثبيت في غطاء الدخان أو تدفق صفح: اغسل بعناية جميع الآبار في الجهاز مرة واحدة مع DPBS قبل التثبيت. إصلاح باستخدام 4 ٪ paraformaldehyde (PFA) في DPBS لمدة 15-20 دقيقة في RT في تدفق صفح (100 ميكرولتر / بئر).
تنبيه: PFA سام: مقبض في غطاء الدخان مع معدات الحماية الشخصية.- أضف بعناية 100 ميكرولتر إلى البئر العلوي للجهاز وانتظر بضع ثوان للسماح لمحلول التثبيت بالتدفق عبر القناة قبل إضافة 100 ميكرولتر إلى البئر السفلي. كرر على الجانب الآخر. بعد الحضانة، قم بإزالة محلول PFA واغسل 3x برفق لمدة 5 دقائق باستخدام DPBS. ترك في 200 μL / جيدا DPBS للتخزين وختم طبق بيتري 10 سم مع بارا فيلم لتخزين في 4 درجة مئوية حتى تجربة المحكمة الجنائية الدولية.
ملاحظة: تأكد من عدم جفاف الأجهزة أثناء التخزين.
- أضف بعناية 100 ميكرولتر إلى البئر العلوي للجهاز وانتظر بضع ثوان للسماح لمحلول التثبيت بالتدفق عبر القناة قبل إضافة 100 ميكرولتر إلى البئر السفلي. كرر على الجانب الآخر. بعد الحضانة، قم بإزالة محلول PFA واغسل 3x برفق لمدة 5 دقائق باستخدام DPBS. ترك في 200 μL / جيدا DPBS للتخزين وختم طبق بيتري 10 سم مع بارا فيلم لتخزين في 4 درجة مئوية حتى تجربة المحكمة الجنائية الدولية.
- احتضان الخلايا مع حل permeabilization (100 ميكرولتر / بئر) من 0.1٪ تريتون X-100 في DPBS لمدة 20 دقيقة في RT في اليوم 1 من إجراء المحكمة الجنائية الدولية. إزالة الحل permeabilization، وإضافة 5٪ مصل الحمير العادي في 0.1٪ تريتون X-100/DPBS الحل (100 ميكرولتر / جيد) لمدة 30 دقيقة في RT.
- إزالة محلول مصل الحمير العادي 5٪، واحتضان الأجهزة مع الأجسام المضادة الأولية (جدول المواد) في مصل الحمير العادي 2٪ في 0.1٪ تريتون X-100/DPBS الحل واحتضان في 4 درجة مئوية بين عشية وضحاها.
- تطبيق تدرج وحدة تخزين. إضافة 100 ميكرولتر / بئر من حل الأجسام المضادة على جانب واحد من microgrooves و 150 ميكرولتر / جيد على الجانب الآخر (500 ميكرولتر المجموع لكل جهاز).
ملاحظة: من الممكن استخدام أجسام مضادة مختلفة على جانبي الميكروجروف. في هذه الحالة، لا تقم بتنفيذ تدرج حجم مع الأجسام المضادة الأولية أو الثانوية عبر microgrooves للحفاظ على العزلة السائلة بين المقصورات. لن تكون ملطخة neurites في microgrooves دون التدرج.
- تطبيق تدرج وحدة تخزين. إضافة 100 ميكرولتر / بئر من حل الأجسام المضادة على جانب واحد من microgrooves و 150 ميكرولتر / جيد على الجانب الآخر (500 ميكرولتر المجموع لكل جهاز).
- في اليوم التالي (اليوم 2 من الإجراء المحكمة الجنائية الدولية)، وإزالة الأجسام المضادة الأولية وغسل بعناية الجهاز 3X لمدة 5 دقائق مع 0.1٪ تريتون X-100/DPBS الحل.
ملاحظة: في الثقافات القابلة للفصل بسهولة، يمكن استبدال غسل 3x لمدة 5 دقائق ب 1x لمدة 30 دقيقة. - العمل في الظلام من الآن فصاعدا، والأجسام المضادة الثانوية (جدول المواد) حساسة للضوء. احتضان الخلايا مع الأجسام المضادة الثانوية في مصل الحمير العادي 2٪ في 0.1٪ تريتون X-100/DPBS حل لمدة 1 ساعة في RT. تنفيذ تدرج حجم كما هو مذكور في الخطوة 8.3.1. بعد الحضانة، قم بإزالة الأجسام المضادة الثانوية واغسل 3x لمدة 5 دقائق باستخدام DPBS.
- تسمية الحمض النووي مع DAPI في DPBS (100 ميكرولتر / بئر) لمدة 20 دقيقة في RT تليها 3x-4x من 5 دقائق غسل مع 0.1٪ تريتون X-100/DPBS الحل. إزالة 0.1٪ Triton X-100/DPBS الحل من جميع الآبار والسماح للثقافة الجافة لبضع ثوان قبل إضافة قطرة واحدة من وسائل الإعلام تصاعد الفلورسنت في كل بئر لختم.
ملاحظة: حافظ على الأجهزة أفقية لمدة 24 ساعة على الأقل للسماح للوسائط المتصاعدة بالانتهاك. بعد 24 ساعة، يمكن تخزين الأجهزة في علبة شرائح عند درجة حرارة 4 درجات مئوية. - الصورة في مداخن z مع المجهر المقلوب.
- لتصوير NMJs ، استخدم هدفا 40x لتحديد موقع myotubes المميز بأجسام مضادة myotube (جدول المواد) وإجراء تسجيلات z-stack لضمان تصوير الأنسجة العصبية والميوتوب. التقاط صور متعددة في حالة myotube كبيرة جدا لتناسب في إطار واحد.
- بالنسبة للقياس الكمي ل NMJ ، قم بحساب عدد التوطينات المشتركة يدويا بين علامة ما قبل الاشتباك العصبي وعلامة AChR من خلال كل كومة z. تطبيع عدد من التوطين المشترك لعدد من myotubes موجودة في كومة ض.
9. تثبيت وإعداد الجهاز ل SEM
ملاحظة: عند تغيير السوائل، احتفظ دائما بكمية صغيرة لتغطية الثقافة لتجنب انهيار الخلية. يستخدم هذا البروتوكول مواد شديدة السمية، وهو مطلوب للعمل مع معدات الحماية الشخصية وفي غطاء الدخان خلال العملية بأكملها.
- التثبيت والتفكيك: إعداد 2.5٪ طازجة الغلوتارالدهيد (GA) في 0.1 M صوديوم cacodylate العازلة (درجة الحموضة 7.6)، مرشح مع مرشح 0.2 ميكرومتر، وتسخين ما يصل إلى 37 درجة مئوية.
تنبيه: الجمعية العامة والصوديوم cacodylate سامة: مقبض في غطاء الدخان مع معدات الحماية الشخصية.- اغسل الجهاز بعناية مرة واحدة مع DPBS لإزالة الوسائط وحطام الخلايا ثم البادئة مع حل GA لمدة 15 دقيقة في RT.
- استخدم مشرطا لقطع ورقة SEM بعناية إلى محيط الجهاز مع تثبيت الجهاز باستخدام ملقط. تأكد من عدم فصل الجهاز أثناء القطع. نقل الجهاز وورقة SEM بمساعدة ملقط إلى طبق بيتري 3 سم ووضع طبق 3 سم في طبق 10 سم لسهولة التعامل معها.
- بعد 15 دقيقة من البادئة، قم بإزالة الجهاز بعناية من ورقة SEM باستخدام ملقط. فصل الجهاز في زاوية واحدة وإزالتها ببطء في اتجاه قطري نحو الزاوية المقابلة. مراقبة الخلايا فصل من الجهاز.
- أضف حل GA إضافي لتغطية ورقة SEM بأكملها في طبق 3 سم ومواصلة التثبيت لمدة إجمالية قدرها 2 ساعة في RT أو بين عشية وضحاها عند 4 درجات مئوية.
ملاحظة: ادفع ورقة SEM برفق تحت حل GA باستخدام ملقط عن طريق تجنب أي أسطح مغطاة بالخلايا.
- متابعة مع بروتوكول قياسي ل SEM. باختصار، احتضان في tetroxide osmium تليها الجفاف مع سلسلة متدرج من الإيثانول. إدراج ورقة SEM في حامل غطاء لتجفيف نقطة حرجة وجبل على كعب الدعم لملصقات الكربون والطلاء. استخدام المجهر الإلكتروني المسح الضوئي للصورة في الجهد المتسارع من 5 كيلو فولت وعلى مسافة عمل من 7 ملم.
10. تقييم وظائف NMJ باستخدام تصوير الكالسيوم بالخلايا الحية
- إعداد الأجهزة: تحديث مقصورة myotube مع 200 ميكرولتر / بئر من اليوم 18 الخلايا العصبية الحركية المتوسطة القاعدية مع 30 نانوغرام / مل من BDNF، GDNF، وCNTF ومقصورة الخلايا العصبية الحركية مع 200 ميكروغرام / بئر من الخلايا العصبية الحركية المتوسطة القاعدية دون عوامل النمو (الجدول 2 والجدول 3).
- إضافة Fluo-4 AM صبغ المخفف في Fluo-4 صبغ المذيبات إلى مقصورة myotube بتركيز نهائي من 5 ميكرومتر واحتضان الجهاز في الظلام في 37 درجة مئوية، 5٪ CO2 لمدة 25 دقيقة. في حين أن الجهاز تحت الحضانة، تمييع كلوريد البوتاسيوم في الوسط القاعدي العصبي الحركي دون عوامل النمو بتركيز نهائي قدره 450 mM.
ملاحظة: فلو-4 AM هو مؤشر الكالسيوم، والذي يظهر زيادة في الفلورسينس عند ربط الكالسيوم. العمل في الظلام من الآن فصاعدا، كما الصبغة حساسة للضوء. - بعد 25 دقيقة، قم بتحديث مقصورة الميوتوب مع 200 ميكرولتر/بئر من اليوم 18 وسط الخلايا العصبية الحركية القاعدية مع 30 نانوغرام/مل من BDNF، GDNF، وCNTF ومقصورة الخلايا العصبية الحركية مع 100 ميكرولتر / بئر من الخلايا العصبية الحركية المتوسطة القاعدية دون عوامل النمو لإعادة تأسيس التدرج الكيميائي والحجمي.
- لمنع NMJs، تكملة المتوسطة مقصورة ميوتوب مع 19 ميكرومتر من AChR خصم تنافسية توبورارين هيدروكلوريد pentahydrate.
تنبيه: توبوكورين هيدروكلوريد بنتاهيدرات سامة: مقبض في غطاء الدخان مع معدات الحماية الشخصية.
- إضافة Fluo-4 AM صبغ المخفف في Fluo-4 صبغ المذيبات إلى مقصورة myotube بتركيز نهائي من 5 ميكرومتر واحتضان الجهاز في الظلام في 37 درجة مئوية، 5٪ CO2 لمدة 25 دقيقة. في حين أن الجهاز تحت الحضانة، تمييع كلوريد البوتاسيوم في الوسط القاعدي العصبي الحركي دون عوامل النمو بتركيز نهائي قدره 450 mM.
- إجراء التسجيلات مع المجهر الكونفوجال مقلوب مجهزة حاضنة تعديلها إلى 37 درجة مئوية، 5٪ CO2.
- مع هدف 10x ، استخدم قناة الحقل الساطع لتحديد موقع myotubes في مقصورة myotube. ضبط قوة الليزر، وكسب وإزاحة للقناة 488 إلى مستوى حيث فلو-4 مضان علامات myotubes الفردية.
ملاحظة: تم الحصول على نتائج تمثيلية عن طريق ضبط أشرطة التمرير في إعدادات A1 للبرنامج إلى قوة ليزر 5٪، وكسب 60 (HV)، وإزاحة 0.
- مع هدف 10x ، استخدم قناة الحقل الساطع لتحديد موقع myotubes في مقصورة myotube. ضبط قوة الليزر، وكسب وإزاحة للقناة 488 إلى مستوى حيث فلو-4 مضان علامات myotubes الفردية.
- تعيين وقت التسجيل إلى 1 دقيقة مع فترات 1 ق. سجل ل 5-10 ق أن يكون خط الأساس، تليها تحفيز الخلايا العصبية الحركية على الفور مع محلول كلوريد البوتاسيوم.
- بعد 5-10 ق في التسجيل، إضافة ببطء 25 ميكرولتر من محلول كلوريد البوتاسيوم إلى بئر واحد من مقصورة الخلايا العصبية الحركية للوصول إلى تركيز النهائي من 50 mM.
ملاحظة: تجنب إضافة محلول كلوريد البوتاسيوم بسرعة كبيرة لأن هذا سيخلق موجة عبر القناة ، مما يسبب قطعا أثرية على التسجيل.
- بعد 5-10 ق في التسجيل، إضافة ببطء 25 ميكرولتر من محلول كلوريد البوتاسيوم إلى بئر واحد من مقصورة الخلايا العصبية الحركية للوصول إلى تركيز النهائي من 50 mM.
- تسجيل مقصورة myotube مع التحفيز العصبي الحركي مرتين مع وقفة 2 دقيقة، تليها التحفيز المباشر مع محلول كلوريد البوتاسيوم 25 ميكرولتر من مقصورة الميوتوب لتقييم نشاط الميوتوب المباشر مستقلة عن إزالة الاستقطاب العصبي الحركي.
- بالنسبة للقياس الكمي ، قم بدائرة كل myotube يدويا باستخدام برنامج التسجيل وتحليل كثافة الفلورسنت Fluo-4 على مدى الفترة الزمنية البالغة دقيقة واحدة. لتحديد الزيادة في تدفق الكالسيوم، طرح متوسط قيمة خط الأساس (أي المتوسط من أول 10 ق قبل تحفيز كلوريد البوتاسيوم) من القيمة القصوى بعد التحفيز مع كلوريد البوتاسيوم. وقد تم الحصول على النتائج التمثيلية باستخدام أداة قياس الوقت الخاصة بالبرنامج.
النتائج
جيل من NMJs في أجهزة microfluidic
لتوليد وحدة محرك الإنسان مع NMJs وظيفية في الأجهزة microfluidic المتاحة تجاريا، استخدمت الخلايا العصبية الحركية المشتقة من iPSC الإنسان والميوتوبات المشتقة من MAB الإنسان. نوعية المواد الخلية البداية مهم، وخاصة القدرة الانصهار من MABs في myotubes أمر بالغ الأهمية لتحقيق نتيجة ناجحة لهذا البروتوكول. MABs من السهل أن تبقي في الثقافة. ومع ذلك، من المهم تقييم قدرة الاندماج لكل دفعة قبل تطبيقها على الأجهزة الدقيقة (الشكل التكميلي 1A، B)18. لا ينبغي استخدام أي دفعات ، والتي لا تظهر تشكيل myotube بعد 10 أيام من التمايز. تم تحديد مؤشر الاندماج في الشكل التكميلي 1B عن طريق حساب النسبة المئوية للنوى داخل myotubes إيجابية لكل علامة myotube من العدد الإجمالي للنوى لكل صورة. وجدنا أن مؤشر الانصهار من حوالي 8٪ كان كافيا لثقافتنا المشتركة في توليد NMJs.
من المهم دائما أن تبدأ التمايز العصبي الحركي من ثقافة نقية من iPSCs. أنقى المدخلات -- أنقى نتيجة. بروتوكول التمايز العصبي الحركي يولد ثقافات الخلايا العصبية الحركية, التي عادة ما تكون إيجابية 85٪-95٪ لعلامات الخلايا العصبية الحركية (الشكل التكميلي 1C, D)18. الخلايا المتبقية عادة ما تكون خلايا السلائف غير متمايزة، والتي في بعض الحالات سوف تخضع لانتشار واسع النطاق، وبالتالي يكون لها تأثير سلبي على نوعية الثقافة. للحصول على أفضل نتيجة لهذا البروتوكول، ينبغي تقييم كفاءة التمايز العصبي الحركي قبل تطبيق اليوم 10 الخلايا العصبية الحركية-NPCs في الجهاز. وبالإضافة إلى ذلك، يمكن إجراء فحص جودة NPC في اليوم 11 لتقييم التعبير عن علامة المجلس الوطني للصحافه Olig2 (الشكل التكميلي 1E، F).
في البداية ، كانت مطلية الخلايا العصبية الحركية - NPCs وMABs في نفس الوقت نقطة في اليوم 10. هنا، بدأ تمايز MAB في اليوم 11. سمح لنا تدرج حجم ونمو عامل التنفيذ في اليوم 14 بتقييم تشكيل NMJ في اليوم 21 ، وبالتالي تقصير البروتوكول بأسبوع واحد. ومن المثير للاهتمام، يمكننا أن نلاحظ تشكيل NMJ مميزة من قبل المحكمة الجنائية الدولية (الشكل التكميلي 2A). ومع ذلك، لم نتمكن من الحصول على إخراج وظيفي عبر تسجيلات الكالسيوم في الخلايا الحية في هذا الوقت المبكر من تمايز الخلايا العصبية الحركية (البيانات غير مبينة). وخلصنا إلى أن الخلايا العصبية الحركية لم تكن ناضجة بما فيه الكفاية لتشكيل اتصالات NMJ وظيفية مع myotubes، على الرغم من أن مورفولوجيا NMJ بدت واعدة. وهذا يتماشى مع ملاحظاتنا السابقة أن إمكانات العمل العفوي في الخلايا العصبية الحركية، المسجلة من خلال التحليل الكهربي التصحيح المشبك، تحدث فقط في اليوم 35 من تمايز الخلايا العصبية الحركية15.
بالإضافة إلى ذلك ، حاولنا إطالة نضوج الخلايا العصبية الحركية ، وكذلك استدامة الثقافة المشتركة ، من خلال نضوج الخلايا العصبية الحركية في الجهاز لمدة أسبوعين (اليوم 24) ، قبل طلاء MABs. لسوء الحظ، لوحظ كمية كبيرة من عفوية العصبية الحركية-neurite عبور من خلال microgrooves، مما أدى إلى تثبيط مرفق MAB (الشكل التكميلي 2B). ونظرا لعدم وجود تشكيل myotube في القناة ، لم ننجح في تحديد NMJs في اليوم 36 ، وبالتالي تطبيق بروتوكول لمدة 28 يوما (الشكل 1).
تحديد وتحديد كمي وتوصيف مورفولوجي للنوماج المختبرية
وبعد اتباع البروتوكول الذي يبلغ 28 يوما (الشكل 1)، يمكن الحصول على ال NMJs التي تعمل بكامل طاقتها. في كل من الجسم الحي وفي المختبر ، تتميز NMJs المناعية أو المناعية كيميائيا من خلال التوطين المشترك لعلامة presynaptic وعلامة ما بعد متشابك. في هذه الدراسة، تم استخدام مزيج من سلسلة الأعصاب الثقيلة (NEFH) وSYP كمزيج علامة presynaptic، مما سمح باتباع نيوريت واحد من سوما الخلايا العصبية الحركية نحو العملية الأكثر البعيدة. على الجانب العضلي، يستخدم على نطاق واسع Btx كعلامة ما بعد متشابك ل AChRs، وبالمثل كان يستخدم في هذه الدراسة. يعزز مكملات الأغرين واللامينين تجميع AChRs في sarcolemma19,20,21 ، مما يسهل تحديد AChRs في المختبر ويزيد أيضا من عدد AChRs وNMJs الحالي18.
من أجل تحديد موقع وحساب NMJs بطريقة غير متحيزة ، يتم تحديد كل myotube من خلال سلسلة myosin الثقيلة (MyHC) الإيجابية وصورت في مداخن z في التكبير 40x باستخدام المجهر الكونفوجال مقلوب. لفترة طويلة جدا myotubes ، تم الحصول على عدة z - مداخن. لتحليل الصور، يتم حساب عدد التوطينات المشتركة بين NEFH/SYP و Btx يدويا من خلال كل مكدس z، ويتم تطبيع عدد التوطينات المشتركة إلى عدد الميوتوب الموجود في المكدس z (الشكل 2A-C)18. ليس كل myotubes سيكون NMJs ، كما رأينا في القياس الكمي من myotubes innervated (الشكل 2D). وبالتالي ، من المهم تنفيذ نهج تسجيل غير متحيز ، حيث يتم تصوير جميع الميوتوب ، بغض النظر عن وجود Btx.
فمن الممكن تحديد نوعين من المورفولوجيا في هذا النظام في المختبر . تظهر NMJs إما كنقطة اتصال واحدة NMJs ، حيث يتطرق neurite إلى مجموعة من AChRs عند نقطة تفاعل واحدة ، أو نقطة اتصال متعددة NMJs ، حيث سيتم مروحة neurite والتفاعل مع مجموعة AChR على سطح أكبر. ويمكن تحديد هذين الشكلين من الناحية المناعية الكيميائية (الشكل 2 ألف)18 ومع نسبة 2B(18)، ويمكن أيضا قياسهما كميا (الشكل 2C)18. بشكل عام ، تسهل نقاط الاتصال المتعددة اتصالا أوسع من خلال تضمين عضلة كبيرة ، مما يشير إلى تشكيل NMJ أكثر نضجا. وعلى النقيض من ذلك، تعتبر نقطة الاتصال الوحيدة NMJs أقل نضجا بسبب الحالة التنموية المبكرة للثقافة.
التقييم الوظيفي للNMJs المختبر
لتقييم وظائف NMJs، استخدمت تسجيلات عابرة للكالسيوم بالخلايا الحية (الشكل 3)18. الاستفادة من نظام معزولة سائلا من الأجهزة microfluidic، تم تحفيز الجانب سوما الخلايا العصبية الحركية مع تركيز عال (50 mM) من كلوريد البوتاسيوم في حين تسجيل في وقت واحد تدفق الكالسيوم في الميوتوب، والتي تم تحميلها مع صبغ فلو-4 الحساسة للكالسيوم (الشكل 3A). على الفور تقريبا على تنشيط الخلايا العصبية الحركية، يمكننا مراقبة تدفق الكالسيوم في myotubes من خلال تشكيل موجة مميزة، مما يؤكد وجود اتصال وظيفي من خلال الخلايا العصبية الحركية-neurite وميوتوب (الشكل 3A-C)18. لم تلاحظ موجات الكالسيوم العفوية ولا تقلصات الميوتوب العفوية ، على الرغم من ملاحظة انكماش الميوتوب عند التحفيز المباشر مع كلوريد البوتاسيوم. كما تأكدت خصوصية الاتصال بإضافة خصم AChR التنافسي، وهو ثنائي كلوريد هيدروكلوريد التوكورات (DTC) إلى مقصورة الميوتوب (الشكل 3A)، مما أدى إلى تثبيط تدفق الكالسيوم (الشكل 3C). وأكد هذا التأثير أن العلاقة بين الخلايا العصبية الحركية وميوتوبس أدى إلى NMJs وظيفية بالكامل. لتقييم عدد الميوتوبات النشطة من خلال تحفيز NMJ ، تم تحفيز مقصورة الميوتوب مباشرة مع كلوريد البوتاسيوم لتحديد العدد الإجمالي للأنابيب النشطة في هذه المقصورة. وكان ما يقرب من 70٪ من myotubes نشطة من خلال تنشيط الخلايا العصبية الحركية مع كلوريد البوتاسيوم (الشكل 3D)18.
تؤكد هذه النتائج تشكيل NMJ الأمثل ، والعدد ، والمورفولوجيا ، والوظائف من خلال الاستزراع المشترك للخلايا العصبية الحركية المشتقة من iPSC وميوتوبات مشتقة من MAB خلال بروتوكول لمدة 28 يوما.
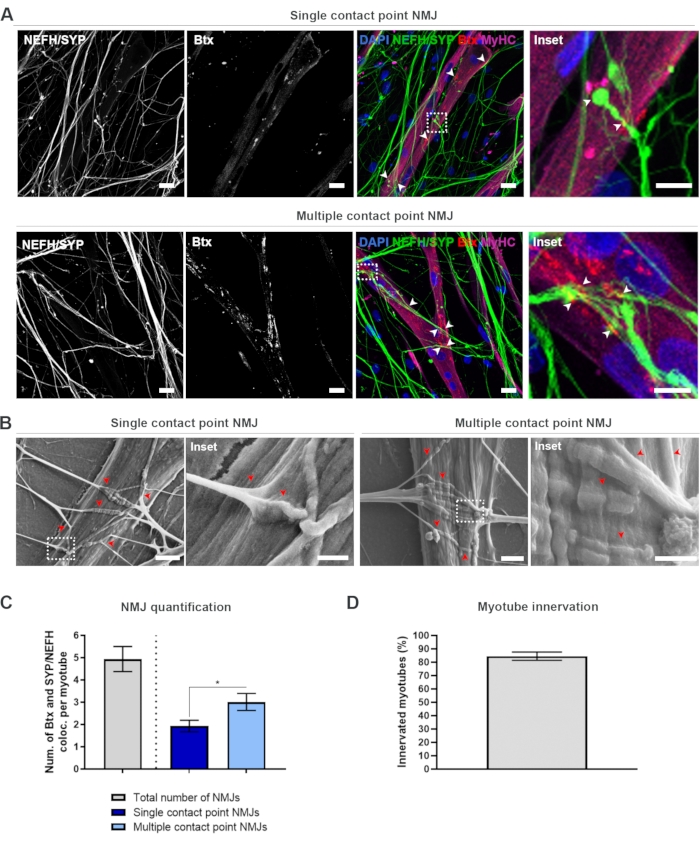
الشكل 2: تشكيل NMJ في الأجهزة microfluidic. (أ) ميكروجرافات Confocal لتشكيل NMJ في أجهزة microfluidic تجميعها مسبقا في اليوم 28. يتم تحديد NMJs من خلال التوطين المشترك (رؤوس الأسهم) للعلامات presynaptic (NEFH و SYP) وعلامة AChR postynaptic (Btx) على myotubes الملطخة ب MyHC. يتم تحديد NMJs بشكل مورفولوجي من خلال تشكيل نقطة اتصال واحدة أو متعددة بين مجموعات neurites و AChR. DAPI التسمية نواة. شريط المقياس، 25 ميكرومتر. Inset يظهر تكبير NMJ. شريط مقياس Inset، 10 ميكرومتر (B) SEM من مورفولوجيا NMJ في أجهزة السيليكون microfluidic في اليوم 28. Arrowheads تصور تضمين neurite في myotube. شريط المقياس، 2 ميكرومتر. Inset يظهر تكبير NMJ. شريط مقياس Inset، 1 ميكرومتر (C) القياس الكمي للعدد الإجمالي من NMJs لكل myotube، فضلا عن عدد من NMJs نقطة اتصال واحدة ومتعددة لكل myotube. يظهر الرسم البياني على أنه متوسط ± خطأ قياسي في المتوسط من أربع نسخ بيولوجية متماثلة. يتم تحديد الأهمية الإحصائية مع اختبار مان ويتني مع * ص < 0.05. (د) تحديد كمية النسبة المئوية للميوتوبات الداخلية. يظهر الرسم البياني على أنه متوسط ± خطأ قياسي في المتوسط من أربع نسخ بيولوجية متماثلة. وقد تم تعديل هذا الرقم من ستوكلوند ديتلاو، ك. وآخرون.18. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
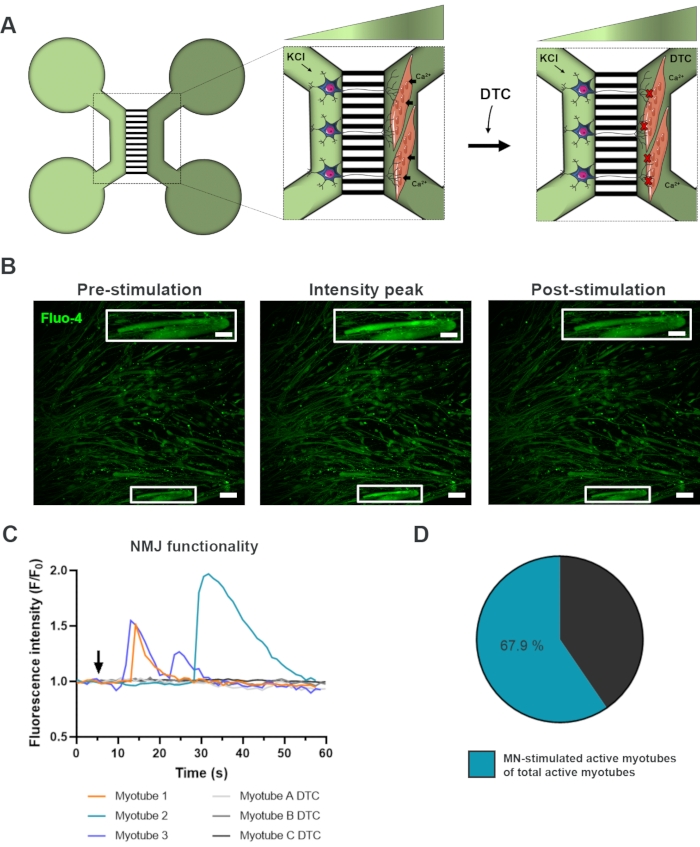
الشكل 3: تأكيد وظيفة NMJ. (أ) رسم تخطيطي لتسجيلات الكالسيوم العابرة للخلايا الحية لوظيفة NMJ في أجهزة ميكروفلويديك التي تم تجميعها مسبقا في اليوم 28 قبل وبعد انسداد NMJ مع التوبوكورارين (DTC)22. يتم تحفيز الخلايا العصبية الحركية في المقصورة الخضراء الخفيفة مع كلوريد البوتاسيوم 50 mM (KCl)، والذي يسبب استجابة الخلايا العصبية الحركية داخل الخلايا من خلال neurites. وهذا يثير تدفق الكالسيوم (Ca2+) في الميوتوب، والتي تسمى بصبغة فلو-4 الحساسة للكالسيوم (المقصورة الخضراء الداكنة). (ب) فلو-4 مضان micrographs من التحفيز المسبق, ذروة كثافة وبعد التحفيز من الميوتوب يصور موجة من زيادة الكالسيوم داخل الخلايا على تحفيز الخلايا العصبية الحركية مع KCl. Inset يظهر تكبير myotube نشطة innervated. أشرطة المقياس، 100 ميكرومتر. Inset مقياس شريط، 200 ميكرومتر(C) ممثل منحنيات تدفق الكالسيوم في myotubes بعد تحفيز الخلايا العصبية الحركية مع KCl (السهم) تأكيد وظائف NMJ. Myotube 1-3 تظهر منحنيات الكالسيوم المميزة من خلال الخلايا العصبية الحركية- myotube الداخلية، في حين يصور myotube A-C DTC منحنيات بعد حجب NMJ مع DTC. (د) نسبة الخلايا العصبية الحركية حفز myotubes النشطة على العدد الإجمالي للميوتوب النشطة. وقد تم تعديل هذا الرقم من ستوكلوند ديتلاو، ك. وآخرون.18. تم تعديل الرسوم التوضيحية للخلايا من Smart Server الطبي Art22. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: التحقق من الخلايا العصبية الحركية، مؤشر الاندماج MAB، ومراقبة الجودة NPC. (أ) صور Confocal من myotubes MAB المستمدة بعد 10 أيام من بدء التمايز. وصفت Myotubes مع علامات myotube: desmin، MyHC، myogenin (MyoG) وtiin. النوى ملطخة بال DAPI. شريط المقياس، 100 ميكرومتر (ب) القياس الكمي لمؤشر الاندماج MAB بعد 10 أيام من بدء التمايز. عند المجاعة ، تندمج MABs في الأنابيب المتعددة النوى ، والتي تم قياسها كميا لإيجابية علامة myotube (AB+). يصور الرسم البياني متوسط ± خطأ قياسي للوسط من ثلاث نسخ بيولوجية متماثلة. (ج) صور Confocal من الخلايا العصبية الحركية المشتقة من iPSC في اليوم 28 من التمايز، والتي وصفت مع علامات الخلايا العصبية الحركية NEFH، أسيتيل ترانسفيراز الكولين (ChAT) و Islet-1 بالإضافة إلى علامة عموم الخلايا العصبية βIII-tubulin (توبولين). النوى ملطخة بال DAPI. أشرطة المقياس، 75 ميكرومتر (D) تحديد كمي لعدد الخلايا، والتي هي إيجابية للخلايا العصبية الحركية وعلامات عموم الخلايا العصبية (AB+). يصور الرسم البياني متوسط ± خطأ قياسي للوسط من ثلاث نسخ بيولوجية متماثلة. (ه) صور Confocal من الشخصيات المشتقة من iPSC في اليوم 11 من التمايز العصبي الحركي، والتي وصفت مع علامة المجلس الوطني للصحافه Olig2 وعلامة عموم الخلايا العصبية βIII-tubulin (توبولين). النوى ملطخة بال DAPI. أشرطة المقياس، 50 ميكرومتر (F) القياس الكمي لعدد من الشخصيات، والتي هي إيجابية لOlig2 و βIII-tubulin (AB+). يصور الرسم البياني متوسط ± خطأ قياسي للوسط من ثلاث نسخ بيولوجية متماثلة. وقد تم تعديل هذا الرقم من ستوكلوند ديتلاو، ك. وآخرون.18. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 2: تحسين بروتوكول الثقافة المشتركة (A) صور Confocal لتشكيل NMJ في اليوم 21 من تمايز الخلايا العصبية الحركية ، عندما يتم بذر MABs في نفس النقطة الزمنية مثل NPCs في اليوم 10. يتم تحديد NMJs من خلال التوطين المشترك (رؤوس الأسهم) للعلامات presynaptic (NEFH و SYP) وعلامة AChR postynaptic (Btx) على myotubes الملطخة ب MyHC. شريط المقياس (يسار)، 10 ميكرومتر. شريط المقياس (يمين)، 5 ميكرومتر (ب) صورة ذات مجال مشرق لقناة myotube في اليوم 24 تصور عفوية الخلايا العصبية الحركية- neurite عبور تثبيط مرفق MABs. شريط المقياس، 100 ميكرومتر. الرجاء الضغط هنا لتحميل هذا الملف.
| الكاشف | تركيز المخزون | التركيز النهائي |
| IMDM | 1x | 80% |
| مصل الأبقار الجنينية | 15% | |
| البنسلين/ستريبتومايسين | 5000 U/mL | 0.5% |
| إل-الجلوتامين | 50x | 1% |
| بيروفات الصوديوم | 100 مليون متر | 1% |
| الأحماض الأمينية غير الأساسية | 100x | 1% |
| الأنسولين نقل السيلينيوم | 100x | 1% |
| bFGF (أضيف طازج) | 50 ميكروغرام/مل | 5 نانوغرام/مل |
الجدول 1: متوسط نمو البنك العربي المتحد. متوسطة يمكن أن تستمر 2 أسابيع في 4 °C. يتم إضافة bFGF جديدة في يوم الاستخدام.
| الكاشف | تركيز المخزون | التركيز النهائي |
| DMEM/F12 | 50% | |
| وسيطة عصبية | 50% | |
| البنسلين/ستريبتومايسين | 5000 U/mL | 1% |
| إل-الجلوتامين | 50x | 0.5 % |
| N-2 الملحق | 100x | 1% |
| B-27 بدون فيتامين أ | 50x | 2% |
| β ميركابتوثانول | 50 مليون متر | 0.1% |
| حمض الأسكوربيك | 200 ميكرومتر | 0.5 ميكرومتر |
الجدول 2: الوسط القاعدي للخلايا العصبية الحركية. متوسطة يمكن أن تستمر 4 أسابيع عند 4 °C.
| يوم | الكاشف | تركيز المخزون | التركيز النهائي | غرفة |
| اليوم العاشر/الحادي عشر | ناهض ممهد | 10 مليون متر | 500 مليون متر | كلا |
| حمض الريتينويك | 1 مليون متر | 0.1 ميكرومتر | ||
| DAPT | 100 مليون متر | 10 ميكرومتر | ||
| BDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| GDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| اليوم الرابع عشر | DAPT | 100 مليون متر | 20 ميكرومتر | كلا |
| BDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| GDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| اليوم السادس عشر | DAPT | 100 مليون متر | 20 ميكرومتر | كلا |
| BDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| GDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| CNTF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| اليوم الثامن عشر | BDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | الخلايا العصبية الحركية |
| GDNF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| CNTF | 0.1 ملغم/مل | 10 نانوغرام/مل | ||
| اليوم الحادي والعشرون+ | BDNF | 0.1 ملغم/مل | 30 نانوغرام/مل | ميوتوب |
| GDNF | 0.1 ملغم/مل | 30 نانوغرام/مل | ||
| CNTF | 0.1 ملغم/مل | 30 نانوغرام/مل | ||
| أغرين | 50 ميكروغرام/مل | 0,01 ميكروغرام/مل | ||
| لامينين | 1 ملغم/مل | 20 ميكروغرام/مل | ||
| اليوم الحادي والعشرون+ | لا ملاحق | الخلايا العصبية الحركية |
الجدول 3: المكملات الغذائية المتوسطة العصبية الحركية. تضاف المكملات الغذائية الطازجة في يوم الاستخدام إلى الوسط القاعدي العصبي الحركي.
| يوم | الكاشف | تركيز المخزون | التركيز النهائي | غرفة |
| اليوم الثامن عشر | DMEM/F12 | 97% | ماب | |
| بيروفات الصوديوم | 100 مليون متر | 1% | ||
| مصل الحصان | 2% | |||
| أغرين | 50 ميكروغرام/مل | 0.01 ميكروغرام/مل |
الجدول 4: متوسط التمايز MAB. متوسطة يمكن أن تستمر 2 أسابيع عند 4 °C. يتم إضافة Agrin طازجة في يوم الاستخدام.
Discussion
يصف البروتوكول طريقة سهلة الاستخدام نسبيا ، والتي تولد وحدات حركية بشرية مع NMJs وظيفية في أجهزة microfluidic المتاحة تجاريا في أقل من 30 يوما. ويوصف كيف يمكن تقييم NMJs مورفولوجيا من خلال التقنيات القياسية مثل المحكمة الجنائية الدولية وSEM ووظيفيا من خلال تسجيلات الكالسيوم الخلايا الحية.
ميزة كبيرة لهذا البروتوكول هو استخدام تكنولوجيا الخلايا الجذعية. وهذا يسمح بالقدرة الكاملة على التكيف حيث يمكن تقييم NMJs في كل من الصحة والمرض، بغض النظر عن ملف المانحين. وقد أثبت النموذج نجاحه ومفيده بالفعل في أبحاث ALS ، حيث حددنا العاهات في نمو النيوريت ، وإعادة النمو ، وأرقام NMJ كأنماط ظاهرة جديدة بسبب الطفرات في جين FUS18. مع هذا النموذج، فمن الممكن لتوسيع نطاق البحث لتشمل أشكال متفرقة من ALS، حيث المسببات غير معروف، وذلك باستخدام iPSCs من المرضى ALS متفرقة. وهذا يوفر ميزة على النماذج الحيوانية التقليدية، التي تعتمد على التعبير المفرط المعدل وراثيا من الجينات المتحولة لتلخيص الأمراض البشرية23،24. وبالإضافة إلى ذلك، يسمح نظامنا البشري الكامل بتلخيص محتمل لعلم وظائف الأعضاء والأمراض الخاصة بالإنسان. أظهرت الدراسات السابقة الاختلافات بين القوارض ومورفولوجيا NMJ البشرية25 ، مما يشير إلى أنه يجب تنفيذ الحذر عند استخدام القوارض لمعالجة أمراض NMJ البشرية. على الرغم من أن هذا النظام هو إعداد بسيط نسبيا في المختبر ، والذي يفتقر إلى تعقيد نموذج في الجسم الحي ، كان من الممكن إثبات أن مورفولوجيا NMJ المعروضة في الأجهزة الدقيقة تشبه NMJs من بتر الإنسان25. وعلاوة على ذلك، يسمح هذا النموذج لتقييم NMJ أثناء تشكيل NMJ والنضج، مما قد يكشف عن الأنماط الظاهرية للأمراض المبكرة، والتي هي غائبة، غير معروفة، أو تجاهلها في عينات ما بعد الوفاة البشرية.
MABs توفير خيار صالح لتوليد myotubes، على الرغم من بقاءها محدودة من 10 أيام هو عيب للنظام. يعتمد بقاء الميوتوب على تعلقهم بالسطح ، والذي من المرجح أن يتعرض للخطر بسبب الانقباضات التلقائية للألياف العضلية. بعد أكثر من 10 أيام ، سيكون معظم myotubes منفصلة ، مما يجعل ثقافة NMJ غير صالحة للاستخدام. من الناحية المثالية ، سيتم إنشاء myotubes من iPSCs أيضا. ومع ذلك، ثبت أن البروتوكولات الحالية يصعب إعادة إنتاج26 بسبب التباين في مؤشر الانصهار27,28,29,30.
باستخدام الأجهزة الدقيقة المتاحة تجاريا، قمنا بإنشاء نظام موحد، والذي يمكن الوصول إليه بالكامل. وتوجد نماذج أخرى من طرازات NMJ31,32,33,34,35,36,37,38,39,40,41,42. ومع ذلك، فإنها تعتمد عادة على مقصورات واحدة، والتي تفتقر إلى التقسيم والعزلة السائلة بين أنواع الخلايا، أو على الأوعية الثقافية المصنوعة خصيصا، مما يقلل من توافر وربما أيضا استنساخ. يمكن شراء الأجهزة الدقيقة المستخدمة لهذا البروتوكول مع microgrooves من أطوال مختلفة ، مما يسمح لمزيد من التحليل مثل transport4344 أو axotomy184546 التحقيقات. العزلة السائلة بين المقصورات تمكن كذلك من العلاج الدوائي المجزأ إما للخلايا العصبية الحركية أو الميوتوب ، والتي يمكن أن تكون مواتية في تطوير العلاج. وقد ظهر المزيد من الشركات المتخصصة في microfluidics ، والتي فتحت لمزيد من مجموعة كبيرة من تصميم الأجهزة والميزات ، مما يزيد من تعزيز إمكانية الوصول للبحوث المختبرية.
في الختام، قمنا بتطوير بروتوكول توفير طريقة موثوقة، تنوعا وسهلة لثقافة وحدات السيارات البشرية مع NMJs وظيفية.
Disclosures
L.V.D.B لديه براءة اختراع على استخدام مثبطات HDAC في مرض شاركوت ماري توث (الولايات المتحدة-2013227717-A1)، هو المؤسس المشارك العلمي لشركة أوغسطين للعلاجات، وعضو في مجلسها الاستشاري العلمي. ولا يعلن المؤلفون الآخرون عن أي مصالح متنافسة.
Acknowledgements
يشكر المؤلفان كورتوت وسيباستيان مونك من LiMoNe، مجموعة الأبحاث البيولوجيا العصبية الجزيئية (VIB-KU Leuven) على نصائحهما بشأن تسجيلات الفلورية العابرة للكالسيوم الحية. وقد دعم هذا البحث كل من لجنة فولبرايت في بلجيكا ولكسمبرغ، وكو لوفين (C1 وصندوق "فتح المستقبل")، وهيئة الأبحاث VIB، ووكالة الابتكار بالعلم والتكنولوجيا( IWT؛ ومنظمة الاستشارات العلمية والتقنية؛ ومنظمة الاستشارات العلمية والتقنية؛ ومنظمة التعاون التقني في مجال التكنولوجيا والابتكار؛ ومنظمة التعاون التقني؛ ومنظمة التعاون والتنمية في مجال التكنولوجيا والابتكار؛ ومنظمة التعاون والتنمية في مجال التكنولوجيا والابتكار؛ ومنظمة التعاون والتنمية في مجال التكنولوجيا SBO-iPSCAF)، "صندوق فلاندرز البحث العلمي" (FWO-فلاندرين)، الهدف ALS، ALS Liga België (علاج ل ALS)، الحكومة البلجيكية (برنامج أعمدة الجذب بين الجامعات P7/16 الذي بدأه مكتب السياسة العلمية الاتحادي البلجيكي)، ومؤسسة تييري لاتران و"جمعية بيلجي كونتري ليه مالادس العصبية-موسكولايير" (ABMM). T.V. و J.B. يتم دعمها من قبل زمالات الدكتوراه التي تمنحها FWO-فلاندرين.
Materials
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
References
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved