Method Article
Generación de Unidades Motoras Humanas con Uniones Neuromusculares Funcionales en Dispositivos Microfluídicos
En este artículo
Resumen
Describimos un método para generar unidades motoras humanas en dispositivos microfluídicos disponibles comercialmente mediante el cocultivo de neuronas motoras derivadas de células madre pluripotentes inducidas por humanos con miotubos derivados de mesoangioblastos primarios humanos, lo que resulta en la formación de uniones neuromusculares funcionalmente activas.
Resumen
Las uniones neuromusculares (NMJ) son sinapsis especializadas entre el axón de la neurona motora inferior y el músculo que facilita el compromiso de la contracción muscular. En los trastornos de las neuronas motoras, como la esclerosis lateral amiotrófica (ELA) y la atrofia muscular espinal (AME), los NMJ se degeneran, lo que resulta en atrofia muscular y parálisis progresiva. El mecanismo subyacente de la degeneración de NMJ es desconocido, en gran parte debido a la falta de modelos de investigación traducibles. Este estudio tuvo como objetivo crear un modelo in vitro versátil y reproducible de una unidad motora humana con NMJ funcionales. Por lo tanto, las neuronas motoras derivadas de células madre pluripotentes inducidas por humanos (hiPSC) y los miotubos derivados de mesoangioblastos primarios (MAB) humanos se cocultivaron en dispositivos microfluídicos disponibles comercialmente. El uso de microcompartimentos aislados fluidamente permite el mantenimiento de microambientes específicos de la célula, al tiempo que permite el contacto de célula a célula a través de microgrooves. Mediante la aplicación de un gradiente quimiotáctico y volumétrico, se estimuló el crecimiento de neuronas motoras-neuritas a través de los microgrooves promoviendo la interacción miotubo y la formación de NMJ. Estos NMJ se identificaron inmunocitoquímicamente a través de la co-localización del marcador presináptico de la neurona motora sinaptofisina (SYP) y el marcador del receptor postsináptico de acetilcolina (AChR) α-bungarotoxina (Btx) en los miotubos y se caracterizaron morfológicamente mediante microscopía electrónica de barrido (SEM). La funcionalidad de los NMJ se confirmó midiendo las respuestas de calcio en los miotubos tras la despolarización de las neuronas motoras. La unidad motora generada utilizando dispositivos microfluídicos estándar y tecnología de células madre puede ayudar a futuras investigaciones centradas en los NMJ en la salud y la enfermedad.
Introducción
Los NMJ facilitan la comunicación entre las neuronas motoras espinales inferiores y las fibras musculares esqueléticas a través de la liberación de neurotransmisores1. En los trastornos de las neuronas motoras como la ELA y la AME, los NMJ se degeneran, lo que provoca una interrupción en la comunicación con los músculos2,3,4,5,6,7. Esto hace que los pacientes pierdan gradualmente su función muscular, lo que hace que estén en silla de ruedas y, finalmente, dependan del soporte vital respiratorio debido a la atrofia progresiva de grupos musculares vitales como el diafragma. Se desconocen los mecanismos subyacentes exactos responsables de esta profunda pérdida de NMJ en estos trastornos. Se han realizado muchos estudios en modelos animales transgénicos, lo que nos ha dado algunas ideas sobre la patogénesis de la degeneración nmJ5,6,8,9,10,11. Sin embargo, para comprender completamente la patología y contrarrestar la denervación, es importante contar con un sistema humano, que permita la plena accesibilidad.
Aquí, el protocolo describe una forma relativamente simple de generar NMJ humanos a través del co-cultivo de neuronas motoras derivadas de hiPSC y miotubos primarios humanos derivados de MAB utilizando dispositivos microfluídicos disponibles comercialmente. El uso de microfluídica para polarizar y aislar fluidamente los somas y axones de las neuronas se conoce desde la primera descripción de las cámaras 'Campenot'12 a finales de la década de 1970. Desde entonces, se han fabricado más diseños microfluídicos, incluidas las opciones comerciales. Los dispositivos utilizados en este protocolo contienen dos compartimentos, y cada compartimento consta de dos pozos conectados con un canal13. Los dos compartimentos están reflejados y conectados con varios microgrooves. Estos microgrooves tienen un tamaño que facilita el crecimiento de neuritas manteniendo el aislamiento fluídico entre los dos compartimentos a través de una presión hidrostática capilar13,14. Usando este sistema, es posible cultivar neuronas motoras en un compartimento y células musculares en el otro, cada una en su medio de cultivo específico, al tiempo que facilita una conexión física a través de neuritas que pasan a través de los microgrooves y se involucran con las células musculares. Este modelo proporciona un sistema in vitro totalmente accesible y adaptable de una unidad motora humana, que se puede utilizar para estudiar la patología temprana de NMJ en enfermedades como la ELA y la AME.
Protocolo
Se obtuvo el consentimiento informado por escrito de todos los sujetos, quienes proporcionaron sus muestras para la generación de iPSC y la cosecha de MAB. El procedimiento fue aprobado por el comité de ética médica del Hospital Universitario de Lovaina (n° S5732-ML11268) y por el principal comité de ética de investigación del Reino Unido como parte del proyecto StemBANCC. Todos los reactivos y equipos utilizados en este protocolo se enumeran en la Tabla de Materiales y deben usarse estériles. Los medios deben calentarse a temperatura ambiente (RT) antes de su uso, a menos que se especifique lo contrario. Para obtener información general sobre el protocolo de cocultura, consulte la Figura 1.
1. Diferenciación de los progenitores de neuronas motoras de las iPSC
- Seguir el protocolo de diferenciación de neurona motora15, adaptado de un estudio previo16, hasta alcanzar el estado de progenitor neural (NPCs) del día 10. De acuerdo con el marco de tiempo del protocolo, la diferenciación se inicia un lunes (día 0), lo que resulta en NPC del día 10 un jueves.
- Criopreservar NPCs día 10 en reemplazo sérico knock-out con 10% de dimetilsulfóxido (DMSO) a una densidad de 2 x 106- 4 x 106 células por vial.
PRECAUCIÓN: El DMSO es tóxico: manipule en una campana extractora con equipo de protección personal.
NOTA: Se espera que aproximadamente el 50% del día 10 NPC sean vitales al descongelarse. Detener el protocolo de diferenciación de neuronas motoras en este estado de NPC del 'día 10' y criopreservar a los NPC para generar un gran número de NPC, que pueden ser almacenados y utilizados más tarde, reduciendo la duración de la línea de tiempo general del protocolo de co-cultivo de 28 días a 19 días en total.
2. Derivación y mantenimiento de MAB humanos
NOTA: Los MAB son células madre mesenquimales asociadas a vasos, que en este caso se han extraído de biopsias obtenidas de un donante sano de 58 años. Se dispone de fuentes comerciales alternativas. Se explica brevemente el protocolo para obtener MAB. Para más información, consulte el protocolo detallado17. Todos los medios MAB deben calentarse a 37 °C antes de su uso.
- Picar el tejido de la biopsia e incubar en colágeno (de piel de ternera) recubierto de platos de 6 cm en un medio de crecimiento (Tabla 1) durante 2 semanas. Cambie el medio cada 4 días.
- Para preparar el recubrimiento de colágeno, disuelva 100 mg de colágeno en 20 ml de ácido acético de 0,1 m. El colágeno tarda en disolverse, así que coloque la mezcla en una plataforma de balanceo durante la noche en RT. Al día siguiente, recarga con 80 mL de ddH2O a un volumen final de 100 mL.
PRECAUCIÓN: El ácido acético es tóxico; mango en una campana extractora con equipo de protección personal.
NOTA: El colágeno del recubrimiento de piel de becerro se puede reutilizar hasta 5 veces. Conservar a 4 °C. - Cubra toda la superficie del plato o el matraz con colágeno, cierre e incube durante 20 min a RT dentro de un flujo laminar. Después de 20 min, recupere el colágeno en un recipiente fresco, cierre el plato / matraz vacío y deje durante 10 min en RT en el flujo laminar.
- Transfiera el plato/matraz a la incubadora para la incubación durante la noche (o al menos 6 h) (37 °C, 5% de CO2). Lavar 5x con solución salina tamponada con fosfato de Dulbecco sin calcio ni magnesio (DPBS) antes de enchapar las células.
- Para preparar el recubrimiento de colágeno, disuelva 100 mg de colágeno en 20 ml de ácido acético de 0,1 m. El colágeno tarda en disolverse, así que coloque la mezcla en una plataforma de balanceo durante la noche en RT. Al día siguiente, recarga con 80 mL de ddH2O a un volumen final de 100 mL.
- Después de 14 días, FACS (fluorescente activated cell sorting) clasifica los MAB para la fosfatasa alcalina humana17 seguido de una mayor expansión. Mantenga los MAB en matraces T75 recubiertos de colágeno en el medio de crecimiento y cambie el medio de crecimiento cada 2 días (10 ml por matraz).
- Criopreservar, pasar o sembrar MABs en dispositivos cuando alcancen el 70% de confluencia.
NOTA: Los MAB pierden su potencial miogénico debido a fusiones espontáneas en contacto de célula a célula. Asegúrese de no exceder el 70% de confluencia al expandir los MAB. Un matraz T75 confluente al 70% contiene aproximadamente 600.000-800.000 células, que se pueden criopreservar a 100.000 células por vial. Cada vial se puede descongelar y sembrar posteriormente en un matraz T75 para su expansión. - Para pasar los MAB, lávelos suavemente una vez con 7 ml de DPBS y luego incube en 7 ml de solución de disociación MAB durante 3 minutos a 37 ° C en CO2 al 5% para disociar las células.
- Neutralice la solución de disociación MAB con 7 ml del medio de crecimiento, raspe suavemente las células y transfiera la suspensión celular a un tubo centrífugo de 50 ml. Lave suavemente el matraz con 5 ml adicionales del medio de crecimiento para recolectar los MAB potencialmente restantes.
- Centrifugar la suspensión celular durante 3 min a 300 x g, luego pasar directamente a un nuevo matraz T75 recubierto de colágeno para la expansión, criopreservar en reemplazo de suero knock-out con DMSO al 10% o contar para sembrar en un dispositivo microfluídico.
NOTA: Los pasajes se realizan 1x-2x por semana para la expansión celular hasta un número máximo de pasaje de 13. Tras la disociación, los MAB aparecen esféricos y de forma grande cuando se examinan bajo el microscopio.
3. Preparación de dispositivos microfluídicos premontados - Día 9
NOTA: El protocolo está adaptado del protocolo de dispositivos neuronales del fabricante de dispositivos microfluídicos y se ha ajustado para el uso de dispositivos preensamblados y de silicona. Aquí, los dispositivos preensamblados se utilizan para la inmunocitoquímica (ICC) y los registros transitorios de calcio de células vivas, mientras que los dispositivos de silicona se utilizan para SEM. La línea de tiempo del protocolo sigue la línea de tiempo para el protocolo de diferenciación de neuronas motoras.
- Prepare los dispositivos microfluídicos el día antes de sembrar las células, ya que el recubrimiento debe incubarse durante la noche. Según el protocolo de la motoneurona, esto será un miércoles. Agregue ~ 10 ml de etanol al 70% -100% a una placa de Petri de 10 cm. Use fórceps para transferir el dispositivo del contenedor de envío a la placa de Petri para su esterilización.
- Sumerja el dispositivo en etanol durante 10 s y transfiera el dispositivo con fórceps a un pedazo de papel para que se seque al aire en el flujo laminar durante ~ 30 min. Voltee el dispositivo varias veces para permitir que ambos lados se sequen. Cuando el dispositivo esté seco, use fórceps para mover cada dispositivo a una placa de Petri individual de 10 cm para facilitar su manejo.
PRECAUCIÓN: El etanol es tóxico; mango en una campana extractora con equipo de protección personal - Cubra el dispositivo con Poli-L-ornitina (PLO) (100 μg/mL) en DPBS e incube a 37 °C, 5% de CO2 durante 3 h.
- Use una pipeta P200 para agregar 100 μL de OLP en DPBS en un pozo superior lo más cerca posible de la abertura del canal y observe el fluido que pasa del pozo superior a través del canal al pozo inferior. Posteriormente, agregue 100 μL de OLP en DPBS al pozo inferior.
- Repita en el otro lado de los microgrooves y termine agregando 100 μL en un lado del dispositivo para crear un gradiente de volumen entre los dos lados espejados del dispositivo para recubrir los microgrooves (por ejemplo, lado derecho 200 μL, lado izquierdo 300 μL). Después de 3 h, lave el dispositivo 3 veces durante 5 minutos con DPBS. Utilice un sistema de succión si es necesario.
NOTA: Asegúrese de evitar cualquier formación de burbujas de aire en los canales en cualquier punto durante el recubrimiento o cultivo de las células. Incluso las burbujas pequeñas se expandirán en poco tiempo, inhibiendo así el recubrimiento, la siembra celular o el flujo de medios a través del canal. Si el fluido se detiene en el canal durante el recubrimiento, vuelva a suspender la solución PLO directamente en el canal desde ambos lados. Si las burbujas todavía están presentes, use 200 μL de DPBS para enjuagar el canal y repita el proceso de recubrimiento como se indicó anteriormente en los pasos 3.3.1-3.3.2. Si aparecen burbujas después de la siembra celular, es imposible recuperar el dispositivo, ya que enjuagar el canal dañará las células.
- Cubra el dispositivo con laminina (20 μg/ml) en un medio neurobasal e incube durante la noche a 37 °C, 5% de CO2. Siga las mismas instrucciones para el recubrimiento PLO de los pasos 3.3.1-3.3.2.
- Al día siguiente, use una pipeta P200 y coloque la punta en el pozo opuesto a la abertura del canal para eliminar el recubrimiento de laminina de los pozos. Agregue DPBS a todos los pozos y deje los dispositivos con DPBS en el flujo laminar en RT para la siembra celular.
NOTA: A partir de este momento, es importante no eliminar el líquido (recubrimiento de laminina, DPBS, medios, solución de fijación, etc.) directamente de los canales, ya que esto podría causar la formación de burbujas de aire. Siempre inspeccione los dispositivos bajo el microscopio antes de sembrar células.
4. Preparación de dispositivos microfluídicos de silicona - Día 9
- Prepare los dispositivos microfluídicos de silicona el día antes de sembrar las células, ya que el recubrimiento debe incubarse durante la noche. Según el protocolo de la motoneurona, esto será un miércoles.
- Agregue ~ 10 ml de etanol al 70% -100% a una placa de Petri de 10 cm. Use un fórceps para transferir el dispositivo del contenedor de envío a la placa de Petri para la esterilización. Sumerja el dispositivo en etanol durante 10 s y transfiéralo con fórceps a un pozo en una placa de 6 pocillos para secar al aire en el flujo laminar durante ~ 30 min. Coloque el dispositivo de lado para permitir que todos los lados se sequen.
- Reduzca las hojas SEM al tamaño del dispositivo (deje unos pocos mm en cada lado). Repita la esterilización como se indicó anteriormente en el paso 4.1.1. Luego, transfiera con fórceps a una placa de Petri de 10 cm para que se seque. Dos o tres hojas SEM cabrán en un plato.
- Cubra los dispositivos y las láminas SEM con PLO (100 μg/mL) en DPBS e incube a 37 °C, 5% co2 durante 3 h.
- Agregue 1 ml de OLP en DPBS por pozo a cada dispositivo en la placa de 6 pocillos. Asegúrese de que el dispositivo esté flotando sobre la solución PLO con el canal y el lado de la micromuera mirando hacia abajo en el líquido. Agregue 10 ml de PLO en DPBS por cada placa de Petri de 10 cm y use fórceps para empujar hacia abajo las láminas sem hacia el líquido.
NOTA: Las láminas SEM generalmente flotarán sobre la parte superior de la solución de recubrimiento. Antes de ensamblar el dispositivo y la hoja, gire la hoja SEM para que la superficie, que ha estado en contacto con la OLP, entre en contacto con el canal y la superficie de micromuesco del dispositivo. - Después de 3 h, lave el dispositivo y las hojas SEM 2x durante 5 min con DPBS seguido de otro lavado durante 5 min con agua estéril. Use un sistema de succión si es necesario. Transfiera cada hoja SEM a una placa de Petri individual de 10 cm para facilitar su manejo.
NOTA: Tanto los dispositivos como las láminas SEM deben estar completamente secos antes del montaje. El lavado final con agua estéril elimina los cristales de sal potenciales del DPBS, que de otro modo podrían inhibir el ensamblaje.
- Agregue 1 ml de OLP en DPBS por pozo a cada dispositivo en la placa de 6 pocillos. Asegúrese de que el dispositivo esté flotando sobre la solución PLO con el canal y el lado de la micromuera mirando hacia abajo en el líquido. Agregue 10 ml de PLO en DPBS por cada placa de Petri de 10 cm y use fórceps para empujar hacia abajo las láminas sem hacia el líquido.
- Trabajar bajo un microscopio en un flujo laminar. Use fórceps para montar el dispositivo de silicona con el canal y la microranura hacia abajo en un ángulo de 90 ° sobre la lámina SEM, asegurando que todos los lados estén alineados. Presione ligeramente hacia abajo sobre el dispositivo para asegurarse de sellar no solo los bordes exteriores, sino también alrededor de pozos, canales y microgrooves.
NOTA: Las áreas adheridas aparecerán grises, mientras que las que aún no están montadas aparecerán claras bajo el microscopio. Asegúrese de que todas las áreas estén bien selladas sin burbujas de aire para evitar el desprendimiento del dispositivo durante el cultivo. En caso de que los escombros o los cristales de sal bloqueen el montaje, vuelva a lavar tanto la lámina SEM como el dispositivo en agua estéril y séquelos antes de volver a intentar el procedimiento de montaje. Si los microgrooves parecen distorsionados por presionar demasiado fuerte sobre el dispositivo, retire el dispositivo completamente de la hoja SEM e intente el montaje nuevamente. Tenga cuidado al recubrir y cambiar el medio una vez que el dispositivo está montado. - Trabajar bajo un microscopio en un flujo laminar. Cubra el dispositivo con laminina (20 μg/ml) en un medio neurobasal e incube durante la noche a 37 °C, 5% de CO2.
NOTA: La incubación durante la noche endurece el dispositivo de silicona y lo sella aún más en la lámina SEM.- Use una pipeta P200 para agregar 100 μL de la solución de laminina en un pozo superior lo más cerca posible de la abertura del canal y observe el fluido que pasa del pozo superior a través del canal al pozo inferior. Verifique si hay fugas alrededor del pozo y el canal.
- Posteriormente, agregue 100 μL de solución de laminina al pozo inferior y verifique si hay fugas. Repita en el otro lado de los microgrooves y termine con 100 μL adicionales en un lado del dispositivo para crear un gradiente de volumen entre los dos lados espejados del dispositivo para recubrir los microgrooves (por ejemplo, lado derecho 200 μL, lado izquierdo 300 μL).
NOTA: En caso de fuga, retire el recubrimiento de laminina, desmonte el dispositivo y las láminas SEM y lave ambos en agua estéril. Déjalos secar y repite a partir del paso 4.3 en adelante. - Al día siguiente, retire el recubrimiento de los pozos con una pipeta P200 colocando la punta en el pozo opuesto a la abertura del canal. Agregue DPBS a todos los pozos y deje los dispositivos con DPBS en el flujo laminar en RT para la siembra celular.
NOTA: A partir de este momento, no retire el líquido (recubrimiento de laminina, DPBS, medios, solución de fijación, etc.) directamente de los canales, ya que esto podría causar la formación de burbujas de aire. Siempre inspeccione los dispositivos bajo el microscopio antes de sembrar células.
5. Chapado de NPCs en dispositivos microfluídicos - Día 10
NOTA: De acuerdo con el protocolo de diferenciación de neuronas motoras15, el emplatado de npCs del día 10 ocurre un jueves.
- Utilizar NPCs recién disociados del día 1015, o descongelar 1-2 viales de NPCs almacenados por 10 mL de medio de neurona motora del día 10 (Tabla 2 y Tabla 3) con solución inhibidora de ROCK (10 μL/mL), y centrifugar la suspensión celular a 100 x g durante 4 min.
- Resuspend el pellet celular en 500-1000 μL del medio de neurona motora del día 10 con solución inhibidora de ROCK (10 μL/mL) y contar las células vivas utilizando cualquier método de conteo preferido.
NOTA: Como se indica a continuación, asegúrese de volver a suspender los NPC en la cantidad correcta de medios para acomodar un volumen de siembra óptimo. - Retire DPBS de dos pocillos en un lado de los microgrooves en el dispositivo con una pipeta P200 y selle 250,000 NPC por dispositivo en 60-100 μL de medios de neurona motora del día 10.
- En el pozo superior derecho, sembra 30-50 μL de la suspensión celular (125,000 células) cerca de la abertura del canal en un ángulo de 45 ° y arrastra el fluido restante suavemente a lo largo del piso del pozo hacia el centro del pozo con la punta de la pipeta.
- Haga una pausa durante unos segundos para permitir que la suspensión celular fluya a través del canal antes de repetir esto en el pozo inferior (125,000 células en 30-50 μL). Use un bolígrafo para marcar el lado sembrado "NPC" o equivalente para facilitar la orientación del dispositivo sin un microscopio.
- Incubar el dispositivo a 37 °C, 5% de CO2 durante 5 min para permitir la unión celular antes de recargar los pocillos de dos semillas con un medio de neurona motora de día 10 adicional (total 200 μL/pozo) e incubar de nuevo a 37 °C, 5% de CO2.
NOTA: Cada pozo puede contener 200 μL. Las células de siembra tanto en los pocillos como en los canales aseguran una estructura robusta del cultivo, reduciendo el riesgo de desprendimiento celular durante los cambios de medios. Es posible sembrar menos células solo en el canal. Sin embargo, esto hará que la cultura sea más susceptible a la corriente de volumen a través de los canales durante cada cambio de medio.
- Use una pipeta P200 para eliminar DPBS de los dos pozos al otro lado de los microgrooves opuestos a los NPC recién sembrados. Agregue 200 μL / pozo de los medios de neurona motora del día 10 y espere unos segundos entre el pozo superior e inferior para permitir que los medios fluyan a través del canal. Luego, agregue 6 ml de DPBS por plato de 10 cm alrededor del dispositivo para evitar la evaporación del medio durante la incubación.
NOTA: Agregue DPBS adicionales alrededor del dispositivo durante el período de cultivo si es necesario. - Realice un cambio completo del medio de la neurona motora en ambos compartimentos del dispositivo el día 11 (viernes), el día 14 (lunes) y el día 16 (miércoles) (Tabla 2 y Tabla 3). Agregue suplementos de medios frescos el día del cambio medio.
NOTA: A partir de este momento, realice todos los cambios de medio con una pipeta P200. Siempre coloque la punta de la pipeta lejos del canal en el borde del pozo y no retire el líquido directamente del canal. Tenga cuidado de no separar los dispositivos de silicona. La extracción y adición de medio debe hacerse lentamente para evitar el desprendimiento celular.- Retire con cuidado todos los medios en ambos pozos con NPC colocando la punta de la pipeta P200 en el borde inferior de la pared del pozo frente a la abertura del canal. Agregue lentamente 50-100 μL de medio de neurona motora fresca al pozo superior colocando la punta de la pipeta P200 en el borde superior de la pared del pozo frente a la abertura del canal.
- Haga una pausa durante unos segundos para permitir que el medio fluya a través del canal antes de agregar 50-100 μL de medio de neurona motora al pozo inferior. Repita este proceso cuidadosamente hasta que ambos pozos contengan 200 μL/pocillo. Repetir en el lado sin celdas.
6. Chapado de MAB en dispositivos microfluídicos - Día 17
- Aproximadamente 7 días antes de sembrar LOS MAB en los dispositivos microfluídicos (día 10 de diferenciación de la neurona motora), descongele los MAB y los sembra en el medio de crecimiento (Tabla 1) en un matraz T75 recubierto con colágeno para permitir una expansión celular suficiente. Ver sección 2.
- En el día 17 de la diferenciación de la neurona motora (jueves), disocie los MAB como se explica en el paso 2.4, resuspenda el pellet celular en ~ 500 μL de medio de crecimiento y cuente las células vivas utilizando cualquier método de conteo preferido.
NOTA: Como se indica a continuación, asegúrese de volver a suspender los MAB en la cantidad correcta de medios para acomodar el volumen de siembra óptimo. - Retire el medio de la neurona motora en el lado no sembrado de los microgrooves en el dispositivo con una pipeta P200, lave suavemente con DPBS y siembre 200,000 MAB por dispositivo en 60-100 μL de medio de crecimiento.
- En el pozo superior derecho, sembra 30-50 μL de suspensión celular (100,000 células) cerca de la abertura del canal en un ángulo de 45 ° y arrastra el líquido restante suavemente a lo largo del piso del pozo hacia el centro del pozo con la punta de la pipeta. Haga una pausa durante unos segundos para permitir el flujo de células a través del canal antes de repetir en el pozo inferior (100,000 células en 30-50 μL).
- Incubar el dispositivo a 37 °C, 5% de CO2 durante 5 min para permitir la fijación de la célula antes de rellenar los dos pocillos recién sembrados de MAB con un medio de crecimiento adicional (total de 200 μL/pocillo). Incubar de nuevo a 37 °C, 5% CO2.
NOTA: No se necesita ningún cambio de medio en el día 17 en el lado de la neurona motora del dispositivo. El cambio medio del día 17 según el método de diferenciación de neuronas motoras publicado anteriormente15 se realiza en su lugar el día 18 (viernes).
7. Implementación de un gradiente volumétrico y quimiotáctico para promover el crecimiento de neuritas de la neurona motora hacia el compartimento MAB
- El día 18, realice un cambio de medio completo en el lado de la neurona motora con el medio de la neurona motora del día 18 (200 μL / pozo). Siga las instrucciones para los cambios de medio mencionados en los pasos 5.5.1-5.5.2. Iniciar la diferenciación MAB en el compartimento MAB del dispositivo (Tabla 2 y Tabla 4).
- Lave cuidadosamente los compartimentos MAB una vez con DPBS antes de agregar medio de diferenciación MAB precalentado (Tabla 4) suplementado con 0.01 μg / ml de agrin humano (200 μL / pozo).
NOTA: Los MAB se fusionarán y formarán miotubos multinucleados en el transcurso de una semana.
- Lave cuidadosamente los compartimentos MAB una vez con DPBS antes de agregar medio de diferenciación MAB precalentado (Tabla 4) suplementado con 0.01 μg / ml de agrin humano (200 μL / pozo).
- El día 21, según el protocolo de diferenciación de la motoneurona (lunes), iniciar el gradiente quimiotáctico y volumétrico (Tabla 2 y Tabla 3).
- Agregue 200 μL/pocillo de medio basal de la neurona motora con 30 ng/mL de factor neurotrófico derivado del cerebro (BDNF), factor neurotrófico derivado de la línea celular glial (GDNF) y factor neurotrófico ciliar (CNTF), agrin humano (0.01 μg/ mL) y laminina (20 μg/mL) al compartimiento del miotubo (previamente definido como el compartimento MAB). Añadir medio basal de la neurona motora (100 μL/pozo) sin factores de crecimiento al compartimento de la neurona motora.
- Repita el paso 7.2 cada dos días hasta el día 28 de la diferenciación de la neurona motora. No se necesita ningún cambio de medios durante los fines de semana.
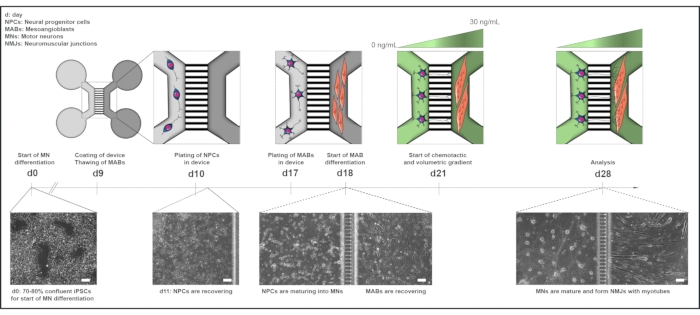
Figura 1: Descripción general esquemática del protocolo de la unidad motora en dispositivos microfluídicos. Línea de tiempo de diferenciación y visión general del cocultivo desde el día 0 hasta el día 28 según la línea de tiempo del protocolo de diferenciación de la neurona motora22. La diferenciación de la neurona motora de las iPSC se inicia en el día 0 y se realiza como se indicó anteriormente durante los siguientes 10 días15. El día 9, el dispositivo se esteriliza y se recubre con PLO-laminina. Los MAB se descongelan para su expansión en matraces T75. El día 10, las neuronas motoras-NPC se colocan en ambos pocillos y en el canal de un compartimento (gris claro) del dispositivo, donde su diferenciación en neuronas motoras se continúa durante una semana. Los MAB se chapan en ambos pozos y en el canal del compartimento opuesto (gris oscuro) el día 17. El día 18 se inicia la diferenciación de los MAB en miotubos. El día 21, se establece un gradiente volumétrico y quimiotáctico para promover la polarización neurona motora-neurita a través de los microgrooves del dispositivo. El compartimento de la neurona motora recibió 100 μL/pozo de medio basal de la neurona motora sin factores de crecimiento (compartimento verde claro), mientras que el compartimento del miotubo recibió 200 μL/pozo del medio basal de la neurona motora con 30 ng/mL de factores de crecimiento (compartimento verde oscuro) (Tabla 2 y Tabla 3). El cultivo se continúa con el gradiente volumétrico y quimiotáctico durante 7 días adicionales hasta el análisis en el día 28. Las imágenes de campo brillante muestran la morfología celular en el día 0, el día 11, el día 18 y el día 28 cultivadas en dispositivos microfluídicos preensamblados. Barra de escala, 100 μm. Esta figura ha sido modificada a partir de Stoklund Dittlau, K. et al.18. Las ilustraciones celulares han sido modificadas a partir de Smart Server medical Art22. Haga clic aquí para ver una versión más grande de esta figura.
8. Fijación e ICC
NOTA: Todos los pasos deben hacerse con cuidado para evitar el desprendimiento de los cultivos neuronales. No retire el líquido de los canales durante los siguientes pasos.
- Realice la fijación en una campana de humos o flujo laminar: lave cuidadosamente todos los pocillos en el dispositivo una vez con DPBS antes de la fijación. Corrija utilizando paraformaldehído (PFA) al 4 % en DPBS durante 15-20 min a RT en el flujo laminar (100 μL/pocillo).
PRECAUCIÓN: El PFA es tóxico: manipule en una campana extractora con equipo de protección personal.- Agregue cuidadosamente 100 μL al pozo superior del dispositivo y espere unos segundos para permitir que la solución de fijación fluya a través del canal antes de agregar 100 μL al pozo inferior. Repite en el otro lado. Después de la incubación, retire la solución de PFA y lave suavemente 3 veces durante 5 minutos con DPBS. Dejar en 200 μL/pozo DPBS para su almacenamiento y sellar la placa de Petri de 10 cm con parafilm para almacenar a 4 °C hasta el experimento ICC.
NOTA: Asegúrese de que los dispositivos no se sequen durante el almacenamiento.
- Agregue cuidadosamente 100 μL al pozo superior del dispositivo y espere unos segundos para permitir que la solución de fijación fluya a través del canal antes de agregar 100 μL al pozo inferior. Repite en el otro lado. Después de la incubación, retire la solución de PFA y lave suavemente 3 veces durante 5 minutos con DPBS. Dejar en 200 μL/pozo DPBS para su almacenamiento y sellar la placa de Petri de 10 cm con parafilm para almacenar a 4 °C hasta el experimento ICC.
- Incubar las células con una solución de permeabilización (100 μL/pocillo) de Tritón X-100 al 0,1% en DPBS durante 20 min a RT el día 1 del procedimiento ICC. Retire la solución de permeabilización y agregue suero de burro normal al 5% en solución triton X-100/DPBS al 0,1% (100 μL/pocillo) durante 30 min a RT.
- Retire la solución de suero de burro normal al 5% e incube los dispositivos con anticuerpos primarios (Tabla de materiales) en suero de burro normal al 2% en solución de Triton X-100/DPBS al 0,1% e incube a 4 °C durante la noche.
- Implementar un degradado de volumen. Añadir 100 μL/pocillo de solución de anticuerpos en un lado de los microgrooves y 150 μL/pocillo en el otro (500 μL en total por dispositivo).
NOTA: Es posible utilizar diferentes anticuerpos a ambos lados de los microgrooves. En este caso, no implemente un gradiente de volumen con anticuerpos primarios o secundarios a través de microgrooves para mantener el aislamiento fluídico entre compartimentos. Las neuritas en los microgrooves no se teñirán sin el gradiente.
- Implementar un degradado de volumen. Añadir 100 μL/pocillo de solución de anticuerpos en un lado de los microgrooves y 150 μL/pocillo en el otro (500 μL en total por dispositivo).
- Al día siguiente (día 2 del procedimiento ICC), retire los anticuerpos primarios y lave cuidadosamente el dispositivo 3 veces durante 5 minutos con una solución de Triton X-100/DPBS al 0,1%.
NOTA: En cultivos fácilmente desmontables, el lavado 3x durante 5 min se puede reemplazar por 1x durante 30 min. - Trabaje en la oscuridad a partir de ahora, ya que los anticuerpos secundarios (Tabla de Materiales) son sensibles a la luz. Incubar células con anticuerpos secundarios en suero de burro normal al 2% en solución triton X-100/DPBS al 0,1% durante 1 h en RT. Implementar un gradiente de volumen como se indica en el paso 8.3.1. Después de la incubación, retire los anticuerpos secundarios y lave 3 veces durante 5 minutos con DPBS.
- Etiquete el ADN nuclear con DAPI en DPBS (100 μL/pocillo) durante 20 min a RT seguido de 3x-4x de lavado de 5 min con solución triton X-100/DPBS al 0,1%. Retire la solución Triton X-100/DPBS al 0,1% de todos los pocillos y deje secar el cultivo durante unos segundos antes de agregar una gota de medios de montaje fluorescentes en cada pozo para sellar.
NOTA: Mantenga los dispositivos horizontales durante al menos 24 horas para permitir que los medios de montaje se ajusten. Después de 24 h, los dispositivos se pueden almacenar en una caja deslizante a 4 °C. - Imagen en pilas z con un microscopio invertido.
- Para obtener imágenes de NMJ, utilice un objetivo 40x para localizar los miotubos marcados con un anticuerpo de miotubo (Tabla de materiales) y realice grabaciones de pila z para garantizar imágenes de tejido neuronal y de miotubo. Tome varias imágenes en caso de que el miotubo sea demasiado grande para caber en un solo marco.
- Para la cuantificación de NMJ, cuente manualmente el número de colocalizaciones entre un marcador presináptico neuronal y un marcador AChR a través de cada pila z. Normalice el número de colocalizaciones con el número de miotubos presentes en la pila z.
9. Fijación y preparación del dispositivo para SEM
NOTA: Al cambiar líquidos, siempre mantenga una pequeña cantidad para cubrir el cultivo para evitar el colapso celular. Este protocolo utiliza sustancias altamente tóxicas, y se requiere trabajar con equipos de protección personal y en una campana extractora de humos durante todo el proceso.
- Fijación y desmontaje: Preparar glutaraldehído (GA) fresco al 2,5% en tampón de cacodilato de sodio de 0,1 M (pH 7,6), filtrar con un filtro de 0,2 μm y calentar hasta 37 °C.
PRECAUCIÓN: Ga y cacodilato de sodio son tóxicos: mango en una campana de humos con equipo de protección personal.- Lave cuidadosamente el dispositivo una vez con DPBS para eliminar los restos de medios y celdas y luego prefije con la solución de GA durante 15 minutos en RT.
- Use un bisturí para cortar cuidadosamente la hoja SEM en el perímetro del dispositivo mientras estabiliza el dispositivo con fórceps. Asegúrese de no separar el dispositivo mientras corta. Mueva el dispositivo y la hoja SEM con la ayuda de pinzas a una placa de Petri de 3 cm y coloque la placa de 3 cm en una placa de 10 cm para facilitar su manejo.
- Después de 15 minutos de prefijación, retire cuidadosamente el dispositivo de la hoja SEM con fórceps. Desmonte el dispositivo en una esquina y retírelo lentamente en una dirección diagonal hacia la esquina opuesta. Observe cómo las células se desprenden del dispositivo.
- Agregue una solución de GA adicional para cubrir toda la lámina SEM en el plato de 3 cm y continúe la fijación durante un total de 2 h en RT o durante la noche a 4 ° C.
NOTA: Empuje suavemente la lámina SEM debajo de la solución GA con fórceps evitando cualquier superficie cubierta de células.
- Continúe con un protocolo estándar para SEM. En resumen, incubar en tetróxido de osmio seguido de deshidratación con una serie graduada de etanol. Inserte la hoja SEM en un soporte de cubierta para el secado en puntos críticos y monte en talones de soporte para pegatinas de carbono y recubrimiento. Utilice un microscopio electrónico de barrido para obtener imágenes a un voltaje de aceleración de 5 kV y una distancia de trabajo de 7 mm.
10. Evaluación de la funcionalidad de NMJ utilizando imágenes de calcio de células vivas
- Preparar dispositivos: Refrescar el compartimento de miotubos con 200 μL/pocillo del medio basal de la neurona motora del día 18 con 30 ng/mL de BDNF, GDNF y CNTF y el compartimento de la neurona motora con 200 μL/pozo de medio basal de la neurona motora sin factores de crecimiento (Tabla 2 y Tabla 3).
- Añadir el colorante Fluo-4 AM diluido en disolvente de colorante Fluo-4 al compartimento del miotubo a una concentración final de 5 μM e incubar el dispositivo en la oscuridad a 37 °C, 5% de CO2 durante 25 min. Mientras el dispositivo está en incubación, diluya el cloruro de potasio en el medio basal de la neurona motora sin factores de crecimiento a una concentración final de 450 mM.
NOTA: Fluo-4 AM es un indicador de calcio, que exhibe un aumento en la fluorescencia al unirse al calcio. Trabaje en la oscuridad a partir de ahora, ya que el tinte es sensible a la luz. - Después de 25 min, refresque el compartimento del miotubo con 200 μL/pocillo del medio basal de la neurona motora del día 18 con 30 ng/mL de BDNF, GDNF y CNTF y el compartimento de la neurona motora con 100 μL/pozo del medio basal de la neurona motora sin factores de crecimiento para restablecer el gradiente quimiotáctico y volumétrico.
- Para bloquear los NMJ, complemente el medio del compartimento de miotubos con 19 μM del antagonista competitivo AChR tubocurarine hydrochloride pentahydrate.
PRECAUCIÓN: El clorhidrato de tubocurarina pentahidratado es tóxico: manipule en una campana extractora con equipo de protección personal.
- Añadir el colorante Fluo-4 AM diluido en disolvente de colorante Fluo-4 al compartimento del miotubo a una concentración final de 5 μM e incubar el dispositivo en la oscuridad a 37 °C, 5% de CO2 durante 25 min. Mientras el dispositivo está en incubación, diluya el cloruro de potasio en el medio basal de la neurona motora sin factores de crecimiento a una concentración final de 450 mM.
- Realizar grabaciones con un microscopio confocal invertido equipado con una incubadora ajustada a 37 °C, 5% CO2.
- Con un objetivo de 10x, utilice el canal de campo brillante para localizar los miotubos en el compartimento de miotubos. Ajuste la potencia, la ganancia y el desplazamiento del láser para el canal 488 a un nivel en el que la fluorescencia Fluo-4 marque los miotubos individuales.
NOTA: Los resultados representativos se obtuvieron ajustando las barras de desplazamiento en la configuración A1 del software a una potencia láser del 5%, una ganancia de 60 (HV) y un desplazamiento de 0.
- Con un objetivo de 10x, utilice el canal de campo brillante para localizar los miotubos en el compartimento de miotubos. Ajuste la potencia, la ganancia y el desplazamiento del láser para el canal 488 a un nivel en el que la fluorescencia Fluo-4 marque los miotubos individuales.
- Ajuste el tiempo de grabación a 1 minuto con intervalos de 1 s. Registro de 5-10 s para tener una línea de base, seguido de la estimulación inmediata de las neuronas motoras con la solución de cloruro de potasio.
- Después de 5-10 s en la grabación, agregue lentamente 25 μL de solución de cloruro de potasio a un pozo del compartimiento de la neurona motora para alcanzar una concentración final de 50 mM.
NOTA: Evite agregar la solución de cloruro de potasio demasiado rápido, ya que esto creará una onda a través del canal, causando artefactos en la grabación.
- Después de 5-10 s en la grabación, agregue lentamente 25 μL de solución de cloruro de potasio a un pozo del compartimiento de la neurona motora para alcanzar una concentración final de 50 mM.
- Registre el compartimento del miotubo con estimulación de la neurona motora dos veces con una pausa de 2 minutos, seguido de una estimulación directa con una solución de cloruro de potasio de 25 μL del compartimento del miotubo para evaluar la actividad directa del miotubo independientemente de la despolarización de la neurona motora.
- Para las cuantificaciones, rodee cada miotubo manualmente con el software de grabación y analice la intensidad fluorescente de Fluo-4 durante el período de tiempo de 1 minuto. Para determinar el aumento de la afluencia de calcio, reste el valor basal promedio (es decir, el promedio de los primeros 10 s antes de la estimulación con cloruro de potasio) del valor máximo después de la estimulación con cloruro de potasio. Los resultados representativos se adquirieron utilizando la herramienta de medición de tiempo del software.
Resultados
Generación de NMJs en dispositivos microfluídicos
Para generar una unidad motora humana con NMJ funcionales en dispositivos microfluídicos disponibles comercialmente, se utilizaron neuronas motoras humanas derivadas de iPSC y miotubos humanos derivados de MAB. La calidad del material de la célula de partida es importante, y especialmente la capacidad de fusión de los MAB en miotubos es crucial para un resultado exitoso de este protocolo. Los MAB son fáciles de mantener en la cultura. Sin embargo, es importante evaluar la capacidad de fusión de cada lote antes de aplicarlos a los dispositivos microfluídicos (Figura suplementaria 1A,B)18. No se debe usar ningún lote que no muestre formación de miotubos después de 10 días de diferenciación. El índice de fusión en la Figura Suplementaria 1B se determinó calculando el porcentaje de núcleos dentro de los miotubos positivos para cada marcador de miotubo del número total de núcleos por imagen. Encontramos que un índice de fusión de aproximadamente el 8% fue suficiente para nuestro cocultivo en la generación de NMJ.
Siempre es importante comenzar una diferenciación de neuronas motoras a partir de un cultivo puro de iPSCs. Cuanto más pura sea la entrada, más puro será el resultado. El protocolo de diferenciación de neuronas motoras genera cultivos de neuronas motoras, que suelen ser 85%-95% positivos para marcadores de neuronas motoras (Figura suplementaria 1C, D)18. Las células restantes generalmente serán células precursoras indiferenciadas, que en algunos casos sufrirán una proliferación extensa y, por lo tanto, tendrán un impacto negativo en la calidad del cultivo. Para obtener el mejor resultado de este protocolo, se debe evaluar la eficiencia de diferenciación de la neurona motora antes de aplicar los NPC de neurona motora del día 10 en el dispositivo. Además, se puede realizar un control de calidad de NPC en el día 11 para evaluar la expresión del marcador NPC Olig2 (Figura suplementaria 1E, F).
Inicialmente, las neuronas motoras-NPC y las MAB se colocaron en el mismo punto de tiempo en el día 10. Aquí, la diferenciación MAB se inició el día 11. El gradiente de volumen y factor de crecimiento implementado el día 14 nos permitió evaluar la formación de NMJ en el día 21, acortando así el protocolo en una semana. Curiosamente, pudimos observar la formación característica de NMJ por ICC (Figura Suplementaria 2A). Sin embargo, no pudimos adquirir una salida funcional a través de los registros de calcio de células vivas tan temprano en la diferenciación de la neurona motora (datos no mostrados). Concluimos que las neuronas motoras aún no estaban lo suficientemente maduras como para formar conexiones funcionales de NMJ con los miotubos, a pesar de que la morfología de NMJ parecía prometedora. Esto está en línea con nuestras observaciones anteriores de que los potenciales de acción espontánea en las neuronas motoras, registrados a través del análisis electrofisiológico de parche-pinza, solo ocurren en el día 35 de la diferenciación de la neurona motora15.
Además, intentamos prolongar la maduración de la neurona motora, así como la sostenibilidad del cocultivo, madurando las neuronas motoras en el dispositivo durante 2 semanas (día 24), antes de emplatar los MAB. Desafortunadamente, se observó una gran cantidad de cruce espontáneo neurona-neurita motora a través de microgrooves, lo que resultó en la inhibición de la unión MAB (Figura suplementaria 2B). Debido a la falta de formación de miotubos en el canal, no logramos identificar NMJ en el día 36 y, por lo tanto, aplicamos el protocolo de 28 días (Figura 1).
Identificación, cuantificación y caracterización morfológica de NMJ in vitro
Después de seguir el protocolo de 28 días (Figura 1), se pudieron obtener NMJ completamente funcionales. Tanto in vivo como in vitro, los NMJ se caracterizan inmunohistoquímicamente o inmunocitoquímicamente a través de la co-localización de un marcador presináptico y un marcador postsináptico. En este estudio, se utilizó una combinación de cadena pesada de neurofilamentos (NEFH) y SYP como combinación de marcadores presinápticos, lo que permitió el seguimiento de una sola neurita desde el soma de la neurona motora hacia el proceso más distal. En el lado muscular, Btx es ampliamente utilizado como un marcador postsináptico para AChRs, y también se utilizó en este estudio. La suplementación de agrin y laminina promueve la agrupación de los AChRs en el sarcolemma19,20,21, facilitando la identificación de AChRs in vitro e igualmente aumenta el número de AChRs y NMJs presentes18.
Con el fin de localizar y calcular los NMJ de una manera imparcial, cada miotubo se identifica a través de la positividad de la cadena pesada de miosina (MyHC) y se toma una imagen en pilas z a un aumento de 40x utilizando un microscopio confocal invertido. Durante miotubos muy largos, se adquirieron múltiples pilas z. Para el análisis de imágenes, el número de colocalizaciones entre NEFH/SYP y Btx se cuenta manualmente a través de cada pila z, y el número de colocalizaciones se normaliza al número de miotubos presentes en la pila z (Figura 2A-C)18. No todos los miotubos tendrán NMJ, como se ve en la cuantificación de los miotubos inervados (Figura 2D). En consecuencia, es importante realizar un enfoque de grabación imparcial, donde se muestren todos los miotubos, independientemente de la presencia de Btx.
Es posible identificar dos tipos de morfologías en este sistema in vitro . Los NMJ aparecen como NMJ de punto de contacto único, donde una neurita toca un grupo de AChR en un punto de interacción, o NMJ de punto de contacto múltiple, donde una neurita se desplegará y se involucrará con el clúster de AChR sobre una superficie más grande. Estas dos morfologías pueden identificarse tanto inmunocitoquímicamente (Figura 2A)18 como con SEM (Figura 2B)18, e igualmente pueden cuantificarse (Figura 2C)18. En general, los múltiples puntos de contacto facilitan una conexión más amplia a través de una gran incrustación muscular, lo que apunta hacia una formación NMJ más madura. Por el contrario, los NMJ de punto de contacto único se consideran menos maduros debido al estado de desarrollo temprano de la cultura.
Evaluación funcional de NMJ in vitro
Para evaluar la funcionalidad de los NMJ, se utilizaron registros transitorios de calcio de células vivas (Figura 3)18. Aprovechando el sistema aislado fluidamente de los dispositivos microfluídicos, se estimuló el lado del soma de la neurona motora con una alta concentración (50 mM) de cloruro de potasio mientras se registraba simultáneamente una afluencia de calcio en los miotubos, que se cargaron con el colorante Fluo-4 sensible al calcio (Figura 3A). Casi inmediatamente después de la activación de la neurona motora, pudimos observar una afluencia de calcio en los miotubos a través de una formación de onda característica, que confirma una conexión funcional a través de la neurona motora-neurita y el miotubo (Figura 3A-C)18. No se observaron ondas de calcio espontáneas ni contracciones espontáneas de miotubos, aunque se observó contracción de miotubos tras la estimulación directa con cloruro de potasio. La especificidad de la conexión se confirmó aún más mediante la adición del antagonista competitivo de AChR, el clorhidrato de tubocurarina pentahidratado (DTC) al compartimento de miotubos (Figura 3A), lo que resultó en una inhibición de la afluencia de calcio (Figura 3C). Este efecto confirmó que la conexión entre las neuronas motoras y los miotubos dio lugar a NMJ completamente funcionales. Para evaluar el número de miotubos activos a través de la estimulación NMJ, el compartimento del miotubo se estimuló directamente con cloruro de potasio para identificar el número total de miotubos activos en este compartimento. Aproximadamente el 70% de los miotubos estaban activos a través de la activación estimulada por la neurona motora con cloruro de potasio (Figura 3D)18.
Estos resultados confirman la formación, el número, la morfología y la funcionalidad óptimos de NMJ a través del co-cultivo de las neuronas motoras derivadas de iPSC y los miotubos derivados de MAB durante un protocolo de 28 días.
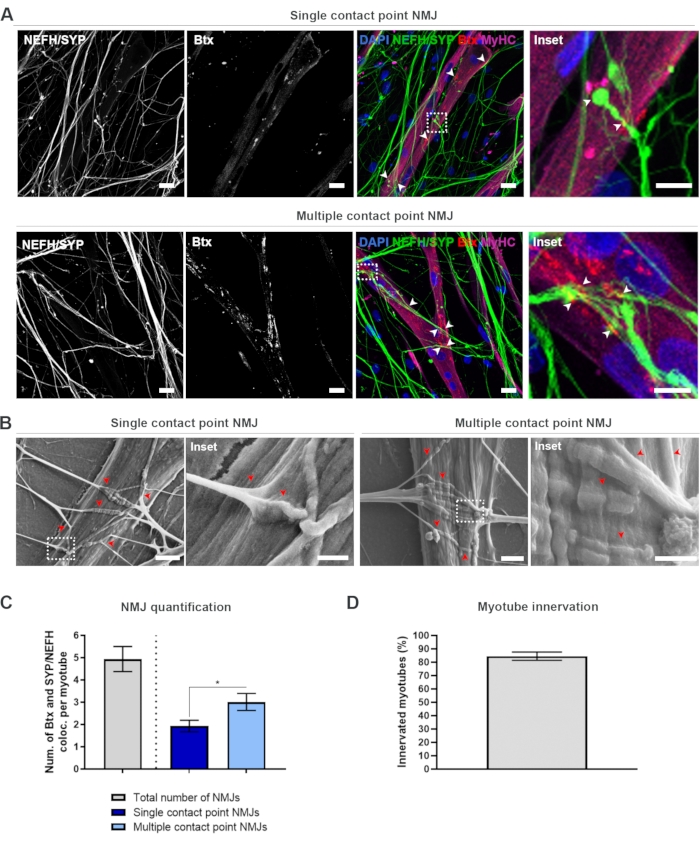
Figura 2: Formación de NMJ en dispositivos microfluídicos. (A) Micrografías confocales de formación de NMJ en dispositivos microfluídicos preensamblados en el día 28. Los NMJ se identifican a través de la colocalización (puntas de flecha) de marcadores presinápticos (NEFH y SYP) y marcadores AChR postsinápticos (Btx) en miotubos teñidos de MyHC. Las NMJ se identifican morfológicamente a través de la formación de puntos de contacto únicos o múltiples entre neuritas y grupos de AChR. Núcleos de etiquetas DAPI. Barra de escala, 25 μm. El recuadro muestra un aumento de un NMJ. Barra de escala insertada, 10 μm. (B) SEM de morfología NMJ en dispositivos microfluídicos de silicona en el día 28. Las puntas de flecha representan la incrustación de neurita en el miotubo. Barra de escala, 2 μm. El recuadro muestra una ampliación de NMJ. Barra de escala insertada, 1 μm. (C) Cuantificación del número total de NMJ por miotubo, así como el número de NMJ de punto de contacto único y múltiple por miotubo. El gráfico se muestra como media ± error estándar de la media de cuatro réplicas biológicas. La significación estadística se determina con la prueba de Mann-Whitney con * p < 0,05. (D) Cuantificación del porcentaje de miotubos inervados. El gráfico se muestra como media ± error estándar de la media de cuatro réplicas biológicas. Esta figura ha sido modificada a partir de Stoklund Dittlau, K. et al.18. Haga clic aquí para ver una versión más grande de esta figura.
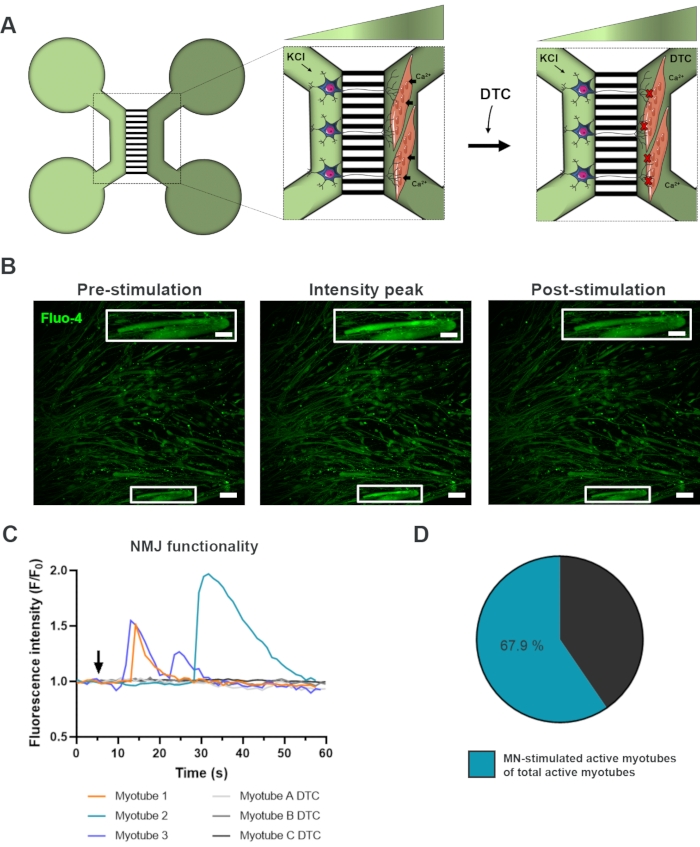
Figura 3: Confirmación de la funcionalidad NMJ. (A) Ilustración esquemática de registros de calcio transitorio de células vivas de la funcionalidad de NMJ en dispositivos microfluídicos preensamblados en el día 28 antes y después del bloqueo de NMJ con tubocurarina (DTC)22. Las neuronas motoras en el compartimento verde claro se estimulan con cloruro de potasio (KCl) de 50 mM, que causa una respuesta de la neurona motora intracelular a través de las neuritas. Esto evoca una afluencia de calcio (Ca2 +) en los miotubos, que están etiquetados con tinte Fluo-4 sensible al calcio (compartimento verde oscuro). (B) Micrografías de fluorescencia Fluo-4 de preestimulación, pico de intensidad y postestimulación de un miotubo que representan una ola de aumento de calcio intracelular tras la estimulación de la neurona motora con KCl. El recuadro muestra un aumento de un miotubo activo inervado. Barras de escala, 100 μm. Barra de escala insertada, 200 μm. (C) Curvas de afluencia de calcio representativas en miotubos después de la estimulación de la neurona motora con KCl (flecha) que confirma la funcionalidad de NMJ. Myotube 1-3 muestra curvas de calcio características a través de la inervación de la neurona motora-miotubo, mientras que el myotube A-C DTC representa curvas después del bloqueo de NMJ con DTC. (D) Relación de miotubos activos estimulados por neuronas motoras sobre el número total de miotubos activos. Esta figura ha sido modificada a partir de Stoklund Dittlau, K. et al.18. Las ilustraciones celulares han sido modificadas a partir de Smart Server medical Art22. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Verificación de neuronas motoras, índice de fusión MAB y control de calidad npc. (A) Imágenes confocales de miotubos derivados de MAB 10 días después del inicio de la diferenciación. Los miotubos están etiquetados con marcadores de miotubos: desmin, MyHC, miogenina (MyoG) y titina. Los núcleos se tiñen con DAPI. Barra de escala, 100 μm. (B) Cuantificación del índice de fusión MAB 10 días después del inicio de la diferenciación. Tras la inanición, los MAB se fusionan en miotubos multinucleados, que se cuantificaron para la positividad del marcador de miotubos (AB +). El gráfico representa la media ± error estándar de la media de tres réplicas biológicas. (C) Imágenes confocales de neuronas motoras derivadas de iPSC en el día 28 de diferenciación, que están marcadas con marcadores de neuronas motoras NEFH, colina acetiltransferasa (ChAT) e Islet-1 además del marcador pan-neuronal βIII-tubulina (Tubulina). Los núcleos se tiñen con DAPI. Barras de escala, 75 μm. (D) Cuantificación del número de células, que son positivas para la neurona motora y los marcadores panneuronales (AB+). El gráfico representa la media ± error estándar de la media de tres réplicas biológicas. (E) Imágenes confocales de NPC derivadas de iPSC en el día 11 de diferenciación de neuronas motoras, que están marcadas con el marcador NPC Olig2 y el marcador panneuronal βIII-tubulina (Tubulin). Los núcleos se tiñen con DAPI. Barras de escala, 50 μm. (F) Cuantificación del número de NPCs, que son positivos para Olig2 y βIII-tubulina (AB+). El gráfico representa la media ± error estándar de la media de tres réplicas biológicas. Esta figura ha sido modificada a partir de Stoklund Dittlau, K. et al.18. Haga clic aquí para descargar este archivo.
Figura suplementaria 2: Optimización del protocolo de cocultivo (A) Imágenes confocales de la formación de NMJ en el día 21 de la diferenciación de la neurona motora, cuando los MAB se siembran en el mismo punto de tiempo que los NPC en el día 10. Los NMJ se identifican a través de la colocalización (puntas de flecha) de marcadores presinápticos (NEFH y SYP) y marcadores AChR postsinápticos (Btx) en miotubos teñidos de MyHC. Barra de escala (izquierda), 10 μm. Barra de escala (derecha), 5 μm. (B) Imagen de campo brillante del canal de miotubo en el día 24 que representa el cruce espontáneo neurona motora-neurita que inhibe la unión de MAB. Barra de escala, 100 μm. Haga clic aquí para descargar este archivo.
| Reactivo | Concentración de existencias | Concentración final |
| IMDM | 1x | 80% |
| Suero fetal bovino | 15% | |
| Penicilina/Estreptomicina | 5000 U/ml | 0.5% |
| L-glutamina | 50x | 1% |
| Piruvato de sodio | 100 metros | 1% |
| Aminoácidos no esenciales | 100x | 1% |
| Insulina transferrina selenio | 100x | 1% |
| bFGF (añadido fresco) | 50 μg/ml | 5 ng/ml |
Tabla 1: Medio de crecimiento del MAB. El medio puede durar 2 semanas a 4 °C. bFGF se agrega fresco el día de su uso.
| Reactivo | Concentración de existencias | Concentración final |
| DMEM/F12 | 50% | |
| Medio neurobasal | 50% | |
| Penicilina/Estreptomicina | 5000 U/ml | 1% |
| L-glutamina | 50x | 0.5 % |
| Suplemento N-2 | 100x | 1% |
| B-27 sin vitamina A | 50x | 2% |
| β-mercaptoetanol | 50 metros | 0.1% |
| Ácido ascórbico | 200 μM | 0,5 μM |
Tabla 2: Medio basal de la neurona motora. El medio puede durar 4 semanas a 4 °C.
| Día | Reactivo | Concentración de existencias | Concentración final | Compartimiento |
| Día 10/11 | Agonista suavizado | 10 mM | 500 nM | Ambos |
| Ácido retinoico | 1 mM | 0,1 μM | ||
| DAPT | 100 metros | 10 μM | ||
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| Día 14 | DAPT | 100 metros | 20 μM | Ambos |
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| Día 16 | DAPT | 100 metros | 20 μM | Ambos |
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| CNTF | 0,1 mg/ml | 10 ng/ml | ||
| Día 18 | BDNF | 0,1 mg/ml | 10 ng/ml | Neurona motora |
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| CNTF | 0,1 mg/ml | 10 ng/ml | ||
| Día 21+ | BDNF | 0,1 mg/ml | 30 ng/ml | Myotube |
| GDNF | 0,1 mg/ml | 30 ng/ml | ||
| CNTF | 0,1 mg/ml | 30 ng/ml | ||
| Agrin | 50 μg/ml | 0,01 μg/ml | ||
| Laminina | 1 mg/ml | 20 μg/ml | ||
| Día 21+ | Sin suplementos | Neurona motora |
Tabla 3: Suplementos de medios para neuronas motoras. Los suplementos se agregan frescos el día de uso al medio basal de la neurona motora.
| Día | Reactivo | Concentración de existencias | Concentración final | Compartimiento |
| Día 18 | DMEM/F12 | 97% | MAB | |
| Piruvato de sodio | 100 metros | 1% | ||
| Suero de caballo | 2% | |||
| Agrin | 50 μg/ml | 0,01 μg/ml |
Tabla 4: Medio de diferenciación MAB. El medio puede durar 2 semanas a 4 °C. Agrin se agrega fresco el día de su uso.
Discusión
El protocolo describe un método relativamente fácil de usar, que genera unidades motoras humanas con NMJ funcionales en dispositivos microfluídicos disponibles comercialmente en menos de 30 días. Se describe cómo los NMJ pueden evaluarse morfológicamente a través de técnicas estándar como ICC y SEM y funcionalmente a través de registros de calcio de células vivas.
Una gran ventaja de este protocolo es el uso de la tecnología de células madre. Esto permite una adaptabilidad total en la que los NMJ pueden evaluarse tanto en salud como en enfermedad, independientemente del perfil del donante. El modelo ya ha demostrado ser exitoso y beneficioso en la investigación de la ELA, donde identificamos deficiencias en el crecimiento de neuritas, el rebrote y los números de NMJ como nuevos fenotipos debidos a mutaciones en el gen FUS18. Con este modelo, es posible ampliar la investigación para incluir formas esporádicas de ELA, donde se desconoce la etiología, mediante el uso de iPSCs de pacientes esporádicos con ELA. Esto proporciona una ventaja sobre los modelos animales tradicionales, que se basan en la sobreexpresión transgénica de genes mutados para recapitular la enfermedad humana23,24. Además, nuestro sistema completamente humano permite una posible recapitulación de la fisiología y la enfermedad específicas del ser humano. Estudios previos demostraron las diferencias entre la morfología de NMJ en roedores y humanos25, lo que sugiere que se debe tener precaución al usar roedores para abordar la patología de NMJ humana. Aunque este sistema es una configuración in vitro relativamente simple, que carece de la complejidad de un modelo in vivo, fue posible demostrar que la morfología NMJ mostrada en los dispositivos microfluídicos se parecía a las NMJ de amputaciones humanas25. Además, este modelo permite la evaluación de NMJ durante la formación y maduración de NMJ, revelando potencialmente fenotipos tempranos de la enfermedad, que están ausentes, no identificables o pasados por alto en muestras humanas post mortem.
Los MAB proporcionan una opción válida para generar miotubos, aunque su supervivencia limitada de 10 días es una desventaja del sistema. La supervivencia del miotubo depende de su unión a la superficie, que probablemente se ve comprometida por las contracciones espontáneas de las miofibras. Después de más de 10 días, la mayoría de los miotubos se habrán desprendido, haciendo que la cultura NMJ sea inutilizable. Idealmente, los miotubos también se generarían a partir de iPSC. Sin embargo, los protocolos actuales han demostrado ser difíciles de reproducir26 debido a la variabilidad en el índice de fusión27,28,29,30.
Mediante el uso de dispositivos microfluídicos disponibles comercialmente, generamos un sistema estandarizado, que es totalmente accesible. Existen otros modelos NMJ31,32,33,34,35,36,37,38,39,40,41,42. Sin embargo, generalmente se basan en compartimentos individuales, que carecen de la compartimentación y el aislamiento fluídico entre los tipos de células, o en recipientes de cultivo hechos a medida, lo que reduce la disponibilidad y potencialmente también la reproducibilidad. Los dispositivos microfluídicos utilizados para este protocolo se pueden adquirir con microgrooves de varias longitudes, lo que permite realizar análisis posteriores como el transporte axonal43,44 o la axotomía18,45,46 investigaciones. El aislamiento fluídico entre compartimentos permite además el tratamiento farmacológico compartimentado de las neuronas motoras o los miotubos, lo que puede ser favorable en el desarrollo de la terapia. Han surgido más empresas especializadas en microfluídica, lo que se ha abierto a una gran selección de diseños y características de dispositivos, promoviendo aún más la accesibilidad para la investigación in vitro.
En conclusión, hemos desarrollado un protocolo que proporciona un método confiable, versátil y fácil para cultivar unidades motoras humanas con NMJ funcionales.
Divulgaciones
L.V.D.B. tiene una patente sobre el uso de inhibidores de HDAC en la enfermedad de Charcot-Marie-Tooth (US-2013227717-A1), es cofundador científico de Augustine Therapeutics y miembro de su consejo asesor científico. Los otros autores no declaran intereses contrapuestos.
Agradecimientos
Los autores agradecen a Nikky Corthout y Sebastian Munck de LiMoNe, Grupo de Investigación de Neurobiología Molecular (VIB-KU Leuven) por sus consejos sobre los registros de fluorescencia transitoria de calcio de células vivas. Esta investigación fue apoyada por la Comisión Fulbright a Bélgica y Luxemburgo, KU Leuven (C1 y Fondo "Abriendo el Futuro"), el VIB, la Agencia para la Innovación por la Ciencia y la Tecnología (IWT; SBO-iPSCAF), el "Fondo para la Investigación Científica de Flandes" (FWO-Vlaanderen), Target ALS, la ALS Liga België (Una cura para la ELA), el Gobierno belga (Programa Interuniversitario de Polos de Atracción P7/16 iniciado por la Oficina Federal de Política Científica de Bélgica), la Fundación Thierry Latran y la "Association Belge contre les Maladies neuro-Musculaires" (ABMM). T.V. y J.B. están respaldados por becas de doctorado otorgadas por FWO-Vlaanderen.
Materiales
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Referencias
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados