Method Article
Génération d’unités motrices humaines avec des jonctions neuromusculaires fonctionnelles dans des dispositifs microfluidiques
Dans cet article
Résumé
Nous décrivons une méthode pour générer des unités motrices humaines dans des dispositifs microfluidiques disponibles dans le commerce en co-cultivant des motoneurones dérivés de cellules souches pluripotentes induites par l’homme avec des myotubes primaires dérivés de mésoangioblastes humains, ce qui entraîne la formation de jonctions neuromusculaires fonctionnellement actives.
Résumé
Les jonctions neuromusculaires (NMJ) sont des synapses spécialisées entre l’axone du motoneurone inférieur et le muscle facilitant l’engagement de la contraction musculaire. Dans les troubles des motoneurones, tels que la sclérose latérale amyotrophique (SLA) et l’amyotrophie spinale (SMA), les NMJ dégénèrent, entraînant une atrophie musculaire et une paralysie progressive. Le mécanisme sous-jacent de la dégénérescence NMJ est inconnu, en grande partie en raison de l’absence de modèles de recherche traduisibles. Cette étude visait à créer un modèle in vitro polyvalent et reproductible d’une unité motrice humaine avec des NMJ fonctionnels. Par conséquent, les motoneurones dérivés de cellules souches pluripotentes induites par l’homme (hiPSC) et les myotubes dérivés du mésoangioblaste primaire humain (MAB) ont été co-cultivés dans des dispositifs microfluidiques disponibles dans le commerce. L’utilisation de micro-compartiments isolés de manière fluide permet le maintien de microenvironnements spécifiques aux cellules tout en permettant un contact de cellule à cellule à travers des microgrooves. En appliquant un gradient chimiotactique et volumétrique, la croissance des motoneurones-neurites à travers les microgrooves favorisant l’interaction myotube et la formation de NMJ ont été stimulées. Ces NMJ ont été identifiés immunocytochimiquement par colocalisation du marqueur présynaptique des motoneurones synaptophysine (SYP) et du marqueur du récepteur postsynaptique de l’acétylcholine (AChR) α-bungarotoxine (Btx) sur les myotubes et caractérisés morphologiquement par microscopie électronique à balayage (MEB). La fonctionnalité des NMJ a été confirmée en mesurant les réponses calciques dans les myotubes lors de la dépolarisation des motoneurones. L’unité motrice générée à l’aide de dispositifs microfluidiques standard et de la technologie des cellules souches peut faciliter la recherche future axée sur les NMJ dans les domaines de la santé et de la maladie.
Introduction
Les NMJ facilitent la communication entre les motoneurones de la colonne vertébrale inférieure et les fibres musculaires squelettiques grâce à la libération de neurotransmetteurs1. Dans les troubles des motoneurones comme la SLA et la SMA, les NMJ dégénèrent, ce qui provoque une perturbation de la communication avec les muscles2,3,4,5,6,7. Il en résulte que les patients perdent progressivement leur fonction musculaire, ce qui les rend en fauteuil roulant et éventuellement dépendants du soutien respiratoire en raison de l’atrophie progressive des groupes musculaires vitaux comme le diaphragme. Les mécanismes sous-jacents exacts responsables de cette perte profonde de NMJ dans ces troubles sont inconnus. De nombreuses études ont été réalisées sur des modèles animaux transgéniques, ce qui nous a permis de mieux comprendre la pathogenèse de la dégénérescence NMJ5,6,8,9,10,11. Cependant, pour bien comprendre la pathologie et contrer la dénervation, il est important d’avoir un système humain, qui permet une accessibilité totale.
Ici, le protocole décrit un moyen relativement simple de générer des NMJ humains grâce à la co-culture de motoneurones dérivés de hiPSC et de myotubes primaires humains dérivés de MAB à l’aide de dispositifs microfluidiques disponibles dans le commerce. L’utilisation de la microfluidique pour polariser et isoler fluidiquement les somas et les axones des neurones est connue depuis la première description des chambres de Campenot12 à la fin des années 1970. Depuis lors, d’autres conceptions microfluidiques ont été fabriquées, y compris des options commerciales. Les dispositifs utilisés dans ce protocole contiennent deux compartiments, et chaque compartiment est constitué de deux puits reliés par un canal13. Les deux compartiments sont mis en miroir et reliés par plusieurs microgrooves. Ces microgrooves ont une taille qui facilite la croissance des neurites tout en maintenant l’isolation fluidique entre les deux compartiments grâce à une pression hydrostatique capillaire13,14. En utilisant ce système, il est possible de cultiver des motoneurones dans un compartiment et des cellules musculaires dans l’autre, chacun dans leur milieu de culture spécifique, tout en facilitant une connexion physique à travers les neurites passant à travers les microgrooves et s’engageant avec les cellules musculaires. Ce modèle fournit un système in vitro entièrement accessible et adaptable d’une unité motrice humaine, qui peut être utilisé pour étudier la pathologie NMJ précoce dans des maladies comme la SLA et la SMA.
Protocole
Le consentement éclairé écrit a été obtenu de tous les sujets, qui ont fourni leurs échantillons pour la génération d’iPSC et la récolte de MAB. La procédure a été approuvée par le comité d’éthique médicale de l’hôpital universitaire de Louvain (n° S5732-ML11268) et par le principal comité d’éthique de la recherche du Royaume-Uni dans le cadre du projet StemBANCC. Tous les réactifs et l’équipement utilisés dans ce protocole sont énumérés dans le Tableau des matériaux et doivent être utilisés stériles. Les fluides doivent être chauffés à la température ambiante (RT) avant utilisation, sauf indication contraire. Pour un aperçu du protocole de co-culture, veuillez consulter la figure 1.
1. Différenciation des progéniteurs des motoneurones des CSPi
- Suivez le protocole de différenciation des motoneurones15, adapté d’une étude précédente16, jusqu’à atteindre l’état de progéniteur neuronal (PNJ) du jour 10. Selon le calendrier du protocole, la différenciation est initiée un lundi (jour 0), ce qui se traduit par des PNJ du jour 10 un jeudi.
- Cryoconservez les PNJ du jour 10 en remplacement sérique knock-out avec 10% de diméthylsulfoxyde (DMSO) à une densité de 2 x 106- 4 x 106 cellules par flacon.
ATTENTION : Le DMSO est toxique : manipuler une hotte avec un équipement de protection individuelle.
REMARQUE: Environ 50% de la journée, 10 PNJ devraient être vitaux lors de la décongélation. Arrêtez le protocole de différenciation des motoneurones à cet état de « PNJ du jour 10 » et cryoconservez les PNJ pour générer un grand nombre de PNJ, qui peuvent être mis en banque et utilisés plus tard, réduisant ainsi la durée de la chronologie globale du protocole de co-culture de 28 jours à 19 jours au total.
2. Dérivation et entretien des MAB humains
REMARQUE: Les MAB sont des cellules souches mésenchymateuses associées à des vaisseaux, qui, dans ce cas, ont été prélevées à partir de biopsies obtenues auprès d’un donneur sain de 58 ans. D’autres sources commerciales sont disponibles. Le protocole pour obtenir des MABs est brièvement expliqué. Pour plus d’informations, reportez-vous au protocole détaillé17. Tous les milieux MAB doivent être chauffés à 37 °C avant utilisation.
- Hacher le tissu de biopsie et incuber sur du collagène (en cuir de veau) enrobé de plats de 6 cm dans un milieu de croissance (tableau 1) pendant 2 semaines. Changez le support tous les 4 jours.
- Pour préparer l’enrobage de collagène, dissoudre 100 mg de collagène dans 20 mL d’acide acétique 0,1 M. Le collagène prend du temps à se dissoudre, alors placez le mélange sur une plate-forme à bascule pendant la nuit à RT. Le lendemain, complétez avec 80 mL de ddH2O jusqu’à un volume final de 100 mL.
ATTENTION: L’acide acétique est toxique; poignée dans une hotte avec équipement de protection individuelle.
REMARQUE: Le collagène du revêtement en cuir de veau peut être réutilisé jusqu’à 5x. Conserver à 4 °C. - Enduire toute la surface du plat ou de la fiole de collagène, fermer et incuber pendant 20 min à RT à l’intérieur d’un flux laminaire. Après 20 min, récupérer le collagène dans un récipient frais, fermer le plat/ flacon vide et laisser reposer pendant 10 min à TA dans le flux laminaire.
- Transférer la boîte/fiole dans l’incubateur pour une incubation d’une nuit (ou au moins 6 h) (37 °C, 5 % de CO2). Laver 5x avec la solution saline tamponnée au phosphate de Dulbecco sans calcium ni magnésium (DPBS) avant de plaquer les cellules.
- Pour préparer l’enrobage de collagène, dissoudre 100 mg de collagène dans 20 mL d’acide acétique 0,1 M. Le collagène prend du temps à se dissoudre, alors placez le mélange sur une plate-forme à bascule pendant la nuit à RT. Le lendemain, complétez avec 80 mL de ddH2O jusqu’à un volume final de 100 mL.
- Après 14 jours, les FACS (tri des cellules activées par fluorescence) trient les MABs pour la phosphatase alcaline humaine17 , suivi d’une expansion supplémentaire. Maintenir les MAB sur des flacons T75 enrobés de collagène dans le milieu de croissance et changer le milieu de croissance tous les 2 jours (10 ml par flacon).
- Cryoconservez, passez ou ensemencez des MABs dans des dispositifs lorsqu’ils atteignent 70% de confluence.
REMARQUE: Les MAB perdent leur potentiel myogénique en raison de fusions spontanées au contact de cellule à cellule. Assurez-vous de ne pas dépasser 70% de confluence lors de l’expansion des MABs. Une fiole T75 confluente à 70 % contient environ 600 000 à 800 000 cellules, qui peuvent être cryoconservées à 100 000 cellules par flacon. Chaque flacon peut ensuite être décongelé et ensemencé dans une fiole T75 pour expansion. - Pour passer les MABs, lavez-les doucement une fois avec 7 mL de DPBS puis incubez dans 7 mL de solution de dissociation MAB pendant 3 min à 37 °C dans 5% de CO2 pour dissocier les cellules.
- Neutraliser la solution de dissociation MAB avec 7 mL du milieu de croissance, gratter doucement les cellules et transférer la suspension cellulaire dans un tube centrifuge de 50 mL. Lavez doucement la fiole avec 5 mL supplémentaires du milieu de croissance pour recueillir les MAB potentiellement restants.
- Centrifuger la suspension cellulaire pendant 3 min à 300 x g, puis passer directement dans une nouvelle fiole T75 enrobée de collagène pour l’expansion, cryoconserver dans le remplacement du sérum knock-out avec 10% de DMSO ou compter pour ensemencer dans un dispositif microfluidique.
REMARQUE: Les passages sont effectués 1x-2x par semaine pour l’expansion cellulaire jusqu’à un nombre maximum de passage de 13. Lors de la dissociation, les MAB apparaissent sphériques et de grande forme lorsqu’ils sont examinés au microscope.
3. Préparation de dispositifs microfluidiques pré-assemblés - Jour 9
REMARQUE: Le protocole est adapté du protocole de dispositif neuronal du fabricant de dispositifs microfluidiques et a été ajusté pour l’utilisation de dispositifs pré-assemblés et en silicone. Ici, des dispositifs pré-assemblés sont utilisés pour l’immunocytochimie (ICC) et les enregistrements transitoires de calcium à cellules vivantes, tandis que les dispositifs en silicone sont utilisés pour la SEM. La chronologie du protocole suit la chronologie du protocole de différenciation des motoneurones.
- Préparez les dispositifs microfluidiques la veille de l’ensemencement des cellules, car l’enrobage doit incuber pendant la nuit. Selon le protocole des motoneurones, ce sera un mercredi. Ajouter ~10 mL d’éthanol à 70% à 100% dans une boîte de Petri de 10 cm. Utilisez des pinces pour transférer l’appareil du conteneur d’expédition à la boîte de Pétri pour la stérilisation.
- Immergez l’appareil dans de l’éthanol pendant 10 s et transférez l’appareil avec des pinces sur un morceau de papier pour sécher à l’air dans le flux laminaire pendant environ 30 minutes. Retournez l’appareil plusieurs fois pour permettre aux deux côtés de sécher. Lorsque l’appareil est sec, utilisez des pinces pour déplacer chaque appareil vers une boîte de Petri individuelle de 10 cm pour une manipulation facile.
ATTENTION : L’éthanol est toxique; poignée dans une hotte avec équipement de protection individuelle - Enduire l’appareil de Poly-L-ornithine (PLO) (100 μg/mL) dans du DPBS et incuber à 37 °C, 5 % de CO2 pendant 3 h.
- Utilisez une pipette P200 pour ajouter 100 μL de PLO dans le DPBS dans un puits supérieur aussi près que possible de l’ouverture du canal et observez le fluide passer du puits supérieur à travers le canal vers le puits inférieur. Par la suite, ajoutez 100 μL de PLO dans le puits de DPBS au fond.
- Répétez l’opération de l’autre côté des microgrooves et terminez en ajoutant 100 μL d’un côté de l’appareil pour créer un gradient de volume entre les deux côtés en miroir de l’appareil pour recouvrir les microgrooves (par exemple, côté droit 200 μL, côté gauche 300 μL). Après 3 h, lavez l’appareil 3x pendant 5 min avec DPBS. Utilisez un système d’aspiration si nécessaire.
REMARQUE: Assurez-vous d’éviter toute formation de bulles d’air dans les canaux à tout moment pendant le revêtement ou la culture des cellules. Même de petites bulles se dilatent sur une courte période, inhibant ainsi le revêtement, l’ensemencement cellulaire ou le flux de média à travers le canal. Si le fluide s’arrête dans le canal pendant le revêtement, remettez en suspension la solution de PLO directement dans le canal des deux côtés. Si des bulles sont toujours présentes, utilisez 200 μL de DPBS pour rincer le canal et répétez le processus de revêtement comme indiqué ci-dessus aux étapes 3.3.1 à 3.3.2. Si des bulles apparaissent après l’ensemencement des cellules, il est impossible de récupérer l’appareil, car le rinçage du canal endommagera les cellules.
- Enduire l’appareil de laminine (20 μg/mL) dans un milieu neurobasal et incuber pendant la nuit à 37 °C, soit 5 % de CO2. Suivez les mêmes instructions pour le revêtement PLO des étapes 3.3.1-3.3.2.
- Le lendemain, utilisez une pipette P200 et placez la pointe dans le puits opposé à l’ouverture du canal pour enlever le revêtement de laminine des puits. Ajouter DPBS à tous les puits et laisser les appareils avec DPBS dans le flux laminaire à RT pour l’ensemencement cellulaire.
REMARQUE: À partir de ce moment, il est important de ne pas éliminer le liquide (revêtement de laminine, DPBS, média, solution de fixation, etc.) directement des canaux, car cela pourrait provoquer la formation de bulles d’air. Inspectez toujours les appareils au microscope avant d’ensemencer les cellules.
4. Préparation de dispositifs microfluidiques en silicone - Jour 9
- Préparez les dispositifs microfluidiques en silicone la veille de l’ensemencement des cellules, car le revêtement doit incuber pendant la nuit. Selon le protocole des motoneurones, ce sera un mercredi.
- Ajouter ~10 mL d’éthanol à 70% à 100% dans une boîte de Petri de 10 cm. Utilisez une pince pour transférer l’appareil du conteneur d’expédition à la boîte de Pétri pour la stérilisation. Immergez l’appareil dans de l’éthanol pendant 10 s et transférez-le avec une pince dans un puits dans une plaque de 6 puits pour sécher à l’air dans le flux laminaire pendant environ 30 min. Placez l’appareil sur le côté pour permettre à tous les côtés de sécher.
- Coupez les feuilles SEM à la taille de l’appareil (laissez quelques mm de chaque côté). Répétez la stérilisation comme indiqué ci-dessus à l’étape 4.1.1. Ensuite, transférer avec une pince dans une boîte de Petri de 10 cm pour sécher. Deux-trois feuilles SEM tiendront dans un plat.
- Enduire les appareils et les feuilles SEM de PLO (100 μg/mL) dans du DPBS et incuber à 37 °C, 5% de CO2 pendant 3 h.
- Ajouter 1 mL de PLO en DPBS par puits à chaque appareil dans la plaque de 6 puits. Assurez-vous que l’appareil flotte sur le dessus de la solution PLO avec le canal et le côté microgroove orientés vers le bas dans le liquide. Ajouter 10 mL de PLO dans le DPBS par boîte de Petri de 10 cm et utiliser des pinces pour pousser les feuilles SEM dans le liquide.
REMARQUE: Les feuilles SEM flottent généralement sur le dessus de la solution de revêtement. Avant d’assembler l’appareil et la feuille, tournez la feuille SEM de sorte que la surface, qui a été en contact avec le PLO, entre en contact avec le canal et la surface microgroove de l’appareil. - Après 3 h, laver l’appareil et les feuilles SEM 2x pendant 5 min avec DPBS suivi d’un autre lavage pendant 5 min avec de l’eau stérile. Utilisez un système d’aspiration si nécessaire. Transférez chaque feuille SEM dans une boîte de Petri individuelle de 10 cm pour une manipulation facile.
REMARQUE: Les appareils et les feuilles SEM doivent être complètement secs avant l’assemblage. Le lavage final à l’eau stérile élimine les cristaux de sel potentiels du DPBS, qui pourraient autrement inhiber l’assemblage.
- Ajouter 1 mL de PLO en DPBS par puits à chaque appareil dans la plaque de 6 puits. Assurez-vous que l’appareil flotte sur le dessus de la solution PLO avec le canal et le côté microgroove orientés vers le bas dans le liquide. Ajouter 10 mL de PLO dans le DPBS par boîte de Petri de 10 cm et utiliser des pinces pour pousser les feuilles SEM dans le liquide.
- Travailler au microscope dans un flux laminaire. Utilisez des pinces pour monter le dispositif en silicone avec le canal et le côté microgroove vers le bas à un angle de 90 ° sur la feuille SEM, en veillant à ce que tous les côtés soient alignés. Appuyez légèrement sur l’appareil pour vous assurer de sceller non seulement les bords extérieurs, mais aussi autour des puits, des canaux et des microgrooves.
REMARQUE: Les zones collées apparaîtront grises, tandis que celles qui ne sont pas encore montées apparaîtront claires au microscope. Assurez-vous que toutes les zones sont bien scellées sans bulles d’air pour éviter le détachement de l’appareil pendant la culture. En cas de débris ou de cristaux de sel bloquant le montage, lavez à nouveau la feuille SEM et l’appareil dans de l’eau stérile et séchez-le avant de réessayer la procédure de montage. Si les microgrooves semblent déformés par une pression trop forte sur l’appareil, retirez complètement l’appareil de la feuille SEM et réessayez le montage. Soyez prudent lorsque vous recouvrez et changez de support une fois l’appareil monté. - Travailler au microscope dans un flux laminaire. Enduire l’appareil de laminine (20 μg/mL) dans un milieu neurobasal et incuber pendant la nuit à 37 °C, soit 5 % de CO2.
REMARQUE: L’incubation pendant la nuit durcit le dispositif en silicone et le scelle davantage sur la feuille SEM.- Utilisez une pipette P200 pour ajouter 100 μL de la solution de laminine dans un puits supérieur aussi près que possible de l’ouverture du canal et observez le fluide passer du puits supérieur à travers le canal vers le puits inférieur. Vérifiez s’il y a des fuites autour du puits et du canal.
- Par la suite, ajoutez 100 μL de solution de laminine au puits inférieur et vérifiez les fuites. Répétez l’opération de l’autre côté des microgrooves et terminez avec 100 μL supplémentaires d’un côté de l’appareil pour créer un gradient de volume entre les deux côtés en miroir de l’appareil pour recouvrir les microgrooves (par exemple, côté droit 200 μL, côté gauche 300 μL).
REMARQUE: En cas de fuite, retirez le revêtement de laminine, démontez l’appareil et les feuilles SEM et lavez les deux à l’eau stérile. Laissez-les sécher et répétez à partir de l’étape 4.3. - Le lendemain, retirez le revêtement des puits avec une pipette P200 en positionnant la pointe dans le puits en face de l’ouverture du canal. Ajouter DPBS à tous les puits et laisser les appareils avec DPBS dans le flux laminaire à RT pour l’ensemencement cellulaire.
REMARQUE: À partir de ce moment, ne retirez pas le liquide (revêtement de laminine, DPBS, média, solution de fixation, etc.) directement des canaux, car cela pourrait provoquer la formation de bulles d’air. Inspectez toujours les appareils au microscope avant d’ensemencer les cellules.
5. Placage des PNJ dans les dispositifs microfluidiques - Jour 10
REMARQUE: Selon le protocole de différenciation des motoneurones15, le placage des PNJ du jour 10 a lieu un jeudi.
- Utiliser des PNJ du jour 10 fraîchement dissociés15, ou décongeler 1 à 2 flacons de NPC en banque par 10 mL de milieu motoneurone du jour 10 (tableau 2 et tableau 3) avec une solution d’inhibiteur de ROCK (10 μL/mL), et centrifuger la suspension cellulaire à 100 x g pendant 4 min.
- Remettre en suspension la pastille cellulaire dans 500-1000 μL de milieu motoneurone du jour 10 avec une solution inhibitrice de ROCK (10 μL / mL) et compter les cellules vivantes en utilisant n’importe quelle méthode de comptage préférée.
REMARQUE: Comme indiqué ci-dessous, assurez-vous de remettre en suspension les PNJ dans la bonne quantité de support pour accueillir un volume d’ensemencement optimal. - Retirez le DPBS de deux puits d’un côté des microgrooves de l’appareil à l’aide d’une pipette P200 et ensemencez 250 000 PNJ par appareil dans 60 à 100 μL de milieux de motoneurones du jour 10.
- Dans le puits supérieur droit, ensemencez 30 à 50 μL de la suspension cellulaire (125 000 cellules) près de l’ouverture du canal à un angle de 45 ° et faites glisser doucement le liquide restant le long du plancher du puits vers le centre du puits avec la pointe de la pipette.
- Faites une pause de quelques secondes pour permettre à la suspension cellulaire de circuler dans le canal avant de répéter cela dans le puits inférieur (125 000 cellules dans 30-50 μL). Utilisez un stylo pour marquer le côté ensemencé « NPC » ou équivalent pour une orientation facile de l’appareil sans microscope.
- Incuber l’appareil à 37 °C, 5 % de CO2 pendant 5 min pour permettre la fixation cellulaire avant de remplir les puits à deux graines avec un milieu motoneurone supplémentaire de jour 10 (total 200 μL/puits) et incuber à nouveau à 37 °C, 5 % de CO2.
REMARQUE: Chaque puits peut contenir 200 μL. L’ensemencement des cellules dans les puits et les canaux assure une structure robuste de la culture, réduisant ainsi le risque de détachement cellulaire lors des changements de milieu. Il est possible d’ensemencer moins de cellules dans le seul canal. Cependant, cela rendra la culture plus sensible au courant de volume à travers les canaux lors de chaque changement de support.
- Utilisez une pipette P200 pour retirer le DPBS des deux puits de l’autre côté des microgrooves en face des PNJ fraîchement ensemencés. Ajouter 200 μL/puits du milieu des motoneurones du jour 10 et attendre quelques secondes entre le puits supérieur et le puits inférieur pour permettre au milieu de circuler dans le canal. Ensuite, ajoutez 6 mL de DPBS par plat de 10 cm autour de l’appareil pour éviter l’évaporation du milieu pendant l’incubation.
REMARQUE: Ajoutez des DPBS supplémentaires autour de l’appareil pendant la période de culture si nécessaire. - Effectuer un changement complet du milieu du motoneurone dans les deux compartiments de l’appareil le jour 11 (vendredi), le jour 14 (lundi) et le jour 16 (mercredi) (tableau 2 et tableau 3). Ajoutez de nouveaux suppléments de médias le jour du changement de support.
REMARQUE: À partir de ce moment, effectuez tous les changements de milieu avec une pipette P200. Placez toujours l’embout de la pipette loin du canal au bord du puits et n’retirez pas le liquide directement du canal. Veillez à ne pas détacher les appareils en silicone. Le retrait et l’ajout de milieu doivent être effectués lentement pour éviter le détachement cellulaire.- Retirez soigneusement tous les supports dans les deux puits avec des PNJ en positionnant l’extrémité de la pipette P200 sur le bord inférieur de la paroi du puits en face de l’ouverture du canal. Ajoutez lentement 50 à 100 μL de milieu motoneurone frais au puits supérieur en positionnant l’extrémité de la pipette P200 sur le bord supérieur de la paroi du puits en face de l’ouverture du canal.
- Faites une pause de quelques secondes pour permettre au milieu de circuler dans le canal avant d’ajouter 50 à 100 μL de milieu motoneurone au puits inférieur. Répétez soigneusement ce processus jusqu’à ce que les deux puits contiennent 200 μL/puits. Répétez sur le côté sans cellules.
6. Placage du MAB dans des dispositifs microfluidiques - Jour 17
- Environ 7 jours avant l’ensemencement des MABs dans les dispositifs microfluidiques (jour 10 de la différenciation des motoneurones), décongeler les MAB et les ensemencer dans le milieu de croissance (tableau 1) dans une fiole T75 recouverte de collagène pour permettre une expansion cellulaire suffisante. Voir la section 2.
- Au jour 17 de la différenciation des motoneurones (jeudi), dissociez les MAB comme expliqué à l’étape 2.4, remettez en suspension la pastille cellulaire dans environ 500 μL de milieu de croissance et comptez les cellules vivantes en utilisant n’importe quelle méthode de comptage préférée.
REMARQUE: Comme indiqué ci-dessous, assurez-vous de remettre en suspension les MABs dans la bonne quantité de support pour accueillir un volume d’ensemencement optimal. - Retirez le milieu du motoneurone du côté non ensemencé des microgrooves de l’appareil à l’aide d’une pipette P200, lavez doucement avec du DPBS et ensemencez 200 000 MABs par appareil dans 60 à 100 μL de milieu de croissance.
- Dans le puits supérieur droit, ensemencez 30 à 50 μL de suspension cellulaire (100 000 cellules) près de l’ouverture du canal à un angle de 45 ° et faites glisser doucement le liquide restant le long du plancher du puits vers le centre du puits avec la pointe de la pipette. Faites une pause de quelques secondes pour permettre le flux des cellules à travers le canal avant de répéter dans le puits inférieur (100 000 cellules dans 30-50 μL).
- Incuber l’appareil à 37 °C, 5 % de CO2 pendant 5 min pour permettre la fixation des cellules avant de remplir les deux puits fraîchement ensemencés de MAB avec un milieu de croissance supplémentaire (total 200 μL/puits). Incuber à nouveau à 37 °C, 5 % de CO2.
REMARQUE: Aucun changement de milieu n’est nécessaire le jour 17 du côté des motoneurones de l’appareil. Le changement de milieu du jour 17 selon la méthode de différenciation des motoneurones publiée précédemment15 est plutôt effectué le jour 18 (vendredi).
7. Mise en place d’un gradient volumétrique et chimiotactique pour favoriser la croissance des neurites des motoneurones vers le compartiment MAB
- Le jour 18, effectuez un changement de milieu complet du côté du motoneurone avec le milieu du motoneurone du jour 18 (200 μL / puits). Suivez les instructions pour les modifications moyennes mentionnées aux étapes 5.5.1 à 5.5.2. Initier la différenciation MAB dans le compartiment MAB de l’appareil (Tableau 2 et Tableau 4).
- Laver soigneusement les compartiments MAB une fois avec du DPBS avant d’ajouter un milieu de différenciation MAB préchauffé (tableau 4) complété par 0,01 μg/mL d’agrin humain (200 μL/puits).
REMARQUE: Les MAB fusionnent et forment des myotubes multinucléés au cours d’une semaine.
- Laver soigneusement les compartiments MAB une fois avec du DPBS avant d’ajouter un milieu de différenciation MAB préchauffé (tableau 4) complété par 0,01 μg/mL d’agrin humain (200 μL/puits).
- Le jour 21, selon le protocole de différenciation des motoneurones (lundi), initier le gradient chimiotactique et volumétrique (tableau 2 et tableau 3).
- Ajouter 200 μL/puits de milieu basal de motoneurone avec 30 ng/mL de facteur neurotrophique dérivé du cerveau (BDNF), de facteur neurotrophique dérivé de la lignée cellulaire gliale (GDNF) et de facteur neurotrophique ciliaire (CNTF), d’agrin humain (0,01 μg/mL) et de laminine (20 μg/mL) au compartiment myotube (précédemment défini comme le compartiment MAB). Ajouter le milieu basal du motoneurone (100 μL/puits) sans facteurs de croissance au compartiment du motoneurone.
- Répétez l’étape 7.2 tous les deux jours jusqu’au jour 28 de la différenciation des motoneurones. Aucun changement de média n’est nécessaire pendant les week-ends.
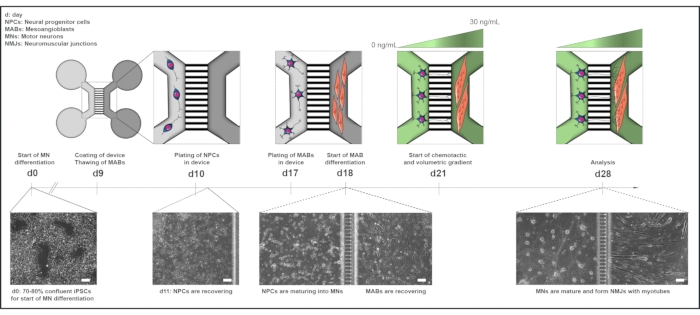
Figure 1 : Vue d’ensemble schématique du protocole de l’unité motrice dans les dispositifs microfluidiques. Chronologie de la différenciation et vue d’ensemble de la co-culture du jour 0 au jour 28 selon la chronologie du protocole de différenciation des motoneurones22. La différenciation des motoneurones par rapport aux CSPi est initiée au jour 0 et effectuée comme indiqué précédemment pendant les 10 jours suivants15. Le jour 9, l’appareil est stérilisé et enduit de PLO-laminine. Les MAB sont décongelés pour être agrandis dans des flacons T75. Le jour 10, les motoneurones-PNJ sont plaqués dans les deux puits et dans le canal d’un compartiment (gris clair) de l’appareil, où leur différenciation en motoneurones se poursuit pendant une semaine. Les MAB sont plaqués dans les deux puits et dans le canal du compartiment opposé (gris foncé) le jour 17. Le jour 18, la différenciation des MABs en myotubes est commencée. Le jour 21, un gradient volumétrique et chimiotactique est établi pour favoriser la polarisation motoneurone-neurite à travers les microgrooves de l’appareil. Le compartiment des motoneurones a reçu 100 μL/puits de milieu basal du motoneurone sans facteurs de croissance (compartiment vert clair), tandis que le compartiment des myotubes a reçu 200 μL/puits de milieu basal du motoneurone avec 30 ng/mL de facteurs de croissance (compartiment vert foncé) (tableau 2 et tableau 3). La culture est poursuivie avec le gradient volumétrique et chimiotactique pendant 7 jours supplémentaires jusqu’à l’analyse au jour 28. Les images en champ lumineux montrent la morphologie cellulaire au jour 0, au jour 11, au jour 18 et au jour 28 cultivées dans des dispositifs microfluidiques pré-assemblés. Barre d’échelle, 100 μm. Ce chiffre a été modifié à partir de Stoklund Dittlau, K. et al.18. Les illustrations de cellules ont été modifiées à partir de Smart Server medical Art22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
8. Fixation et ICC
REMARQUE: Toutes les étapes doivent être effectuées avec soin pour éviter le détachement des cultures neuronales. Ne retirez pas le liquide des canaux au cours des étapes suivantes.
- Effectuer la fixation dans une hotte ou un flux laminaire: Lavez soigneusement tous les puits de l’appareil une fois avec DPBS avant la fixation. Fixer à l’aide de 4 % de paraformaldéhyde (PFA) dans le DPBS pendant 15 à 20 min à RT dans le flux laminaire (100 μL/puits).
ATTENTION : Le PFA est toxique : manipuler une hotte avec un équipement de protection individuelle.- Ajoutez soigneusement 100 μL au puits supérieur de l’appareil et attendez quelques secondes pour permettre à la solution de fixation de circuler dans le canal avant d’ajouter 100 μL au puits inférieur. Répétez de l’autre côté. Après l’incubation, retirer la solution de PFA et laver doucement 3x pendant 5 min avec du DPBS. Laisser dans 200 μL/puits DPBS pour le stockage et sceller la boîte de Pétri de 10 cm avec un parafilm pour conserver à 4 °C jusqu’à l’expérience ICC.
REMARQUE: Assurez-vous que les appareils ne sèchent pas pendant le stockage.
- Ajoutez soigneusement 100 μL au puits supérieur de l’appareil et attendez quelques secondes pour permettre à la solution de fixation de circuler dans le canal avant d’ajouter 100 μL au puits inférieur. Répétez de l’autre côté. Après l’incubation, retirer la solution de PFA et laver doucement 3x pendant 5 min avec du DPBS. Laisser dans 200 μL/puits DPBS pour le stockage et sceller la boîte de Pétri de 10 cm avec un parafilm pour conserver à 4 °C jusqu’à l’expérience ICC.
- Incuber les cellules avec une solution de perméabilisation (100 μL/puits) de Triton X-100 à 0,1 % dans du DPBS pendant 20 min à TA le jour 1 de la procédure ICC. Retirer la solution de perméabilisation et ajouter 5 % de sérum d’âne normal dans une solution de Triton X-100/DPBS à 0,1 % (100 μL/puits) pendant 30 min à TA.
- Retirer la solution normale de sérum d’âne à 5 % et incuber les dispositifs avec des anticorps primaires (table des matières) dans du sérum d’âne normal à 2 % dans une solution de Triton X-100/DPBS à 0,1 % et incuber à 4 °C pendant la nuit.
- Implémentez un dégradé de volume. Ajouter 100 μL/puits de solution d’anticorps d’un côté des microgrooves et 150 μL/puits de l’autre (500 μL au total par dispositif).
REMARQUE: Il est possible d’utiliser différents anticorps de chaque côté des microgrooves. Dans ce cas, ne mettez pas en œuvre un gradient de volume avec des anticorps primaires ou secondaires à travers les microgrooves pour maintenir l’isolement fluidique entre les compartiments. Les neurites dans les microgrooves ne seront pas colorées sans le gradient.
- Implémentez un dégradé de volume. Ajouter 100 μL/puits de solution d’anticorps d’un côté des microgrooves et 150 μL/puits de l’autre (500 μL au total par dispositif).
- Le lendemain (jour 2 de la procédure ICC), retirez les anticorps primaires et lavez soigneusement l’appareil 3x pendant 5 min avec une solution de Triton X-100/DPBS à 0,1%.
REMARQUE: Dans les cultures facilement détachables, le lavage 3x pendant 5 min peut être remplacé par 1x pendant 30 min. - Travaillez désormais dans l’obscurité, car les anticorps secondaires (Table des matériaux) sont sensibles à la lumière. Incuber des cellules avec des anticorps secondaires dans du sérum d’âne normal à 2 % dans une solution de Triton X-100/DPBS à 0,1 % pendant 1 h à TA. Mettre en œuvre un gradient de volume comme indiqué à l’étape 8.3.1. Après l’incubation, retirez les anticorps secondaires et lavez 3x pendant 5 min avec du DPBS.
- Étiqueter l’ADN nucléaire avec DAPI dans DPBS (100 μL/puits) pendant 20 min à RT suivi d’un lavage de 3x-4x de 5 min avec une solution de Triton X-100/DPBS à 0,1 %. Retirez la solution Triton X-100/DPBS à 0,1 % de tous les puits et laissez la culture sécher pendant quelques secondes avant d’ajouter une goutte de support de montage fluorescent dans chaque puits pour sceller.
REMARQUE: Gardez les périphériques horizontaux pendant au moins 24 heures pour permettre au support de montage de se régler. Après 24 h, les appareils peuvent être rangés dans un étui à glissière à 4 °C. - Image en z-piles avec un microscope inversé.
- Pour imager les NMJ, utilisez un objectif 40x pour localiser les myotubes marqués d’un anticorps myotube (Table des matériaux) et effectuez des enregistrements z-stack pour assurer l’imagerie des tissus neuronaux et myotubes. Prenez plusieurs images au cas où le myotube serait trop grand pour tenir dans un seul cadre.
- Pour la quantification NMJ, comptez manuellement le nombre de colocalisations entre un marqueur présynaptique neuronal et un marqueur AChR à travers chaque pile z. Normalisez le nombre de colocalisations au nombre de myotubes présents dans la pile z.
9. Fixation et préparation de l’appareil pour SEM
REMARQUE: Lorsque vous changez de liquide, gardez toujours une petite quantité pour couvrir la culture afin d’éviter l’effondrement cellulaire. Ce protocole utilise des substances hautement toxiques et il est nécessaire de travailler avec un équipement de protection individuelle et dans une hotte pendant tout le processus.
- Fixation et démontage : Préparer du glutaraldéhyde (GA) frais à 2,5 % dans un tampon de cacodylate de sodium de 0,1 M (pH 7,6), filtrer avec un filtre de 0,2 μm et chauffer jusqu’à 37 °C.
ATTENTION : L’AG et le cacodylate de sodium sont toxiques : manipuler dans une hotte avec un équipement de protection individuelle.- Lavez soigneusement l’appareil une fois avec DPBS pour enlever le support et les débris cellulaires, puis préfixez avec la solution GA pendant 15 min à RT.
- Utilisez un scalpel pour couper soigneusement la feuille SEM au périmètre de l’appareil tout en stabilisant l’appareil avec des pinces. Assurez-vous de ne pas détacher l’appareil lors de la coupe. Déplacez l’appareil et la feuille SEM à l’aide d’une pince dans une boîte de Petri de 3 cm et placez la boîte de 3 cm dans une boîte de 10 cm pour une manipulation facile.
- Après 15 minutes de préfixation, retirez soigneusement l’appareil de la feuille SEM à l’aide d’une pince. Détachez l’appareil dans un coin et retirez-le lentement dans une direction diagonale vers le coin opposé. Observez les cellules se détacher de l’appareil.
- Ajouter une solution GA supplémentaire pour couvrir toute la feuille SEM dans le plat de 3 cm et poursuivre la fixation pendant un total de 2 h à RT ou pendant la nuit à 4 °C.
REMARQUE: Poussez doucement la feuille SEM sous la solution GA avec des pinces en évitant toute surface recouverte de cellules.
- Continuez avec un protocole standard pour SEM. En bref, incuber dans du tétroxyde d’osmium suivi d’une déshydratation avec une série graduée d’éthanol. Insérez une feuille SEM dans un support de couvercle pour le séchage des points critiques et montez-la sur des talons de support pour les autocollants et le revêtement en carbone. Utilisez un microscope électronique à balayage pour imager à une tension d’accélération de 5 kV et une distance de travail de 7 mm.
10. Évaluation de la fonctionnalité NMJ à l’aide de l’imagerie calcique des cellules vivantes
- Préparer les dispositifs : Rafraîchir le compartiment des myotubes avec 200 μL/puits du milieu basal des motoneurones du jour 18 avec 30 ng/mL de BDNF, de GDNF et de CNTF et le compartiment des motoneurones avec 200 μL/puits de milieu basal des motoneurones sans facteurs de croissance (tableaux 2 et 3).
- Ajouter le colorant Fluo-4 AM dilué dans un solvant colorant Fluo-4 dans le compartiment du myotube à une concentration finale de 5 μM et incuber le dispositif dans l’obscurité à 37 °C, 5 % de CO2 pendant 25 min. Pendant que l’appareil est en incubation, diluer le chlorure de potassium dans le milieu basal des motoneurones sans facteurs de croissance à une concentration finale de 450 mM.
REMARQUE: Fluo-4 AM est un indicateur de calcium, qui présente une augmentation de la fluorescence lors de la liaison au calcium. Travaillez dans l’obscurité à partir de maintenant, car le colorant est sensible à la lumière. - Après 25 min, rafraîchir le compartiment myotube avec 200 μL/puits du milieu basal du motoneurone jour 18 avec 30 ng/mL de BDNF, GDNF et CNTF et le compartiment motoneurone avec 100 μL/puits de milieu basal du motoneurone sans facteurs de croissance pour rétablir le gradient chimiotactique et volumétrique.
- Pour bloquer les NMJ, complétez le milieu du compartiment myotube avec 19 μM de l’antagoniste compétitif AChR, le chlorhydrate de tubocurarine pentahydraté.
ATTENTION: Le chlorhydrate de tubocurarine pentahydraté est toxique: manipuler dans une hotte avec un équipement de protection individuelle.
- Ajouter le colorant Fluo-4 AM dilué dans un solvant colorant Fluo-4 dans le compartiment du myotube à une concentration finale de 5 μM et incuber le dispositif dans l’obscurité à 37 °C, 5 % de CO2 pendant 25 min. Pendant que l’appareil est en incubation, diluer le chlorure de potassium dans le milieu basal des motoneurones sans facteurs de croissance à une concentration finale de 450 mM.
- Effectuez des enregistrements avec un microscope confocal inversé équipé d’un incubateur réglé à 37 °C, 5% de CO2.
- Avec un objectif 10x, utilisez le canal de champ lumineux pour localiser les myotubes dans le compartiment myotube. Ajustez la puissance, le gain et le décalage du laser pour le canal 488 à un niveau où la fluorescence Fluo-4 marque les myotubes individuels.
REMARQUE: Des résultats représentatifs ont été obtenus en ajustant les barres de défilement dans les paramètres A1 du logiciel à une puissance laser de 5%, un gain de 60 (HV) et un décalage de 0.
- Avec un objectif 10x, utilisez le canal de champ lumineux pour localiser les myotubes dans le compartiment myotube. Ajustez la puissance, le gain et le décalage du laser pour le canal 488 à un niveau où la fluorescence Fluo-4 marque les myotubes individuels.
- Réglez le temps d’enregistrement sur 1 min avec des intervalles de 1 s. Enregistrer pendant 5-10 s pour avoir une ligne de base, suivie de stimuler immédiatement les motoneurones avec la solution de chlorure de potassium.
- Après 5 à 10 s dans l’enregistrement, ajouter lentement 25 μL de solution de chlorure de potassium à un puits du compartiment des motoneurones pour atteindre une concentration finale de 50 mM.
REMARQUE: Évitez d’ajouter la solution de chlorure de potassium trop rapidement, car cela créerait une onde à travers le canal, provoquant des artefacts sur l’enregistrement.
- Après 5 à 10 s dans l’enregistrement, ajouter lentement 25 μL de solution de chlorure de potassium à un puits du compartiment des motoneurones pour atteindre une concentration finale de 50 mM.
- Enregistrer le compartiment du myotube avec une stimulation des motoneurones deux fois avec une pause de 2 minutes, suivie d’une stimulation directe avec une solution de chlorure de potassium de 25 μL du compartiment du myotube pour évaluer l’activité directe du myotube indépendamment de la dépolarisation des motoneurones.
- Pour les quantifications, encerclez chaque myotube manuellement avec le logiciel d’enregistrement et analysez l’intensité fluorescente Fluo-4 sur une période de 1 min. Pour déterminer l’augmentation de l’afflux de calcium, soustrayez la valeur de référence moyenne (c.-à-d. la moyenne des 10 premières secondes avant la stimulation du chlorure de potassium) de la valeur maximale après stimulation avec du chlorure de potassium. Les résultats représentatifs ont été obtenus à l’aide de l’outil de mesure du temps du logiciel.
Résultats
Génération de NMJ dans les dispositifs microfluidiques
Pour générer une unité motrice humaine avec des NMJ fonctionnels dans des dispositifs microfluidiques disponibles dans le commerce, des motoneurones humains dérivés de l’iPSC et des myotubes humains dérivés du MAB ont été utilisés. La qualité du matériau cellulaire de départ est importante, et en particulier la capacité de fusion des MABs en myotubes est cruciale pour un résultat réussi de ce protocole. Les MAB sont faciles à garder dans la culture. Cependant, il est important d’évaluer la capacité de fusion de chaque lot avant de les appliquer aux dispositifs microfluidiques (Figure supplémentaire 1A, B)18. Les lots qui ne présentent pas de formation de myotubes après 10 jours de différenciation ne doivent pas être utilisés. L’indice de fusion de la figure supplémentaire 1B a été déterminé en calculant le pourcentage de noyaux positifs dans les myotubes pour chaque marqueur myotube du nombre total de noyaux par image. Nous avons constaté qu’un indice de fusion d’environ 8 % était suffisant pour notre co-culture dans la génération de NMJ.
Il est toujours important de commencer une différenciation des motoneurones à partir d’une culture pure de CSPi. Plus l’entrée est pure, plus le résultat est pur. Le protocole de différenciation des motoneurones génère des cultures de motoneurones, qui sont généralement positives de 85 % à 95 % pour les marqueurs de motoneurones (Figure supplémentaire 1C, D)18. Les cellules restantes seront généralement des cellules précurseurs indifférenciées qui, dans certains cas, subiront une prolifération importante et auront donc un impact négatif sur la qualité de la culture. Pour obtenir le meilleur résultat de ce protocole, l’efficacité de la différenciation des motoneurones doit être évaluée avant d’appliquer le jour 10 des motoneurones-PNJ dans l’appareil. De plus, un contrôle de qualité des PNJ peut être effectué au jour 11 pour évaluer l’expression du marqueur PNJ Olig2 (Figure supplémentaire 1E,F).
Initialement, les motoneurones-PNJ et les MAB ont été plaqués au même moment le jour 10. Ici, la différenciation MAB a été initiée le jour 11. Le gradient de volume et de facteur de croissance mis en œuvre le jour 14 nous a permis d’évaluer la formation de NMJ au jour 21, raccourcissant ainsi le protocole d’une semaine. Fait intéressant, nous avons pu observer la formation caractéristique de NMJ par ICC (figure supplémentaire 2A). Cependant, nous n’avons pas été en mesure d’acquérir une sortie fonctionnelle via les enregistrements de calcium des cellules vivantes aussi tôt dans la différenciation des motoneurones (données non montrées). Nous avons conclu que les motoneurones n’étaient pas encore assez matures pour former des connexions NMJ fonctionnelles avec les myotubes, même si la morphologie NMJ semblait prometteuse. Ceci est conforme à nos observations précédentes selon lesquelles les potentiels d’action spontanée dans les motoneurones, enregistrés par une analyse électrophysiologique patch-clamp, ne se produisent qu’au jour 35 de la différenciation des motoneurones15.
De plus, nous avons tenté de prolonger la maturation des motoneurones, ainsi que la durabilité de la co-culture, en faisant mûrir les motoneurones dans l’appareil pendant 2 semaines (jour 24), avant de plaquer les MAB. Malheureusement, une grande quantité de croisement spontané motoneurone-neurite à travers des microgrooves a été observée, ce qui a entraîné l’inhibition de l’attachement MAB (figure supplémentaire 2B). En raison de l’absence de formation de myotubes dans le canal, nous n’avons pas réussi à identifier les NMJ au jour 36 et avons donc appliqué le protocole de 28 jours (Figure 1).
Identification, quantification et caractérisation morphologique des NMJ in vitro
Après avoir suivi le protocole de 28 jours (Figure 1), des NMJ pleinement fonctionnels ont pu être obtenus. Tant in vivo qu’in vitro, les NMJ sont caractérisés immunohisto- ou immunocytochimiquement par la colocalisation d’un marqueur présynaptique et d’un marqueur postsynaptique. Dans cette étude, une combinaison de chaîne lourde de neurofilaments (NEFH) et de SYP en tant que combinaison de marqueurs présynaptiques a été utilisée, ce qui a permis le suivi d’une seule neurite du soma du motoneurone vers le processus le plus distal. Du côté musculaire, btx est largement utilisé comme marqueur postsynaptique pour les AChR, et a également été utilisé dans cette étude. La supplémentation en agrin et en laminine favorise le regroupement des AChR au sarcolemma19,20,21, ce qui facilite l’identification des AChR in vitro et augmente également le nombre d’AChR et de NMJ présents18.
Afin de localiser et de calculer les NMJ de manière impartiale, chaque myotube est identifié par la positivité de la chaîne lourde de myosine (MyHC) et imagé dans des piles z à un grossissement de 40x à l’aide d’un microscope confocal inversé. Pour les myotubes très longs, plusieurs piles z ont été acquises. Pour l’analyse d’images, le nombre de colocalisations entre NEFH/SYP et Btx est compté manuellement dans chaque pile z, et le nombre de colocalisations est normalisé au nombre de myotubes présents dans la pile z (Figure 2A-C)18. Tous les myotubes n’auront pas de NMJ, comme le montre la quantification des myotubes innervés (Figure 2D). Par conséquent, il est important d’effectuer une approche d’enregistrement impartiale, où tous les myotubes sont imagés, indépendamment de la présence de Btx.
Il est possible d’identifier deux types de morphologies dans ce système in vitro . Les NMJ apparaissent soit comme des NMJ à point de contact unique, où une neurite touche un groupe d’AChR à un point d’interaction, soit comme des NMJ à point de contact multiple, où une neurite se déploiera et s’engagera avec le cluster AChR sur une plus grande surface. Ces deux morphologies peuvent être identifiées à la fois immunocytochimiquement (Figure 2A)18 et avec SEM (Figure 2B)18, et peuvent également être quantifiées (Figure 2C)18. Dans l’ensemble, les points de contact multiples facilitent une connexion plus large grâce à un grand ancrage musculaire, ce qui indique une formation NMJ plus mature. En revanche, les NMJ à point de contact unique sont considérés comme moins matures en raison de l’état de développement précoce de la culture.
Évaluation fonctionnelle des NMJ in vitro
Pour évaluer la fonctionnalité des NMJ, des enregistrements transitoires de calcium sur cellules vivantes ont été utilisés (Figure 3)18. Tirant parti du système isolé fluidement des dispositifs microfluidiques, le côté soma du motoneurone a été stimulé avec une concentration élevée (50 mM) de chlorure de potassium tout en enregistrant simultanément un afflux de calcium dans les myotubes, qui étaient chargés avec le colorant Fluo-4 sensible au calcium (Figure 3A). Presque immédiatement après l’activation des motoneurones, nous avons pu observer un afflux de calcium dans les myotubes par une formation d’onde caractéristique, qui confirme une connexion fonctionnelle à travers le motoneurone-neurite et le myotube (Figure 3A-C)18. Aucune onde de calcium spontanée ni contraction spontanée des myotubes n’a été observée, bien qu’une contraction des myotubes lors d’une stimulation directe avec du chlorure de potassium ait été observée. La spécificité de la connexion a été confirmée par l’ajout de l’antagoniste compétitif de l’AChR, le chlorhydrate de tubocurarine pentahydraté (DTC) au compartiment myotube (Figure 3A), ce qui a entraîné une inhibition de l’afflux de calcium (Figure 3C). Cet effet a confirmé que la connexion entre les motoneurones et les myotubes a donné lieu à des NMJ pleinement fonctionnels. Pour évaluer le nombre de myotubes actifs par stimulation NMJ, le compartiment myotube a été stimulé directement avec du chlorure de potassium pour identifier le nombre total de myotubes actifs dans ce compartiment. Environ 70 % des myotubes étaient actifs par activation stimulée par les motoneurones avec du chlorure de potassium (figure 3D)18.
Ces résultats confirment la formation, le nombre, la morphologie et la fonctionnalité optimaux de NMJ grâce à la co-culture des motoneurones dérivés de l’iPSC et des myotubes dérivés du MAB au cours d’un protocole de 28 jours.
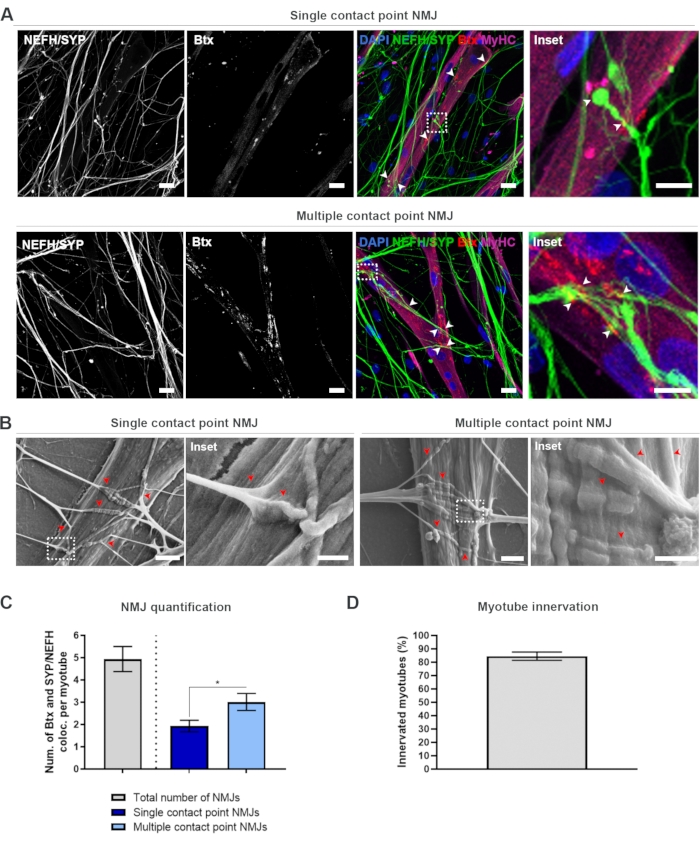
Figure 2: Formation de NMJ dans des dispositifs microfluidiques. (A) Micrographies confocales de la formation de NMJ dans des dispositifs microfluidiques pré-assemblés au jour 28. Les NMJ sont identifiés par la colocalisation (pointes de flèche) de marqueurs présynaptiques (NEFH et SYP) et de marqueurs AChR postsynaptiques (Btx) sur des myotubes colorés par MyHC. Les NMJ sont identifiés morphologiquement par la formation de points de contact uniques ou multiples entre les neurites et les amas AChR. Noyaux d’étiquette DAPI. Barre d’échelle, 25 μm. L’encart montre un grossissement d’un NMJ. Barre d’échelle encastrée, 10 μm. (B) SEM de morphologie NMJ dans des dispositifs microfluidiques en silicone au jour 28. Les pointes de flèche représentent l’encastrement de neurite dans le myotube. Barre d’échelle, 2 μm. L’encart montre un grossissement de NMJ. Barre d’échelle en médaillon, 1 μm. (C) Quantification du nombre total de NMJ par myotube ainsi que du nombre de NMJ à point de contact unique et multiple par myotube. Le graphique est représenté comme moyenne ±'erreur-type de la moyenne de quatre répliques biologiques. La signification statistique est déterminée avec le test de Mann-Whitney avec * p < 0,05. (D) Quantification du pourcentage de myotubes innervés. Le graphique est représenté comme moyenne ±'erreur-type de la moyenne de quatre répliques biologiques. Ce chiffre a été modifié à partir de Stoklund Dittlau, K. et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
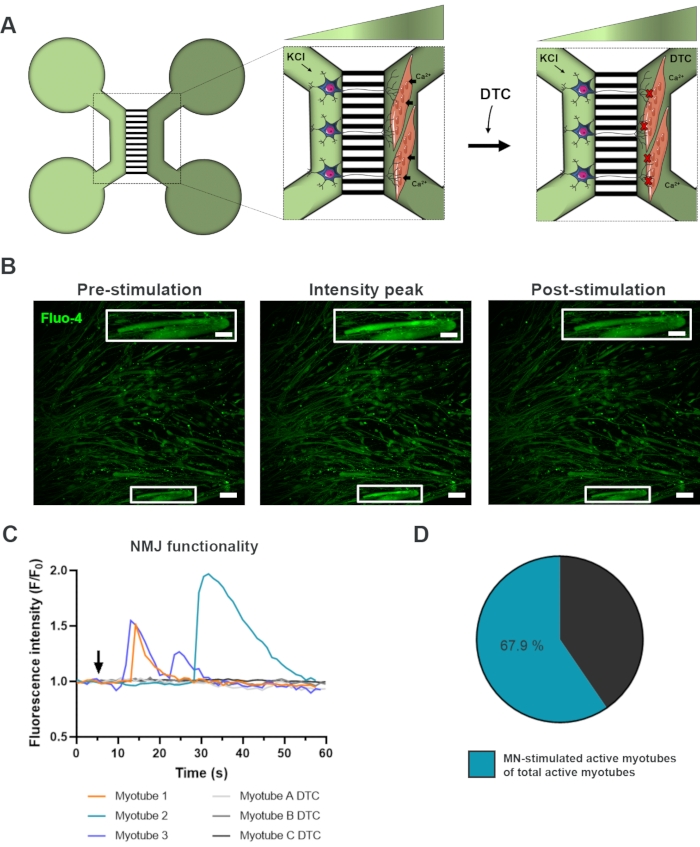
Figure 3 : Confirmation de la fonctionnalité NMJ. (A) Illustration schématique des enregistrements de calcium transitoire sur cellules vivantes de la fonctionnalité NMJ dans des dispositifs microfluidiques pré-assemblés au jour 28 avant et après le blocage nmJ avec la tubocurarine (DTC)22. Les motoneurones dans le compartiment vert clair sont stimulés avec 50 mM de chlorure de potassium (KCl), ce qui provoque une réponse intracellulaire des motoneurones à travers les neurites. Cela évoque un afflux de calcium (Ca2+) dans les myotubes, qui sont marqués avec un colorant Fluo-4 sensible au calcium (compartiment vert foncé). (B) Micrographies de fluorescence Fluo-4 de pré-stimulation, pic d’intensité et post-stimulation d’un myotube représentant une onde d’augmentation intracellulaire du calcium lors de la stimulation des motoneurones avec KCl. L’encadré montre un grossissement d’un myotube actif innervé. Barres d’échelle, 100 μm. Barre d’échelle en médaillon, 200 μm. (C) Courbes représentatives de l’afflux de calcium dans les myotubes après stimulation des motoneurones avec KCl (flèche) confirmant la fonctionnalité NMJ. Les myotubes 1 à 3 présentent des courbes de calcium caractéristiques par innervation motoneurone-myotube, tandis que le myotube A-C DTC représente des courbes après le blocage NMJ avec DTC. (D) Rapport des myotubes actifs stimulés par les motoneurones sur le nombre total de myotubes actifs. Ce chiffre a été modifié à partir de Stoklund Dittlau, K. et al.18. Les illustrations de cellules ont été modifiées à partir de Smart Server medical Art22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Vérification des motoneurones, indice de fusion MAB et contrôle de la qualité des PNJ. (A) Images confocales de myotubes dérivés du MAB 10 jours après le début de la différenciation. Les myotubes sont marqués avec des marqueurs myotubes: desmine, MyHC, myogénine (MyoG) et titine. Les noyaux sont colorés avec DAPI. Barre d’échelle, 100 μm. (B) Quantification de l’indice de fusion MAB 10 jours après le début de la différenciation. Après la famine, les MAB fusionnent en myotubes multinucléés, qui ont été quantifiés pour la positivité des marqueurs myotubes (AB +). Le graphique représente la moyenne ±'erreur-type de la moyenne de trois réplicats biologiques. (C) Images confocales de motoneurones dérivés de l’iPSC au jour 28 de différenciation, qui sont marqués avec des marqueurs de motoneurones NEFH, choline acétyltransférase (ChAT) et Islet-1 en plus du marqueur panneuro neuronal βIII-tubuline (tubuline). Les noyaux sont colorés avec DAPI. Barres d’échelle, 75 μm. (D) Quantification du nombre de cellules, qui sont positives pour les motoneurones et les marqueurs pan-neuronaux (AB+). Le graphique représente la moyenne ±'erreur-type de la moyenne de trois réplicats biologiques. (E) Images confocales de PNJ dérivés de l’iPSC au jour 11 de la différenciation des motoneurones, qui sont marquées avec le marqueur NPC Olig2 et le marqueur pan-neuronal βIII-tubuline (tubuline). Les noyaux sont colorés avec DAPI. Barres d’échelle, 50 μm. (F) Quantification du nombre de PNJ positifs pour Olig2 et βIII-tubuline (AB+). Le graphique représente la moyenne ±'erreur-type de la moyenne de trois réplicats biologiques. Ce chiffre a été modifié à partir de Stoklund Dittlau, K. et al.18. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Optimisation du protocole de co-culture (A) Images confocales de la formation de NMJ au jour 21 de la différenciation des motoneurones, lorsque les MAB sont ensemencés en même temps que les PNJ au jour 10. Les NMJ sont identifiés par la colocalisation (pointes de flèche) de marqueurs présynaptiques (NEFH et SYP) et de marqueurs AChR postsynaptiques (Btx) sur des myotubes colorés par MyHC. Barre d’échelle (à gauche), 10 μm. Barre d’échelle (droite), 5 μm. (B) Image en champ lumineux du canal myotube au jour 24 représentant un croisement spontané motoneurone-neurite inhibant la fixation des MABs. Barre d’échelle, 100 μm. Veuillez cliquer ici pour télécharger ce fichier.
| Réactif | Concentration des stocks | Concentration finale |
| ImDM | 1x | 80% |
| Sérum bovin fœtal | 15% | |
| Pénicilline/streptomycine | 5000 U/mL | 0.5% |
| L-glutamine | 50x | 1% |
| Pyruvate de sodium | 100 mM | 1% |
| Acides aminés non essentiels | 100x | 1% |
| Insuline transferrine sélénium | 100x | 1% |
| bFGF (ajouté frais) | 50 μg/mL | 5 ng/mL |
Tableau 1 : Moyenne de croissance du MAB. Le milieu peut durer 2 semaines à 4 °C. bFGF est ajouté frais le jour de l’utilisation.
| Réactif | Concentration des stocks | Concentration finale |
| DMEM/F12 | 50% | |
| Milieu neurobasal | 50% | |
| Pénicilline/streptomycine | 5000 U/mL | 1% |
| L-glutamine | 50x | 0.5 % |
| Supplément N-2 | 100x | 1% |
| B-27 sans vitamine A | 50x | 2% |
| β-mercaptoéthanol | 50 mM | 0.1% |
| Acide ascorbique | 200 μM | 0,5 μM |
Tableau 2 : Milieu basal du motoneurone. Le milieu peut durer 4 semaines à 4 °C.
| Jour | Réactif | Concentration des stocks | Concentration finale | Compartiment |
| Jour 10/11 | Agoniste lissé | 10 mM | 500 nM | Les deux |
| Acide rétinoïque | 1 mM | 0,1 μM | ||
| Le | 100 mM | 10 μM | ||
| BdNF | 0,1 mg/mL | 10 ng/mL | ||
| Le GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Jour 14 | Le | 100 mM | 20 μM | Les deux |
| BdNF | 0,1 mg/mL | 10 ng/mL | ||
| Le GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Jour 16 | Le | 100 mM | 20 μM | Les deux |
| BdNF | 0,1 mg/mL | 10 ng/mL | ||
| Le GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Le | 0,1 mg/mL | 10 ng/mL | ||
| Jour 18 | BdNF | 0,1 mg/mL | 10 ng/mL | Motoneurone |
| Le GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Le | 0,1 mg/mL | 10 ng/mL | ||
| Jour 21+ | BdNF | 0,1 mg/mL | 30 ng/mL | Myotube |
| Le GDNF | 0,1 mg/mL | 30 ng/mL | ||
| Le | 0,1 mg/mL | 30 ng/mL | ||
| Agrin | 50 μg/mL | 0,01 μg/mL | ||
| Laminine | 1 mg/mL | 20 μg/mL | ||
| Jour 21+ | Pas de suppléments | Motoneurone |
Tableau 3 : Suppléments de milieu motoneurone. Les suppléments sont ajoutés frais le jour de l’utilisation au milieu basal du motoneurone.
| Jour | Réactif | Concentration des stocks | Concentration finale | Compartiment |
| Jour 18 | DMEM/F12 | 97% | MAB | |
| Pyruvate de sodium | 100 mM | 1% | ||
| Sérum de cheval | 2% | |||
| Agrin | 50 μg/mL | 0,01 μg/mL |
Tableau 4 : Milieu de différenciation MAB. Le milieu peut durer 2 semaines à 4 °C. Agrin est ajouté frais le jour de l’utilisation.
Discussion
Le protocole décrit une méthode relativement facile à utiliser, qui génère des unités motrices humaines avec des NMJ fonctionnels dans des dispositifs microfluidiques disponibles dans le commerce en moins de 30 jours. Il est décrit comment les NMJ peuvent être évalués morphologiquement par des techniques standard telles que l’ICC et le SEM et fonctionnellement par des enregistrements de calcium de cellules vivantes.
Un grand avantage de ce protocole est l’utilisation de la technologie des cellules souches. Cela permet une adaptabilité totale dans laquelle les NMJ peuvent être évalués à la fois dans la santé et la maladie, indépendamment du profil du donneur. Le modèle s’est déjà avéré efficace et bénéfique dans la recherche sur la SLA, où nous avons identifié des déficiences dans l’excroissance des neurites, la repousse et le nombre de NMJ comme de nouveaux phénotypes dus à des mutations du gène FUS18. Avec ce modèle, il est possible d’élargir la recherche pour inclure des formes sporadiques de SLA, dont l’étiologie est inconnue, en utilisant des CSPi de patients atteints de SLA sporadiques. Cela offre un avantage par rapport aux modèles animaux traditionnels, qui reposent sur la surexpression transgénique de gènes mutés pour récapituler la maladie humaine23,24. De plus, notre système entièrement humain permet une récapitulation potentielle de la physiologie et de la maladie spécifiques à l’homme. Des études antérieures ont démontré les différences entre la morphologie des NMJ chez les rongeurs et chez l’homme25, ce qui suggère qu’il faut faire preuve de prudence lors de l’utilisation de rongeurs pour traiter la pathologie humaine des NMJ. Bien que ce système soit une configuration in vitro relativement simple, qui n’a pas la complexité d’un modèle in vivo, il a été possible de démontrer que la morphologie nmJ affichée dans les dispositifs microfluidiques ressemblait aux NMJ des amputés humains25. De plus, ce modèle permet une évaluation de la NMJ pendant la formation et la maturation de la NMJ, révélant potentiellement des phénotypes précoces de la maladie, qui sont absents, non identifiables ou négligés dans les échantillons post-mortem humains.
Les MAB offrent une option valable pour générer des myotubes, bien que leur survie limitée à 10 jours soit un inconvénient du système. La survie des myotubes repose sur leur attachement à la surface, qui est probablement compromis par des contractions spontanées des myofibres. Après plus de 10 jours, la plupart des myotubes se seront détachés, rendant la culture NMJ inutilisable. Idéalement, les myotubes seraient également générés à partir d’iPSC. Cependant, les protocoles actuels se sont révélés difficiles à reproduire26 en raison de la variabilité de l’indice de fusion27,28,29,30.
En utilisant des dispositifs microfluidiques disponibles dans le commerce, nous avons généré un système standardisé, qui est entièrement accessible. D’autres modèles NMJ existent31,32,33,34,35,36,37,38,39,40,41,42. Cependant, ils reposent généralement sur des compartiments uniques, qui n’ont pas le compartimentage et l’isolement fluidique entre les types de cellules, ou sur des récipients de culture sur mesure, ce qui réduit la disponibilité et potentiellement aussi la reproductibilité. Les dispositifs microfluidiques utilisés pour ce protocole peuvent être achetés avec des microgrooves de différentes longueurs, ce qui permet des analyses plus approfondies telles que le transport axonal43,44 ou l’axotomie18,45,46 investigations. L’isolement fluidique entre les compartiments permet en outre un traitement médicamenteux compartimenté des motoneurones ou des myotubes, ce qui peut être favorable au développement thérapeutique. De plus en plus d’entreprises spécialisées dans la microfluidique ont vu le jour, ce qui s’est ouvert à un large choix de conceptions et de fonctionnalités de dispositifs, favorisant ainsi l’accessibilité à la recherche in vitro.
En conclusion, nous avons développé un protocole fournissant une méthode fiable, polyvalente et facile pour cultiver des unités motrices humaines avec des NMJ fonctionnels.
Déclarations de divulgation
L.V.D.B. détient un brevet sur l’utilisation d’inhibiteurs de HDAC dans la maladie de Charcot-Marie-Tooth (US-2013227717-A1), est co-fondateur scientifique d’Augustine Therapeutics et membre de son conseil consultatif scientifique. Les autres auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Les auteurs remercient Nikky Corthout et Sebastian Munck de LiMoNe, Research Group Molecular Neurobiology (VIB-KU Leuven) pour leurs conseils sur les enregistrements de fluorescence transitoire du calcium des cellules vivantes. Cette recherche a été soutenue par la Commission Fulbright en Belgique et au Luxembourg, la KU Leuven (C1 et Fonds « Opening the Future »), le VIB, l’Agence pour l’innovation par la science et la technologie (IWT; SBO-iPSCAF), le « Fonds pour la Recherche Scientifique Flandre » (FWO-Vlaanderen), Target ALS, l’ALS Liga België (Un remède contre la SLA), le Gouvernement Belge (Programme Interuniversité Attraction Poles P7/16 initié par l’Office Fédéral belge de la politique scientifique), la Fondation Thierry Latran et l’Association Belge contre les Maladies neuro-Musculaires (ABMM). T.V. et J.B. sont soutenus par des bourses de doctorat décernées par FWO-Vlaanderen.
matériels
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Références
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon