Method Article
Mikroakışkan Cihazlarda Fonksiyonel Nöromüsküler Kavşaklara Sahip İnsan Motor Ünitelerinin Üretimi
Bu Makalede
Özet
fonksiyonel olarak aktif nöromüsküler kavşakların oluşumuyla sonuçlanan insan primer mezoangioblast türevli miyotüplerle birlikte insan kaynaklı pluripotent kök hücre türevi motor nöronları birlikte kült haline getirmekle ticari olarak mevcut mikroakışkan cihazlarda insan motor üniteleri üretmek için bir yöntem açıklıyoruz.
Özet
Nöromüsküler kavşaklar (NMJ'ler), alt motor nöronun aksonu ile kas kasılmasının katılımını kolaylaştıran kas arasında özel sinapslardır. Amyotrofik lateral skleroz (ALS) ve spinal müsküler atrofi (SMA) gibi motor nöron bozukluklarında, NMJ'ler dejenere olur ve bu da kas atrofisi ve ilerleyici felç ile sonuçlanır. NMJ dejenerasyonunun altında kalan mekanizma, büyük ölçüde çevrilebilir araştırma modellerinin eksikliği nedeniyle bilinmemektedir. Bu çalışma, fonksiyonel NMJ'lere sahip bir insan motor ünitesinin çok yönlü ve tekrarlanabilir bir in vitro modelini oluşturmayı amaçlamaktadır. Bu nedenle, insan indüklenmiş pluripotent kök hücre (hiPSC) türevi motor nöronlar ve insan primer mezoangioblast (MAB) türevi miyotubelar ticari olarak mevcut mikroakışkan cihazlarda birlikte kültürlendi. Akışkan olarak izole edilmiş mikro bölmelerin kullanımı, hücreye özgü mikroçevinlerin korunmasına izin verirken, mikrogroovlar aracılığıyla hücreden hücreye temasa izin verir. Kemotaktik ve hacimsel bir gradyan uygulanarak, miyotube etkileşimini ve NMJ'lerin oluşumunu teşvik eden mikrogroovlar aracılığıyla motor nöron-nötrallerin büyümesi teşvik edildi. Bu NMJ'ler, motor nöron presynaptik belirteç sinaptofiz (SYP) ve postsinaptik asetilkolin reseptörü (AChR) belirteci α-bungarotoxin (Btx) ile eş lokalizasyon yoluyla immünostokimyasal olarak tanımlandı ve taramalı elektron mikroskopisi (SEM) kullanılarak morfolojik olarak karakterize edildi. NMJ'lerin işlevselliği, motor nöronların depolarizasyonu üzerine miyotüplerdeki kalsiyum yanıtları ölçülerek doğrulandı. Standart mikroakışkan cihazlar ve kök hücre teknolojisi kullanılarak üretilen motor ünitesi, sağlık ve hastalıkta NMJ'lere odaklanan gelecekteki araştırmalara yardımcı olabilir.
Giriş
NMJ'ler, nörotransmitterlerin salınma yoluyla alt spinal motor nöronlar ve iskelet kas lifleri arasındaki iletişimi kolaylaştırır1. ALS ve SMA gibi motor nöron bozukluklarında, NMJ'ler dejenere olur ve bu da kaslarla iletişimde bir bozulmaya neden olur2,3,4,5,6,7. Bu, hastaların yavaş yavaş kas fonksiyonlarını kaybetmelerine neden olur, bu da diyafram gibi hayati kas gruplarının ilerleyici atrofisi nedeniyle tekerlekli sandalyeye bağlı olmalarına ve sonunda solunum yaşam desteğine bağımlı olmalarına neden olur. Bu bozukluklardaki bu derin NMJ kaybının altında tam olarak altta kalan mekanizmalar bilinmemektedir. Transgenik hayvan modelleri üzerinde birçok çalışma yapılmıştır, bu da bize NMJ dejenerasyonunun patogenezine dair bazı bilgiler vermiştir5,6,8,9,10,11. Bununla birlikte, patolojiyi tam olarak anlamak ve denervasyona karşı koymak için, tam erişilebilirliğe izin veren bir insan sistemine sahip olmak önemlidir.
Burada protokol, hiPSC türevi motor nöronların ve insan birincil MAB türevli miyotüplerin ticari olarak mevcut mikroakışkan cihazlar kullanılarak ortaklaşa kült haline sokularak insan NMJ'leri üretmenin nispeten basit bir yolunu açıklar. Nöronların somalarını ve aksonlarını polarize etmek ve akışkan bir şekilde izole etmek için mikroakışkanların kullanımı, 1970'lerin sonundaki 'Campenot' odalarının12'nin ilk tanımından beri bilinmektedir. O zamandan beri, ticari seçenekler de dahil olmak üzere daha fazla mikroakışkan tasarımlar üretilmiştir. Bu protokolde kullanılan cihazlar iki bölme içerir ve her bölme bir kanal13 ile bağlı iki kuyudan oluşur. İki bölme yansıtılır ve birkaç mikrogroov ile bağlanır. Bu mikrogroovlar, kılcal hidrostatik basınç yoluyla iki bölme arasında akışkan izolasyonu korurken neurit büyümesini kolaylaştıran bir boyuta sahiptir13,14. Bu sistemi kullanarak, motor nöronları bir bölmede ve kas hücrelerini diğerinde, her biri kendi kültür ortamlarında kültüre etmek mümkündür, ancak yine de mikrogroovlardan geçen ve kas hücreleriyle etkileşime giren nötroritler aracılığıyla fiziksel bir bağlantıyı kolaylaştırır. Bu model, ALS ve SMA gibi hastalıklarda erken NMJ patolojisini incelemek için kullanılabilecek bir insan motor ünitesinin tamamen erişilebilir ve uyarlanabilir bir in vitro sistemini sağlar.
Protokol
iPSC üretimi ve MAB hasadı için örneklerini sağlayan tüm deneklerden yazılı bilgilendirilmiş onam alındı. Prosedür, Üniversite Hastanesi Leuven 'in (n° S5732-ML11268) tıbbi etik komitesi ve StemBANCC projesinin bir parçası olarak İngiltere'nin ana araştırma etik komitesi tarafından onaylandı. Bu protokolde kullanılan tüm reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir ve steril olarak kullanılmalıdır. Ortam, aksi belirtilmedikçe kullanılmadan önce oda sıcaklığına (RT) ısıtılmalıdır. Ortak kültür protokolüne genel bir bakış için lütfen Şekil 1'e bakın.
1. Motor nöron progenitörlerinin iPSC'lerden farklılaşması
- Önceki bir çalışmadan uyarlanan motor nöron farklılaşma protokolünü izleyin116, 10 nöral progenitör (NPC) durumuna ulaşana kadar. Protokolün zaman dilimine göre, farklılaşma Pazartesi günü (0. gün) başlatılır ve bu da Perşembe günü 10.
- Şişe başına 2 x 106- 4 x 106 hücre yoğunluğunda %10 dimetil sülfit (DMSO) ile nakavt serumu değişiminde kriyoprezikler 10 NPC'leri saklar.
DİkKAT: DMSO toksiktir: kişisel koruyucu ekipmana sahip bir duman kaputunda tutamak.
NOT: 10 NPC'nin çözülme sırasında hayati öneme sahip olması beklenir. Motor nöron farklılaşma protokolünü bu 'gün 10 NPC' durumunda durdurun ve daha sonra bankaya yatırılabilir ve kullanılabilecek çok sayıda NPC oluşturmak için NPC'leri kriyoprezserve edin ve ortak kültür protokolünün genel zaman çizelgesinin uzunluğunu toplam 28 günden 19 güne düşürün.
2. İnsan MAB'lerinin türetimi ve bakımı
NOT: MAB'ler, bu durumda 58 yaşındaki sağlıklı bir donörden elde edilen biyopsilerden elde edilen damarla ilişkili mezenkimal kök hücrelerdir. Alternatif ticari kaynaklar mevcuttur. MAB'leri elde etme protokolü kısaca açıklanmıştır. Daha fazla bilgi için ayrıntılı protokol17'ye bakın. Tüm MAB ortamları kullanılmadan önce 37 °C'ye ısıtılmalıdır.
- Biyopsi dokusunu kıyma ve kollajen üzerine kuluçka (dana derisinden) 2 hafta boyunca büyüme ortamında (Tablo 1) 6 cm'lik yemekler kapladı. Ortamı her 4 günde bir değiştirin.
- Kollajen kaplama hazırlamak için, 0.1 M Asetik asidin 20 mL'sinde 100 mg kollajen çözün. Kollajenin çözülmesi zaman alır, bu nedenle karışımı RT'de bir gecede sallanan bir platforma yerleştirin. Ertesi gün, 80 mL ddH2O ile 100 mL'lik son hacme kadar yükleme yapın.
DİkKAT: Asetik asit toksiktir; kişisel koruyucu ekipman ile duman kaputunda tutamak.
NOT: Dana derisi kaplamadan kolajen 5 kata kadar yeniden kullanılabilir. 4 °C'de saklayın. - Kabın veya mataranın tüm yüzeyini kolajenle kaplayın, laminer bir akış içinde RT'de 20 dakika boyunca kapatın ve kuluçkaya yatırın. 20 dakika sonra, kolajeni taze bir kapta kurtarın, boş kabı / şişeyi kapatın ve laminar akışta RT'de 10 dakika bekletin.
- Çanağı/matarayı bir gecede (veya en az 6 saat) inkübasyon için inkübatöre aktarın (37 °C, %5 CO2). Hücreleri kaplamadan önce Dulbecco'nun fosfat tamponlu salinini kalsiyum veya magnezyum (DPBS) olmadan 5x yıkayın.
- Kollajen kaplama hazırlamak için, 0.1 M Asetik asidin 20 mL'sinde 100 mg kollajen çözün. Kollajenin çözülmesi zaman alır, bu nedenle karışımı RT'de bir gecede sallanan bir platforma yerleştirin. Ertesi gün, 80 mL ddH2O ile 100 mL'lik son hacme kadar yükleme yapın.
- 14 gün sonra, FACS (floresan aktif hücre sıralama) insan alkalin fosfataz17 için MAB'leri sıralar ve ardından daha fazla genişleme. MaB'leri büyüme ortamında kollajen kaplı T75 şişelerinde muhafaza ettinin ve büyüme ortamını her 2 günde bir değiştirin (şişe başına 10 mL).
- %70 izdihama ulaşırken cihazlarda kriyoprezik, pasaj veya tohum MAB'leri.
NOT: MAB'ler hücreden hücreye temas sırasında spontan füzyonlar nedeniyle miyojenik potansiyellerini kaybederler. MAB'leri genişletirken %70'i aşmadığınızdan emin olun. %70 bir konfluent T75 şişesi, şişe başına 100.000 hücrede kriyoprezerserve edilebilen yaklaşık 600.000-800.000 hücre içerir. Her şişe daha sonra çözülebilir ve genişleme için bir T75 şişesinde tohumlanabilir. - MAB'leri geçirmek için, 7 mL DPBS ile bir kez hafifçe yıkayın ve ardından hücreleri ayrıştırmak için% 5 CO2'de 37 ° C'de 3 dakika boyunca 7 mL MAB ayrıştırma çözeltisinde kuluçkaya yatırın.
- MAB ayrışma çözeltisini büyüme ortamının 7 mL'si ile nötralize edin, hücreleri hafifçe kazıyın ve hücre süspansiyonunu 50 mL santrifüj tüpüne aktarın. Kalan MAB'leri toplamak için şişeyi ekstra 5 mL büyüme ortamıyla hafifçe yıkayın.
- Hücre süspansiyonu 300 x g'da 3 dakika santrifüjleyin, ardından genişleme için doğrudan yeni bir kollajen kaplı T75 şişesine geçiş, %10 DMSO ile nakavt serum değişiminde kriyoprezik tasarruf edin veya mikroakışkan bir cihazda tohuma sayın.
NOT: Pasajlar, maksimum geçiş sayısı 13 olana kadar hücre genişlemesi için haftada 1x-2x gerçekleştirilir. Ayrışma üzerine, MGB'ler mikroskop altında incelendiğinde küresel ve büyük şekilli görünür.
3. Önceden monte edilmiş mikroakışkan cihazların hazırlanması - Gün 9
NOT: Protokol, mikroakışkan cihaz üreticisinin nöron cihazı protokolünden uyarlanmıştır ve hem önceden monte edilmiş hem de silikon cihazların kullanımı için ayarlanmıştır. Burada, önceden monte edilmiş cihazlar immünositokimya (ICC) ve canlı hücre kalsiyum geçici kayıtları için kullanılırken, silikon cihazlar SEM için kullanılır. Protokolün zaman çizelgesi, motor nöron farklılaşma protokolünün zaman çizelgesini izler.
- Kaplamanın gece boyunca kuluçkalanması gerektiğinden, mikroakışkan cihazları tohumlama hücresinden bir gün önce hazırlayın. Motor nöron protokolüne göre, bu çarşamba olacak. 10 cm Petri kabına ~10 mL%70-%100 etanol ekleyin. Cihazı nakliye konteynerinden sterilizasyon için Petri kabına aktarmak için forseps kullanın.
- Cihazı 10 s etanol içine batırın ve cihazı bir kağıt parçasına aktarın ve laminer akışta ~ 30 dakika boyunca kurutun. Her iki tarafın da kurumasını sağlamak için cihazı birkaç kez çevirin. Cihaz kuruyken, kolay kullanım için her cihazı tek bir 10 cm Petri kabına taşımak için forseps kullanın
DİkKAT: Etanol toksiktir; kişisel koruyucu ekipmana sahip duman kaputunda tutamak - Cihazı DPBS'de Poli-L-ornitin (FKÖ) (100 μg/mL) ile kapla ve 37 °C'de kuluçkaya yatır, 3 saat boyunca %5 CO2 .
- Bir P200 pipet kullanarak DPBS'ye 100 μL FKÖ ekleyin ve kanal açıklığına mümkün olduğunca yakın bir şekilde ve kanaldan tabana doğru geçen sıvıyı gözlemleyin. Daha sonra, DPBS'de 100 μL FKÖ'nün altını iyice ekleyin.
- Mikrogroovların diğer tarafında tekrarlayın ve mikrogroovları kaplamak için cihazın iki aynalı tarafı arasında bir hacim gradyanı oluşturmak için cihazın bir tarafına 100 μL ekleyerek bitirin (örneğin, sağ taraf 200 μL, sol taraf 300 μL). 3 saat sonra, cihazı DPBS ile 5 dakika boyunca 3x yıkayın. Gerekirse bir emme sistemi kullanın.
NOT: Hücrelerin kaplanması veya kült haline getirtmesi sırasında herhangi bir noktada kanallarda herhangi bir hava kabarcığı oluşumunu önleyin. Küçük kabarcıklar bile kısa bir süre içinde genişler, böylece kanal boyunca kaplama, hücre tohumlama veya ortam akışını engeller. Kaplama sırasında akışkan kanalda durursa, FKÖ çözeltisini doğrudan her iki taraftan kanala yeniden kullanın. Kabarcıklar hala varsa, kanalı yıkamak ve yukarıda 3.3.1-3.3.2 adımlarında belirtildiği gibi kaplama işlemini tekrarlamak için 200 μL DPBS kullanın. Hücre tohumlamadan sonra kabarcıklar ortaya çıkarsa, kanalın yıkanmasının hücrelere zarar vereceğinden cihazı kurtarmak imkansızdır.
- Cihazı bir Nörobasal ortamda laminin (20 μg/mL) ile kapleyin ve gece boyunca 37 °C, %5 CO2'de kuluçkaya yatın. 3.3.1-3.3.2 numaralı adımlardan FKÖ kaplaması için aynı talimatları izleyin.
- Ertesi gün, bir P200 pipet kullanın ve laminin kaplamasını kuyulardan çıkarmak için ucu kanal açıklığın karşısındaki kuyuya yerleştirin. Tüm kuyulara DPBS ekleyin ve DPBS'li cihazları hücre tohumlama için RT'deki laminer akışta bırakın.
NOT: Bu noktadan sonra, hava kabarcığı oluşumuna neden olabileceğinden, sıvının (laminin kaplama, DPBS, ortam, fiksasyon çözeltisi vb.) doğrudan kanallardan çıkarılmaması önemlidir. Hücreleri tohumlamadan önce her zaman mikroskop altındaki cihazları inceleyin.
4. Silikon mikroakışkan cihazların hazırlanması - Gün 9
- Kaplamanın bir gecede kuluçkaya yatması gerektiğinden, silikon mikroakışkan cihazları tohumlama hücresinden bir gün önce hazırlayın. Motor nöron protokolüne göre, bu çarşamba olacak.
- 10 cm Petri kabına ~10 mL%70-%100 etanol ekleyin. Cihazı nakliye kabından sterilizasyon için Petri kabına aktarmak için bir forseps kullanın. Cihazı 10 s etanol içine batırın ve forseps ile 6 kuyulu bir plakadaki bir kuyuya aktarın ve laminer akışta ~ 30 dakika boyunca kurutun. Tüm tarafların kurumasını sağlamak için cihazı yan tarafına yerleştirin.
- SEM levhalarını cihazın boyutuna kadar kesin (her iki tarafta birkaç mm bırakın). 4.1.1. adımda yukarıda belirtildiği gibi sterilizasyonu tekrarlayın. Daha sonra, kurutmak için 10 cm Petri kabına toslar ile aktarın. İki-üç SEM levha bir yemeğe sığar.
- Cihazları ve SEM levhalarını DPBS'de FKÖ (100 μg/mL) ile kapla ve 37 °C'de kuluçkaya yatır, 3 saat boyunca %5 CO2 .
- 6 kuyulu plakadaki her cihaza kuyu başına DPBS cinsinden 1 mL FKÖ ekleyin. Cihazın, kanal ve mikrogroov tarafı sıvıya bakacak şekilde FKÖ çözümünün üstünde yüzdür olduğundan emin olun. 10 cm Petri kabı başına DPBS'ye 10 mL FKÖ ekleyin ve SEM levhalarını sıvıya itmek için tokmak kullanın.
NOT: SEM levhalar genellikle kaplama çözeltisinin üstünde yüzer. Cihazı ve levhayı monte etmeden önce, SEM sayfasını çevirin, böylece FKÖ ile temas eden yüzey, cihazın kanalına ve mikrogroove yüzeyine temas etti. - 3 saat sonra, cihazı ve SEM levhalarını DPBS ile 5 dakika boyunca 2x yıkayın ve ardından steril suyla 5 dakika daha yıkayın. Gerekirse bir emme sistemi kullanın. Kolay kullanım için her SEM sayfasını tek bir 10 cm Petri kabına aktarın.
NOT: Montajdan önce hem cihazların hem de SEM levhaların tamamen kuru olması gerekir. Steril su ile son yıkama, potansiyel tuz kristallerini DPBS'den uzaklaştırır, aksi takdirde montajı engelleyebilir.
- 6 kuyulu plakadaki her cihaza kuyu başına DPBS cinsinden 1 mL FKÖ ekleyin. Cihazın, kanal ve mikrogroov tarafı sıvıya bakacak şekilde FKÖ çözümünün üstünde yüzdür olduğundan emin olun. 10 cm Petri kabı başına DPBS'ye 10 mL FKÖ ekleyin ve SEM levhalarını sıvıya itmek için tokmak kullanın.
- Laminer akışta mikroskop altında çalışın. Silikon cihazı kanal ve mikrogroov tarafı 90° açıyla SEM levhasına monte etmek için tokmaklar kullanın ve tüm tarafların hizalanmasını sağlayın. Sadece dış kenarları değil, kuyuları, kanalları ve mikrogroovları da kapattığından emin olmak için cihazın üzerine hafifçe bastırın.
NOT: Bağlı alanlar gri görünürken, henüz monte olmayanlar mikroskop altında net görünecektir. Kültleştirme sırasında cihazın kopmasını önlemek için tüm alanların hava kabarcıkları olmadan iyi kapatıldığından emin olun. Montajı engelleyen döküntü veya tuz kristalleri durumunda, montaj prosedürünü yeniden denemeden önce hem SEM levhasını hem de cihazı steril suda yeniden yıkayın ve kurutun. Mikrogroovlar cihaza çok sert basmaktan bozulmuş görünüyorsa, cihazı SEM sayfasından tamamen çıkarın ve montajı tekrar deneyin. Cihaz monte edildikten sonra kaplama ve ortam değiştirme yaparken dikkatli olun. - Laminer akışta mikroskop altında çalışın. Cihazı bir Nörobasal ortamda laminin (20 μg/mL) ile kapleyin ve gece boyunca 37 °C, %5 CO2'de kuluçkaya yatın.
NOT: Bir gecede inkübasyon silikon cihazı sertleştirerek SEM levhasına daha fazla sızdırmaz hale sağlar.- Bir P200 pipet kullanarak laminin çözeltisinin 100 μL'lik kısmını bir üste ve kanal açıklığına mümkün olduğunca yakın bir şekilde ekleyin ve sıvının kanaldan tabana doğru iyi geçtiğini gözlemleyin. Kuyu ve kanalın etrafında sızıntı olup olmadığını kontrol edin.
- Daha sonra, tabana 100 μL laminin çözeltisi ekleyin ve sızıntı olup olmadığını kontrol edin. Mikrogroovların diğer tarafında tekrarlayın ve mikrogroovları kaplamak için cihazın iki aynalı tarafı arasında bir hacim gradyanı oluşturmak için cihazın bir tarafında ek 100 μL ile bitirin (örneğin, sağ taraf 200 μL, sol taraf 300 μL).
NOT: Sızıntı durumunda, laminin kaplamasını çıkarın, cihazı ve SEM levhalarını sökün ve her ikisini de steril suda yıkayın. 4.3. adımdan itibaren kurumasına ve tekrarlanmasına izin verin. - Ertesi gün, ucu kanal açıklığın karşısındaki kuyuya konumlandırarak kaplamayı bir P200 pipet ile kuyulardan çıkarın. Tüm kuyulara DPBS ekleyin ve DPBS'li cihazları hücre tohumlama için RT'deki laminer akışta bırakın.
NOT: Bu noktadan sonra, hava kabarcığı oluşumuna neden olabileceğinden, sıvıyı (laminin kaplama, DPBS, ortam, fiksasyon çözeltisi vb.) doğrudan kanallardan çıkarmayın. Hücreleri tohumlamadan önce her zaman mikroskop altındaki cihazları inceleyin.
5. Mikroakışkan cihazlarda NPC'lerin kaplatını - Gün 10
NOT: Motor nöron farklılaşma protokolüne göre15, 10 NPC'lerin kaplaması Perşembe günü gerçekleşir.
- Rock inhibitörü (10 μL/mL) çözeltisi ile 10 mL'lik günlük 10 motor nöron ortamı (Tablo 2 ve Tablo 3) başına yeni ayrışmış 10 NPC15 veya 1-2 şişe bankalanmış NPC'yi çözün ve hücre süspansiyonu 100 x g'da 4 dakika boyunca santrifüj edin.
- Hücre peletini ROCK inhibitörü (10 μL/mL) çözeltisi ile 10.
NOT: Aşağıda belirtildiği gibi, en uygun tohumlama hacmine uyum sağlamak için NPC'leri doğru miktarda ortama yeniden harcadığından emin olun. - 10 günlük motor nöron ortamlarının 60-100 μL'sinde cihaz başına P200 pipet ve tohum 250.000 NPC ile cihazdaki mikrogroovların bir tarafındaki iki kuyudan DPBS'yi çıkarın.
- Sağ üst kısımda, 45° açıyla açılan kanala yakın hücre süspansiyonunun (125.000 hücre) 30-50 μL'lik tohumu ve kalan sıvıyı pipet ucuyla kuyunun ortasına doğru yavaşça sürükleyin.
- Bunu alt kuyuda tekrarlamadan önce hücre süspansiyonun kanaldan akmasını sağlamak için birkaç saniye bekleyin (30-50 μL'de 125.000 hücre). Mikroskop olmadan cihazın kolay yönlendirilmeleri için tohumlu tarafı "NPC" veya eşdeğeri işaretlemek için bir kalem kullanın.
- Cihazı 37 °C'de kuluçkaya yatırın, 5 dakika boyunca% 5 CO2 , iki tohumlu kuyuları ek bir gün 10 motor nöron ortamıyla (toplam 200 μL / kuyu) doldurmadan önce hücre bağlanmasına izin vermek için ve 37 °C,% 5 CO2'de tekrar kuluçkaya yatırın.
NOT: Her kuyu 200 μL içerebilir. Sadece kanalda daha az hücre tohumlamak mümkündür. Ancak bu, kültürü her orta değişiklik sırasında kanallar aracılığıyla birim akımına daha duyarlı hale getirir.
- DPBS'yi taze tohumlu NPC'lerin karşısındaki mikrogroovların diğer tarafındaki iki kuyudan çıkarmak için bir P200 pipet kullanın. Ardından, kuluçka sırasında ortamın buharlaşmasını önlemek için cihazın etrafına 10 cm'lik çanak başına 6 mL DPBS ekleyin.
NOT: Gerekirse kültür döneminde cihazın etrafına ek DPBS ekleyin. - Cihazın her iki bölmesinde 11.gün (Cuma), 14. gün (Pazartesi) ve 16. Orta değişiklik gününde yeni medya takviyeleri ekleyin.
NOT: Bu noktadan sonra, tüm orta değişiklikleri bir P200 pipetle gerçekleştirin. Pipet ucunu her zaman kuyunun kenarındaki kanaldan uzağa yerleştirin ve sıvıyı doğrudan kanaldan çıkarmayın. Silikon cihazları ayırmamaya dikkat edin. Hücre müfrezesini önlemek için ortamın çıkarılması ve eklenmesi yavaş yapılmalıdır.- P200 pipet ucunu kanal açıklığının karşısındaki kuyu duvarının alt kenarına konumlandırarak NPC'lerle her iki kuyudaki tüm ortamları dikkatlice çıkarın. P200 pipet ucunu kanal açıklığının karşısındaki kuyu duvarının üst kenarına konumlandırarak yavaşça üst tarafa 50-100 μL taze motor nöron ortamı ekleyin.
- Alta 50-100 μL motor nöron ortamı eklemeden önce ortamın kanaldan akmasını sağlamak için birkaç saniye bekleyin. Her iki kuyu da 200 μL/ kuyu içerene kadar bu işlemi dikkatlice tekrarlayın. Hücre olmadan yan tarafta tekrarlayın.
6. Mikroakışkan cihazlarda MAB kaplaması - Gün 17
- Mikroakışkan cihazlarda (motor nöron farklılaşması 10. gün) MBS tohumlamadan yaklaşık 7 gün önce, yeterli hücre genişlemesine izin vermek için kollajen ile kaplanmış bir T75 şişesinde MAB'leri çözün ve büyüme ortamında (Tablo 1) tohumlayın. Bkz. bölüm 2.
- Motor nöron farklılaşması (Perşembe) 17.
NOT: Aşağıda belirtildiği gibi, en uygun tohumlama hacmine uyum sağlamak için MAB'leri doğru miktarda ortama yeniden depoladığınızdan emin olun. - Cihazdaki mikrogroovların tohumlanmamış tarafındaki motor nöron ortamını bir P200 pipetle çıkarın, DPBS ile hafifçe yıkayın ve 60-100 μL büyüme ortamında cihaz başına 200.000 MAB tohumlayın.
- Sağ üst kısımda, kanal açıklığı 45° açıyla yakın 30-50 μL hücre süspansiyonu (100.000 hücre) tohumu ve kalan sıvıyı pipet ucu ile kuyunun ortasına doğru yavaşça sürükleyin. Alt kuyuda tekrarlamadan önce hücrelerin kanaldan akmasına izin vermek için birkaç saniye bekleyin (30-50 μL'de 100.000 hücre).
- Cihazı 37 °C'de kuluçkaya yaslanın, 5 dakika boyunca% 5 CO2 hücre bağlanmasına izin verin, iki yeni MAB tohumlu kuyuyu ek büyüme ortamıyla (toplam 200 μL / kuyu) doldurmadan önce. 37 °C'de tekrar kuluçkaya yaslanın, %5 CO2.
NOT: Cihazın motor nöron tarafında 17. günde orta değişiklik yapılmasına gerek yoktur. Daha önce yayınlanan motor nöron farklılaşma yöntemine göre 17. gün orta değişim15 bunun yerine 18. günde (Cuma) gerçekleştirilir.
7. Motor nöron neuritlerinin MAB bölmesine doğru büyümesini teşvik etmek için hacimsel ve kemotatik bir gradyanın uygulanması
- 18. günde, 18. gün motor nöron ortamı (200 μL/kuyu) ile motor nöron tarafında tam bir orta değişiklik gerçekleştirin. 5.5.1-5.5.2 adımlarında belirtilen orta değişiklikler için yönergeleri izleyin. Cihazın MAB bölmesinde MAB farklılaştırmasını başlatın (Tablo 2 ve Tablo 4).
- 0,01 μg/mL insan agrin (200 μL/kuyu) ile desteklenmiş önceden ısıtılmış MAB farklılaşma ortamı (Tablo 4) eklemeden önce MAB bölmelerini DPBS ile bir kez dikkatlice yıkayın.
NOT: MAU'lar bir hafta boyunca çok yönlü miyotütleri kaynaştıracak ve oluşturacaktır.
- 0,01 μg/mL insan agrin (200 μL/kuyu) ile desteklenmiş önceden ısıtılmış MAB farklılaşma ortamı (Tablo 4) eklemeden önce MAB bölmelerini DPBS ile bir kez dikkatlice yıkayın.
- 21. günde, motor nöron farklılaşma protokolüne (Pazartesi) göre, kemotaktik ve hacimsel gradyanı başlatın (Tablo 2 ve Tablo 3).
- Beyin kaynaklı nörotrofik faktör (BDNF), glial hücre hattı türevli nörotrofik faktör (GDNF) ve sili ile 30 ng/mL motor nöron bazal ortamın 200 μL / kuyusunu ekleyin miyotüp bölmesine (daha önce MAB bölmesi olarak tanımlanan) insan agrin (0.01 μg/mL) ve laminin (20 μg/mL) nörotrofik faktör (CNTF). Motor nöron bölmesine büyüme faktörü olmadan motor nöron bazal ortamı (100 μL/kuyu) ekleyin.
- Motor nöron farklılaşması 28. güne kadar her saniye 7.2 adımını tekrarlayın. Hafta sonları medya değişikliğine gerek yoktur.
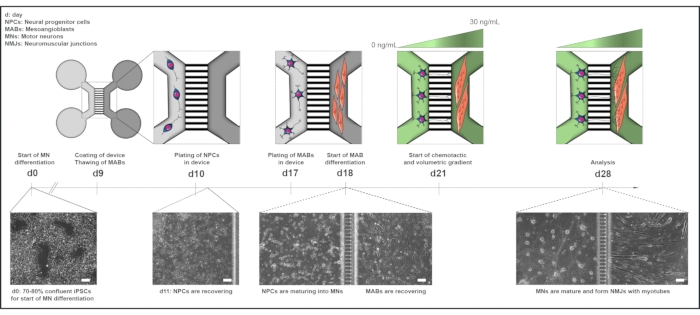
Şekil 1: Mikroakışkan cihazlarda motor ünitesi protokolüne şematik genel bakış. Motor nöron farklılaşma protokolünün zaman çizelgesine göre 0 günden 28. güne kadar farklılaşma zaman çizelgesi ve ortak kültüre genel bakış22. IPSC'lerden motor nöron farklılaşması 0. 9. günde, cihaz sterilize edilir ve PLO-laminin ile kaplanmıştır. MAB'ler T75 şişelerinde genişleme için çözülür. 10. günde, motor nöron-NPC'ler hem kuyularda hem de cihazın bir bölmesinin (açık gri) kanalında kaplanır ve burada motor nöronlara farklılaşmaları bir hafta boyunca devam eder. CAL'ler 17. günde hem kuyularda hem de karşı bölmenin (koyu gri) kanalında kaplanmıştır. 18. günde, MABs miyotubes'a farklılaşmaya başlar. 21. günde, cihazın mikrogroovları aracılığıyla motor nöron-neurit polarizasyonunu teşvik etmek için hacimsel ve kemotaktik bir gradyan kurulur. Motor nöron bölmesi büyüme faktörleri olmadan 100 μL / kuyu motor nöron bazal ortam (açık yeşil bölme) alırken, miyotube bölmesi 30 ng / mL büyüme faktörleri (koyu yeşil bölme) ile 200 μL / kuyu motor nöron bazal ortam aldı (Tablo 2 ve Tablo 3). Kültür, 28. günde analize kadar 7 gün daha hacimsel ve kemotaktik gradyan ile sürdürülür. Parlak alan görüntüleri, hücre morfolojisi 0. Ölçek çubuğu, 100 μm. Bu rakam Stoklund Dittlau, K. ve ark.18'den değiştirilmiştir. Hücre çizimleri Smart Server medical Art22'den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. Fiksasyon ve ICC
NOT: Nöronal kültürlerin kopmasını önlemek için tüm adımlar dikkatlice yapılmalıdır. Aşağıdaki adımlar sırasında kanallardan sıvı çıkarmayın.
- Duman kaputunda veya laminar akışta sabitleme gerçekleştirin: Sabitlemeden önce cihazdaki tüm kuyuları DPBS ile bir kez dikkatlice yıkayın. Laminer akışta (100 μL/kuyu) RT'de 15-20 dakika dpbs%4 paraformaldehit (PFA) kullanarak düzeltin.
DİkKAT: PFA toksiktir: kişisel koruyucu ekipmana sahip bir duman kaputunda tutamak.- Cihazın üst kuyusuna dikkatlice 100 μL ekleyin ve alttaki kuyuya 100 μL eklemeden önce sabitleme çözeltisinin kanaldan akmasını sağlamak için birkaç saniye bekleyin. Diğer tarafta tekrar et. İnkübasyondan sonra PFA çözeltisi çıkarın ve DPBS ile 5 dakika boyunca 3x hafifçe yıkayın. Depolama için 200 μL/ kuyu DPBS'de bırakın ve ICC deneyine kadar 4 °C'de saklamak için 10 cm petri kabını parafilm ile kapatın.
NOT: Cihazların depolama sırasında kurumadığını unutmayın.
- Cihazın üst kuyusuna dikkatlice 100 μL ekleyin ve alttaki kuyuya 100 μL eklemeden önce sabitleme çözeltisinin kanaldan akmasını sağlamak için birkaç saniye bekleyin. Diğer tarafta tekrar et. İnkübasyondan sonra PFA çözeltisi çıkarın ve DPBS ile 5 dakika boyunca 3x hafifçe yıkayın. Depolama için 200 μL/ kuyu DPBS'de bırakın ve ICC deneyine kadar 4 °C'de saklamak için 10 cm petri kabını parafilm ile kapatın.
- Hücreleri, ICC prosedürünün 1. gününde RT'de 20 dakika boyunca DPBS'de %0,1 Triton X-100 permeabilizasyon çözeltisi (100 μL/kuyu) ile kuluçkaya yatırın. Permeabilizasyon çözeltisini çıkarın ve RT'de 30 dakika boyunca% 0.1 Triton X-100 / DPBS çözeltisinde (100 μL / kuyu)% 5 normal eşek serumu ekleyin.
- %5 normal eşek serumu çözeltisini çıkarın ve %2 normal eşek serumunda primer antikorlu (Malzeme Tablosu) cihazları %0,1 Triton X-100/DPBS çözeltisinde kuluçkaya yatırın ve bir gecede 4 °C'de kuluçkaya yatırın.
- Birim degradesi uygulayın. Mikrogroovların bir tarafına 100 μL/kuyu antikor çözeltisi, diğer tarafına 150 μL/kuyu ekleyin (cihaz başına toplam 500 μL).
NOT: Mikrogroovların her iki tarafında farklı antikorlar kullanmak mümkündür. Bu durumda, bölmeler arasındaki akışkan izolasyonu sürdürmek için mikrogroovlar arasında birincil veya ikincil antikorlara sahip bir hacim gradyanı uygulamayın. Mikrogroovlardaki nötralentler gradyan olmadan lekelendirilmeyecektir.
- Birim degradesi uygulayın. Mikrogroovların bir tarafına 100 μL/kuyu antikor çözeltisi, diğer tarafına 150 μL/kuyu ekleyin (cihaz başına toplam 500 μL).
- Ertesi gün (ICC prosedürünün 2. günü), birincil antikorları çıkarın ve cihazı% 0.1 Triton X-100 / DPBS çözeltisi ile 5 dakika boyunca 3x dikkatlice yıkayın.
NOT: Kolayca ayrılabilir kültürlerde, 5 dakika için 3x yıkama 30 dakika boyunca 1x ile değiştirilebilir. - İkincil antikorlar (Malzeme Tablosu) ışığa duyarlı olduğundan, bundan sonra karanlıkta çalışın. RT'de 1 saat boyunca %2 normal eşek serumunda ikincil antikor içeren hücreleri %0,1 Triton X-100/DPBS çözeltisinde kuluçkaya yatırın. Kuluçkadan sonra, ikincil antikorları çıkarın ve DPBS ile 5 dakika boyunca 3x yıkayın.
- Nükleer DNA'yı DPBS'de DAPI (100 μL/kuyu) ile RT'de 20 dakika boyunca etiketlenin ve ardından %0,1 Triton X-100/DPBS çözeltisi ile 3x-4x 5 dk yıkama. %0,1 Triton X-100/DPBS solüsyonunun tüm kuyulardan çıkarılmasını ve mühürlemek için her kuyuya bir damla Floresan montaj ortamı eklemeden önce kültürün birkaç saniye kurumasını bekleyin.
NOT: Montaj medyasının ayarlanabilmesi için cihazları en az 24 saat yatay tutun. 24 saat sonra, cihazlar 4 °C'de bir slayt kasasında saklanabilir. - Ters mikroskopla z yığınları halinde görüntü.
- NMJ'leri görüntülemek için, miyotube antikor (Malzeme Tablosu) ile işaretlenmiş miyotüpleri bulmak ve nöronal ve miyotube doku görüntülemesini sağlamak için z-stack kayıtları gerçekleştirmek için 40x hedef kullanın. Miyotütün tek bir kareye sığmayacak kadar büyük olması durumunda birden fazla görüntü alın.
- NMJ nicelemesi için, her z yığını boyunca nöronal presinaptik işaretleyici ile AChR işaretçisi arasındaki ortak lokalizasyonların sayısını manuel olarak sayın. Ortak yerelleştirme sayısını z yığınında bulunan miyotube sayısına normalleştirin.
9. Cihazın SEM için sabitlenmesi ve hazırlanması
NOT: Sıvıları değiştirirken, hücre çökmesini önlemek için kültürü kapsayacak şekilde her zaman az miktarda saklayın. Bu protokol son derece toksik maddeler kullanır ve tüm süreç boyunca kişisel koruyucu ekipmanla ve duman kaputunda çalışmak gerekir.
- Sabitleme ve sökme: 0,1 M sodyum kakadodylat tamponunda (pH 7,6) taze %2,5 glutaraldehit (GA) hazırlayın, 0,2 μm filtreli filtre hazırlayın ve 37 °C'ye kadar ısıtın.
DİkKAT: GA ve sodyum kakodylat toksiktir: kişisel koruyucu ekipmana sahip bir duman kaputunda tutamak.- Medya ve hücre kalıntılarını gidermek için cihazı DPBS ile bir kez dikkatlice yıkayın ve ardından RT'de 15 dakika boyunca GA çözeltisi ile önekleyin.
- Cihazı kümeslerle sabitlerken SEM levhasını cihazın çevresine dikkatlice kesmek için bir neşter kullanın. Keserken cihazı ayırmamaya dikkat edin. Cihazı ve SEM levhasını forseps yardımıyla 3 cm Petri kabına taşıyın ve kolay kullanım için 3 cm'lik kabı 10 cm'lik bir kabın içine yerleştirin.
- 15 dakikalık önekten sonra, cihazı uzunlagılar kullanarak SEM sayfasından dikkatlice çıkarın. Cihazı bir köşede ayırın ve yavaşça çapraz yönde karşı köşeye doğru çıkarın. Aygıttan ayırılan hücreleri gözlemleyin.
- SEM sayfasının tamamını 3 cm'lik çanağa örtmek için ek GA çözeltisi ekleyin ve RT'de veya 4 °C'de gece boyunca toplam 2 saat sabitlemeye devam edin.
NOT: Hücre kaplı yüzeylerden kaçınarak SEM sayfasını GA çözeltisinin altına forsepsle hafifçe itin.
- SEM için standart bir protokolle devam edin. Kısacası, osmiyum tetroksitte kuluçkaya yatırın ve ardından dereceli bir etanol serisi ile dehidrasyon. Kritik nokta kurutma için SEM levhayı bir kapak tutucusuna yerleştirin ve karbon çıkartmalar ve kaplama için destek saplamalarına monte edin. 5 kV hızlanan voltajda ve 7 mm çalışma mesafesinde görüntü almak için bir tarama elektron mikroskobu kullanın.
10. Canlı hücre kalsiyum görüntüleme kullanılarak NMJ işlevselliğinin değerlendirilmesi
- Cihazları hazırlayın: Myotube bölmesini 200 μL/günün kuyusu ile yenileyin 18 motor nöron bazal ortam, 30 ng/mL BDNF, GDNF ve CNTF ve motor nöron bölmesi 200 μL/kuyu motorlu nöron bazal ortam ile büyüme faktörleri olmadan (Tablo 2 ve Tablo 3).
- Fluo-4 boya çözücüde seyreltilmiş Fluo-4 boyasını 5 μM'lik son konsantrasyonda miyotube bölmesine ekleyin ve cihazı 37 °C'de karanlıkta kuluçkaya yatırın, 25 dakika boyunca% 5 CO2 . Cihaz inkübasyon altındayken, potasyum klorürü 450 mM'lik son konsantrasyonda büyüme faktörleri olmadan motor nöron bazal ortamda seyreltin.
NOT: Fluo-4, kalsiyum bağlanması üzerine floresan artışı gösteren bir kalsiyum göstergesidir. Boya ışığa duyarlı olduğu için bundan sonra karanlıkta çalışın. - 25 dakika sonra, miyotüp bölmesini 200 μL / günün kuyusu ile yenileyin 18 motor nöron bazal ortam ve 30 ng / mL BDNF, GDNF ve CNTF ile motor nöron bölmesi ve kemotatik ve hacimsel gradyanı yeniden kurmak için büyüme faktörleri olmadan 100 μL / kuyu motor nöron bazal orta ile motor nöron bölmesi.
- NMJ'leri engellemek için, miyotube bölmesi ortamını AChR rekabetçi antagonist tubocurarine hidroklorür pentahydratının 19 μM'si ile tamamlar.
DİkKAT: Tubocurarine hidroklorür pentahydrat toksiktir: kişisel koruyucu ekipmana sahip bir duman kaputunda sapın.
- Fluo-4 boya çözücüde seyreltilmiş Fluo-4 boyasını 5 μM'lik son konsantrasyonda miyotube bölmesine ekleyin ve cihazı 37 °C'de karanlıkta kuluçkaya yatırın, 25 dakika boyunca% 5 CO2 . Cihaz inkübasyon altındayken, potasyum klorürü 450 mM'lik son konsantrasyonda büyüme faktörleri olmadan motor nöron bazal ortamda seyreltin.
- Kayıtları 37 °C, %5 CO2'ye ayarlanmış bir inkübatörle donatılmış ters konfokal mikroskopla gerçekleştirin.
- 10x hedefiyle, miyotube bölmesindeki miyotütleri bulmak için parlak alan kanalını kullanın. 488 kanalı için lazer gücünü, kazancını ve ofsetini Fluo-4 floresansının tek tek miyotüpleri işaretlediği bir seviyeye ayarlayın.
NOT: Yazılımın A1 ayarlarındaki kaydırma çubukları % 5 lazer gücüne, 60 (HV) kazanıcıya ve 0 uzaklığına ayarlanarak temsili sonuçlar elde edildi.
- 10x hedefiyle, miyotube bölmesindeki miyotütleri bulmak için parlak alan kanalını kullanın. 488 kanalı için lazer gücünü, kazancını ve ofsetini Fluo-4 floresansının tek tek miyotüpleri işaretlediği bir seviyeye ayarlayın.
- Kayıt süresini 1 s aralıklarla 1 dakika olarak ayarlayın. 5-10 s'nin bir taban çizgisine sahip olması, ardından motor nöronların potasyum klorür çözeltisi ile hemen uyarılması için kayıt.
- Kayda 5-10 sn'den sonra, 50 mM'lik son konsantrasyona ulaşmak için motor nöron bölmesinin bir kuyusuna yavaşça 25 μL potasyum klorür çözeltisi ekleyin.
NOT: Potasyum klorür çözeltisini çok hızlı eklemekten kaçının, çünkü bu kanaldan bir dalga oluşturarak kayıtta eserlere neden olur.
- Kayda 5-10 sn'den sonra, 50 mM'lik son konsantrasyona ulaşmak için motor nöron bölmesinin bir kuyusuna yavaşça 25 μL potasyum klorür çözeltisi ekleyin.
- Motor nöron depolarizasyondan bağımsız olarak doğrudan miyotube aktivitesini değerlendirmek için miyotube bölmesini motor nöron stimülasyonu ile iki kez 2 dakikalık bir duraklama ile kaydedin, ardından miyotüp bölmesinin 25 μL potasyum klorür çözeltisi ile doğrudan stimülasyon.
- Nicelemeler için, her miyotülü kayıt yazılımıyla manuel olarak daire içine edin ve 1 dakikalık zaman dilimi boyunca Fluo-4 floresan yoğunluğunu analiz edin. Kalsiyum akınındaki artışı belirlemek için, potasyum klorür ile uyarılmadan sonra ortalama taban çizgisi değerini (yani potasyum klorür stimülasyonundan önceki ilk 10 sn'den ortalama) en yüksek değerden çıkarın. Temsili sonuçlar, yazılımın Zaman Ölçümü aracı kullanılarak elde edilmiştir.
Sonuçlar
Mikroakışkan cihazlarda NMJ üretimi
Ticari olarak kullanılabilen mikroakışkan cihazlarda fonksiyonel NMJ'lere sahip bir insan motor ünitesi oluşturmak için insan iPSC türevli motor nöronlar ve insan MAB türevi miyotubes kullanılmıştır. Başlangıç hücresi malzemesinin kalitesi önemlidir ve özellikle MAB'lerin miyotubelara füzyon yeteneği bu protokolün başarılı bir sonucu için çok önemlidir. MAB'leri kültürde tutmak kolaydır. Bununla birlikte, mikroakışkan cihazlara uygulamadan önce her partinin füzyon kapasitesini değerlendirmek önemlidir (Ek Şekil 1A,B)18. 10 günlük farklılaşmadan sonra miyotube oluşumunu göstermeyen partiler kullanılmamalıdır. Ek Şekil 1B'deki füzyon indeksi, görüntü başına toplam çekirdek sayısının her bir miyotube işaretçisi için pozitif olan myotube'lardaki çekirdek yüzdesi hesaplanarak belirlendi. NMJ'lerin üretilmesinde ortak kültürümüz için yaklaşık %8'lik bir füzyon indeksinin yeterli olduğunu gördük.
Saf bir iPSC kültüründen motor nöron farklılaşmasına başlamak her zaman önemlidir. Girdi ne kadar saf olursa sonuç o kadar saftır. Motor nöron farklılaşma protokolü, motor nöron belirteçleri için tipik olarak% 85-% 95 pozitif olan motor nöron kültürleri üretir (Ek Şekil 1C,D)18. Kalan hücreler genellikle farklılaşmamış öncül hücreler olacaktır, bu da bazı durumlarda geniş bir çoğalma geçirecek ve böylece kültürün kalitesi üzerinde olumsuz bir etkiye sahip olacaktır. Bu protokolün en iyi sonucunu elde etmek için, 10 motor nöron-NPC'yi cihaza uygulamadan önce motor nöron farklılaşma verimliliği değerlendirilmelidir. Buna ek olarak, NPC işaretleyici Olig2 ifadesini değerlendirmek için 11. günde bir NPC kalite kontrolü yapılabilir (Ek Şekil 1E,F).
Başlangıçta, motor nöron-NPC'ler ve MAB'ler 10. Burada MAB farklılaşması 11. 14. günde uygulanan hacim ve büyüme faktörü gradyanı, 21. İlginçtir ki, ICC tarafından karakteristik NMJ oluşumunu gözlemleyebiliriz (Ek Şekil 2A). Bununla birlikte, motor nöron farklılaşmasında bu kadar erken canlı hücre kalsiyum kayıtları aracılığıyla fonksiyonel bir çıktı elde edemedik (veriler gösterilmedi). Motor nöronların henüz miyotubelarla fonksiyonel NMJ bağlantıları oluşturacak kadar olgun olmadığı sonucuna vardık, ancak NMJ morfolojisi umut verici görünüyordu. Bu, yama kelepçesi elektrofizyolojik analizi ile kaydedilen motor nöronlardaki spontan etki potansiyellerinin sadece motor nöron farklılaşmanın 35.
Buna ek olarak, MAB'leri kaplamadan önce motor nöronları 2 hafta (24 gün) boyunca olgunlaşarak motor nöron olgunlaşmasını ve ortak kültür sürdürülebilirliğini uzatmaya çalıştık. Ne yazık ki, mikrogroovlardan çok miktarda spontan motor nöron-neurit geçişi gözlendi ve bu da MAB ekinin inhibisyonunu ile sonuçlandı (Ek Şekil 2B). Kanaldaki miyotube formasyonunun olmaması nedeniyle 36. günde NMJ'leri tespit etmede başarısız olduk ve bu nedenle 28 günlük protokolü uyguladık (Şekil 1).
In vitro NMJ'lerin tanımlanması, nicelleştirilmesi ve morfolojik karakterizasyonu
28 günlük protokole (Şekil 1) uyduktan sonra, tamamen işlevsel NMJ'ler elde edilebilir. Hem in vivo hem de in vitro, NMJ'ler presinaptik bir belirteç ve postsinaptik bir belirtecin birlikte lokalizasyonu yoluyla immünhisto veya immünostokimyasal olarak karakterize edilir. Bu çalışmada, motor nöronun somasından en distal sürece doğru tek bir neurit takip edilmesine izin veren nörofilament ağır zincir (NEFH) ve SYP'nin presinyaptik belirteç kombinasyonu olarak bir kombinasyonu kullanılmıştır. Kas tarafında, Btx yaygın olarak AChR'ler için postsinaptik bir belirteç olarak kullanılır ve aynı şekilde bu çalışmada da kullanılmıştır. Agrin ve laminin takviyesi, AChR'lerin sarkolemma19,20,21'de kümelenmesine teşvik eder, bu da AChR'lerin in vitro olarak tanımlanmasını kolaylaştırır ve aynı şekilde mevcut ACHR ve NMJ sayısını arttırır18.
NMJ'leri tarafsız bir şekilde bulmak ve hesaplamak için, her miyotüp miyosin ağır zinciri (MyHC) pozitifliği ile tanımlanır ve ters konfokal mikroskop kullanılarak 40x büyütmede z yığınları halinde görüntülenir. Çok uzun miyotubes için birden fazla z-stack alındı. Görüntü analizi için, NEFH/SYP ve Btx arasındaki ortak yerelleştirmelerin sayısı her z yığını boyunca el ile sayılır ve birlikte yerelleştirme sayısı z yığınında bulunan miyotüt sayısına normalleştirilir (Şekil 2A-C)18. Tüm miyotube'larda, içselleştirilmiş miyotütlerin niceminde görüldüğü gibi NMJ'ler olmayacaktır (Şekil 2D). Sonuç olarak, Btx varlığından bağımsız olarak tüm miyotütlerin görüntülendiği tarafsız bir kayıt yaklaşımı gerçekleştirmek önemlidir.
Bu in vitro sistemde iki tür morfolojiyi tanımlamak mümkündür. NMJ'ler, bir neurite'in bir etkileşim noktasındaki bir ACHR kümesine dokunduğu tek temas noktası NMJ'leri veya bir neurite'nin daha büyük bir yüzey üzerinde AChR kümesiyle etkileşime gireceği birden fazla temas noktası NMJ'si olarak görünür. Bu iki morfoloji hem immünosimyatik olarak (Şekil 2A)18 hem de SEM (Şekil 2B)18 ile tanımlanabilir ve aynı şekilde ölçülebilir (Şekil 2C)18. Genel olarak, çoklu temas noktaları, daha olgun bir NMJ oluşumuna işaret eden büyük bir kas yerleştirme yoluyla daha geniş bir bağlantıyı kolaylaştırır. Buna karşılık, tek temas noktası NMJ'ler kültürün erken gelişimsel durumu nedeniyle daha az olgun olarak kabul edilir.
In vitro NMJ'lerin fonksiyonel değerlendirmesi
NMJ'lerin işlevselliğini değerlendirmek için canlı hücreli kalsiyum geçici kayıtları kullanılmıştır (Şekil 3)18. Mikroakışkan cihazların akışkan izole sisteminden yararlanan motor nöron soma tarafı, yüksek konsantrasyonda (50 mM) potasyum klorür ile uyarılırken, aynı zamanda kalsiyuma duyarlı Fluo-4 boyası ile yüklenen miyotüplerdeki kalsiyum akınını kaydetti (Şekil 3A). Motor nöron aktivasyonundan hemen sonra, motor nöron-neurit ve miyotube aracılığıyla fonksiyonel bir bağlantıyı doğrulayan karakteristik bir dalga oluşumu yoluyla miyotüplerde kalsiyum akını gözlemleyebiliriz (Şekil 3A-C)18. Potasyum klorür ile doğrudan stimülasyon üzerine miyotube kasılması gözlenmesine rağmen spontan kalsiyum dalgaları veya spontan miyotüp kasılmaları gözlenmedi. Bağlantının özgüllüğü, rekabetçi AChR antagonisti, tubocurarine hidroklorür pentahydrat (DTC) miyotüp bölmesine (Şekil 3A) eklenerek daha da doğrulandı ve bu da kalsiyum akınının inhibisyonu ile sonuçlandı (Şekil 3C). Bu etki, motor nöronlar ve miyotubelar arasındaki bağlantının tamamen işlevsel NMJ'lerle sonuçlendiğini doğruladı. Aktif miyotütlerin sayısını NMJ stimülasyonu yoluyla değerlendirmek için, miyotüt bölmesi doğrudan potasyum klorür ile uyarılmış ve bu bölmedeki toplam aktif miyotüt sayısını tanımlamaktadır. Miyotüplerin yaklaşık %70'i potasyum klorür ile motor nöron uyarılmış aktivasyon yoluyla aktifti (Şekil 3D)18.
Bu sonuçlar, 28 günlük bir protokol sırasında iPSC türevi motor nöronların ve MAB türevli miyotüplerin birlikte kült haline alınması yoluyla en uygun NMJ oluşumunu, sayısını, morfolojisini ve işlevselliğini doğrulamamaktadır.
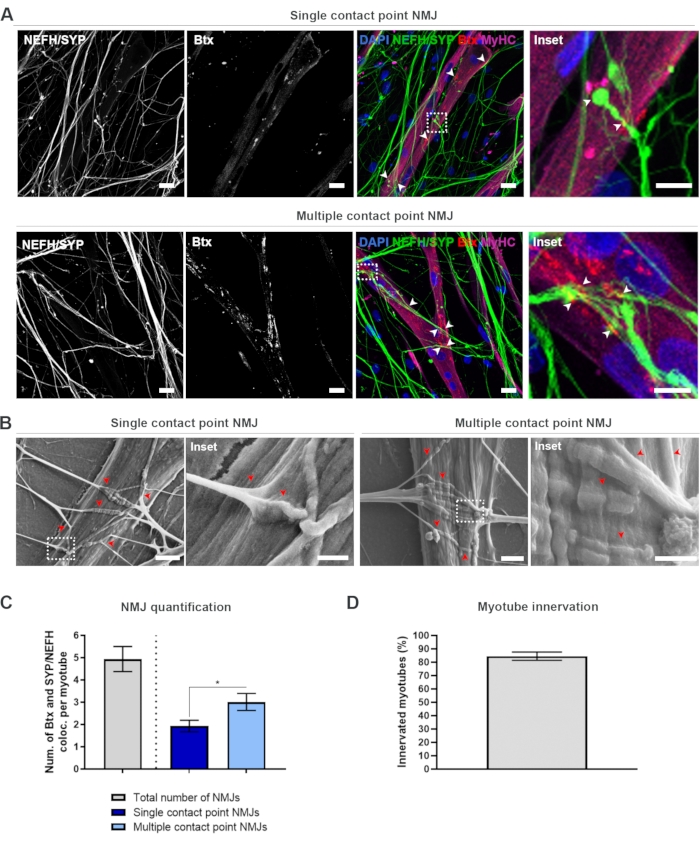
Şekil 2: Mikroakışkan cihazlarda NMJ oluşumu. (A) 28. günde önceden monte edilmiş mikroakışkan cihazlarda NMJ oluşumunun konfokal mikrografileri. NMJ'ler, MyHC lekeli miyotubeslarda presinyaptik belirteçlerin (NEFH ve SYP) ve postsinaptik AChR işaretleyicisinin (Btx) ortak lokalizasyonu (ok uçları) aracılığıyla tanımlanır. NMJ'ler, nötrerler ve AChR kümeleri arasındaki tek veya çoklu temas noktası oluşumu yoluyla morfolojik olarak tanımlanır. DAPI etiket çekirdeği. Ölçek çubuğu, 25 μm. Inset, bir NMJ'nin büyütme olduğunu gösterir. İç ölçek çubuğu, 28. günde silikon mikroakışkan cihazlarda 10 μm. (B) SEM NMJ morfolojisi. Ok uçları miyotüme neurite gömme tasvir. Ölçek çubuğu, 2 μm. Inset, NMJ'nin büyüttme olduğunu gösterir. İç ölçek çubuğu, 1 μm. (C) Miyotube başına toplam NMJ sayısının ve miyotube başına tek ve çoklu temas noktası NMJ sayısının ölçülmesi. Grafik, dört biyolojik kopyadan ortalama ± standart hatası olarak gösterilir. İstatistiksel önem, * p < 0.05 ile Mann-Whitney testi ile belirlenir. (D) İçselleştirilmiş miyotütlerin yüzdesinin ölçülmesi. Grafik, dört biyolojik kopyadan ortalama ± standart hatası olarak gösterilir. Bu rakam Stoklund Dittlau, K. ve ark.18'den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
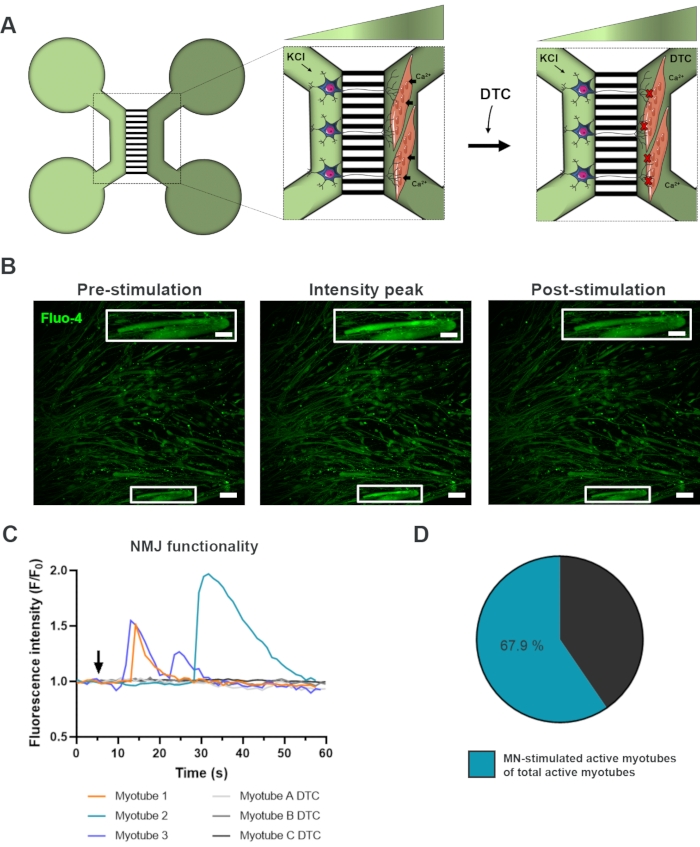
Şekil 3: NMJ işlevselliğinin onaylanması. (A) Tubocurarine (DTC)22 ile NMJ tıkanıklığı öncesi ve sonrası 28. Açık yeşil bölmedeki motor nöronlar, neuritler yoluyla hücre içi motor nöron yanıtına neden olan 50 mM potasyum klorür (KCl) ile uyarılır. Bu, kalsiyuma duyarlı Fluo-4 boyası (koyu yeşil bölme) ile etiketlenmiş miyotubelarda kalsiyum (Ca2+) akınını çağrıştırır. (B) KCl ile motor nöron stimülasyonu üzerine hücre içi kalsiyum artışı dalgasını gösteren bir miyotülün pre-stimülasyonu, yoğunluk zirvesi ve sonrası uyarılmasının fluo-4 floresan mikrografileri, içselleştirilmiş aktif bir miyotülün büyütmesini gösterir. Ölçek çubukları, 100 μm. İç ölçek çubuğu, 200 μm. (C) NMJ işlevselliğini onaylayan KCl (ok) ile motor nöron stimülasyonundan sonra miyotüplerde temsili kalsiyum akışı eğrileri. Myotube 1-3, motor nöron-miyotube innervasyonu yoluyla karakteristik kalsiyum eğrileri gösterirken, myotube A-C DTC, DTC ile NMJ bloke edildikten sonra eğrileri gösterir. (D) Motor nöron uyarılmış aktif miyotütlerin toplam aktif miyotüt sayısı üzerindeki oranı. Bu rakam Stoklund Dittlau, K. ve ark.18'den değiştirilmiştir. Hücre çizimleri Smart Server medical Art22'den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Motor nöron doğrulaması, MAB füzyon indeksi ve NPC kalite kontrolü. (A) Farklılaşmanın başlatılmasından 10 gün sonra MAB türevi miyotütlerin konfokal görüntüleri. Miyotubelar miyotube işaretleyicileri ile etiketlenir: desmin, MyHC, miyogenin (MyoG) ve titin. Çekirdekler DAPI ile boyanmıştır. Ölçek çubuğu, 100 μm. (B) Farklılaşmanın başlatılmasından 10 gün sonra MAB füzyon indeksinin nicelemesi. Açlıktan sonra, MGB'ler miyotube işaretleyici pozitifliği (AB+) için ölçülen çok yönlü miyotütlere kaynaşır. Grafik, ortalamanın üç biyolojik kopyadan standart ± hatası anlamına gelir. (C) Pan-nöronal belirteç βIII-tubulin'e (Tubulin) ek olarak motor nöron belirteçleri NEFH, kolin asetiltransfezaz (ChAT) ve Adacık-1 ile etiketlenen farklılaşmanın 28. Çekirdekler DAPI ile boyanmıştır. Ölçek çubukları, 75 μm. (D) Motor nöron ve pan-nöron belirteçleri (AB+) için pozitif olan hücre sayısının nicelemesi. Grafik, ortalamanın üç biyolojik kopyadan standart ± hatası anlamına gelir. (E) NPC işaretleyici Olig2 ve pan-nöronal belirteç βIII-tubulin (Tubulin) ile etiketlenen motor nöron farklılaşmanın 11. Çekirdekler DAPI ile boyanmıştır. Ölçek çubukları, 50 μm. (F) Olig2 ve βIII-tubulin (AB+) için pozitif olan NPC sayısının nicelemesi. Grafik, ortalamanın üç biyolojik kopyadan standart ± hatası anlamına gelir. Bu rakam Stoklund Dittlau, K. ve ark.18'den değiştirilmiştir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: Ortak kültür protokolünün optimizasyonu (A) NMJ oluşumunun konfokal görüntülerinin motor nöron farklılaşmasının 21. NMJ'ler, MyHC lekeli miyotubeslarda presinyaptik belirteçlerin (NEFH ve SYP) ve postsinaptik AChR işaretleyicisinin (Btx) ortak lokalizasyonu (ok uçları) aracılığıyla tanımlanır. Ölçek çubuğu (solda), 10 μm. Ölçek çubuğu (sağda), 5 μm. (B) Myotube kanalının 24. Ölçek çubuğu, 100 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
| Reaktif | Stok konsantrasyonu | Son konsantrasyon |
| IMDM | 1x | 80% |
| Fetal sığır serumu | 15% | |
| Penisilin/Streptomisiin | 5000 U/mL | 0.5% |
| L-glutamin | 50x | 1% |
| Sodyum piruvat | 100 mM | 1% |
| Esansiyel olmayan amino asitler | 100x | 1% |
| İnsülin transferrin selenyum | 100x | 1% |
| bFGF (taze eklendi) | 50 μg/mL | 5 ng/mL |
Tablo 1: MAB büyüme ortamı. Orta 4 °C'de 2 hafta sürebilir.
| Reaktif | Stok konsantrasyonu | Son konsantrasyon |
| DMEM/F12 | 50% | |
| Nörobakal ortam | 50% | |
| Penisilin/Streptomisiin | 5000 U/mL | 1% |
| L-glutamin | 50x | 0.5 % |
| N-2 takviyesi | 100x | 1% |
| A vitamini içermeyen B-27 | 50x | 2% |
| β-mercaptoethanol | 50 mM | 0.1% |
| Askorbik asit | 200 μM | 0,5 μM |
Tablo 2: Motor nöron bazal ortam. Orta 4 °C'de 4 hafta sürebilir.
| Gün | Reaktif | Stok konsantrasyonu | Son konsantrasyon | Kompartıman |
| Gün 10/11 | Yumuşatılmış agonist | 10 mM | 500 nM | Her ikisi |
| Retinoik asit | 1 mM | 0,1 μM | ||
| DAPT | 100 mM | 10 μM | ||
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 14. Gün | DAPT | 100 mM | 20 μM | Her ikisi |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 16. Gün | DAPT | 100 mM | 20 μM | Her ikisi |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 18. Gün | BDNF | 0.1 mg/mL | 10 ng/mL | Motor nöron |
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 21. Gün+ | BDNF | 0.1 mg/mL | 30 ng/mL | Myotube |
| GDNF | 0.1 mg/mL | 30 ng/mL | ||
| CNTF | 0.1 mg/mL | 30 ng/mL | ||
| Agrin | 50 μg/mL | 0,01 μg/mL | ||
| Laminin | 1 mg/mL | 20 μg/mL | ||
| 21. Gün+ | Takviye yok | Motor nöron |
Tablo 3: Motor nöron orta takviyeleri. Takviyeler motor nöron bazal ortama kullanım gününde taze eklenir.
| Gün | Reaktif | Stok konsantrasyonu | Son konsantrasyon | Kompartıman |
| 18. Gün | DMEM/F12 | 97% | MEMİLİ | |
| Sodyum piruvat | 100 mM | 1% | ||
| At serumu | 2% | |||
| Agrin | 50 μg/mL | 0,01 μg/mL |
Tablo 4: MAB farklılaşma ortamı. Orta 4 °C'de 2 hafta sürebilir. Agrin kullanım gününde taze eklenir.
Tartışmalar
Protokol, 30 günden kısa bir sürede ticari olarak kullanılabilen mikroakışkan cihazlarda fonksiyonel NMJ'lere sahip insan motor üniteleri üreten nispeten kolay bir kullanım yöntemini tanımlamaktadır. NMJ'lerin ICC ve SEM gibi standart tekniklerle ve fonksiyonel olarak canlı hücre kalsiyum kayıtlarıyla morfolojik olarak nasıl değerlendirilebileceği açıklanmaktadır.
Bu protokolün büyük bir avantajı kök hücre teknolojisinin kullanılmasıdır. Bu, NMJ'lerin donör profilinden bağımsız olarak hem sağlık hem de hastalıkta değerlendirilebileceği tam uyum sağlar. Model, FUS geninde mutasyonlara bağlı olarak neurit büyüme, yeniden büyüme ve NMJ sayılarındaki bozuklukları yeni fenotipler olarak tanımladığımız ALS araştırmalarında zaten başarılı ve faydalı olduğunu kanıtlamıştır18. Bu model ile sporadik ALS hastalarından iPSC'ler kullanılarak, etiyolojinin bilinmediği ALS'nin sporadik formlarını da kapsayacak şekilde araştırmayı genişletmek mümkündür. Bu, insan hastalığını yeniden canlandırmak için mutasyona uğramış genlerin transgenik aşırı ifadesine dayanan geleneksel hayvan modellerine göre bir avantaj sağlar23,24. Buna ek olarak, tamamen insan sistemimiz, insana özgü fizyoloji ve hastalığın potansiyel olarak yeniden kapsüllenmesine izin verir. Önceki çalışmalar kemirgen ve insan NMJ morfolojisi arasındaki farkları göstermiştir25, bu da insan NMJ patolojisini ele almak için kemirgenler kullanırken dikkatli olunması gerektiğini göstermektedir. Bu sistem, bir in vivo modelin karmaşıklığından yoksun nispeten basit bir in vitro kurulum olmasına rağmen, mikroakışkan cihazlarda görüntülenen NMJ morfolojisinin insan amputatlarının NMJ'lerine benzediğini göstermek mümkündü25. Ayrıca, bu model NMJ oluşumu ve olgunlaşması sırasında NMJ değerlendirmesine izin verir ve insan ölüm sonrası örneklerinde bulunmayan, tanımlanamayan veya göz ardı edilen erken hastalık fenotiplerini potansiyel olarak ortaya çıkarır.
MAU'lar miyotüpler oluşturmak için geçerli bir seçenek sağlar, ancak 10 günlük sınırlı hayatta kalmaları sistemin bir dezavantajıdır. Miyotüp hayatta kalma, muhtemelen miyoberlerin spontan kasılmaları ile tehlikeye giren yüzeye bağlanmalarına dayanır. 10 günden fazla bir süre sonra, çoğu miyotüt ayrılmış olacak ve NMJ kültürünü kullanılamaz hale getirecek. İdeal olarak, miyotube'lar iPSC'lerden de oluşturulur. Bununla birlikte, mevcut protokollerin füzyon indeksinde değişkenlik nedeniyle 26'yı çoğaltmanın zor olduğu kanıtlanmıştır27,28,29,30.
Ticari olarak kullanılabilen mikroakışkan cihazları kullanarak, tamamen erişilebilir standartlaştırılmış bir sistem oluşturduk. Diğer NMJ modelleri var31,32,33,34,35,36,37,38,39,40,41,42. Bununla birlikte, genellikle hücre tipleri arasında bölümlere ayırma ve akışkan izolasyondan yoksun olan tek bölmelere veya kullanılabilirliği ve potansiyel olarak tekrarlanabilirliği düşüren özel yapım kültür gemilerine güvenirler. Bu protokol için kullanılan mikroakışkan cihazlar, aksonal taşıma43,44 veya axotomy18,45,46 incelemeleri gibi daha fazla analize izin veren çeşitli uzunluklardaki mikrogroovlarla satın alınabilir. Bölmeler arasındaki akışkan izolasyon, motor nöronların veya miyotüplerin bölümlere ayrılmış ilaç tedavisini daha da sağlar ve bu da tedavi gelişiminde elverişli olabilir. Çok çeşitli cihaz tasarımı ve özelliklerine açılan ve in vitro araştırmalar için erişilebilirliği daha da teşvik eden mikroakışkanlar konusunda uzmanlaşmış daha fazla şirket ortaya çıkmıştır.
Sonuç olarak, fonksiyonel NMJ'lerle insan motor ünitelerini kültüre etmek için güvenilir, çok yönlü ve kolay bir yöntem sağlayan bir protokol geliştirdik.
Açıklamalar
L.V.D.B. Charcot-Marie-Tooth hastalığında (US-2013227717-A1) HDAC inhibitörlerinin kullanımına ilişkin bir patente sahiptir, Augustine Therapeutics'in bilimsel kurucularından ve bilimsel danışma kurulunun bir üyesidir. Diğer yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Yazarlar, canlı hücre kalsiyum geçici floresan kayıtları hakkındaki tavsiyeleri için LiMoNe, Research Group Moleküler Nörobiyoloji'den (VIB-KU Leuven) Nikky Corthout ve Sebastian Munck'a teşekkür ediyor. Bu araştırma Fulbright Komisyonu tarafından Belçika ve Lüksemburg, KU Leuven (C1 ve "Geleceği Açma" Fonu), VIB, Bilim ve Teknoloji İnovasyon Ajansı (IWT; SBO-iPSCAF), "Bilimsel Araştırmalar Fonu Flanders" (FWO-Vlaanderen), Target ALS, ALS Liga België (A Cure for ALS), Belçika Hükümeti (Belçika Federal Bilim Politika Ofisi tarafından başlatılan Üniversitelerarası Cazibe Direkleri Programı P7/16), Thierry Latran Vakfı ve "Association Belge contre les Maladies neuro-Musculaires" (ABMM). T.V. ve J.B.
Malzemeler
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Referanslar
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır