Method Article
在微流体装置中生成具有功能性神经肌肉接头的人类运动单元
摘要
我们描述了一种在市售微流体装置中产生人类运动单元的方法,方法是将人诱导多能干细胞衍生的运动神经元与人类原代介观细胞衍生的肌管共同培养,从而形成功能活性的神经肌肉接头。
摘要
神经肌肉接头(NMJ)是下运动神经元的轴突和肌肉之间的特殊突触,促进肌肉收缩的参与。在运动神经元疾病中,如肌萎缩性侧索硬化症(ALS)和脊髓性肌萎缩症(SMA),NMJs退化,导致肌肉萎缩和进行性麻痹。NMJ退化的潜在机制尚不清楚,主要是由于缺乏可翻译的研究模型。这项研究旨在创建具有功能性NMJ的人类运动单元的多功能且可重复的 体外 模型。因此,在市售的微流体装置中共培养了人诱导多能干细胞(hiPSC)衍生的运动神经元和人原发性介观母细胞(MAB)衍生的肌管。使用流体隔离的微隔室可以维持细胞特异性微环境,同时允许通过微凹槽进行细胞间接触。通过应用趋化和体积梯度,刺激运动神经元 - 神经突起通过促进肌管相互作用的微凹槽的生长和NMJ的形成。这些NMJ通过运动神经元突触前标志物突触素(SYP)和突触后乙酰胆碱受体(AChR)标志物α-bungarotox(Btx)在肌管上的共定位进行免疫细胞化学鉴定,并使用扫描电子显微镜(SEM)进行形态学表征。NMJ的功能通过测量运动神经元去极化时肌管中的钙反应来证实。使用标准微流体装置和干细胞技术生成的运动单元可以帮助未来专注于健康和疾病中NMJ的研究。
引言
NMJ通过释放神经递质促进下脊柱运动神经元和骨骼肌纤维之间的通信1。在ALS和SMA等运动神经元疾病中,NMJs退化,导致与肌肉的通信中断2,3,4,5,6,7。这导致患者逐渐失去肌肉功能,这导致他们被轮椅束缚,并最终依赖于呼吸系统生命支持,因为重要肌肉群如隔膜等逐渐萎缩。导致这些疾病中NMJs严重丧失的确切潜在机制尚不清楚。已经对转基因动物模型进行了许多研究,这使我们对NMJ变性的发病机制有了一定的了解5,6,8,9,10,11。然而,为了充分了解病理学并抵消去神经支配,重要的是要有一个允许完全可及性的人类系统。
在这里,该协议描述了一种相对简单的方法,通过使用市售的微流体装置共培养hiPSC衍生的运动神经元和人类原代MAB衍生的肌管来产生人类NMJ。自20世纪70年代末首次描述"Campenot"室12 以来,使用微流体来极化和流体分离神经元的体细胞和轴突就已经为人所知。从那时起,已经制造了更多的微流体设计,包括商业选择。该协议中使用的设备包含两个隔间,每个隔间由两个与通道13连接的孔组成。两个隔间是镜像的,并用几个微槽连接。这些微凹槽的尺寸有助于神经突生长,同时通过毛细管静水压力保持两个隔室之间的流体隔离13,14。使用该系统,可以在一个隔室中培养运动神经元,在另一个隔室中培养肌肉细胞,每个隔室在其特定的培养基中培养,同时仍然通过穿过微凹槽的神经突起并促进物理连接并与肌肉细胞结合。该模型为人类运动单元提供了一个完全可访问和适应性强的 体外 系统,可用于研究ALS和SMA等疾病的早期NMJ病理学。
研究方案
从所有受试者那里获得了书面知情同意,他们为iPSC生成和MAB收获提供了样本。该程序由鲁汶大学医院医学伦理委员会(编号S5732-ML11268)和英国主要研究伦理委员会批准,作为StemBANCC项目的一部分。本方案中使用的所有试剂和设备均列在 材料表中 ,应无菌使用。除非另有说明,否则使用前应将培养基加热至室温(RT)。有关共培养方案的概述,请参见 图 1。
1. 运动神经元祖细胞与iPSCs的分化
- 遵循运动神经元分化方案15,该协议改编自先前的研究16,直到达到第10天神经祖(NPC)状态。根据协议的时间范围,分化在星期一(第0天)开始,这导致星期四的第10天NPC。
- 将第10天的NPC以每瓶2×106-4×10 6个细胞的 密度冷冻保存在用10%二甲基亚砜(DMSO)替代的敲除血清中。
注意:DMSO有毒:装在通风橱中,并配有个人防护装备。
注意:预计每天大约50%的10个NPC在解冻后至关重要。在此"第10天NPC"状态下停止运动神经元分化方案,并冷冻保存NPC以产生大量NPC,这些NPC可以在以后储存和使用,将共培养方案的总体时间线从28天减少到总共19天。
2. 人类MABs的派生和维护
注意:MABs是血管相关的间充质干细胞,在这种情况下,它们是从58岁的健康供体获得的活检中收获的。有其他商业来源。简要解释了获取 MABs 的协议。有关详细信息,请参阅详细协议17。使用前应将所有MAB培养基加热至37°C。
- 切碎活检组织,在生长培养基(表1)中涂有6厘米培养皿的胶原蛋白(来自小牛皮)上孵育2周。每4天更换一次培养基。
- 要制备胶原蛋白涂层,将100毫克胶原蛋白溶解在20毫升0.1M乙酸中。胶原蛋白需要时间溶解,因此在RT下将混合物放在摇摆平台上过夜。第二天,加注 80 mL ddH2O 至最终体积为 100 mL。
注意:乙酸是有毒的;装在通风橱中,配有个人防护装备。
注意:来自小牛皮涂层的胶原蛋白可以重复使用多达5倍。储存在4°C。 - 用胶原蛋白涂覆培养皿或烧瓶的整个表面,关闭并在层流内的室温下孵育20分钟。20分钟后,在新鲜容器中恢复胶原蛋白,关闭空的培养皿/烧瓶,在层流中RT放置10分钟。
- 将培养皿/烧瓶转移到培养箱过夜(或至少6小时)孵育(37°C,5%CO 2)。在接种细胞之前,用Dulbecco的磷酸盐缓冲盐水洗涤5次,不含钙或镁(DPBS)。
- 要制备胶原蛋白涂层,将100毫克胶原蛋白溶解在20毫升0.1M乙酸中。胶原蛋白需要时间溶解,因此在RT下将混合物放在摇摆平台上过夜。第二天,加注 80 mL ddH2O 至最终体积为 100 mL。
- 14天后,FACS(荧光活化细胞分选)对MABs进行人碱性磷酸酶17 的分选,然后进一步扩增。将MABs维持在生长培养基中胶原包衣的T75烧瓶上,并每2天更换一次生长培养基(每个烧瓶10mL)。
- 当达到70%汇合时,在设备中冷冻保存,传代或播种MABs。
注意:MABs由于细胞间接触时的自发融合而失去其肌原潜力。在扩展 MAB 时,请确保汇合度不要超过 70%。一个70%汇合的T75烧瓶含有大约600,000-800,000个细胞,可以冷冻保存在每瓶100,000个细胞。每个小瓶稍后可以解冻并接种在T75烧瓶中以进行膨胀。 - 为了传代MABs,用7 mL DPBS轻轻洗涤一次,然后在37°C下在5%CO 2 中孵育7mL MAB解离溶液3分钟以解离细胞。
- 用7mL生长培养基中和MAB解离溶液,轻轻刮擦细胞,并将细胞悬浮液转移到50mL离心管中。用额外的5 mL生长培养基轻轻洗涤烧瓶,以收集可能剩余的MABs。
- 将细胞悬浮液以300× g离心3分钟,然后直接传到新的胶原包衣T75烧瓶中进行扩增,冷冻保存在具有10%DMSO的敲除血清替代物中或在微流体装置中计数以接种。
注意:每周进行1x-2x传代以进行细胞扩增,直到最大传代次数为13。解离后,在显微镜下检查时,MAB呈球形且形状较大。
3. 预组装微流体装置的制备 - 第9天
注:该协议改编自微流体器件制造商的神经元器件实验方案,并已针对预组装和硅胶器件的使用进行了调整。在这里,预组装设备用于免疫细胞化学(ICC)和活细胞钙瞬时记录,而有机硅设备用于SEM。该协议的时间线遵循运动神经元分化方案的时间表。
- 在接种细胞的前一天准备微流体装置,因为涂层需要孵育过夜。根据运动神经元协议,这将是一个星期三。将约10毫升70%-100%乙醇加入10厘米培养皿中。使用镊子将设备从运输容器转移到培养皿中进行灭菌。
- 将设备浸没在乙醇中10秒,并将带有镊子的设备转移到一张纸上,在层流中风干约30分钟。翻转设备几次,让两面干燥。当设备干燥时,使用镊子将每个设备移动到单独的10厘米培养皿中,以便于操作
注意:乙醇是有毒的;装在通风橱中,配有个人防护装备 - 在DPBS中涂上聚L-鸟氨酸(PLO)(100μg/ mL)设备,并在37°C,5%CO 2 下孵育3小时。
- 使用P200移液器在DPBS中加入100μLPLO,尽可能靠近通道开口,并观察从顶部孔通过通道到底部孔的流体。随后,将DPBS中的100μLPLO加入底部孔中。
- 在微凹槽的另一侧重复,并通过在器件的一侧添加100μL来完成,以在器件的两个镜像侧之间产生体积梯度以涂覆微凹槽(例如,右侧200μL,左侧300μL)。3小时后,用DPBS洗涤设备3x5分钟。如果需要,请使用抽吸系统。
注意:在细胞的包衣或培养过程中,确保避免在通道中形成任何气泡。即使是很小的气泡也会在短时间内膨胀,从而抑制包衣,细胞接种或介质流过通道。如果流体在涂覆过程中停止在通道中,请从两侧将PLO溶液直接重悬到通道中。如果气泡仍然存在,请使用200μLDPBS冲洗通道并重复上述步骤3.3.1-3.3.2中所述的包衣过程。如果在细胞接种后出现气泡,则无法恢复设备,因为冲洗通道会损坏细胞。
- 在神经基质培养基中涂覆层粘连蛋白(20μg/ mL)装置,并在37°C,5%CO 2下孵育过夜。按照步骤3.3.1-3.3.2中的PLO涂层的相同说明进行操作。
- 第二天,使用P200移液器并将尖端放置在与通道开口相反的孔中,以从孔中除去层粘连蛋白涂层。将DPBS添加到所有孔中,并将带有DPBS的器件留在室温的层流中以进行细胞接种。
注意:从这一点开始,重要的是不要直接从通道中去除液体(层粘连蛋白涂层,DPBS,介质,固定溶液等),因为这可能会导致气泡形成。在接种细胞之前,始终在显微镜下检查设备。
4. 硅胶微流体器件的制备 - 第9天
- 在接种细胞的前一天准备有机硅微流体装置,因为涂层需要孵育过夜。根据运动神经元协议,这将是一个星期三。
- 将约10毫升70%-100%乙醇加入10厘米培养皿中。使用镊子将设备从运输容器转移到培养皿中进行灭菌。将设备浸没在乙醇中10秒,并用镊子转移到6孔板中的孔中,在层流中风干约30分钟。将设备侧放,让所有侧面干燥。
- 将扫描电镜片削成设备的大小(每侧留出几毫米)。重复步骤4.1.1中所述的灭菌。然后,用镊子转移到10厘米的培养皿中晾干。两到三个SEM片材将适合一个盘子。
- 在DPBS中涂覆PLO(100μg/ mL)设备和SEM片,并在37°C,5%CO 2 下孵育3小时。
- 向6孔板中的每个设备添加每孔1 mL PPBS中的DPBS。确保设备漂浮在PLO溶液的顶部,通道和微凹槽侧朝下进入液体。每10厘米培养皿在DPBS中加入10毫升PLO,并使用镊子将SEM片向下推入液体中。
注:扫描电镜片通常会漂浮在涂层溶液的顶部。在组装设备和片材之前,将SEM片材转动,使与PLO接触的表面接触到器件的通道和微凹槽表面。 - 3小时后,用DPBS洗涤设备和SEM片2x5分钟,然后用无菌水再次洗涤5分钟。如果需要,请使用抽吸系统。将每个SEM片材转移到单独的10厘米培养皿中,以便于处理。
注:设备和扫描电镜在组装前必须完全干燥。用无菌水进行最终洗涤,从DPBS中去除潜在的盐晶体,否则可能会抑制组装。
- 向6孔板中的每个设备添加每孔1 mL PPBS中的DPBS。确保设备漂浮在PLO溶液的顶部,通道和微凹槽侧朝下进入液体。每10厘米培养皿在DPBS中加入10毫升PLO,并使用镊子将SEM片向下推入液体中。
- 在显微镜下以层流工作。使用镊子将硅胶装置与通道和微凹槽面朝下以90°角安装到SEM片上,确保所有侧面对齐。轻轻按压到设备上,确保不仅密封外边缘,还密封孔、通道和微凹槽周围。
注意:粘合区域将显示为灰色,而尚未安装的区域在显微镜下将显示为清晰。确保所有区域密封良好,没有气泡,以避免在培养过程中设备脱落。如果碎屑或盐晶体堵塞安装,请在无菌水中重新清洗SEM片材和设备并晾干,然后再重试安装过程。如果微凹槽因在设备上用力过猛而失真,请从SEM工作表中完全卸下设备,然后再次尝试安装。安装设备后,在涂覆和更换介质时要小心。 - 在显微镜下以层流工作。在神经基质培养基中涂覆层粘连蛋白(20μg/ mL)装置,并在37°C,5%CO 2下孵育过夜。
注:过夜孵育会使硅胶器件硬化,并进一步将其密封在SEM片上。- 使用P200移液器将100μL层粘连蛋白溶液加入顶部孔中,尽可能靠近通道开口,并观察从顶部孔通过通道到底部孔的流体。检查井和通道周围的泄漏。
- 随后,向底部孔中加入100μL层粘连蛋白溶液并检查泄漏。在微凹槽的另一侧重复,并在器件的一侧额外增加100μL,以在器件的两个镜面之间产生体积梯度以涂覆微凹槽(例如,右侧200μL,左侧300μL)。
注:如果发生泄漏,请取下层粘连蛋白涂层,拆卸设备和扫描片,然后在无菌水中清洗。让它们干燥,然后从步骤4.3开始重复。 - 第二天,使用P200移液器将尖端定位在通道开口对面的孔中,从孔中去除涂层。将DPBS添加到所有孔中,并将带有DPBS的器件留在室温的层流中以进行细胞接种。
注意:从这一点开始,不要直接从通道中取出液体(层粘连蛋白涂层,DPBS,介质,固定溶液等),因为这可能会导致气泡形成。在接种细胞之前,始终在显微镜下检查设备。
5. 微流体装置中 NPC 的电镀 - 第 10 天
注意:根据运动神经元分化方案15,第10天NPC的电镀发生在星期四。
- 使用新鲜解离的第10天NPC15,或用ROCK抑制剂(10μL / mL)溶液每10mL第10天运动神经元培养基(表2 和 表3)解冻1-2瓶储存的NPC,并将细胞悬浮液以100× g 离心4分钟。
- 将细胞沉淀重悬于500-1000μL第10天运动神经元培养基中,用ROCK抑制剂(10μL / mL)溶液重悬,并使用任何优选的计数方法计数活细胞。
注意:如下所述,请确保将 NPC 重悬到正确数量的介质中,以适应最佳的种子设定量。 - 用P200移液器从设备微凹槽一侧的两个孔中取出DPBS,并在60-100μL第10天运动神经元培养基中为每个设备接种250,000个NPC。
- 在右上方孔中,以45°角在靠近通道开口的地方接种30-50μL细胞悬浮液(125,000个细胞),并用移液器尖端沿着孔底轻轻地将剩余液体拖向孔的中心。
- 暂停几秒钟,让细胞悬浮液流过通道,然后在下孔中重复(30-50μL中的125,000个细胞)。使用笔将种子面标记为"NPC"或等效项,以便在没有显微镜的情况下轻松定位设备。
- 将设备在37°C,5%CO 2 下孵育5分钟以允许细胞附着,然后用额外的第10天运动神经元培养基(总计200μL/孔)填充两个晶种孔,并在37°C,5%CO 2下再次孵育。
注意:每个孔可以包含200μL.在孔和通道中接种细胞可确保培养物结构的稳健性,从而降低培养基更换期间细胞脱离的风险。可以在通道中接种更少的细胞。然而,这将使培养物在每次介质更换期间更容易受到通过通道的体积电流的影响。
- 使用P200移液器从新接种的NPC对面的微槽另一侧的两个孔中取出DPBS。加入200μL/孔的第10天运动神经元培养基,并在顶部和底部孔之间等待几秒钟,以使培养基流过通道。然后,在设备周围每10厘米培养皿中加入6mL DPBS,以防止培养基在孵育过程中蒸发。
注意:如果需要,在培养期间在设备周围添加额外的DPBS。 - 在第11天(星期五),第14天(星期一)和第16天(星期三)在设备的两个隔室中进行完整的运动神经元介质更换(表2 和 表3)。在更换培养基的当天添加新鲜的培养基补充剂。
注意:从此时起,使用P200移液器进行所有介质更换。始终将移液器吸头放置在远离通道的孔边缘,并且不要直接从通道中除去液体。小心不要拆下硅胶设备。应缓慢地去除和添加培养基,以防止细胞脱离。- 通过将 P200 移液器吸头放置在与通道开口相对的孔壁底部边缘,小心地取出两个 NPC 孔中的所有介质。通过将P200移液器尖端置于与通道开口相对的孔壁顶部边缘,缓慢地将50-100μL新鲜运动神经元培养基缓慢加入顶部孔中。
- 暂停几秒钟,让培养基流过通道,然后将50-100μL运动神经元培养基加入底部孔中。小心地重复此过程,直到两个孔都含有200μL/孔。在不带单元格的侧面重复上述步骤。
6. MAB在微流体装置中的电镀 - 第17天
- 在微流体装置(运动神经元分化的第10天)中接种MABs之前约7天,解冻MABs并将其接种在生长培养基(表1)中,在涂有胶原蛋白的T75烧瓶中,以允许足够的细胞扩增。见第2节。
- 在运动神经元分化的第17天(星期四),如步骤2.4中所述解离MABs,将细胞沉淀重悬于〜500μL生长培养基中,并使用任何优选的计数方法计数活细胞。
注:如下所述,请确保将MAB重悬到正确数量的培养基中,以适应最佳的种子设定体积。 - 用P200移液器除去设备中微凹槽未播种侧的运动神经元培养基,用DPBS轻轻洗涤,并在60-100μL生长培养基中接种每个设备200,000 MABs。
- 在右上方的孔中,以45°角在靠近通道开口的地方播种30-50μL细胞悬浮液(100,000个细胞),并用移液器尖端沿着孔底轻轻地将剩余液体拖向孔的中心。暂停几秒钟以允许细胞流过通道,然后在下孔中重复(30-50μL中的100,000个细胞)。
- 将设备在37°C,5%CO 2 下孵育5分钟以允许细胞附着,然后用额外的生长培养基(总计200μL/孔)填充两个新鲜MAB接种的孔。在37°C,5%CO 2下再次孵育。
注意:第17天无需在设备的运动神经元侧更换培养基。根据先前发表的运动神经元分化方法15,第17 天介质变化在第18天(星期五)进行。
7.实施体积和化学定向梯度,以促进运动神经元神经突向MAB室的生长
- 在第18天,使用第18天运动神经元培养基(200μL/孔)在运动神经元侧进行完全培养基更换。按照步骤 5.5.1-5.5.2 中提到的中等更改说明进行操作。在装置的 MAB 隔离区启动 MAB 分化(表 2 和 表 4)。
- 在加入预热的MAB分化培养基(表4)并补充0.01μg/ mL人agrin(200μL /孔)之前,用DPBS小心地洗涤MAB室一次。
注意:MABs将在一周的时间内融合并形成多核肌管。
- 在加入预热的MAB分化培养基(表4)并补充0.01μg/ mL人agrin(200μL /孔)之前,用DPBS小心地洗涤MAB室一次。
- 在第21天,根据运动神经元分化方案(星期一),启动趋化和体积梯度(表2 和 表3)。
- 将200μL/孔的运动神经元基础培养基与30ng / mL脑源性神经营养因子(BDNF),神经胶质细胞系来源的神经营养因子(GDNF)和睫状神经营养因子(CNTF),人Agrin(0.01μg/ mL)和层粘连蛋白(20μg/ mL)加入肌管室(先前定义为MAB室)。将无生长因子的运动神经元基础培养基(100 μL/孔)加入运动神经元室。
- 每隔一天重复步骤7.2,直到运动神经元分化的第28天。周末无需更换介质。
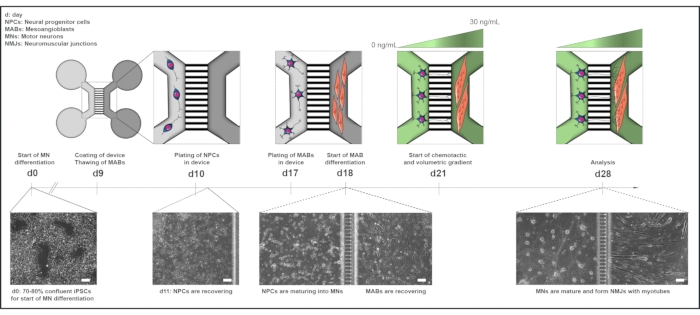
图1:微流体器件中电机单元协议的示意图。 根据运动神经元分化方案的时间线,从第0天到第28天的分化时间表和共培养概述22。运动神经元与 iPSCs 的分化在第 0 天开始,并按照前面所述在接下来的 10 天内进行15。在第9天,该设备被灭菌并涂有PLO-层粘连蛋白。将MABs解冻以在T75烧瓶中膨胀。在第10天,运动神经元 - NPC被接种在两个孔和装置的一个隔室(浅灰色)的通道中,在那里它们继续分化为运动神经元一周。17天,在两个孔和相反隔室(深灰色)的通道中镀上MABs。在第18天,MABs开始分化为肌管。在第21天,建立体积和化学定向梯度,通过装置的微凹槽促进运动神经元 - 神经突极化。运动神经元室接受100μL/孔无生长因子的运动神经元基础培养基(浅绿色室),而肌管室接受200μL/孔运动神经元基础培养基,具有30ng / mL生长因子(深绿色室)(表2 和 表3)。继续使用体积和化学定向梯度培养 7 天,直到第 28 天进行分析。明场图像显示在第0天,第11天,第18天和第28天在预组装的微流体装置中培养的细胞形态。比例尺,100 μm。这个数字是从Stoklund Dittlau, K. et al.18修改而来的。细胞插图已从智能服务器医疗艺术22修改而来。 请点击此处查看此图的放大版本。
8. 固定和ICC
注意:所有步骤都应仔细进行,以防止神经元培养物脱离。在以下步骤中,请勿从通道中取出液体。
- 在通风橱或层流中进行固定:在固定前用DPBS小心地清洗设备中的所有孔一次。在层流(100μL/孔)中,在室温下在DPBS中使用4%多聚甲醛(PFA)固定15-20分钟。
注意:PFA有毒:装在通风橱中,装有个人防护装备。- 小心地向设备的顶部孔中加入100μL,并等待几秒钟,让固定溶液流过通道,然后再向底部孔中加入100μL。在另一侧重复上述步骤。孵育后,除去PFA溶液,用DPBS轻轻洗涤3x5分钟。留在200μL /孔DPBS中储存,并用副膜密封10厘米培养皿以储存在4°C直至ICC实验。
注:确保设备在储存过程中不会变干。
- 小心地向设备的顶部孔中加入100μL,并等待几秒钟,让固定溶液流过通道,然后再向底部孔中加入100μL。在另一侧重复上述步骤。孵育后,除去PFA溶液,用DPBS轻轻洗涤3x5分钟。留在200μL /孔DPBS中储存,并用副膜密封10厘米培养皿以储存在4°C直至ICC实验。
- 在ICC程序的第1天,在DPBS中用0.1%Triton X-100的透化溶液(100μL /孔)孵育细胞20分钟。除去透化溶液,在室温下加入0.1%Triton X-100 / DPBS溶液(100μL /孔)中的5%正常驴血清30分钟。
- 除去5%正常驴血清溶液,将一抗(材料表)的装置在2%正常驴血清中孵育在0.1%Triton X-100 / DPBS溶液中,并在4°C下孵育过夜。
- 实现音量渐变。在微凹槽的一侧加入100μL/孔的抗体溶液,在另一侧加入150μL/孔(每个设备总共500μL)。
注意:可以在微凹槽的两侧使用不同的抗体。在这种情况下,不要在微凹槽中实现一抗或二抗的体积梯度,以维持隔室之间的流体隔离。没有梯度,微凹槽中的神经突不会被染色。
- 实现音量渐变。在微凹槽的一侧加入100μL/孔的抗体溶液,在另一侧加入150μL/孔(每个设备总共500μL)。
- 第二天(ICC程序的第2天),取出一抗,并用0.1%Triton X-100 / DPBS溶液小心地洗涤设备3x5分钟。
注意:在易于拆卸的培养物中,洗涤3x5分钟可以替换为1x洗涤30分钟。 - 从现在开始在黑暗中工作,因为二抗(材料表)对光敏感。将具有二抗的细胞在2%正常驴血清中孵育在0.1%Triton X-100 / DPBS溶液中,在室温下孵育1小时。孵育后,除去二抗并用DPBS洗涤3x5分钟。
- 在DPBS(100μL /孔)中用DAPI在室温下标记核DNA20分钟,然后用0.1%Triton X-100 / DPBS溶液洗涤3x-4x 5分钟。从所有孔中取出0.1%Triton X-100 / DPBS溶液,让培养物干燥几秒钟,然后在每个孔中加入一滴荧光安装介质进行密封。
注:保持设备水平放置至少24小时,以便设置安装介质。24小时后,设备可以储存在4°C的玻片盒中。 - 使用倒置显微镜在z-stack中成像。
- 要对NMJ进行成像,请使用40倍物镜定位标有肌管抗体的肌管(材料表),并执行z-stack记录以确保神经元和肌管组织成像。拍摄多张图片,以防 myotube 太大而无法放入单个帧中。
- 对于 NMJ 定量,手动计算神经元突触前标记物和 AChR 标记物之间通过每个 z 栈的共定位次数。将共定位的数量归一化为z-stack中存在的肌管数量。
9. 用于扫描电镜的装置的固定和准备
注意:更换液体时,请始终保持少量以覆盖培养物,以避免细胞塌陷。该协议使用剧毒物质,并且在整个过程中需要使用个人防护设备和通风橱。
- 固定和拆卸:在0.1M二甲苯二甲酸钠缓冲液(pH 7.6)中制备新鲜的2.5%戊二醛(GA),用0.2μm过滤器过滤,并加热至37°C。
注意:GA和己二甲酸钠有毒:装在通风橱中,带上个人防护装备。- 用DPBS小心地清洗设备一次,以除去培养基和细胞碎片,然后在室温下用GA溶液前缀15分钟。
- 使用手术刀小心地将SEM片切割到设备的周边,同时用镊子固定设备。确保在切割时不要拆下设备。在镊子的帮助下将设备和SEM片移动到3厘米培养皿中,并将3厘米培养皿置于10厘米培养皿中,以便于操作。
- 前缀 15 分钟后,使用镊子小心地从 SEM 表中取出设备。在一个角落拆下设备,然后沿对角线方向向另一个角落缓慢取下设备。观察单元与设备的分离。
- 添加额外的GA溶液以覆盖3cm培养皿中的整个SEM片,并在室温下继续固定2小时或在4°C下过夜。
注:用镊子轻轻推动GA溶液下方的SEM片,避免任何细胞覆盖的表面。
- 继续使用 SEM 的标准协议。简而言之,在四氧化锇中孵育,然后用一系列分级乙醇脱水。将SEM片材插入盖玻片支架中,用于临界点干燥,并安装在支撑短截线上,用于碳贴纸和涂层。使用扫描电子显微镜在5 kV的加速电压和7 mm的工作距离下成像。
10. 使用活细胞钙成像评估 NMJ 功能
- 准备装置:用200μL/孔第18天运动神经元基础培养基(含30ng/mL的BDNF、GDNF和CNTF)刷新肌管室,用200μL/孔无生长因子的运动神经元基础培养基刷新运动神经元室(表2 和 表3)。
- 将Flu-4 AM染料稀释在Flu-4染料溶剂中,以5μM的最终浓度加入肌管室,并将设备在37°C,5%CO 2 的黑暗中孵育25分钟。当设备处于孵育状态时,以终浓度为450mM稀释无生长因子的运动神经元基础培养基中的氯化钾。
注意:Fluo-4 AM是一种钙指示剂,在钙结合时表现出荧光的增加。从现在开始在黑暗中工作,因为染料对光敏感。 - 25分钟后,用200μL/孔第18天运动神经元基础培养基(含30ng / mL的BDNF,GDNF和CNTF)刷新肌管室,并用100μL/孔的运动神经元基础培养基(无生长因子)刷新肌管室,以重新建立趋化和体积梯度。
- 为了阻断NMJ,用19μM的AChR竞争性拮抗剂盐酸图博库瑞林五水合物补充肌管室培养基。
注意:盐酸图博库拉林五水合物有毒:装在通风橱中,装有个人防护装备。
- 将Flu-4 AM染料稀释在Flu-4染料溶剂中,以5μM的最终浓度加入肌管室,并将设备在37°C,5%CO 2 的黑暗中孵育25分钟。当设备处于孵育状态时,以终浓度为450mM稀释无生长因子的运动神经元基础培养基中的氯化钾。
- 使用配备调节至37°C,5%CO2的培养箱的倒置共聚焦显微镜进行记录。
- 对于10倍物镜,使用明场通道在肌管室中定位肌管。将488通道的激光功率,增益和偏移量调整到Fluo-4荧光标记单个肌管的水平。
注:通过将软件A1设置中的滚动条调整为5%的激光功率,增益为60(HV)和偏移量为0,可以获得具有代表性的结果。
- 对于10倍物镜,使用明场通道在肌管室中定位肌管。将488通道的激光功率,增益和偏移量调整到Fluo-4荧光标记单个肌管的水平。
- 将录制时间设置为 1 分钟,间隔 1 秒。记录5-10秒有基线,然后立即用氯化钾溶液刺激运动神经元。
- 进入记录5-10秒后,缓慢地向运动神经元室的一个孔中加入25μL氯化钾溶液,以达到50mM的最终浓度。
注意:避免过快地添加氯化钾溶液,因为这会在通道中产生波浪,从而导致记录出现伪影。
- 进入记录5-10秒后,缓慢地向运动神经元室的一个孔中加入25μL氯化钾溶液,以达到50mM的最终浓度。
- 用运动神经元刺激记录肌管室两次,暂停2分钟,然后用肌管室的25μL氯化钾溶液直接刺激,以评估独立于运动神经元去极化的直接肌管活性。
- 对于定量,使用记录软件手动圈出每个肌管,并在1分钟的时间内分析Fluo-4荧光强度。为了确定钙流入的增加,从氯化钾刺激后的峰值中减去平均基线值(即,从氯化钾刺激前的前10秒开始的平均值)。代表性结果是使用软件的时间测量工具获得的。
结果
微流体器件中 NMJ 的生成
为了在市售的微流体装置中产生具有功能NMJ的人类运动单元,使用了人iPSC衍生的运动神经元和人MAB衍生的肌管。起始细胞材料的质量很重要,特别是MABs与肌管的融合能力对于该协议的成功结果至关重要。MABs很容易保留在培养物中。然而,在将每批次应用于微流体装置之前,评估每批的融合能力非常重要(补充图1A,B)18。任何在分化10天后不显示肌管形成的批次都不应使用。补充图1B中的融合指数是通过计算每个肌管标记物中每个肌管标记物中每张图像的细胞核总数的阳性百分比来确定的。我们发现,大约8%的融合指数足以使我们的共培养产生NMJ。
从纯iPSC培养物开始运动神经元分化始终很重要。输入越纯 - 结果越纯。运动神经元分化方案产生运动神经元培养物,运动神经元标志物通常为85%-95%阳性(补充图1C,D)18。剩余的细胞通常是未分化的前体细胞,在某些情况下将经历广泛的增殖,从而对培养物的质量产生负面影响。为了获得该协议的最佳结果,在将第10天的运动神经元 - NPC应用于设备之前,应评估运动神经元分化效率。此外,可以在第11天进行NPC质量检查,以评估NPC标记Olig2的表达(补充图1E,F)。
最初,运动神经元NPC和MABs在第10天的同一时间点接种。在这里,MAB分化在第11天开始。在第14天实施的体积和生长因子梯度使我们能够在第21天评估NMJ的形成,从而将方案缩短一周。有趣的是,我们可以通过ICC观察特征性NMJ的形成(补充图2A)。然而,我们无法在运动神经元分化的早期通过活细胞钙记录获得功能输出(数据未显示)。我们得出结论,运动神经元还不够成熟,无法与肌管形成功能性NMJ连接,尽管NMJ形态看起来很有希望。这与我们之前的观察一致,即通过膜片钳电生理分析记录的运动神经元中的自发动作电位仅发生在运动神经元分化的第35天15。
此外,我们试图通过在接种MABs之前将设备中的运动神经元成熟2周(第24天)来延长运动神经元成熟以及共培养可持续性。不幸的是,观察到大量自发的运动神经元 - 神经突过微凹槽,这导致MAB附着的抑制(补充图2B)。由于通道中缺乏肌管形成,我们在第36天鉴定NMJs失败,因此应用了28天方案(图1)。
体外 NMJ 的鉴定、定量和形态学表征
遵循28天协议(图1)后,可以获得功能齐全的NMJ。无论是在体内还是在体外,NMJs都通过突触前标志物和突触后标志物的共定位来表征免疫组织或免疫细胞化学。在这项研究中,使用神经丝重链(NEFH)和SYP的组合作为突触前标志物的组合,这允许从运动神经元的体细胞到最远端过程的单个神经突起的跟随。在肌肉方面,Btx被广泛用作AChR的突触后标志物,同样在这项研究中使用。补充agrin和层粘连蛋白可促进AChRs在sarcolemma19,20,21的聚集,使其更容易在体外识别AChRs,并同样增加存在的AChRs和NMJ的数量18。
为了以无偏的方式定位和计算NMJ,每个肌管通过肌球蛋白重链(MyHC)阳性进行鉴定,并使用倒置共聚焦显微镜以40倍放大倍率在z-stack中成像。对于很长的肌管,获得了多个z-stack。对于图像分析,NEFH / SYP和Btx之间的共定位次数通过每个z-stack手动计数,并且共定位的数量被归一化为z-stack中存在的肌管数量(图2A-C)18。并非所有的肌管都会有NMJ,如神经支配的肌管的定量所示(图2D)。因此,重要的是执行无偏记录方法,其中所有肌管都成像,独立于Btx的存在。
可以在该 体外 系统中鉴定两种类型的形态学。NMJ要么表现为单个接触点NMJs,其中神经突触在一个相互作用点处的AChR簇上,要么表现为多个接触点NMJ,其中神经突起将在较大的表面上扇出并与AChR团簇啮合。这两种形态学可以通过免疫细胞化学(图2A)18 和SEM(图2B)18进行鉴定,并且同样可以定量(图2C)18。总体而言,多个接触点通过大肌肉嵌入促进更广泛的连接,这指向更成熟的NMJ形成。相反,由于培养物的早期发育状态,单接触点NMJ被认为不太成熟。
体外NMJ的功能评估
为了评估NMJ的功能,使用活细胞钙瞬时记录(图3)18。利用微流体装置的流体隔离系统,运动神经元体细胞侧被高浓度(50mM)氯化钾刺激,同时记录肌管中钙的流入,肌管中加载了钙敏感的Flu-4染料(图3A)。几乎在运动神经元激活后,我们可以通过特征性波形成观察到肌管中的钙流入,这证实了通过运动神经元 - 神经突和肌管的功能连接(图3A-C)18。没有观察到自发的钙波或自发的肌管收缩,尽管在用氯化钾直接刺激时观察到肌管收缩。通过将竞争性AChR拮抗剂盐酸图博库拉林五水合物(DTC)添加到肌管室(图3A)中,进一步证实了连接的特异性,这导致钙流入的抑制(图3C)。这种效应证实了运动神经元和肌管之间的连接导致了功能齐全的NMJ。为了通过NMJ刺激评估活性肌管的数量,直接用氯化钾刺激肌管室以确定该室中活性肌管的总数。大约70%的肌管通过氯化钾的运动神经元刺激的激活而活跃(图3D)18。
这些结果通过在28天方案期间共培养iPSC衍生的运动神经元和MAB衍生的肌管,证实了最佳的NMJ形成,数量,形态和功能。
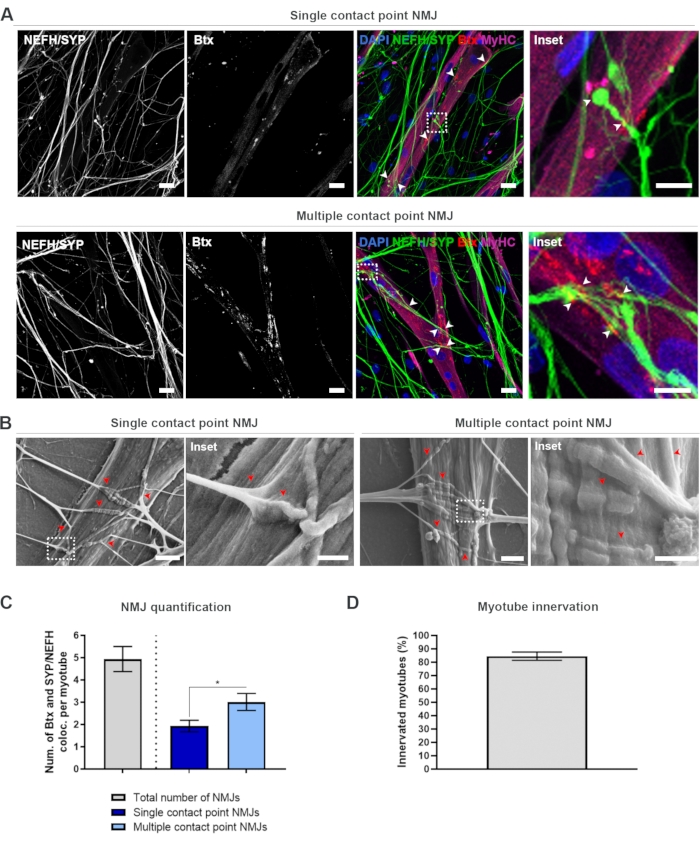
图2:微流体装置中的NMJ形成。 (A)第28天预组装微流体装置中NMJ形成的共聚焦显微照片。NMJ通过MyHC染色的肌管上突触前标记物(NEFH和SYP)和突触后AChR标记(Btx)的共定位(箭头)来鉴定。NMJ通过神经突和AChR团簇之间的单个或多个接触点形成在形态学上被鉴定。DAPI 标记核。比例尺,25 μm。插图显示 NMJ 的放大倍率。第28天,10μm.(B)有机硅微流体装置中NMJ形态的SEM的插入比例尺。箭头描绘了神经突嵌入肌管。比例尺,2 μm。插图显示 NMJ 的放大倍率。插入比例尺,1μm.(C)定量每个肌管的NMJ总数以及每个肌管的单点和多接触点NMJ的数量。图形显示为来自四个生物重复的平均值±标准误差。统计显著性由曼惠特尼检验确定,* p < 0.05。(D)神经支配肌管百分比的定量。图形显示为来自四个生物重复的平均值±标准误差。这个数字是从Stoklund Dittlau, K. et al.18修改而来的。 请点击此处查看此图的放大版本。
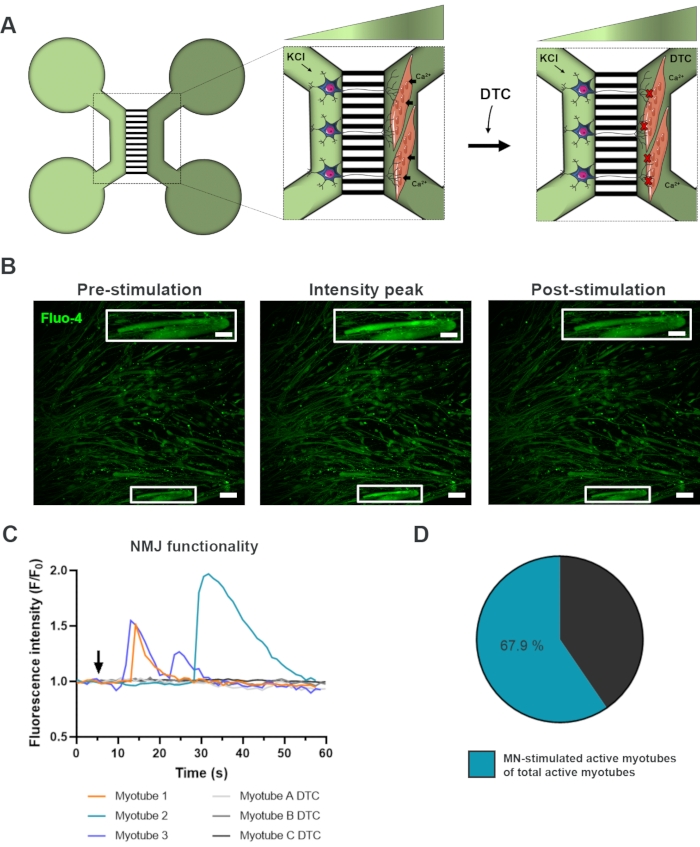
图 3:确认 NMJ 功能。 (A)在用管尿素(DTC)阻断NMJ阻断之前和之后的第28天预组装的微流体装置中NMJ功能的活细胞瞬时钙记录的示意图22。浅绿色隔室中的运动神经元受到50mM氯化钾(KCl)的刺激,其通过神经突起引起细胞内运动神经元反应。这唤起了肌管中钙(Ca2 +)的流入,肌管中标有钙敏感的Flu-4染料(深绿色隔室)。(B)Myotube的刺激前,强度峰值和刺激后的Flu-4荧光显微照片,描绘了用KCl刺激运动神经元时细胞内钙增加的波浪。比例尺,100 μm。插入比例尺,200μm.(C)运动神经元刺激后肌管中的代表性钙流入曲线,KCl(箭头)确认NMJ功能。Myotube 1-3通过运动神经元 - 肌管神经支配显示特征性钙曲线,而肌管A-C DTC描绘了NMJ阻断与DTC后的曲线。(D)运动神经元刺激的活性肌管与活性肌管总数的比值。这个数字是从Stoklund Dittlau, K. et al.18修改而来的。细胞插图已从智能服务器医疗艺术22修改而来。 请点击此处查看此图的放大版本。
补充图1:运动神经元验证,MAB融合指数和鼻咽癌质量控制。 (A)分化开始后10天MAB衍生的肌管的共聚焦图像。肌管用肌管标记标记:desmin,MyHC,肌原蛋白(MyoG)和titin。细胞核用DAPI染色。比例尺,100μm.(B)分化开始后10天定量MAB融合指数。饥饿后,MABs融合成多核肌管,其被量化为肌管标志物阳性(AB +)。图描述了来自三个生物重复的平均值±标准误差。(C)分化第28天iPSC衍生的运动神经元的共聚焦图像,除了泛神经元标志物βIII-微管蛋白(管蛋白)外,还标有运动神经元标志物NEFH,胆碱乙酰转移酶(ChAT)和胰岛-1。细胞核用DAPI染色。比例尺,75μm.(D)细胞数量的定量,这些细胞对运动神经元和泛神经元标记物(AB +)呈阳性。图描述了来自三个生物重复的平均值±标准误差。(E)运动神经元分化第11天iPSC衍生的NPC的共聚焦图像,用NPC标记Olig2和泛神经元标记βIII-微管蛋白(微管蛋白)。标记。细胞核用DAPI染色。比例尺,50μm.(F)NPC数量的定量,对Olig2和βIII-微管蛋白(AB +)呈阳性。图描述了来自三个生物重复的平均值±标准误差。这个数字是从Stoklund Dittlau, K. et al.18修改而来的。 请点击此处下载此文件。
补充图2:共培养方案的优化 (A)运动神经元分化第21天NMJ形成的共聚焦图像,当MABs在第10天与NPC在同一时间点播种时。NMJ通过MyHC染色的肌管上突触前标记物(NEFH和SYP)和突触后AChR标记(Btx)的共定位(箭头)来鉴定。比例尺(左),10 μm。比例尺(右),5μm.(B)第24天肌管通道的明场图像,描绘了抑制MABs附着的自发运动神经元 - 神经突交。比例尺,100 μm 。请单击此处下载此文件。
| 试剂 | 库存集中度 | 最终浓度 |
| 断续器 | 1 倍 | 80% |
| 胎牛血清 | 15% | |
| 青霉素/链霉素 | 5000 U/mL | 0.5% |
| L-谷氨酰胺 | 50 倍 | 1% |
| 丙酮酸钠 | 100 平方米 | 1% |
| 非必需氨基酸 | 100 倍 | 1% |
| 胰岛素转铁蛋白硒 | 100 倍 | 1% |
| bFGF (添加新鲜) | 50微克/毫升 | 5 纳克/毫升 |
表1:人与生物圈生物生长培养基。 培养基可以在4°C下持续2周,bFGF在使用当天新鲜添加。
| 试剂 | 库存集中度 | 最终浓度 |
| DMEM/F12 | 50% | |
| 神经基底培养基 | 50% | |
| 青霉素/链霉素 | 5000 U/mL | 1% |
| L-谷氨酰胺 | 50 倍 | 0.5 % |
| N-2 补充剂 | 100 倍 | 1% |
| 不含维生素A的B-27 | 50 倍 | 2% |
| β-巯基乙醇 | 50 毫米 | 0.1% |
| 抗坏血酸 | 200 微米 | 0.5 微米 |
表2:运动神经元基础培养基。 培养基可以在4°C下持续4周。
| 日 | 试剂 | 库存集中度 | 最终浓度 | 车厢 |
| 第10/11天 | 平滑激动剂 | 10 毫米 | 500 毫安 | 双 |
| 视黄酸 | 1 毫米 | 0.1 微米 | ||
| 达普特 | 100 平方米 | 10 微米 | ||
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 第14天 | 达普特 | 100 平方米 | 20 微米 | 双 |
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 第16天 | 达普特 | 100 平方米 | 20 微米 | 双 |
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 国家工作队 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 第18天 | 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | 运动神经元 |
| 断续器 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 国家工作队 | 0.1毫克/毫升 | 10 纳克/毫升 | ||
| 天 21+ | 断续器 | 0.1毫克/毫升 | 30 纳克/毫升 | 肌管 |
| 断续器 | 0.1毫克/毫升 | 30 纳克/毫升 | ||
| 国家工作队 | 0.1毫克/毫升 | 30 纳克/毫升 | ||
| 阿格林 | 50微克/毫升 | 0,01 微克/毫升 | ||
| 层粘连蛋白 | 1毫克/毫升 | 20微克/毫升 | ||
| 天 21+ | 无补充剂 | 运动神经元 |
表3:运动神经元培养基补充剂。 补充剂在使用当天新鲜添加到运动神经元基础培养基中。
| 日 | 试剂 | 库存集中度 | 最终浓度 | 车厢 |
| 第18天 | DMEM/F12 | 97% | 人与生物圈计划 | |
| 丙酮酸钠 | 100 平方米 | 1% | ||
| 马血清 | 2% | |||
| 阿格林 | 50微克/毫升 | 0.01 微克/毫升 |
表4:人脑生物分类培养基。 培养基可以在4°C下持续2周。 Agrin在使用当天新鲜添加。
讨论
该协议描述了一种相对易于使用的方法,该方法在不到30天的时间内在市售的微流体装置中生成具有功能NMJ的人体运动单元。它描述了如何通过ICC和SEM等标准技术在形态学上评估NMJ,并通过活细胞钙记录进行功能评估。
该协议的一大优点是使用干细胞技术。这允许完全的适应性,其中NMJ可以在健康和疾病中进行评估,而与供体概况无关。该模型已被证明在ALS研究中已经成功且有益,其中我们发现由于 FUS 基因突变而导致的神经突出生长,再生和NMJ数量的损伤是新的表型18。通过该模型,通过使用来自散发性ALS患者的iPSCs,可以将研究扩展到包括散发形式的ALS,其中病因尚不清楚。与传统动物模型相比,这提供了优势,传统动物模型依靠突变基因的转基因过表达来概括人类疾病23,24。此外,我们完全由人类组成的系统可以潜在地概括人类特定的生理学和疾病。先前的研究表明啮齿动物和人类NMJ形态之间的差异25,这表明在使用啮齿动物解决人类NMJ病理学时必须谨慎行事。虽然该系统是一个相对简单的 体外 设置,缺乏 体内 模型的复杂性,但有可能证明微流体装置中显示的NMJ形态类似于人类截肢者的NMJs25。此外,该模型允许在NMJ形成和成熟期间进行NMJ评估,可能揭示早期疾病表型,这些表型在人类死后样本中不存在,无法识别或被忽视。
MABs提供了产生肌管的有效选择,尽管它们有限的10天存活是该系统的缺点。肌管存活依赖于它们对表面的附着,这可能受到肌纤维自发收缩的影响。超过10天后,大多数肌管将分离,使NMJ培养物无法使用。理想情况下,肌管也将从iPSCs产生。然而,由于融合指数27,28,29,30的可变性,目前的方案已被证明难以重现26。
通过使用市售的微流体装置,我们生成了一个完全可访问的标准化系统。其他NMJ模型存在31,32,33,34,35,36,37,38,39,40,41,42。然而,它们通常依赖于单个隔室,缺乏细胞类型之间的区室化和流体分离,或者依赖于定制的培养容器,这降低了可用性,并可能降低可重复性。用于该协议的微流体装置可以购买各种长度的微槽,这允许进一步分析,例如轴突转运43,44 或轴突切开术18,45,46 研究。隔室之间的流体隔离进一步实现了运动神经元或肌管的区室化药物治疗,这可能有利于治疗的发展。更多专门从事微流体的公司已经出现,这为大量的设备设计和功能提供了选择,进一步促进了 体外 研究的可及性。
总之,我们开发了一种方案,提供了一种可靠,多功能和简单的方法来培养具有功能性NMJ的人体运动单元。
披露声明
L.V.D.B.拥有HDAC抑制剂在Charcot-Marie-Tooth疾病中使用专利(US-2013227717-A1),是Augustine Therapeutics的科学联合创始人,也是其科学顾问委员会成员。其他作者声明没有竞争利益。
致谢
作者感谢来自LiMoNe的Nikky Corthout和Sebastian Munck,研究小组分子神经生物学(VIB-KU Leuven)对活细胞钙瞬时荧光记录的建议。这项研究得到了比利时和卢森堡富布赖特委员会,KU Leuven(C1和"开放未来"基金),VIB,科学技术创新机构(IWT;SBO-iPSCAF)、"法兰德斯科学研究基金"(FWO-Vlaanderen)、目标ALS、ALS Liga België(ALS的治愈方法)、比利时政府(由比利时联邦科学政策办公室发起的大学间吸引力极点计划P7/16)、Thierry Latran基金会和"比利时抵抗疾病神经肌肉组织协会"(ABMM)。T.V.和J.B由FWO-Vlaanderen颁发的博士奖学金支持。
材料
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
参考文献
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。