Method Article
Geração de Unidades Motoras Humanas com Junções Neuromusculares Funcionais em Dispositivos Microfluidos
Neste Artigo
Resumo
Descrevemos um método para gerar unidades motoras humanas em dispositivos microfluidos comercialmente disponíveis, co-culminando neurônios motores pluripotentes induzidos por células-tronco com miótubos primários derivados do mesoangioblast, resultando na formação de junções neuromusculares funcionalmente ativas.
Resumo
As junções neuromusculares (NMJs) são sinapses especializadas entre o axônio do neurônio motor inferior e o músculo facilitando o engajamento da contração muscular. Em distúrbios do neurônio motor, como esclerose lateral amiotrófica (ELA) e atrofia muscular espinhal (SMA), os NMJs degeneram, resultando em atrofia muscular e paralisia progressiva. O mecanismo subjacente da degeneração do NMJ é desconhecido, em grande parte devido à falta de modelos de pesquisa traduzíveis. Este estudo teve como objetivo criar um modelo in vitro versátil e reprodutível de uma unidade motora humana com NMJs funcionais. Portanto, os neurônios motores derivados de células-tronco pluripotentes induzidas pelo homem (hiPSC) e os miótubos derivados do mesoangioblast (MAB) foram co-cultivados em dispositivos microfluidos disponíveis comercialmente. O uso de micropartidamentos fluidamente isolados permite a manutenção de microambientes específicos para células, permitindo o contato celular-célula através de microgrooves. Aplicando-se um gradiente quimotactic e volumoso, estimularam-se o crescimento dos neurônios-neuritos motores através dos microvalôos que promovem a interação do miotube e a formação de NMJs. Estes NMJs foram identificados imunocitoquimicamente através da co-localização do marcador pré-sináptico de neurônio motor sinaptofisina (SYP) e do marcador de asttilcolina pós-sinóptica (AChR) marcador α-bungarotoxina (Btx) em miotubes e caracterizado morfologicamente usando microscopia eletrônica de varredura (SEM). A funcionalidade dos NMJs foi confirmada medindo respostas de cálcio nos miotubes após a despolarização dos neurônios motores. A unidade motora gerada usando dispositivos microfluidos padrão e tecnologia de células-tronco pode ajudar futuras pesquisas com foco em NMJs em saúde e doenças.
Introdução
Os NMJs facilitam a comunicação entre neurônios motores espinhais inferiores e fibras musculares esqueléticas através da liberação de neurotransmissores1. Em distúrbios do neurônio motor como ELA e SMA, os NMJs degeneram, o que causa uma interrupção na comunicação com os músculos2,3,4,5,6,7. Isso resulta em pacientes gradualmente perdendo sua função muscular, o que faz com que eles sejam cadeirantes e eventualmente dependentes de suporte respiratório de vida devido à atrofia progressiva de grupos musculares vitais como o diafragma. Os mecanismos subjacentes exatos responsáveis por essa profunda perda de NMJs nesses transtornos são desconhecidos. Muitos estudos têm sido feitos em modelos animais transgênicos, o que nos deu algumas informações sobre a patogênese da degeneração do NMJ5,6,8,9,10,11. No entanto, para entender completamente a patologia e neutralizar a denervação, é importante ter um sistema humano, que permita plena acessibilidade.
Aqui, o protocolo descreve uma maneira relativamente simples de gerar NMJs humanos através da co-cultivo de neurônios motores derivados do hiPSC e miótubos primários derivados do MAB usando dispositivos microfluidos disponíveis comercialmente. O uso de microfluidos para polarizar e isolar fluidamente as somas e axônios dos neurônios é conhecido desde a primeira descrição das câmaras 'Campenot'12 no final da década de 1970. Desde então, mais projetos microfluidos foram fabricados, incluindo opções comerciais. Os dispositivos utilizados neste protocolo contêm dois compartimentos, e cada compartimento consiste em dois poços conectados a um canal13. Os dois compartimentos são espelhados e conectados com vários microgrooves. Esses microgrooves têm um tamanho que facilita o crescimento de neurita, mantendo o isolamento fluido entre os dois compartimentos através de uma pressão hidrostática capilar13,14. Utilizando esse sistema, é possível cultivar neurônios motores em um compartimento e células musculares no outro, cada um em seu meio de cultura específica, ao mesmo tempo em que facilita uma conexão física através de neurites que passam pelos microrregiões e se envolvem com as células musculares. Este modelo fornece um sistema in vitro totalmente acessível e adaptável de uma unidade motora humana, que pode ser usado para estudar a patologia inicial do NMJ em doenças como ELA e SMA.
Protocolo
O consentimento informado por escrito foi obtido de todos os sujeitos, que forneceram suas amostras para geração de IPSC e colheita de MAB. O procedimento foi aprovado pelo comitê de ética médica do Hospital Universitário Leuven (n° S5732-ML11268) e pelo principal comitê de ética em pesquisa do Reino Unido como parte do projeto StemBANCC. Todos os reagentes e equipamentos utilizados neste protocolo estão listados na Tabela de Materiais e devem ser utilizados estéreis. A mídia deve ser aquecida à temperatura ambiente (RT) antes do uso, a menos que seja especificada de outra forma. Para uma visão geral do protocolo de co-cultura, consulte a Figura 1.
1. Diferenciação de progenitores de neurônios motores dos iPSCs
- Siga o protocolo de diferenciação de neurônios motores15, adaptado de um estudo anterior16, até chegar ao dia 10 estado progenitor neural (NPCs). De acordo com o cronograma do protocolo, a diferenciação é iniciada em uma segunda-feira (dia 0), que resulta no dia 10 NPCs em uma quinta-feira.
- Criopreservar dia 10 NPCs em substituição de soro de knock-out com 10% de sulfóxido de dimetil (DMSO) a uma densidade de 2 x 106- 4 x 106 células por frasco.
ATENÇÃO: O DMSO é tóxico: manuseie em um capô de fumaça com equipamento de proteção individual.
NOTA: Aproximadamente 50% do dia 10 NPCs devem ser vitais para o descongelamento. Pare o protocolo de diferenciação de neurônios motores neste estado de "dia 10 NPC" e criopreserve os NPCs para gerar um grande número de NPCs, que podem ser bancados e usados posteriormente, reduzindo o comprimento da linha do tempo global do protocolo de cocultura de 28 dias para 19 dias no total.
2. Derivação e manutenção de MABs humanos
NOTA: Os MABs são células-tronco mesenquimais associadas a vasos, que neste caso foram colhidas a partir de biópsias obtidas de um doador saudável de 58 anos. Fontes comerciais alternativas estão disponíveis. O protocolo para obter MABs é brevemente explicado. Para mais informações, consulte o protocolo detalhado17. Todas as mídias MAB devem ser aquecidas a 37 °C antes de usar.
- Pique o tecido de biópsia e incubar em colágeno (de pele de bezerro) revestiu pratos de 6 cm em um meio de crescimento (Tabela 1) por 2 semanas. Troque o meio a cada 4 dias.
- Para preparar o revestimento de colágeno, dissolva 100 mg de colágeno em 20 mL de ácido acético de 0,1 M. O colágeno leva tempo para dissolver, então coloque a mistura em uma plataforma de balanço durante a noite no RT. No dia seguinte, cubra com 80 mL de ddH2O para um volume final de 100 mL.
ATENÇÃO: O ácido acético é tóxico; manusear em um capô de fumaça com equipamento de proteção pessoal.
NOTA: O colágeno do revestimento de pele de bezerro pode ser reutilizado em até 5x. Armazenar a 4 °C. - Cubra toda a superfície do prato ou o frasco com colágeno, feche e incubar por 20 minutos na RT dentro de um fluxo laminar. Depois de 20 min, recupere o colágeno em um recipiente fresco, feche o prato/frasco vazio e deixe por 10 minutos no RT no fluxo laminar.
- Transfira o prato/frasco para a incubadora para incubação durante a noite (ou pelo menos 6h) (37 °C, 5% de CO2). Lave 5x com a solução salina tamponada de fosfato de Dulbecco sem cálcio ou magnésio (DPBS) antes de emplacar células.
- Para preparar o revestimento de colágeno, dissolva 100 mg de colágeno em 20 mL de ácido acético de 0,1 M. O colágeno leva tempo para dissolver, então coloque a mistura em uma plataforma de balanço durante a noite no RT. No dia seguinte, cubra com 80 mL de ddH2O para um volume final de 100 mL.
- Após 14 dias, facs (classificação celular ativada fluorescente) classificam os MABs para fosfattase alcalina humana17 seguido de expansão adicional. Mantenha os MABs em frascos T75 revestidos de colágeno no meio de crescimento e mude o meio de crescimento a cada 2 dias (10 mL por frasco).
- Criopreserve, passagem ou sementes MABs em dispositivos ao atingir 70% de confluência.
NOTA: Os MABs perdem seu potencial miogênico devido a fusões espontâneas no contato célula-celular. Certifique-se de não exceder 70% de confluência ao expandir os MABs. Um frasco T75 70% confluente contém aproximadamente 600.000-800.000 células, que podem ser criopreservadas a 100.000 células por frasco. Cada frasco pode ser descongelado e semeado em um frasco T75 para expansão. - Para passar MABs, lave-os suavemente uma vez com 7 mL de DPBS e, em seguida, incubar em 7 mL de solução de dissociação MAB por 3 min a 37 °C em 5% de CO2 para dissociar as células.
- Neutralizar a solução de dissociação MAB com 7 mL do meio de crescimento, raspe suavemente as células e transfira a suspensão celular para um tubo de centrífuga de 50 mL. Lave suavemente o frasco com um extra de 5 mL do meio de crescimento para coletar MABs potencialmente restantes.
- Centrifugar a suspensão celular por 3 min a 300 x g, depois passar diretamente para um novo frasco T75 revestido de colágeno para expansão, criopreservar em substituição de soro knock-out com 10% DMSO ou contar para semente em um dispositivo microfluido.
NOTA: As passagens são realizadas 1x-2x por semana para expansão celular até um número máximo de passagem de 13. Após a dissociação, os MABs aparecem esféricos e grandes em forma quando examinados sob o microscópio.
3. Preparação de dispositivos microfluidos pré-montados - Dia 9
NOTA: O protocolo é adaptado do protocolo de dispositivo de neurônio do fabricante de dispositivos microfluidos e foi ajustado para o uso de dispositivos pré-montados e de silicone. Aqui, dispositivos pré-montados são usados para imunocytoquímica (ICC) e gravações transitórias de cálcio de células vivas, enquanto dispositivos de silicone são usados para SEM. A linha do tempo do protocolo segue o cronograma para o protocolo de diferenciação de neurônios motores.
- Prepare os dispositivos microfluidos um dia antes de semear células, pois o revestimento precisa incubar durante a noite. De acordo com o protocolo do neurônio motor, esta será uma quarta-feira. Adicione ~10 mL de 70%-100% de etanol a uma placa de Petri de 10 cm. Use fórceps para transferir o dispositivo do contêiner de transporte para a placa de Petri para esterilização.
- Submergir o dispositivo em etanol por 10 s e transfira o dispositivo com fórceps para um pedaço de papel para secar no fluxo laminar por ~30 min. Gire o dispositivo algumas vezes para permitir que ambos os lados sequem. Quando o dispositivo estiver seco, use fórceps para mover cada dispositivo para uma placa de Petri individual de 10 cm para facilitar o manuseio
ATENÇÃO: O etanol é tóxico; alça em um capô de fumaça com equipamento de proteção pessoal - Cubra o dispositivo com Poli-L-ornithine (PLO) (100 μg/mL) em DPBS e incubar a 37 °C, 5% de CO2 por 3h.
- Use uma pipeta P200 para adicionar 100 μL de PLO em DPBS em uma parte superior e próxima da abertura do canal o mais possível e observe o fluido passando do topo bem através do canal até o poço inferior. Posteriormente, adicione 100 μL de OLP em DPBS ao fundo bem.
- Repita do outro lado dos microvalos e finalize adicionando 100 μL em um lado do dispositivo para criar um gradiente de volume entre os dois lados espelhados do dispositivo para revestir os microrressores (por exemplo, lado direito 200 μL, lado esquerdo 300 μL). Depois de 3h, lave o dispositivo 3x por 5 min com DPBS. Use um sistema de sucção, se necessário.
NOTA: Certifique-se de evitar qualquer formação de bolha de ar nos canais em qualquer ponto durante o revestimento ou cultivo das células. Mesmo pequenas bolhas se expandirão em um curto espaço de tempo, inibindo assim o revestimento, a semeadura celular ou o fluxo de mídia através do canal. Se o fluido parar no canal durante o revestimento, resuspense a solução PLO diretamente no canal de ambos os lados. Se as bolhas ainda estiverem presentes, use 200 μL de DPBS para lavar o canal e repetir o processo de revestimento conforme indicado acima nas etapas 3.3.1-3.3.2. Se bolhas aparecerem após a semeadura celular, é impossível recuperar o dispositivo, pois a descarga do canal danificará as células.
- Cubra o dispositivo com laminina (20 μg/mL) em um meio neurobásal e incubar durante a noite a 37 °C, 5% de CO2. Siga as mesmas instruções para o revestimento da OLP das etapas 3.3.1-3.3.2.
- No dia seguinte, use uma pipeta P200 e posicione a ponta no poço oposto à abertura do canal para remover o revestimento de laminina dos poços. Adicione DPBS a todos os poços e deixe os dispositivos com DPBS no fluxo laminar no RT para semeadura celular.
NOTA: A partir deste ponto, é importante não remover líquido (revestimento de laminina, DPBS, mídia, solução de fixação, etc.) diretamente dos canais, pois isso pode causar a formação de bolhas de ar. Inspecione sempre os dispositivos sob o microscópio antes de semear células.
4. Preparação de dispositivos microfluidos de silicone - Dia 9
- Prepare os dispositivos microfluidos de silicone um dia antes de semear células, pois o revestimento precisa incubar durante a noite. De acordo com o protocolo do neurônio motor, esta será uma quarta-feira.
- Adicione ~10 mL de 70%-100% de etanol a uma placa de Petri de 10 cm. Use um fórceps para transferir o dispositivo do recipiente de transporte para a placa de Petri para esterilização. Submergir o dispositivo em etanol por 10 s e transferir com fórceps para um poço em uma placa de 6 poços para secar no fluxo laminar por ~30 min. Posicione o dispositivo de lado para permitir que todos os lados sequem.
- Reduza as folhas SEM para o tamanho do dispositivo (deixe alguns mm em cada lado). Repita a esterilização conforme indicado acima na etapa 4.1.1. Em seguida, transfira com fórceps para uma placa de Petri de 10 cm para secar. Duas e três folhas SEM caberão em um prato.
- Cubra os dispositivos e as folhas SEM com o OLP (100 μg/mL) em DPBS e incubar a 37 °C, 5% de CO2 por 3h.
- Adicione 1 mL de OLP em DPBS por poço a cada dispositivo na placa de 6 poços. Certifique-se de que o dispositivo está flutuando em cima da solução PLO com o lado do canal e do microrreso voltado para baixo no líquido. Adicione 10 mL de OLP em DPBS por placa de Petri de 10 cm e use fórceps para empurrar as folhas SEM para o líquido.
NOTA: As folhas SEM geralmente flutuam em cima da solução de revestimento. Antes de montar o dispositivo e a folha, gire a folha SEM para que a superfície, que esteve em contato com a OLP, entre em contato com o canal e a superfície microgroove do dispositivo. - Depois de 3h, lave o dispositivo e as folhas SEM 2x por 5 min com DPBS seguido de outra lavagem por 5 min com água estéril. Use um sistema de sucção, se necessário. Transfira cada folha SEM para uma placa de Petri individual de 10 cm para facilitar o manuseio.
NOTA: Ambos os dispositivos e as folhas SEM devem estar completamente secos antes do montagem. A lavagem final com água estéril remove cristais de sal potenciais do DPBS, o que pode inibir a montagem.
- Adicione 1 mL de OLP em DPBS por poço a cada dispositivo na placa de 6 poços. Certifique-se de que o dispositivo está flutuando em cima da solução PLO com o lado do canal e do microrreso voltado para baixo no líquido. Adicione 10 mL de OLP em DPBS por placa de Petri de 10 cm e use fórceps para empurrar as folhas SEM para o líquido.
- Trabalhe sob um microscópio em um fluxo laminar. Use fórceps para montar o dispositivo de silicone com o canal e o lado microgroove para baixo em um ângulo de 90° na folha SEM, garantindo que todos os lados estejam alinhados. Pressione levemente para baixo no dispositivo para ter certeza de selar não apenas bordas externas, mas também em torno de poços, canais e microgrooves.
NOTA: As áreas ligadas parecerão cinzas, enquanto as ainda não montadas aparecerão claras sob o microscópio. Certifique-se de que todas as áreas estão bem seladas sem bolhas de ar para evitar o descolamento do dispositivo durante a colheita. Em caso de detritos ou cristais de sal que bloqueiam a montagem, refira a folha e o dispositivo sem em água estéril e seque antes de tentar novamente o procedimento de montagem. Se os microrressortos aparecerem distorcidos de pressionar muito forte no dispositivo, remova o dispositivo completamente da folha SEM e tente a montagem novamente. Tenha cuidado ao revestir e alterar a mídia uma vez que o dispositivo esteja montado. - Trabalhe sob um microscópio em um fluxo laminar. Cubra o dispositivo com laminina (20 μg/mL) em um meio neurobásal e incubar durante a noite a 37 °C, 5% de CO2.
NOTA: A incubação durante a noite endurece o dispositivo de silicone e ainda o sela na folha SEM.- Use uma pipeta P200 para adicionar 100 μL da solução de laminina em uma parte superior e próxima da abertura do canal possível e observe o fluido passando do topo bem através do canal até o poço inferior. Verifique se há vazamentos ao redor do poço e do canal.
- Posteriormente, adicione 100 μL de solução de laminina ao poço inferior e verifique se há vazamentos. Repita do outro lado dos microrressores e finalize com um adicional de 100 μL em um lado do dispositivo para criar um gradiente de volume entre os dois lados espelhados do dispositivo para revestir os microgrooves (por exemplo, lado direito 200 μL, lado esquerdo 300 μL).
NOTA: Em caso de vazamento, remova o revestimento de laminina, desmonte o dispositivo e as folhas SEM e lave ambos em água estéril. Deixe-os secar e repita a partir do passo 4.3 em diante. - No dia seguinte, retire o revestimento dos poços com uma pipeta P200 posicionando a ponta no bem oposto à abertura do canal. Adicione DPBS a todos os poços e deixe os dispositivos com DPBS no fluxo laminar no RT para semeadura celular.
NOTA: A partir deste ponto, não remova o líquido (revestimento de laminina, DPBS, mídia, solução de fixação, etc.) diretamente dos canais, pois isso pode causar a formação de bolhas de ar. Inspecione sempre os dispositivos sob o microscópio antes de semear células.
5. Chapeamento de NPCs em dispositivos microfluidos - Dia 10
NOTA: De acordo com o protocolo de diferenciação de neurônios motores15, o revestimento do dia 10 NPCs ocorre em uma quinta-feira.
- Use os recém-dissociados dia 10 NPCs15, ou descongele 1-2 frascos de NPCs bancados por 10 mL do dia 10 meio de neurônio motor (Tabela 2 e Tabela 3) com inibidor de ROCHA (10 μL/mL) solução, e centrifugar a suspensão celular a 100 x g por 4 min.
- Resuspenda a pelota celular em 500-1000 μL do dia 10 meio neurônio motor com inibidor de ROCHA (10 μL/mL) solução e conte as células vivas usando qualquer método de contagem preferencial.
NOTA: Como indicado abaixo, certifique-se de resususpensar os NPCs na quantidade correta de mídia para acomodar um volume de semeadura ideal. - Remova DPBS de dois poços de um lado dos microvalos no dispositivo com uma pipeta P200 e sementes de 250.000 NPCs por dispositivo em 60-100 μL de mídia de neurônio motor do dia 10.
- No poço superior direito, semente 30-50 μL da suspensão celular (125.000 células) perto da abertura do canal em um ângulo de 45° e arraste o fluido restante suavemente ao longo do piso do poço em direção ao centro do poço com a ponta pipeta.
- Pare por alguns segundos para permitir que a suspensão da célula flua através do canal antes de repetir isso no poço inferior (125.000 células em 30-50 μL). Use uma caneta para marcar o lado semeado "NPC" ou equivalente para facilitar a orientação do dispositivo sem um microscópio.
- Incubar o dispositivo a 37 °C, 5% de CO2 por 5 min para permitir o acessório celular antes de cobrir os poços de duas semeaduras com um médio de neurônio motor adicional de 10 dias (total de 200 μL/bem) e incubar novamente a 37 °C, 5% de CO2.
NOTA: Cada poço pode conter 200 μL. Células de semeadura em poços e canais garantem uma estrutura robusta da cultura, diminuindo o risco de descolamento celular durante as alterações da mídia. É possível semear menos células apenas no canal. No entanto, isso tornará a cultura mais suscetível à corrente de volume através dos canais durante cada alteração média.
- Use uma pipeta P200 para remover DPBS dos dois poços do outro lado dos microgrooves em frente aos NPCs recém-semeados. Adicione 200 μL/well do dia 10 de mídia de neurônio motor e espere alguns segundos entre a parte superior e inferior bem para permitir que a mídia flua através do canal. Em seguida, adicione 6 mL de DPBS por prato de 10 cm ao redor do dispositivo para evitar a evaporação do meio durante a incubação.
NOTA: Adicione DPBS adicionais ao redor do dispositivo durante o período de cultura, se necessário. - Realize uma mudança média completa do neurônio motor em ambos os compartimentos do aparelho nos dias 11 (sexta-feira), dia 14 (segunda-feira), e dia 16 (quarta-feira) (Tabela 2 e Tabela 3). Adicione suplementos de mídia frescos no dia da mudança média.
NOTA: A partir deste ponto, realize todas as alterações médias com uma pipeta P200. Posicione sempre a ponta da pipeta longe do canal na borda do poço e não remova o líquido diretamente do canal. Tenha cuidado para não desprender os dispositivos de silicone. A remoção e adição do meio devem ser feitas lentamente para evitar o descolamento celular.- Remova cuidadosamente todas as mídias em ambos os poços com NPCs posicionando a ponta de pipeta P200 na borda inferior da parede do poço em frente à abertura do canal. Adicione lentamente 50-100 μL de neurônio motor fresco médio ao topo bem, posicionando a ponta de pipeta P200 na borda superior da parede do poço em frente à abertura do canal.
- Pare por alguns segundos para permitir que o meio flua através do canal antes de adicionar 50-100 μL de neurônio motor médio ao fundo bem. Repita este processo cuidadosamente até que ambos os poços contenham 200 μL/well. Repita na lateral sem células.
6. Chapeamento de MAB em dispositivos microfluidos - Dia 17
- Aproximadamente 7 dias antes de semear MABs nos dispositivos microfluidos (dia 10 de diferenciação de neurônios motores), descongelar MABs e semeá-los no meio de crescimento (Tabela 1) em um frasco T75 revestido com colágeno para permitir expansão celular suficiente. Veja a seção 2.
- No dia 17 da diferenciação do neurônio motor (quinta-feira), dissociar MABs como explicado na etapa 2.4, resuspensar a pelota celular em ~500 μL de meio de crescimento e contar as células vivas usando qualquer método de contagem preferencial.
NOTA: Como indicado abaixo, certifique-se de resuspensar os MABs na quantidade correta de mídia para acomodar o volume de semeadura ideal. - Remova o meio do neurônio motor no lado não semeado dos microgrooves no dispositivo com uma pipeta P200, lave suavemente com DPBS e 200.000 MABs por dispositivo em 60-100 μL de meio de crescimento.
- No poço superior direito, semente 30-50 μL de suspensão celular (100.000 células) perto da abertura do canal em um ângulo de 45° e arraste o fluido restante suavemente ao longo do chão do poço em direção ao centro do poço com a ponta pipeta. Pare por alguns segundos para permitir o fluxo de células através do canal antes de repetir no poço inferior (100.000 células em 30-50 μL).
- Incubar o dispositivo a 37 °C, 5% de CO2 por 5 min para permitir o acessório celular antes de cobrir os dois poços recém-semeados com mab com meio de crescimento adicional (total de 200 μL/well). Incubar novamente a 37 °C, 5% de CO2.
NOTA: Não é necessária mudança média no dia 17 no lado do neurônio motor do dispositivo. Dia 17 a mudança média de acordo com o método de diferenciação de neurônios motores publicado anteriormente15 é realizada no dia 18 (sexta-feira).
7. Implantação de gradiente volumoso e quimotactico para promover o crescimento de neurites de neurônios motores em direção ao compartimento MAB
- No dia 18, realize uma mudança média completa no lado do neurônio motor com o meio de neurônio motor do dia 18 (200 μL/bem). Siga as instruções para alterações médias mencionadas nas etapas 5.5.1-5.5.2. Inicie a diferenciação de MAB no compartimento MAB do dispositivo (Tabela 2 e Tabela 4).
- Lave cuidadosamente os compartimentos de MAB uma vez com DPBS antes de adicionar o meio de diferenciação de MAB pré-aquecido (Tabela 4) complementado com 0,01 μg/mL de agrin humana (200 μL/well).
NOTA: Os MABs se fundirão e formarão miostubos multinucleados ao longo de uma semana.
- Lave cuidadosamente os compartimentos de MAB uma vez com DPBS antes de adicionar o meio de diferenciação de MAB pré-aquecido (Tabela 4) complementado com 0,01 μg/mL de agrin humana (200 μL/well).
- No dia 21, de acordo com o protocolo de diferenciação de neurônios motores (segunda-feira), inicie o gradiente quimotactic e volumoso (Tabela 2 e Tabela 3).
- Adicione 200 μL/poço do neurônio motor meio basal com 30 ng/mL de fator neurotrófico derivado do cérebro (BDNF), fator neurotrófico derivado da linha celular glial (GDNF) e c Fator neurotrófico neurotrófico iiliar (CNTF), agrin humano (0,01 μg/mL) e laminina (20 μg/mL) para o compartimento do miotube (previamente definido como compartimento MAB). Adicione o meio basal do neurônio motor (100 μL/well) sem fatores de crescimento ao compartimento do neurônio motor.
- Repita o passo 7.2 a cada segundo dia até o dia 28 da diferenciação do neurônio motor. Não é necessária mudança de mídia durante os fins de semana.
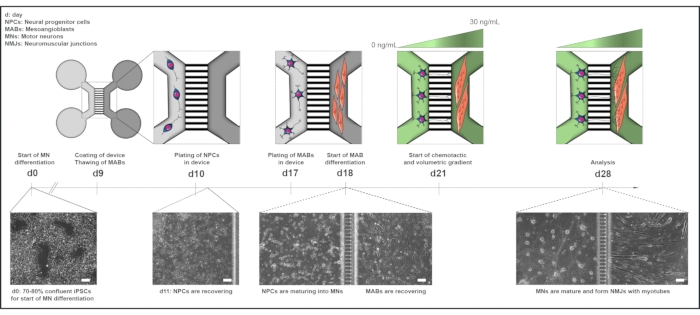
Figura 1: Visão geral esquemática do protocolo da unidade motora em dispositivos microfluidos. Cronograma de diferenciação e visão geral da cocultura do dia 0 ao dia 28 de acordo com a linha do tempo do protocolo de diferenciação de neurônios motores22. A diferenciação do neurônio motor dos iPSCs é iniciada no dia 0 e realizada como indicado anteriormente para os 10 dias seguintes15. No dia 9, o dispositivo é esterilizado e revestido com PLO-laminin. MABs são descongelados para expansão em frascos T75. No dia 10, os neurônios motores-NPCs são banhados em ambos os poços e no canal de um compartimento (cinza claro) do dispositivo, onde sua diferenciação em neurônios motores é continuada por uma semana. Os MABs são banhados em ambos os poços e no canal do compartimento oposto (cinza escuro) no dia 17. No dia 18, começa a diferenciação dos MABs nos miotubes. No dia 21, um gradiente volutrico e quimotactic é estabelecido para promover a polarização neurônio-neurite motora através dos microvalhões do dispositivo. O compartimento do neurônio motor recebeu 100 μL/bem do meio basal do neurônio motor sem fatores de crescimento (compartimento verde claro), enquanto o compartimento do miotube recebeu 200 μL/well de meio basal do neurônio motor com 30 ng/mL de fatores de crescimento (compartimento verde escuro) (Tabela 2 e Tabela 3). A cultura continua com o gradiente volumoso e quimotactico por mais 7 dias até a análise no dia 28. Imagens de campo brilhante mostram morfologia celular no dia 0, dia 11, dia 18 e dia 28 cultivados em dispositivos microfluidos pré-montados. Barra de escala, 100 μm. Este número foi modificado de Stoklund Dittlau, K. et al.18. As ilustrações celulares foram modificadas do Smart Server medical Art22. Clique aqui para ver uma versão maior desta figura.
8. Fixação e ICC
NOTA: Todas as etapas devem ser feitas com cuidado para evitar o desprendimento das culturas neuronais. Não remova o líquido dos canais durante as etapas seguintes.
- Realize a fixação em um capô de fumaça ou fluxo laminar: Lave cuidadosamente todos os poços do dispositivo uma vez com DPBS antes da fixação. Corrija usando 4 % de paraformaldeído (PFA) em DPBS por 15-20 min no RT no fluxo laminar (100 μL/well).
ATENÇÃO: O PFA é tóxico: manuseie em um capô de fumaça com equipamento de proteção individual.- Adicione cuidadosamente 100 μL ao poço superior do dispositivo e espere alguns segundos para permitir que a solução de fixação flua pelo canal antes de adicionar 100 μL ao poço inferior. Repita do outro lado. Após a incubação, remova a solução PFA e lave suavemente 3x por 5 min com DPBS. Deixe em 200 μL/bem DPBS para armazenamento e sele a placa de petri de 10 cm com parafilm para armazenar a 4 °C até o experimento ICC.
NOTA: Certifique-se de que os dispositivos não secarão durante o armazenamento.
- Adicione cuidadosamente 100 μL ao poço superior do dispositivo e espere alguns segundos para permitir que a solução de fixação flua pelo canal antes de adicionar 100 μL ao poço inferior. Repita do outro lado. Após a incubação, remova a solução PFA e lave suavemente 3x por 5 min com DPBS. Deixe em 200 μL/bem DPBS para armazenamento e sele a placa de petri de 10 cm com parafilm para armazenar a 4 °C até o experimento ICC.
- Incubar as células com uma solução de permeabilização (100 μL/well) de 0,1% Triton X-100 em DPBS por 20 min na RT no primeiro dia do procedimento icc. Remova a solução de permeabilização e adicione 5% de soro normal de burro em 0,1% solução Triton X-100/DPBS (100 μL/well) por 30 min na RT.
- Remova a solução de soro de burro 5% normal e incuba dispositivos com anticorpos primários (Tabela de Materiais) em soro de burro normal de 0,1% em solução Triton X-100/DPBS e incubar a 4 °C durante a noite.
- Implemente um gradiente de volume. Adicione 100 μL/bem de solução de anticorpos em um lado dos microrregiões e 150 μL/bem do outro (500 μL total por dispositivo).
NOTA: É possível usar diferentes anticorpos em ambos os lados dos microgrooves. Neste caso, não implemente um gradiente de volume com anticorpos primários ou secundários em microrresários para sustentar o isolamento fluido entre os compartimentos. Os neurites nos microgrooves não serão manchados sem o gradiente.
- Implemente um gradiente de volume. Adicione 100 μL/bem de solução de anticorpos em um lado dos microrregiões e 150 μL/bem do outro (500 μL total por dispositivo).
- No dia seguinte (dia 2 do procedimento ICC), remova os anticorpos primários e lave cuidadosamente o dispositivo 3x por 5 min com solução Triton X-100/DPBS de 0,1%.
NOTA: Em culturas facilmente destacáveis, lavar 3x por 5 min pode ser substituída por 1x por 30 min. - Trabalhe no escuro a partir de agora, pois os anticorpos secundários (Tabela de Materiais) são sensíveis à luz. Incubar células com anticorpos secundários em soro de burro 2% normal em solução Triton X-100/DPBS de 0,1% para 1 h na RT. Implemente um gradiente de volume conforme indicado na etapa 8.3.1. Após a incubação, remova os anticorpos secundários e lave 3x por 5 min com DPBS.
- Rotule o DNA nuclear com DAPI em DPBS (100 μL/well) por 20 min na RT seguido de 3x-4x de lavagem de 5 min com solução Triton X-100/DPBS de 0,1%. Remova a solução Triton X-100/DPBS de 0,1% de todos os poços e deixe a cultura secar por alguns segundos antes de adicionar uma gota de mídia fluorescente de montagem em cada poço para selar.
NOTA: Mantenha os dispositivos horizontais por pelo menos 24 horas para permitir que a mídia de montagem seja definida. Após 24h, os dispositivos podem ser armazenados em uma caixa de slides a 4 °C. - Imagem em pilhas z com um microscópio invertido.
- Para fotografar NMJs, use um objetivo de 40x para localizar os miotubes marcados com um anticorpo do miotube (Tabela de Materiais) e realizar gravações de z-stack para garantir imagens neuronais e de tecido do miotube. Tire várias imagens caso o miotube seja muito grande para caber em um único quadro.
- Para quantificação NMJ, conte manualmente o número de co-localizações entre um marcador pré-sináptico neuronal e um marcador AChR através de cada pilha z. Normalize o número de co-localizações para o número de motubes presentes na pilha z.
9. Fixação e preparação do dispositivo para SEM
NOTA: Ao trocar líquidos, mantenha sempre uma pequena quantidade para cobrir a cultura para evitar o colapso celular. Este protocolo utiliza substâncias altamente tóxicas, e é necessário trabalhar com equipamentos de proteção individual e em um capô de fumaça durante todo o processo.
- Fixação e desmontagem: Prepare o glutaraldeído fresco de 2,5% (GA) em tampão de cacodilato de sódio de 0,1 M (pH 7.6), filtro com filtro de 0,2 μm e aqueça até 37 °C.
ATENÇÃO: GA e cacodilato de sódio são tóxicos: manusear em um capô de fumaça com equipamento de proteção individual.- Lave cuidadosamente o dispositivo uma vez com DPBS para remover os detritos de mídia e células e, em seguida, prefixo com solução GA por 15 min no RT.
- Use um bisturi para cortar cuidadosamente a folha SEM para o perímetro do dispositivo enquanto estabiliza o dispositivo com fórceps. Certifique-se de não desprender o dispositivo durante o corte. Mova o dispositivo e a folha SEM com a ajuda de fórceps para uma placa de Petri de 3 cm e coloque a placa de 3 cm em uma placa de 10 cm para fácil manuseio.
- Após 15 minutos de prefixação, remova cuidadosamente o dispositivo da folha SEM usando fórceps. Retire o dispositivo em um canto e remova-o lentamente em uma direção diagonal em direção ao canto oposto. Observe as células se soltarem do dispositivo.
- Adicione solução adicional de GA para cobrir toda a folha SEM no prato de 3 cm e continue a fixação por um total de 2 h no RT ou durante a noite a 4 °C.
NOTA: Empurre suavemente a folha SEM sob a solução GA com fórceps, evitando superfícies cobertas de células.
- Continue com um protocolo padrão para SEM. Resumindo, incubar em tetroxida de ósmio seguido de desidratação com uma série classificada de etanol. Insira a folha SEM em um suporte de deslizamento para secagem de ponto crítico e montagem em stubs de suporte para adesivos de carbono e revestimento. Use um microscópio eletrônico de varredura para imagem a uma tensão acelerada de 5 kV e uma distância de trabalho de 7 mm.
10. Avaliação da funcionalidade do NMJ usando imagens de cálcio de células vivas
- Prepare os dispositivos: Atualize o compartimento do miotube com 200 μL/bem do dia 18 de neurônio motor meio basal com 30 ng/mL de BDNF, GDNF e CNTF e o compartimento do neurônio motor com 200 μL/bem de meio basal do neurônio motor sem fatores de crescimento (Tabela 2 e Tabela 3).
- Adicione fluo-4 AM corante diluído em solvente de corante Fluo-4 ao compartimento do miotube em uma concentração final de 5 μM e incubar o dispositivo no escuro a 37 °C, 5% de CO2 por 25 min. Enquanto o dispositivo está sob incubação, diluir cloreto de potássio no meio basal do neurônio motor sem fatores de crescimento em uma concentração final de 450 mM.
NOTA: Fluo-4 AM é um indicador de cálcio, que apresenta um aumento da fluorescência na ligação de cálcio. Trabalhe no escuro de agora em diante, pois o corante é sensível à luz. - Após 25 min, refresque o compartimento do miotube com 200 μL/bem do dia 18 do neurônio motor meio basal com 30 ng/mL de BDNF, GDNF e CNTF e o compartimento do neurônio motor com 100 μL/poço de neurônio motor meio basal sem fatores de crescimento para restabelecer o gradiente quimotactic e volutrico.
- Para bloquear os NMJs, suplemente o meio do compartimento do miotube com 19 μM do antagonista competitivo da AChR, o pentahidrato de cloridrato de tubocurarina.
ATENÇÃO: O pentahidrato de cloridrato de tubocurarina é tóxico: manusear em um capô de fumaça com equipamento de proteção individual.
- Adicione fluo-4 AM corante diluído em solvente de corante Fluo-4 ao compartimento do miotube em uma concentração final de 5 μM e incubar o dispositivo no escuro a 37 °C, 5% de CO2 por 25 min. Enquanto o dispositivo está sob incubação, diluir cloreto de potássio no meio basal do neurônio motor sem fatores de crescimento em uma concentração final de 450 mM.
- Realize gravações com um microscópio confocal invertido equipado com uma incubadora ajustada a 37 °C, 5% de CO2.
- Com um objetivo de 10x, use o canal de campo brilhante para localizar os miotubes no compartimento do miotube. Ajuste a potência do laser, ganho e deslocamento para o canal 488 a um nível onde a fluorescência Fluo-4 marca os miotubes individuais.
NOTA: Os resultados representativos foram adquiridos ajustando as barras de rolagem nas configurações A1 do software para uma potência laser de 5%, um ganho de 60 (HV) e um deslocamento de 0.
- Com um objetivo de 10x, use o canal de campo brilhante para localizar os miotubes no compartimento do miotube. Ajuste a potência do laser, ganho e deslocamento para o canal 488 a um nível onde a fluorescência Fluo-4 marca os miotubes individuais.
- Defina o tempo de gravação para 1 min com intervalos de 1 s. Recorde para 5-10 s para ter uma linha de base, seguido por imediatamente estimulando neurônios motores com a solução de cloreto de potássio.
- Após 5-10 s na gravação, adicione lentamente 25 μL de solução de cloreto de potássio a um poço do compartimento do neurônio motor para atingir uma concentração final de 50 mM.
NOTA: Evite adicionar a solução de cloreto de potássio muito rápido, pois isso criará uma onda através do canal, causando artefatos na gravação.
- Após 5-10 s na gravação, adicione lentamente 25 μL de solução de cloreto de potássio a um poço do compartimento do neurônio motor para atingir uma concentração final de 50 mM.
- Registre o compartimento do miotube com estimulação de neurônio motor duas vezes com uma pausa de 2 minutos, seguido de estimulação direta com solução de cloreto de potássio de 25 μL do compartimento do miotube para avaliar a atividade direta do miotube independente da despolarização do neurônio motor.
- Para quantificações, circule cada miotube manualmente com o software de gravação e analise a intensidade fluorescente Fluo-4 durante o período de 1 minuto. Para determinar o aumento do fluxo de cálcio, subtraia o valor médio da linha de base (ou seja, média dos primeiros 10 s antes da estimulação do cloreto de potássio) do valor máximo após a estimulação com cloreto de potássio. Os resultados representativos foram adquiridos utilizando a ferramenta de medição de tempo do software.
Resultados
Geração de NMJs em dispositivos microfluidos
Para gerar uma unidade motora humana com NMJs funcionais em dispositivos microfluidos disponíveis comercialmente, foram utilizados neurônios motores derivados do iPSC humano e miótubos derivados do MAB humano. A qualidade do material celular inicial é importante, e especialmente a capacidade de fusão dos MABs em mítutos é crucial para um resultado bem-sucedido deste protocolo. MABs são fáceis de manter na cultura. No entanto, é importante avaliar a capacidade de fusão de cada lote antes de aplicá-los aos dispositivos microfluidos (Figura Suplementar 1A,B)18. Os lotes, que não apresentem formação de miotube após 10 dias de diferenciação, não devem ser utilizados. O índice de fusão na Figura Suplementar 1B foi determinado pelo cálculo do percentual de núcleos dentro dos miótubos positivo para cada marcador do miotube do número total de núcleos por imagem. Descobrimos que um índice de fusão de aproximadamente 8% foi suficiente para nossa co-cultura na geração de NMJs.
É sempre importante iniciar uma diferenciação de neurônio motor a partir de uma cultura pura de iPSCs. Quanto mais pura a entrada- mais pura o resultado. O protocolo de diferenciação de neurônios motores gera culturas de neurônios motores, que normalmente são 85%-95% positivos para marcadores de neurônios motores (Figura Suplementar 1C,D)18. As demais células geralmente serão células precursoras indiferenciadas, que em alguns casos sofrerão uma extensa proliferação e, por meio deste, terão um impacto negativo na qualidade da cultura. Para obter o melhor resultado deste protocolo, a eficiência de diferenciação de neurônios motores deve ser avaliada antes de aplicar o dia 10 neurônios motores-NPCs no dispositivo. Além disso, uma verificação de qualidade do NPC pode ser realizada no dia 11 para avaliar a expressão do marcador NPC Olig2 (Figura Suplementar 1E,F).
Inicialmente, os neurônios motores-NPCs e os MABs foram banhados ao mesmo horário no dia 10. Aqui, a diferenciação do MAB foi iniciada no dia 11. O gradiente de volume e fator de crescimento implementado no dia 14 nos permitiu avaliar a formação do NMJ no dia 21, encurtando assim o protocolo em uma semana. Curiosamente, pudemos observar a formação característica de NMJ por ICC (Figura Suplementar 2A). No entanto, não conseguimos adquirir uma saída funcional através das gravações de cálcio de células vivas tão cedo na diferenciação do neurônio motor (dados não mostrados). Concluímos que os neurônios motores ainda não estavam maduros o suficiente para formar conexões de NMJ funcionais com os miotubes, embora a morfologia NMJ parecesse promissora. Isso está em consonância com nossas observações anteriores de que potenciais de ação espontânea em neurônios motores, registrados através de análise eletrofisiológica de grampo de remendo, só ocorrem no dia 35 de diferenciação de neurônios motores15.
Além disso, tentamos prolongar a maturação do neurônio motor, bem como a sustentabilidade da cocultura, amadurecendo os neurônios motores no dispositivo por 2 semanas (dia 24), antes de emplaar os MABs. Infelizmente, observou-se uma grande quantidade de neurônio-neurite motora espontânea atravessando microgrooves, o que resultou na inibição do apego mab (Figura Suplementar 2B). Devido à falta de formação do miotube no canal, não tivemos sucesso na identificação de NMJs no dia 36 e, portanto, aplicamos o protocolo de 28 dias (Figura 1).
Identificação, quantificação e caracterização morfológica de NMJs in vitro
Após seguir o protocolo de 28 dias (Figura 1), podem ser obtidos NMJs totalmente funcionais. Tanto in vivo quanto in vitro, os NMJs são caracterizados imunohisto ou imunocytoques pela co-localização de um marcador pré-sináptico e um marcador postsinápico. Neste estudo, foi utilizada uma combinação de cadeia pesada de neurofilamento (NEFH) e SYP como uma combinação de marcadores pré-sinápticos, o que permitiu o seguinte de um único neurite da soma do neurônio motor para o processo mais distal. No lado muscular, o Btx é amplamente utilizado como um marcador post-sináptico para AChRs, e também foi usado neste estudo. A suplementação de agrin e laminina promove o agrupamento das AChRs no sarcolemma19,20,21, facilitando a identificação de AChRs in vitro e também aumenta o número de AChRs e NMJs presentes18.
A fim de localizar e calcular os NMJs de forma imparcial, cada miotube é identificado através da cadeia pesada de miosina (MyHC)-positividade e imageado em pilhas de z a 40x de ampliação usando um microscópio confocal invertido. Por myotubes muito longos, várias pilhas z foram adquiridas. Para análise de imagem, o número de co-localizações entre NEFH/SYP e Btx é contado manualmente através de cada pilha z, e o número de co-localizações é normalizado para o número de motubes presentes na pilha z (Figura 2A-C)18. Nem todos os miotubes terão NMJs, como visto na quantificação de miótubos inervados (Figura 2D). Consequentemente, é importante realizar uma abordagem de gravação imparcial, onde todos os miotubes são imagens, independente da presença de Btx.
É possível identificar dois tipos de morfologias neste sistema in vitro . Os NMJs aparecem como NMJs de ponto de contato único, onde um neurite toca em um conjunto de AChRs em um ponto de interação, ou NMJs de ponto de contato múltiplo, onde um neurite se espalhará e se envolverá com o cluster AChR sobre uma superfície maior. Essas duas morfologias podem ser identificadas imunocytochemicamente (Figura 2A)18 e com SEM (Figura 2B)18, e também podem ser quantificadas (Figura 2C)18. No geral, os múltiplos pontos de contato facilitam uma conexão mais ampla através de um grande incorporação muscular, que aponta para uma formação NMJ mais madura. Em contrapartida, os NMJs de ponto de contato único são considerados menos maduros devido ao estado de desenvolvimento precoce da cultura.
Avaliação funcional de NMJs in vitro
Para avaliar a funcionalidade dos NMJs, foram utilizadas gravações transitórias de cálcio de células vivas (Figura 3)18. Aproveitando-se do sistema fluidamente isolado dos dispositivos microfluidos, o lado soma do neurônio motor foi estimulado com uma alta concentração (50 mM) de cloreto de potássio enquanto registrava simultaneamente um influxo de cálcio nos miótubos, que eram carregados com o corante Fluo-4 sensível ao cálcio (Figura 3A). Quase imediatamente após a ativação do neurônio motor, pudemos observar um fluxo de cálcio nos miótubos através de uma formação de onda característica, que confirma uma conexão funcional através do neurônio-neurite motor e do miotube (Figura 3A-C)18. Não foram observadas ondas espontâneas de cálcio nem contrações espontâneas do miotube, embora tenha sido observada contração do miotube sobre estimulação direta com cloreto de potássio. A especificidade da conexão foi confirmada adicionando o antagonista competitivo AChR, tubocurarine hidrocloreto pentahidrato (DTC) ao compartimento do miotube (Figura 3A), o que resultou em uma inibição do influxo de cálcio (Figura 3C). Este efeito confirmou que a conexão entre neurônios motores e motubes resultou em NMJs totalmente funcionais. Para avaliar o número de miotubes ativos através da estimulação do NMJ, o compartimento do miotube foi estimulado diretamente com cloreto de potássio para identificar o número total de miotubes ativos neste compartimento. Aproximadamente 70% dos miotubes estavam ativos através da ativação estimulada pelo neurônio motor com cloreto de potássio (Figura 3D)18.
Esses resultados confirmam a formação, número, morfologia e funcionalidade ideal do NMJ através da co-cultivo dos neurônios motores derivados do iPSC e miótubos derivados do MAB durante um protocolo de 28 dias.
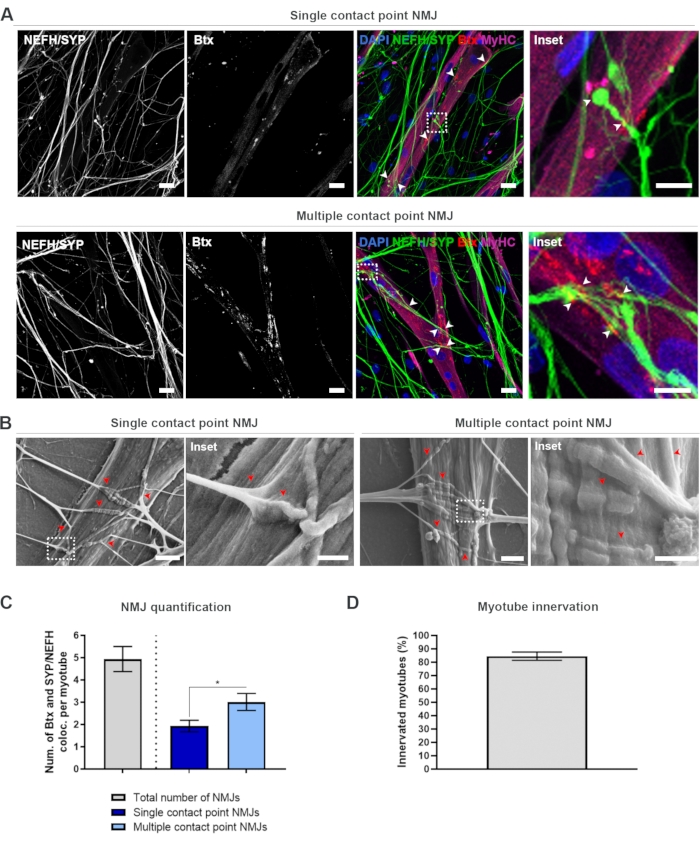
Figura 2: Formação de NMJ em dispositivos microfluidos. (A) Micrografos confocal da formação de NMJ em dispositivos microfluidos pré-montados no dia 28. Os NMJs são identificados através da co-localização (pontas de flecha) de marcadores pré-sinápticos (NEFH e SYP) e marcador AChR postsinápico (Btx) em myotubes manchados de MyHC. Os NMJs são identificados morfologicamente através da formação de ponto de contato único ou múltiplo entre neurites e aglomerados AChR. Núcleos de etiqueta DAPI. Barra de escala, 25 μm. Inset mostra uma ampliação de um NMJ. Barra de escala de inset, 10 μm. (B) SEM de morfologia NMJ em dispositivos microfluidos de silicone no dia 28. Pontas de flecha retratam a incorporação de neurite no miotube. Barra de escala, 2 μm. Inset mostra uma ampliação do NMJ. Barra de escala de inset, 1 μm. (C) Quantificação do número total de NMJs por myotube, bem como o número de NMJs single e múltiplo ponto de contato por myotube. O gráfico é mostrado como ± erro padrão da média a partir de quatro réplicas biológicas. A significância estatística é determinada com o teste de Mann-Whitney com * p < 0,05. (D) Quantificação da porcentagem de miótubos inervados. O gráfico é mostrado como ± erro padrão da média a partir de quatro réplicas biológicas. Este número foi modificado de Stoklund Dittlau, K. et al.18. Clique aqui para ver uma versão maior desta figura.
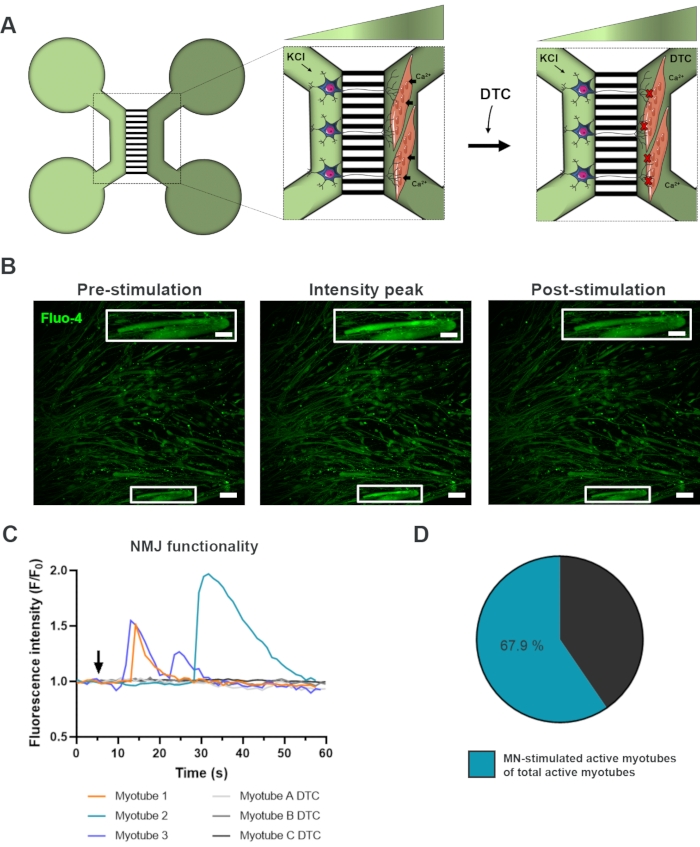
Figura 3: Confirmação da funcionalidade do NMJ. (A) Ilustração esquemática de gravações transitórias de cálcio de células vivas da funcionalidade NMJ em dispositivos microfluidos pré-montados no dia 28 antes e depois do bloqueio do NMJ com tubocurarine (DTC)22. Os neurônios motores no compartimento verde claro são estimulados com cloreto de potássio de 50 mM (KCl), o que causa uma resposta intracelular do neurônio motor através dos neurídeos. Isso evoca um influxo de cálcio (Ca2+) em mofutas, que são rotulados com corante Fluo-4 sensível ao cálcio (compartimento verde escuro). (B) Micrografias de fluorescência fluo-4 de pré-estimulação, pico de intensidade e pós-estimulação de um miotube representando uma onda de aumento de cálcio intracelular sobre a estimulação do neurônio motor com KCl. Inset mostra uma ampliação de um miotube ativo innervated. Barras de escala, 100 μm. Barra de escala de entrada, 200 μm. (C) Curvas representativas de fluxo de cálcio em miotubes após estimulação de neurônio motor com KCl (seta) confirmando a funcionalidade NMJ. Myotube 1-3 mostra curvas características de cálcio através da innervação neurônio-miotube motor, enquanto o Myotube A-C DTC retrata curvas após o bloqueio do NMJ com DTC. (D) Proporção de miótubos ativos estimulados por neurônios motores no número total de miotubes ativos. Este número foi modificado de Stoklund Dittlau, K. et al.18. As ilustrações celulares foram modificadas do Smart Server medical Art22. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Verificação do neurônio motor, índice de fusão de MAB e controle de qualidade NPC. (A) Imagens confocal de motubes derivados do MAB 10 dias após o início da diferenciação. Os miotubes são rotulados com marcadores de miotube: desmin, MyHC, myogenin (MyoG) e titin. Os núcleos estão manchados com DAPI. Barra de escala, 100 μm. (B) Quantificação do índice de fusão MAB 10 dias após o início da diferenciação. Após a fome, os MABs se fundem em miótubos multinucleados, que foram quantificados para positividade de marcadores do miotube (AB+). O gráfico mostra ± erro padrão da média a partir de três réplicas biológicas. (C) Imagens confocal de neurônios motores derivados do iPSC no dia 28 de diferenciação, que são rotuladas com marcadores de neurônio motor NEFH, acetiltransferase de colina (ChAT) e Islet-1, além do marcador pan-neuronal βIII-tubulin (Tubulin). Os núcleos estão manchados com DAPI. Barras de escala, 75 μm. (D) Quantificação do número de células, que são positivas para neurônios motores e marcadores pan-neuronais (AB+). O gráfico mostra ± erro padrão da média a partir de três réplicas biológicas. (E) Imagens confocal de NPCs derivadas do iPSC no dia 11 de diferenciação de neurônios motores, que são rotuladas com o marcador NPC Olig2 e o marcador pan-neuronal βIII-tubulin (Tubulin). Os núcleos estão manchados com DAPI. Barras de escala, 50 μm. (F) Quantificação do número de NPCs, que são positivos para Olig2 e βIII-tubulin (AB+). O gráfico mostra ± erro padrão da média a partir de três réplicas biológicas. Este número foi modificado de Stoklund Dittlau, K. et al.18. Clique aqui para baixar este Arquivo.
Figura suplementar 2: Otimização do protocolo de cocultura (A) Imagens confocal da formação de NMJ no dia 21 de diferenciação de neurônios motores, quando os MABs são semeados ao mesmo ponto de tempo que os NPCs no dia 10. Os NMJs são identificados através da co-localização (pontas de flecha) de marcadores pré-sinápticos (NEFH e SYP) e marcador AChR postsinápico (Btx) em myotubes manchados de MyHC. Barra de escala (esquerda), 10 μm. Barra de escala (à direita), 5 μm. (B) Imagem de campo brilhante do canal do miotube no dia 24 representando a travessia neurônio-neurite motora espontânea inibindo o apego de MABs. Barra de escala, 100 μm. Clique aqui para baixar este Arquivo.
| Reagente | Concentração de estoque | Concentração final |
| IMDM | 1x | 80% |
| Soro bovino fetal | 15% | |
| Penicilina/Estreptomicina | 5000 U/mL | 0.5% |
| L-glutamina | 50x | 1% |
| Piruvato de sódio | 100 mM | 1% |
| Aminoácidos não essenciais | 100x | 1% |
| Selênio transferrino de insulina | 100x | 1% |
| bFGF (adicionado fresco) | 50 μg/mL | 5 ng/mL |
Tabela 1: Meio de crescimento do MAB. O médio pode durar 2 semanas a 4 °C. bFGF é adicionado fresco no dia do uso.
| Reagente | Concentração de estoque | Concentração final |
| DMEM/F12 | 50% | |
| Meio neurobásal | 50% | |
| Penicilina/Estreptomicina | 5000 U/mL | 1% |
| L-glutamina | 50x | 0.5 % |
| Suplemento N-2 | 100x | 1% |
| B-27 sem vitamina A | 50x | 2% |
| β-mercaptoetanol | 50 mM | 0.1% |
| Ácido ascórbico | 200 μM | 0,5 μM |
Tabela 2: Meio basal do neurônio motor. O médio pode durar 4 semanas a 4 °C.
| Dia | Reagente | Concentração de estoque | Concentração final | Compartimento |
| Dia 11/10 | Agonista suavizada | 10 mM | 500 nM | Ambos |
| Ácido retinóico | 1 mM | 0,1 μM | ||
| DAPT | 100 mM | 10 μM | ||
| BDNF | 0,1 mg/mL | 10 ng/mL | ||
| GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Dia 14. | DAPT | 100 mM | 20 μM | Ambos |
| BDNF | 0,1 mg/mL | 10 ng/mL | ||
| GDNF | 0,1 mg/mL | 10 ng/mL | ||
| Dia 16. | DAPT | 100 mM | 20 μM | Ambos |
| BDNF | 0,1 mg/mL | 10 ng/mL | ||
| GDNF | 0,1 mg/mL | 10 ng/mL | ||
| CNTF | 0,1 mg/mL | 10 ng/mL | ||
| Dia 18. | BDNF | 0,1 mg/mL | 10 ng/mL | Neurônio motor |
| GDNF | 0,1 mg/mL | 10 ng/mL | ||
| CNTF | 0,1 mg/mL | 10 ng/mL | ||
| Dia 21. | BDNF | 0,1 mg/mL | 30 ng/mL | Myotube |
| GDNF | 0,1 mg/mL | 30 ng/mL | ||
| CNTF | 0,1 mg/mL | 30 ng/mL | ||
| Rio Agrin | 50 μg/mL | 0,01 μg/mL | ||
| Laminina | 1 mg/mL | 20 μg/mL | ||
| Dia 21. | Sem suplementos | Neurônio motor |
Tabela 3: Suplementos médios do neurônio motor. Suplementos são adicionados frescos no dia do uso ao meio basal do neurônio motor.
| Dia | Reagente | Concentração de estoque | Concentração final | Compartimento |
| Dia 18. | DMEM/F12 | 97% | MAB | |
| Piruvato de sódio | 100 mM | 1% | ||
| Soro de cavalo | 2% | |||
| Rio Agrin | 50 μg/mL | 0,01 μg/mL |
Tabela 4: Meio de diferenciação do MAB. O médio pode durar 2 semanas a 4 °C. Agrin é adicionado fresco no dia do uso.
Discussão
O protocolo descreve um método relativamente fácil de usar, que gera unidades motoras humanas com NMJs funcionais em dispositivos microfluidos disponíveis comercialmente em menos de 30 dias. Descreve-se como os NMJs podem ser avaliados morfologicamente através de técnicas padrão como ICC e SEM e funcionalmente através de gravações de cálcio de células vivas.
Uma grande vantagem deste protocolo é o uso da tecnologia de células-tronco. Isso permite a adaptabilidade total na qual os NMJs podem ser avaliados tanto em saúde quanto em doenças, independentemente do perfil do doador. O modelo já se mostrou bem sucedido e benéfico em pesquisas de ELA, onde identificamos prejuízos no crescimento de neurite, recrescimento e números de NMJ como novos fenótipos devido a mutações no gene FUS18. Com esse modelo, é possível ampliar a pesquisa para incluir formas esporádicas de ELA, onde a etiologia é desconhecida, utilizando iPSCs de pacientes esporádicos de ELA. Isso fornece uma vantagem sobre os modelos animais tradicionais, que dependem da superexpressão transgênica de genes mutantes para recapitular a doença humana23,24. Além disso, nosso sistema totalmente humano permite a recapitulação potencial da fisiologia e doenças específicas do homem. Estudos anteriores demonstraram as diferenças entre a morfologia do roedor e o NMJ humano25, o que sugere que a cautela deve ser implementada ao usar roedores para abordar a patologia do NMJ humano. Embora este sistema seja uma configuração in vitro relativamente simples, que carece da complexidade de um modelo in vivo, foi possível demonstrar que a morfologia NMJ exibida nos dispositivos microfluidos se assemelhava a NMJs de amputados humanos25. Além disso, este modelo permite a avaliação do NMJ durante a formação e maturação do NMJ, potencialmente revelando fenótipos precoces da doença, ausentes, não identificáveis ou negligenciados em amostras humanas pós-morte.
Os MABs fornecem uma opção válida para gerar miotubes, embora sua sobrevivência limitada de 10 dias seja uma desvantagem do sistema. A sobrevivência do miotube depende de seu apego à superfície, que provavelmente está comprometida por contrações espontâneas dos miofibers. Após mais de 10 dias, a maioria dos myotubes terá se destacado, tornando a cultura NMJ inutilizável. Idealmente, os miotubes seriam gerados a partir de iPSCs também. No entanto, os protocolos atuais têm se mostrado difíceis de reproduzir26 devido à variabilidade no índice de fusão27,28,29,30.
Usando dispositivos microfluidos disponíveis comercialmente, geramos um sistema padronizado, totalmente acessível. Outros modelos NMJ existem31,32,33,34,35,36,37,38,39,40,41,42. No entanto, eles normalmente dependem de compartimentos únicos, que não possuem a compartimentação e isolamento fluido entre os tipos de células, ou em vasos de cultura personalizados, o que diminui a disponibilidade e potencialmente também a reprodutibilidade. Os dispositivos microfluidos utilizados para este protocolo podem ser adquiridos com microvalôos de vários comprimentos, o que permite análises posteriores como transporte axonal43,44 ou axotomia18,45,46 investigações. O isolamento fluido entre os compartimentos permite ainda o tratamento compartimentalizado de medicamentos de neurônios motores ou miotubes, o que pode ser favorável no desenvolvimento da terapia. Mais empresas especializadas em microfluidos surgiram, que se abriram para uma grande seleção de design e recursos de dispositivos, promovendo ainda mais a acessibilidade para pesquisas in vitro.
Em conclusão, desenvolvemos um protocolo que fornece um método confiável, versátil e fácil de cultivar unidades motoras humanas com NMJs funcionais.
Divulgações
L.V.D.B. tem uma patente sobre o uso de inibidores de HDAC na doença de Charcot-Marie-Tooth (EUA-2013227717-A1), é um co-fundador científico da Augustine Therapeutics, e membro de seu conselho consultivo científico. Os outros autores não declaram interesses concorrentes.
Agradecimentos
Os autores agradecem a Nikky Corthout e Sebastian Munck da LiMoNe, Grupo de Pesquisa Neurobiologia Molecular (VIB-KU Leuven) por seus conselhos sobre gravações de fluorescência transitória de cálcio de células vivas. Esta pesquisa foi apoiada pela Comissão Fulbright para a Bélgica e luxemburguês, KU Leuven (C1 e "Abrindo o Futuro" Fundo), o VIB, a Agência de Inovação pela Ciência e Tecnologia (IWT; SBO-iPSCAF), o "Fundo de Pesquisa Científica Flandres" (FWO-Vlaanderen), a Target ALS, a ALS Liga België (A Cura para a ALS), o Governo belga (Interuniversity Attraction Poles Program P7/16 iniciado pelo Escritório Federal de Política científica belga), pela Fundação Thierry Latran e pela "Association Belge contre les Maladies neuro-Musculaires" (ABMM). T.V. e J.B. são apoiados por bolsas de doutorado concedidas pela FWO-Vlaanderen.
Materiais
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Referências
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados