Method Article
Erzeugung humanmotorischer Einheiten mit funktionellen neuromuskulären Verbindungen in mikrofluidischen Geräten
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Methode zur Erzeugung menschlicher motorischer Einheiten in kommerziell erhältlichen mikrofluidischen Geräten durch Kokulturierung von humanen induzierten pluripotenten Stammzell-abgeleiteten Motoneuronen mit humanen primären Mesoangioblasten-abgeleiteten Myotuben, was zur Bildung funktionell aktiver neuromuskulärer Verbindungen führt.
Zusammenfassung
Neuromuskuläre Verbindungen (NMJs) sind spezialisierte Synapsen zwischen dem Axon des unteren Motoneurons und dem Muskel, die das Eingreifen der Muskelkontraktion erleichtern. Bei Motoneuronerkrankungen wie amyotropher Lateralsklerose (ALS) und spinaler Muskelatrophie (SMA) degenerieren NMJs, was zu Muskelatrophie und fortschreitender Lähmung führt. Der zugrunde liegende Mechanismus der NMJ-Degeneration ist unbekannt, was vor allem auf das Fehlen übersetzbarer Forschungsmodelle zurückzuführen ist. Diese Studie zielte darauf ab, ein vielseitiges und reproduzierbares In-vitro-Modell einer menschlichen motorischen Einheit mit funktionellen NMJs zu erstellen. Daher wurden humane induzierte pluripotente Stammzellen (hiPSC)-abgeleitete Motoneuronen und humane primäre Mesoangioblasten (MAB)-abgeleitete Myotuben in kommerziell erhältlichen mikrofluidischen Geräten kokulturiert. Die Verwendung von fluidisch isolierten Mikrokompartimenten ermöglicht die Aufrechterhaltung zellspezifischer Mikroumgebungen und ermöglicht gleichzeitig den Kontakt von Zelle zu Zelle durch Mikrobohrungen. Durch die Anwendung eines chemotaktischen und volumetrischen Gradienten wurde das Wachstum von Motoneuron-Neuriten durch die Mikrorillen, die die Myotube-Interaktion und die Bildung von NMJs fördern, stimuliert. Diese NMJs wurden immunzytochemisch durch Kolokalisation von Motoneuronen-präsynaptischem Marker Synaptophysin (SYP) und postsynaptischem Acetylcholinrezeptor (AChR) Marker α-Bungarotoxin (Btx) auf Myotuben identifiziert und morphologisch mittels Rasterelektronenmikroskopie (REM) charakterisiert. Die Funktionalität der NMJs wurde durch die Messung der Kalziumreaktionen in Myotuben bei der Depolarisation der Motoneuronen bestätigt. Die motorische Einheit, die mit standardisierten mikrofluidischen Geräten und Stammzelltechnologie erzeugt wird, kann die zukünftige Forschung unterstützen, die sich auf NMJs in Gesundheit und Krankheit konzentriert.
Einleitung
NMJs erleichtern die Kommunikation zwischen unteren spinalen Motoneuronen und Skelettmuskelfasern durch die Freisetzung von Neurotransmittern1. Bei Motoneuronerkrankungen wie ALS und SMA degenerieren die NMJs, was zu einer Störung der Kommunikation mit den Muskeln führt2,3,4,5,6,7. Dies führt dazu, dass die Patienten allmählich ihre Muskelfunktion verlieren, was dazu führt, dass sie an den Rollstuhl gebunden sind und schließlich aufgrund der fortschreitenden Atrophie lebenswichtiger Muskelgruppen wie des Zwerchfells auf die Atemwegserhaltung angewiesen sind. Die genauen zugrunde liegenden Mechanismen, die für diesen tiefgreifenden Verlust von NMJs bei diesen Störungen verantwortlich sind, sind unbekannt. Viele Studien wurden an transgenen Tiermodellen durchgeführt, was uns einige Einblicke in die Pathogenese der NMJ-Degeneration gegeben hat5,6,8,9,10,11. Um die Pathologie vollständig zu verstehen und der Denervierung entgegenzuwirken, ist es jedoch wichtig, ein menschliches System zu haben, das volle Zugänglichkeit ermöglicht.
Hier beschreibt das Protokoll eine relativ einfache Möglichkeit, menschliche NMJs durch die Co-Kultivierung von hiPSC-abgeleiteten Motoneuronen und humanen primären MAB-abgeleiteten Myotuben unter Verwendung kommerziell erhältlicher mikrofluidischer Geräte zu erzeugen. Die Verwendung von Mikrofluidik zur Polarisierung und fluidischen Isolierung der Somas und Axone von Neuronen ist seit der erstbeschriebenen Beschreibung der "Campenot"-Kammern12 in den späten 1970er Jahren bekannt. Seitdem wurden mehr mikrofluidische Designs hergestellt, einschließlich kommerzieller Optionen. Die in diesem Protokoll verwendeten Geräte enthalten zwei Fächer, und jedes Fach besteht aus zwei Vertiefungen, die mit einem Kanal13 verbunden sind. Die beiden Fächer sind verspiegelt und mit mehreren Mikrobohrungen verbunden. Diese Mikrorillen haben eine Größe, die das Neuritenwachstum erleichtert und gleichzeitig die fluidische Isolierung zwischen den beiden Kompartimenten durch einen kapillaren hydrostatischen Druck aufrechterhält13,14. Mit diesem System ist es möglich, Motoneuronen in einem Kompartiment und Muskelzellen in dem anderen zu kultivieren, jeweils in ihrem spezifischen Kulturmedium, während sie gleichzeitig eine physische Verbindung durch Neuriten ermöglichen, die durch die Mikrogrooves gehen und sich mit den Muskelzellen beschäftigen. Dieses Modell bietet ein vollständig zugängliches und anpassungsfähiges In-vitro-System einer menschlichen motorischen Einheit, mit dem die frühe NMJ-Pathologie bei Krankheiten wie ALS und SMA untersucht werden kann.
Protokoll
Von allen Probanden, die ihre Proben für die iPSC-Generierung und die MAB-Ernte zur Verfügung stellten, wurde eine schriftliche Einverständniserklärung eingeholt. Das Verfahren wurde von der medizinischen Ethikkommission des Universitätsspitals Leuven (Nr. S5732-ML11268) und von der wichtigsten forschungsethischen Kommission des Vereinigten Königreichs im Rahmen des StemBANCC-Projekts genehmigt. Alle in diesem Protokoll verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt und sollten steril verwendet werden. Medien sollten vor Gebrauch auf Raumtemperatur (RT) erhitzt werden, sofern nicht anders angegeben. Eine Übersicht über das Co-Culture-Protokoll finden Sie in Abbildung 1.
1. Differenzierung von Motoneuron-Vorläufern von iPS-Zellen
- Befolgen Sie das Motoneuron-Differenzierungsprotokoll15, das aus einer früheren Studie16 angepasst wurde, bis der Zustand des neuronalen Vorläufers (NPCs) am Tag 10 erreicht ist. Entsprechend dem Zeitrahmen des Protokolls wird die Differenzierung an einem Montag (Tag 0) eingeleitet, was zu Tag 10 NPCs an einem Donnerstag führt.
- Kryokonservierung Tag 10 NPCs im Knock-out Serumersatz mit 10% Dimethylsulfoxid (DMSO) bei einer Dichte von 2 x 106- 4 x 106 Zellen pro Fläschchen.
ACHTUNG: DMSO ist giftig: Griff in einem Abzug mit persönlicher Schutzausrüstung.
HINWEIS: Es wird erwartet, dass etwa 50% des Tages 10 NPCs nach dem Auftauen lebenswichtig sind. Stoppen Sie das Motoneuron-Differenzierungsprotokoll in diesem "Tag 10 NPC" -Zustand und kryokonservieren Sie die NPCs, um eine große Anzahl von NPCs zu erzeugen, die später gespeichert und verwendet werden können, wodurch die Länge der Gesamtzeitleiste des Co-Kultur-Protokolls von 28 Tagen auf insgesamt 19 Tage reduziert wird.
2. Ableitung und Pflege von Human-MABs
HINWEIS: MABs sind gefäßassoziierte mesenchymale Stammzellen, die in diesem Fall aus Biopsien eines 58-jährigen gesunden Spenders gewonnen wurden. Alternative kommerzielle Quellen sind verfügbar. Das Protokoll zur Erlangung von MABs wird kurz erläutert. Weitere Informationen entnehmen Sie bitte dem ausführlichen Protokoll17. Alle MAB-Medien sollten vor Gebrauch auf 37 °C erhitzt werden.
- Zerkleinern Sie das Biopsiegewebe und inkubieren Sie auf Kollagen (aus Kalbsleder) beschichteten 6 cm Schalen in einem Wachstumsmedium (Tabelle 1) für 2 Wochen. Wechseln Sie das Medium alle 4 Tage.
- Um eine Kollagenbeschichtung herzustellen, lösen Sie 100 mg Kollagen in 20 ml 0,1 M Essigsäure auf. Kollagen braucht Zeit, um sich aufzulösen, also legen Sie die Mischung über Nacht bei RT auf eine Schaukelplattform. Am nächsten Tag mit 80 ml ddH2O auf ein Endvolumen von 100 ml auffüllen.
VORSICHT: Essigsäure ist giftig; Griff in einem Abzug mit persönlicher Schutzausrüstung.
HINWEIS: Kollagen aus Kalbslederbeschichtung kann bis zu 5x wiederverwendet werden. Bei 4 °C lagern. - Beschichten Sie die gesamte Oberfläche der Schale oder des Kolbens mit Kollagen, schließen Sie sie und inkubieren Sie sie für 20 minuten bei RT in einer laminaren Strömung. Nach 20 min das Kollagen in einem frischen Behälter zurückgewinnen, die leere Schüssel/den leeren Kolben verschließen und 10 min bei RT in der laminaren Strömung stehen lassen.
- Die Schale/den Kolben wird zur Inkubation über Nacht (oder mindestens 6 h) in den Inkubator überlegt (37 °C, 5 % CO2). Waschen Sie 5x mit Dulbeccos phosphatgepufferter Kochsalzlösung ohne Kalzium oder Magnesium (DPBS), bevor Sie die Zellen plattieren.
- Um eine Kollagenbeschichtung herzustellen, lösen Sie 100 mg Kollagen in 20 ml 0,1 M Essigsäure auf. Kollagen braucht Zeit, um sich aufzulösen, also legen Sie die Mischung über Nacht bei RT auf eine Schaukelplattform. Am nächsten Tag mit 80 ml ddH2O auf ein Endvolumen von 100 ml auffüllen.
- Nach 14 Tagen sortiert FACS (Fluorescent Activated Cell Sorting) die MABs auf humane alkalische Phosphatase17 , gefolgt von einer weiteren Expansion. Halten Sie die MABs auf kollagenbeschichteten T75-Kolben im Wachstumsmedium und wechseln Sie das Wachstumsmedium alle 2 Tage (10 ml pro Kolben).
- Kryokonservierung, Passage oder Seed-MABs in Geräten, wenn 70% Konfluenz erreicht werden.
HINWEIS: MABs verlieren ihr myogenes Potential durch spontane Fusionen bei Zell-zu-Zell-Kontakt. Stellen Sie sicher, dass der Zusammenfluss von 70% nicht überschritten wird, wenn Sie MABs erweitern. Ein 70%iger konfluenter T75-Kolben enthält etwa 600.000-800.000 Zellen, die bei 100.000 Zellen pro Durchstechflasche kryokonserviert werden können. Jede Durchstechflasche kann später aufgetaut und zur Ausdehnung in einem T75-Kolben ausgesät werden. - Um MABs zu passieren, waschen Sie sie vorsichtig einmal mit 7 ml DPBS und inkubieren Sie dann in 7 ml MAB-Dissoziationslösung für 3 min bei 37 °C in 5% CO2 , um die Zellen zu dissoziieren.
- Neutralisieren Sie die MAB-Dissoziationslösung mit 7 ml des Wachstumsmediums, kratzen Sie die Zellen vorsichtig ab und übertragen Sie die Zellsuspension in ein 50 ml Zentrifugenröhrchen. Waschen Sie den Kolben vorsichtig mit zusätzlichen 5 ml des Wachstumsmediums, um potenziell verbleibende MABs aufzufangen.
- Zentrifugieren Sie die Zellsuspension für 3 min bei 300 x g, dann gehen Sie direkt zu einem neuen kollagenbeschichteten T75-Kolben zur Expansion, Kryokonservierung im Knock-out-Serumersatz mit 10% DMSO oder zählen Sie zur Aussaat in einem mikrofluidischen Gerät.
HINWEIS: Passagen werden 1x-2x pro Woche für die Zellexpansion bis zu einer maximalen Passagenzahl von 13 durchgeführt. Bei der Dissoziation erscheinen MABs sphärisch und groß in der Form, wenn sie unter dem Mikroskop untersucht werden.
3. Vorbereitung von vormontierten mikrofluidischen Geräten - Tag 9
HINWEIS: Das Protokoll wurde aus dem Neuronen-Geräteprotokoll des Herstellers von Mikrofluidikgeräten angepasst und wurde für die Verwendung von vormontierten und Silikongeräten angepasst. Hier werden vormontierte Geräte für immunzytochemische (ICC) und Live-Cell-Calcium-Transientenaufnahmen verwendet, während Silikongeräte für REM verwendet werden. Die Zeitleiste des Protokolls folgt der Zeitleiste für das Motoneuron-Differenzierungsprotokoll.
- Bereiten Sie die mikrofluidischen Geräte am Tag vor der Aussaat der Zellen vor, da die Beschichtung über Nacht inkubiert werden muss. Nach dem Motoneuron-Protokoll wird dies ein Mittwoch sein. Fügen Sie ~ 10 ml 70% -100% Ethanol in eine 10 cm Petrischale hinzu. Verwenden Sie eine Pinzette, um das Gerät vom Versandbehälter zur Sterilisation in die Petrischale zu bringen.
- Tauchen Sie das Gerät für 10 s in Ethanol und übertragen Sie das Gerät mit einer Pinzette auf ein Blatt Papier, um es in der Laminarströmung für ~ 30 minuten an der Luft zu trocknen. Drehen Sie das Gerät einige Male um, damit beide Seiten trocknen können. Wenn das Gerät trocken ist, verwenden Sie eine Pinzette, um jedes Gerät in eine einzelne 10 cm Petrischale zu bewegen, um die Handhabung zu erleichtern
VORSICHT: Ethanol ist giftig; Griff im Abzug mit persönlicher Schutzausrüstung - Beschichten Sie das Gerät mit Poly-L-Ornithin (PLO) (100 μg/ml) in DPBS und inkubieren Sie bei 37 °C, 5% CO2 für 3 h.
- Verwenden Sie eine P200-Pipette, um 100 μL PLO in DPBS in einem oberen Well sowie so nah wie möglich an der Kanalöffnung hinzuzufügen und die Flüssigkeit zu beobachten, die von der oberen Vertiefung durch den Kanal zur unteren Vertiefung gelangt. Anschließend werden 100 μL PLO in DPBS in die Bodenmulde gegeben.
- Wiederholen Sie dies auf der anderen Seite der Mikrobohrungen und beenden Sie es, indem Sie 100 μL auf einer Seite des Geräts hinzufügen, um einen Volumengradienten zwischen den beiden gespiegelten Seiten des Geräts zu erzeugen, um die Mikrobohrungen zu beschichten (z. B. rechte Seite 200 μL, linke Seite 300 μL). Nach 3 h waschen Sie das Gerät 3x für 5 min mit DPBS. Verwenden Sie bei Bedarf ein Absaugsystem.
HINWEIS: Achten Sie darauf, die Bildung von Luftblasen in den Kanälen zu jedem Zeitpunkt während der Beschichtung oder Kultivierung der Zellen zu vermeiden. Selbst kleine Blasen dehnen sich über kurze Zeit aus und hemmen dadurch die Beschichtung, die Zellaussaat oder den Medienfluss über den Kanal. Wenn die Flüssigkeit während der Beschichtung im Kanal stoppt, wird die PLO-Lösung von beiden Seiten direkt in den Kanal zurückgeführt. Wenn noch Blasen vorhanden sind, verwenden Sie 200 μL DPBS, um den Kanal zu spülen, und wiederholen Sie den Beschichtungsvorgang wie oben in den Schritten 3.3.1-3.3.2 angegeben. Wenn nach dem Aussaaten der Zellen Blasen auftreten, ist es unmöglich, das Gerät wiederherzustellen, da das Spülen des Kanals die Zellen schädigt.
- Beschichten Sie das Gerät mit Laminin (20 μg/ml) in einem neurobasalen Medium und inkubieren Sie es über Nacht bei 37 °C, 5% CO2. Befolgen Sie die gleichen Anweisungen für die PLO-Beschichtung aus den Schritten 3.3.1-3.3.2.
- Verwenden Sie am nächsten Tag eine P200-Pipette und positionieren Sie die Spitze im Bohrloch gegenüber der Kanalöffnung, um die Laminin-Beschichtung von den Vertiefungen zu entfernen. Fügen Sie DPBS zu allen Vertiefungen hinzu und lassen Sie die Geräte mit DPBS in der laminaren Strömung bei RT für die Zellaussaat.
HINWEIS: Ab diesem Zeitpunkt ist es wichtig, Flüssigkeit (Lamininbeschichtung, DPBS, Medien, Fixierlösung usw.) nicht direkt aus den Kanälen zu entfernen, da dies zur Bildung von Luftblasen führen kann. Untersuchen Sie die Geräte immer unter dem Mikroskop, bevor Sie Zellen säen.
4. Vorbereitung von mikrofluidischen Silikongeräten - Tag 9
- Bereiten Sie die mikrofluidischen Silikongeräte am Tag vor der Aussaat der Zellen vor, da die Beschichtung über Nacht inkubiert werden muss. Nach dem Motoneuron-Protokoll wird dies ein Mittwoch sein.
- Fügen Sie ~ 10 ml 70% -100% Ethanol in eine 10 cm Petrischale hinzu. Verwenden Sie eine Pinzette, um das Gerät vom Versandbehälter zur Sterilisation in die Petrischale zu bringen. Tauchen Sie das Gerät für 10 s in Ethanol und übertragen Sie es mit einer Pinzette in eine Vertiefung in einer 6-Well-Platte, um in der Laminarströmung für ~ 30 min an der Luft zu trocknen. Positionieren Sie das Gerät auf der Seite, damit alle Seiten trocknen können.
- Schneiden Sie die REM-Blätter auf die Größe des Geräts ab (lassen Sie einige mm auf jeder Seite). Wiederholen Sie die Sterilisation wie oben in Schritt 4.1.1 beschrieben. Anschließend mit einer Pinzette zum Trocknen in eine 10 cm Petrischale geben. Zwei bis drei REM-Platten passen in eine Schüssel.
- Beschichten Sie die Geräte und die REM-Platten mit PLO (100 μg/ml) in DPBS und inkubieren Sie bei 37 °C, 5% CO2 für 3 h.
- Fügen Sie 1 ml PLO in DPBS pro Vertiefung zu jedem Gerät in der 6-Well-Platte hinzu. Stellen Sie sicher, dass das Gerät auf der Oberseite der PLO-Lösung schwimmt, wobei der Kanal und die Mikrospindelseite nach unten in die Flüssigkeit zeigen. Fügen Sie 10 ml PLO in DPBS pro 10 cm Petrischale hinzu und drücken Sie die REM-Blätter mit einer Pinzette in die Flüssigkeit.
HINWEIS: REM-Platten schwimmen normalerweise auf der Beschichtungslösung. Bevor Sie das Gerät und das Blatt zusammenbauen, drehen Sie das REM-Blatt so um, dass die Oberfläche, die mit dem PLO in Kontakt gekommen ist, den Kanal und die Mikrobohrungsoberfläche des Geräts berührt. - Nach 3 h waschen Sie das Gerät und die REM-Blätter 2x für 5 min mit DPBS, gefolgt von einer weiteren Wäsche für 5 min mit sterilem Wasser. Verwenden Sie bei Bedarf ein Absaugsystem. Übertragen Sie jedes REM-Blatt zur einfachen Handhabung in eine individuelle 10 cm Petrischale.
HINWEIS: Sowohl Geräte als auch REM-Platten müssen vor der Montage vollständig trocken sein. Die abschließende Wäsche mit sterilem Wasser entfernt potenzielle Salzkristalle aus dem DPBS, die sonst die Montage behindern könnten.
- Fügen Sie 1 ml PLO in DPBS pro Vertiefung zu jedem Gerät in der 6-Well-Platte hinzu. Stellen Sie sicher, dass das Gerät auf der Oberseite der PLO-Lösung schwimmt, wobei der Kanal und die Mikrospindelseite nach unten in die Flüssigkeit zeigen. Fügen Sie 10 ml PLO in DPBS pro 10 cm Petrischale hinzu und drücken Sie die REM-Blätter mit einer Pinzette in die Flüssigkeit.
- Arbeiten Sie unter dem Mikroskop in einer laminaren Strömung. Verwenden Sie eine Pinzette, um das Silikongerät mit der Kanal- und Mikrospindelseite nach unten in einem Winkel von 90 ° auf der REM-Platte zu montieren und sicherzustellen, dass alle Seiten ausgerichtet sind. Drücken Sie leicht auf das Gerät, um sicherzustellen, dass nicht nur die äußeren Kanten, sondern auch die Vertiefungen, Kanäle und Mikrorillen abgedichtet werden.
HINWEIS: Geklebte Bereiche erscheinen grau, während diejenigen, die noch nicht montiert sind, unter dem Mikroskop klar erscheinen. Stellen Sie sicher, dass alle Bereiche ohne Luftblasen gut abgedichtet sind, um ein Ablösen des Geräts während der Kultivierung zu vermeiden. Im Falle von Ablagerungen oder Salzkristallen, die die Montage blockieren, waschen Sie sowohl die REM-Platte als auch das Gerät in sterilem Wasser erneut und trocknen Sie sie, bevor Sie den Montagevorgang erneut versuchen. Wenn die Mikrorillen durch zu starkes Drücken auf das Gerät verzerrt erscheinen, entfernen Sie das Gerät vollständig vom REM-Blatt und versuchen Sie die Montage erneut. Seien Sie vorsichtig beim Beschichten und Medienwechsel, sobald das Gerät montiert ist. - Arbeiten Sie unter dem Mikroskop in einer laminaren Strömung. Beschichten Sie das Gerät mit Laminin (20 μg/ml) in einem neurobasalen Medium und inkubieren Sie es über Nacht bei 37 °C, 5% CO2.
HINWEIS: Die Inkubation über Nacht härtet das Silikongerät aus und versiegelt es weiter auf der REM-Platte.- Verwenden Sie eine P200-Pipette, um 100 μL der Lamininlösung in einem möglichst oberen Brunnen sowie in der Nähe der Kanalöffnung hinzuzufügen und zu beobachten, wie die Flüssigkeit vom oberen Brunnen durch den Kanal zum unteren Brunnen gelangt. Überprüfen Sie das Bohrloch und den Kanal auf Leckagen.
- Anschließend 100 μL Lamininlösung in die Bodenmulde geben und auf Leckage prüfen. Wiederholen Sie dies auf der anderen Seite der Mikrobohrungen und beenden Sie es mit zusätzlichen 100 μL auf einer Seite des Geräts, um einen Volumengradienten zwischen den beiden verspiegelten Seiten des Geräts zu erzeugen, um die Mikrobohrungen zu beschichten (z. B. rechte Seite 200 μL, linke Seite 300 μL).
HINWEIS: Entfernen Sie im Falle einer Leckage die Lamininbeschichtung, zerlegen Sie das Gerät und die REM-Platten und waschen Sie beide in sterilem Wasser. Lassen Sie sie trocknen und wiederholen Sie sie ab Schritt 4.3. - Entfernen Sie am nächsten Tag die Beschichtung mit einer P200-Pipette von den Vertiefungen, indem Sie die Spitze im Bohrloch gegenüber der Kanalöffnung positionieren. Fügen Sie DPBS zu allen Vertiefungen hinzu und lassen Sie die Geräte mit DPBS in der laminaren Strömung bei RT für die Zellaussaat.
HINWEIS: Entfernen Sie ab diesem Zeitpunkt keine Flüssigkeit (Lamininbeschichtung, DPBS, Medien, Fixierlösung usw.) direkt aus den Kanälen, da dies zur Bildung von Luftblasen führen kann. Untersuchen Sie die Geräte immer unter dem Mikroskop, bevor Sie Zellen säen.
5. Beschichtung von NPCs in mikrofluidischen Geräten - Tag 10
HINWEIS: Gemäß dem Motoneuron-Differenzierungsprotokoll15 erfolgt die Beschichtung von NPCs des Tages 10 an einem Donnerstag.
- Verwenden Sie frisch dissoziierte NPCs vom Tag 1015 oder tauen Sie 1-2 Durchstechflaschen mit NPCs pro 10 ml des Tages 10 Motoneuronnenmedium (Tabelle 2 und Tabelle 3) mit ROCK-Inhibitorlösung (10 μL/ml) auf und zentrifugieren Sie die Zellsuspension bei 100 x g für 4 min.
- Resuspendieren Sie das Zellpellet in 500-1000 μL Des Tages 10 Motoneuronmediums mit ROCK-Inhibitor(10 μL/ml) Lösung und zählen Sie die lebenden Zellen mit einer beliebigen Zählmethode.
HINWEIS: Wie unten angegeben, stellen Sie sicher, dass Sie die NPCs in die richtige Medienmenge resuspendieren, um ein optimales Seeding-Volumen unterzubringen. - Entfernen Sie DPBS aus zwei Vertiefungen auf einer Seite der Mikrobohrungen im Gerät mit einer P200-Pipette und säen Sie 250.000 NPCs pro Gerät in 60-100 μL des Motoneuron-Mediums des Tages 10.
- In der oberen rechten Vertiefung 30-50 μL der Zellsuspension (125.000 Zellen) in der Nähe der Kanalöffnung in einem Winkel von 45° aussäten und die verbleibende Flüssigkeit vorsichtig entlang des Bohrlochbodens in Richtung der Mitte der Vertiefung mit der Pipettenspitze ziehen.
- Halten Sie einige Sekunden inne, damit die Zellsuspension durch den Kanal fließen kann, bevor Sie dies im unteren Bohrloch (125.000 Zellen in 30-50 μL) wiederholen. Verwenden Sie einen Stift, um die ausgesäte Seite "NPC" oder gleichwertig zu markieren, um die Einfache Orientierung des Geräts ohne Mikroskop zu ermöglichen.
- Inkubieren Sie das Gerät bei 37 ° C, 5% CO2 für 5 min, um die Zellanheftung zu ermöglichen, bevor Sie die beiden ausgesäten Vertiefungen mit einem zusätzlichen Tag 10 Motoneuronenmedium (insgesamt 200 μL / Well) auffüllen und erneut bei 37 ° C, 5% CO2, inkubieren.
HINWEIS: Jede Vertiefung kann 200 μL enthalten. Die Aussaat von Zellen in beiden Vertiefungen und Kanälen gewährleistet eine robuste Struktur der Kultur, wodurch das Risiko einer Zellablösung bei Medienwechseln verringert wird. Es ist möglich, weniger Zellen nur im Kanal zu säen. Dies macht die Kultur jedoch anfälliger für den Volumenstrom durch die Kanäle bei jedem Medienwechsel.
- Verwenden Sie eine P200-Pipette, um DPBS aus den beiden Vertiefungen auf der anderen Seite der Mikrobohrungen gegenüber den frisch ausgesäten NPCs zu entfernen. Fügen Sie 200 μL/Well des Tages 10 Motoneuron-Medien hinzu und warten Sie einige Sekunden zwischen dem oberen und unteren Bohrloch, damit die Medien durch den Kanal fließen können. Fügen Sie dann 6 ml DPBS pro 10 cm Schale um das Gerät hinzu, um die Verdunstung des Mediums während der Inkubation zu verhindern.
HINWEIS: Fügen Sie bei Bedarf während des Kulturzeitraums zusätzliche DPBS um das Gerät hinzu. - Führen Sie an Tag 11 (Freitag), Tag 14 (Montag) und Tag 16 (Mittwoch) einen vollständigen Wechsel des Motoneurons in beiden Kompartimenten des Geräts durch (Tabelle 2 und Tabelle 3). Fügen Sie am Tag des Medienwechsels frische Medienergänzungen hinzu.
HINWEIS: Führen Sie ab diesem Zeitpunkt alle Medienwechsel mit einer P200 Pipette durch. Positionieren Sie die Pipettenspitze immer weg vom Kanal am Rand des Bohrlochs und entfernen Sie die Flüssigkeit nicht direkt aus dem Kanal. Achten Sie darauf, die Silikongeräte nicht zu lösen. Das Entfernen und Hinzufügen von Medium sollte langsam erfolgen, um eine Zellablösung zu verhindern.- Entfernen Sie vorsichtig alle Medien in beiden Vertiefungen mit NPCs, indem Sie die P200-Pipettenspitze am unteren Rand der Vertiefungswand gegenüber der Kanalöffnung positionieren. Fügen Sie langsam 50-100 μL frisches Motoneuronmedium in die obere Vertiefung ein, indem Sie die P200-Pipettenspitze am oberen Rand der Bohrlochwand gegenüber der Kanalöffnung positionieren.
- Halten Sie einige Sekunden inne, damit das Medium durch den Kanal fließen kann, bevor Sie 50-100 μL Motoneuronmedium in den Bodentopf geben. Wiederholen Sie diesen Vorgang vorsichtig, bis beide Vertiefungen 200 μL/Well enthalten. Wiederholen Sie den Vorgang an der Seite ohne Zellen.
6. Beschichtung von MAB in mikrofluidischen Geräten - Tag 17
- Etwa 7 Tage vor der Aussaat von MABs in den mikrofluidischen Geräten (Tag 10 der Motoneurondifferenzierung) die MABs auftauen und im Wachstumsmedium (Tabelle 1) in einem mit Kollagen beschichteten T75-Kolben aussäen, um eine ausreichende Zellexpansion zu ermöglichen. Siehe Abschnitt 2.
- Dissoziieren Sie am Tag 17 der Motoneurondifferenzierung (Donnerstag) MABs wie in Schritt 2.4 erläutert, resuspendieren Sie das Zellpellet in ~ 500 μL Wachstumsmedium und zählen Sie die lebenden Zellen mit einer beliebigen Zählmethode.
HINWEIS: Stellen Sie wie unten angegeben sicher, dass Sie die MABs in die richtige Medienmenge resuspendieren, um ein optimales Seeding-Volumen zu ermöglichen. - Entfernen Sie das Motoneuronmedium auf der ungesetzten Seite der Mikrobohrungen im Gerät mit einer P200-Pipette, waschen Sie es vorsichtig mit DPBS und säen Sie 200.000 MABs pro Gerät in 60-100 μL Wachstumsmedium.
- In der oberen rechten Vertiefung säen Sie 30-50 μL Zellsuspension (100.000 Zellen) in der Nähe der Kanalöffnung in einem Winkel von 45° und ziehen sie die restliche Flüssigkeit vorsichtig entlang des Bohrlochbodens in Richtung der Mitte des Bohrlochs mit der Pipettenspitze. Halten Sie einige Sekunden inne, um den Zellfluss durch den Kanal zu ermöglichen, bevor Sie sich im unteren Brunnen wiederholen (100.000 Zellen in 30-50 μL).
- Inkubieren Sie das Gerät bei 37 °C, 5% CO2 für 5 min, um die Zellbindung zu ermöglichen, bevor Sie die beiden frisch mit MAB ausgesäten Vertiefungen mit zusätzlichem Wachstumsmedium (insgesamt 200 μL / Well) auffüllen. Erneut bei 37 °C, 5% CO2 inkubieren.
HINWEIS: Am Tag 17 ist auf der Motoneuronseite des Geräts kein Mittelwechsel erforderlich. Tag 17 Mittlere Veränderung nach der zuvor veröffentlichten Motoneuron-Differenzierungsmethode15 wird stattdessen am Tag 18 (Freitag) durchgeführt.
7. Implementierung eines volumetrischen und chemotaktischen Gradienten zur Förderung des Wachstums von Motoneuronneuriten in Richtung MAB-Kompartiment
- Führen Sie an Tag 18 eine vollständige Medienänderung auf der Motoneuronseite mit Tag 18 Motoneuronmedium (200 μL / well) durch. Befolgen Sie die Anweisungen für mittlere Änderungen, die in den Schritten 5.5.1-5.5.2 erwähnt werden. Initiieren Sie die MAB-Differenzierung im MAB-Fach des Geräts (Tabelle 2 und Tabelle 4).
- Waschen Sie die MAB-Kompartimente einmal sorgfältig mit DPBS, bevor Sie ein vorgewärmtes MAB-Differenzierungsmedium (Tabelle 4) hinzufügen, das mit 0,01 μg/ml humanem Agrin (200 μL/Well) ergänzt wird.
HINWEIS: MABs verschmelzen und bilden im Laufe einer Woche mehrkernige Myotuben.
- Waschen Sie die MAB-Kompartimente einmal sorgfältig mit DPBS, bevor Sie ein vorgewärmtes MAB-Differenzierungsmedium (Tabelle 4) hinzufügen, das mit 0,01 μg/ml humanem Agrin (200 μL/Well) ergänzt wird.
- Beginnen Sie am Tag 21 gemäß dem Motoneuron-Differenzierungsprotokoll (Montag) den chemotaktischen und volumetrischen Gradienten (Tabelle 2 und Tabelle 3).
- Fügen Sie 200 μL / Well des motoneuronischen Basalmediums mit 30 ng / ml des vom Gehirn abgeleiteten neurotrophen Faktors (BDNF), des aus Gliazelllinien abgeleiteten neurotrophen Faktors (GDNF) und des ziliaren neurotrophen Faktors (CNTF), des menschlichen Agrins (0,01 μg / ml) und des Laminins (20 μg / ml) zum Myotube-Kompartiment (zuvor als MAB-Kompartiment definiert) hinzu. Dem Motoneuron-Kompartiment ein Motoneuron-Basalmedium (100 μL/Well) ohne Wachstumsfaktoren zuführen.
- Wiederholen Sie Schritt 7.2 jeden zweiten Tag bis zum 28. Tag der Motoneurondifferenzierung. Am Wochenende ist kein Medienwechsel erforderlich.
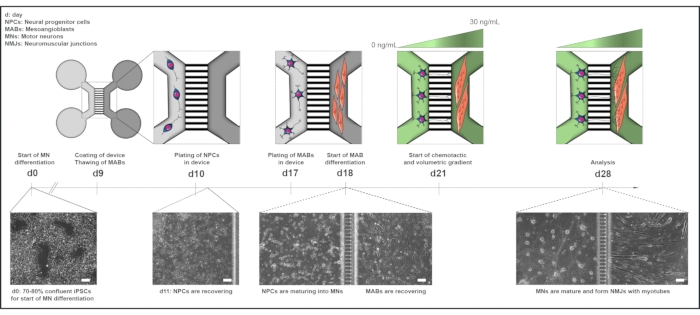
Abbildung 1: Schematische Übersicht über das Motoreinheitsprotokoll in mikrofluidischen Bauelementen. Differenzierungszeitleiste und Kokulturübersicht von Tag 0 bis Tag 28 gemäß der Zeitleiste des Motoneuron-Differenzierungsprotokolls22. Die Differenzierung von Motoneuronen aus iPS-Zellen wird am Tag 0 eingeleitet und wie bereits erwähnt für die folgenden 10 Tage durchgeführt15. Am Tag 9 wird das Gerät sterilisiert und mit PLO-Laminin beschichtet. MABs werden für den Ausbau in T75-Kolben aufgetaut. Am Tag 10 werden die Motoneuron-NPCs in beiden Vertiefungen und im Kanal eines Fachs (hellgrau) des Geräts plattiert, wo ihre Differenzierung in Motoneuronen für eine Woche fortgesetzt wird. MABs werden am 17. Tag in beiden Vertiefungen und im Kanal des gegenüberliegenden Fachs (dunkelgrau) plattiert. Am Tag 18 beginnt die Differenzierung von MABs in Myotuben. Am Tag 21 wird ein volumetrischer und chemotaktischer Gradient festgestellt, um die Motoneuron-Neuriten-Polarisation durch die Mikrobohrungen des Geräts zu fördern. Das Motoneuron-Kompartiment erhielt 100 μL/Well des Motoneuron-Basalmediums ohne Wachstumsfaktoren (hellgrünes Kompartiment), während das Myotube-Kompartiment 200 μL/Well des Motoneuron-Basalmediums mit 30 ng/ml Wachstumsfaktoren (dunkelgrünes Kompartiment) erhielt (Tabelle 2 und Tabelle 3). Die Kultur wird mit dem volumetrischen und chemotaktischen Gradienten für weitere 7 Tage bis zur Analyse am Tag 28 fortgesetzt. Hellfeldbilder zeigen die Zellmorphologie an Tag 0, Tag 11, Tag 18 und Tag 28, kultiviert in vormontierten mikrofluidischen Geräten. Maßstabsleiste, 100 μm. Diese Zahl wurde von Stoklund Dittlau, K. et al.18 modifiziert. Die Zellillustrationen wurden von Smart Server medical Art22 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
8. Fixierung und ICC
HINWEIS: Alle Schritte sollten sorgfältig durchgeführt werden, um eine Ablösung der neuronalen Kulturen zu verhindern. Entfernen Sie während der folgenden Schritte keine Flüssigkeit aus den Kanälen.
- Fixierung in einem Abzug oder laminaren Durchfluss durchführen: Waschen Sie alle Vertiefungen im Gerät vor der Fixierung vorsichtig einmal mit DPBS. Mit 4 % Paraformaldehyd (PFA) in DPBS für 15-20 min bei RT in der Laminarströmung (100 μL/Well) fixieren.
ACHTUNG: PFA ist giftig: Griff in einem Abzug mit persönlicher Schutzausrüstung.- Geben Sie vorsichtig 100 μL in die obere Vertiefung des Geräts und warten Sie einige Sekunden, bis die Fixierlösung durch den Kanal fließen kann, bevor Sie 100 μL in die untere Vertiefung geben. Wiederholen auf der anderen Seite. Nach der Inkubation die PFA-Lösung entfernen und 3x 5 min vorsichtig mit DPBS waschen. Lassen Sie 200 μL/Well DPBS zur Lagerung einwirken und verschließen Sie die 10 cm Petrischale mit Parafilm, um sie bis zum ICC-Experiment bei 4 °C zu lagern.
HINWEIS: Stellen Sie sicher, dass die Geräte während der Lagerung nicht austrocknen.
- Geben Sie vorsichtig 100 μL in die obere Vertiefung des Geräts und warten Sie einige Sekunden, bis die Fixierlösung durch den Kanal fließen kann, bevor Sie 100 μL in die untere Vertiefung geben. Wiederholen auf der anderen Seite. Nach der Inkubation die PFA-Lösung entfernen und 3x 5 min vorsichtig mit DPBS waschen. Lassen Sie 200 μL/Well DPBS zur Lagerung einwirken und verschließen Sie die 10 cm Petrischale mit Parafilm, um sie bis zum ICC-Experiment bei 4 °C zu lagern.
- Inkubieren Sie die Zellen mit einer Permeabilisierungslösung (100 μL/Well) von 0,1% Triton X-100 in DPBS für 20 min bei RT am Tag 1 des ICC-Verfahrens. Entfernen Sie die Permeabilisierungslösung und geben Sie 5% normales Eselserum in 0,1% Triton X-100/DPBS-Lösung (100 μL/Well) für 30 min bei RT.
- Entfernen Sie die 5% ige normale Eselserumlösung und inkubieren Sie Geräte mit primären Antikörpern (Tabelle der Materialien) in 2% normalem Eselserum in 0,1% Triton X-100 / DPBS-Lösung und inkubieren Sie bei 4 ° C über Nacht.
- Implementieren Sie einen Volumenverlauf. Fügen Sie 100 μL/Well Antikörperlösung auf der einen Seite der Mikrobohrungen und 150 μL/Well auf der anderen Seite hinzu (500 μL insgesamt pro Gerät).
HINWEIS: Es ist möglich, verschiedene Antikörper auf beiden Seiten der Mikrobohrungen zu verwenden. Implementieren Sie in diesem Fall keinen Volumengradienten mit primären oder sekundären Antikörpern über Mikrobohrungen, um die fluidische Isolierung zwischen den Kompartimenten aufrechtzuerhalten. Die Neurite in den Mikrorillen werden ohne den Farbverlauf nicht gebeizt.
- Implementieren Sie einen Volumenverlauf. Fügen Sie 100 μL/Well Antikörperlösung auf der einen Seite der Mikrobohrungen und 150 μL/Well auf der anderen Seite hinzu (500 μL insgesamt pro Gerät).
- Am folgenden Tag (Tag 2 des ICC-Verfahrens) entfernen Sie die primären Antikörper und waschen das Gerät vorsichtig 3x für 5 min mit 0,1% Triton X-100/DPBS-Lösung.
HINWEIS: In leicht abnehmbaren Kulturen kann das Waschen 3x für 5 min durch 1x für 30 min ersetzt werden. - Arbeiten Sie von nun an im Dunkeln, da sekundäre Antikörper (Table of Materials) lichtempfindlich sind. Inkubieren von Zellen mit sekundären Antikörpern in 2% normalem Eselserum in 0,1% Triton X-100/DPBS-Lösung für 1 h bei RT. Implementieren Sie einen Volumengradienten wie in Schritt 8.3.1 angegeben. Nach der Inkubation die sekundären Antikörper entfernen und 3x für 5 min mit DPBS waschen.
- Markierung der Kern-DNA mit DAPI in DPBS (100 μL/Well) für 20 min bei RT, gefolgt von 3x-4x von 5 min Wäsche mit 0,1% Triton X-100/DPBS Lösung. Entfernen Sie die 0,1% ige Triton X-100/DPBS-Lösung aus allen Vertiefungen und lassen Sie die Kultur einige Sekunden trocknen, bevor Sie in jeder Vertiefung einen Tropfen fluoreszierendes Montagemedium zum Versiegeln hinzufügen.
HINWEIS: Halten Sie die Geräte mindestens 24 Stunden lang horizontal, damit das Montagemedium eingestellt werden kann. Nach 24 h können die Geräte in einem Diakoffer bei 4 °C gelagert werden. - Bild in Z-Stacks mit einem inversen Mikroskop.
- Um NMJs abzubilden, verwenden Sie ein 40-faches Objektiv, um die mit einem Myotube-Antikörper markierten Myotuben (Table of Materials) zu lokalisieren, und führen Sie Z-Stack-Aufnahmen durch, um eine neuronale und Myotube-Gewebebildgebung sicherzustellen. Nehmen Sie mehrere Bilder auf, falls die Myotube zu groß ist, um in einen einzigen Rahmen zu passen.
- Zählen Sie für die NMJ-Quantifizierung manuell die Anzahl der Kolokalisationen zwischen einem neuronalen präsynaptischen Marker und einem AChR-Marker durch jeden Z-Stack. Normalisieren Sie die Anzahl der Kolokalisierungen auf die Anzahl der im Z-Stapel vorhandenen Myotubes.
9. Fixierung und Vorbereitung des Produkts für REM
HINWEIS: Bewahren Sie beim Wechseln von Flüssigkeiten immer eine kleine Menge auf, um die Kultur abzudecken, um einen Zellkollaps zu vermeiden. Dieses Protokoll verwendet hochgiftige Substanzen, und es ist erforderlich, während des gesamten Prozesses mit persönlicher Schutzausrüstung und in einem Abzug zu arbeiten.
- Fixierung und Demontage: Frisch 2,5% Glutaraldehyd (GA) in 0,1 M Natriumcacodylatpuffer (pH 7,6) zubereiten, mit einem 0,2 μm Filter filtern und auf 37 °C erhitzen.
VORSICHT: GA und Natriumcacodylat sind giftig: Griff in einem Abzug mit persönlicher Schutzausrüstung.- Waschen Sie das Gerät einmal vorsichtig mit DPBS, um die Medien und Zellablagerungen zu entfernen, und stellen Sie dann bei RT 15 Minuten lang GA-Lösung vor.
- Verwenden Sie ein Skalpell, um das REM-Blatt vorsichtig an den Umfang des Geräts zu schneiden, während Sie das Gerät mit einer Pinzette fixieren. Achten Sie darauf, das Gerät beim Schneiden nicht zu lösen. Bewegen Sie das Gerät und das REM-Blatt mit Hilfe einer Pinzette in eine 3 cm Petrischale und legen Sie die 3 cm große Schale zur einfachen Handhabung in eine 10 cm große Schale.
- Entfernen Sie das Gerät nach 15 Minuten Präfix vorsichtig mit einer Pinzette aus dem REM-Blatt. Trennen Sie das Gerät in einer Ecke und entfernen Sie es langsam in diagonaler Richtung in Richtung der gegenüberliegenden Ecke. Beobachten Sie, wie sich die Zellen vom Gerät lösen.
- Fügen Sie zusätzliche GA-Lösung hinzu, um das gesamte REM-Blatt in der 3 cm großen Schale abzudecken, und setzen Sie die Fixierung für insgesamt 2 h bei RT oder über Nacht bei 4 ° C fort.
HINWEIS: Drücken Sie das REM-Blatt vorsichtig mit einer Pinzette unter die GA-Lösung, indem Sie zellbedeckte Oberflächen vermeiden.
- Fahren Sie mit einem Standardprotokoll für SEM fort. Kurz gesagt, inkubieren Sie in Osmiumtetroxid, gefolgt von einer Dehydratisierung mit einer abgestuften Reihe von Ethanol. Legen Sie eine REM-Folie zur kritischen Punkttrocknung in einen Deckglashalter ein und montieren Sie sie an Stützstutzen für Carbon-Aufkleber und Beschichtung. Verwenden Sie ein Rasterelektronenmikroskop, um mit einer Beschleunigungsspannung von 5 kV und einem Arbeitsabstand von 7 mm zu fotografieren.
10. Bewertung der NMJ-Funktionalität mittels Lebendzell-Calcium-Bildgebung
- Geräte vorbereiten: Myotube-Kompartiment mit 200 μL/Well des Tages 18 Motoneuron-Basalmedium mit 30 ng/ml BDNF, GDNF und CNTF und das Motoneuron-Kompartiment mit 200 μL/Well des Motoneuron-Basalmediums ohne Wachstumsfaktoren auffrischen (Tabelle 2 und Tabelle 3).
- Fluo-4 AM-Farbstoff, verdünnt in Fluo-4-Farbstofflösungsmittel, in einer Endkonzentration von 5 μM in das Myotube-Kompartiment geben und das Gerät im Dunkeln bei 37 °C, 5% CO2 für 25 min inkubieren. Verdünnen Sie Kaliumchlorid im Motoneuron-Basalmedium ohne Wachstumsfaktoren in einer Endkonzentration von 450 mM, während das Gerät inkubiert wird.
HINWEIS: Fluo-4 AM ist ein Calciumindikator, der bei Calciumbindung eine Erhöhung der Fluoreszenz aufweist. Arbeiten Sie von nun an im Dunkeln, da der Farbstoff lichtempfindlich ist. - Nach 25 Minuten erfrischen Sie das Myotube-Kompartiment mit 200 μL / Well des Tages 18 Motoneuron-Basalmedium mit 30 ng / ml BDNF, GDNF und CNTF und das Motoneuronkompartiment mit 100 μL / Well des Motoneuron-Basalmediums ohne Wachstumsfaktoren, um den chemotaktischen und volumetrischen Gradienten wiederherzustellen.
- Um die NMJs zu blockieren, ergänzen Sie das Myotube-Kompartimentmedium mit 19 μM des AChR-kompetitiven Antagonisten Tubocurarinhydrochlorid-Pentahydrat.
VORSICHT: Tubocurarinhydrochlorid-Pentahydrat ist giftig: Griff in einem Abzug mit persönlicher Schutzausrüstung.
- Fluo-4 AM-Farbstoff, verdünnt in Fluo-4-Farbstofflösungsmittel, in einer Endkonzentration von 5 μM in das Myotube-Kompartiment geben und das Gerät im Dunkeln bei 37 °C, 5% CO2 für 25 min inkubieren. Verdünnen Sie Kaliumchlorid im Motoneuron-Basalmedium ohne Wachstumsfaktoren in einer Endkonzentration von 450 mM, während das Gerät inkubiert wird.
- Führen Sie Aufnahmen mit einem inversen konfokalen Mikroskop durch, das mit einem inkubator ausgestattet ist, der auf 37 °C, 5% CO2 eingestellt ist.
- Verwenden Sie mit einem 10-fachen Objektiv den Hellfeldkanal, um die Myotubes im Myotube-Fach zu lokalisieren. Stellen Sie die Laserleistung, die Verstärkung und den Offset für den 488-Kanal auf ein Niveau ein, auf dem die Fluo-4-Fluoreszenz die einzelnen Myotuben markiert.
HINWEIS: Repräsentative Ergebnisse wurden erzielt, indem die Bildlaufleisten in den A1-Einstellungen der Software auf eine Laserleistung von 5%, eine Verstärkung von 60 (HV) und einen Offset von 0 eingestellt wurden.
- Verwenden Sie mit einem 10-fachen Objektiv den Hellfeldkanal, um die Myotubes im Myotube-Fach zu lokalisieren. Stellen Sie die Laserleistung, die Verstärkung und den Offset für den 488-Kanal auf ein Niveau ein, auf dem die Fluo-4-Fluoreszenz die einzelnen Myotuben markiert.
- Stellen Sie die Aufnahmezeit auf 1 min mit 1 s Intervallen ein. Rekord für 5-10 s, um eine Baseline zu haben, gefolgt von sofortiger Stimulation von Motoneuronen mit der Kaliumchloridlösung.
- Nach 5-10 s in der Aufzeichnung langsam 25 μL Kaliumchloridlösung in eine Vertiefung des Motoneuronkompartiments geben, um eine Endkonzentration von 50 mM zu erreichen.
HINWEIS: Vermeiden Sie es, die Kaliumchloridlösung zu schnell hinzuzufügen, da dies eine Welle durch den Kanal erzeugt, die Artefakte auf der Aufnahme verursacht.
- Nach 5-10 s in der Aufzeichnung langsam 25 μL Kaliumchloridlösung in eine Vertiefung des Motoneuronkompartiments geben, um eine Endkonzentration von 50 mM zu erreichen.
- Zeichnen Sie das Myotube-Kompartiment mit Motoneuronstimulation zweimal mit einer 2-minütigen Pause auf, gefolgt von einer direkten Stimulation mit 25 μL Kaliumchloridlösung des Myotube-Kompartiments, um die direkte Myotube-Aktivität unabhängig von der Motoneuron-Depolarisation zu beurteilen.
- Kreisen Sie für Quantifizierungen jedes Myotube manuell mit der Aufnahmesoftware ein und analysieren Sie die Fluo-4-Fluoreszenzintensität über den Zeitraum von 1 Minute. Um den Anstieg des Kalziumeintrags zu bestimmen, subtrahieren Sie den durchschnittlichen Ausgangswert (d. h. den Durchschnitt der ersten 10 s vor der Kaliumchloridstimulation) vom Spitzenwert nach der Stimulation mit Kaliumchlorid. Die repräsentativen Ergebnisse wurden mit dem Zeitmesstool der Software erfasst.
Ergebnisse
Generierung von NMJs in mikrofluidischen Bauelementen
Um eine menschliche motorische Einheit mit funktionellen NMJs in kommerziell erhältlichen mikrofluidischen Geräten zu erzeugen, wurden menschliche iPSC-abgeleitete Motoneuronen und menschliche MAB-abgeleitete Myotuben verwendet. Die Qualität des Ausgangszellmaterials ist wichtig, und insbesondere die Fusionsfähigkeit der MABs zu Myotuben ist entscheidend für ein erfolgreiches Ergebnis dieses Protokolls. MABs sind leicht in der Kultur zu halten. Es ist jedoch wichtig, die Fusionsfähigkeit jeder Charge zu bewerten, bevor sie auf die mikrofluidischen Vorrichtungen angewendet wird (ergänzende Abbildung 1A,B)18. Chargen, die nach 10 Tagen Differenzierung keine Myotubebildung zeigen, sollten nicht verwendet werden. Der Fusionsindex in Supplemental Figure 1B wurde durch Berechnung des Prozentsatzes der Kerne innerhalb von Myotuben bestimmt, die für jeden Myotube-Marker der Gesamtzahl der Kerne pro Bild positiv sind. Wir fanden heraus, dass ein Fusionsindex von etwa 8% für unsere Co-Kultur bei der Generierung von NMJs ausreichte.
Es ist immer wichtig, eine Motoneurondifferenzierung aus einer reinen Kultur von iPS-Zellen zu beginnen. Je reiner der Input - desto reiner das Ergebnis. Das Motoneuron-Differenzierungsprotokoll erzeugt Motoneuronkulturen, die typischerweise zu 85%-95% positiv auf Motoneuronmarker sind (ergänzende Abbildung 1C,D)18. Bei den verbleibenden Zellen handelt es sich in der Regel um undifferenzierte Vorläuferzellen, die sich in einigen Fällen stark vermehren und sich dadurch negativ auf die Qualität der Kultur auswirken. Um das beste Ergebnis dieses Protokolls zu erzielen, sollte die Effizienz der Motoneurondifferenzierung bewertet werden, bevor die Motoneuron-NPCs des Tages 10 in das Gerät aufgetragen werden. Zusätzlich kann am Tag 11 eine NPC-Qualitätsprüfung durchgeführt werden, um die Expression des NPC-Markers Olig2 zu bewerten (ergänzende Abbildung 1E,F).
Zunächst wurden die Motoneuron-NPCs und die MABs am 10. Tag gleichzeitig plattiert. Hier wurde am 11. Tag die MAB-Differenzierung eingeleitet. Der am Tag 14 implementierte Volumen- und Wachstumsfaktorgradient ermöglichte es uns, die NMJ-Formation am Tag 21 zu bewerten und dadurch das Protokoll um eine Woche zu verkürzen. Interessanterweise konnten wir die charakteristische NMJ-Bildung durch ICC beobachten (Ergänzende Abbildung 2A). Wir waren jedoch nicht in der Lage, einen funktionellen Output über die Live-Cell-Calcium-Aufzeichnungen so früh in der Motoneurondifferenzierung zu erhalten (Daten nicht gezeigt). Wir kamen zu dem Schluss, dass die Motoneuronen noch nicht reif genug waren, um funktionelle NMJ-Verbindungen mit den Myotuben einzugehen, obwohl die NMJ-Morphologie vielversprechend aussah. Dies steht im Einklang mit unseren früheren Beobachtungen, dass spontane Aktionspotentiale in Motoneuronen, die durch eine elektrophysiologische Patch-Clamp-Analyse aufgezeichnet wurden, erst am Tag 35 der Motoneurondifferenzierung auftreten15.
Darüber hinaus haben wir versucht, die Reifung der Motoneuronen sowie die Nachhaltigkeit der Kokultur zu verlängern, indem wir die Motoneuronen im Gerät für 2 Wochen (Tag 24) reifen ließen, bevor die MABs plattiert wurden. Leider wurde eine große Menge an spontaner Motoneuron-Neurit-Kreuzung durch Mikrorillen beobachtet, was zur Hemmung der MAB-Bindung führte (ergänzende Abbildung 2B). Aufgrund der fehlenden Myotube-Bildung im Kanal konnten wir nmJs am 36. Tag nicht identifizieren und wandten daher das 28-Tage-Protokoll an (Abbildung 1).
Identifizierung, Quantifizierung und morphologische Charakterisierung von in vitro NMJs
Nach Befolgung des 28-Tage-Protokolls (Abbildung 1) konnten voll funktionsfähige NMJs erhalten werden. Sowohl in vivo als auch in vitro werden NMJs immunhisto- oder immunzytochemisch durch die Colokalisation eines präsynaptischen Markers und eines postsynaptischen Markers charakterisiert. In dieser Studie wurde eine Kombination aus Neurofilament Heavy Chain (NEFH) und SYP als präsynaptische Markerkombination verwendet, die es ermöglichte, einem einzelnen Neuriten vom Soma des Motoneurons in Richtung des distalsten Prozesses zu folgen. Auf der Muskelseite wird Btx häufig als postsynaptischer Marker für AChRs verwendet und wurde ebenfalls in dieser Studie verwendet. Die Supplementierung von Agrin und Laminin fördert die Clusterbildung der AChRs am Sarkolemma19,20,21, was die Identifizierung von AChRs in vitro erleichtert und ebenfalls die Anzahl der vorhandenen AChRs und NMJs erhöht18.
Um die NMJs unvoreingenommen zu lokalisieren und zu berechnen, wird jede Myotube durch Myosin Heavy Chain (MyHC)-Positivität identifiziert und in z-Stacks bei 40-facher Vergrößerung mit einem invertierten konfokalen Mikroskop abgebildet. Für sehr lange Myotuben wurden mehrere Z-Stacks erworben. Für die Bildanalyse wird die Anzahl der Kolokalisierungen zwischen NEFH/SYP und Btx manuell durch jeden Z-Stack gezählt, und die Anzahl der Co-Lokalisierungen wird auf die Anzahl der im Z-Stack vorhandenen Myotubes normalisiert (Abbildung 2A-C)18. Nicht alle Myotuben haben NMJs, wie in der Quantifizierung von innervierten Myotuben zu sehen ist (Abbildung 2D). Folglich ist es wichtig, einen unvoreingenommenen Aufnahmeansatz durchzuführen, bei dem alle Myotuben unabhängig von der Btx-Präsenz abgebildet werden.
Es ist möglich, zwei Arten von Morphologien in diesem In-vitro-System zu identifizieren. Die NMJs erscheinen entweder als Einzelkontaktpunkt-NMJs, bei denen ein Neurit einen Cluster von AChRs an einem Interaktionspunkt berührt, oder als NMJs mit mehreren Kontaktpunkten, bei denen sich ein Neurit auffächert und über eine größere Oberfläche mit dem AChR-Cluster interagiert. Diese beiden Morphologien können sowohl immunzytochemisch (Abbildung 2A)18 als auch mit REM (Abbildung 2B)18 identifiziert und ebenfalls quantifiziert werden (Abbildung 2C)18. Insgesamt ermöglichen die multiplen Kontaktpunkte eine breitere Verbindung durch eine große Muskeleinbettung, was auf eine reifere NMJ-Formation hinweist. Im Gegensatz dazu gelten die Single Contact Point NMJs aufgrund des frühen Entwicklungsstandes der Kultur als weniger ausgereift.
Funktionelle Bewertung von in vitro NMJs
Um die Funktionalität der NMJs zu bewerten, wurden livezellige Kalzium-Transientenaufzeichnungen verwendet (Abbildung 3)18. Unter Ausnutzung des fluidisch isolierten Systems der mikrofluidischen Geräte wurde die Motoneuron-Soma-Seite mit einer hohen Konzentration (50 mM) Kaliumchlorid stimuliert und gleichzeitig ein Zustrom von Kalzium in die Myotuben aufgezeichnet, die mit dem calciumsensitiven Fluo-4-Farbstoff beladen waren (Abbildung 3A). Fast unmittelbar nach der Aktivierung des Motoneurons konnten wir einen Kalziumeintrag in die Myotuben durch eine charakteristische Wellenbildung beobachten, die eine funktionelle Verbindung durch den Motoneuron-Neuriten und die Myotube bestätigt (Abbildung 3A-C)18. Es wurden weder spontane Kalziumwellen noch spontane Myotubekontraktionen beobachtet, obwohl eine Myotubekontraktion bei direkter Stimulation mit Kaliumchlorid beobachtet wurde. Die Spezifität der Verbindung wurde weiter bestätigt, indem der kompetitive AChR-Antagonist, Tubocurarinhydrochlorid-Pentahydrat (DTC) zum Myotube-Kompartiment hinzugefügt wurde (Abbildung 3A), was zu einer Hemmung des Kalziumeintrags führte (Abbildung 3C). Dieser Effekt bestätigte, dass die Verbindung zwischen Motoneuronen und Myotuben zu voll funktionsfähigen NMJs führte. Um die Anzahl der aktiven Myotuben durch NMJ-Stimulation zu bewerten, wurde das Myotube-Kompartiment direkt mit Kaliumchlorid stimuliert, um die Gesamtzahl der aktiven Myotuben in diesem Kompartiment zu identifizieren. Etwa 70% der Myotuben waren durch motoneuronstimulierte Aktivierung mit Kaliumchlorid aktiv (Abbildung 3D)18.
Diese Ergebnisse bestätigen die optimale NMJ-Bildung, -Anzahl, -Morphologie und -Funktionalität durch Co-Kultivierung der iPSC-abgeleiteten Motoneuronen und MAB-abgeleiteten Myotuben während eines 28-tägigen Protokolls.
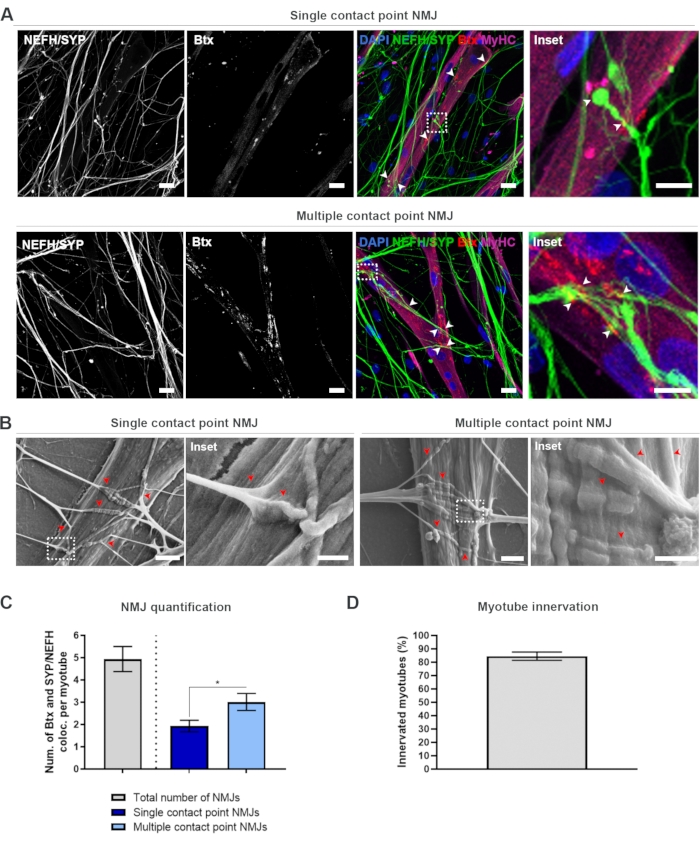
Abbildung 2: NMJ-Bildung in mikrofluidischen Bauelementen. (A) Konfokale Mikroaufnahmen der NMJ-Bildung in vormontierten mikrofluidischen Bauelementen am Tag 28. NMJs werden durch die Co-Lokalisation (Pfeilspitzen) von präsynaptischen Markern (NEFH und SYP) und postsynaptischen AChR-Markern (Btx) auf MyHC-gefärbten Myotuben identifiziert. NMJs werden morphologisch durch einzel- oder mehrfache Kontaktpunktbildung zwischen Neuriten und AChR-Clustern identifiziert. DAPI-Markierungskerne. Maßstabsleiste, 25 μm. Inset zeigt eine Vergrößerung eines NMJ. Eingelassener Maßstabsbalken, 10 μm. (B) REM der NMJ-Morphologie in mikrofluidischen Silikongeräten am Tag 28. Pfeilspitzen zeigen die Einbettung von Neuriten in die Myotube. Maßstabsleiste, 2 μm. Inset zeigt eine Vergrößerung von NMJ. Inset Scale Bar, 1 μm. (C) Quantifizierung der Gesamtzahl der NMJs pro Myotube sowie der Anzahl der Single- und Multiple-Contact-Point-NMJs pro Myotube. Die Grafik wird als Mittelwert ± Standardfehler des Mittelwerts von vier biologischen Replikaten dargestellt. Die statistische Signifikanz wird mit dem Mann-Whitney-Test mit * p < 0,05 bestimmt. (D) Quantifizierung des Prozentsatzes der innervierten Myotuben. Die Grafik wird als Mittelwert ± Standardfehler des Mittelwerts von vier biologischen Replikaten dargestellt. Diese Zahl wurde von Stoklund Dittlau, K. et al.18 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
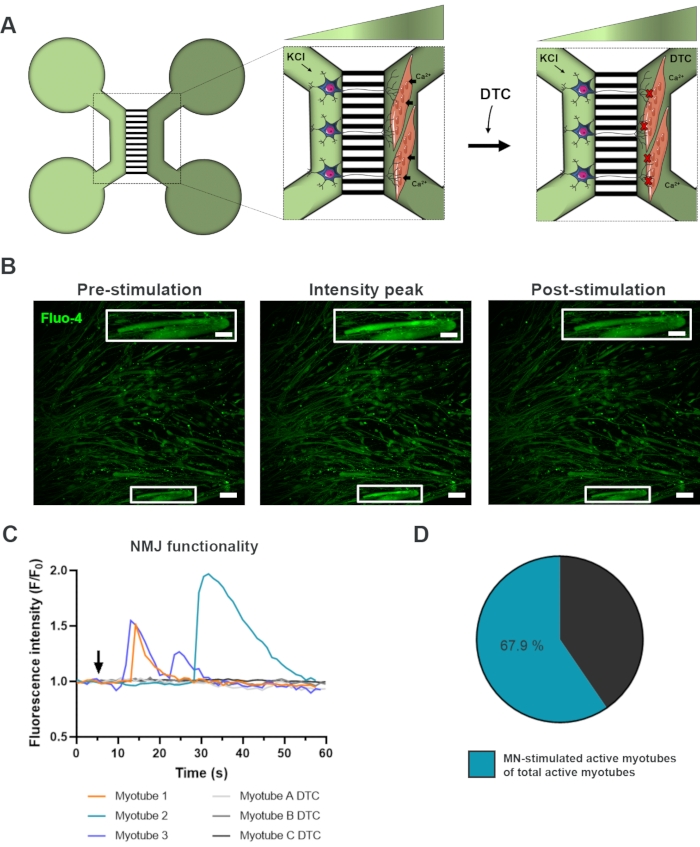
Abbildung 3: Bestätigung der NMJ-Funktionalität. (A) Schematische Darstellung von transienten Calciumaufzeichnungen von Lebendzellen der NMJ-Funktionalität in vormontierten mikrofluidischen Geräten am Tag 28 vor und nach der NMJ-Blockade mit Tubocurarin (DTC)22. Motoneuronen im hellgrünen Kompartiment werden mit 50 mM Kaliumchlorid (KCl) stimuliert, das durch die Neuriten eine intrazelluläre Motoneuronantwort hervorruft. Dies ruft einen Zustrom von Kalzium (Ca2+) in Myotuben hervor, die mit calciumempfindlichem Fluo-4-Farbstoff (dunkelgrünes Kompartiment) gekennzeichnet sind. (B) Fluo-4-Fluoreszenzmikroskopieaufnahmen von Prästimulation, Intensitätspeak und Poststimulation einer Myotube, die eine Welle des intrazellulären Calciumanstiegs bei Motoneuronstimulation mit KCl darstellen. Inset zeigt eine Vergrößerung eines innervierten aktiven Myotube. Maßstabsleisten, 100 μm. Eingebauter Maßstabsbalken, 200 μm. (C) Repräsentative Kalzium-Einströmkurven in Myotuben nach Motoneuronstimulation mit KCl (Pfeil), die die NMJ-Funktionalität bestätigen. Myotube 1-3 zeigen charakteristische Kalziumkurven durch Motoneuron-Myotube-Innervation, während Myotube A-C DTC Kurven nach NMJ-Blockierung mit DTC darstellt. (D) Verhältnis der von Motoneuronen stimulierten aktiven Myotuben zur Gesamtzahl der aktiven Myotuben. Diese Zahl wurde von Stoklund Dittlau, K. et al.18 modifiziert. Die Zellillustrationen wurden von Smart Server medical Art22 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Motoneuronverifikation, MAB-Fusionsindex und NPC-Qualitätskontrolle. (A) Konfokale Bilder von MAB-abgeleiteten Myotuben 10 Tage nach Beginn der Differenzierung. Myotubes sind mit Myotube-Markern gekennzeichnet: Desmin, MyHC, Myogenin (MyoG) und Titin. Kerne werden mit DAPI angefärbt. Maßstabsbalken, 100 μm. (B) Quantifizierung des MAB-Fusionsindex 10 Tage nach Beginn der Differenzierung. Nach dem Verhungern verschmelzen MABs zu mehrkernigen Myotuben, die für die Myotube-Marker-Positivität (AB +) quantifiziert wurden. Die Grafik zeigt den Mittelwert ± Standardfehler des Mittelwerts von drei biologischen Replikaten. (C) Konfokale Bilder von iPSC-abgeleiteten Motoneuronen am Tag 28 der Differenzierung, die zusätzlich zum panronalen Marker βIII-Tubulin (Tubulin) mit den Motoneuronmarkern NEFH, Cholinacetyltransferase (ChAT) und Islet-1 markiert sind. Kerne werden mit DAPI angefärbt. Skalenbalken, 75 μm. (D) Quantifizierung der Anzahl der Zellen, die positiv auf motoneuronische und pannonale Marker (AB+) sind. Die Grafik zeigt den Mittelwert ± Standardfehler des Mittelwerts von drei biologischen Replikaten. (E) Konfokale Bilder von iPSC-abgeleiteten NPCs an Tag 11 der Motoneurondifferenzierung, die mit dem NPC-Marker Olig2 und dem panronalen Marker βIII-Tubulin (Tubulin) markiert sind. Kerne werden mit DAPI angefärbt. Maßstabsbalken, 50 μm. (F) Quantifizierung der Anzahl der NPCs, die positiv für Olig2 und βIII-Tubulin (AB+) sind. Die Grafik zeigt den Mittelwert ± Standardfehler des Mittelwerts von drei biologischen Replikaten. Diese Zahl wurde von Stoklund Dittlau, K. et al.18 modifiziert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Optimierung des Kokulturprotokolls (A) Konfokale Bilder der NMJ-Bildung an Tag 21 der Motoneurondifferenzierung, wenn MABs zum gleichen Zeitpunkt wie NPCs an Tag 10 ausgesät werden. NMJs werden durch die Co-Lokalisation (Pfeilspitzen) von präsynaptischen Markern (NEFH und SYP) und postsynaptischen AChR-Markern (Btx) auf MyHC-gefärbten Myotuben identifiziert. Maßstabsleiste (links), 10 μm. Maßstabsbalken (rechts), 5 μm. (B) Hellfeldbild des Myotube-Kanals an Tag 24, das die spontane Kreuzung von Motoneuronen-Neuriten zeigt, die die Bindung von MABs hemmt. Maßstabsleiste, 100 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| Reagenz | Bestandskonzentration | Endkonzentration |
| IMDM | 1x | 80% |
| Fötales Rinderserum | 15% | |
| Penicillin/Streptomycin | 5000 U/ml | 0.5% |
| L-Glutamin | 50-fach | 1% |
| Natriumpyruvat | 100 mM | 1% |
| Nicht-essentielle Aminosäuren | 100-fach | 1% |
| Insulintransferrin Selen | 100-fach | 1% |
| bFGF (frisch hinzugefügt) | 50 μg/ml | 5 ng/ml |
Tabelle 1: MAB-Wachstumsmedium. Medium kann 2 Wochen bei 4 °C halten. bFGF wird am Tag der Anwendung frisch zugegeben.
| Reagenz | Bestandskonzentration | Endkonzentration |
| DMEM/F12 | 50% | |
| Neurobasales Medium | 50% | |
| Penicillin/Streptomycin | 5000 U/ml | 1% |
| L-Glutamin | 50-fach | 0.5 % |
| N-2 Ergänzung | 100-fach | 1% |
| B-27 ohne Vitamin A | 50-fach | 2% |
| β-Mercaptoethanol | 50 mM | 0.1% |
| Ascorbinsäure | 200 μM | 0,5 μM |
Tabelle 2: Motoneuron Basalmedium. Medium kann 4 Wochen bei 4 °C halten.
| Tag | Reagenz | Bestandskonzentration | Endkonzentration | Abteil |
| Tag 10/11 | Geglätteter Agonist | 10 mM | 500 nM | Beide |
| Retinsäure | 1 mM | 0,1 μM | ||
| DAPT | 100 mM | 10 μM | ||
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| Tag 14 | DAPT | 100 mM | 20 μM | Beide |
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| Tag 16 | DAPT | 100 mM | 20 μM | Beide |
| BDNF | 0,1 mg/ml | 10 ng/ml | ||
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| CNTF | 0,1 mg/ml | 10 ng/ml | ||
| Tag 18 | BDNF | 0,1 mg/ml | 10 ng/ml | Motorisches Neuron |
| GDNF | 0,1 mg/ml | 10 ng/ml | ||
| CNTF | 0,1 mg/ml | 10 ng/ml | ||
| Tag 21+ | BDNF | 0,1 mg/ml | 30 ng/ml | Myotube |
| GDNF | 0,1 mg/ml | 30 ng/ml | ||
| CNTF | 0,1 mg/ml | 30 ng/ml | ||
| Agrin | 50 μg/ml | 0,01 μg/ml | ||
| Laminin | 1 mg/ml | 20 μg/ml | ||
| Tag 21+ | Keine Zuschläge | Motorisches Neuron |
Tabelle 3: Motoneuron-Medium-Ergänzungen. Nahrungsergänzungsmittel werden am Tag der Anwendung frisch in das Basalmedium des Motoneurons gegeben.
| Tag | Reagenz | Bestandskonzentration | Endkonzentration | Abteil |
| Tag 18 | DMEM/F12 | 97% | MAB | |
| Natriumpyruvat | 100 mM | 1% | ||
| Pferdeserum | 2% | |||
| Agrin | 50 μg/ml | 0,01 μg/ml |
Tabelle 4: MAB-Differenzierungsmedium. Medium kann 2 Wochen bei 4 °C halten. Agrin wird am Tag der Anwendung frisch hinzugefügt.
Diskussion
Das Protokoll beschreibt eine relativ einfach zu bedienende Methode, die in weniger als 30 Tagen menschliche motorische Einheiten mit funktionellen NMJs in kommerziell erhältlichen mikrofluidischen Geräten erzeugt. Es wird beschrieben, wie die NMJs morphologisch durch Standardtechniken wie ICC und REM und funktionell durch Live-Cell-Calcium-Aufnahmen bewertet werden können.
Ein großer Vorteil dieses Protokolls ist die Verwendung der Stammzelltechnologie. Dies ermöglicht eine vollständige Anpassungsfähigkeit, bei der NMJs unabhängig vom Spenderprofil sowohl gesundheitlich als auch krank bewertet werden können. Das Modell hat sich bereits in der ALS-Forschung als erfolgreich und vorteilhaft erwiesen, wo wir Beeinträchtigungen des Neuritenwachstums, des Nachwachsens und der NMJ-Zahlen als neuartige Phänotypen aufgrund von Mutationen im FUS-Gen identifiziert haben18. Mit diesem Modell ist es möglich, die Forschung auf sporadische Formen von ALS auszuweiten, bei denen die Ätiologie unbekannt ist, indem iPS-Zellen von sporadischen ALS-Patienten verwendet werden. Dies bietet einen Vorteil gegenüber herkömmlichen Tiermodellen, die auf einer transgenen Überexpression mutierter Gene beruhen, um menschliche Krankheiten zu rekapitulieren23,24. Darüber hinaus ermöglicht unser vollständig menschliches System eine mögliche Rekapitulation der humanspezifischen Physiologie und Krankheit. Frühere Studien zeigten die Unterschiede zwischen der NAGEtier- und der menschlichen NMJ-Morphologie25, was darauf hindeutet, dass bei der Verwendung von Nagetieren zur Behandlung der menschlichen NMJ-Pathologie Vorsicht geboten ist. Obwohl es sich bei diesem System um einen relativ einfachen In-vitro-Aufbau handelt, dem die Komplexität eines In-vivo-Modells fehlt, konnte gezeigt werden, dass die in den mikrofluidischen Geräten gezeigte NMJ-Morphologie NMJs von menschlichen Amputaten ähnelt25. Darüber hinaus ermöglicht dieses Modell eine NMJ-Bewertung während der NMJ-Bildung und -Reifung und deckt möglicherweise frühe Krankheitsphänotypen auf, die in menschlichen Post-Mortem-Proben fehlen, nicht identifizierbar oder übersehen werden.
MABs bieten eine gültige Option zur Erzeugung von Myotuben, obwohl ihr begrenztes Überleben von 10 Tagen ein Nachteil des Systems ist. Das Myotube-Überleben hängt von ihrer Anhaftung an der Oberfläche ab, die wahrscheinlich durch spontane Kontraktionen der Myofiber beeinträchtigt wird. Nach mehr als 10 Tagen haben sich die meisten Myotubes gelöst, was die NMJ-Kultur unbrauchbar macht. Idealerweise würden die Myotuben auch aus iPS-Zellen erzeugt. Aktuelle Protokolle haben sich jedoch aufgrund der Variabilität des Fusionsindex als schwierig erwiesen2627,28,29,30.
Durch die Verwendung kommerziell erhältlicher mikrofluidischer Geräte haben wir ein standardisiertes System generiert, das vollständig zugänglich ist. Andere NMJ-Modelle existieren31,32,33,34,35,36,37,38,39,40,41,42. Sie verlassen sich jedoch typischerweise auf einzelne Kompartimente, denen die Kompartimentierung und fluidische Isolierung zwischen Zelltypen fehlt, oder auf maßgeschneiderte Kulturgefäße, was die Verfügbarkeit und möglicherweise auch die Reproduzierbarkeit verringert. Die für dieses Protokoll verwendeten mikrofluidischen Geräte können mit Mikrobohrungen unterschiedlicher Länge erworben werden, was weitere Analysen wie axonaler Transport43,44 oder Axotomie18,45,46 Untersuchungen ermöglicht. Die fluidische Isolierung zwischen den Kompartimenten ermöglicht darüber hinaus eine kompartimentierte medikamentöse Behandlung von Motoneuronen oder Myotuben, was in der Therapieentwicklung günstig sein kann. Weitere Unternehmen, die sich auf Mikrofluidik spezialisiert haben, sind entstanden, was sich für eine große Auswahl an Gerätedesign und -funktionen geöffnet hat, was die Zugänglichkeit für die In-vitro-Forschung weiter fördert.
Zusammenfassend haben wir ein Protokoll entwickelt, das eine zuverlässige, vielseitige und einfache Methode zur Kultivierung menschlicher motorischer Einheiten mit funktionalen NMJs bietet.
Offenlegungen
L.V.D.B. hat ein Patent auf die Verwendung von HDAC-Inhibitoren bei der Charcot-Marie-Tooth-Krankheit (US-2013227717-A1), ist wissenschaftlicher Mitbegründer von Augustine Therapeutics und Mitglied des wissenschaftlichen Beirats. Die anderen Autoren erklären keine konkurrierenden Interessen.
Danksagungen
Die Autoren danken Nikky Corthout und Sebastian Munck von LiMoNe, Forschungsgruppe Molekulare Neurobiologie (VIB-KU Leuven) für ihren Rat zu livezelligen Kalzium-Transientenfluoreszenzaufnahmen. Diese Forschung wurde von der Fulbright-Kommission für Belgien und Luxemburg, der KU Leuven (C1 und Fonds "Opening the Future"), dem VIB, der Agentur für Innovation durch Wissenschaft und Technologie (IWT; SBO-iPSCAF), der "Fund for Scientific Research Flanders" (FWO-Vlaanderen), Target ALS, die ALS Liga België (A Cure for ALS), die belgische Regierung (Interuniversity Attraction Poles Program P7/16 initiiert vom belgischen Bundesamt für Wissenschaftspolitik), die Thierry Latran Foundation und die "Association Belge contre les Maladies neuro-Musculaires" (ABMM). T.V. und J.B. werden durch Ph.D.-Stipendien unterstützt, die von FWO-Vlaanderen vergeben werden.
Materialien
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Referenzen
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten