Method Article
マイクロ流体デバイスにおける機能性神経筋接合を有するヒト運動ユニットの生成
要約
ヒトが誘導した多能性幹細胞由来の運動ニューロンを、機能的に活性な神経筋接合の形成をもたらすヒトの一次メソアンジオ芽細胞由来筋膜と共培養することにより、市販の微小流体デバイスにおけるヒト運動ユニットを生成する方法を説明する。
要約
神経筋接合部 (NmJs) は、下の運動ニューロンの軸索と筋肉の収縮の関与を促進する筋肉の間の特殊なシナプスです。筋萎縮性側索硬化症(ALS)や脊髄筋萎縮症(SMA)などの運動ニューロン障害では、NMJが退化し、筋肉萎縮および進行性麻痺を生じる。NMJ変性の根本的なメカニズムは、主に翻訳可能な研究モデルの欠如のために不明である。本研究は、機能的なNJを搭載した人間のモーターユニットの汎用性と再現性のある インビトロ モデルを作成することを目的とした。そこで、ヒト誘導多能性幹細胞(hiPSC)由来の運動ニューロンとヒト一次メソアンジオ芽細胞(MAB)由来のミオチューブを、市販のマイクロ流体デバイスで共培養した。流動分離されたマイクロコンパートメントを使用することで、細胞特異的な微小環境の維持を可能にし、マイクログルーブを介して細胞間接触を可能にする。化学式および体積勾配を適用することにより、ミオチューブ相互作用を促進するマイクログルーブを介した運動ニューロン-神経ニューライトの成長およびNmJの形成が刺激された。これらのNJは、筋管内で運動ニューロンシナプス前マーカーシナプトフィシン(SYP)とポストナプティックアセチルコリン受容体(AChR)マーカー α-ブンガロトキシン(Btx)の共局在化を通じて免疫細胞化学的に同定され、走査電子顕微鏡(SEM)を用いて形態学的に特徴付けられた。NJの機能性は、運動ニューロンの脱分極時にミオチューブ中のカルシウム応答を測定することによって確認された。標準的なマイクロ流体装置と幹細胞技術を用いて発生するモーターユニットは、健康と疾患のNmJに焦点を当てた将来の研究を支援することができます。
概要
NJSは、神経伝達物質1の放出を通じて、下部脊髄運動ニューロンと骨格筋線維との間のコミュニケーションを促進する。ALSやSMAのような運動ニューロン障害では、NmJは縮退し、筋肉とのコミュニケーションに混乱を引き起こす2、3、4、5、6、7。これは、患者が徐々に筋肉機能を失うことになり、車椅子に縛られ、最終的には横隔膜のような重要な筋肉群の進行性萎縮のために呼吸生命維持に依存する。これらの障害におけるこの深いNJの喪失の原因となる正確な根本的なメカニズムは不明である。トランスジェニック動物モデルに関する多くの研究が行われ、NMJ変性症の病因に関するいくつかの洞察が得られた5,6,8,9,10,11。しかし、病理を十分に理解し、脱性を打ち消すためには、完全なアクセシビリティを可能にする人間のシステムを持つことが重要です。
ここで、プロトコルは、市販のマイクロ流体デバイスを使用してhiPSC由来の運動ニューロンおよびヒト一次MAB由来ミオチューブの共培養を通じてヒトMJを生成する比較的簡単な方法を記述する。ニューロンのソマと軸索を偏光し、流動的に分離するためのマイクロ流体の使用は、1970年代後半の「カンペノン」室12の最初の記述以来知られている。それ以来、商業オプションを含む、より多くのマイクロ流体設計が製造されています。このプロトコルで使用されるデバイスは、2つのコンパートメントを含み、各コンパートメントは、channel13で接続された2つのウェルで構成されています。2つのコンパートメントはミラー化され、いくつかのマイクロ溝と接続されている。これらのマイクログルーブは毛管の静水圧13,14を通して2つのコンパートメント間の流体分離を維持しながら、神経突起成長を促進するサイズを有する。このシステムを使用すると、運動ニューロンを一方のコンパートメントで培養し、筋肉細胞を他の1つのコンパートメントで培養し、それぞれが特定の培養培地で培養し、マイクログルーブを通過して筋肉細胞と係合する神経突起を介した物理的な接続を促進することができる。このモデルはALSおよびSMAのような病気の初期NMJ病理学を研究するために使用することができる人間の運動単位の完全にアクセス可能で、適応可能なインビトロシステムを提供する。
プロトコル
iPSC生成およびMAB収穫のためにサンプルを提供したすべての被験者から書面によるインフォームド・コンセントが得られました。この手続きは、大学病院ルーヴェンの医療倫理委員会(n° S5732-ML11268)とStemBANCCプロジェクトの一環として英国の主要研究倫理委員会によって承認されました。このプロトコルで使用されるすべての試薬および装置は 、材料表 に記載されており、滅菌を使用する必要があります。特に明記されていない限り、使用前にメディアを室温(RT)に加熱する必要があります。共カルチャー プロトコルの概要については、 図 1 を参照してください。
1. iPSCからの運動ニューロン前駆物質の分化
- 運動ニューロン分化プロトコル15に従い、以前の研究16から適応し、10日目の神経前駆物質(NPC)状態に達するまで。プロトコルの時間枠に従って、分化は月曜日(0日目)に開始され、木曜日には10日目のNPCになります。
- クライオプション10日目NPCは、1バイアルあたり2 x 106-4 x 106 細胞の密度で10%ジメチルスルホキシド(DMSO)とのノックアウト血清置換術を行う。
注意:DMSOは有毒です:個人的な保護具とヒュームフードでハンドル。
注:1日の約50%は、解凍時に10台のNPCが不可欠であると予想されています。この「10日NPC」状態で運動ニューロン分化プロトコルを停止し、NPCを凍結保存して多数のNPCを生成し、後でバンクして使用することができ、共培養プロトコルの全体的なタイムラインの長さを合計28日から19日に短縮します。
2. ヒトMABsの導出と維持
注:MABは血管関連間葉系幹細胞であり、この場合、58歳の健康ドナーから得られた生検から採取されています。代替の商業ソースが利用可能です。MABs を取得するためのプロトコルについて簡単に説明します。詳細については、詳細なプロトコル17を参照してください。すべてのMAB培地は、使用前に37°Cに加熱する必要があります。
- 生検組織をミンチし、コラーゲン(カーフスキンから)にインキュベートし、6cmの皿を成長培地(表1)で2週間コーティングした。4日ごとにメディアを変更します。
- コラーゲンコーティングを調製するには、0.1Mの酢酸の20mLにコラーゲン100mgを溶解します。コラーゲンは溶解するのに時間がかかるので、RTで一晩ロッキングプラットフォーム上に混合物を置きます。翌日、80 mLのddH2Oを上げて最終容積100mLにアップ。
注意:酢酸は有毒です。個人的な保護具が付いている煙のフードのハンドル。
注:カーフスキンコーティングのコラーゲンは5倍まで再利用できます。4 °Cで保管。 - 皿またはフラスコの表面全体にコラーゲンをコーティングし、ラミナーフロー内のRTで20分間閉じてインキュベートします。20分後、新鮮な容器にコラーゲンを回収し、空の皿/フラスコを閉じ、積層流れのRTで10分間放置します。
- 皿/フラスコをインキュベーターに一晩(または少なくとも6時間)インキュベート(37°C、5%CO2)に移します。メッキ細胞の前にカルシウムまたはマグネシウム(DPBS)なしでDulbeccoのリン酸緩衝生理食塩水で5倍洗浄します。
- コラーゲンコーティングを調製するには、0.1Mの酢酸の20mLにコラーゲン100mgを溶解します。コラーゲンは溶解するのに時間がかかるので、RTで一晩ロッキングプラットフォーム上に混合物を置きます。翌日、80 mLのddH2Oを上げて最終容積100mLにアップ。
- 14日後、FACS(蛍光活性化細胞選別)は、ヒトアルカリホスファターゼ17 のMABsをソートし、続いてさらに拡張します。コラーゲンコーティングされたT75フラスコのMABsを成長培地に維持し、2日ごとに成長培地を変化させます(1フラスコあたり10 mL)。
- 70%合流に達するとデバイス内の凍結保存、通過、または播種MAB。
注意: MABsは細胞間接触時の自発的な融合のために筋原性の潜在能力を失う。MABs を拡張する場合は、70% を超えないようにしてください。コンフルエントT75フラスコ1個は約60万~80万個の細胞を含み、バイアルあたり10万個の細胞で凍結保存することができます。各バイアルは、後で解凍し、拡張のためにT75フラスコに播種することができます。 - MABを通過させるために、DPBSの7 mLで1回静かに洗浄し、MAB解離液の7 mLで3min3 min 3 7 minの5%CO2のCO2 で細胞を解離します。
- 7 mLの増殖培地でMAB解離液を中和し、細胞を軽く掻き取り、細胞懸濁液を50 mL遠心分離管に移します。フラスコを成長培地の余分な5 mLで静かに洗い、潜在的に残っているMABを収集します。
- 300 x gで3分間の細胞懸濁液を遠心分離し、その後、拡張のために新しいコラーゲンコーティングT75フラスコに直接通過し、10%DMSOでノックアウト血清置換術中の凍結保存するか、マイクロ流体装置で播種するカウントする。
注:13の最大通過数まで、セル拡張の場合、1週間に1x-2xの通路が実行されます。解離すると、MABsは顕微鏡下で調べると球状で大きな形状に見えます。
3. 組み立て済みマイクロ流体デバイスの調製 - 9日目
注:このプロトコルは、マイクロ流体デバイスメーカーのニューロンデバイスプロトコルから適応され、組み立て済みデバイスとシリコーンデバイスの両方を使用するように調整されています。ここでは、あらかじめ組み立てられたデバイスが免疫細胞化学(ICC)および生細胞カルシウム過渡記録に使用され、シリコーンデバイスはSEMに使用されます。プロトコルのタイムラインは、運動ニューロン分化プロトコルのタイムラインに従います。
- コーティングが一晩インキュベートする必要があるように、細胞を播種する前日にマイクロ流体デバイスを準備します。運動ニューロンプロトコルによると、これは水曜日になります。70%~100%のエタノールを10cmのペトリ皿に10mL程度加えます。鉗子を使用して、デバイスを輸送コンテナからペトリ皿に移して滅菌します。
- 装置をエタノールに10 sで沈め、鉗子で装置を紙に移し、30分間の層流で空気乾燥する。デバイスを数回反転させて、両面を乾かします。装置が乾燥しているときは、各デバイスを個々の10cmのペトリ皿に移動させ、容易に取り扱うために鉗子を使用する
注意: エタノールは有毒です。個人的な保護具が付いている煙のフードのハンドル - ポリL-オルニチン(PLO)(100 μg/mL)をDPBSでコーティングし、37°C、5%CO2 で3時間インキュベートします。
- P200ピペットを使用して、DPBSの100 μLを上部に加え、チャネル開口部にできるだけ近く、上から下の井戸を通って流れる流体を観察します。その後、DPBSで100 μLのPLOを底部に加えます。
- マイクログルーブの反対側で繰り返し、デバイスの片側に100 μLを追加して、マイクログルーブ(例えば、右側200 μL、左側300 μL)をコーティングするためにデバイスの2つのミラー面の間にボリューム勾配を作成して終了します。3時間後、デバイス3倍をDPBSで5分間洗います。必要に応じて吸引システムを使用してください。
注:細胞のコーティングまたは培養中の任意の時点でチャネルに気泡の形成を避けるようにしてください。小さな気泡でも短時間で膨張し、コーティング、細胞の播種、または媒体流れを抑制します。コーティング中に流路で流体が停止した場合は、PLO溶液を両側から直接チャネルに再中断します。気泡がまだ存在する場合は、200 μL の DPBS を使用してチャネルをフラッシュし、上記の手順 3.3.1 ~3.3.2 で説明したコーティングプロセスを繰り返します。セルのシード処理後に泡が現れた場合、チャネルをフラッシュすると細胞が損傷するので、デバイスを回復することは不可能です。
- 装置にラミニン(20 μg/mL)を神経基底培地に塗布し、37°C、5%CO2で一晩インキュベートします。手順 3.3.1~3.3.2 の PLO コーティングの手順と同じ手順に従います。
- 翌日、P200ピペットを使用し、先端をチャネル開口部とは正反対に配置して、ウェルからラミニンコーティングを除去します。DPBSをすべてのウェルに追加し、セルシード用のRTで層流にDPBSを持つデバイスを残します。
注:この時点から、気泡形成の原因となる可能性があるため、液体(ラミニンコーティング、DPBS、メディア、固定液など)を直接取り除かないようにすることが重要です。細胞を播種する前に、必ず顕微鏡下でデバイスを検査してください。
4. シリコーンマイクロ流体デバイスの調製 - 9日目
- コーティングが一晩インキュベートする必要があるので、細胞を播種する前日にシリコーンマイクロ流体デバイスを準備します。運動ニューロンプロトコルによると、これは水曜日になります。
- 70%~100%のエタノールを10cmのペトリ皿に10mL程度加えます。鉗子を使用して、デバイスを輸送コンテナからペトリ皿に移して滅菌します。装置をエタノールに10 s浸し、鉗子を6ウェルプレートのウェルに移し、層流で30分間空気乾燥します。装置を側面に置いて、すべての側面が乾燥できるようにします。
- SEMシートをデバイスのサイズに切り詰めます(両側に数mm残します)。手順 4.1.1 で前述したように、殺菌を繰り返します。その後、鉗子で10cmのペトリ皿に移して乾燥させる。2~3枚のSEMシートが1皿に収まります。
- デバイスとSEMシートに、DPBSでPLO(100 μg/mL)をコーティングし、37°C、5%のCO2 で3時間インキュベートします。
- 6ウェルプレートの各デバイスに、DPBSあたり1mLのPLOを追加します。デバイスが、チャネルとマイクログルーブ側が液体に向いているPLOソリューションの上に浮かんでいるかどうかを確認します。10 cmのペトリ皿あたりDPBSに10mLのPLOを加え、鉗子を使用してSEMシートを液体に押し込みます。
注:SEMシートは通常、コーティング溶液の上に浮かびます。装置およびシートを組み立てる前に、PLOと接触した表面が装置のチャネルおよびマイクロ溝表面に接触するように、SEMシートを回して下さい。 - 3時間後、デバイスとSEMシート2xをDPBSで5分間洗い、続いて滅菌水で5分間別の洗浄を行います。必要に応じて吸引システムを使用してください。各SEMシートを個別の10cmペトリ皿に移し、取り扱いが容易です。
メモ:デバイスとSEMシートの両方が、組み立てる前に完全に乾燥している必要があります。滅菌水による最後の洗浄は、DPBSから潜在的な塩結晶を除去し、そうでなければ組み立てを阻害する可能性がある。
- 6ウェルプレートの各デバイスに、DPBSあたり1mLのPLOを追加します。デバイスが、チャネルとマイクログルーブ側が液体に向いているPLOソリューションの上に浮かんでいるかどうかを確認します。10 cmのペトリ皿あたりDPBSに10mLのPLOを加え、鉗子を使用してSEMシートを液体に押し込みます。
- 層流で顕微鏡で働く。鉗子を使用して、チャネルとマイクログルーブ側を90°の角度でSEMシートに取り付け、すべての側面が整列していることを確認します。デバイスを軽く押し下げて、外縁だけでなく、井戸、チャネル、マイクログルーブの周りも確実に密封します。
注:ボンドされた領域は灰色で表示され、まだ取り付けられていない領域は顕微鏡下でクリア表示されます。培養中に装置の剥離を避けるために、すべての領域が気泡なしで十分に密閉されていることを確認してください。破片や塩結晶が土台を遮断する場合は、SEMシートとデバイスの両方を滅菌水で再洗浄し、取り付け手順を再試行する前に乾燥させます。マイクロ溝がデバイスで強く押しすぎないように見える場合は、SEMシートからデバイスを完全に取り外して、再度取り付けを試してください。装置が取り付けられたら、コーティングや交換媒体の際は注意が必要です。 - 層流で顕微鏡で働く。装置にラミニン(20 μg/mL)を神経基底培地に塗布し、37°C、5%CO2で一晩インキュベートします。
注:一晩インキュベーションはシリコーン装置を堅くし、さらにSEMシートにそれを密封する。- P200ピペットを使用して、ラミニン溶液の100 μLを可能な限りチャネル開口部に近づけ、上部ウェルから下部ウェルに流れる流体を観察します。井戸とチャネルの周りの漏れがないか確認してください。
- その後、100 μL のラミニン溶液を底面ウェルに加え、漏れがないか確認します。マイクログルーブの反対側で繰り返し、デバイスの片側に100 μLを追加して、マイクログルーブ(例えば、右側200 μL、左側300 μL)をコーティングするためにデバイスの2つのミラー面間にボリューム勾配を作成します。
注:漏れた場合は、ラミニンコーティングを取り外し、デバイスとSEMシートを分解し、両方を滅菌水で洗浄します。それらを乾燥させ、ステップ4.3以降に繰り返します。 - 翌日、P200ピペットでウェルからコーティングを取り除き、先端をチャネル開口部の反対側に配置します。DPBSをすべてのウェルに追加し、セルシード用のRTで層流にDPBSを持つデバイスを残します。
注:この時点から、気泡の形成を引き起こす可能性があるため、チャネルから直接液体(ラミニンコーティング、DPBS、メディア、固定溶液など)を除去しないでください。細胞を播種する前に、必ず顕微鏡下でデバイスを検査してください。
マイクロ流体デバイスにおけるNPCのめっき - 10日目
注:運動ニューロン分化プロトコル15によると、10日目のNPCのめっきは木曜日に発生します。
- 解約10日目のNPC15、または10日目の運動ニューロン培地10mL当たりのバンクNPCの1-2バイアル(表2および表3)をROCK阻害剤(10μL/mL)溶液で解凍し、細胞懸濁液を100xgで遠心分離して4分間使用する。
- ROCKインヒビター(10 μL/mL)溶液を用いて500-1000μLの運動ニューロン培地で細胞ペレットを再懸濁し、好ましい計数法を用いて生細胞をカウントします。
注: 以下に述べられているように、最適なシード ボリュームに対応するために、NPC を適切な量のメディアに再中断してください。 - P200ピペットを備えたデバイスのマイクログルーブの片側にある2つのウェルからDPBSを取り外し、10日目の運動ニューロンメディアの60〜100 μLでデバイスあたり250,000 NPCをシードします。
- 右上のウェルでは、45°の角度でチャネル開口部に近い細胞懸濁液(125,000細胞)のシード30〜50μLを、ピペットチップでウェルの中央に向かってウェルフロアに沿って残りの流体を穏やかにドラッグします。
- 数秒間一時停止して、セルの懸濁液がチャネルを流れ、下層ウェル(30~50 μLの125,000セル)で繰り返します。ペンを使用して、顕微鏡なしでデバイスの向きを容易にするために、シード側「NPC」または同等のマークを付けます。
- 37°Cでデバイスをインキュベートし、5分間5%CO2 で細胞の取り付けが可能な場合は、追加の10日目の運動ニューロン培地(合計200μL/well)で2種のウェルをトッピングし、37°C、5%CO2で再びインキュベートします。
注:各ウェルには200 μLを含めることができます。ウェルとチャネルの両方に細胞を播種すると、培養物の堅牢な構造が保証され、メディアの変更時に細胞が剥離するリスクが低くなります。チャネル内でシードするセルの数を減らすことも可能です。ただし、これにより、各メディアの変更中にチャネルを通じてボリューム電流に影響を受けやすくなります。
- P200ピペットを使用して、新たに播種されたNPCの反対側にあるマイクログルーブの反対側にある2つの井戸からDPBSを取り除きます。次に、インキュベーション中の培地の蒸発を防ぐために、装置の周囲に10cm皿あたり6mLのDPBSを加えます。
注: 必要に応じて、カルチャ期間中にデバイスの周囲に DPBS を追加します。 - 11日目(金曜日)、14日目(月曜日)、16日目(水曜)(表2 および 表3)の両方の区画で、完全運動ニューロン培地の変化を行う。メディア変更の日に新鮮なメディアのサプリメントを追加します。
注: この時点から、P200 ピペットを使用してすべてのメディア変更を実行します。常にピペットチップを溝から井戸の端に置き、チャネルから直接液体を取り除かないでください。シリコーンデバイスを取り外さないように注意してください。セルの剥離を防ぐために、メディアの除去と追加はゆっくりと行う必要があります。- P200ピペットチップをチャネル開口部の反対側のウェルウォールの下端に配置して、両方のウェル内のすべてのメディアをNPCで慎重に取り外します。P200ピペットチップをチャネル開口部の反対側のウェルウォールの上端に配置することで、50-100 μLの新鮮な運動ニューロン媒体を上ウェルにゆっくりと加えます。
- 数秒間一時停止して、メディアがチャネルを流れ、50-100 μLの運動ニューロン媒体を底部に追加します。両方のウェルに200 μL/wellが含まれるまで、このプロセスを慎重に繰り返します。セルなしで側で繰り返します。
6. マイクロ流体デバイスにおけるMABのめっき - 17日目
- MABをマイクロ流体デバイス(運動ニューロン分化10日目)に播種する約7日前に、MABsを解凍し、十分な細胞拡張を可能にするために、コラーゲンでコーティングされたT75フラスコの成長培地(表1)に播種します。セクション2を参照してください。
- 運動ニューロン分化の17日目(木曜日)に、ステップ2.4で説明したようにMABsを解約し、細胞ペレットを増殖培地〜500μL〜500μLで再懸濁し、任意の好ましい計数法を用いて生細胞をカウントする。
注: 以下に述べられているように、最適なシード ボリュームに対応するために、必ず正しい量のメディアに MAB を再中断してください。 - P200ピペットを使用してデバイス内のマイクログルーブの未播種側の運動ニューロン培地を取り出し、DPBSで穏やかに洗浄し、60〜100μLの成長培地でデバイスあたり200,000 MABをシードします。
- 右上の井戸では、45°の角度でチャネル開口部に近い細胞懸濁液(100,000細胞)のシード30〜50 μLを、ピペットチップでウェルフロアの中央に向かってそっと引きずります。数秒間一時停止して、チャネルを通る細胞の流れを可能にしてから、下層ウェル(30~50 μLの100,000個のセル)を繰り返します。
- 37°Cでデバイスをインキュベートし、5分間5%CO2 で細胞の取り付けが可能な後、2つの新しいMABシードの井戸に成長培地(合計200 μL/well)を加えます。37°C、5%CO2で再びインキュベートする。
メモ:デバイスの運動ニューロン側の17日目にメディアの変更は必要ありません。前に公表された運動ニューロン分化方法15 による17日目の培地変化は、代わりに18日目(金)に行われる。
7. MABコンパートメントに向かって運動ニューロン神経ニューライトの成長を促進するための容積および化学式勾配の実施
- 18日目に、18日目の運動ニューロン培地(200 μL/well)で運動ニューロン側で完全な培地変化を行います。手順 5.5.1~5.5.2 で説明されている中程度の変更に関する指示に従います。デバイスの MAB コンパートメントで MAB の分化を開始します (表 2 および 表 4)。
- MABコンパートメントをDPBSで1回慎重に洗浄してから、予熱したMAB分化培地(表4)に0.01 μg/mLのヒトアグリン(200 μL/well)を加えます。
注:MABsは1週間の間に多核のミオチューブを融合し、形成します。
- MABコンパートメントをDPBSで1回慎重に洗浄してから、予熱したMAB分化培地(表4)に0.01 μg/mLのヒトアグリン(200 μL/well)を加えます。
- 21日目に、運動ニューロン分化プロトコル(月曜日)に従って、化学戦術および体積勾配を開始する(表2 および 表3)。
- 脳由来神経栄養因子(BDNF)の30ng/mL、グリア細胞系由来神経栄養因子(GDNF)および毛様神経栄養因子(CNTF)、ヒトアグリン(0.01 μg/mL)、ラミン(20μg/mL)を持つ運動ニューロン基底培地の200 μL/wellを追加します。運動ニューロンの基礎媒体(100 μL/well)を運動ニューロンコンパートメントに成長因子なしで加えます。
- 運動ニューロン分化の28日目まで、2日ごとにステップ7.2を繰り返します。週末はメディアの変更は必要ありません。
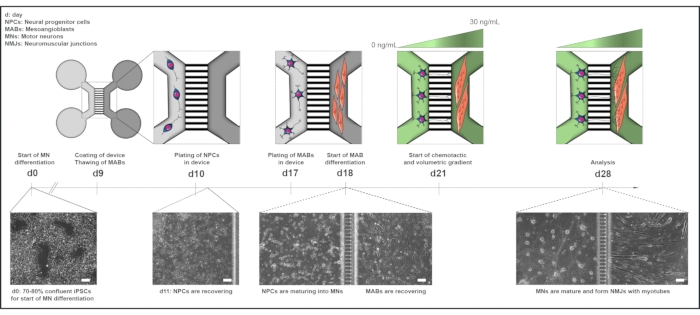
図1:マイクロ流体デバイスにおけるモータユニットプロトコルの概略図 運動ニューロン分化プロトコル22のタイムラインに従って、0日目から28日目までの分化タイムラインおよび共培養の概要。iPSCからの運動ニューロン分化は0日目に開始され、次の10日15日に対して前述のように行われる。9日目には、装置を殺菌し、PLOラミニンでコーティングする。MAB は T75 フラスコで拡張するために解凍されます。10日目には、運動ニューロンNPCは、デバイスの1つのコンパートメント(ライトグレー)の両方のウェルとチャネルでメッキされ、運動ニューロンへの分化が1週間続きます。MABは17日目にウェルと反対コンパートメント(ダークグレー)のチャネルの両方にメッキされます。18日目に、MABsのミオチューブへの分化が始まります。21日目には、装置のマイクロ溝を通して運動ニューロン-神経突起分極性を促進するために、体積および化学戦術勾配が確立される。運動ニューロンコンパートメントは、成長因子(明るい緑色のコンパートメント)のない運動ニューロン基底培地の100 μL/wellを受け取り、筋管コンパートメントは30 ng/mLの成長因子(濃緑色コンパートメント)を有する運動ニューロン基底培地の200 μL/wellを受け取った(表2 および 表3)。培養は、28日目の分析までさらに7日間、体積および化学戦術勾配で継続される。明視野画像は、組み立てられたマイクロ流体デバイスで培養された0日目、11日目、18日目、28日目の細胞形態を示しています。スケールバー、100 μm。この図は、ストクルンド・ディットラウ、K.ら18から変更されています。セルのイラストは、スマートサーバー医療アート22から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
8. 固定とICC
注:すべてのステップは、ニューロンの培養の剥離を防ぐために慎重に行われるべきです。次の手順でチャネルから液体を取り除かないでください。
- ヒュームフードまたはラミナーフローでの固定を行う:慎重に固定する前にDPBSでデバイス内のすべての井戸を慎重に洗浄します。DPBSで4%パラホルムアルデヒド(PFA)を使用して、積層流(100 μL/well)のRTで15〜20分間固定します。
注意:PFAは有毒です:個人的な保護具とヒュームフードでハンドル。- デバイスの上部ウェルに100 μLを慎重に追加し、数秒間待って固定ソリューションがチャネルを流れるのに対し、100 μLを底ウェルに追加します。反対側で繰り返します。インキュベーション後、PFA溶液を取り出し、DPBSで3倍の5分間静かに洗います。200 μL/well DPBSに保管し、10cmのシャーレをパラフィルムで密封し、ICC実験まで4°Cで保管します。
メモ:デバイスが保管中に乾燥していないことを確認してください。
- デバイスの上部ウェルに100 μLを慎重に追加し、数秒間待って固定ソリューションがチャネルを流れるのに対し、100 μLを底ウェルに追加します。反対側で繰り返します。インキュベーション後、PFA溶液を取り出し、DPBSで3倍の5分間静かに洗います。200 μL/well DPBSに保管し、10cmのシャーレをパラフィルムで密封し、ICC実験まで4°Cで保管します。
- 透過性溶液(100 μL/ウェル)をDPBSで0.1%のトリトンX-100で、ICC手順の1日目にRTで20分間インキュベートします。パーメビライゼーション溶液を取り出し、0.1%トリトンX-100/DPBS溶液(100 μL/well)に5%の正常ロバ血清をRTで30分間添加します。
- 5%の正常ロバ血清溶液を取り出し、一次抗体(材料表)を含むデバイスを0.1%トリトンX-100/DPBS溶液で2%正常ロバ血清でインキュベートし、一晩4°Cでインキュベートします。
- ボリューム グラデーションを実装します。マイクログルーブの片側に100 μL/ウェルの抗体溶液を、もう一方の側に150 μL/wellを加えます(デバイスあたり合計500 μL)。
注:マイクロ溝の両側に異なる抗体を使用することが可能です。この場合、コンパートメント間の流体分離を維持するために、マイクロ溝全体の一次または二次抗体を持つ体積勾配を実装しないでください。マイクロ溝の中の神経突起は勾配なしでは染色されません。
- ボリューム グラデーションを実装します。マイクログルーブの片側に100 μL/ウェルの抗体溶液を、もう一方の側に150 μL/wellを加えます(デバイスあたり合計500 μL)。
- 翌日(ICC手順の2日目)、一次抗体を取り除き、0.1%トリトンX-100/DPBS溶液で5分間慎重に洗浄します。
注意:簡単に取り外し可能な文化では、5分間の洗浄3倍を30分間1倍に交換できます。 - 二次抗体(材料表)は光に敏感であるように、これから暗闇の中で働く。2%正常ロバ血清中の2%正常ロバ血清中の細胞をRTで1時間1時間用に2%正常ロバ血清でインキュベートする。インキュベーション後、二次抗体を取り除き、DPBSで3倍の5分間洗浄します。
- DPBS(100 μL/well)にDAPIで核DNAのラベルをRTで20分間ラベルし、続いて0.1%トリトンX-100/DPBS溶液で5分間の洗浄の3x-4xを続けます。0.1%トリトンX-100/DPBS溶液を全てのウェルから取り出し、培養液を数秒間乾燥させてから、各ウェルに蛍光実装媒体を1滴ずつ加えてシールします。
メモ:取り付けメディアを設定できるように、デバイスを少なくとも24時間水平に保ちます。24時間後、装置は4°Cのスライドケースに貯えることができる。 - 反転顕微鏡を使用したZスタック内の画像。
- NJSを画像化するには、40倍の目的を使用して、myotube抗体(材料表)でマークされたミオチューブを見つけ、Zスタック記録を実行して神経細胞およびミオチューブ組織イメージングを確実に行います。myotube が大きすぎて 1 つのフレームに収まらない場合に備えて、複数の画像を撮影します。
- NMJ 定量の場合、各 z スタックを介してニューロンのシナプス前マーカーと AChR マーカーの間の共局在化の数を手動でカウントします。z スタック内に存在する myotube の数に対する共ローカライズの数を正規化します。
9. SEM用デバイスの固定と準備
注:液体を交換する場合は、細胞の崩壊を避けるために培養物をカバーするために、常に少量を保管してください。このプロトコルは、非常に有毒な物質を使用し、それは、全体のプロセス中に、個人的な保護具とヒュームフードで動作することが必要とされます。
- 固定および分解: 0.1 Mカコチル酸ナトリウムバッファー(pH 7.6)に新鮮な2.5%グルタルアルデヒド(GA)を準備し、0.2 μmフィルターでフィルターし、37°Cまで加熱します。
注意:GAとカコチル酸ナトリウムは有毒です:個人的な保護具とヒュームフードでハンドル。- 慎重にDPBSでデバイスを慎重に洗浄して、メディアとセルの破片を取り除き、RTで15分間GA溶液を接頭辞します。
- スカルメスを使用して、鉗子でデバイスを安定させながら、SEMシートをデバイスの周囲に慎重に切断します。切断中にデバイスを取り外さないようにしてください。3 cmのペトリ皿に鉗子の助けを借りて装置およびSEMシートを動かし、容易な処理のための10cm皿の中に3cm皿を置く。
- 接頭辞の15分後に、鉗子を使用してSEMシートからデバイスを慎重に取り外します。デバイスを1つのコーナーで取り外し、反対側の角に向かって斜め方向にゆっくりと取り外します。セルがデバイスから切り離されるのを観察します。
- 3 cm皿のSEMシート全体をカバーするために追加のGAソリューションを追加し、RTでまたは4°Cで一晩で合計2時間の固定を継続します。
注: セルで覆われたサーフェスを避けて、フォースを使用して、GA ソリューションの下の SEM シートを静かに押します。
- SEM の標準プロトコルを続行します。簡単に言えば、オスミウム四酸化されたインキュベートに続いて、エタノールの段階的なシリーズで脱水が行われた。SEMシートをカバースリップホルダーに挿入して、重要なポイントを乾燥させ、カーボンステッカーやコーティング用のサポートスタブに取り付けます。走査型電子顕微鏡を使用して、加速電圧5kV、動作距離7mmで画像を作成します。
10. 生細胞カルシウムイメージングを用いたNMJ機能評価
- デバイスの準備:BDNF、GDNF、およびCNTFの30 ng/mLを有する18日目の運動ニューロン基底媒体の200 μL/wellで筋管コンパートメントをリフレッシュし、運動ニューロン基底培地の200 μL/wellの運動ニューロン基底媒体を成長因子なしでリフレッシュします(表2 および 表3)。
- Fluo-4色素溶媒で希釈したFluo-4色素を5μMの最終濃度でミオチューブコンパートメントに加え、37°C、5%CO2 で暗闇の中で25分間インキュベートします。装置がインキュベーションの下にある間、450 mMの最終的な濃度で成長因子なしで運動ニューロンの基底媒体の塩化カリウムを薄くする。
注意:蛍光-4 AMはカルシウム結合時に蛍光の増加を示すカルシウム指標である。染料は光に敏感なので、これからは暗闇の中で働きます。 - 25分後、BDNF、GDNF、およびCNTFの30 ng/mLを有する200μL/well 18運動ニューロン基底媒体と、運動ニューロン基底培地の100 μL/wellの運動ニューロンコンパートメントで、化学戦術と体積勾配を再確立する成長因子なしで、筋管コンパートメントをリフレッシュします。
- NMJをブロックするには、AChR競合アンタゴニストのツボクラリン塩酸塩五水和物の19 μMでミオチューブコンパートメント培地を補います。
注意:Tubocurarine塩酸塩五水和物は有毒です:個人的な保護具とヒュームフードでハンドル。
- Fluo-4色素溶媒で希釈したFluo-4色素を5μMの最終濃度でミオチューブコンパートメントに加え、37°C、5%CO2 で暗闇の中で25分間インキュベートします。装置がインキュベーションの下にある間、450 mMの最終的な濃度で成長因子なしで運動ニューロンの基底媒体の塩化カリウムを薄くする。
- 37°C、5%CO2に調整されたインキュベーターを装備した反転共焦点顕微鏡で録音を行います。
- 10xの目的で、明視野チャネルを使用して、ミオチューブコンパートメント内のミオチューブを見つけます。488チャンネルのレーザーパワー、ゲイン、オフセットを、蛍光4の蛍光が個々のミオチューブをマークするレベルに調整します。
注:代表的な結果は、ソフトウェアのA1設定のスクロールバーをレーザーパワー5%、ゲイン60(HV)、オフセット0に調整することで獲得されました。
- 10xの目的で、明視野チャネルを使用して、ミオチューブコンパートメント内のミオチューブを見つけます。488チャンネルのレーザーパワー、ゲイン、オフセットを、蛍光4の蛍光が個々のミオチューブをマークするレベルに調整します。
- 1 s間隔で記録時間を1分に設定します。5〜10sがベースラインを有し、続いて直ちに塩化カリウム溶液で運動ニューロンを刺激する記録。
- 5-10秒後に、25 μLの塩化カリウム溶液を運動ニューロンコンパートメントの1ウェルにゆっくりと加え、最終的な濃度50mMに到達します。
注:これは、チャネルを介して波を作成し、記録上のアーティファクトを引き起こすので、あまりにも速く塩化カリウム溶液を追加しないでください。
- 5-10秒後に、25 μLの塩化カリウム溶液を運動ニューロンコンパートメントの1ウェルにゆっくりと加え、最終的な濃度50mMに到達します。
- 2分のポーズで2回運動ニューロン刺激を伴う筋管コンパートメントを記録し、続いて筋管コンパートメントの25μL塩化カリウム溶液を直接刺激して、運動ニューロン脱分極とは無関係に直接ミオチューブ活性を評価する。
- 定量化の場合は、各 myotube を記録ソフトウェアで手動で丸で囲み、1 分間の Fluo-4 蛍光強度を分析します。カルシウム流入の増加を決定するには、塩化カリウムによる刺激後のピーク値から平均ベースライン値(すなわち、塩化カリウム刺激前の最初の10sから平均)を差し引く。代表的な結果は、ソフトウェアの時間測定ツールを使用して取得されました。
結果
マイクロ流体デバイスにおけるNmJの生成
市販のマイクロ流体デバイスにおいて機能的NMJを有するヒトモータユニットを生成するために、ヒトiPSC由来の運動ニューロンおよびヒトMAB由来のミオチューブが使用された。出発細胞材料の品質は重要であり、特にMABsのミオチューブへの融合能力は、このプロトコルの成功の結果にとって極めて重要である。MABsは文化に保つのが簡単です。しかし、マイクロ流体デバイスに適用する前に、各バッチの融合能力を評価することが重要です(補足図1A、B)18。分化10日後にミオチューブ形成を示さないバッチは使用すべきではない。補足図1Bの核融合指数は、画像当たりの全核数の各筋管マーカーに対して、myotubes陽性の核の割合を算出することによって求めた。我々は、約8%の融合指数が、我々の共文化に十分なNmJを生成する上で十分であることがわかった。
iPSCの純粋な培養から運動ニューロン分化を開始することは常に重要です。入力が純粋である - より純粋な結果。運動ニューロン分化プロトコルは、運動ニューロンマーカーに対して典型的には85%-95%の陽性である運動ニューロン培養物を生成する(補足図1C、D)18。残りの細胞は通常未分化前駆細胞であり、場合によっては広範な増殖を受け、それによって培養の質に悪影響を及ぼす。このプロトコルの最良の結果を得るためには、運動ニューロンの分化効率を評価してから、10日目の運動ニューロンNPCをデバイスに適用する必要があります。また、NPC品質チェックを11日目に行い、NPCマーカーOlig2の発現を評価することができます(補足図1E、F)。
当初、運動ニューロンNPCとMABsは10日目に同じ時点でメッキされました。ここでは、MAB の分化が 11 日目に開始されました。14日目に実装された体積および成長因子勾配により、21日目にNMJ形成を評価することができ、プロトコルを1週間短縮することができました。興味深いことに、ICC(補足図2A)により特徴的なNMJ形成を観察することができました。しかし、この初期の運動ニューロン分化では、生細胞のカルシウム記録を介して機能的な出力を得ることができなかった(データは示していない)。我々は、NMJ形態が有望に見えたにもかかわらず、運動ニューロンはまだミオチューブと機能的なNMJ接続を形成するのに十分に成熟していないと結論付けた。これは、パッチクランプ電気生理学的分析を通じて記録された運動ニューロンの自発的な行動電位が、運動ニューロン分化15日目にのみ起こるという以前の観測と一致している。
さらに、MABsをめっきする前に、デバイス内の運動ニューロンを2週間(24日目)熟成させることで、運動ニューロンの成熟と共培養の持続性を延長することを試みた。残念ながら、マイクログルーブを介した多数の自発的運動ニューロン-神経突起交差が観察され、MABの付着が阻害された(補足図2B)。チャネル内の myotube の形成が不足しているため、36 日目に NJ の識別に失敗し、28 日間のプロトコルを適用しました (図 1)。
インビトロNmJの同定、定量化、形態学的特徴付け
28日間のプロトコル(図1)に従った後、完全に機能するMJを取得することができました。生体内およびインビトロの両方で、NMJは、シナプス前マーカーとポストナプティックマーカーの共局在化を通じて免疫ヒストトまたは免疫細胞化学的に特徴付けられる。本研究では、シナプス前マーカーの組合せとしてニューロフィラメント重鎖(NEFH)とSYPを組み合わせて使用し、運動ニューロンの相腫から最も遠位のプロセスに向かって単一の神経突起の以下を可能にした。筋肉側では、BtxはACHRsのポストナプスマーカーとして広く使用されており、この研究でも同様に使用されました。アグリンとラミニンの補充は、サルコレンマ19,20,21でのACHRsのクラスタリングを促進し、インビトロでACHRsを同定しやすくし、同様にACHRsおよびNJの数を増加させる18。
偏りのない方法でNmJを見つけて計算するために、各ミオチューブはミオシン重鎖(MyHC)陽性を介して識別され、反転共焦点顕微鏡を使用して40倍の倍率でZスタックで画像化されます。非常に長いミオチューブでは、複数のzスタックが獲得されました。画像解析では、NEFH/SYPとBtxの共同ローカリゼーションの数は各zスタックを介して手動でカウントされ、共局在化の数はzスタックに存在するミオチューブの数に正規化されます(図2A-C)18。すべてのミオチューブが、インナートベートされたミオチューブの定量化に見られるように、NmJを持つわけではありません(図2D)。したがって、すべての myotube が Btx の存在とは無関係に画像化される、公平な記録アプローチを実行することが重要です。
この インビトロ 系では2種類の形態を同定することが可能である。NJ は、1 つの相互作用ポイントで AChR のクラスターに対して Neurite が接触する単一の接触点 NJ として表示されるか、複数の接触点 NJS として表示され、そこでは、ニューライトがファンアウトして大きなサーフェス上で AChR クラスターとエンゲージします。これら2つの形態は、免疫細胞化学的に(図2A)18 およびSEM(図2B)18)との両方を同定することができ、同様に定量することができる(図2C)18。全体的に見て、複数の接触点は、より成熟したNMJ形成を指し示す大きな筋肉埋め込みを通じてより広範な接続を促進する。対照的に、単一接触点のNmJは、培養の初期の発達状態のために成熟性が低いと考えられる。
インビトロNMJの機能評価
NmJの機能性を評価するために、生細胞カルシウム過渡的な記録を使用した(図3)18。マイクロ流体デバイスの流体分離システムを利用して、運動ニューロンソーマ側を高濃度(50mM)の塩化カリウムで刺激し、同時にカルシウム感受性Fluo-4色素を装填したミオチューブ中のカルシウムの流入を記録した(図3A)。運動ニューロンの活性化直後に、特徴的な波形成を通じてミオチューブのカルシウム流入を観察することができ、運動ニューロン-神経突起と筋管を通る機能的な接続を確認します(図3A-C)18。塩化カリウムを直接刺激した場合の筋管収縮は観察されたが、自発的なカルシウム波や自発的な筋管収縮は観察されなかった。この接続の特異性は、競合するAChRアンタゴニスト、五水和物のトゥボクラリン(DTC)をミオチューブコンパートメント(図3A)に添加することによってさらに確認され、カルシウム流入の阻害をもたらした(図3C)。この効果は、運動ニューロンと筋管の間の接続が完全に機能するNmJをもたらしたことを確認した。NMJ刺激を介して活性筋管数を評価するために、このコンパートメント内の活性筋管の総数を同定するために、ミオチューブコンパートメントを塩化カリウムで直接刺激した。ミオチューブの約70%は、運動ニューロン刺激を受けた塩化カリウムによる活性化によって活動していた(図3D)18。
これらの結果は、28日間のプロトコル中にiPSC由来の運動ニューロンとMAB由来のミオチューブを共培養して、最適なNMJ形成、数、形態および機能性を確認した。
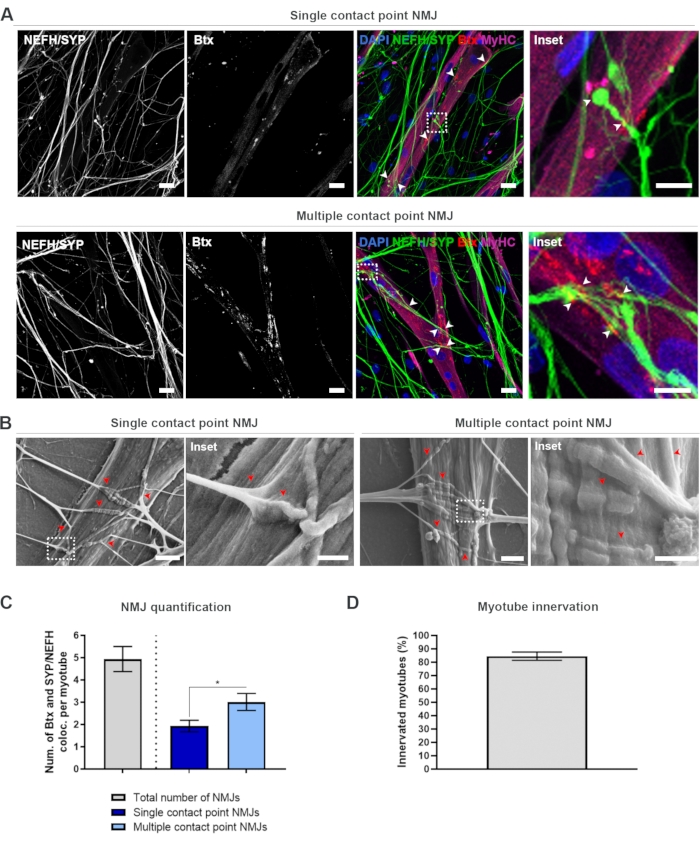
図2:マイクロ流体デバイスにおけるNMJ形成(A)28日目にあらかじめ組み立てられたマイクロ流体デバイスにおけるNMJ形成の共焦点顕微鏡写真。NmJは、MyHC染色されたミオチューブ上のシナプス前マーカー(NEFHおよびSYP)およびポストナプティックAChRマーカー(Btx)の共局在化(矢印)を介して同定される。NMJは、神経突起とAChRクラスタ間の単一または複数の接触点形成を通じて形態学的に同定される。DAPI ラベル核。スケールバー、25 μm。インセットは、NMJの倍率を示す。28日目のシリコーンマイクロ流体デバイスにおけるNMJ形態の10 μm(B)SEMのインセットスケールバー。矢印は、ミオチューブへのニューライト埋め込みを描いています。スケールバー、2 μm。インセットは、NMJの倍率を示す。インセットスケールバー、1 μm(C)ミオチューブあたりのNMJsの総数、およびミオチューブあたりの単一および複数の接触点NMJの数を定量化します。グラフは、4つの生物学的複製からの平均±平均の標準誤差として示される。統計的有意性は、0.05<*pでマン・ホイットニー検定で決定されます。(D) インナートベートされたミオチューブの割合の定量化。グラフは、4つの生物学的複製からの平均±平均の標準誤差として示される。この図は、ストクルンド・ディットラウ、K.ら18から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
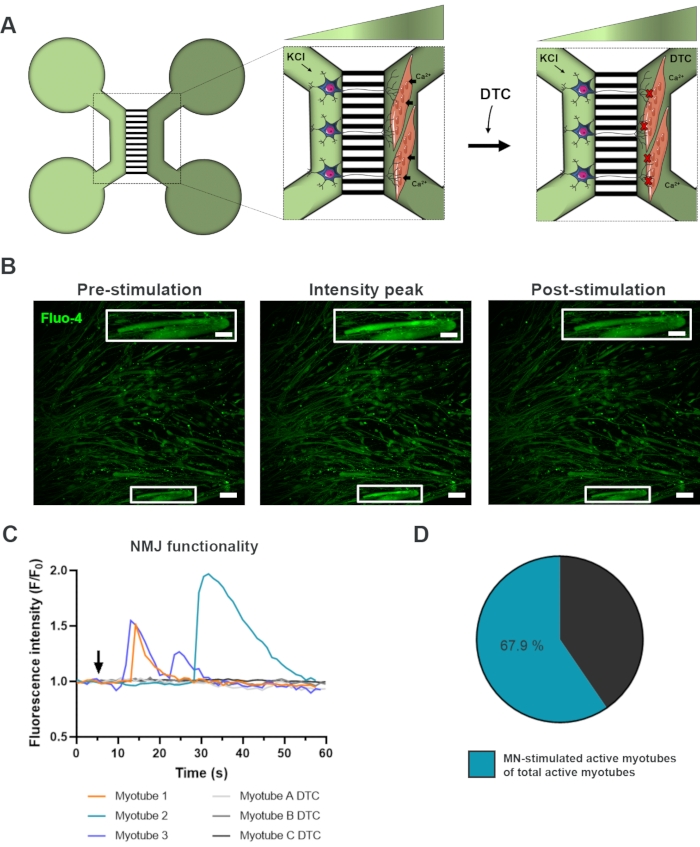
図3:NMJ機能の確認 (A)NMJ閉塞前後の28日目の事前に組み立てられたマイクロ流体デバイスにおけるNMJ機能の生細胞一過性カルシウム記録の概略図(DTC)22。光緑色のコンパートメント内の運動ニューロンは、50 mMの塩化カリウム(KCl)で刺激され、神経突起を介して細胞内運動ニューロン応答を引き起こす。これは、カルシウム感受性Fluo-4染料(濃緑色のコンパートメント)で標識されたミオチューブ中のカルシウム(Ca2+)の流入を呼び起こす。(B)蛍光顕微鏡写真は、KClによる運動ニューロン刺激時に細胞内カルシウム増加の波を描いた筋管のプレ刺激、強度ピークおよびポスト刺激の顕微鏡写真である。スケールバー、100 μm。インセットスケールバー、200μm(C)NmJ機能を確認したKCl(矢印)による運動ニューロン刺激後の筋管における代表的なカルシウム流入曲線。Myotube 1-3は運動ニューロン-ミオチューブのインナレーションを通して特徴的なカルシウム曲線を示し、myotube A-C DTCはNMJブロッキング後のDTCの曲線を示しています。(D) 活動筋管の総数に対する運動ニューロン刺激活性筋管数の比率この図は、ストクルンド・ディットラウ、K.ら18から変更されています。セルのイラストは、スマートサーバー医療アート22から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
補足図1:運動ニューロン検証、MAB融合指数、NPC品質管理 (A) MAB由来のミオチューブの共焦点画像は、分化開始から10日後に行う。ミオチューブには、デスミン、MyHC、ミオゲニン(MyoG)、チチンなどのミオチューブマーカーが付いています。核はDAPIで染色されます。スケールバー、100 μm(B)分化開始10日後のMAB融合指数の定量化。飢餓時に、MABsは多核化された筋管に融合し、これは筋管マーカー陽性(AB+)のために定量化された。グラフは、3つの生物学的複製からの平均±平均の標準誤差を示す。(C)分化の28日目のiPSC由来運動ニューロンの共焦点画像は、汎ニューロンマーカーβIIIチューブリン(Tubulin)に加えて、NEFH、コリンアセチルトランスビシエージ(ChAT)およびアイレット-1で標識されている。核はDAPIで染色されます。スケールバー、75 μm(D)運動ニューロンおよび汎ニューロンマーカー(AB+)に対して正の細胞数の定量化。グラフは、3つの生物学的複製からの平均±平均の標準誤差を示す。(E)NPCマーカーOlig2および汎ニューロンマーカーβIII-チューブリン(Tubulin)で標識された運動ニューロン分化の11日目におけるiPSC由来NPCの共焦点画像。核はDAPIで染色されます。スケールバー、50 μm(F)NPCの数の定量化、これはOlig2およびβIII-チューブリン(AB+)に対して正である。グラフは、3つの生物学的複製からの平均±平均の標準誤差を示す。この図は、ストクルンド・ディットラウ、K.ら18から変更されています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:MABが10日目にNPCと同じ時点で播種される運動ニューロン分化の21日目におけるNMJ形成の共焦点像の最適化NmJは、MyHC染色されたミオチューブ上のシナプス前マーカー(NEFHおよびSYP)およびポストナプティックAChRマーカー(Btx)の共局在化(矢印)を介して同定される。スケールバー(左)、10 μm。スケールバー(右)、5μm(B)24日目の筋管チャネルの明視野画像は、MABの付着を阻害する自発的な運動ニューロン-神経突起交差を描いた。スケールバー、100 μm.このファイルをダウンロードするには、ここをクリックしてください。
| 試薬 | 在庫集中 | 最終濃度 |
| IMDM | 1x | 80% |
| ウシ胎児血清 | 15% | |
| ペニシリン/ストレプトマイシン | 5000 U/mL | 0.5% |
| L-グルタミン | 50倍 | 1% |
| ピルビン酸ナトリウム | 100mM | 1% |
| 非必須アミノ酸 | 100倍 | 1% |
| インスリントランスフェリンセレン | 100倍 | 1% |
| bFGF (新たに追加) | 50 μg/mL | 5 ng/mL |
表1:MAB増殖培地培地は、4°Cで2週間持続することができbFGFは、使用日に新鮮に添加される。
| 試薬 | 在庫集中 | 最終濃度 |
| DMEM/F12 | 50% | |
| 神経基底培地 | 50% | |
| ペニシリン/ストレプトマイシン | 5000 U/mL | 1% |
| L-グルタミン | 50倍 | 0.5 % |
| N-2 サプリメント | 100倍 | 1% |
| ビタミンAなしB-27 | 50倍 | 2% |
| βメルカプトエタノール | 50mM | 0.1% |
| アスコルビン酸 | 200 μM | 0.5 μM |
表2:運動ニューロン基底培地培地は4°Cで4週間持続することができます。
| 日 | 試薬 | 在庫集中 | 最終濃度 | コンパートメント |
| 10/11日目 | 平滑化アゴニスト | 10mM | 500 nM | 両方とも |
| レチノイン酸 | 1 mM | 0.1 μM | ||
| ダプト | 100mM | 10 μM | ||
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 14日目 | ダプト | 100mM | 20 μM | 両方とも |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| 16日目 | ダプト | 100mM | 20 μM | 両方とも |
| BDNF | 0.1 mg/mL | 10 ng/mL | ||
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 18日目 | BDNF | 0.1 mg/mL | 10 ng/mL | 運動ニューロン |
| GDNF | 0.1 mg/mL | 10 ng/mL | ||
| CNTF | 0.1 mg/mL | 10 ng/mL | ||
| 21日目+ | BDNF | 0.1 mg/mL | 30 ng/mL | ミオチューブ |
| GDNF | 0.1 mg/mL | 30 ng/mL | ||
| CNTF | 0.1 mg/mL | 30 ng/mL | ||
| アグリン | 50 μg/mL | 0,01 μg/mL | ||
| ラミニン | 1 mg/mL | 20 μg/mL | ||
| 21日目+ | サプリメントなし | 運動ニューロン |
表3:運動ニューロン培地サプリメント。 サプリメントは、運動ニューロンの基底媒体に使用日に新鮮に追加されます。.
| 日 | 試薬 | 在庫集中 | 最終濃度 | コンパートメント |
| 18日目 | DMEM/F12 | 97% | MAB | |
| ピルビン酸ナトリウム | 100mM | 1% | ||
| 馬の血清 | 2% | |||
| アグリン | 50 μg/mL | 0.01 μg/mL |
表4:MAB分化培地培地は4°Cで2週間持続することができます。 アグリンは、使用日に新鮮に追加されます。
ディスカッション
このプロトコルは、30日以内に市販のマイクロ流体デバイスで機能的なNmJを持つヒトモーターユニットを生成する比較的使いやすい方法を記述する。これは、NMJがICCおよびSEMなどの標準的な技術を通じて形態学的に評価され、生細胞カルシウム記録を通じて機能的にどのように評価することができるかを説明する。
このプロトコルの大きな利点は、幹細胞技術の使用です。これにより、ドナープロファイルとは無関係に、健康と病気の両方でNMJを評価できる完全な適応性が可能になります。このモデルはALS研究で既に成功し、有益であることが証明されており、FUS gene18の突然変異による新しい表現型として神経突起の成長、再成長、NMJの数の障害を同定しました。このモデルでは、病因が不明なALSの散発的な形態を、散発的なALS患者のiPSCを用いることで、研究を拡大することが可能である。これは、ヒト疾患を再現するために変異遺伝子のトランスジェニック過剰発現に依存する従来の動物モデルに対する利点を提供する23,24。さらに、当社の完全な人間のシステムは、人間固有の生理学や病気の潜在的な再現を可能にします。これまでの研究では、げっ歯類とヒトNMJ形態25の違いが示されており、げっ歯類を使用してヒトNMJ病理に対処する際には注意を払う必要があることを示唆しています。このシステムはインビボモデルの複雑さを欠く比較的単純なインビトロセットアップであるが、マイクロ流体デバイスに表示されるNMJ形態がヒト切断体25のNMJに似ていることを実証することが可能であった。さらに、このモデルは、NMJ形成および成熟中のNMJ評価を可能にし、ヒト死後のサンプルに存在しない、識別できない、または見落とされている初期の疾患の型を明らかにする可能性がある。
MABsは、10日の限られた生存期間はシステムの欠点であるが、myotubesを生成するための有効なオプションを提供する。筋管の生存は、筋線維の自発的な収縮によって損なわれる可能性が高い表面への愛着に依存している。10日を超えた後、ほとんどのミオチューブは切り離され、NMJ文化は使用できなくなります。理想的には、iPSCからもミオチューブが生成されます。しかし、現在のプロトコルは、融合指数27,28,29,30の変動により再現が困難であることが証明されています。
市販のマイクロ流体装置を用いることで、完全にアクセス可能な標準化システムを生成しました。その他のNMJモデルは31,32,33,34,35,36,37,38,39,40,41,42が存在する。しかし、通常、それらは、細胞タイプ間の区画化および流動性分離を欠く単一のコンパートメント、またはカスタムメイドの培養容器に依存しており、可用性を低下させ、再現性を低下させる可能性がある。このプロトコルに使用されるマイクロ流体装置は、軸索輸送43,44またはaxotomy18,45,46調査などのさらなる分析を可能にする、様々な長さのマイクログルーブで購入することができます。コンパートメント間の流体分離は、運動ニューロンまたはミオチューブのいずれかによる区分化薬物治療をさらに可能にし、治療の開発に有利であり得る。マイクロ流体を専門とする企業が増え、デバイスの設計と機能を豊富に選択し、インビトロ研究のアクセシビリティをさらに高めています。
結論として、我々は、機能的なNmJと人間のモーターユニットを培養する信頼性の高い、汎用性と簡単な方法を提供するプロトコルを開発しました。
開示事項
L.V.D..Bは、シャルコー・マリー・トゥース病(US-2013227717-A1)におけるHDAC阻害剤の使用に関する特許を取得しており、オーガスティン・セラピューティクスの科学的共同創設者であり、科学諮問委員会のメンバーです。他の著者は、競合する利益を宣言しません。
謝辞
著者らは、LiMoNeのニッキー・コルトゥートとセバスチャン・マンク、研究グループ分子神経生物学(VIB-KUルーヴェン)に、生細胞カルシウム一過性蛍光記録に関するアドバイスに感謝する。この研究は、ベルギーとルクセンブルクのフルブライト委員会、KUルーヴェン(C1と「未来を開く」基金)、VIB、科学技術イノベーション庁(IWT)によって支援されました。SBO-iPSCAF)、「科学研究フランダース基金」(FWO-ヴラアンドレレン)、ターゲットALS、ALSリーガルギア(ALSの治療法)、ベルギー政府(ベルギー連邦科学政策局が開始した大学間アトラクションポールプログラムP7/16)、ティエリー・ラトラン財団、および「協会ベルジュ・コントレス・レ・マジェ・ニューカル・ムスル(AB)」T.V.とJ.Bは、FWO-ヴランドヘレンによって授与された博士号フェローシップによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
参考文献
- Plomp, J. J., Kaminski, H. J., Kusner, L. L. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. , 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, &. #. 2. 0. 1. ;., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861 (2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., Péault, B. M., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. , 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530 (2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- . Smart Servier Medical Art Available from: https://smart.servier.com/ (2021)
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681 (2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649 (2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299 (2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473 (2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049 (2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537 (2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335 (2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993 (2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved