Method Article
إجراء موحد لرصد تزهر الطحالب الضارة في شيلي عن طريق تحليل ميتاباركودينغ
In This Article
Summary
يقدم هذا البروتوكول خطوات لتحليل الطحالب الفوقية، التي تستهدف جينات 16S rRNA و 18S rRNA، لرصد تكاثر الطحالب الضارة والميكروبيوم المرتبط بها في عينات مياه البحر. وهي أداة قوية قائمة على الجزيئية ولكنها تتطلب العديد من الإجراءات ، والتي يتم شرحها بصريا هنا خطوة بخطوة.
Abstract
وقد تم تنفيذ رصد تكاثر الطحالب الضارة في جميع أنحاء العالم، واستخدمت شيلي، وهي بلد يشتهر بمصائد الأسماك وتربية الأحياء المائية، بشكل مكثف التحليلات المجهرية والتكسينية لعقود لهذا الغرض. وقد بدأت للتو الأساليب البيولوجية الجزيئية، مثل تسلسل الحمض النووي عالي الإنتاجية والنهج القائمة على التجميع البكتيري، في إدخالها في رصد HAB التشيلي، ولم يتم توحيد الإجراءات بعد. هنا، يتم إدخال 16S rRNA و 18S rRNA التحليلات metabarcoding لرصد HABs التشيلية خطوة بخطوة. وفقا لفرضية حديثة، يلعب الارتباط المتبادل بين الطحالب والبكتيريا علاقة نقدية تآزرية أو عدائية مسؤولة عن بدء الإزهار والصيانة والانحدار. وبالتالي، فإن رصد HAB من منظورات الطحالب البكتيرية قد يوفر فهما أوسع لآليات HAB وأساس الإنذار المبكر. تحليل ميتاباركودينج هي واحدة من الأدوات الجزيئية الأنسب لهذا الغرض لأنه يمكن الكشف عن معلومات تصنيفية ضخمة الطحالب البكتيرية في عينة. توفر الإجراءات البصرية لأخذ العينات لتحليل التكويد فوق التلوي هنا تعليمات محددة تهدف إلى تقليل الأخطاء وجمع بيانات موثوقة.
Introduction
ومن المعروف أن العديد من أنواع العوالق النباتية البحرية تنتج سموم داخلية المنشأ، وعندما تتراكم هذه الأنواع بأعداد كافية، فإنها تضر بالبيئة البحرية. ويلاحظ هذا الطحالب الضارة بلومز (HABs) اليوم على سواحل معظم قارات العالم1. العوالق النباتية السامة تتراكم لأول مرة في الأنسجة ثنائية الصمام، مما يؤدي إلى المرض والموت في مستويات أعلى من الكائنات الغذائية، بما في ذلك البشر، عند الهضم. وفي وقت لاحق، تجلب هذه الأحداث آثارا خطيرة على الاقتصاد المحلي، والاجتماعية والاقتصادية، والصحة العامة2. وتقدر الأضرار التي لحقت بالاقتصاد العالمي الناجمة عن HABs أن الملايين إلى المليارات من الدولارات كل عام3. شيلي هي واحدة من العديد من البلدان التي تعاني من HABs متكررة.
شيلي بلد من الأراضي الطويلة، وتمتد على مدى 4300 كم شمالا وجنوبا. وتواجه الأرض الغربية الممدودة المحيط الهادئ، مما يزيد بطبيعة الحال من فرص تعرض شيلي لمركبات ثنائية الفينيل متعددة الأوجه. خاصة في جنوب تشيلي، وهناك العديد من تربية سمك السلمون الشهيرة عالميا، وفي كل مرة يحدث HAB في المنطقة، والسموم الطحالب يؤدي إلى سمك السلمون المستزرعة الضخمة الوقوع المرضى ويموت4،5،6. في تشيلي، كان العام الذي ضرب فيه HAB الاقتصاد أكثر من غيره هو عام 2016، مع خسارة سنوية تقدر ب 800 مليون دولار أمريكي7،8. تختلف أنواع الطحالب السامة المسببة حسب السنة والموقع. بالنسبة لقضية عام 2016 ، تسبب مجمع من ألكسندريوم كاتانيلا وبسودوشاتونيلا فيروكليوسا في انتشار HAB في معظم الساحل التشيلي الجنوبي7،8. وحدث أحدث HAB في شيلي مع أنواع الطحالب المسببة لهيتيروسيغما أكاشيو في مارس 2021 في كامانشاكا، الواقعة في جنوب تشيلي، حيث توجد في المنطقة مزرعة سلمون كبيرة.
10 - تقوم شيلي منذ سنوات عديدة برصد السواحل باستخدام طريقتين رئيسيتين؛ مراقبة مياه البحر بالمجاهر لتحديد أنواع الطحالب السامة بانتظام وقياس مستويات السموم في المحار عن طريق المقايسات الكيميائية الحيوية9. ولا يمنع الكشف المبكر عن الطحالب السامة ومستويات السموم في المحار HABs؛ غير أن هذه التحليلات يمكن أن تؤدي إلى اتخاذ تدابير مضادة فورية والحد من الأضرار التي تلحق بالمجتمعات المحلية. ولزيادة تعزيز فعالية هذه الاستراتيجية، أضيفت مؤخرا طريقة تحليلية جزيئية إلى برنامجنا التقليدي لرصد الطحالب والبكتيريا ذات الصلة في عينات مياه البحر. على وجه التحديد ، تم اختيار طريقة تسلسل متوازية ضخمة باستخدام ميتاباركودينج التي تستهدف جينات 16S rRNA و 18S rRNA. على الرغم من أن هذه التقنية تتطلب إجراءات معقدة وآلات وكواشف باهظة الثمن ، إلا أنها تقنية متقدمة يمكنها اكتشاف الآلاف من الطحالب والبكتيريا جينيا / الأنواع الموجودة في عينة مياه البحر في وقت واحد.
وتكهنت أسباب HAB أن تكون مختلفة، مثل درجة الحرارة والموسم، ولكن من المستحيل تعميمها. وذلك لأن أنواع وترددات HAB تعتمد على المنطقة والظروف الصدغية ، والتي تنطوي على ظواهر طبيعية مثل التفرد الجغرافي ، وخلط العناصر الغذائية ، والجريان السطحي للعنصر من الأرض بسبب الخطأ2،10،11،12. بالإضافة إلى ذلك، تؤثر العوامل الاصطناعية مثل البهيجة على HABs المحلية12،13. نظرا للمجمع متعدد العوامل ، فإنه ليس من السهل إجراء تنبؤ HAB دقيق. في السنوات الأخيرة ، هناك وجهة نظر مفادها أن مجموعات بكتيرية محددة قد تكون مرتبطة بتطوير HABs كأحد العوامل ، وكانت الأبحاث لدعم هذه الفرضية واضحة بشكل متزايد14و15و16و17و18. وتستخدم تقنيات البيولوجيا الجزيئية عموما لدراسة التجميع البكتيري. ومع ذلك، لم يتم بعد إنشاء مثل هذه الطريقة الموحدة في رصد HAB التشيلي9. لدراسة الارتباط البكتيري الطحالب مع HABs، فمن الضروري أن يؤدي في وقت واحد تحليل ميتاباركودينج لبرامج الرصد الساحلية التشيلية الحالية. وهكذا، يقدم هذا البروتوكول بصريا برنامجنا التشيلي لرصد HAB، مع التركيز على إجراء تدريجي لتحليل الطحالب والكشف عن أنواع البكتيريا في عينات مياه البحر باستخدام تحليل التكويد الفوقي.
البروتوكول الكامل الذي يصف برنامجنا التشيلي لرصد HAB متاحفي Yarimizu وآخرون. ويشمل إجراءات أخذ عينات مياه البحر، والكشف المجهري عن أنواع الطحالب، والكشف الجيني للطحالب البكتيرية، وتحليل الصباغ، وجمع بيانات الأرصاد الجوية، واختبارات خصائص المياه الفيزيائية والكيميائية. البروتوكول التدريجي من 16S rRNA و 18S rRNA التحليل metabarcoding للكشف عن الطحالب والأنواع البكتيرية متاحة كما preprint19. يوضح هذا البروتوكول بشكل خاص خطوات تحليل العلامات الوصفية لأنه الجزء الأكثر تعقيدا وتسليط الضوء على برنامج مراقبة HAB الخاص بنا. ويتضمن هذا البروتوكول أيضا إدخال البرنامج والكشف المجهري عن أنواع الطحالب. عند تحليل أنواع الطحالب عن طريق التكويد فوق التلوي ، من المهم إجراء الفحص المجهري في وقت واحد للتحقق من النتائج من الطريقتين. لا يتضمن هذا البروتوكول كيفية استخدام البرامج لتعيين التصنيف، ولكن يتم عبارة توصية قاعدة البيانات بإيجاز في نهاية المقطع التالي.
Protocol
1. جمع العينات وال المعالجة المسبقة
- جمع ما يقرب من 3 لتر من عينة المياه من النقطة المستهدفة.
- تصفية 1 لتر من عينة الماء لتحليل 16S rRNA من خلال الترشيح جنبا إلى جنب (1 ميكرومتر و 0.2 ميكرومتر غشاء بحجم المسام) لفصل البكتيريا الحية الحرة والمرفقة.
- تصفية آخر 1 لتر من عينة المياه لتحليل 18S-rRNA (كشف العوالق النباتية) من خلال ترشيح واحد مع غشاء 0.2 ميكرومتر.
ملاحظة: يجب إكمال ترشيح عينة الماء في غضون 12 ساعة من أخذ العينات. - قطع الغشاء المصفى إلى نصفين مع مقص جراحي معقم ولفه بورق الألومنيوم. يخزن عند -20 درجة مئوية لمدة تصل إلى شهر واحد أو انتقل إلى الخطوة التالية.
- استخراج الحمض النووي مع طريقة Chelex كما هو موضح9. يخزن عند -20 درجة مئوية لمدة تصل إلى شهر واحد.
2. تحليل المجهر
- نقل 1 مل من عينة المياه بواسطة ماصة على شريحة شبكة 1 مل.
- مراقبة العينة تحت المجهر.
- تسجيل أسماء وكمية أنواع العوالق النباتية.
3. 16S rRNA و 18S rRNA التحليل metabarcoding
ملاحظة: تتكون هذه العملية من سبعة أقسام: التحضير، أول توليد amplicon PCR، تنظيف amplicon الأول، الفهرسة بواسطة PCR الثاني، التحقق من amplicon PCR الثاني وتنظيفه، تعديل تركيز الحمض النووي، وتشبع الحمض النووي وتسلسله. تستغرق العملية بأكملها 5 أيام على الأقل (40 ساعة) من قبل موظفي المختبر ذوي الخبرة. راجع جدول المواد لأرقام المنتجات والمصنوعات.
- اعداد
- تنظيف ماصة وخزانة غطاء محرك السيارة صفح مع الإيثانول 70٪ تليها التعرض للأشعة فوق البنفسجية لمدة 30 دقيقة في كثير من الأحيان. تعقيم المواد التي سيتم استخدامها.
- قم بذوبان عينات الحمض النووي في درجة حرارة الغرفة، والطرد المركزي عند 100 × ز لمدة دقيقتين، ونقل 100 ميكرولتر من كل عينة فائقة إلى شرائح 8 أنبوب.
- أول جيل AMPLICON PCR
ملاحظة: تنفيذ الإجراءات التالية في خزانة غطاء محرك السيارة صفن. قم دائما بتخفيف التهيئة من مخزون 1 ميكرومتر إلى التركيز المستهدف مع مياه درجة PCR لتجنب تلوث التمهيدي.- إعداد أول مزيج رئيسي PCR في أنبوب معقم 1.5 مل لردود الفعل (الجدول 1، الجدول 2).
- Aliquot 22.5 ميكرولتر من المزيج الرئيسي في شريط 8 أنبوب وإضافة 2.5 ميكرولتر من عينة الحمض النووي. استخدام 2.5 ميكرولتر من الماء الصف PCR للسيطرة السلبية.
- تشغيل دورة PCR الأولى (الجدول 3).
- إعداد 100 مل من هلام Agarose-TBE 2٪ يحتوي على 10 ميكرولتر من وصمة هلام الحمض النووي 1x.
- قم بتحميل خليط من 1.5 ميكرولتر من صبغة تحميل الحمض النووي 1x و 4 ميكرولتر من منتج PCR على هلام الآغاروز. أيضا، تحميل 100 BP سلم الحمض النووي على هلام.
- إجراء الكهربائي في 100 V لمدة 30 دقيقة.
- تأكد من وجود نطاق يتراوح بين 500 و600 نقطة أساس تحت التقاط صورة ضوء الأشعة فوق البنفسجية. التمهيدي ديمر الفرقة هو الجولة 80 نقطة أساس.
ملاحظة: تحتوي عينات المياه البحرية على مثبطات PCR. يمكن أحيانا حل amplicons المفقودة عن طريق تخفيف العينات 1:100 أو 1:1000 مع الماء الصف PCR. - تخزين أول منتجات PCR في -20 درجة مئوية حتى الخطوة التالية.
تنبيه: لا تتجاوز أسبوع واحد من التخزين.
- أول تنظيف AMPLICON PCR
ملاحظة: يمكن تنفيذ هذا المقطع خارج خزانة غطاء محرك السيارة صفح.- استخدام نظام تنظيف الحمض النووي الخرز المغناطيسي لإزالة بقايا تفاعل PCR، بما في ذلك منتجات التمهيدي ديمر.
- نقل 20 ميكرولتر من كل منتج PCR تنظيفها الأولى إلى لوحة بئر 96 جديدة. ختم لوحة مع فيلم الختم الجزئي. يخزن عند -20 درجة مئوية حتى تستمر الخطوة التالية.
تنبيه: لا تتجاوز أكثر من أسبوع واحد من التخزين.
- الفهرسة حسب PCR الثاني
ملاحظة: في هذا القسم، سيتم تضخيم منتجات PCR الأولى المنقى مع تركيبات التمهيدي الفهرس المختلفة.- تمييع جميع مؤشر 1 ومؤشر 2 التمهيديات (الجدول 4) إلى 1 ميكرومتر مع الماء PCR الصف في 8 أنبوب PCR شرائط وضعت في خزانة غطاء محرك السيارة صفح.
ملاحظة: يمكن تنفيذ الخطوات henceforward في هذا المقطع خارج خزانة غطاء محرك السيارة صفح، كما التمهيديات مؤشر محددة لردود الفعل PCR الأولى تخيم محول. - مؤشر الموضع 1 التمهيدي في الصف الأفقي مؤشر 2 التمهيديات في صف عمودي (الجدول 5).
- في لوحة جديدة من 96 بئرا، أضف 12.5 ميكرولتر من التركيبة الجاهزة للبدء الساخن إلى كل بئر.
- إضافة 2.5 ميكرولتر من كل التمهيدي مؤشر (1 ميكرومتر) إلى كل وكذلك في الجدول 4 باستخدام ماصة متعددة القنوات.
- إضافة 7.5 ميكرولتر من تنقية أول منتج PCR.
- تخلط بلطف عن طريق الأنابيب صعودا وهبوطا 10 مرات. تغطية لوحة مع فيلم الختم الصغير.
- تشغيل دورة PCR الثاني (الجدول 3).
- حافظ على اللوحة عند -20 درجة مئوية.
تنبيه: لا تتجاوز أسبوع واحد من التخزين.
- تمييع جميع مؤشر 1 ومؤشر 2 التمهيديات (الجدول 4) إلى 1 ميكرومتر مع الماء PCR الصف في 8 أنبوب PCR شرائط وضعت في خزانة غطاء محرك السيارة صفح.
- التحقق من تضخيم PCR الثاني وتنظيفه
- استخدم محلل الأجزاء والكواشف المقترنة. دوامة وتدور أسفل الكاشف قبل الاستخدام.
- السماح للعينة العازلة وشريط شاشة الحمض النووي إلى equilibrate في درجة حرارة الغرفة لمدة 30 دقيقة. ثم ضع شريط شاشة الحمض النووي في محلل الأجزاء.
- مزيج 2 ميكرولتر من عينة العازلة و 3 ميكرولتر من amplicon PCR الثانية في شرائط أنبوب 8 جديدة. أدخل شرائط الأنبوب 8 في محلل الأجزاء. اضغط تشغيل لبدء.
تنبيه: يجب تجنب تكوين فقاعات الهواء. - تأكد من أن amplicons PCR الثانية هي تقريبا 613 نقطة أساس (600 - 630 نقطة أساس) لكل من جينات 16S و 18S rRNA.
- تنقية منتجات PCR الثانية باستخدام نظام تنظيف الحمض النووي الخرز المغناطيسي.
- تعديل تركيز الحمض النووي
- قياس تركيز الحمض النووي في منتجات PCR الثانية المنقى باستخدام مطياف قياس كمي حمض النوى.
- حساب تركيز الجينات المستهدفة في nM، وهو ما يمثل متوسط حجم المكتبة النهائية 613 نقطة أساس لكل من جينات 16S و 18S rRNA:
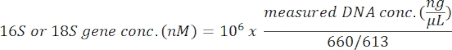
- تمييع كل منتج PCR الثاني المنقى مع الماء PCR معقمة إلى 4 nM في لوحة بئر جديدة 0.2 مل 96.
ملاحظة: يمكن تخزين اللوحة عند -20 درجة مئوية هنا. وإلا، يجب تنفيذ بقية الإجراءات دون توقف. - Aliquot 3 ميكرولتر من كل 4 NM ثانية PCR المنتج ومزيج كل في أنبوب جديد معقم 1.5 مل كمكتبة مجمعة. إبقاء الأنبوب عند 4 درجة مئوية أو على حمام جليدي في جميع الأوقات.
- قياس تركيز المكتبة المجمعة للتأكيد باستخدام مطياف قياس كمي للحمض النووي. ضبط التركيز إلى 4 nM إذا كان أعلى من 4 nM.
ملاحظة: ينتج الحمض النووي المركز أكثر من المطلوب أرقاما مقروءة مبالغ فيها، مما يعوق التحليل.
- تشبع الحمض النووي وتسلسله
ملاحظة: يستخدم هذا المقطع نظام Illumina MiSeq مع الكواشف محددة. راجع أرقام المنتجات في جدول المواد.
ملاحظة: بدقة اتبع الوقت. إذابة جميع الكواشف باستثناء الخراطيش في يوم التسلسل.- قبل يوم واحد من التسلسل، قم بإزالة خرطوشة كاشف جاهزة للاستخدام مملوءة مسبقا من -20 درجة مئوية وتخزينها عند 4 درجات مئوية للذوبان.
- تعيين كتلة الحرارة مناسبة لأنابيب الطرد المركزي 1.5 مل إلى 96 درجة مئوية.
- ضع المخزن المؤقت للتهجين على الجليد.
- تمييع الصف الجزيئي NaOH من 1 N إلى 0.2 N في أنبوب جديد مع الماء الصف PCR.
- تمييع مكتبة تحكم جاهزة للاستخدام مع المخزن المؤقت TE (الرقم الحموضة 8.0) من مخزون 10 nM إلى 4 nM في أنبوب جديد (أي 2 ميكرولتر من مكتبة التحكم + 3 ميكرولتر من المخزن المؤقت TE).
- مزيج 16 ميكرولتر من 4 مكتبة عينة nM مجمعة مع 4 ميكرولتر من 4 مكتبة التحكم nM في أنبوب جديد المسمى "1".
- مزيج 10 ميكرولتر من عينة في أنبوب "1" مع 10 ميكرولتر من 0.2 N NaOH في أنبوب جديد المسمى "2".
- دوامة أنبوب 2 لمدة 5 ق، تدور لفترة وجيزة، واحتضان في درجة حرارة الغرفة لمدة 5 دقائق.
- إضافة 980 ميكرولتر من المخزن المؤقت التهجين إلى أنبوب 2.
- في أنبوب جديد المسمى "3"، مزيج 260 ميكرولتر العينة من أنبوب 2 مع 390 ميكرولتر من العازلة التهجين. مزيج عن طريق عكس الأنبوب.
- حضانة أنبوب 3 في 96 درجة مئوية لمدة 2 دقيقة ووضعه على الفور على الجليد لمدة أقصاها 2 دقيقة.
- قم بإزالة الخرطوشة من الثلاجة 4 درجة مئوية.
- إعداد ورقة نموذج التسلسل مع كل محولات الفهرس 1 و فهرس 2 كما في الجدول 6.
- إزالة flowcell من مجموعة V3 MiSeq. تنظيف بلطف flowcell مع الماء العقيم الصف الجزيئي PCR.
ملاحظة: لا تصب الماء على النقاط الشعرية من flowcell. امسح الماء برفق من الخلية المتدفقة بورق غير ليفي. - قم بتحميل الحجم الكامل للأنبوب 3 (650 ميكرولتر) في الخرطوشة.
- في برنامج تشغيل الأداة، حدد التسلسل واتبع التعليمات. أدخل flowcell ومخازن التأسيس المؤقتة والخرطوشة. تحميل نموذج ورقة. اضغط تشغيل لبدء رد الفعل.
ملاحظة: هذا التسلسل تشغيل سيستغرق 3-5 أيام. سيتم تحميل البيانات تلقائيا إلى منصة Basespace. سيتم تخزين البيانات الخام في مجلدين في الكمبيوتر: مجلد التحليل الذي يحتوي على ملفات fastq والإخراج التي تحتوي على ملفات bcl وصور JPEG.
4.Taxonomic تعيين لتسلسل البيانات
- معالجة الملفات FASTQ
ملاحظة: حزمة DADA223 R24 هي واحدة من قواعد البيانات الموصى بها لمعالجة ملفات FASTQ. يتوفر الدليل التوجيهي في [https://github.com/mickeykawai/exec_dada2]. تم إعداد هذا المبدأ التوجيهي من خلال اعتماد النسخة الأخيرة من DADA2 خط أنابيب تعليمي [https://benjjneb.github.io/dada2/tutorial.html].- معالجة تسلسل FASTQ RAW المقترنة النهاية للتشذيب، تصفية الجودة، dereplication والعد من تسلسل فريدة من نوعها، والاستدلال عينة، ودمج في المتجاورة وإزالة تسلسلات الشميريك.
- استخدم المعلمات المحددة DADA2 التالية لكل من شظايا الجينات 16S rRNA و 18S rRNA؛ trimLefts = 0، 0، truncLens =[التحقق من جودة التسلسل وتعيينه إلى طول مناسب].
ملاحظة: القيم الافتراضية للمعلمات الأخرى maxN = 0، maxEE = 2،2، trancQ = 2.
- تعيين التصنيف
ملاحظة: ينصح قاعدة بيانات سيلفا rRNA لتعيين التصنيف لدادا2 [silva_nr_v132_train_set.fa.gz يتم تعيينها كإعداد افتراضي].- إزالة الكلوروبلاست وOTUs الميتوكوندريا لتحليل شظايا الجينات 16S rRNA. إزالة singletons من 16S rRNA و 18S rRNA التحليل.
- Rarify جميع العينات حتى عمق التسلسل على أساس عينة وجود أدنى عمق التسلسل.
- تسجيل عدد القراءات و OTUs المعينة و على أي مستوى، تمت تصفيتها القراءات، و عدد singletons استبعاد.
- التحليل الإحصائي
- إجراء تحليل إحصائي على البيانات الميكروبية باستخدام حزم R من phyloseq25 والنباتي26.
النتائج
يستخدم هذا البروتوكول تحليل ميتاباركودينج الجينات 18S rRNA لتحديد أنواع الطحالب في عينات مياه البحر. تظهر نتيجة تمثيلية في الشكل 1،حيث تم تحليل مياه البحر التي تم جمعها من ميتري، بويرتو مونت، تشيلي (−41.597؛ −72.7056) في 19 فبراير 2019، مع هذا البروتوكول. وأظهرت النتيجة ما مجموعه 750 13 قراءة مع أكثر من 30 نوعا من الطحالب في عينة مياه البحر. وكانت الطحالب المهيمنة في هذه العينة نافيكولا spp. مع وفرة نسبية من 70.77٪. كما لوحظ وفرة كافية لMicromonas (6.40٪) ، Chaetoceros spp. (4.44 ٪) ، سكريبسيلا SPP.( 2.44 ٪) ، وبروسنتروم spp. (1.28%). تم الكشف عن Pseudochattonella spp.، واحدة من أعلى المعادن السامة المسببة للHAB التشيلي، مع 0.52٪ من هذه العينة مياه البحر.
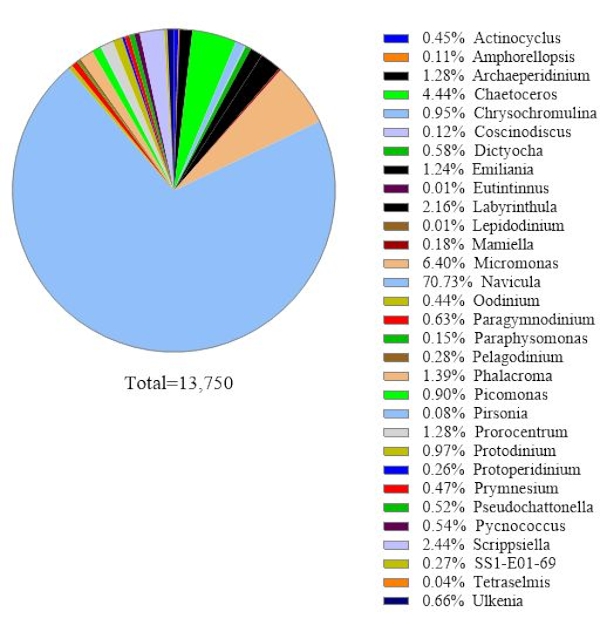
وللتحقق من موثوقية البيانات، قورنت أنواع الطحالب التي حددها التحليل الجيني 18S rRNA بالأنواع التي تم الحصول عليها عن طريق المجهر في عينة مياه البحر نفسها(الشكل 2). بما يتفق مع تحليل الجينات 18S rRNA ، أظهر المجهر أن النوع المهيمن كان Navicula spp. مع وفرة نسبية من 74.1٪ وبروسنتروم spp. (0.60٪) كنوع ثانوي. وعلى العكس من ذلك، لم يتم تحديد Heterocapsa spp. (9.04٪) الموثقة من المراقبة المجهرية من خلال تحليل الجينات 18S rRNA في هذه العينة. كان هناك 12.6٪ من خلايا العوالق النباتية الصغيرة حول غير معروف سجلت عن طريق المجهر. هذا يمكن أن يكون Micromonas، وفقا لنتائج 18S rRNA.
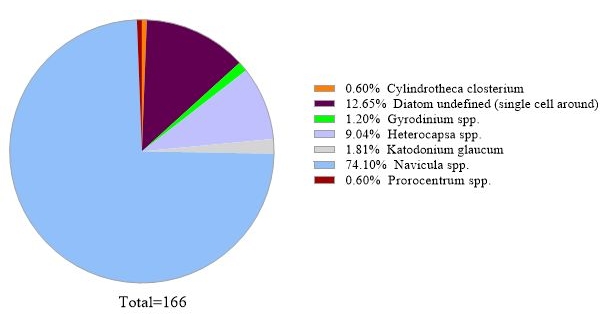
يستخدم البروتوكول تحليل ميتاباركودينج الجينات 16S rRNA لتحديد الأنواع البكتيرية في عينات مياه البحر. تظهر نتيجة تمثيلية في الشكل 3، حيث تم تحليل نفس مياه البحر المستخدمة في التحليل الجيني 18S rRNA مع تحليل جين 16S rRNA. وأظهرت النتيجة ما مجموعه 31758 قراءة مع أكثر من 30 نوعا بكتيريا في عينة مياه البحر. وينبغي توضيح أن عينة مياه البحر هذه قد مرت عبر أغشية المرشحات المترادف (1 ميكرومتر و0.2 ميكرومتر من أحجام المسام) لفصل البكتيريا الحية الحرة عن البكتيريا المرفقة. ثم عولجت الخلايا التي التقطها كل غشاء فلتر لاستخراج الحمض النووي، يليها تحليل الجينات 16S rRNA. تظهر النتيجة التمثيلية في الشكل 3 أنواع البكتيريا التي تم تحديدها من غشاء حجم المسام 0.2 ميكرومتر ، والتي تعرف بأنها البكتيريا الحية الحرة. وكانت البكتيريا الحية الحرة المهيمنة Amylibacter spp. مع وفرة نسبية من 20.02٪، تليها Clade Ia (13.53٪) وأليجيفوس spp. (7.06%). أما بقية الأنواع البكتيرية التي تم اكتشافها من عينة مياه البحر هذه فقد تم توزيعها بالتساوي نسبيا. ويمكن إجراء نفس التحليل للخلايا التي استولت عليها غشاء بحجم المسام 1 ميكرومتر كما كشف الأنواع إرفاق البكتيريا.
عندما يتم إجراء هذه المقايسات metabarcoding في النقاط الزمنية المجدولة خلال فترة دراسة معينة، يمكن تلخيص النتائج كتحليل سلسلة زمنية. إحدى الطرق للقيام بذلك هي رسم الوفرة النسبية لأنواع معينة من الطحالب والبكتيريا كدالة للوقت للعثور على نمط نمو فريد من نوعه. يظهر الشكل 4 مؤامرة من سلسلة زمنية تمثيلية من ألكسندريوم وبسودوشاتونيلا في ميتري، تشيلي. طريقة أخرى لتلخيص تحليل ميتاباركودينج سلسلة زمنية هو رسم جميع الطحالب والبكتيريا المحددة كدالة للوقت، مما يمثل التغير السكاني لمجموعات معينة من الكائنات الحية. يلخص الشكل 5 والشكل 6 الوفرة النسبية لجميع جنس البكتيريا وترتيبها، على التوالي، والتي يتم اكتشافها من مياه البحر في ميتري على مدى خمسة أشهر.
الجدول 1: أول محتوى مزيج رئيسي ل PCR: يعرض الجدول محتوى المزيج الرئيسي لكل رد فعل لتحليلات rRNA و 18S rRNA 16S. يتم سرد تسلسلات التمهيدي في الجدول 3. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 2: تسلسلات التمهيدي: يتم سرد التمهيديات لأول PCR لتحليلات 16S rRNA و 18S rRNA. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 3: دورات PCR: وترد الدورات الحرارية لأول PCR والثاني PCR. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 4: تسلسلات الفهارس: يتم سرد المؤشرات 1 (i7) و index 2 (i5) التمهيدية التي سيتم استخدامها ل PCR الثاني. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 5: مثال على تحديد المواقع في المؤشر 1 والمؤشر 2: للحد من الخطأ، يجب وضع التمهيديات مؤشر في الموقف أولا، ويتم نقل aliquot من كل لوحة 96 جيدا باستخدام ماصة متعددة القنوات. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 6: مثال على ورقة العينة: قبل التسلسل، يجب إنشاء ورقة عينة المطابقة للمحولات الفهرس 1 و فهرس 2. الرجاء الضغط هنا لتحميل هذا الجدول.
الشكل 1:النتيجة التمثيلية لتحليل التكويد فوق الريبي 18S rRNA: تم تحديد أنواع الطحالب الموجودة في عينة مياه البحر التي تم جمعها من ميتري، لوس لاغوس، تشيلي في 19 فبراير 2019، من خلال 18S rRNA metabarcoding المقايسة. تم التخلص من التسلسلات المخصصة "غير معروفة" ، وتم رسم الوفرة النسبية لكل نوع تم تحديده. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2:النتيجة التمثيلية للتحليل المجهري: تم تحديد أنواع الطحالب من عينة مياه من ميتري، لوس لاغوس، تشيلي في 19 فبراير 2019، عن طريق المجهر. تم حساب كمية كل نوع يدويا ورسمها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
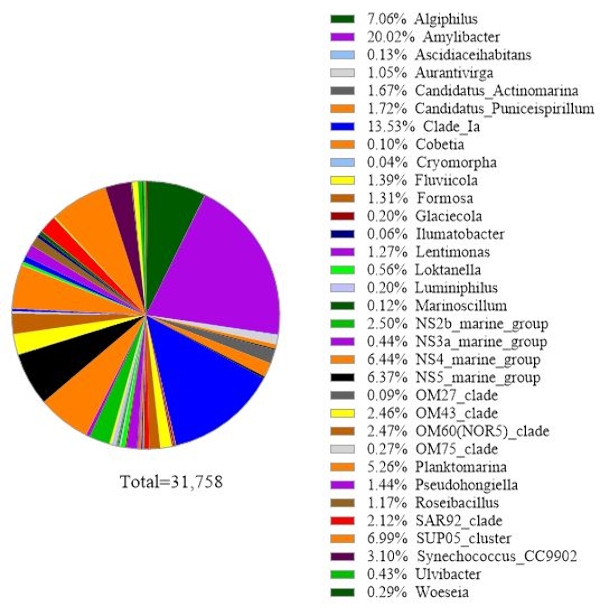
الشكل 3:النتيجة التمثيلية لتحليل التكويد فوق التكويد 16S rRNA: تم تحديد الأنواع البكتيرية الموجودة في عينة مياه من ميتري، لوس لاغوس، تشيلي في 19 فبراير 2019، من خلال فحص 16S rRNA metabarcoding. وقد تم رسم الوفرة النسبية لكل نوع تم تحديده. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
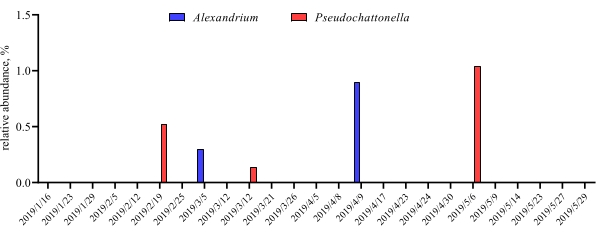
الشكل 4: ممثل الوقت سلسلة مؤامرة من الكسندريوم SPP. وSpp Pseudochattonella. التي تم الحصول عليها من 18S rRNA metabarcodingin Metri, شيلي: الشكل طبعها من Yarimizu وآخرون9. تم رصد نوعي الطحالب السامة ، ألكسندريوم وبسودوشاتونيلا بشكل انتقائي من خلال تحليل 18S rRNA مع مرور الوقت ، وتم رسم الوفرة النسبية كدالة للنقطة الزمنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
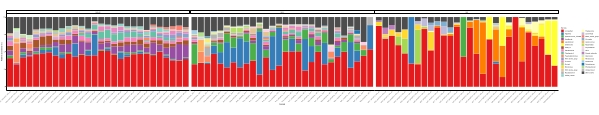
الشكل 5: ممثل جنس الوقت سلسلة مؤامرة تم الحصول عليها من 16S rRNA و 18S rRNA metabarcoding: جميع جنس بكتيرية ويوكاريوتيك المحددة في مياه ميتري, شيلي, رصدها على مدى خمسة أشهر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
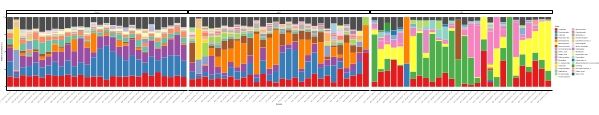
الشكل 6:مؤامرة ترتيب الممثل سلسلة زمنية تم الحصول عليها من 16S rRNA و 18S rRNA metabarcoding: جميع الأوامر البكتيرية و eukaryotic المحددة في مياه ميتري، شيلي، ورصدت على مدى خمسة أشهر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول S1 والجدول S2:
الجدول S1: البيانات الأولية للأرقام 5 والشكل 6. الجدول S2: نتيجة فحص مراقبة الجودة على البيانات الخام من الشكل 5 والشكل 6. يرجى الضغط هنا لتحميل هذه الجداول.
Discussion
وقد نجح هذا البروتوكول في إجراء تحليل للميتاباركودينغ الجيني 18S rRNA و 16S rRNA لتحديد الأنواع الطحالب والبكتيرية في عينات مياه البحر لرصد HABs التشيلية. وكانت الطحالب المهيمنة وبعض الطحالب الطفيفة التي اكتشفها هذا البروتوكول متسقة مع تلك التي تم الحصول عليها عن طريق المجهر، مما يؤكد موثوقية البروتوكول. تسليط الضوء على البروتوكول هو أن التحليل كشف الكسندريوم spp. وSPP Pseudochattonella., اثنين من الأنواع المسببة للمشاكل HAB في جنوب شيلي, من مياه البحر من ميتري حتى في وفرة منخفضة. خصوصا ، (بسودوشاتونيلا سي بي) هي الأنواع الصعبة لتحديد تحت المجهر لأن الخلايا الصغيرة وتمزق بسهولة تحت الضوء أو استخدام المثبتات27،28. يمكن أن يوفر الميتاباركودينج معلومات عن أنواع الطحالب التي نادرا ما تكون موجودة في عينات مياه البحر التي لا يمكن للفحص المجهري تحديدها. كما اكتشف البروتوكول أكثر من 30 نوعا بكتيريا. على الرغم من أن كيفية ارتباط هذه البكتيريا بنمو الطحالب غير معروفة في هذه المرحلة ، فإن جمع البيانات الضخمة للأنواع البكتيرية الطحالب في تحليل السلسلة الزمنية سيوفر مثل هذه الاكتشافات الهامة. وبالتالي، فإن إضافة تحليل التكويد فوق التلوي إلى برامج رصد HAB التشيلية التقليدية ستعزز بلا شك كفاءة رصد HAB الحالية. في الواقع، يمكن أن يكون هذا البروتوكول البصري لتحليل الميتاباركودينج مفيدا ليس فقط لرصد البكتيريا الطحالب في المياه التشيلية ولكن أيضا لبرامج مراقبة السواحل في المناطق الأخرى المتضررة من HAB في جميع أنحاء العالم.
على الرغم من أن هذا البروتوكول يوفر المزايا المذكورة أعلاه، إلا أنه ينبغي مناقشة عيوب الأسلوب. وكما رأينا في البروتوكول البصري، فإن طريقة التكويد الفوقي تستغرق وقتا طويلا ومعقدة، وتتطلب آلات وأجهزة كاشفة باهظة الثمن. يجب تدريب موظفي المختبر تدريبا خاصا، وإلا فإنه سيضيع المواد والعمالة والوقت. بالإضافة إلى ذلك ، يجب إقران الكشف عن الطحالب عن طريق التنظير المجهري للتحقق من أن نفس النوع المهيمن يتم تحديده من الطريقتين المتعامدة29. المجهر هو أداة غير الغازية، في معظمها، لتحديد أنواع الطحالب، وهذا يعني أنه من الصعب ارتكاب الأخطاء عندما يكون لأنواع الطحالب أشكال فريدة وواضحة. وبطبيعة الحال، يمكن أن يحدث خطأ بشري إذا كان هذا النوع من الأشكال مشابهة جدا لبعضهم البعض. من ناحية أخرى ، بما أن تحليل ميتاباركودينج يتطلب خطوات متعددة ، فإنه يزيد من الأخطاء بشكل طبيعي. يمكن أن تكون عينة مختلطة ، إضافة كاشف خاطئ ، أو فقدان بعض الإجراءات. لذلك ، من الأهمية بمكان مقارنة نتائج ميتاباركودينج مع تلك التي تم الحصول عليها عن طريق المجهر. وأخيرا، لا ينطبق البروتوكول إلا من الناحية النوعية، ويجب حساب النتائج حسب الوفرة النسبية. وكما ذكر لامب وآخرون في عام 2019، فإن التعريف الحالي كلأداء الكمي لا يزال محدودا، ويلزم إجراء أبحاث إضافية قبل استخدام الميتاباركودينج بثقة للتطبيقات الكمية30.
تم تحسين هذا البروتوكول ل 140 - 170 عينة لكل تشغيل من دليل إعداد مكتبة التسلسل الميتاجنومي 16S الصادر عن شركة Illumina Inc. تم اختبار البروتوكول الأمثل عدة مرات وتعديله بشكل أكبر لإصدار هذا الإصدار النهائي. لذلك، فمن المستحسن جدا أن تتبع كل خطوة على وجه التحديد. والجزء الأكثر أهمية في البروتوكول هو أن هناك حاجة إلى مزيد من الحذر لتجنب تلوث العينة. يجب تنظيف المواسير وغطاء محرك السيارة تدفق صفح مع 70٪ من الكحول والأشعة فوق البنفسجية التعرض في جميع الأوقات، وينبغي أن تكون المواد القابلة للتعقيم autoclaved. وينبغي تخفيف المبرمجين والكواشف مباشرة من المخزون في كل شوط جديد، أو إعادة استخدام الكواشف والتعرض لعدة تمييعات يمكن أن يكون سببا للتلوث العينة. يحدد البروتوكول متى يمكن إجراء العملية خارج غطاء تدفق صفح. ما لم يكن خلاف ذلك، ينبغي أن تعامل عينات في غطاء محرك السيارة تدفق صفح تنظيفها. عند التعامل مع شرائط متعددة 8 أنبوب في وقت واحد، فمن المستحسن للعمل على الشريط الأول 8 أنبوب وسقف قبل الانتقال إلى قطاع 8 أنبوب المقبل. ترك الغطاء مفتوحا لفترة طويلة يمكن أن يسبب تلوث العينة كما 16S و 18S الجينات rRNA هي في كل مكان للغاية في المناطق المحيطة بها. يجب اتباع الوقت المذكور، مثل وقت الخلط ووقت الحضانة، كما هو موضح بالضبط لأنه تم اختيار أفضل مدة لكل خطوة استنادا إلى اختبارات التشغيل المتعددة. فالوقت الزائد أو غير الكافي يمكن، على سبيل المثال، أن يقلل من غلة العينة. وينبغي وقف العملية فقط في الجزء الذي يقول البروتوكول إنه يمكن أن يتوقف. ومن الأهمية بمكان أن تكون هناك سيطرة سلبية لأنها تؤكد أن النتائج الإيجابية ليست إيجابيات زائفة مصطنعة. وأخيرا، يوصى بشدة بالتخطيط للأيام لأنها تتطلب خمسة أيام على الأقل لمعالجة جميع الخطوات، ولا يمكن إيقاف بعض الأجزاء حتى علامة التوقف التالية.
ويلاحظ هنا بإيجاز تقييد التعيين التصنيفي للبيانات المتسلسلة. يتم تحديث تسلسل النيوكليوتيدات المكتشفة حديثا للأنواع البكتيرية والطحالب في بنك البيانات يوميا. في حين يتم تسجيل الأنواع الطحالب والبكتيرية المدروسة بشكل موثوق ، هناك أيضا العديد من التسلسلات لأنواع غير معروفة تم تحديثها في بنك البيانات. ويشير التقرير إلى أن حل تسلسلات النيوكليوتيدات المسجلة لا يكفي دائما لتحديد الأنواع ولكن فقط لتحديد جنسها. وهكذا، يجب أن يتم تحديد الأنواع المجهرية بشكل متعامد. إن إنشاء خط أنابيب مفتوح الوصول لهذا العمل له ميزة كبيرة في التعامل مع مجموعة كبيرة من البيانات التسلسلية في وقت واحد والتحقيق بكفاءة عند حدوث خطأ. بالإضافة إلى ذلك، إخراج DADA2 في ملف نص أو csv، مما يجعل من السهل إجراء مزيد من التحليل الإحصائي. من ناحية أخرى، مطلوب ملقم كبير لتنفيذ تعيينات التصنيف خاصة عندما تكون مجموعة بيانات كبيرة. لإعداد خط الأنابيب ، هناك حاجة إلى المهندسين لإعداد خط الأنابيب ، ويجب على المهنيين فهم المعلمات والتشغيل ولينكس والمعلوماتية الحيوية.
وبصرف النظر عن النطاق كأداة لرصد HAB، يمكن توسيع استخدام هذا البروتوكول لأغراض البحث الاستقصائي. على سبيل المثال، هناك مناقشات مستمرة بين الحكومة التشيلية والصيادين المحليين جنبا إلى جنب مع جمعيات السلام البيئي بشأن زيادة عدد HAB المحلية31،32. وتزعم الحكومة أن ذلك يرجع إلى ظاهرة طبيعية مثل الاحترار العالمي والنينيو، في حين تدعي الأطراف اللاحقة أن تربية السلمون المائية هي السبب. السلمون ليس من الأنواع الأصلية في شيلي ولم يكن في المياه التشيلية قبل نصف قرن. الحكومة التشيلية في ذلك الوقت تهدف إلى تنمية الاقتصاد وخلق فرص العمل للمناطق الفقيرة من خلال تطوير الأعمال سمك السلمون33. مع تدخل من الخارج من أجل الربح الرأسمالي، حققت تشيلي نجاحا كبيرا في تنمية الاستزراع المائي على غرار القلم، وارتفع عدد سمك السلمون بشكل ملحوظ في العقود القليلة الماضية31و32و33. وفي وقت لاحق، تم إلقاء كمية كبيرة من الغذاء لسمك السلمون في البحر، مما دفع السكان المحليين إلى الشك في أن استزراع السلمون المائي هو السبب في تواتر HABs المحلية31،32. الحقيقة غير معروفة الآن، ولكن يجب فهمها في نهاية المطاف حتى يمكن وضع استراتيجيات لحماية البيئة البحرية المحلية والاقتصاد وصحة الإنسان من HABs. وقد يسهم التحليل الجزيئي القائم على العلاقة المحلية بين الطحالب والبكتيريا في توضيح خطوة إلى الأمام لمثل هذا الموضوع. على سبيل المثال، يمكن لهذه التقنية البحث في الأنواع الطحالب والبكتيرية التي لم تكن موجودة في المنطقة المحيطية المستهدفة من قبل ولكنها زادت بشكل كبير في السنوات الأخيرة، وهو ما يشبه إلى حد ما الدراسة التي أجراها ساكاي وآخرون لاكتشاف مجموعة غير مسجلة من السلمندر ياماتو(هينوبيوس فاندنبورغهي)من قبل نظام المعلومات الجغرافية وتحليل eDNA34. لذلك، خارج أداة مراقبة HAB، هذا البروتوكول metabarcoding لديه الاستخدام المحتمل لآفاق أخرى.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود تضارب في المصالح. ولم يكن للممولين أي دور في تصميم الدراسة، في جمع البيانات وتحليلها وتفسيرها؛ في كتابة المخطوطة، أو في قرار نشر النتائج.
Acknowledgements
وقد دعمت هذه الدراسة منحة (JPMJSA1705) لدراسة عن شراكة بحوث العلوم والتكنولوجيا من أجل التنمية المستدامة ورصد الطحالب في شيلي (SATREPS-MACH). نشكر الدكتورة ساندرا ريوس (جامعة لوس لاغوس) على السماح لنا باستخدام مقطع فيلم. نشكر نيل أندرو هولاند على التدقيق الدؤوب للمخطوطة. ونعرب عن خالص تقديرنا لأعضاء فريق المختبر في CREAN-IFOP في بويرتو مونت، شيلي، لتقديم المشورة لنا بشأن تحديد العوالق النباتية.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL single tube | ThermoFisher | Q32856 | sterile |
| 1.5 mL tubes | ThermoFisher | 2150N | sterile |
| 8-strip 0.2 mL PCR tubes and flat cap | ThermoFisher | AB0451 & 4323032 | sterile |
| 96-well 0.2 mL PCR plate | ThermoFisher | N8010560 | |
| AccuRuler 100 bp DNA Ladder | MaestroGen | 02001-500 | |
| Chelex 100 Chelating Resin | Bio-Rad | 1432832 | |
| Chemical Duty Vacuum Pressure Pump | MilliporeSigma | WP6122050 | |
| D1000 Reagents | Agilent Technologies | 5067-5583 | |
| D1000 sample buffer | Agilent Technologies | 5067-5602 | |
| DNA loading dye (Blue/Orange Loading Dye 6X) | Promega | G1881 | |
| Ethanol Molecular Biology Grade | E7023 | Merck KGaA | |
| Filtration device | ThermoFisher | 09-740-36H, 09-740-23E | |
| Fluorescent DNA concentration measurement kit (Qubit dsDNA HS Assay kit) | Thermo Fisher Scientific | Q32851 | |
| Fluorometer (Qubit4 Fluorometer) | ThermoFisher | Q33238 | |
| Fragment analysis verification matrix (D1000 ScreenTape) | Agilent Technologies | 5067-5582 | |
| Fragment Analyzer (Agilent Tapestation 4150) | Agilent | G2992AA | |
| GelRed Nucleic Acid Gel Stain | Biotium | 41002 | |
| Generic bench vortexer (Vortex Genie 2) | Scientific Industries | SI-0236 | |
| Heat block | |||
| High performance sequencing-grade DNA polymerase (KAPA HiFi Hotstart ReadyMix), 2X | Roche | KK2602 | |
| HT1 Hybridization buffer | Illumina | 20015892 | |
| Illumina Nextera XT v2 Index Kit set A, B, C and D | Illumina | FC-131-2001, -2002, -2003, -2004 | |
| Laminar hood cabinet | Biobase Co. | Biobase PCR-800 PCR Cabinet | |
| Loading tips (Specific for Agilent TapeStation systems) | Agilent Technologies | 5067-5598 | |
| Magnetic beads DNA cleanup system (ProNex® Size-Selective Purification System) | Promega | NG2002 | |
| Magnetic stand for 96 wells (Magnetic Stand-96) | ThermoFisher | AM10027 | |
| Micro-seal film for 96-well plate | ThermoFisher | 4311971 | sterile |
| MiSeq Reagent Kit v3 | Illumina | MS-102-3003 | includes pre-filled, ready-to-use reagent cartridges. |
| MiSeq system | Illumina | SY-410-1003 | includes pre-installed software |
| Molecular grade nuclease-free water | Integrated DNA Technologies | 11-05-01-04 | |
| Molecular grade sodium hydroxide (NaOH) 1M | Merck KGaA | 1091371000 | |
| Multichannel pipettes | Not specified | Not specified | |
| Multi-Purpose Agarose | Cleaver Scientific | CSL-AG500 | |
| Ow D2 Wide-Gel Electrophoresis System | ThermoFisher | D2 | |
| Ow EC-105 Compact Power Supply | ThermoFisher | 105ECA-115 | |
| Pellet Pestle— Cordless Motor | ThermoFisher | K749540-0000 | |
| PhiX control Kit v3 | Illumina | FC-110-300 | ready-to-use control library for Illumina sequencing |
| Pipette tips | Not specified | Not specified | sterile |
| Pipettes | Not specified | Not specified | 2, 10, 20, 100, 1000 μL |
| SterivexTM GP 0.22 μm filter unit | MilliporeSigma | SVGP01050 | |
| Tabletop centrifuge | Eppendorf 5427R Centrifuge | Eppendorf AG | |
| TBE buffer | ThermoFisher | B52 | |
| TE buffer (pH 8.0) | ThermoFisher | AM9849 | |
| Terr PCR Direct FFPE Kit | Takara Bio USA | 639284 | includes 2X Terra PCR Direct Buffer |
| Terra PCR Direct Polymerase Mix, 1.25 U/μL | Takara Bio USA | 639271 | High performance Inhibitor-tolerant DNA polymerase |
| ThermalCycler (MiniAMP Plus Thermal Cycler) | ThermoFisher | A37835 | |
| TransIlluminator and image capture system | Analytik Jena, AG | GelDoc-ItTS2 Imager | |
| Whatman 1.0 m pore-sized membrane | MilliporeSigma | WHA111110 |
References
- Hallegraeff, G., Enevoldsen, H., Zingone, A. Global harmful algal bloom status reporting. Harmful Algae. 102, 101992(2021).
- Anderson, D. M. Red Tides. Scientific American. 271 (2), 52-58 (1994).
- Sanseverino, I., Conduto, A. D. S., Pozzoli, L., Dobricic, S., Lettieri, T. Algal Bloom and its Economic Impact. , Publications Office of the European Union. (2016).
- Molinet, C., Niklitschek, E., Seguel, M., Díaz, P. Trends of natural accumulation and detoxification of paralytic shellfish poison in two bivalves from the Norwest Patagonian inland sea. Revista de Biologia Marina Y Oceanografia. 45, 195-204 (2010).
- Mardones, J., Clement, A., Rojas, X., Aparicio, C. Alexandrium catenella during 2009 in Chilean waters, and recent expansion to coastal ocean. Harmful Algae News. 41, 8-9 (2010).
- Alvarez, G., et al. Paralytic shellfish toxins in surf clams Mesodesma donacium during a large bloom of Alexandrium catenella dinoflagellates associated to an intense shellfish mass mortality. Toxins (Basel). 11 (4), (2019).
- Clément, A., et al. Exceptional summer conditions and HABs of Pseudochattonella in Southern Chile create record impacts on salmon farms. Harmful Algae News. 53, 1-3 (2016).
- Trainer, V. L., et al. Pelagic harmful algal blooms and climate change: Lessons from nature's experiments with extremes. Harmful Algae. 91, 101591(2020).
- Yarimizu, K., et al. Protocols for monitoring harmful algal blooms for sustainable aquaculture and coastal fisheries in Chile. International Journal of Environmental Research and Public Health. 17 (20), (2020).
- Roegner, G. C., Hickey, B. M., Newton, J. A., Shanks, A. L., Armstrong, D. A. Wind-induced plume and bloom intrusions into Willapa Bay, Washington. Limnology & Oceanography. 47 (4), 1033-1042 (2002).
- Tweddle, J. F., et al. Relationships among upwelling, phytoplankton blooms, and phycotoxins in coastal Oregon shellfish. Marine Ecology Progress Series. 405, 131-145 (2010).
- Glibert, P. M., Anderson, D. M., Gentien, P., Graneli, E., Sellner, K. G. The global complex phenomena of harmful algae blooms. Oceanography. 18 (2), 130-141 (2005).
- Paredes-Mella, J., Varela, D., Fernández, P., Espinoza-González, O. Growth performance of Alexandrium catenella from the Chilean fjords under different environmental drivers: Plasticity as a response to a highly variable environment. Journal of Plankton Research. 42 (2), 119-134 (2020).
- Azam, F., Malfatti, F. Microbial structuring of marine ecosystems. Nature Reviews Microbiology. 5, 782-791 (2007).
- Amin, S. A., et al. Interaction and signaling between a cosmopolitan phytoplankton and associated bacteria. Nature. 522, 98-101 (2015).
- Berdalet, E., et al. Marine harmful algal blooms, human health, and wellbeing: Challenges and opportunities in the 21st century. Journal of Marine Biology Association. 2015, U. K. 1-31 (2015).
- Ramanan, R., Kim, B. -H., Cho, D. -H., Oh, H. -M., Kim, H. -S. Algae-bacteria interactions: Evolution, ecology, and emerging applications. Biotechnology Advances. 34 (1), 14-29 (2016).
- Seymour, J. R., Amin, S. A., Raina, J. B., Stocker, R. Zooming in on the phycosphere: The ecological interface for phytoplankton-bacteria relationships. Nature Reviews Microbiology. 2, 17065(2017).
- Maruyama, F., et al. 16S and 18S Metabarcoding analysis for Chilean coastal waters harmful algal blooms. protocol.io. , (2020).
- Tanabe, A. S., et al. Comparative study of the validity of three regions of the 18S-rRNA gene for massively parallel sequencing-based monitoring of the planktonic eukaryote community. Molecular Ecology Resources. 16, 402-414 (2016).
- Nishitani, G., et al. Multiple plastids collected by the Dinoflagellate Dinophysis mitra through Kleptoplastidy. Applied and Environmental Microbiology. 78 (3), 813-821 (2012).
- Klindworth, A., et al. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies. Nucleic Acids Research. 41 (1), 1(2013).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- R, R Team DCore. R: A language and environment for statistical computing. R Foundation for Statistical Computing. , Vienna, Austria. Available from: http://www.R-project.org (2007).
- McMurdie, P. J., Holmes, S. phyloseq: An R Package for Reproducible Interactive Analysis and Graphics of Microbiome Census Data. PLoS One. 8 (4), 61217(2013).
- Dixon, P. VEGAN, a package of R functions for community ecology. Journal of Vegetation Science. 14 (6), 927-930 (2003).
- Dittami, S. M., Riisberg, I., Edvardsen, B. Molecular probes for the detection and identification of ichthyotoxic marine microalgae of the genus Pseudochattonella (Dictyochophyceae, Ochrophyta). Environmental Science and Pollution Research. 20 (10), 6824-6837 (2013).
- Mardones, J. I., et al. Salinity-growth response and ichthyotoxic potency of the Chilean Pseudochattonella verruculosa. Frontiers in Marine Science. 6 (24), (2019).
- Santi, I., Kasapidis, P., Karakassis, I., Pitta, P. A comparison of DNA metabarcoding and microscopy methodologies for the study of aquatic microbial eukaryotes. Diversity. 13 (5), 180(2021).
- Lamb, P. D., et al. How quantitative is metabarcoding: A meta-analytical approach. Molecular Ecology. 28 (2), 420-430 (2019).
- Mascareño, A., et al. Controversies in social-ecological systems: lessons from a major red tide crisis on Chiloe Island, Chile. Ecology and Society. 23, (2018).
- Armijo, J., Oerder, V., Auger, P. -A., Bravo, A., Molina, E. The 2016 red tide crisis in southern Chile: Possible influence of the mass oceanic dumping of dead salmons. Marine Pollution Bulletin. 150, 110603(2020).
- Swanson, H. A. Caught in Comparisons: Japanese Salmon in an Uneven World. , University of California, Santa Cruz. Doctor of Phylosophy thesis (2013).
- Sakai, Y., et al. Discovery of an unrecorded population of Yamato salamander (Hynobius vandenburghi) by GIS and eDNA analysis. Environmental DNA. 1 (3), 281-289 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved