Method Article
Um procedimento padronizado para monitorar flores algas nocivas no Chile por análise de metabarco
Neste Artigo
Resumo
Este protocolo introduz etapas da análise de metabarcoco, visando genes de rRNA 16S e 18S rRNA, para monitoramento de flores algas nocivas e seu microbioma associado em amostras de água do mar. É uma poderosa ferramenta molecular, mas requer vários procedimentos, que são explicados visualmente passo a passo.
Resumo
O monitoramento de algas nocivas (HABs) tem sido implementado em todo o mundo, e o Chile, um país famoso por sua pesca e aquicultura, tem usado intensamente análises microscópicas e toxinas por décadas para esse fim. Métodos biológicos moleculares, como sequenciamento de DNA de alto rendimento e abordagens baseadas em montagem bacteriana, estão apenas começando a ser introduzidos no monitoramento chileno de HAB, e os procedimentos ainda não foram padronizados. Aqui, são introduzidas análises de metabar codificação de rRNA de 16S e 18S para monitoramento de HABs chilenos. De acordo com uma hipótese recente, a associação mutualista alga-bacteriana desempenha uma relação sinérgica crítica ou antagônica, contabilizando a iniciação, manutenção e regressão da floração. Assim, o monitoramento do HAB a partir de perspectivas algas-bacterianas pode fornecer uma compreensão mais ampla dos mecanismos de HAB e a base para o alerta precoce. A análise de metabarco é uma das ferramentas moleculares mais adequadas para este fim, pois pode detectar informações taxonômicas algal-bacterianas maciças em uma amostra. Os procedimentos visuais de amostragem para análise de metabarcocosinufem instruções específicas, visando reduzir erros e coleta de dados confiáveis.
Introdução
Muitas espécies de fitoplâncton marinho são conhecidas por produzir toxinas endógenas, e quando essas espécies se acumulam em número suficiente, elas são prejudiciais ao ambiente marinho. Tais Flores algas nocivas (HABs) são observadas hoje nas costas da maioria dos continentes do mundo1. Fitoplâncton tóxico se acumula pela primeira vez em tecidos bivalve, levando a doenças e morte em níveis tróficos mais altos de organismos, incluindo humanos, após a digestão. Posteriormente, esses eventos trazem graves implicações para a economia local, a socioeconomia e a saúde pública2. Estima-se que os danos à economia global causados pelos HABs sejam de milhões a bilhões de dólares a cada ano3. O Chile é um dos muitos países que sofrem de HABs frequentes.
O Chile é um país de terras longas, que se estende por mais de 4.300 km ao norte e ao sul. A terra ocidental alongada enfrenta o Oceano Pacífico, o que naturalmente aumenta as chances do Chile experimentar HABs. Especialmente no sul do Chile, existem muitas aquiculturas de salmão mundialmente famosas, e toda vez que um HAB ocorre na região, as toxinas algas resultam em salmão de criação maciça adoecendo e morrendo4,5,6. No Chile, o ano em que o HAB mais atingiu a economia foi 2016, com um prejuízo anual estimado em US$ 800 milhões7,8. As espécies de algas tóxicas causais variam de acordo com o ano e a localização. Para o caso de 2016, um complexo de Alexandrium catanella e Pseudochattonella verruclosa causou um HAB generalizado na maior parte da costa sul do Chile7,8. O HAB mais recente no Chile ocorreu com a espécie de algas causais de Heterosigma Akashiwo em março de 2021 em Camanchaca, localizada no sul do Chile, onde a área tem uma grande fazenda de salmão.
O Chile vem realizando monitoramento costeiro há muitos anos usando dois métodos principais; observando a água do mar com microscópios para identificar espécies de algas tóxicas regularmente e medindo os níveis de toxinas em mariscos por ensaios bioquímicos9. A detecção precoce de algas tóxicas e os níveis de toxinas em mariscos não previnem HABs; no entanto, essas análises podem desencadear contramedidas imediatas e reduzir danos às comunidades locais. Para fortalecer ainda mais a eficácia dessa estratégia, um método analítico de base molecular foi recentemente adicionado ao nosso programa convencional de monitoramento de HAB chileno para detectar algas e comunidades bacterianas relacionadas em amostras de água do mar. Especificamente, foi escolhido um método de sequenciamento paralelo maciço usando metabar codificação que tem como alvo os genes rRNA e 18S rRNA 16S. Embora esta técnica exija procedimentos complicados e máquinas e reagentes caros, é uma tecnologia avançada que pode detectar milhares de algas e bactérias genera/espécies presentes em uma amostra de água do mar ao mesmo tempo.
Especula-se que as causas do HAB sejam diversas, como temperatura e estação, mas é impossível generalizá-las. Isso porque as espécies e frequências hab dependem da região e das condições espátulas, envolvendo fenômenos naturais como singularidade geográfica, mistura de nutrientes e escoamento de elementos da terra devido a errosion2,10,11,12. Além disso, fatores artificiais como a eutrofização influenciam as HABs locais12,13. Devido ao complexo multifator, não é fácil fazer uma previsão precisa de HAB. Nos últimos anos, há uma visão de que populações bacterianas específicas podem estar relacionadas ao desenvolvimento de HABs como um dos fatores, e pesquisas para apoiar essa hipótese têm sido cada vez mais evidentes14,15,16,17,18. As técnicas de biologia molecular são geralmente usadas para estudar o conjunto bacteriano; no entanto, esse método padronizado ainda não foi estabelecido no monitoramento do HAB chileno9. Para estudar a associação algas-bacterianas com os HABs, é imprescindível realizar simultaneamente análises de metabarcote para os atuais programas de monitoramento costeiro chilenos. Assim, este protocolo apresenta visualmente nosso programa de monitoramento do HAB chileno, com foco em um procedimento passo a passo para analisar a detecção de algas e espécies de bactérias em amostras de água do mar usando análise de metabarco.
O protocolo completo que descreve nosso programa de monitoramento hab chileno está disponível em Yarimizu et al.9. Inclui os procedimentos de amostragem de água do mar, detecção microscópica de espécies algas, detecção de genes algas-bacterianas, análise de pigmentos, coleta de dados meteorológicos e ensaios de propriedades físicas e químicas da água. O protocolo stepwise de análise de metabar codificação de rRNA e 18S rRNA 16S para detecção de espécies algas e bacterianas está disponível como uma pré-impressão19. Este protocolo demonstra particularmente as etapas de análise de metabarcoco, uma vez que é a parte mais complicada e o destaque do nosso programa de monitoramento HAB. Este protocolo também inclui a introdução do programa e a detecção de microscopia de espécies algas. Ao analisar espécies algas por metabar codificação, é crucial realizar simultaneamente microscopia para verificar os resultados dos dois métodos. Este protocolo não inclui como usar software para atribuição de taxonomia, mas a recomendação do banco de dados é brevemente declarada no final da seção a seguir.
Protocolo
1. Coleta e pré-tratamento de amostras
- Colete aproximadamente 3 L de amostra de água do local alvo.
- Filtrar 1 L de amostra de água para análise de rRNA 16S através de uma filtragem tandem (1 μm e 0,2 μm de membrana do tamanho de poros) para separar bactérias de vida livre e anexadas.
- Filtre outros 1 L de amostra de água para análise de 18S-rRNA (detecção de fitoplâncton) através de uma única filtragem com uma membrana de 0,2 μm.
NOTA: A filtragem da amostra de água deve ser concluída dentro de 12 horas após a amostragem. - Corte a membrana filtrada ao meio com uma tesoura cirúrgica estéril e enrole-a com papel alumínio. Armazene a -20 °C por até 1 mês ou proceda para a próxima etapa.
- Extrair DNA com o método Chelex como descrito9. Armazenar a -20 °C por até 1 mês.
2. Análise de microscópio
- Transfira 1 mL da amostra de água por uma pipeta para um deslizamento de grade de 1 mL.
- Observe a amostra sob um microscópio.
- Registros de nomes e quantidade de espécies de fitoplâncton.
3. Análise de metabar codificação de rRNA de 16S e 18S
NOTA: Este processo consiste em sete seções: preparação, primeira geração de amplicon pcr, primeira limpeza de amplicon, indexação por segundo PCR, segunda verificação e limpeza de amplicon pcr, ajuste de concentração de DNA e desnaturação e sequenciamento de DNA. Todo o processo leva no mínimo 5 dias (40 h) por um pessoal de laboratório experiente. Consulte a Tabela de Materiais para números de produtos e manufaturas.
- Preparação
- Pipetas limpas e armário de capô laminar com 70% de etanol seguido de exposição UV por 30 min com frequência. Esterilizar materiais a serem utilizados.
- Descongele amostras de DNA à temperatura ambiente, centrífuga a 100 x g por 2 min, e transfira 100 μL de cada amostra sobrenante para tiras de 8 tubos.
- Primeira geração de amplicon PCR
NOTA: Realize os seguintes procedimentos em um armário de capô laminar. Diluir sempre os primers de 1 μM até a concentração de destino com água de grau PCR para evitar contaminação do primer.- Prepare o primeiro mix mestre pcr em um tubo estéril de 1,5 mL para reações(Tabela 1, Tabela 2).
- Alíquota de 22,5 μL da mistura mestre em uma tira de 8 tubos e adicione 2,5 μL de amostra de DNA. Use 2,5 μL de água de grau PCR para controle negativo.
- Execute o primeiro ciclo PCR(Tabela 3).
- Prepare 100 mL de gel Agarose-TBE de 2% contendo 10 μL de 1x mancha de gel de ácido nucleico.
- Carregue uma mistura de 1,5 μL de corante de carregamento de DNA 1x e 4 μL de produto PCR no gel de agarose. Além disso, carregue 100 bp escada de DNA no gel.
- Realize eletroforese a 100 V por 30 min.
- Certifique-se de que há uma banda com alcance de 500-600 bp sob uma captura de imagem de luz UV. A banda primer-dimer é de 80 bp.
NOTA: As amostras de água marinha contêm inibidores de PCR. Amplicons ausentes às vezes podem ser resolvidos diluindo amostras 1:100 ou 1:1000 com água de grau PCR. - Armazene os primeiros produtos PCR a -20 °C até o próximo passo.
ATENÇÃO: Não exceda uma semana de armazenamento.
- Primeira limpeza de amplicon PCR
NOTA: Esta seção pode ser realizada fora de um armário de capô laminar.- Use o sistema de limpeza de DNA de contas magnéticas para remover resíduos de reação pcr, incluindo produtos de primer-dimer.
- Transfira 20 μL de cada primeiro produto PCR limpo para uma nova placa de 96 poços. Sele a placa com um filme de micro-vedação. Armazene a -20 °C até o próximo passo.
ATENÇÃO: Não exceda mais de uma semana de armazenamento.
- Indexação por segundo PCR
NOTA: Nesta seção, os primeiros produtos PCR purificados serão amplificados com várias combinações de primer de índice.- Diluir todos os primers do Índice 1 e do Índice2 (Tabela 4) para 1 μM com água de grau PCR em 8 tiras pcr de tubo colocadas em um armário de capô laminar.
NOTA: Os passos a partir de agora nesta seção podem ser executados fora de um gabinete de capô laminar, pois os primers de índice são específicos para o primeiro adaptador de reações PCR. - Posição Índice 1 primer em uma linha horizontal Indicador 2 primers em uma linha vertical (Tabela 5).
- Em uma nova placa de 96 poços, adicione 12,5 μL de formulação pronta para partida a quente para cada poço.
- Adicione 2,5 μL de cada primer de índice (1 μM) a cada um, bem como na Tabela 4 usando uma pipeta multicanal.
- Adicione 7,5 μL do primeiro produto PCR purificado.
- Misture suavemente por pipetting para cima e para baixo 10 vezes. Cubra a placa com um filme de micro-vedação.
- Execute o segundo ciclo PCR(Tabela 3).
- Mantenha a placa a -20 °C.
ATENÇÃO: Não exceda uma semana de armazenamento.
- Diluir todos os primers do Índice 1 e do Índice2 (Tabela 4) para 1 μM com água de grau PCR em 8 tiras pcr de tubo colocadas em um armário de capô laminar.
- Segunda verificação e limpeza de amplicon pcr
- Use um analisador de fragmentos e reagente associado. Vórtice e gire o reagente antes de usar.
- Permita que o tampão de amostra e a fita da tela de DNA se equilibrem na temperatura da sala por 30 minutos. Em seguida, coloque a fita de tela de DNA em um analisador de fragmentos.
- Misture 2 μL de tampão de amostra e 3 μL de amplicon pcr segundo em novas 8 tiras de tubo. Insira as 8 tiras do tubo no analisador de fragmentos. Pressione a corrida para começar.
ATENÇÃO: A formação de bolhas de ar deve ser evitada. - Certifique-se de que os amplificadores de pcr segundo são aproximadamente 613 bp (600 - 630 bp) para os genes 16S e 18S rRNA.
- Purifique os produtos de segundo PCR usando um sistema de limpeza de DNA de contas magnéticas.
- Ajuste de concentração de DNA
- Meça a concentração de DNA nos produtos purificados de segundo PCR usando um especttômetro de quantificação de ácido nucleico.
- Calcule a concentração de genes-alvo em nM, contabilizando o tamanho médio da biblioteca final como 613 bp para genes de rRNA 16S e 18S:
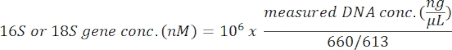
- Diluir cada segundo produto PCR purificado com água PCR estéril para 4 nM em uma nova placa de 0,2 mL 96.
NOTA: A placa pode ser armazenada a -20 °C aqui. Caso contrário, o restante dos procedimentos deve ser realizado sem parar. - Aliquot 3 μL de cada produto PCR de 4 nM segundo e misture tudo em um novo tubo estéril de 1,5 mL como uma biblioteca agrupada. Mantenha o tubo a 4 °C ou no banho de gelo o tempo todo.
- Meça a concentração da biblioteca agrupada para confirmação usando um especttômetro de quantificação de ácido nucleico. Ajuste a concentração para 4 nM se for superior a 4 nM.
NOTA: O DNA supercontomestado produz números de leitura superestimados, dificultando a análise.
- Desnaturação e sequenciamento de DNA
NOTA: Esta seção usa o sistema Illumina MiSeq com reagentes específicos. Veja os números dos produtos na Tabela de Materiais.
NOTA: Siga rigorosamente o tempo. Descongele todos os reagentes, exceto cartuchos no dia do sequenciamento.- Um dia antes de sequenciar, remova um cartucho de reagente pronto para uso pré-preenchido a partir de -20 °C e armazene a 4 °C para descongelar.
- Coloque um bloco de calor adequado para tubos de centrífugas de 1,5 mL a 96 °C.
- Coloque o tampão de hibridização no gelo.
- Diluir o grau molecular NaOH de 1 N a 0,2 N em um novo tubo com água de grau PCR.
- Diluir uma biblioteca de controle pronta para uso com tampão TE (pH 8.0) de 10 nM de estoque para 4 nM em um novo tubo (ou seja, 2 μL de biblioteca de controle + 3 μL de buffer TE).
- Misture 16 μL de biblioteca de amostras agrupadas de 4 nM com 4 μL de biblioteca de controle de 4 nM em um novo tubo rotulado como "1".
- Misture 10 μL de amostra no tubo "1" com 10 μL de 0,2 N NaOH em um novo tubo rotulado "2".
- Vórtice o tubo 2 para 5 s, gire brevemente, e incubar à temperatura ambiente por 5 minutos.
- Adicione 980 μL de tampão de hibridização ao tubo 2.
- Em um novo tubo rotulado como "3", misture 260 μL a amostra do tubo 2 com 390 μL de tampão de hibridização. Misture invertendo o tubo.
- Incubar tubo 3 a 96 °C por 2 min e colocá-lo imediatamente no gelo por um máximo de 2 min.
- Retire o cartucho da geladeira de 4 °C.
- Configure a folha de amostra para sequenciamento com cada índice correspondente 1 e adaptadores do índice 2 como na Tabela 6.
- Remova a célula de fluxo do kit MiSeq v3. Limpe suavemente a célula de fluxo com água PCR de grau molecular estéril.
NOTA: Não despeje água sobre os pontos capilares da célula de fluxo. Limpe suavemente a água da célula de fluxo com papel não fibroso. - Carregue o volume total do tubo 3 (650 μL) no cartucho.
- No software de operação de instrumentos, selecione sequenciamento e siga as instruções. Insira célula de fluxo, tampão de incorporação e cartucho. Carregue folha de amostras. Pressione Run para iniciar a reação.
NOTA: Esta sequência de execução levará de 3 a 5 dias. Os dados serão enviados automaticamente para a plataforma Basespace. Os dados brutos serão armazenados em duas pastas no computador: pasta de análise contendo arquivos fastq e Saída contendo arquivos bcl e imagens jpeg.
4.Atribuição taxonômica para sequenciar dados
- Processamento de arquivos FASTQ
NOTA: O pacote DADA223 de R24 é um dos bancos de dados recomendados para processar arquivos FASTQ. A diretriz está disponível em [https://github.com/mickeykawai/exec_dada2]. Esta diretriz foi preparada adotando a versão recente do tutorial de pipeline DADA2 [https://benjjneb.github.io/dada2/tutorial.html].- Processe sequências de extremidades emparelhadas FASTQ cruas para aparamento, filtragem de qualidade, dereplicação e contagem de sequências únicas, inferência de amostra, fusão em contigas e remoção de sequências quimricas.
- Utilização seguindo os parâmetros especificados dada2 para fragmentos genéticos de rRNA de 16S e 18S; trimLefts=0, 0, truncLens=[Verifique a qualidade da sequência e defina-a para um comprimento apropriado].
NOTA: Os valores padrão para os outros parâmetros são maxN=0, maxEE=2,2, trancQ=2.
- Atribuição de taxonomia
NOTA: O banco de dados de rRNA silva é recomendado para atribuição de taxonomia para DADA2 [silva_nr_v132_train_set.fa.gz é definido como padrão].- Remova os OTUs cloroplasto e mitocondrial para análise de fragmentos genéticos de rRNA 16S. Remova singletons da análise de rRNA 16S e 18S.
- Rarificar todas as amostras até mesmo a profundidade de sequenciamento com base na amostra com a menor profundidade de sequenciamento.
- Registre o número de leituras, OTUs atribuídos e em que nível, leituras filtradas e o número de singletons excluídos.
- Análise estatística
- Realizar análise estatística em dados microbianos utilizando pacotes R de filoseq25 e vegan26.
Resultados
Este protocolo usa a análise de metabarcocote de genes 18S rRNA para identificar espécies algas em amostras de água do mar. Um resultado representativo é mostrado na Figura 1, na qual a água do mar coletada de Metri, Puerto Montt, Chile (-41.597; -72.7056) em 19 de fevereiro de 2019, foi analisada com este protocolo. O resultado mostrou um total de 13.750 leituras com mais de 30 espécies de algas na amostra de água do mar. A alga dominante nesta amostra foi Navicula spp. com uma abundância relativa de 70,77%. Além disso, observou-se abundância suficiente para Micromonas (6,40%), Chaetoceros spp. (4,44%), Scripsiella spp. (2,44%) e Prorocentrum spp. (1.28%). Pseudochattonella spp., um dos maiores causadores de algas tóxicas do HAB chileno, foi detectado com 0,52% desta amostra de água do mar.
Para verificar a confiabilidade dos dados, as espécies algas identificadas pela análise genética de rRNA 18S foram comparadas às obtidas por microscopia na mesma amostra de água do mar(Figura 2). Consistente com a análise genética de rRNA 18S, a microscopia mostrou que a espécie dominante era Navicula spp. com uma abundância relativa de 74,1% e Prorocentrum spp. (0,60%) como espécie menor. Por outro lado, a Heterocapsa spp. (9,04%) documentada a partir da observação microscópica não foi identificada pela análise genética de rRNA 18S nesta amostra. Havia 12,6% de pequenas em torno de células fitoplânctons não identificáveis registradas por microscopia. Pode ser micromonas,de acordo com os resultados do rRNA 18S.
O protocolo utiliza a análise de metabarcocote de genes 16S rRNA para identificar espécies bacterianas em amostras de água do mar. Um resultado representativo é mostrado na Figura 3,na qual a mesma água do mar utilizada para a análise genética de rRNA 18S foi analisada com análise genética de 16S rRNA. O resultado mostrou um total de 31.758 leituras com mais de 30 espécies bacterianas na amostra de água do mar. Deve-se delinear que esta amostra de água do mar foi passada através de membranas de filtro tandem (tamanhos de 1 μm e 0,2 μm poros) para separar bactérias livres de bactérias ligadas. Em seguida, as células capturadas por cada membrana filtrante foram tratadas para extração de DNA, seguidas pela análise genética de rRNA 16S. O resultado representativo na Figura 3 mostra espécies de bactérias identificadas a partir de 0,2 μm de membrana do tamanho do poro, que são definidas como bactérias de vida livre. A bactéria dominante de vida livre foi Amylibacter spp. com uma abundância relativa de 20,02%, seguida por Clade Ia (13,53%) e Aligiphilus spp. (7.06%). O resto das espécies bacterianas detectadas a partir desta amostra de água do mar foram relativamente distribuídas igualmente. A mesma análise pode ser feita para células capturadas por membrana do tamanho de 1 μm de poros como detecção de espécies de bactérias anexadas.
Quando esses ensaios de metabarização são realizados em pontos de tempo programados durante um determinado período de estudo, os resultados podem ser resumidos como análise de séries temporizadas. Uma maneira de fazê-lo é traçar a abundância relativa de determinadas espécies algas e bacterianas em função do tempo para encontrar um padrão de crescimento único. A Figura 4 mostra uma trama representativa da série temporal de Alexandrium e Pseudochattonella em Metri, Chile. Outra forma de resumir uma análise de metabarco de séries tempoescos é traçar todas as algas e bacterianas identificadas em função do tempo, representando a mudança populacional de certos grupos de organismos. A Figura 5 e a Figura 6 resumem a abundância relativa de todo o gênero e ordem bacteriana, respectivamente, que são detectados a partir da água do mar de Metri ao longo de cinco meses.
Tabela 1: Primeiro conteúdo de mix mestre pcr: A tabela mostra conteúdo mestre de mix por reação para análises de rRNA 16S e 18S. As sequências de primer estão listadas na Tabela 3. Clique aqui para baixar esta Tabela.
Tabela 2: Sequências de primer: Os primers para o primeiro PCR estão listados para análises de rRNA 16S e 18S. Clique aqui para baixar esta Tabela.
Tabela 3: Ciclos pcr: Os ciclos térmicos para primeiro PCR e segundo PCR estão listados. Clique aqui para baixar esta Tabela.
Tabela 4: Sequências de índice: Os primers index 1 (i7) e Index 2 (i5) a serem usados para o segundo PCR estão listados. Clique aqui para baixar esta Tabela.
Tabela 5: Exemplo de posicionamento do Índice 1 e do Índice 2: Para reduzir o erro, os primers de índice devem ser colocados na posição primeiro, e a alíquota de cada um é transferida para uma placa de 96 poços usando pipeta multicanal. Clique aqui para baixar esta Tabela.
Tabela 6: Exemplo de folha de amostra: Antes do sequenciamento, deve-se criar uma folha de amostra correspondente aos adaptadores do índice 1 e do índice 2. Clique aqui para baixar esta Tabela.
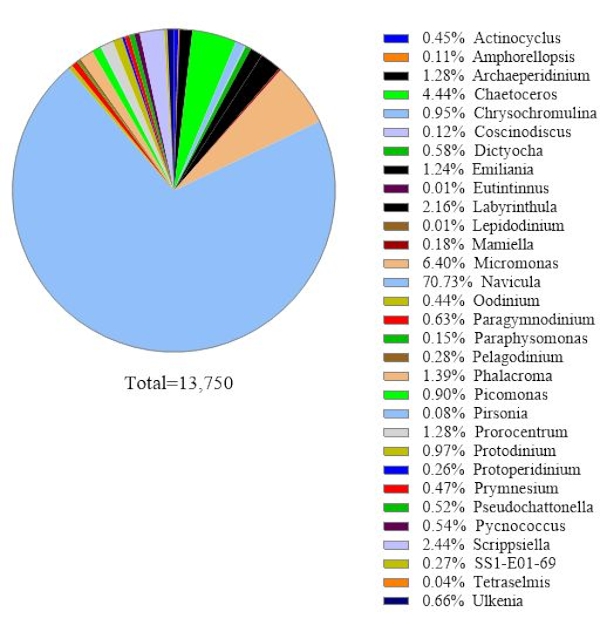
Figura 1: Resultado representativo da análise de metabar codificação de rRNA 18S: Espécies de algas presentes em uma amostra de água do mar coletadas em Metri, Los Lagos, Chile em 19 de fevereiro de 2019, foram identificadas pelo ensaio de metabarificação de rRNA 18S. As sequências atribuídas "desconhecidas" foram eliminadas, e a abundância relativa de cada espécie identificada foi plotada. Clique aqui para ver uma versão maior desta figura.
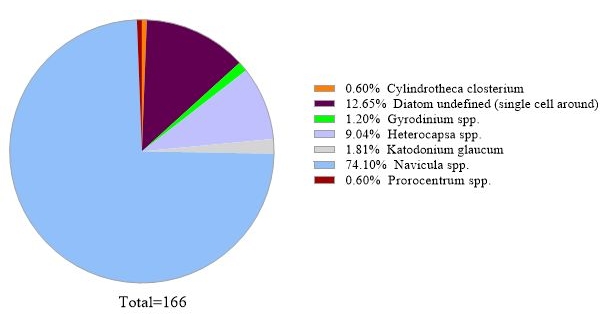
Figura 2: Resultado representativo da análise microscópica: As espécies de algas foram identificadas a partir de uma amostra de água de Metri, Los Lagos, Chile, em 19 de fevereiro de 2019, por microscopia. A quantidade de cada espécie foi contada manualmente e plotada. Clique aqui para ver uma versão maior desta figura.
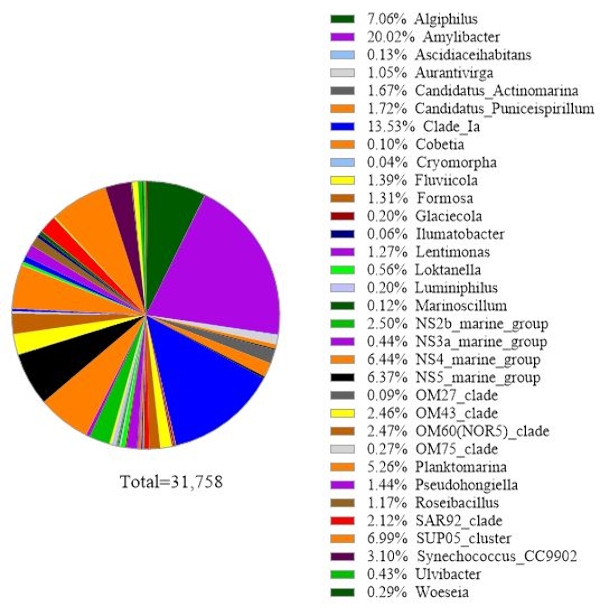
Figura 3: Resultado representativo da análise de metabarcocote de 16S rRNA: Espécies bacterianas presentes em uma amostra de água de Metri, Los Lagos, Chile em 19 de fevereiro de 2019, foram identificadas pelo ensaio de metabarificação de rRNA 16S. A abundância relativa de cada espécie identificada foi traçada. Clique aqui para ver uma versão maior desta figura.
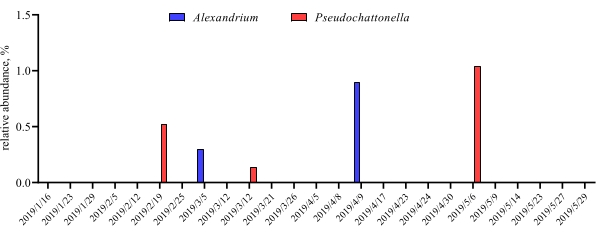
Figura 4: Enredo representativo da série temporal de Alexandrium spp. e Pseudochattonella spp. obtido a partir de 18S rRNA metabarcodingin Metri, Chile: Figura reimpressa de Yarimizu et al9. As duas espécies de algas tóxicas, Alexandrium e Pseudochattonella foram seletivamente monitoradas pela análise de rRNA 18S ao longo do tempo, e a abundância relativa foi traçada em função do ponto de tempo. Clique aqui para ver uma versão maior desta figura.
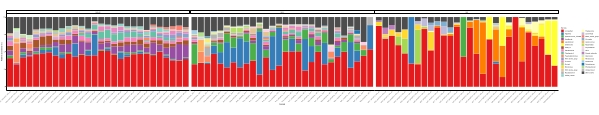
Figura 5: Enredo representativo da série temporal do gênero de gênero obtido a partir de 16S rRNA e 18S rRNA metabarcoding: Todos os gêneros bacterianos e eucarióticos identificados na água de Metri, Chile, monitorados ao longo de cinco meses. Clique aqui para ver uma versão maior desta figura.
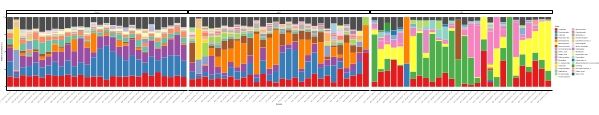
Figura 6: Parcela de ordem representativa obtida a partir de 16S rRNA e 18S rRNA metabarcoding: Todas as ordens bacterianas e eucarióticas identificadas na água de Metri, Chile, monitoradas ao longo de cinco meses. Clique aqui para ver uma versão maior desta figura.
Tabela S1 e Tabela S2:
Tabela S1: Dados brutos para Figura 5 e Figura 6. Tabela S2: Resultado da verificação do QC sobre os dados brutos da Figura 5 e Figura 6. Clique aqui para baixar estas Tabelas.
Discussão
Este protocolo realizou com sucesso a análise de metabarcocote de genes 18S rRNA e 16S rRNA para identificar espécies algas e bacterianas em amostras de água do mar para monitoramento de HABs chilenos. As algas dominantes e algumas algas menores detectadas por este protocolo foram consistentes com as obtidas por microscopia, confirmando a confiabilidade do protocolo. O destaque do protocolo é que a análise detectou Alexandrium spp. e Pseudochattonella spp., as duas espécies mais problemáticas causadores de HAB no sul do Chile, a partir da água do mar de Metri mesmo em baixa abundância. Especialmente, Pseudochattonella Spp. são espécies desafiadoras para identificar sob um microscópio porque as células são pequenas e facilmente rompidas sob a luz ou uso de fixativos27,28. A metabar codificação pode fornecer informações de espécies algas que dificilmente estão presentes em amostras de água do mar que a microscopia não pode identificar. O protocolo também detectou mais de 30 espécies bacterianas. Embora a forma como essas bactérias estejam relacionadas ao crescimento de algas seja desconhecida neste momento, a coleta maciça de dados de espécies algas bacterianas na análise da série temporal possivelmente fornecerá descobertas tão importantes. Assim, a adição de análises de metabarco aos programas convencionais de monitoramento de HAB chilenos, sem dúvida, fortalecerá a atual eficiência de monitoramento de HAB. De fato, este protocolo visual para análise de metabarcococo pode ser benéfico não apenas para o monitoramento algal-bacteriano da água chilena, mas também para os programas de monitoramento da costa em outras áreas afetadas pelo HAB em todo o mundo.
Embora este protocolo tenha proporcionado as vantagens acima indicadas, as desvantagens do método devem ser discutidas. Como visto no protocolo visual, o método de metabar codificação é demorado e complexo, exigindo máquinas e reagentes caros. O pessoal do laboratório deve ser especialmente treinado, ou vai desperdiçar material, trabalho e tempo. Além disso, a detecção de algas por metabarificação deve ser emparelhada com microscopia para verificar se as mesmas espécies dominantes são identificadas a partir dos dois métodos ortogonais29. A microscopia é uma ferramenta não invasiva, em sua maioria, para identificar espécies algas, o que significa que é mais difícil cometer erros quando as espécies de algas têm formas únicas e aparentes. É claro que o erro humano pode ocorrer se a espécie tiver formas muito semelhantes umas às outras. Por outro lado, uma vez que a análise de metabarcocos requer múltiplas etapas, ela naturalmente aumenta os erros. Pode ser uma amostra misturada, adição errada de reagente, ou falta de alguns procedimentos. Portanto, é fundamental comparar os resultados de metabarco com os obtidos por microscopia. Por fim, o protocolo é aplicável apenas qualitativamente, e os resultados devem ser calculados para abundância relativa. Como lamb et al. afirmaram em 2019, a metabar codificação atual como o desempenho quantitativo ainda é limitado, e pesquisas adicionais são necessárias antes que a metabarificação possa ser utilizada com confiança para aplicações quantitativas30.
Este protocolo foi otimizado para 140 - 170 amostras por execução do manual de preparação da biblioteca metagenômica 16S emitido pela Illumina Inc. O protocolo otimizado foi testado muitas vezes e modificado para emitir esta versão final. Portanto, é altamente recomendável seguir cada passo com precisão. A parte mais crítica do protocolo é que é necessário um cuidado extra para evitar a contaminação da amostra. As pipetas e a coifa de fluxo laminar devem ser limpas com 70% de álcool e exposição uv o tempo todo, e os materiais esterilizáveis devem ser autoclavados. Os primers e reagentes devem ser diluídos diretamente do estoque a cada nova corrida, ou reutilização de reagentes e exposição a várias diluições pode ser uma causa de contaminação amostral. O protocolo especifica quando a operação pode ser feita fora do capô de fluxo laminar. A menos que o contrário, as amostras devem ser tratadas em um capô de fluxo laminar limpo. Ao lidar com várias tiras de 8 tubos simultaneamente, recomenda-se trabalhar na primeira tira de 8 tubos e tampá-la antes de se mover para a próxima tira de 8 tubos. Deixar a tampa aberta por muito tempo pode causar contaminação amostral, pois os genes 16S e 18S rRNA são altamente onipresentes no ambiente. O tempo indicado, como tempo de mistura e tempo de incubação, deve ser seguido como exatamente descrito porque a melhor duração para cada etapa foi selecionada com base nas múltiplas corridas de teste. O tempo excessivo ou insuficiente pode, por exemplo, reduzir o rendimento amostral. O processo deve ser interrompido apenas na parte que o protocolo diz que pode parar. É crucial ter um controle negativo, pois confirma que os resultados positivos não são falsos positivos artificiais. Por fim, é altamente recomendável planejar os dias porque requer pelo menos cinco dias para processar todas as etapas, e algumas peças não podem ser paradas até o próximo sinal de parada.
A limitação da atribuição taxonômica para dados sequenciados é brevemente observada aqui. Sequências de nucleotídeos recém-descobertas para espécies bacterianas e algas são atualizadas diariamente no banco de dados. Embora espécies algas e bacterianas bem estudadas sejam registradas de forma confiável, há também muitas sequências para espécies desconhecidas atualizadas no banco de dados. Indica que a resolução de sequências de nucleotídeos registradas nem sempre é suficiente para identificação de espécies, mas apenas para identificação do gênero. Assim, a identificação microscópica das espécies deve ser realizada ortogonicamente. Estabelecer um pipeline de acesso aberto para este trabalho tem uma vantagem significativa em lidar com um grande conjunto de dados sequenciados ao mesmo tempo e investigar eficientemente quando ocorre um erro. Além disso, a saída do DADA2 está em um texto ou arquivo csv, o que facilita a análise estatística posterior. Por outro lado, um servidor grande é necessário para executar atribuições taxonômicas, especialmente quando um conjunto de dados é grande. Para montar o pipeline, os engenheiros são necessários para configurar o pipeline, e os profissionais devem entender parâmetros, operação, Linux e bioinformática.
Além do escopo como ferramenta de monitoramento hab, o uso deste protocolo pode ser expandido para fins de pesquisa investigativa. Por exemplo, há debates em andamento entre o governo chileno e pescadores locais, juntamente com as associações de paz ambiental sobre o aumento do número de HAB31locais ,32. O governo afirma que é devido a um fenômeno natural como o aquecimento global e o El Niño, enquanto as partes posteriores afirmam que a aquicultura de salmão é a causa. O salmão não é uma espécie indígena do Chile e não estava na água chilena há meio século. O governo chileno na época visava crescer a economia e criar empregos para áreas pobres, desenvolvendo um negócio desalmão 33. Com a intervenção do exterior para o lucro do capital, o Chile fez grande sucesso no desenvolvimento da aquicultura estilo caneta, e o número de salmões aumentou notavelmente nas últimas décadas31,32,33. Posteriormente, uma grande quantidade de alimentos para salmão foi lançada no mar, levando as pessoas locais a suspeitar que a aquicultura de salmão é a razão para as frequentes HABs locais31,32. A verdade é desconhecida agora, mas deve ser entendida eventualmente para que estratégias para proteger o ambiente marinho local, a economia e a saúde humana dos HABs possam ser elaboradas. A análise molecular sobre a relação alga-bacteriana local pode contribuir para um esclarecimento avançado para tal assunto. Por exemplo, a técnica pode pesquisar as espécies algas e bacterianas que não estavam presentes na área oceânica alvo antes, mas aumentaram dramaticamente nos últimos anos, o que é um pouco semelhante ao estudo feito por Sakai et al. para a descoberta de uma população não registrada de salamandra Yamato (Hynobius vandenburghi) pelo SIG e análise eDNA34. Portanto, além da ferramenta de monitoramento hab, este protocolo de metabarificação tem o potencial de uso para outras perspectivas.
Divulgações
Os autores não declaram conflito de interesses. Os financiadores não tiveram papel na concepção do estudo, na coleta, análise ou interpretação dos dados; na redação do manuscrito, ou na decisão de publicar os resultados.
Agradecimentos
Este estudo foi apoiado pela bolsa (JPMJSA1705) para um estudo sobre Parceria de Pesquisa em Ciência e Tecnologia para Algas de Monitoramento do Desenvolvimento Sustentável no Chile (SATREPS-MACH). Agradecemos à Dra. Agradecemos a Neal Andrew Holland por sua diligente revisão do manuscrito. Expressamos nosso sincero agradecimento aos membros do grupo de laboratório do CREAN-IFOP em Puerto Montt, Chile, por nos aconselharem sobre a identificação de fitoplâncton.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL single tube | ThermoFisher | Q32856 | sterile |
| 1.5 mL tubes | ThermoFisher | 2150N | sterile |
| 8-strip 0.2 mL PCR tubes and flat cap | ThermoFisher | AB0451 & 4323032 | sterile |
| 96-well 0.2 mL PCR plate | ThermoFisher | N8010560 | |
| AccuRuler 100 bp DNA Ladder | MaestroGen | 02001-500 | |
| Chelex 100 Chelating Resin | Bio-Rad | 1432832 | |
| Chemical Duty Vacuum Pressure Pump | MilliporeSigma | WP6122050 | |
| D1000 Reagents | Agilent Technologies | 5067-5583 | |
| D1000 sample buffer | Agilent Technologies | 5067-5602 | |
| DNA loading dye (Blue/Orange Loading Dye 6X) | Promega | G1881 | |
| Ethanol Molecular Biology Grade | E7023 | Merck KGaA | |
| Filtration device | ThermoFisher | 09-740-36H, 09-740-23E | |
| Fluorescent DNA concentration measurement kit (Qubit dsDNA HS Assay kit) | Thermo Fisher Scientific | Q32851 | |
| Fluorometer (Qubit4 Fluorometer) | ThermoFisher | Q33238 | |
| Fragment analysis verification matrix (D1000 ScreenTape) | Agilent Technologies | 5067-5582 | |
| Fragment Analyzer (Agilent Tapestation 4150) | Agilent | G2992AA | |
| GelRed Nucleic Acid Gel Stain | Biotium | 41002 | |
| Generic bench vortexer (Vortex Genie 2) | Scientific Industries | SI-0236 | |
| Heat block | |||
| High performance sequencing-grade DNA polymerase (KAPA HiFi Hotstart ReadyMix), 2X | Roche | KK2602 | |
| HT1 Hybridization buffer | Illumina | 20015892 | |
| Illumina Nextera XT v2 Index Kit set A, B, C and D | Illumina | FC-131-2001, -2002, -2003, -2004 | |
| Laminar hood cabinet | Biobase Co. | Biobase PCR-800 PCR Cabinet | |
| Loading tips (Specific for Agilent TapeStation systems) | Agilent Technologies | 5067-5598 | |
| Magnetic beads DNA cleanup system (ProNex® Size-Selective Purification System) | Promega | NG2002 | |
| Magnetic stand for 96 wells (Magnetic Stand-96) | ThermoFisher | AM10027 | |
| Micro-seal film for 96-well plate | ThermoFisher | 4311971 | sterile |
| MiSeq Reagent Kit v3 | Illumina | MS-102-3003 | includes pre-filled, ready-to-use reagent cartridges. |
| MiSeq system | Illumina | SY-410-1003 | includes pre-installed software |
| Molecular grade nuclease-free water | Integrated DNA Technologies | 11-05-01-04 | |
| Molecular grade sodium hydroxide (NaOH) 1M | Merck KGaA | 1091371000 | |
| Multichannel pipettes | Not specified | Not specified | |
| Multi-Purpose Agarose | Cleaver Scientific | CSL-AG500 | |
| Ow D2 Wide-Gel Electrophoresis System | ThermoFisher | D2 | |
| Ow EC-105 Compact Power Supply | ThermoFisher | 105ECA-115 | |
| Pellet Pestle— Cordless Motor | ThermoFisher | K749540-0000 | |
| PhiX control Kit v3 | Illumina | FC-110-300 | ready-to-use control library for Illumina sequencing |
| Pipette tips | Not specified | Not specified | sterile |
| Pipettes | Not specified | Not specified | 2, 10, 20, 100, 1000 μL |
| SterivexTM GP 0.22 μm filter unit | MilliporeSigma | SVGP01050 | |
| Tabletop centrifuge | Eppendorf 5427R Centrifuge | Eppendorf AG | |
| TBE buffer | ThermoFisher | B52 | |
| TE buffer (pH 8.0) | ThermoFisher | AM9849 | |
| Terr PCR Direct FFPE Kit | Takara Bio USA | 639284 | includes 2X Terra PCR Direct Buffer |
| Terra PCR Direct Polymerase Mix, 1.25 U/μL | Takara Bio USA | 639271 | High performance Inhibitor-tolerant DNA polymerase |
| ThermalCycler (MiniAMP Plus Thermal Cycler) | ThermoFisher | A37835 | |
| TransIlluminator and image capture system | Analytik Jena, AG | GelDoc-ItTS2 Imager | |
| Whatman 1.0 m pore-sized membrane | MilliporeSigma | WHA111110 |
Referências
- Hallegraeff, G., Enevoldsen, H., Zingone, A. Global harmful algal bloom status reporting. Harmful Algae. 102, 101992(2021).
- Anderson, D. M. Red Tides. Scientific American. 271 (2), 52-58 (1994).
- Sanseverino, I., Conduto, A. D. S., Pozzoli, L., Dobricic, S., Lettieri, T. Algal Bloom and its Economic Impact. , Publications Office of the European Union. (2016).
- Molinet, C., Niklitschek, E., Seguel, M., Díaz, P. Trends of natural accumulation and detoxification of paralytic shellfish poison in two bivalves from the Norwest Patagonian inland sea. Revista de Biologia Marina Y Oceanografia. 45, 195-204 (2010).
- Mardones, J., Clement, A., Rojas, X., Aparicio, C. Alexandrium catenella during 2009 in Chilean waters, and recent expansion to coastal ocean. Harmful Algae News. 41, 8-9 (2010).
- Alvarez, G., et al. Paralytic shellfish toxins in surf clams Mesodesma donacium during a large bloom of Alexandrium catenella dinoflagellates associated to an intense shellfish mass mortality. Toxins (Basel). 11 (4), (2019).
- Clément, A., et al. Exceptional summer conditions and HABs of Pseudochattonella in Southern Chile create record impacts on salmon farms. Harmful Algae News. 53, 1-3 (2016).
- Trainer, V. L., et al. Pelagic harmful algal blooms and climate change: Lessons from nature's experiments with extremes. Harmful Algae. 91, 101591(2020).
- Yarimizu, K., et al. Protocols for monitoring harmful algal blooms for sustainable aquaculture and coastal fisheries in Chile. International Journal of Environmental Research and Public Health. 17 (20), (2020).
- Roegner, G. C., Hickey, B. M., Newton, J. A., Shanks, A. L., Armstrong, D. A. Wind-induced plume and bloom intrusions into Willapa Bay, Washington. Limnology & Oceanography. 47 (4), 1033-1042 (2002).
- Tweddle, J. F., et al. Relationships among upwelling, phytoplankton blooms, and phycotoxins in coastal Oregon shellfish. Marine Ecology Progress Series. 405, 131-145 (2010).
- Glibert, P. M., Anderson, D. M., Gentien, P., Graneli, E., Sellner, K. G. The global complex phenomena of harmful algae blooms. Oceanography. 18 (2), 130-141 (2005).
- Paredes-Mella, J., Varela, D., Fernández, P., Espinoza-González, O. Growth performance of Alexandrium catenella from the Chilean fjords under different environmental drivers: Plasticity as a response to a highly variable environment. Journal of Plankton Research. 42 (2), 119-134 (2020).
- Azam, F., Malfatti, F. Microbial structuring of marine ecosystems. Nature Reviews Microbiology. 5, 782-791 (2007).
- Amin, S. A., et al. Interaction and signaling between a cosmopolitan phytoplankton and associated bacteria. Nature. 522, 98-101 (2015).
- Berdalet, E., et al. Marine harmful algal blooms, human health, and wellbeing: Challenges and opportunities in the 21st century. Journal of Marine Biology Association. 2015, U. K. 1-31 (2015).
- Ramanan, R., Kim, B. -H., Cho, D. -H., Oh, H. -M., Kim, H. -S. Algae-bacteria interactions: Evolution, ecology, and emerging applications. Biotechnology Advances. 34 (1), 14-29 (2016).
- Seymour, J. R., Amin, S. A., Raina, J. B., Stocker, R. Zooming in on the phycosphere: The ecological interface for phytoplankton-bacteria relationships. Nature Reviews Microbiology. 2, 17065(2017).
- Maruyama, F., et al. 16S and 18S Metabarcoding analysis for Chilean coastal waters harmful algal blooms. protocol.io. , (2020).
- Tanabe, A. S., et al. Comparative study of the validity of three regions of the 18S-rRNA gene for massively parallel sequencing-based monitoring of the planktonic eukaryote community. Molecular Ecology Resources. 16, 402-414 (2016).
- Nishitani, G., et al. Multiple plastids collected by the Dinoflagellate Dinophysis mitra through Kleptoplastidy. Applied and Environmental Microbiology. 78 (3), 813-821 (2012).
- Klindworth, A., et al. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies. Nucleic Acids Research. 41 (1), 1(2013).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- R, R Team DCore. R: A language and environment for statistical computing. R Foundation for Statistical Computing. , Vienna, Austria. Available from: http://www.R-project.org (2007).
- McMurdie, P. J., Holmes, S. phyloseq: An R Package for Reproducible Interactive Analysis and Graphics of Microbiome Census Data. PLoS One. 8 (4), 61217(2013).
- Dixon, P. VEGAN, a package of R functions for community ecology. Journal of Vegetation Science. 14 (6), 927-930 (2003).
- Dittami, S. M., Riisberg, I., Edvardsen, B. Molecular probes for the detection and identification of ichthyotoxic marine microalgae of the genus Pseudochattonella (Dictyochophyceae, Ochrophyta). Environmental Science and Pollution Research. 20 (10), 6824-6837 (2013).
- Mardones, J. I., et al. Salinity-growth response and ichthyotoxic potency of the Chilean Pseudochattonella verruculosa. Frontiers in Marine Science. 6 (24), (2019).
- Santi, I., Kasapidis, P., Karakassis, I., Pitta, P. A comparison of DNA metabarcoding and microscopy methodologies for the study of aquatic microbial eukaryotes. Diversity. 13 (5), 180(2021).
- Lamb, P. D., et al. How quantitative is metabarcoding: A meta-analytical approach. Molecular Ecology. 28 (2), 420-430 (2019).
- Mascareño, A., et al. Controversies in social-ecological systems: lessons from a major red tide crisis on Chiloe Island, Chile. Ecology and Society. 23, (2018).
- Armijo, J., Oerder, V., Auger, P. -A., Bravo, A., Molina, E. The 2016 red tide crisis in southern Chile: Possible influence of the mass oceanic dumping of dead salmons. Marine Pollution Bulletin. 150, 110603(2020).
- Swanson, H. A. Caught in Comparisons: Japanese Salmon in an Uneven World. , University of California, Santa Cruz. Doctor of Phylosophy thesis (2013).
- Sakai, Y., et al. Discovery of an unrecorded population of Yamato salamander (Hynobius vandenburghi) by GIS and eDNA analysis. Environmental DNA. 1 (3), 281-289 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados