Method Article
زرع والتحكم في الأنظمة اللاسلكية الخالية من البطاريات لربط الأعصاب الطرفية
In This Article
Summary
هذا بروتوكول للزرع الجراحي وتشغيل واجهة تعمل بالطاقة اللاسلكية للأعصاب الطرفية. نوضح فائدة هذا النهج مع أمثلة من محفزات الأعصاب الموضوعة على العصب الوركي أو العصب الحجابي للفئران.
Abstract
كثيرا ما تستخدم واجهات الأعصاب الطرفية في علم الأعصاب التجريبي والطب التجديدي لمجموعة واسعة من التطبيقات. يمكن أن تكون هذه الواجهات مستشعرات أو مشغلات أو كليهما. يجب أن ترتبط الطرق التقليدية لربط الأعصاب الطرفية بنظام خارجي أو تعتمد على طاقة البطارية التي تحد من الإطار الزمني للتشغيل. مع التطورات الأخيرة لواجهات الأعصاب الطرفية اللاسلكية الخالية من البطاريات والقابلة للزرع بالكامل ، يمكن لفئة جديدة من الأجهزة أن توفر إمكانات تتطابق أو تتجاوز تلك الموجودة في سلائفها السلكية أو التي تعمل بالبطارية. تصف هذه الورقة طرق (i) الزرع الجراحي و (ii) تشغيل هذا النظام والتحكم فيه لاسلكيا في الفئران البالغة. تم اختيار نماذج العصب الوركي والحجابي كأمثلة لتسليط الضوء على تنوع هذا النهج. توضح الورقة كيف يمكن للواجهة العصبية الطرفية أن تثير إمكانات عمل العضلات المركبة (CMAPs) ، وتقدم بروتوكول تحفيز كهربائي علاجي ، وتتضمن قناة لإصلاح إصابة الأعصاب الطرفية. توفر هذه الأجهزة خيارات علاجية موسعة للتحفيز العلاجي بجرعة واحدة أو جرعة متكررة ويمكن تكييفها مع مجموعة متنوعة من مواقع الأعصاب.
Introduction
تحدث إصابات الأعصاب الطرفية الرضحية (PNIs) في الولايات المتحدة بمعدل سنوي يبلغ حوالي 200000 سنويا1. معظم المرضى الذين يعانون من PNIs يتركون مع إعاقات وظيفية دائمة. في أسوأ حالاته ، قد يؤدي هذا إلى شلل العضلات ويؤدي إلى ألم الأعصاب المقاوم للعلاج الشديد لدرجة أن المرضى على استعداد للخضوع لبتر الأطراف كعلاج2. أكبر عقبة أمام تحسين نتائج PNI هي أن تجديد المحور العصبي بطيء جدا مقارنة بالمسافات التي يجب أن ينمو فيها مرة أخرى. على سبيل المثال، ينمو محور عصبي بشري بالغ بمعدل 1 مم/يوم ولكن قد يضطر إلى التجدد عبر مسافات >1000 مم في حالة وجود آفة في الطرف القريب.
في الممارسة السريرية الحالية ، ~ 50٪ من PNIs تتطلب إصلاحا جراحيا3. لتجديد الأعصاب بنجاح ، يجب أن تنمو المحاور العصبية (i) عبر موقع الآفة (أي عبور الفجوة) ثم (ii) تتجدد أسفل المسار العصبي للوصول إلى هدف العضو النهائي (أي إعادة النمو البعيد) (الشكل 1). لا توجد أدوية معتمدة من إدارة الغذاء والدواء الأمريكية ثبت أنها تسرع تجديد الأعصاب. لقد تغير الوضع الراهن للإدارة السريرية ل PNI بشكل تدريجي فقط على مدى العقود العديدة الماضية ويقتصر على التحسينات التقنية للطرق الجراحية مثل عمليات نقل العصب الحركي البعيد لتقليل المسافة التي يجب أن تقطعها المحاور العصبية المجددة4 ، أو قنوات الأعصاب الاصطناعية "خارج الرف" للحالات التي يتراجع فيها العصب القريب ولا يمكن خياطته مباشرة معا5. ومع ذلك ، كانت هناك أربع تجارب سريرية عشوائية على التحفيز الكهربائي العلاجي المطبق على الأعصاب بعد الجراحة ، والتي كانت دراسات أحادية المركز بقيادة الدكتور ك. مينغ تشان في جامعة ألبرتا والتي أظهرت تحسنا ملحوظا في إعادة تعصيب العضلات6،7،8 أو الجلد9. تم تنفيذ العمل التأسيسي لبروتوكول التحفيز الكهربائي هذا في القوارض10،11 ، حيث ثبت أن التحفيز الكهربائي يعمل على وجه التحديد من خلال تعزيز عبور الفجوة (الشكل 1) ولكن ليس إعادة النمو البعيد12،13،14،15.
كان الوضع الجراحي لأقطاب الأسلاك عبر الجلد المستخدمة في جميع التجارب السريرية العشوائية الأربع للتحفيز الكهربائي ضروريا لأن آثاره تعتمد على توصيل تيار كاف لإزالة استقطاب جسم الخلية العصبية عند 20 هرتز بشكل مستمر لمدة 1 ساعة11. في الممارسة السريرية ، لا يمكن تحمل بروتوكول التحفيز الكهربائي هذا لمعظم المرضى بالشدة المطلوبة عبر أقطاب كهربائية محفزة للسطح على الجلد بسبب الألم. هناك مخاطر غير تافهة مرتبطة بتشغيل الأقطاب الكهربائية عبر الجلد بعد الجراحة ، مثل عدوى الجرح العميق أو الإزاحة العرضية للأسلاك من الأعصاب أثناء نقل المريض من غرفة العمليات (OR). بالإضافة إلى ذلك ، فإن التكلفة العالية لوقت غرفة العمليات نفسها هي مثبطة ضد محاولة ذلك في هذا الإعداد بدلا من أثناء التعافي الحاد بعد العملية الجراحية. تظهر فئة جديدة من واجهات الأعصاب الطرفية اللاسلكية الخالية من البطاريات والقابلة للزرع بالكامل لمعالجة هذا القصور في واجهات الأعصاب الطرفية الحالية.
تستعد هذه الفئة الجديدة من الأنظمة الإلكترونية اللاسلكية القابلة للزرع لزيادة سهولة ومرونة جرعات التحفيز الكهربائي وكسر الحواجز التي تحول دون تنفيذها السريري على نطاق أوسع. تصف هذه الورقة طرق (i) الزرع الجراحي و (ii) تشغيل هذا النظام والتحكم فيه لاسلكيا في نماذج الأعصاب الوركية والحجيبة للفئران البالغة. يوضح كيف يمكن لواجهة الأعصاب الطرفية أن تثير CMAPs ، وتقدم بروتوكول تحفيز كهربائي علاجي ، وحتى تعمل كقناة لإصلاح الأعصاب الطرفية. يمكن تكييف البروتوكولات هنا مع المتغيرات الأخرى لهذه التقنية التي يمكنها توصيل نبضات ضوئية للتعديل العصبي بوساطة علم البصريات16 ، أو إطلاق الدواء الخاضع للرقابة17 ، أو نوبات متكررة من التحفيز الكهربائي بمرور الوقت18,19.
Protocol
يتم تنفيذ جميع الإجراءات الموضحة في هذا البروتوكول وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدام (IACUC) بجامعة نورث وسترن. يتبع هذا البروتوكول إرشادات رعاية لمركز الطب المقارن بجامعة نورث وسترن و IACUC. من الضروري التشاور مع IACUC عند تكييف البروتوكولات.
1. تصنيع محفز إلكتروني لاسلكي (الشكل 2)
- استخدم النحاس / البوليميد / النحاس (نحاس علوي وسفلي بسمك 18 ميكرومتر ، بوليميد بسمك 75 ميكرومتر) كركيزة لملف حصادة طاقة التردد اللاسلكي (أي هوائي جهاز استقبال لاسلكي).
- استخدم الاستئصال المباشر بالليزر لتركيب ثقوب للأقطاب الكهربائية على الطبقات النحاسية العلوية والسفلية وتشكيل الجهاز. قم بتوصيل الطبقات العلوية والسفلية كهربائيا باستخدام معجون الفضة من خلال الثقوب.
- قم بتوصيل المكونات الإلكترونية بعبوات تجارية ، مثل الصمام الثنائي والمكثف ، عن طريق اللحام.
- استخدم البولي يوريثين التساهمي الديناميكي القابل للامتصاص الحيوي (b-DCPU ؛ سمك 200 ميكرومتر) الموليبدينوم المغلف (Mo ؛ سمك 15 ميكرومتر ؛ هيكل أفعواني) كأقطاب تمديد قابلة للتمدد19.
- قم بتشكيل قطب الكفة للواجهة بين الجهاز والعصب باستخدام فيلم بولي (حمض اللاكتيك المشترك جليكوليك) (PLGA) (بسمك 300 ميكرومتر).
- بعد توصيل هوائي جهاز الاستقبال اللاسلكي وقطب التمديد القابل للتمدد ، قم بتغليف هوائي جهاز الاستقبال اللاسلكي والاتصال بالإيبوكسي المقاوم للماء أو polydimethysiloxane (PDMS). انظر الشكل 2 (يمين) للجهاز المجمع بالكامل.
- قم بتأكيد التشغيل اللاسلكي للجهاز ، باستخدام مولد شكل موجة لتوليد نبضات كهربائية أحادية الطور عبر الملف الأساسي (أي ملف الإرسال).
ملاحظة: عند فحص توظيف المحاور الطرفية وتحريض التجديد المحوري بواسطة محفزات أحادية الطور وثنائية الطور ، أبلغت الدراسات السابقة عن تأثير ضئيل بسبب الاختلافات في خاصية شكل الموجة20 ، وقد تمكنت هذه المجموعة من تحقيق تعزيز التحفيز الكهربائي العلاجي بنفس معلمات التيار أحادي الطور في الفئران21 والجرذان18. علاوة على ذلك ، فحصت الدراسات السابقة التوافق الحيوي في الجسم الحي وفي المختبر ولم تجد أي دليل على تلف الأنسجة من تأثيرات التسخين أو المواد نفسها. بسبب هذه النتائج والمدة المحدودة للتحفيز الكهربائي العلاجي في الدراسة الحالية ، تم استخدام محفزات أحادية الطور ، بدلا من ثنائية الطور ، في هذا البروتوكول. - قم بقياس جهد خرج التيار المباشر الناتج باستخدام راسم الذبذبات المتصل بقطب الكفة.
2. إعداد الجهاز للزرع
- ضع أجهزة الزرع في طبق بتري معقم وأغلقها بالأغشية.
- قم بإشعاع الأجهزة بضوء الأشعة فوق البنفسجية لمدة 30 دقيقة لكل جانب.
3. الإجراء الجراحي لزرع العصب الوركي الأيمن للفئران لواجهة العصب المحيطي اللاسلكية الخالية من البطارية للتحفيز الكهربائي (الشكل 3)
ملاحظة: الحفاظ على ظروف معقمة. إجراء العمليات الجراحية داخل المنطقة الجراحية المخصصة لغرفة إجراءات. سيرتدي الجراح قناع وجه ومعطفا وقبعة وقفازات معقمة أثناء الجراحة. إذا تم إجراء أكثر من عملية جراحية واحدة ، قم بتغيير القفازات المعقمة بين واستخدم أدوات جراحية نظيفة ومعقمة لكل عملية جراحية. تعقيم الأدوات بين العمليات الجراحية عن طريق التعقيم الحراري (الأوتوكلاف أو معقم الخرز الزجاجي). استخدم فئران Sprague-Dawley البالغة التي تزن 200-250 جم.
- يجب تحفيز التخدير باستخدام تخدير غاز إيزوفلوران (تحريض 3٪، صيانة 1-3٪) في الأكسجين (2 لتر/دقيقة)، مع إعطاء ميلوكسيكام تحت الجلد (1-2 ملغ/كغ). تغطية عيون الفئران مع مرهم العيون المخصصة لمنع الجفاف.
- ضع الفئران في وضعية الانبطاح على طاولات جراحية مطهرة للإجراءات اللاحقة. بالنسبة للفترة الجراحية المتبقية ، قم بتقييم معدل التنفس (يجب أن يكون ~ 2 / ثانية) ، ولون الأنسجة ، وعمق التخدير لا يقل عن كل 15 دقيقة ، والحفاظ على مستويات الأيزوفلوران وفقا لذلك. تأكد من عمق التخدير المناسب عن طريق فحص منعكس الدواسة (عدم الاستجابة لقرصة إصبع القدم الثابتة). مراقبة الأغشية المخاطية ، والتي يجب أن تبقى وردية ورطبة.
- حلق المنطقة الجراحية ، بما في ذلك الساق اليمنى والنصف السفلي من الظهر. افرك المنطقة الجراحية المحلوقة باستخدام وسادة بيتادين ، متبوعة بمسحة إيثانول طبية بنسبة 70٪ ، وكرر عملية الفرك هذه ثلاث مرات لتطهير الجلد.
- قم بعمل شق 1.5 - 2 سم في الجلد موازيا لعظم الفخذ الأيمن باستخدام مقص الأنسجة ، متبوعا بفصل حاد للنسيج الضام تحت الجلد على الظهر (الإنسي مباشرة إلى الشق) لمسح جيب تحت الجلد لملف الاستقبال (الشكل 4 أ). قم بعمل شق لاحق (1.2-1.5 سم) على عضلة الألوية اليمنى موازية لشق الجلد.
- اعزل العصب الوركي برفق باستخدام مجسات تشريح معدنية ذات نهايات حادة (الشكل 4 ب).
ملاحظة: يقع العصب الوركي في عمق العضلة ذات الرأسين الفخذية ويعمل بالتوازي مع عظم الفخذ. يقترح نطاق تشريح. - زرع الجهاز اللاسلكي الخالي من البطارية على العصب الوركي (الشكل 4C) عن طريق لف الكفة حول العصب الوركي الأيمن المعزول ، دون وضع العصب تحت التوتر أو تشويه مساره18،19،20. ضع علامة على الجلد حيث يتم وضع ملف الاستقبال لمزيد من التحفيز الكهربائي.
- خياطة شق العضلات الألوية باستخدام خيوط قابلة للامتصاص (الشكل 4 د).
ملاحظة: يقع النصف العلوي من ملف الاستقبال فوق عضلة الألوية وواجهة الكفة تحتها. - أغلق شق الجلد بمشابك الجرح (أو الخيط المدفون ؛ الشكل 4E). تطابق حواف الجلد.
- تقديم 1 ساعة من التحفيز الكهربائي المستمر بعد الجراحة 20 هرتز مع عرض نبضة 200 ميكرو ثانية تحت التخدير (الشكل 4F). إعادة إلى أقفاصها المنزلية بعد أن تتعافى تماما من التخدير.
ملاحظة: يرد أدناه وصف للبروتوكول المفصل. يظهر ملف الاستقبال فوق الجلد في الشكل 4F. - علاج ما بعد الجراحة
- ضع الجرذ في قفص استرداد بدون فراش ، مبطن بمناشف ورقية ، مع وضع نصف القفص على مصدر حرارة مناسب منظم لدرجة الحرارة (وسادة تدفئة معتمدة).
- راقب الجرذ بعناية حتى يصبح متنقلا. بمجرد أن يكون متنقلا وتقييمه مستقرا ، أعد الجرذ إلى قفص المنزل وراقب إعادة الاندماج الاجتماعي.
- بعد الشفاء الحاد ، راقب الفئران بحثا عن عدوى موقع الشق وأعراض الألم العصبي ، بما في ذلك على سبيل المثال لا الحصر الحراسة والتلوي والخدش وتشويه الذات. راقب الفئران يوميا لفترة التعافي بعد الجراحة لمدة 5 أيام ، ومرة واحدة على الأقل كل ثلاثة أيام بعد ذلك إذا لم يتم التضحية بالفئران في اليوم الخامس.
- يجب تطبيق ميلوكسيكام (1-2 ملغ/كغ) تحت الجلد مرة واحدة يوميا لمدة يومين إلى ثلاثة أيام بعد الجراحة، اعتمادا على مستوى الألم/الانزعاج المعروض لدى. في حالة الاشتباه في وجود ألم مستمر ، استمر في ميلوكسيكام بعد هذه الفترة بعد الجراحة ، وإذا ثبت أنه مقاوم للحرارة ، فقم بالقتل الرحيم للفأر مبكرا بالتشاور مع الفريق البيطري.
- قم بإزالة الغرز الجلدية أو مشابك الجرح بعد 10-12 يوما من الجراحة.
4. الإجراء الجراحي لزرع العصب الحجابي الأيسر للفئران من المحفزات اللاسلكية (الشكل 5 أ)
ملاحظة: الحفاظ على ظروف معقمة ، كما في القسم 3. استخدم فئران Sprague-Dawley البالغة التي يتراوح وزنها بين 200 و 250 جم. تعقيم جميع الأدوات الجراحية قبل الاستخدام.
- يجب تحفيز التخدير باستخدام تخدير غاز إيزوفلوران (تحريض 3٪، صيانة 1-3٪) في الأكسجين (2 لتر/دقيقة)، مع إعطاء ميلوكسيكام تحت الجلد (1-2 ملغ/كغ). تغطية عيون الفئران مع مرهم العيون المخصصة لمنع الجفاف.
- ضع الفئران في وضع ضعيف على طاولات جراحية مطهرة للإجراءات اللاحقة. بالنسبة للمدة الجراحية المتبقية ، قم بتقييم معدل التنفس ولون الأنسجة وعمق التخدير بما لا يقل عن كل 15 دقيقة ، والحفاظ على مستويات الأيزوفلوران وفقا لذلك. تأكد من عمق التخدير المناسب عن طريق فحص منعكس الدواسة (عدم الاستجابة لقرصة إصبع القدم الثابتة). مراقبة الأغشية المخاطية ، والتي يجب أن تبقى وردية ورطبة.
- حلق المنطقة الجراحية على الجانب البطني من الرقبة. افرك المنطقة الجراحية المحلوقة باستخدام وسادة بيتادين ، متبوعة بمسحة إيثانول طبية بنسبة 70٪ ، وكرر عملية الفرك هذه ثلاث مرات لتطهير الجلد.
- يتم تطبيق البوبيفاكايين (2 ملغ/ كغ، مخفف في محلول ملحي لا يتجاوز الحجم الكلي 0.5 مل) تحت الجلد عند خط الوسط على الرقبة، مستهدفا الطبقة الأكثر سطحية. قم بعمل شق في خط الوسط بطول 3 سم عبر الجلد واللفافة العنقية السطحية لكشف العضلات القصية اللامية والعضلات القصية الترقوية الخشائية (الشكل 5 ب).
ملاحظة: يقترح نطاق تشريح. - ارفع القصية الترقوية الخشائية باستخدام تشريح حاد لطيف باستخدام مسبار وسحبه بشكل جانبي باستخدام حلقة وعاء (الشكل 5C). حرر بلطف وتراجع عن الأوميويد. بعد ذلك ، حرر بلطف وتراجع الإنسي العصب المبهم والحزمة السباتية تحت العضلة اللامية أومو.
ملاحظة: التمييز الرئيسي هنا هو بين العصب المبهم والعصب الحجابي. قطع omohyoid إذا كان من الضروري فضح الهياكل تحتها. - عزل العصب الحجابي (الشكل 5D).
ملاحظة: يمتد العصب الحجابي على طول سطح العضلة القشرية الأمامية ، ويعمل كعصب طولي صغير بشكل ملحوظ يعبر عموديا على الضفيرة العضدية. على عكس العصب الوركي ، فإن التشريح حول العصب الحجابي في الرقبة أكثر تعقيدا. قم بإجراء تأكيد الفيزيولوجيا الكهربية (الخطوة 4.7) قبل الزرع للحصول على أفضل النتائج. - ضع قطب التسجيل تحت الجلد ، فقط ذيليا إلى القفص الصدري ، المماثل للعصب الحجابي المعزول (الشكل 5E). ضع المحفزات على العصب الحجابي وقم بتأكيدها عبر الإشارات المتزامنة (الشكل 6).
ملاحظة: استحضار استجابة قصوى مع شدة تحفيز ~ 3-6 مللي أمبير ومدة تحفيز 0.02 مللي ثانية أمر نموذجي. - تحقق من الاستئصال الكامل للعصب الحجابي من خلال إظهار الإلغاء الكامل للاستجابة المستحثة عند تطبيق محفز كهربائي على طرف العصب القريب بالنسبة إلى موقع الاستئصال (الشكل 6).
- زرع جهاز لاسلكي خال من البطارية على العصب الحجابي (الشكل 5F) عن طريق وضع ملف الاستقبال للجهاز القابل للزرع على القصية اللامية ، عميقا بالنسبة للعضلات القصية الترقوية الخشائية الثنائية ، مع الكفة حول العصب الحجابي والأقطاب الكهربائية الملامسة الموضوعة بشكل عمودي على العصب.
- أغلق اللفافة العنقية السطحية بخيوط بسيطة قابلة للامتصاص (الشكل 5G). أغلق الجلد بخيوط قابلة للامتصاص مقلوبة متقطعة في الأدمة العميقة. إعادة إلى أقفاصها المنزلية فقط بعد أن تتعافى تماما من التخدير.
- للعلاج بعد الجراحة، اتبع الخطوة 3.10.
5. التوصيل اللاسلكي للتحفيز الكهربائي العلاجي
- تطبيق التحفيز الكهربائي لمدة 1 ساعة على الفئران تحت التخدير العام. للتحفيز اللاسلكي ، ضع مولد شكل موجة / وظيفة (الجهد: 1-15 Vpp) ومكبر صوت اختياري فوق لتوفير الطاقة الكهربائية لملف حثي خارجي (أي ملف نقل) (ملف حلزوني ثنائي الأبعاد مع 5 لفات ؛ القطر: 2 سم) لضمان اقتران حثي جيد مع ملف الاستقبال المزروع. تقديم نبضات أحادية الطور ، 200 ميكرو ثانية عند 20 هرتز لمدة 1 ساعة.
- للتحقق من توصيل التحفيز الكهربائي وتحديده ، قم بتسجيل CMAPs من العضلة الأمامية الظنبوبية ، وضبط جهد التحفيز لتقديم تنشيط فوق أقصى للعصب الوركي. استخدم أقطاب إبرة متحدة المركز لجميع التسجيلات.
ملاحظة: إذا كان الجهد الأقصى الناتج عن الوظيفة غير كاف لإثارة استجابة قصوى، فاستخدم مكبر للصوت.
6. القتل الرحيم
- الطريقة الأساسية
- ضع القفص تحت غرفة توصيل CO2 ، مضبوطا على معدل 8-12 LPM (أو معدل تدفق مناسب بناء على حجم الغرفة). مراقبة الفئران لفقدان الوعي ثم لمدة 1 دقيقة على الأقل من توقف التنفس.
- الطريقة الثانوية
- أداء خلع عنق الرحم أو بضع الصدر الثنائي.
النتائج
في نموذج إصابة العصب الوركي ، يتم وضع الغرسة حول العصب الوركي الأيمن قبل الإصلاح الشامل لفرع العصب الظنبوبي (الشكل 3 ، الشكل 4 أ ، والشكل 7 أ). يتم وضع قطب إبرة متحدة المركز 30 G في العضلة الأمامية الظنبوبية اليمنى لتحديد معلمات التحفيز اللازمة للتحفيز الكهربائي بأقصى شدة. تتضمن هذه التجارب رفع شدة التحفيز حتى يستقر حجم الاستجابة عند الحد الأقصى. نظرا لأن الظنبوب الأمامي معصب بالفرع الشظوي للعصب الوركي ، فإنه يتم تجنيبه في إصابة استئصال العصب الظنبوبي. وبالتالي ، فإن التسجيل من الظنبوب الأمامي يتيح المراقبة المستمرة لعلاج التحفيز الكهربائي.
بالنسبة لنبضة تحفيز واحدة يتم توصيلها بواسطة قطب كهربائي سلكي إلى العصب الوركي الأيمن (5 مللي أمبير ، 0.02 مللي ثانية) ، يتم استنباط استجابة CMAP القصوى بسعة ذروة سلبية تبلغ 5.4 مللي فولت مسجلة على الظنبوب المماثل الأمامي (الشكل 7 ب ؛ أثر أسود). للحصول على نبضة تحفيز مماثلة يتم توصيلها بواسطة الغرسة اللاسلكية الخالية من البطارية ، يتم استنباط استجابة CMAP مماثلة بسعة ذروة سلبية تبلغ 4.6 مللي فولت (الشكل 7 ب ؛ أثر برتقالي). وهذا يتفق مع تقرير حديث يفيد بأن تحفيز العصب اللاسلكي يحقق في المتوسط 88٪ من CMAP من تحفيز العصب القائم على الأسلاك21 ، وهو أعلى بكثير من العتبة المطلوبة للتأثيرات العلاجية في الدراسات السريرية6،7،8،9. في المثال الموضح ، كان زمن الوصول الأطول للمحفز اللاسلكي مقابل المحفز السلكي بسبب بعده الأكبر عن العضلة المسجلة.
في نموذج العصب الحجابي ، يتم وضع الغرسة حول العصب الحجابي الأيمن قبل القطع (الشكل 5). لتحديد معلمات التحفيز اللازمة للتحفيز الكهربائي ذي الكثافة القصوى ، يتم وضع قطب إبرة متحدة المركز 30 G تحت الجلد على الهامش الساحلي الأمامي الأيمن (المماثل) للتسجيل من الحجاب الحاجز الأيمن. تتضمن التجارب رفع جهد التحفيز حتى يستقر حجم الاستجابة عند الحد الأقصى. نظرا لأن العصب الحجابي يمكن أن يكون من الصعب عزله عن الهياكل الوعائية العصبية المحيطة ، يمكن تأكيد هويته من خلال استحضار استجابة نشل (الشكل 6 ؛ أثر برتقالي). يمكن التحقق من خصوصية التحفيز بشكل أكبر عن طريق نقل العصب الحجابي البعيد إلى الكفة الكهربية العصبية مع الإلغاء اللاحق لاستجابة الارتعاش (الشكل 6 ؛ أثر أسود).
يمكن توصيل علاج التحفيز الكهربائي المتكرر منخفض التردد إلى العصب الوركي لمدة 1 ساعة باستخدام بروتوكول راسخ يعزز تجديد المحور العصبي (6،7،8،9،10،11; الشكل 8). تم وضع واجهة الكفة للزرع اللاسلكي على العصب الوركي الأيمن ، وتم وضع قطب إبرة متحدة المركز 30 G على عضلة الظنبوب الأمامية اليمنى لمراقبة العلاج. يوضح الشكل 8 أ أربعة طفرات متسلسلة في تخطيط كهربية العضل المسجل في بداية (0 دقيقة) من التحفيز الكهربائي 1 ساعة 20 هرتز. يوضح الشكل 8B أربعة طفرات أخرى مسجلة في 40 دقيقة من التحفيز الكهربائي لمدة 1 ساعة مع انخفاض طفيف في سعة الذروة ، وهو ما يتوافق مع نمط التعب الذي لوحظ مع علاج التحفيز الكهربائي القائم على الأسلاك15,21.
يمكن تقييم درجة تجدد الأعصاب الطرفية باستخدام مقتفيات رجعية مطبقة بشكل بعيد على موقع الآفة العصبية. نظرا لأن المحاور العصبية المحيطية تنبت براعم جانبية متعددة ، فإن التتبع الرجعي وعدد سوما الخلايا العصبية الحركية في الحبل الشوكي يسمح بإجراء تقييم أكثر دقة لعدد الخلايا العصبية المتجددة من حساب المحاور العصبية المتجددة داخل العصب نفسه31. لإثبات ذلك ، تم نقل جذع العصب الوركي عن طريق إصابة سحق. بعد 3 أسابيع من الشفاء ، تم إعطاء صبغتين رجعيتين فلوريتين مختلفتين على فرعين من العصب الوركي: العصب الشظوي (الأخضر) والعصب الظنبوبي (الأحمر) ، على التوالي (الشكل 9 أ). يوضح الشكل 9B-D مجموعات فرعية مضاءة من الخلايا العصبية الحركية السفلية في القرن الأمامي للحبل الشوكي القطني والتي تشكل إما العصب الظنبوبي (الشكل 9B) أو العصب الشظوي (الشكل 9C). تظهر صورة التراكب عمودين متميزين من الخلايا العصبية المصنفة في القرن الأمامي للحبل الشوكي ، والتي يمكن قياسها كميا من حيث التوزيع المكاني وعدد الخلايا العصبية الحركية التي جددت محورا عصبيا بعيدا عن موقع الآفة (الشكل 9 د).
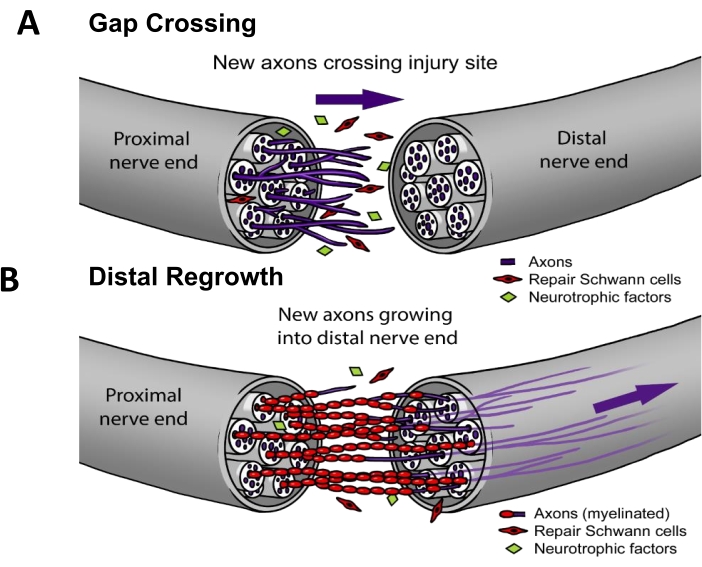
الشكل 1: نموذج تجديد الأعصاب. (أ) يحدث عبور الفجوة مبكرا بعد إصلاح الأعصاب عندما تنمو المحاور العصبية من الطرف العصبي القريب إلى الطرف البعيد بعد الإصلاح. (ب) ترتبط مدة إعادة النمو البعيد بالمسافة إلى العضو النهائي المستهدف (مثل الجلد والعضلات) ومعدل إعادة نمو محور عصبي. تستهدف معظم علاجات تحسين إصلاح الأعصاب إحدى هاتين العمليتين أو كلتيهما. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
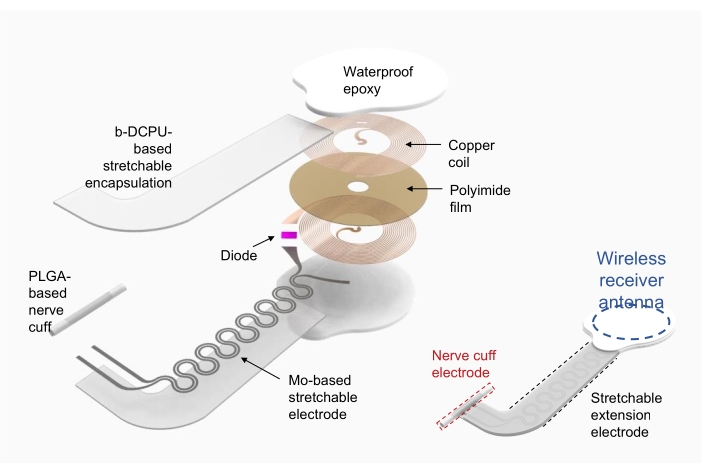
الشكل 2: رسم توضيحي لتصنيع محفز إلكتروني لاسلكي. طبقات مفصلة على اليسار من هيكل الجهاز ، بما في ذلك ملف حصادة طاقة تردد الراديو الدائري ، وقطب تمديد قابل للتمدد ، وكفة عصبية تلتف حول عصب مهم. على اليمين ، رسم توضيحي مبسط يوضح ثلاثة أجزاء من الجهاز. الاختصارات: PLGA = بولي (حمض اللاكتيك المشترك الجليكوليك) ؛ b-DCPU = البولي يوريثين التساهمي الديناميكي القابل للامتصاص الحيوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
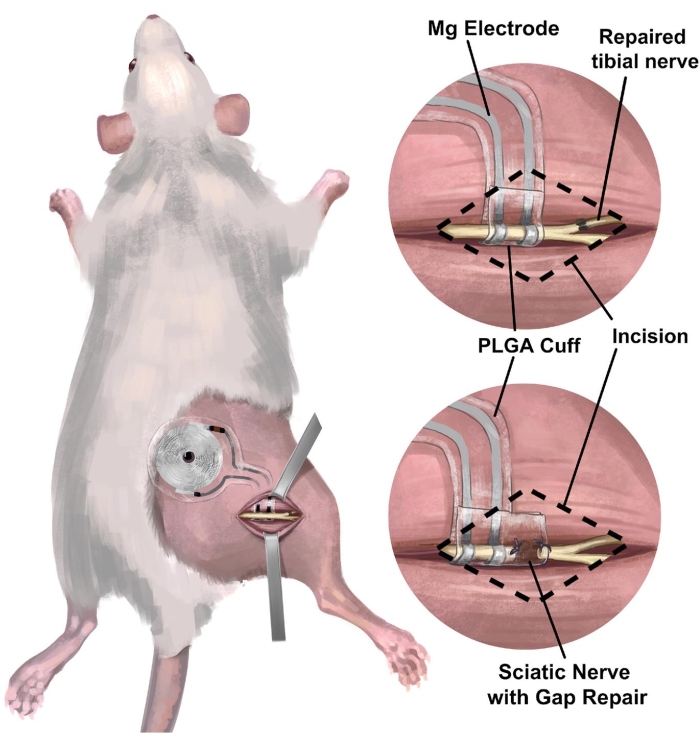
الشكل 3: زرع واجهة عصبية لاسلكية خالية من البطارية في نموذج العصب الوركي للفئران. (أ) يوضح الشكل نظاما قابلا للانغراس بالكامل في العصب الوركي الأيمن للفئران. (ب) توضح اللوحة العلوية واجهة قطب كهربائي موضوعة على العصب الوركي بالقرب من الإصلاح من طرف إلى طرف للعصب الظنبوبي الأيمن. تظهر اللوحة السفلية واجهة قطب كهربائي مع إصلاح فجوة سد الكفة العصبية الممتدة بين الطرف القريب وجذع العصب البعيد. اختصار: PLGA = بولي (حمض اللاكتيك المشترك الجليكوليك). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
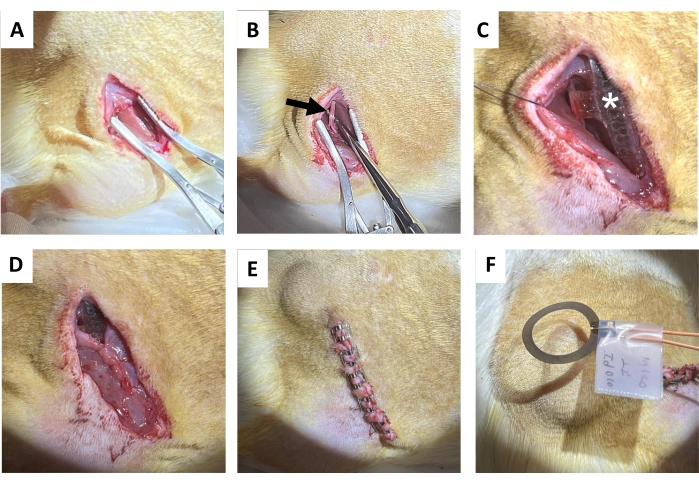
الشكل 4: إجراء زراعة العصب الوركي. أ: شق في الجلد، والنسيج الضام تحت الجلد، وعضلة الألوية لكشف أوتار الركبة. ب: العصب الوركي المعزول (السهم الأسود). (ج) جهاز ما بعد الزرع مع الكفة العصبية والأسلاك (علامة النجمة البيضاء) والزرع المرئي (النجمة). د: إغلاق النسيج الضام بالخيط. ه: إغلاق الشق بواسطة مشابك الجرح. (F) التحفيز الكهربائي اللاسلكي الناتج عن ملف فوق الجلد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
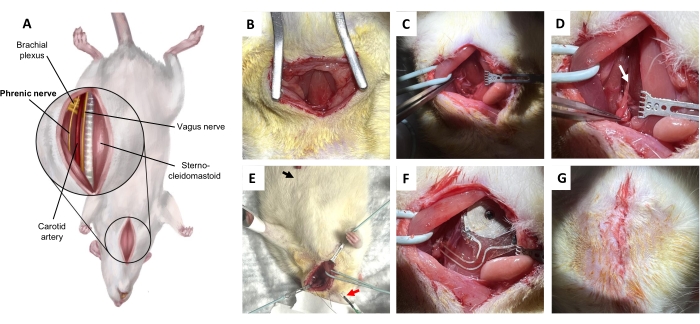
الشكل 5: إجراء زراعة العصب الحجابي. أ: منظر بطني للرقبة في وضع الاستلقاء. ب: شق الجلد والنسيج الضام تحت الجلد لكشف العضلة القصية اللامية. ج: تشريح الفراغ المجهد بين العضلة اللامية والعضلة القصية الترقوية الخشائية. د: العصب الحجابي (السهم)، معزول عن الضفيرة العضدية. ه: التثبيت التخطيطي العضلي الغشائي للعصب الحجابي. سهم أسود ، قطب تسجيل. السهم الأحمر ، المحفزات. (و) الزرع. (ز) إغلاق الجلد بغرز جلدية عميقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
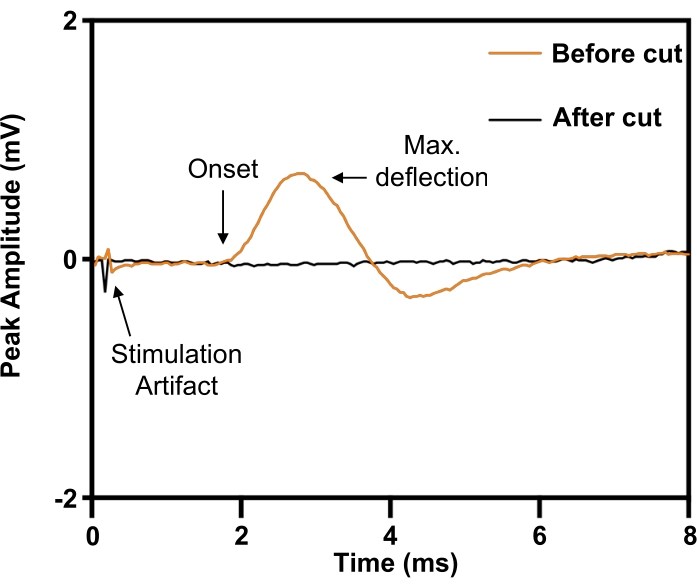
الشكل 6: تأكيد الإصابة الكاملة بقطع العصب الحجابي عن طريق تحفيز جهود عمل العضلات المركبة من الحجاب الحاجز. قبل استئصال العصب الحجابي (ORANGE) ، أثار التحفيز الكهربائي للعصب الحجابي إمكانات عمل العضلات المركبة على الحجاب الحاجز المماثل ، والذي تم إلغاؤه عن طريق استئصال العصب الحجابي (BLACK). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
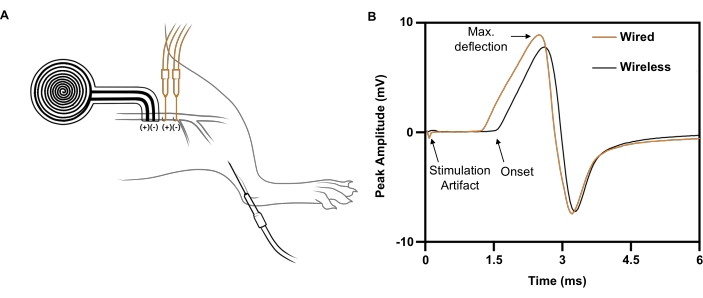
الشكل 7: دراسات التوصيل العصبي التمثيلية التي تقارن التحفيز الكهربائي اللاسلكي بالتحفيز الكهربائي القائم على الأسلاك. (أ) رسم توضيحي لمواضع الأجهزة اللاسلكية (BLACK) والسلكية (ORANGE) على العصب الوركي. تم وضع قطب التسجيل في الظنبوب الأمامي. (ب) جهود عمل العضلات المركبة التي تثيرها الغرسة السلكية (ORANGE) مقابل الغرسة اللاسلكية (BLACK). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
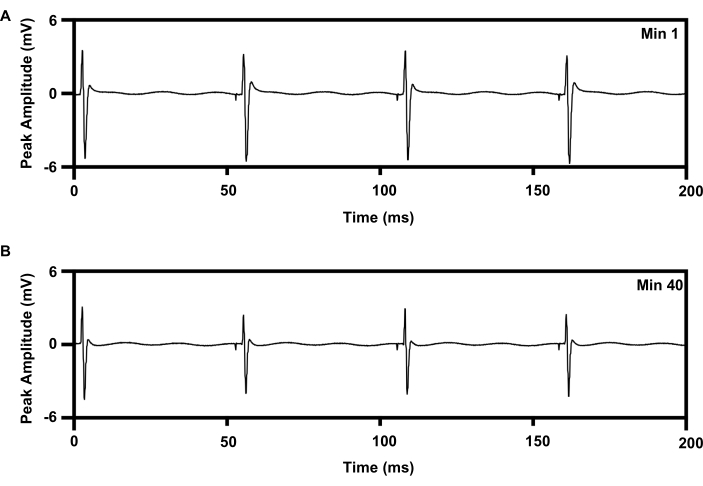
الشكل 8: تسجيل تخطيط كهربية العضل من عضلة TA مع تحفيز كهربائي متكرر 20 هرتز لمدة 1 ساعة من الغرسات. (أ) أثر تخطيط كهربية العضل عند الدقيقة 1 من e-stim. (ب) تتبع EMG عند الحد الأدنى 40 من e-stim. الاختصارات: EMG = تخطيط كهربية العضل. TA = الظنبوب الأمامي. e-stim = التحفيز الكهربائي ؛ دقيقة = دقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
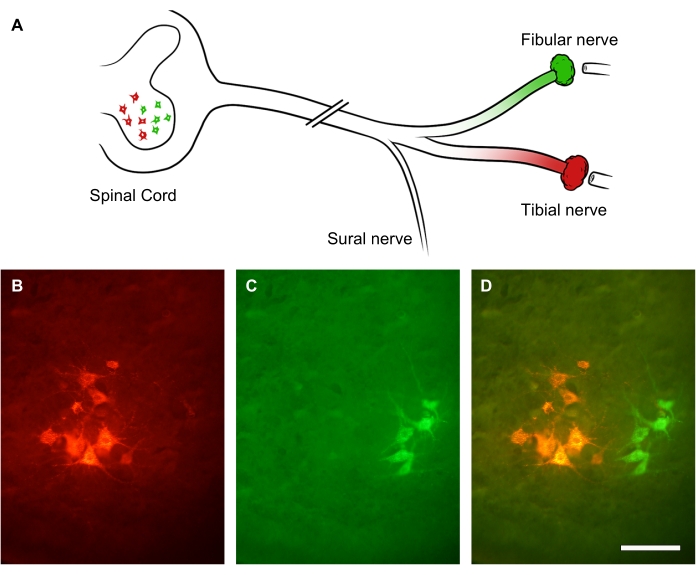
الشكل 9: صور تمثيلية لتجديد العصب الوركي. (أ) رسم توضيحي لإصابة العصب الوركي ووضع العلامات الارتجاعية الفلورية. تم نقل محاور العصب الوركي عن طريق إصابة سحق. بعد 3 أسابيع من الشفاء ، تم تصنيف فروعه البعيدة - العصب الشظوي (باللون الأخضر) والعصب الظنبوبي (باللون الأحمر) - بأثر رجعي. (ب-د) صور للحبل الشوكي القطني تظهر سوما عصبية داخل القرن الأمامي الظهيري. قضبان المقياس = 30 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تصف هذه الورقة خطوات الزرع الجراحي وتشغيل واجهات الأعصاب الطرفية اللاسلكية الخالية من البطاريات والقابلة للزرع بالكامل في نموذج العصب الوركي والحجابي للفئران. نوضح كيف يمكن استخدام هذه الفئة الجديدة من الغرسات الطبية الحيوية لتقديم نموذج تحفيز كهربائي علاجي يظهر أنه يعزز تجديد المحور العصبي في الدراسات قبل السريرية والسريرية (للمراجعة ، انظر22). هذا البروتوكول غير معقد ويمكن استقرائه لنماذج حيوانية أصغر ، مثل الفئران21 ، بالإضافة إلى أجهزة لاسلكية أخرى خالية من البطاريات وقابلة للزرع بالكامل مع وظائف تشمل واجهات الأعصاب الطرفية الإلكترونية الضوئية والموائع الدقيقة18،23،24،25،26،27،28،29،30. كما تم إثبات النهج باستخدام العصب الوركي للقوارض ، وهو النموذج التجريبي الأكثر شيوعا31.
وقد ظهر تنوع هذا النهج عندما يتم تكييفه للتفاعل مع العصب الحجابي ، والذي نادرا ما يستخدم كنموذج لإصابة الأعصاب الطرفية32 ، ربما لأنه مشكلة سريرية غير معترف بها إلى حد كبير33،34،35. أصبح تشخيص إصابات العصب الحجابي وإعادة التأهيل قضية مهمة خلال جائحة COVID-1936،37،38. من غير المعروف حاليا ما إذا كان يمكن زيادة تجديد المحاور العصبية الحجابي والتعافي من شلل الحجاب الحاجز من خلال نموذج التحفيز الكهربائي القصير منخفض التردد. ومع ذلك ، فإن التحفيز الكهربائي للعصب الحجابي لسرعة عضلات الحجاب الحاجز هو خيار ثابت لفشل الجهاز التنفسي في المرضى الذين يعانون من الشلل الرباعي من إصابة الحبل الشوكي العنقيالعالية 39،40،41،42،43. ويجري استكشاف مؤشرات أخرى، بما في ذلك فطام جهاز التنفس الصناعي بعد الإصابة بمرض خطير44.
يجب التأكيد على العديد من الخطوات الحاسمة لضمان التشغيل الجيد للنظام المزروع. أولا ، من المهم تجنب استخدام الكثير من القوة على المكونات الإلكترونية الرقيقة للأجهزة عند التعامل معها لمنع إزالة عزل الرصاص أو الالتواء أو الكسر. بعد ذلك ، من المهم تحديد موقع ملف حصادة طاقة التردد اللاسلكي بدقة على الجلد المغطي. ثالثا ، تسمح المحاذاة الدقيقة لملف النقل لمصدر طاقة التردد اللاسلكي الخارجي عبر ملف حصادة الطاقة للجهاز المزروع بمشبك معقوفة بالتشغيل المستقر. أخيرا ، لتأكيد التحفيز الكهربائي بالإضافة إلى الملاحظة البصرية لارتعاش العضلات ، يوصى بالمراقبة الفسيولوجية العصبية الدورية. في حالة التشريح الأكثر تعقيدا للعصب الحجابي في الرقبة ، يساعد التأكيد الفيزيولوجي الكهربي في إثبات أن العصب الصحيح قد تم عزله (الشكل 6).
إلى جانب المحفزات الكهربائية اللاسلكية الخالية من البطاريات الموضحة في هذه الورقة18،19،21 ، من المحتمل أن تشترك العديد من الأجهزة الأخرى في نفس الإجراءات. على سبيل المثال ، نظرا لأن الأقطاب الكهربائية المصممة للزرع في الأعصاب البلعومية والمبهمة لتسجيل الإشارات بشكل مزمن من الجهاز العصبي الوديواللاودي 30،45،46 تشترك في منطقة جراحية مماثلة مع العصب الحجابي ، يمكن تكييف هذا البروتوكول لزرعها. تعد المحفزات اللاسلكية المتوافقة حيويا طويلة المدى للأعصاب الطرفية ، مثل ReStore ، أدوات رائعة للبقاء في مكانها وتحفيز الأعصاب حسب الحاجة25،47،48،49،50. كما تم الإبلاغ عن غرسات تسجيل لاسلكية متعددة القنوات ذات صلة51. بشكل عام ، نعتقد أنه يمكن تكييف بروتوكولات التحفيز الجراحي والكهربائي هذه كمعيار لجميع واجهات الأعصاب المحيطية اللاسلكية المتعلقة بالتحفيز الكهربائي أو التسجيل.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
استخدم هذا العمل منشأة NUFAB التابعة لمركز NUANCE بجامعة نورث وسترن ، والتي تلقت دعما من SHyNE Resource (NSF ECCS-1542205) ، و IIN ، وبرنامج MRSEC في Northwestern (NSF DMR-1720139). استفاد هذا العمل من مرفق MatCI المدعوم من برنامج MRSEC التابع للمؤسسة الوطنية للعلوم (DMR-1720139) في مركز أبحاث المواد بجامعة نورث وسترن. تعترف CF بالدعم المقدم من معهد يونيس كينيدي شرايفر لصحة الطفل والتنمية البشرية التابع للمعاهد الوطنية للصحة (المنحة رقم R03HD101090) والمؤسسة الأمريكية العصبية العضلية (منحة التنمية). يقر ي. ه. بالدعم المقدم من مؤسسة العلوم الوطنية (رقم المنحة. CMMI1635443). تم دعم هذا العمل من قبل معهد كويري سيمبسون للإلكترونيات الحيوية في جامعة نورث وسترن.
Materials
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
References
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7(2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, Pt 6 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990(2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724(2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397(2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349(2018).
- Repair Brushart, M. Nerve Repair. , Oxford University Press. (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723(2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066(2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698(2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115(2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved