Method Article
Implantation und Steuerung von drahtlosen, batterielosen Systemen für periphere Nervenschnittstellen
In diesem Artikel
Zusammenfassung
Dabei handelt es sich um ein Protokoll für die chirurgische Implantation und den Betrieb einer drahtlos betriebenen Schnittstelle für periphere Nerven. Wir demonstrieren die Nützlichkeit dieses Ansatzes anhand von Beispielen von Nervenstimulatoren, die entweder auf dem Ischias- oder dem Phrenicusnerv der Ratte platziert wurden.
Zusammenfassung
Periphere Nervenschnittstellen werden häufig in den experimentellen Neurowissenschaften und der regenerativen Medizin für eine Vielzahl von Anwendungen eingesetzt. Solche Schnittstellen können Sensoren, Aktoren oder beides sein. Herkömmliche Methoden der peripheren Nervenschnittstelle müssen entweder an ein externes System angeschlossen sein oder auf Batteriestrom angewiesen sein, was den Zeitrahmen für den Betrieb begrenzt. Mit den jüngsten Entwicklungen von drahtlosen, batterielosen und vollständig implantierbaren peripheren Nervenschnittstellen kann eine neue Klasse von Geräten Fähigkeiten bieten, die denen ihrer kabelgebundenen oder batteriebetriebenen Vorgänger entsprechen oder diese übertreffen. In dieser Arbeit werden Methoden beschrieben, um (i) dieses System chirurgisch zu implantieren und (ii) drahtlos mit Strom zu versorgen und zu steuern. Die Modelle des Ischias- und des Nervus phrenicus wurden als Beispiele ausgewählt, um die Vielseitigkeit dieses Ansatzes zu verdeutlichen. Die Arbeit zeigt, wie die periphere Nervenschnittstelle zusammengesetzte Muskelaktionspotentiale (CMAPs) hervorrufen, ein therapeutisches elektrisches Stimulationsprotokoll liefern und einen Kanal für die Reparatur peripherer Nervenverletzungen integrieren kann. Solche Geräte bieten erweiterte Behandlungsmöglichkeiten für die therapeutische Stimulation mit Einzeldosis oder wiederholter Dosis und können an eine Vielzahl von Nervenstandorten angepasst werden.
Einleitung
Traumatische periphere Nervenverletzungen (PNIs) treten in den USA mit einer jährlichen Inzidenz von etwa 200.000 pro Jahr auf1. Die meisten Patienten, die an PNIs leiden, bleiben mit dauerhaften funktionellen Beeinträchtigungen zurück. Im schlimmsten Fall kann dies zu einer Muskellähmung führen und behandlungsrefraktäre neuropathische Schmerzen auslösen, die so stark sind, dass die Patienten bereit sind, sich einer Amputation von Gliedmaßen als Behandlungzu unterziehen 2. Das größte Hindernis für die Verbesserung der PNI-Ergebnisse besteht darin, dass die Regeneration der Axone im Verhältnis zu den Entfernungen, in denen sie nachwachsen müssen, zu langsam ist. Zum Beispiel wächst ein erwachsenes menschliches Axon mit 1 mm/Tag, muss sich aber im Falle einer Läsion in einer proximalen Gliedmaße über Entfernungen >1000 mm regenerieren.
In der aktuellen klinischen Praxis müssen ~50 % der PNIs chirurgisch repariert werden3. Für eine erfolgreiche Nervenregeneration müssen die Axone (i) über die Läsionsstelle wachsen (d. h. Lückenkreuzung) und sich dann (ii) entlang der Nervenbahn regenerieren, um ein Endorganziel zu erreichen (d. h. distales Nachwachsen) (Abbildung 1). Es gibt keine von der FDA zugelassenen Medikamente, die nachweislich die Nervenregeneration beschleunigen. Der Status quo des klinischen Managements von PNI hat sich in den letzten Jahrzehnten nur schrittweise verändert und beschränkt sich auf technische Verfeinerungen chirurgischer Methoden, wie z. B. distale motorische Nerventransfers, um die Distanz zu verkürzen, die regenerierende Axone zurücklegen müssen4 oder synthetische Nervenleitungen "von der Stange" für Fälle, in denen sich der proximale Nerv zurückzieht und nicht direkt wieder zusammengenäht werden kann5. Es gab jedoch vier randomisierte klinische Studien zur therapeutischen Elektrostimulation, die postoperativ auf Nerven angewendet wurde, bei denen es sich um monozentrische Studien unter der Leitung von Dr. K. Ming Chan an der University of Alberta handelte, die eine signifikant verbesserte Reinnervation von Muskeln 6,7,8 oder Haut9 zeigten. Die grundlegende Arbeit für dieses elektrische Stimulationsprotokoll wurde an Nagetieren10,11 durchgeführt, wo gezeigt wurde, dass die elektrische Stimulation spezifisch durch die Verbesserung der Spaltüberquerung (Abbildung 1), aber nicht durch das distale Nachwachsen 12,13,14,15 wirkt.
Die chirurgische Platzierung von transkutanen Drahtelektroden, die in allen vier randomisierten klinischen Studien zur Elektrostimulation verwendet wurden, war notwendig, da ihre Wirkung von der Abgabe eines ausreichenden Stroms abhängt, um den Neuronenzellkörper bei 20 Hz kontinuierlich für 1 h zu depolarisieren1 h 11. In der klinischen Praxis ist dieses Elektrostimulationsprotokoll für die meisten Patienten bei den Intensitäten, die über oberflächenstimulierende Elektroden auf der Haut aufgrund von Schmerzen erforderlich sind, nicht tolerierbar. Es gibt nicht triviale Risiken, die mit dem Führen von transkutanen Elektroden nach der Operation verbunden sind, wie z. B. eine tiefe Wundinfektion oder eine versehentliche Verschiebung von Drähten von den Nerven während des Patiententransports aus dem Operationssaal (OP). Darüber hinaus sind die hohen Kosten für die OP-Zeit selbst ein Hindernis dafür, dies in diesem Umfeld zu versuchen, anstatt während der akuten postoperativen Erholung. Eine neue Klasse von drahtlosen, batterielosen und vollständig implantierbaren peripheren Nervenschnittstellen entsteht, um dieses Manko bestehender peripherer Nervenschnittstellen zu beheben.
Diese neue Klasse von drahtlosen, implantierbaren elektronischen Systemen ist in der Lage, die Dosierung von Elektrostimulationen einfacher und flexibler zu machen und die Barrieren zu überwinden, die eine breitere klinische Implementierung verhindern. In dieser Arbeit werden Methoden beschrieben, um (i) dieses System chirurgisch zu implantieren und (ii) drahtlos mit Strom zu versorgen und zu steuern. Es zeigt, wie die periphere Nervenschnittstelle CMAPs hervorrufen, ein therapeutisches elektrisches Stimulationsprotokoll liefern und sogar als Kanal für die Reparatur peripherer Nerven fungieren kann. Die Protokolle hier können für andere Varianten dieser Technologie angepasst werden, die Lichtimpulse für die optogenetisch vermittelte Neuromodulation16, die kontrollierte Wirkstofffreisetzung17 oder wiederholte Anfälle elektrischer Stimulation über die Zeitabgeben können 18,19.
Protokoll
Alle in diesem Protokoll beschriebenen Verfahren werden in Übereinstimmung mit dem NIH-Leitfaden für die Pflege und Verwendung von Labortieren durchgeführt und wurden vom Institutional Animal Care and Use Committee (IACUC) der Northwestern University genehmigt. Dieses Protokoll folgt den Tierpflegerichtlinien des Center for Comparative Medicine der Northwestern University und der IACUC. Bei der Anpassung der Protokolle ist es notwendig, die IACUC zu konsultieren.
1. Herstellung eines drahtlosen elektronischen Stimulators (Abbildung 2)
- Verwenden Sie Kupfer/Polyimid/Kupfer (18 μm dickes oberes und unteres Kupfer, 75 μm dickes Polyimid) als Substrat für die Hochfrequenz-Power-Harvester-Spule (d. h. drahtlose Empfängerantenne).
- Verwenden Sie die direkte Laserablation, um Löcher für die Elektroden auf der oberen und unteren Kupferschicht zu strukturieren und das Gerät zu formen. Verbinden Sie die obere und untere Schicht elektrisch mit Silberpaste durch die Löcher.
- Befestigen Sie die elektronischen Komponenten mit handelsüblichen Verpackungen wie Diode und Kondensator durch Löten.
- Verwenden Sie das bioresorbierbare dynamische kovalente Polyurethan (b-DCPU; 200 μm dick) eingekapseltes Molybdän (Mo; 15 μm dick; Serpentinstruktur) als dehnbare Verlängerungselektroden19.
- Die Manschettenelektrode für die Schnittstelle zwischen Gerät und Nerv wird mit einer 300 μm dicken Polymilch-Co-Glykolsäure-Folie (PLGA) geformt.
- Nach dem Anschließen der drahtlosen Empfängerantenne und der dehnbaren Verlängerungselektrode verkapseln Sie die drahtlose Empfängerantenne und die Verbindung mit handelsüblichem wasserdichtem Epoxid oder Polydimethysiloxan (PDMS). Siehe Abbildung 2 (rechts) für das fertig montierte Gerät.
- Bestätigen Sie den drahtlosen Betrieb des Geräts, indem Sie einen Wellenformgenerator verwenden, um monophasische elektrische Impulse über die Primärspule (d. h. die Übertragungsspule) zu erzeugen.
ANMERKUNG: Bei der Untersuchung der Rekrutierung peripherer Axone und der Induktion der axonalen Regeneration durch monophasische und biphasische Stimuli berichteten frühere Studien über einen vernachlässigbaren Effekt aufgrund der Unterschiede in der Wellenformcharakteristik20, und diese Gruppe war in der Lage, eine Verbesserung der therapeutischen elektrischen Stimulation mit den gleichen monophasischen Stromparametern bei Mäusen21 und Ratten18 zu erzielen. Darüber hinaus untersuchten frühere Studien die Biokompatibilität in vivo und in vitro und fanden keine Hinweise auf Gewebeschäden durch Erhitzungseffekte oder die Materialien selbst. Aufgrund dieser Befunde und der begrenzten Dauer der therapeutischen Elektrostimulation in der vorliegenden Studie wurden in diesem Protokoll monophasische statt biphasische Stimuli verwendet. - Messen Sie die resultierende Gleichstrom-Ausgangsspannung mit einem Oszilloskop, das an die Manschettenelektrode angeschlossen ist.
2. Vorbereitung des Produkts für die Implantation
- Legen Sie die Implantate in eine sterile Petrischale und versiegeln Sie diese mit Parafilm.
- Bestrahlen Sie die Geräte mit UV-Licht für 30 min pro Seite.
3. Chirurgischer Eingriff der Implantation des rechten Ischiasnervs der Ratte einer drahtlosen, batterielosen peripheren Nervenschnittstelle zur elektrischen Stimulation (Abbildung 3)
HINWEIS: Halten Sie sterile Bedingungen aufrecht. Führen Sie Operationen innerhalb des dafür vorgesehenen Operationsbereichs eines Behandlungsraums bei Tieren durch. Der Chirurg trägt während der Operation eine Gesichtsmaske, einen Mantel, eine Mütze und sterile Handschuhe. Wenn mehr als eine Operation durchgeführt wird, wechseln Sie die sterilen Handschuhe zwischen den Tieren und verwenden Sie für jede Operation saubere, sterile chirurgische Instrumente. Sterilisieren Sie die Werkzeuge zwischen den Operationen durch Hitzesterilisation (Autoklav oder Glasperlensterilisator). Verwenden Sie ausgewachsene Sprague-Dawley-Ratten mit einem Gewicht von 200-250 g.
- Eine Anästhesie mit einer Isofluran-Gasanästhesie (3 % Induktion, 1-3 % Erhaltung) in Sauerstoff (2 l/min) mit subkutaner Verabreichung von Meloxicam (1-2 mg/kg) einleiten. Bedecken Sie die Augen der Ratten mit einer speziellen Augensalbe, um ein Austrocknen zu verhindern.
- Legen Sie die Ratten für nachfolgende Eingriffe in Bauchlage auf desinfizierte Operationstische. Beurteilen Sie für die verbleibende Dauer der Operation die Atemfrequenz (sollte ~2/s betragen), die Gewebefarbe und die Anästhesietiefe mindestens alle 15 Minuten und halten Sie den Isofluranspiegel entsprechend aufrecht. Bestätigen Sie die angemessene Narkosetiefe, indem Sie den Pedalreflex (mangelnde Reaktion auf ein festes Einklemmen der Zehen) überprüfen. Überwachen Sie die Schleimhäute, die rosa und feucht bleiben sollten.
- Rasieren Sie den Operationsbereich, einschließlich des rechten Beins und der unteren Hälfte des Rückens. Schrubben Sie den rasierten Operationsbereich mit einem Betadin-Pad, gefolgt von einem 70%igen medizinischen Ethanoltupfer und wiederholen Sie diesen Peeling-Vorgang dreimal zur Hautdesinfektion.
- Mit einer Gewebeschere wird ein 1,5 – 2 cm langer Hautschnitt parallel zum rechten Oberschenkelknochen gemacht, gefolgt von einer stumpfen Abtrennung des subkutanen Bindegewebes auf dem Rücken (direkt medial des Schnitts), um eine subkutane Tasche für die Empfängerspule freizumachen (Abbildung 4A). Machen Sie einen anschließenden Schnitt (1,2-1,5 cm) am rechten Gesäßmuskel parallel zum Hautschnitt.
- Isolieren Sie den Ischiasnerv vorsichtig mit Metalldissektionssonden mit stumpfen Enden (Abbildung 4B).
HINWEIS: Der Ischiasnerv befindet sich tief am Bizeps femoris und verläuft parallel zum Oberschenkelknochen. Ein Sezierfernrohr wird vorgeschlagen. - Implantieren Sie das drahtlose, batterielose Gerät auf den Ischiasnerv (Abbildung 4C), indem Sie die Manschette um den isolierten rechten Ischiasnerv wickeln, ohne den Nerv unter Spannung zu setzen oder seine Bahn zu verzerren 18,19,20. Markieren Sie auf der Haut, wo die Empfängerspule für eine weitere elektrische Stimulation platziert ist.
- Nähen Sie den Gesäßmuskelschnitt mit resorbierbaren Nähten (Abbildung 4D).
HINWEIS: Die obere Hälfte der Empfängerspule sitzt über dem Gesäßmuskel und die Manschettenschnittstelle darunter. - Verschließen Sie den Hautschnitt mit Wundklammern (oder vergrabener Naht; Abbildung 4E). Passen Sie die Hautränder an.
- 1 Stunde kontinuierliche postoperative elektrische Stimulation mit 20 Hz und 200 μs Pulsbreite unter Narkose (Abbildung 4F). Bringen Sie die Tiere in ihre Heimatkäfige zurück, nachdem sie sich vollständig von der Narkose erholt haben.
HINWEIS: Das detaillierte Protokoll wird unten beschrieben. Die Empfängerspule ist in Abbildung 4F oberhalb der Haut dargestellt. - Postoperative Behandlung
- Setzen Sie die Ratte in einen Auffangkäfig ohne Einstreu, der mit Papiertüchern ausgelegt ist, wobei die Hälfte des Käfigs auf eine geeignete temperaturgeregelte Wärmequelle (zugelassenes Heizkissen) gestellt wird.
- Beobachte die Ratte sorgfältig, bis sie gehfähig ist. Sobald die Ratte gehfähig und stabil ist, setzen Sie sie in den häuslichen Käfig zurück und achten Sie auf eine soziale Wiedereingliederung.
- Überwachen Sie die Ratten nach der akuten Genesung auf Infektionen an der Inzisionsstelle und auf Symptome neurogener Schmerzen, einschließlich, aber nicht beschränkt auf Bewachen, Sichwinden, Kratzen und Selbstverstümmelung. Überwachen Sie die Ratten täglich für die 5-tägige postoperative Erholungsphase und danach mindestens alle drei Tage, wenn die Ratten nicht an Tag 5 getötet werden.
- Meloxicam (1-2 mg/kg) einmal täglich für zwei bis drei Tage nach der Operation subkutan verabreichen, abhängig vom Grad der Schmerzen/Beschwerden des Tieres. Wenn der Verdacht auf anhaltende Schmerzen besteht, setzen Sie Meloxicam postoperativ über diesen Zeitraum hinaus fort, und wenn es sich als refraktär erweist, euthanasieren Sie die Ratte frühzeitig in Absprache mit dem Tierarztteam.
- Entfernen Sie die Hautnähte oder Wundklammern 10-12 Tage nach der Operation.
4. Chirurgischer Eingriff bei der Implantation des linken Phrenicus der Ratte mit drahtlosen Stimulatoren (Abbildung 5A)
HINWEIS: Halten Sie sterile Bedingungen ein, wie in Abschnitt 3 beschrieben. Verwenden Sie erwachsene Sprague-Dawley-Ratten mit einem Gewicht von 200-250 g. Sterilisieren Sie alle chirurgischen Instrumente vor dem Gebrauch.
- Eine Anästhesie mit einer Isofluran-Gasanästhesie (3 % Induktion, 1-3 % Erhaltung) in Sauerstoff (2 l/min) mit subkutaner Verabreichung von Meloxicam (1-2 mg/kg) einleiten. Bedecken Sie die Augen der Ratte mit einer speziellen Augensalbe, um ein Austrocknen zu verhindern.
- Legen Sie die Ratten für nachfolgende Eingriffe in Rückenlage auf desinfizierte Operationstische. Beurteilen Sie für die verbleibende Dauer der Operation die Atemfrequenz, die Gewebefarbe und die Narkosetiefe mindestens alle 15 Minuten und halten Sie den Isofluranspiegel entsprechend aufrecht. Bestätigen Sie die angemessene Narkosetiefe, indem Sie den Pedalreflex (mangelnde Reaktion auf ein festes Einklemmen der Zehen) überprüfen. Überwachen Sie die Schleimhäute, die rosa und feucht bleiben sollten.
- Rasieren Sie den Operationsbereich auf der ventralen Seite des Halses. Schrubben Sie den rasierten Operationsbereich mit einem Betadin-Pad, gefolgt von einem 70%igen medizinischen Ethanoltupfer und wiederholen Sie diesen Peeling-Vorgang dreimal zur Hautdesinfektion.
- Bupivacain (2 mg/kg, verdünnt in Kochsalzlösung bis zu einem Gesamtvolumen von 0,5 ml) subkutan an der Mittellinie am Hals verabreichen, wobei die oberflächlichste Schicht anvisiert wird. Machen Sie einen 3 cm langen Mittellinienschnitt durch die Haut und die oberflächliche Halsfaszie, um die Muskeln sternohyoideus und sternocleidomastoideus freizulegen (Abbildung 5B).
HINWEIS: Es wird ein Sezierfernrohr empfohlen. - Das Sternocleidomastoideum wird durch sanfte stumpfe Dissektion mit einer Sonde angehoben und mit einer Gefäßschlaufe seitlich zurückgezogen (Abbildung 5C). Befreien Sie das Omohyoid vorsichtig und ziehen Sie es zurück. Als nächstes werden der Vagusnerv und das Halsschlagaderbündel unterhalb des Musculus omohyoideus vorsichtig befreit und medial zurückgezogen.
HINWEIS: Die Hauptunterscheidung besteht hier zwischen dem Vagusnerv und dem Nervus phrenicus. Schneiden Sie das Omohyoid ab, wenn es notwendig ist, die darunter liegenden Strukturen freizulegen. - Isolieren Sie den Nervus phrenicus (Abbildung 5D).
ANMERKUNG: Der Nervus phrenicus verläuft entlang der Oberfläche des Musculus scalene anterior und verläuft als bemerkenswert kleiner Längsnerv, der senkrecht zum Plexus brachialis verläuft. Im Gegensatz zum Ischiasnerv ist die Anatomie um den Nervus phrenicus am Hals komplexer. Führen Sie vor der Implantation eine elektrophysiologische Bestätigung (Schritt 4.7) durch, um optimale Ergebnisse zu erzielen. - Platzieren Sie die Aufzeichnungselektrode subkutan, nur kaudal zum Brustkorb, ipsilateral zum isolierten Nervus phrenicus (Abbildung 5E). Platzieren Sie die Stimulatoren auf dem Nervus phrenicus und bestätigen Sie sie über synchrone Signale (Abbildung 6).
HINWEIS: Typisch ist das Hervorrufen einer maximalen Reaktion mit einer Stimulusintensität von ~3-6 mA und einer Stimulusdauer von 0,02 ms. - Überprüfen Sie die vollständige Durchtrennung des Nervus phrenicus, indem Sie die vollständige Aufhebung der evozierten Reaktion zeigen, wenn ein elektrischer Stimulus auf das proximale Nervenende relativ zur Durchtrennungsstelle angewendet wird (Abbildung 6).
- Implantieren Sie ein drahtloses, batterieloses Gerät auf den Nervus phrenicus (Abbildung 5F), indem Sie die Empfängerspule des implantierbaren Geräts auf dem Sternohyoideus platzieren, tief relativ zu den bilateralen Musculus sternocleidomastoideus, wobei die Manschette um den Nervus phrenicus gelegt wird und die Kontaktelektroden senkrecht zum Nerv positioniert sind.
- Verschließen Sie die oberflächliche zervikale Faszie mit einfachen, resorbierbaren Nähten (Abbildung 5G). Verschließen Sie die Haut mit unterbrochenen invertierten resorbierbaren Nähten in der tiefen Dermis. Bringen Sie die Tiere erst dann in ihre Heimatkäfige zurück, wenn sie sich vollständig von der Narkose erholt haben.
- Für die postoperative Behandlung befolgen Sie Schritt 3.10.
5. Drahtlose Verabreichung der therapeutischen Elektrostimulation
- Wenden Sie die Ratten 1 h lang unter Vollnarkose elektrisch zu stimulieren. Für die drahtlose Stimulation wird ein Wellenform-/Funktionsgenerator (Spannung: 1-15 Vs) und ein optionaler Verstärker über dem Tier platziert, um eine externe induktive Spule (d. h. eine Übertragungsspule) (zweidimensionale Spiralspule mit 5 Windungen; Durchmesser: 2 cm) mit Strom zu versorgen, um eine gute induktive Kopplung mit der implantierten Empfängerspule zu gewährleisten. Liefern Sie monophasische 200-μs-Impulse bei 20 Hz für eine Dauer von 1 Stunde.
- Um die Verabreichung der elektrischen Stimulation zu überprüfen und zu quantifizieren, zeichnen Sie CMAPs vom vorderen Schienbeinmuskel auf und passen Sie die Stimulationsspannung an, um eine supramaximale Aktivierung des Ischiasnervs zu erreichen. Verwenden Sie für alle Aufnahmen konzentrische Nadelelektroden.
HINWEIS: Wenn die von der Funktion erzeugte maximale Spannung nicht ausreicht, um eine maximale Reaktion hervorzurufen, verwenden Sie einen Verstärker.
6. Euthanasie
- Primäre Methode
- Stellen Sie den Käfig unter eine CO2 - Förderkammer, die auf eine Rate von 8-12 l/min (oder eine geeignete Durchflussrate basierend auf der Kammergröße) eingestellt ist. Überwachen Sie die Ratten auf Bewusstlosigkeit und dann für mindestens 1 Minute Atemstillstand.
- Sekundäre Methode
- Führen Sie eine zervikale Luxation oder eine bilaterale Thorakotomie durch.
Ergebnisse
Im Ischiasnerv-Verletzungsmodell wird das Implantat um den rechten Ischiasnerv herum platziert, bevor der Tibianervast vollständig repariert wird (Abbildung 3, Abbildung 4A und Abbildung 7A). Eine konzentrische 30-G-Nadelelektrode wird in den rechten Musculus tibialis anterior eingesetzt, um die Reizparameter zu definieren, die für eine elektrische Stimulation mit maximaler Intensität erforderlich sind. Zu diesen Experimenten gehört die Erhöhung der Stimulationsintensität, bis die Antwortgröße ein Maximum erreicht. Da der Tibialis anterior vom fibulären Ast des Ischiasnervs innerviert wird, wird er bei der Durchtrennungsverletzung des Nervus tibialis geschont. Somit ermöglicht die Aufzeichnung von Tibialis anterior eine kontinuierliche Überwachung der Elektrostimulationsbehandlung.
Für einen einzelnen Stimulusimpuls, der von einer Drahtelektrode an den rechten Ischiasnerv abgegeben wird (5 mA, 0,02 ms), wird eine maximale CMAP-Antwort mit einer negativen Spitzenamplitude von 5,4 mV ausgelöst, die auf dem ipsilateralen Tibialis anterior aufgezeichnet wurde (Abbildung 7B; schwarze Spur). Für einen vergleichbaren Stimulusimpuls, der vom drahtlosen, batterielosen Implantat abgegeben wird, wird eine vergleichbare CMAP-Antwort mit einer negativen Spitzenamplitude von 4,6 mV hervorgerufen (Abbildung 7B; orangefarbene Spur). Dies steht im Einklang mit einem kürzlich veröffentlichten Bericht, wonach die drahtlose Nervenstimulation im Durchschnitt 88 % der CMAP aus der drahtbasierten Nervenstimulation21 erreicht, was weit über dem Schwellenwert liegt, der in klinischen Studien für therapeutische Effekte erforderlich ist 6,7,8,9. Im gezeigten Beispiel war die längere Latenz des drahtlosen Stimulators im Vergleich zum kabelgebundenen Stimulator auf seinen größeren Abstand zum aufgezeichneten Muskel zurückzuführen.
Im Modell des Nervus phrenicus wird das Implantat vor der Durchtrennung um den rechten Nervus phrenicus herum platziert (Abbildung 5). Um die Stimulusparameter zu definieren, die für eine elektrische Stimulation mit maximaler Intensität erforderlich sind, wird eine konzentrische 30-G-Nadelelektrode subkutan am rechten (ipsilateralen) vorderen Rippenrand platziert, um vom rechten Hemidiaphragma aus aufzuzeichnen. Bei den Experimenten wird die Stimulationsspannung erhöht, bis die Antwortgröße auf ihrem Maximum einpendelt. Da es schwierig sein kann, den Nervus phrenicus von den umgebenden neurovaskulären Strukturen zu isolieren, kann seine Identität durch eine Zuckungsreaktion bestätigt werden (Abbildung 6; orangefarbene Spur). Die Spezifität der Stimulation kann durch Durchtrennung des Nervus phrenicus distal der Nervenelektrodenmanschette mit anschließender Aufhebung der Zuckungsantwort weiter verifiziert werden (Abbildung 6; schwarze Spur).
Eine repetitive, niederfrequente Elektrostimulationstherapie kann dem Ischiasnerv 1 h lang unter Verwendung eines etablierten Protokolls verabreicht werden, das die Axonregeneration verbessert (6,7,8,9,10,11; Abbildung 8). Die Manschettenschnittstelle des drahtlosen Implantats wurde auf dem rechten Ischiasnerv platziert, und die konzentrische 30-G-Nadelelektrode wurde auf den rechten Tibialis-Vordermuskel gelegt, um die Behandlung zu überwachen. Abbildung 8A zeigt vier aufeinanderfolgende Spitzen in der aufgezeichneten Elektromyographie zu Beginn (0 min) der 1 h 20 Hz elektrischen Stimulation. Abbildung 8B zeigt vier weitere Spitzen, die während der 40 Minuten der 1-stündigen elektrischen Stimulation mit einer leichten Abnahme der Spitzenamplitude aufgezeichnet wurden, was mit dem Ermüdungsmuster übereinstimmt, das bei der drahtbasierten Elektrostimulationstherapie15,21 festgestellt wurde.
Der Grad der peripheren Nervenregeneration kann mit Hilfe von retrograden Tracern beurteilt werden, die distal auf die Nervenläsionsstelle appliziert werden. Da periphere Axone mehrere Kollateralsprossen sprießen lassen, ermöglichen die retrograde Verfolgung und Zählung des Motoneuronsomas im Rückenmark eine genauere Beurteilung der Anzahl der regenerierenden Neuronen als die Zählung der regenerierenden Axone innerhalb des Nervs selbst31. Um dies zu demonstrieren, wurde der Ischiasnerv-Stamm durch eine Quetschverletzung durchtrennt. Nach 3-wöchiger Genesung wurden zwei verschiedene fluoreszierende retrograde Farbstoffe auf zwei Zweige des Ischiasnervs verabreicht: den Nervus fibularis (grün) bzw. den Nervus tibialis (rot) (Abbildung 9A). Abbildung 9B-D zeigt leuchtende Untergruppen von unteren Motoneuronen im Vorderhorn des lumbalen Rückenmarks, die entweder den Nervus tibialis (Abbildung 9B) oder den Nervus fibularis (Abbildung 9C) bilden. Das Overlay-Bild zeigt zwei unterschiedliche Spalten markierter Neuronen im Vorderhorn des Rückenmarks, die in Bezug auf die räumliche Verteilung und die Anzahl der Motoneuronen, die ein Axon distal der Läsionsstelle regeneriert haben, quantifiziert werden können (Abbildung 9D).
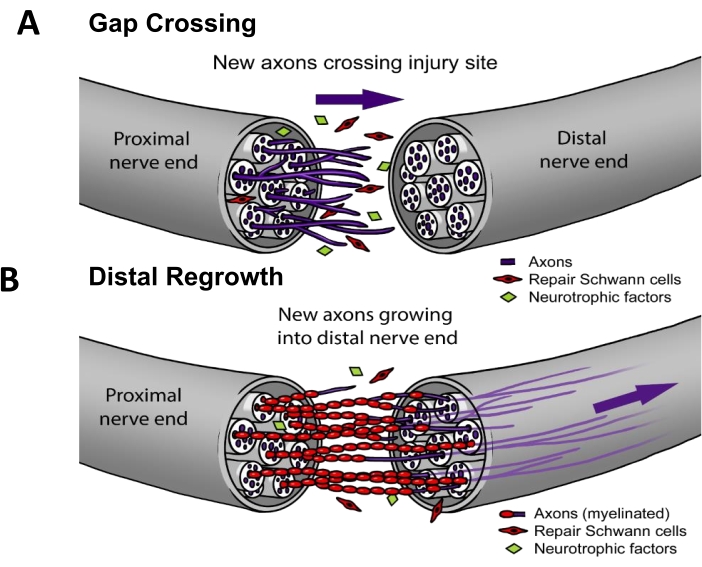
Abbildung 1: Modell der Nervenregeneration. (A) Die Lückenkreuzung tritt früh nach der Nervenreparatur auf, wenn die Axone nach der Reparatur vom proximalen zum distalen Nervenende wachsen. (B) Die Dauer des distalen Nachwachsens hängt mit dem Abstand zum Zielendorgan (z. B. Haut, Muskel) und der Geschwindigkeit des Axonnachwachsens zusammen. Die meisten Therapien zur Verbesserung der Nervenreparatur zielen auf einen oder beide dieser Prozesse ab. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
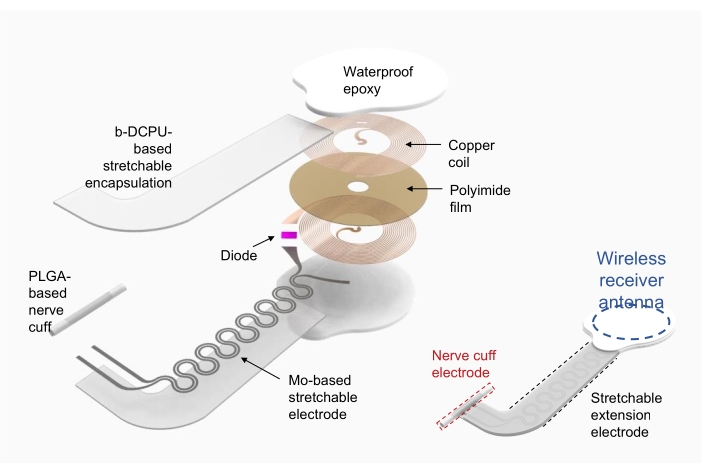
Abbildung 2: Illustration einer Herstellung eines drahtlosen elektronischen Stimulators. Links sind detaillierte Schichten der Struktur des Geräts zu sehen, darunter eine kreisförmige Hochfrequenz-Power-Harvester-Spule, eine dehnbare Verlängerungselektrode und eine Nervenmanschette, die sich um einen interessierenden Nerv wickelt. Rechts, eine vereinfachte Abbildung, die drei Teile des Geräts zeigt. Abkürzungen: PLGA = Poly(milchsäure-co-glykolsäure); b-DCPU = bioresorbierbares dynamisches kovalentes Polyurethan. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
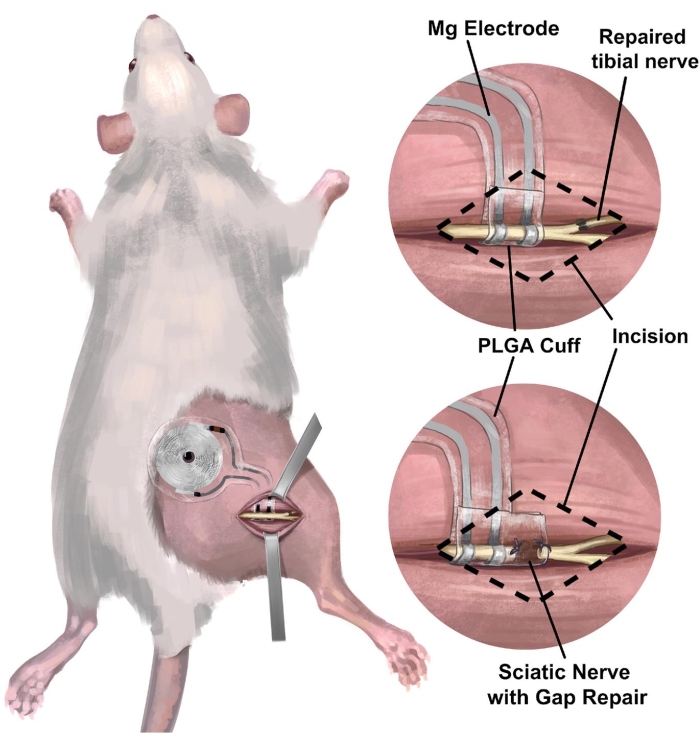
Abbildung 3: Implantation einer drahtlosen, batterielosen Nervenschnittstelle in das Ischiasnerv-Modell der Ratte. (A) Die Abbildung zeigt ein vollständig implantierbares System im rechten Ischiasnerv einer Ratte. (B) Das obere Bild zeigt eine Elektrodenschnittstelle, die auf dem Ischiasnerv direkt in der Nähe der End-to-End-Reparatur des rechten Tibianervs positioniert ist. Das untere Bild zeigt eine Elektrodenschnittstelle mit einer verlängerten Nervenmanschette, die die Lücke zwischen dem proximalen Ende und dem distalen Nervenstumpf überbrückt. Abkürzung: PLGA = Polymilch-Co-Glykolsäure. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
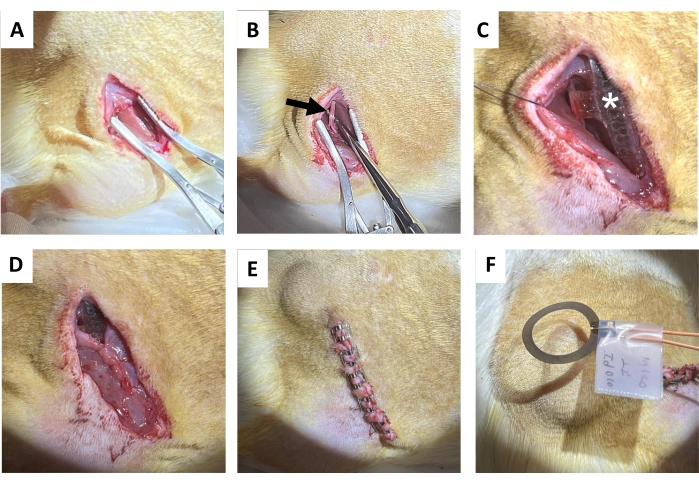
Abbildung 4: Verfahren zur Implantation des Ischiasnervs. (A) Einschnitt auf die Haut, das subkutane Bindegewebe und den Gesäßmuskel, um die hintere Oberschenkelmuskulatur freizulegen. (B) Isolierter Ischiasnerv (schwarzer Pfeil). (C) Gerät nach der Implantation mit Nervenmanschette, Drähten (weißes Sternchen) und sichtbarem Implantat (Stern). (D) Verschluss des Bindegewebes durch Naht. (E) Verschluss des Einschnitts durch Wundclips. (F) Drahtlose elektrische Stimulation, die durch eine Spule über der Haut erzeugt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
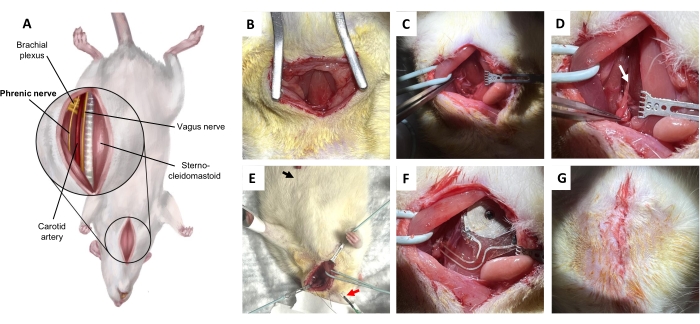
Abbildung 5: Verfahren zur Implantation des Nervus phrenicus. (A) Ventrale Ansicht des Halses in Rückenlage. (B) Inzision auf der Haut und im subkutanen Bindegewebe, um den Musculus sternohyoideus freizulegen. (C) Präparieren des Potentialraums zwischen dem Musculus omohyoideus und dem Musculus sternocleidomastoideus. (D) Nervus phrenicus (Pfeil), isoliert vom Plexus brachialis. (E) Diaphragmatische elektromyographische Bestätigung des Nervus phrenicus. Schwarzer Pfeil, Aufzeichnungselektrode. Roter Pfeil, Stimulatoren. (F) Implantation. (G) Verschluss der Haut mit tiefen Hautnähten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
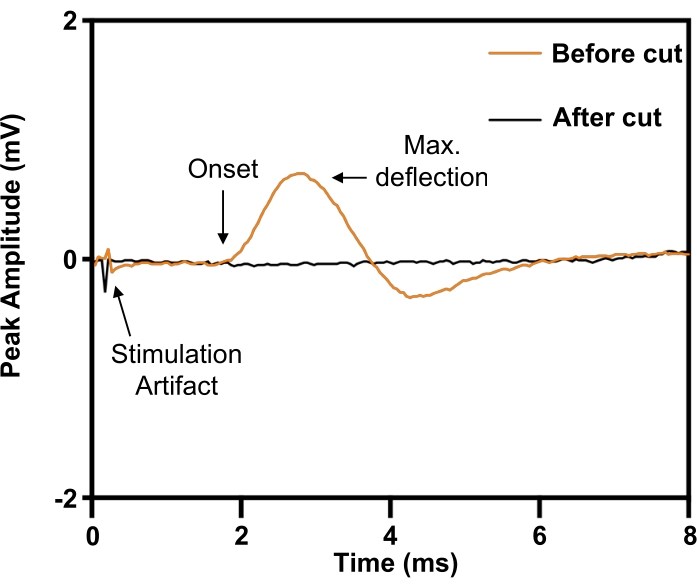
Abbildung 6: Bestätigung einer vollständigen Verletzung des Nervus phrenicus durch evozierte zusammengesetzte Muskelaktionspotentiale aus dem Zwerchfell. Vor der Durchtrennung des Nervus phrenicus (ORANGE) löste die elektrische Stimulation des Nervus phrenicus zusammengesetzte Muskelaktionspotentiale am ipsilateralen Zwerchfell aus, die durch die Durchtrennung des Nervus phrenicus (BLACK) aufgehoben wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
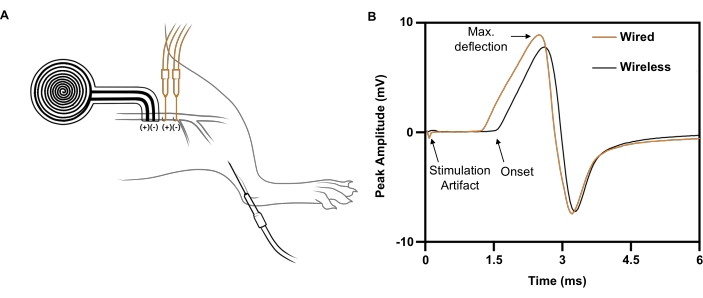
Abbildung 7: Repräsentative Nervenleitungsstudien, in denen drahtlose mit drahtgebundener Elektrostimulation verglichen wird. (A) Illustration der Platzierung von drahtlosen (SCHWARZ) und kabelgebundenen (ORANGE) Geräten auf dem Ischiasnerv. Die Aufzeichnungselektrode wurde im Tibialis anterior platziert. (B) Zusammengesetzte Muskelaktionspotentiale, die durch ein drahtgebundenes Implantat (ORANGE) im Vergleich zu einem drahtlosen Implantat (SCHWARZ) hervorgerufen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
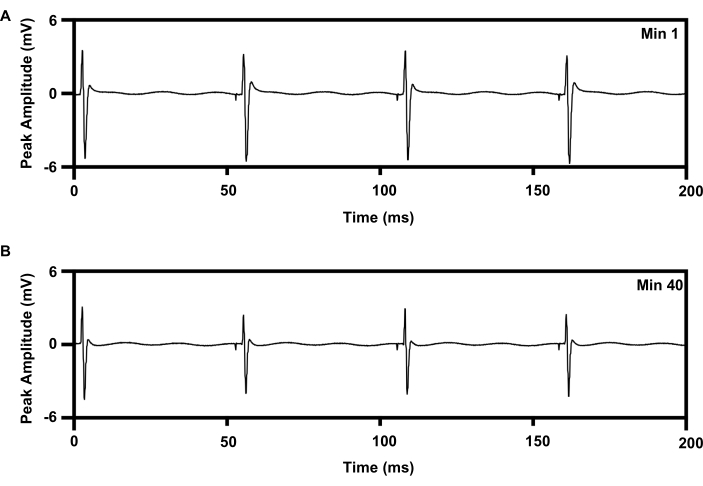
Abbildung 8: EMG-Aufzeichnung vom TA-Muskel mit 20 Hz repetitiver elektrischer Stimulation für 1 h von Implantaten. (A) EMG-Spur bei min 1 der E-Stim. (B) EMG-Spur bei min 40 von e-stim. Abkürzungen: EMG = Elektromyographie; TA = Tibialis anterior; E-Stim = Elektrische Stimulation; min = Minute. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
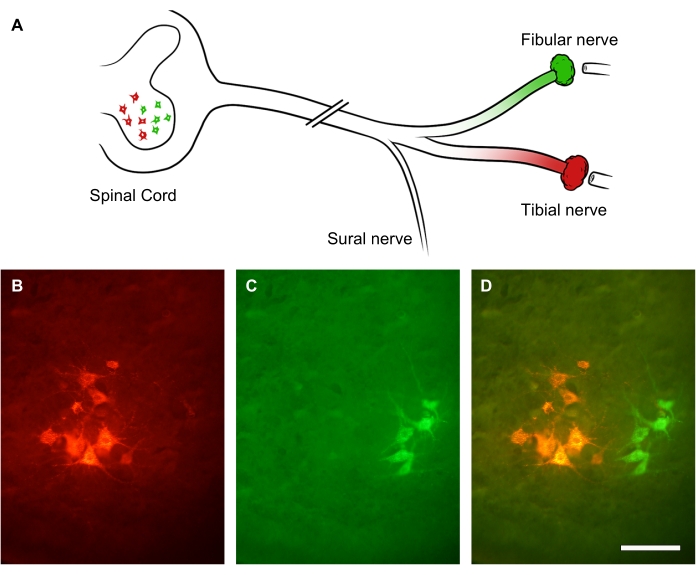
Abbildung 9: Repräsentative Bilder der Regeneration des Ischiasnervs. (A) Illustration einer Ischiasnervverletzung und fluoreszierender retrograder Markierung. Die Axone des Ischiasnervs wurden durch eine Quetschverletzung durchtrennt. Nach 3 Wochen der Genesung waren seine distalen Äste - der Nervus fibularis (in grün) und der Nervus tibialis (in rot) - retrograd markiert. (B-D) Bilder eines lumbalen Rückenmarks, das ein neuronales Soma innerhalb des ipsilesionalen Vorderhorns zeigt. Maßstabsbalken = 30 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Arbeit werden die Schritte der chirurgischen Implantation und des Betriebs einer drahtlosen, batterielosen und vollständig implantierbaren peripheren Nervenschnittstelle im Ischias- und Phrenicus-Nerv-Modell der Ratte beschrieben. Wir zeigen, wie diese neuartige Klasse von biomedizinischen Implantaten verwendet werden kann, um ein therapeutisches Elektrostimulationsparadigma zu liefern, das in präklinischen und klinischen Studien gezeigt hat, dass es die Axonregeneration verbessert (zur Übersicht, siehe22). Dieses Protokoll ist unkompliziert und kann auf kleinere Tiermodelle wie Mäuse21 sowie andere drahtlose, batterielose und vollständig implantierbare Geräte mit Funktionen wie optoelektronischen und mikrofluidischen peripheren Nervenschnittstellen 18,23,24,25,26,27,28,29,30 extrapoliert werden. Demonstriert wird auch der Ansatz unter Verwendung des Nagetier-Ischiasnervs, der das gebräuchlichste experimentelle Modellist 31.
Die Vielseitigkeit dieses Ansatzes hat sich gezeigt, wenn er an die Schnittstelle mit dem Nervus phrenicus angepasst wird, der selten als Modell für periphere Nervenverletzungen verwendet wird32, vielleicht weil es sich um ein stark unterschätztes klinisches Problem handelt 33,34,35. Die Diagnose und Rehabilitation von Verletzungen des Nervus phrenicus ist während der COVID-19-Pandemie zu einem wichtigen Thema geworden 36,37,38. Es ist derzeit nicht bekannt, ob die Regeneration der phrenischen Axone und die Erholung von der Zwerchfelllähmung durch dieses kurze, niederfrequente elektrische Stimulationsparadigma verbessert werden kann. Die elektrische Stimulation des Nervus phrenicus für die Stimulation der Zwerchfellmuskulatur ist jedoch eine etablierte Option bei respiratorischer Insuffizienz bei Patienten mit Tetraplegie aufgrund einer hohen zervikalen Rückenmarksverletzung 39,40,41,42,43. Weitere Indikationen werden derzeit untersucht, darunter die Entwöhnung von Beatmungsgeräten nach einer kritischen Erkrankung44.
Es sollten mehrere kritische Schritte hervorgehoben werden, um einen guten Betrieb des implantierten Systems zu gewährleisten. Erstens ist es wichtig, bei der Handhabung nicht zu viel Kraft auf die dünnen elektronischen Komponenten der Geräte auszuüben, um eine Entisolierung, ein Knicken oder einen Bruch des Bleis zu verhindern. Als nächstes ist es wichtig, die Position der Hochfrequenz-Power-Harvester-Spule auf der darüber liegenden Haut genau zu markieren. Drittens ermöglicht die sorgfältige Ausrichtung der Übertragungsspule des externen Hochfrequenznetzteils über der Power-Harvester-Spule des implantierten Geräts mit einer Schwanenhalsklemme einen stabilen Betrieb. Um die elektrische Stimulation zusätzlich zur visuellen Beobachtung der Muskelzuckungen zu bestätigen, wird eine regelmäßige neurophysiologische Überwachung empfohlen. Bei der komplexeren Anatomie des Nervus phrenicus im Nacken hilft die elektrophysiologische Bestätigung, dass der richtige Nerv isoliert wurde (Abbildung 6).
Neben den drahtlosen, batterielosen elektrischen Stimulatoren, die in diesem Artikel 18,19,21 gezeigt werden, haben viele andere Geräte möglicherweise die gleichen Verfahren. Da zum Beispiel Elektroden, die dazu bestimmt sind, sich in den Nervus glossopharyngeus und den Vagusnerv zu implantieren, um chronisch Signale vom sympathischen und parasympathischen Nervensystem30, 45, 46 aufzuzeichnen, ein ähnliches chirurgisches Gebiet mit dem Nervus phrenicus teilen, kann dieses Protokoll für ihre Implantation angepasst werden. Drahtlose biokompatible Langzeitstimulatoren für periphere Nerven, wie z. B. ReStore, sind großartige Werkzeuge, um an Ort und Stelle zu bleiben und die Nerven nach Bedarf zu stimulieren 25,47,48,49,50. Relevante Mehrkanal-Implantate für die drahtlose Aufzeichnung wurden ebenfalls gemeldet51. Insgesamt glauben wir, dass diese chirurgischen und elektrischen Stimulationsprotokolle als Standard für alle drahtlosen peripheren Nervenschnittstellen im Zusammenhang mit elektrischer Stimulation oder Aufzeichnung angepasst werden können.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Für diese Arbeit wurde die NUFAB-Einrichtung des NUANCE Center der Northwestern University verwendet, die von der SHyNE-Ressource (NSF ECCS-1542205), dem IIN und dem MRSEC-Programm von Northwestern (NSF DMR-1720139) unterstützt wurde. Für diese Arbeit wurde die MatCI Facility genutzt, die vom MRSEC-Programm der National Science Foundation (DMR-1720139) am Materials Research Center der Northwestern University unterstützt wird. C.K.F. bedankt sich für die Unterstützung durch das Eunice Kennedy Shriver Institute of Child Health and Human Development der NIH (Grant Nr. R03HD101090) und die American Neuromuscular Foundation (Development Grant). Y.H. bedankt sich für die Unterstützung durch die NSF (Zuschuss-Nr. CMMI1635443). Diese Arbeit wurde vom Querrey Simpson Institute for Bioelectronics an der Northwestern University unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
Referenzen
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7 (2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990 (2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724 (2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397 (2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349 (2018).
- Repair Brushart, M. . Nerve Repair. , (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723 (2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066 (2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698 (2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115 (2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten