Method Article
Имплантация и управление беспроводными безбатарейными системами для сопряжения периферических нервов
В этой статье
Резюме
Это протокол хирургической имплантации и эксплуатации интерфейса с беспроводным питанием для периферических нервов. Мы демонстрируем полезность этого подхода на примерах нервных стимуляторов, помещенных либо на седалищный, либо на диафрагмальный нерв крысы.
Аннотация
Интерфейсы периферических нервов часто используются в экспериментальной неврологии и регенеративной медицине для широкого спектра применений. Такими интерфейсами могут быть датчики, исполнительные механизмы или и то, и другое. Традиционные методы сопряжения периферических нервов должны либо быть привязаны к внешней системе, либо полагаться на питание от батареи, что ограничивает временные рамки операции. Благодаря недавним разработкам беспроводных, безбатарейных и полностью имплантируемых периферических нервных интерфейсов, новый класс устройств может предложить возможности, которые соответствуют или превосходят возможности их проводных предшественников или предшественников с батарейным питанием. В этой статье описываются методы (i) хирургической имплантации и (ii) беспроводного питания и управления этой системой у взрослых крыс. В качестве примеров были выбраны модели седалищного и диафрагмального нервов, чтобы подчеркнуть универсальность этого подхода. В статье показано, как периферический нервный интерфейс может вызывать сложные мышечные потенциалы действия (CMAPs), обеспечивать терапевтический протокол электростимуляции и включать проводник для восстановления повреждений периферических нервов. Такие устройства предлагают расширенные возможности лечения для однократной или повторной терапевтической стимуляции и могут быть адаптированы к различным нервным участкам.
Введение
Травматические повреждения периферических нервов (ПНИ) встречаются в США с ежегодной частотой около 200 000 вгод1. Большинство пациентов, страдающих ПНИ, остаются с постоянными функциональными нарушениями. В худшем случае это может привести к параличу мышц и вызвать резистентную к лечению нейропатическую боль, настолько сильную, что пациенты готовы подвергнуться ампутации конечности вкачестве лечения. Самым большим препятствием для улучшения результатов ПНИ является то, что регенерация аксонов происходит слишком медленно по сравнению с расстояниями, на которые они должны отрасти. Например, аксон взрослого человека растет со скоростью 1 мм/день, но в случае поражения проксимального отдела конечности ему может потребоваться регенерация на расстоянии >1000 мм.
В современной клинической практике ~50% ПНИ требуют хирургического вмешательства3. Для успешной регенерации нерва аксоны должны (i) расти поперек места поражения (т.е. пересечение щели), а затем (ii) регенерировать вниз по нервному пути, чтобы достичь мишени в органе-мишени (т.е. дистального отрастания) (рис. 1). Не существует одобренных FDA препаратов, способных ускорить регенерацию нервов. За последние несколько десятилетий статус-кво клинического ведения ПНИ изменился только постепенно и ограничивается техническими усовершенствованиями хирургических методов, таких как пересадка дистальных двигательных нервов для уменьшения расстояния, которое должны пройти регенерирующие аксоны4, или «готовые» синтетические нервные каналы для случаев, когда проксимальный нерв втягивается и не может быть непосредственно сшит обратно5. Тем не менее, было проведено четыре рандомизированных клинических исследования терапевтической электростимуляции, применяемой к нервам после операции, которые были одноцентровыми исследованиями под руководством доктора К. Минг Чана из Университета Альберты, которые показали значительное улучшение реиннервации мышц 6,7,8 или кожи9. Фундаментальная работа для этого протокола электростимуляции была проведена на грызунах 10,11, где было показано, что электростимуляция работает, в частности, усиливая пересечение щели (рис. 1), но не дистальный рост 12,13,14,15.
Хирургическое размещение чрескожных проволочных электродов, использованных во всех четырех рандомизированных клинических исследованиях электростимуляции, было необходимо, поскольку его эффекты зависят от подачи достаточного тока для деполяризации тела нейронной клетки с частотой 20 Гц непрерывно в течение 1 часа11 минут. В клинической практике этот протокол электростимуляции непереносим для большинства пациентов при требуемой интенсивности через поверхностно-стимулирующие электроды на коже из-за боли. Существуют нетривиальные риски, связанные с установкой чрескожных электродов в послеоперационном периоде, такие как инфицирование глубокой раны или случайное смещение проводов от нервов во время транспортировки пациента из операционной (ИЛИ). Кроме того, высокая стоимость операционного времени сама по себе является препятствием для того, чтобы попытаться сделать это в таких условиях, а не во время острого послеоперационного восстановления. Новый класс беспроводных, безбатарейных и полностью имплантируемых периферических нервных интерфейсов появляется для устранения этого недостатка существующих периферических нервных интерфейсов.
Этот новый класс беспроводных имплантируемых электронных систем призван повысить простоту и гибкость дозирования электростимуляции и разрушить барьеры, препятствующие ее более широкому клиническому применению. В этой статье описываются методы (i) хирургической имплантации и (ii) беспроводного питания и управления этой системой на моделях седалищного и диафрагмального нервов взрослых крыс. Он показывает, как интерфейс периферических нервов может вызывать CMAP, доставлять терапевтический протокол электростимуляции и даже выступать в качестве проводника для восстановления периферических нервов. Приведенные здесь протоколы могут быть адаптированы для других вариантов этой технологии, которые могут доставлять световые импульсы для оптогенетически опосредованной нейромодуляции16, контролируемого высвобождения лекарств17 или повторяющихся приступов электрической стимуляции в течение долгого времени18,19.
протокол
Все процедуры, описанные в этом протоколе, выполняются в соответствии с Руководством NIH по уходу и использованию лабораторных животных и были одобрены Институциональным комитетом по уходу и использованию животных (IACUC) Северо-Западного университета. Этот протокол соответствует рекомендациям по уходу за животными Центра сравнительной медицины Северо-Западного университета и IACUC. При адаптации протоколов необходимо проконсультироваться с IACUC.
1. Изготовление беспроводного электронного стимулятора (рис. 2)
- Используйте медь/полиимид/медь (верхняя и нижняя медь толщиной 18 мкм, полиимид толщиной 75 мкм) в качестве подложки для катушки радиочастотного сборщика мощности (т. е. антенны беспроводного приемника).
- Используйте прямую лазерную абляцию для создания отверстий для электродов на верхнем и нижнем слоях меди и придания формы устройству. Электрически соедините верхний и нижний слои с помощью серебряной пасты через отверстия.
- Прикрепите электронные компоненты к коммерческой упаковке, такие как диод и конденсатор, с помощью пайки.
- Используйте биорезорбируемый динамический ковалентный полиуретан (b-DCPU; толщина 200 мкм), инкапсулированный молибденом (Mo; толщина 15 мкм; змеевидная структура) в качестве растягивающихся удлинительных электродов19.
- Сформируйте манжетный электрод для интерфейса между устройством и нервом с помощью пленки из полимолочной гликолевой кислоты (PLGA) (толщиной 300 мкм).
- После подключения антенны беспроводного приемника и растягивающегося удлинительного электрода герметизируйте антенну беспроводного приемника и соединение с помощью коммерциализированной водонепроницаемой эпоксидной смолы или полидиметисилоксана (PDMS). На рисунке 2 (справа) показано полностью собранное устройство.
- Подтвердите беспроводную работу устройства, используя генератор сигналов для генерации монофазных электрических импульсов через первичную катушку (т. е. катушку передачи).
ПРИМЕЧАНИЕ: Изучая рекрутирование периферических аксонов и индукцию регенерации аксонов монофазными и двухфазными стимулами, предыдущие исследования сообщали о незначительном эффекте из-за различий в характеристике формы волны20, и эта группа смогла достичь терапевтического усиления электрической стимуляции с теми же параметрами монофазного тока у мышей21 и крыс18. Кроме того, в предыдущих исследованиях изучалась биосовместимость in vivo и in vitro и не было обнаружено никаких доказательств повреждения тканей в результате воздействия нагрева или самих материалов. Из-за этих результатов и ограниченной продолжительности терапевтической электростимуляции в настоящем исследовании в этом протоколе использовались монофазные, а не двухфазные стимулы. - Измерьте полученное выходное напряжение постоянного тока с помощью осциллографа, подключенного к электроду манжеты.
2. Подготовка устройства к имплантации
- Поместите имплантаты в стерильную чашку Петри и запечатайте ее парапленкой.
- Облучайте устройства ультрафиолетовым светом в течение 30 минут с каждой стороны.
3. Хирургическая процедура имплантации правого седалищного нерва крысы беспроводного, безбатарейного интерфейса периферического нерва для электростимуляции (рис. 3)
ПРИМЕЧАНИЕ: Поддерживайте стерильные условия. Выполняйте операции в специально отведенной для этого хирургической зоне процедурного кабинета для животных. Во время операции хирург надевает маску, пальто, шапочку и стерильные перчатки. Если проводится более одной операции, меняйте стерильные перчатки между животными и используйте чистые, стерильные хирургические инструменты для каждой операции. Стерилизуйте инструменты между операциями путем термической стерилизации (автоклав или стерилизатор стеклянных шариков). Используют взрослых крыс породы Спрэг-Доули, которые весят 200-250 г.
- Индуцируют анестезию с помощью изофлурановой газовой анестезии (3% индукция, 1-3% поддерживающая) в кислороде (2 л/мин) с подкожным введением мелоксикама (1-2 мг/кг). Закрывайте глаза крыс специальной офтальмологической мазью, чтобы предотвратить высыхание.
- Поместите крыс в положение лежа на продезинфицированных хирургических столах для последующих процедур. В течение оставшейся продолжительности операции оценивайте частоту дыхания (должно быть ~2/с), цвет тканей и глубину анестезии не реже, чем каждые 15 минут, и поддерживайте соответствующий уровень изофлурана. Подтвердите надлежащую глубину анестезии, проверив педальный рефлекс (отсутствие реакции на сильное защемление пальца ноги). Следите за слизистыми оболочками, которые должны оставаться розовыми и влажными.
- Побрейте операционную область, включая правую ногу и нижнюю половину спины. Потрите выбритую операционную область бетадиновой подушечкой, затем тампоном с 70% медицинским этанолом и повторите этот процесс скрабирования три раза для дезинфекции кожи.
- Сделайте разрез на коже диаметром 1,5–2 см параллельно правой бедренной кости с помощью тканевых ножниц с последующим тупым отделением подкожной соединительной ткани на спине (непосредственно медиально от разреза), чтобы очистить подкожный карман для приемной катушки (Рисунок 4А). Сделайте последующий разрез (1,2-1,5 см) на правой ягодичной мышце параллельно разрезу кожи.
- Аккуратно изолируйте седалищный нерв металлическими рассекающими зондами с тупыми концами (рис. 4B).
ПРИМЕЧАНИЕ: Седалищный нерв расположен глубоко в двуглавой мышце бедра и проходит параллельно бедренной кости. Предложена область препарирования. - Имплантируйте беспроводное устройство без батарей на седалищный нерв (рис. 4C), обернув манжету вокруг изолированного правого седалищного нерва, не натягивая нерв и не искажая его траекторию 18,19,20. Отметьте на коже место размещения приемной катушки для дальнейшей электростимуляции.
- Зашить разрез ягодичной мышцы рассасывающимися нитями (рис. 4D).
ПРИМЕЧАНИЕ: Верхняя половина катушки приемника находится над ягодичной мышцей и интерфейсом манжеты под ней. - Закройте разрез кожи зажимами для раны (или скрытым швом; Рисунок 4E). Совместите края кожи.
- Обеспечьте 1 час непрерывной послеоперационной электростимуляции с частотой 20 Гц с длительностью импульса 200 мкс под наркозом (рис. 4F). Возвращайте животных в их домашние клетки после того, как они полностью оправятся от наркоза.
ПРИМЕЧАНИЕ: Подробный протокол описан ниже. Катушка приемника показана над обшивкой на рисунке 4F. - Послеоперационное лечение
- Поместите крысу в клетку для восстановления без подстилки, застеленную бумажными полотенцами, при этом половину клетки поместите на соответствующий источник тепла с регулируемой температурой (одобренную грелку).
- Внимательно наблюдайте за крысой до тех пор, пока она не станет амбулаторной. После того, как крыса будет амбулаторной и оценена как стабильная, верните ее в домашнюю клетку и понаблюдайте за социальной реинтеграцией.
- После острого выздоровления наблюдайте за крысами на предмет инфекции в месте разреза и симптомов нейрогенной боли, включая, помимо прочего, защиту, корчи, расчесывание и членовредительство. Наблюдайте за крысами ежедневно в течение 5-дневного периода послеоперационного восстановления, и не реже одного раза в три дня после этого, если крысы не были принесены в жертву на 5-й день.
- Мелоксикам (1-2 мг/кг) вводят подкожно один раз в день в течение двух-трех дней после операции, в зависимости от уровня боли/дискомфорта животного. При подозрении на постоянную боль продолжайте прием мелоксикама после этого периода после операции, а если он окажется рефрактерным, усыпите крысу на ранней стадии, проконсультировавшись с ветеринарной командой.
- Снимите кожные швы или зажимы для ран через 10-12 дней после операции.
4. Хирургическая процедура имплантации беспроводных стимуляторов левого диафрагмального нерва крысы (рис. 5А)
ПРИМЕЧАНИЕ: Поддерживайте стерильные условия, как в разделе 3. Используют взрослых крыс Спрэга-Доули весом 200-250 г. Перед использованием стерилизуйте все хирургические инструменты.
- Индуцируют анестезию с помощью изофлурановой газовой анестезии (3% индукция, 1-3% поддерживающая) в кислороде (2 л/мин) с подкожным введением мелоксикама (1-2 мг/кг). Закройте глаза крысы специальной офтальмологической мазью, чтобы предотвратить высыхание.
- Поместите крыс в положение лежа на спине на продезинфицированных хирургических столах для последующих процедур. В течение оставшейся продолжительности операции оценивайте частоту дыхания, цвет тканей и глубину анестезии не реже чем каждые 15 минут и поддерживайте соответствующий уровень изофлурана. Подтвердите надлежащую глубину анестезии, проверив педальный рефлекс (отсутствие реакции на сильное защемление пальца ноги). Следите за слизистыми оболочками, которые должны оставаться розовыми и влажными.
- Побрейте прооперированную область на вентральной поверхности шеи. Потрите выбритую операционную область бетадиновой подушечкой, затем тампоном с 70% медицинским этанолом и повторите этот процесс скрабирования три раза для дезинфекции кожи.
- Вводят бупивакаин (2 мг/кг, разведенный в физиологическом растворе, не превышающий общего объема 0,5 мл) подкожно по средней линии шеи, воздействуя на самый поверхностный слой. Сделайте разрез по средней линии 3 см через кожу и поверхностную шейную фасцию, чтобы обнажить грудино-подъязычную и грудино-ключично-сосцевидную мышцы (рис. 5B).
ПРИМЕЧАНИЕ: Рекомендуется использовать область препарирования. - Поднимите грудино-ключично-сосцевидный сустав с помощью мягкого тупого рассечения зондом и втяните его в боковое положение с помощью петли сосуда (рис. 5C). Осторожно освободите и втяните подъязычную кость. Затем осторожно освободите и медиально втяните блуждающий нерв и сонный пучок под подъязычной мышцей.
ПРИМЕЧАНИЕ: Основное различие здесь проводится между блуждающим нервом и диафрагмальным нервом. Разрежьте подъязычную кость, если необходимо обнажить нижележащие структуры. - Изолируют диафрагмальный нерв (рис. 5D).
ПРИМЕЧАНИЕ: Диафрагмальный нерв проходит вдоль поверхности передней лестничной мышцы, проходя в виде заметно небольшого продольного нерва, пересекающегося перпендикулярно плечевому сплетению. В отличие от седалищного нерва, анатомия вокруг диафрагмального нерва на шее более сложная. Для достижения наилучших результатов перед имплантацией необходимо провести электрофизиологическое подтверждение (шаг 4.7). - Поместите регистрирующий электрод подкожно, каудально к грудной клетке, ипсилатерально к изолированному диафрагмальному нерву (рис. 5E). Поместите стимуляторы на диафрагмальный нерв и подтвердите с помощью синхронной сигнализации (рис. 6).
ПРИМЕЧАНИЕ: Типичный вызов максимального отклика при интенсивности стимула ~3-6 мА и длительности стимула 0,02 мс является типичным. - Проверьте полное рассечение диафрагмального нерва, показав полную отмену вызванного ответа при приложении электрического стимула к проксимальному концу нерва относительно места рассечения (рис. 6).
- Имплантируйте беспроводное устройство без батареек в диафрагмальный нерв (Рисунок 5F), поместив приемную катушку имплантируемого устройства на грудино-сосцевидную мышцу, глубоко относительно двусторонней грудино-ключично-сосцевидной мышцы, с манжетой вокруг диафрагмального нерва и контактными электродами, расположенными перпендикулярно нерву.
- Закройте поверхностную шейную фасцию простыми рассасывающимися нитями (рис. 5G). Закрыть кожу прерывистыми втянутыми рассасывающимися швами в глубоких слоях дермы. Возвращайте животных в домашние клетки только после того, как они полностью оправятся от наркоза.
- Для послеоперационного лечения следуйте шагу 3.10.
5. Беспроводная доставка терапевтической электростимуляции
- Применяют электростимуляцию в течение 1 ч крысам под общим наркозом. Для беспроводной стимуляции разместите генератор сигналов/функций (напряжение: 1-15 В между пиками) и дополнительный усилитель над животным, чтобы обеспечить электрическое питание внешней индуктивной катушки (т. е. катушки передачи) (двумерная спиральная катушка с 5 витками; диаметр: 2 см), чтобы обеспечить хорошую индуктивную связь с имплантированной катушкой приемника. Подавайте монофазные импульсы длительностью 200 мкс с частотой 20 Гц в течение 1 часа.
- Чтобы проверить и количественно оценить доставку электростимуляции, запишите CMAP от передней большеберцовой мышцы, регулируя напряжение стимуляции для обеспечения супрамаксимальной активации седалищного нерва. Используйте концентрические игольчатые электроды для всех записей.
ПРИМЕЧАНИЕ: Если максимальное напряжение, генерируемое функцией, недостаточно для получения максимального отклика, используйте усилитель.
6. Эвтаназия
- Первичный метод
- Поместите сепаратор в камеру подачи CO2 со скоростью 8-12 литров в минуту (или соответствующий расход в зависимости от размера камеры). Наблюдайте за крысами на предмет потери сознания, а затем в течение не менее 1 минуты остановки дыхания.
- Вторичный метод
- Выполняют вывих шейки матки или двустороннюю торакотомию.
Результаты
В модели повреждения седалищного нерва имплантат размещается вокруг правого седалищного нерва до начала восстановления ветви большеберцового нерва (рис. 3, рис. 4А и рис. 7А). Концентрический игольчатый электрод 30 G помещается в переднюю мышцу правой большеберцовой кости для определения параметров стимула, необходимых для электростимуляции максимальной интенсивности. Эти эксперименты включают в себя повышение интенсивности стимуляции до тех пор, пока величина отклика не выйдет на плато максимума. Поскольку передняя большеберцовая кость иннервируется малоберцовой ветвью седалищного нерва, она сохраняется при повреждении пересечения большеберцового нерва. Таким образом, запись с передней большеберцовой кости позволяет осуществлять непрерывный мониторинг лечения электростимуляцией.
Для одиночного импульса, подаваемого проволочным электродом на правый седалищный нерв (5 мА, 0,02 мс), максимальный ответ CMAP вызывается с отрицательной пиковой амплитудой 5,4 мВ, зарегистрированной на передней ипсилатеральной большеберцовой кости (рис. 7B; черная полоса). Для сопоставимого импульса стимула, доставляемого беспроводным имплантатом без батареи, вызывается сопоставимый ответ CMAP с отрицательной пиковой амплитудой 4,6 мВ (рис. 7B; оранжевая кривая). Это согласуется с недавним сообщением о том, что беспроводная стимуляция нервов достигает в среднем 88% CMAP по сравнению с проводной стимуляцией нервов21, что значительно выше порога, необходимого для терапевтического эффекта в клинических исследованиях 6,7,8,9. В показанном примере более длительная задержка беспроводного стимулятора по сравнению с проводным стимулятором была обусловлена его большим расстоянием от зарегистрированной мышцы.
В модели диафрагмального нерва имплантат размещается вокруг правого диафрагмального нерва перед рассечением (рис. 5). Для определения параметров стимула, необходимых для электростимуляции максимальной интенсивности, на правый (ипсилатеральный) передний реберный край подкожно помещают концентрический игольчатый электрод 30 G для записи из правого полушария. Эксперименты заключаются в повышении напряжения стимуляции до тех пор, пока величина отклика не выйдет на плато максимума. Поскольку диафрагмальный нерв может быть трудно изолировать от окружающих сосудисто-нервных структур, его идентичность может быть подтверждена путем вызова реакции подергивания (рис. 6; оранжевый след). Специфичность стимуляции может быть дополнительно проверена путем рассечения диафрагмального нерва дистальнее манжеты нервного электрода с последующим устранением подергательной реакции (рис. 6; черный след).
Повторяющаяся низкочастотная электростимуляция может быть проведена к седалищному нерву в течение 1 ч с использованием установленного протокола, который усиливает регенерацию аксонов (6,7,8,9,10,11; Рисунок 8). Интерфейс манжеты беспроводного имплантата был размещен на правом седалищном нерве, а концентрический игольчатый электрод 30 G был размещен на передней мышце правой большеберцовой кости для мониторинга лечения. На рисунке 8А показаны четыре последовательных всплеска в зарегистрированной электромиографии в начале (0 мин) электростимуляции продолжительностью 1 ч 20 Гц. На рисунке 8В показаны четыре других всплеска, зарегистрированных в течение 40 минут 1-часовой электростимуляции с небольшим снижением пиковой амплитуды, что согласуется с характером усталости, отмеченным при проводной электростимуляции15,21.
Степень регенерации периферических нервов можно оценить с помощью ретроградных индикаторов, нанесенных дистально на место поражения нерва. Поскольку периферические аксоны прорастают множественными коллатеральными отростками, ретроградное отслеживание и подсчет сома двигательного нейрона в спинном мозге позволяют более точно оценить количество регенерирующих нейронов, чем подсчет регенерирующих аксоновв самом нерве. Чтобы продемонстрировать это, ствол седалищного нерва был пересечен размозжением. Через 3 недели выздоровления два разных флуоресцентных ретроградных красителя были введены на две ветви седалищного нерва: малоберцовый нерв (зеленый) и большеберцовый нерв (красный) соответственно (рис. 9А). На рисунке 9B-D показаны освещенные подгруппы нижних мотонейронов в переднем роге поясничного отдела спинного мозга, которые образуют либо большеберцовый нерв (рис. 9B), либо малоберцовый нерв (рис. 9C). На наложенном изображении видны две отдельные колонки меченых нейронов в переднем роге спинного мозга, которые могут быть количественно оценены с точки зрения пространственного распределения и количества двигательных нейронов, которые регенерировали аксон, дистальнее места поражения (рис. 9D).
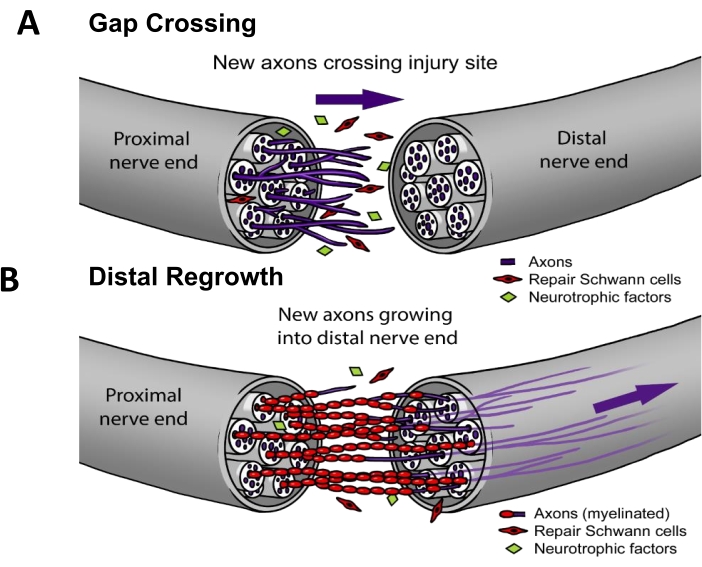
Рисунок 1: Модель регенерации нервов. (А) Пересечение щелей происходит в начале периода восстановления нерва, когда аксоны после восстановления растут от проксимального к дистальному концу нерва. (Б) Продолжительность дистального отрастания связана с расстоянием до целевого органа-мишени (например, кожи, мышцы) и скоростью отрастания аксонов. Большинство методов лечения для улучшения восстановления нервов нацелены на один или оба этих процесса. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
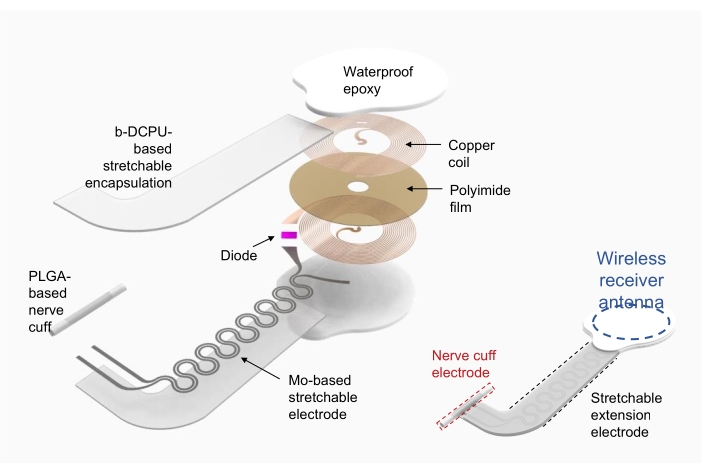
Рисунок 2: Иллюстрация изготовления беспроводного электронного стимулятора. Слева детализированные слои структуры устройства, включая круглую катушку радиочастотного сборщика энергии, растягивающийся удлинительный электрод и нервную манжету, обернутую вокруг интересующего нерва. Справа, упрощенная иллюстрация, показывающая три части устройства. Сокращения: PLGA = поли(молочно-когликолевая кислота); b-DCPU = биорезорбируемый динамический ковалентный полиуретан. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
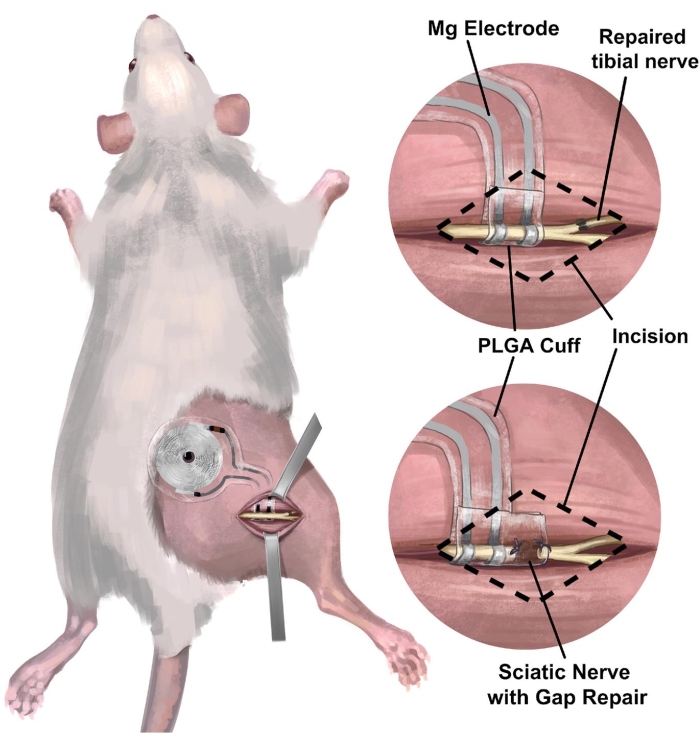
Рисунок 3: Имплантация беспроводного, безбатарейного нервного интерфейса в модели седалищного нерва крысы. (А) На рисунке изображена полностью имплантируемая система в правом седалищном нерве крысы. (B) На верхней панели показан интерфейс электрода, расположенный на седалищном нерве проксимальнее места восстановления правого большеберцового нерва. На нижней панели показан интерфейс электродов с расширенным зазором между проксимальным концом и дистальной культей нерва. Аббревиатура: PLGA = поли(молочно-когликолевая кислота). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
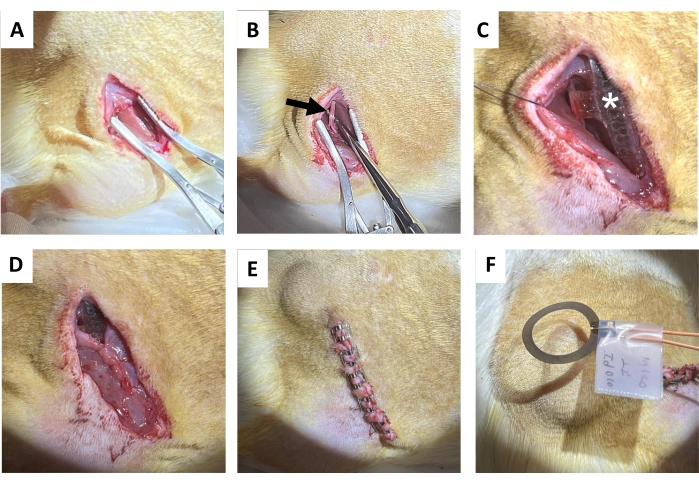
Рисунок 4: Процедура имплантации седалищного нерва. (A) Разрез на коже, подкожной соединительной ткани и ягодичной мышце для обнажения подколенного сухожилия. (Б) Изолированный седалищный нерв (черная стрелка). (C) Постимплантационное устройство с манжетой нерва, спицами (белая звездочка) и видимым имплантатом (звездочка). (D) Закрытие соединительной ткани швом. (E) Закрытие разреза зажимами для раны. (F) Беспроводная электрическая стимуляция, генерируемая спиралью над кожей. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
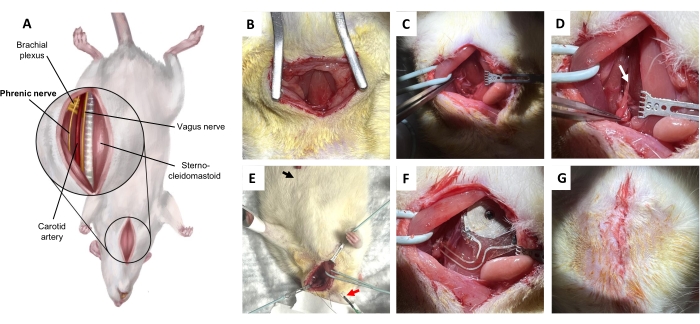
Рисунок 5: Процедура имплантации диафрагмального нерва. (A) Вентральный вид шеи в положении лежа на спине. (B) Разрез на коже и подкожной соединительной клетчатке для обнажения грудино-подъязычной мышцы. (C) Рассечение потенциального пространства между опоязычной мышцей и грудино-ключично-сосцевидной мышцей. (D) Диафрагмальный нерв (стрелка), изолированный от плечевого сплетения. (E) Диафрагмальное электромиографическое подтверждение диафрагмального нерва. Черная стрелка, регистрирующий электрод. Красная стрелка, стимуляторы. (F) Имплантация. (G) Закрытие кожи глубокими кожными швами. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
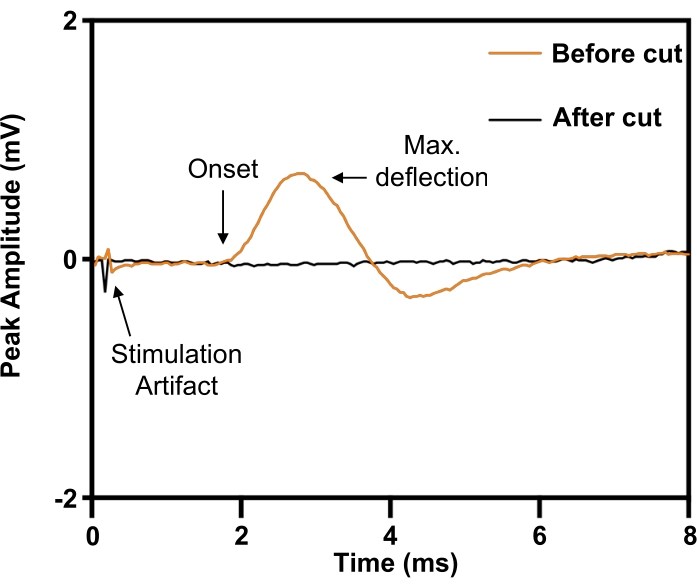
Рисунок 6: Подтверждение полного повреждения диафрагмального нерва вызванными потенциалами действия сложных мышц диафрагмы. Перед транссекцией диафрагмального нерва (ORANGE) электрическая стимуляция диафрагмального нерва вызывала сложные мышечные потенциалы действия на ипсилатеральной диафрагме, которые были отменены при рассечении диафрагмального нерва (BLACK). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
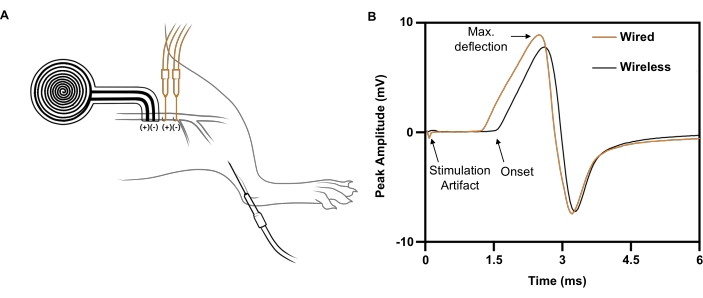
Рисунок 7: Репрезентативные исследования нервной проводимости, сравнивающие беспроводную и проводную электростимуляцию. (A) Иллюстрация размещения беспроводных (ЧЕРНЫЙ) и проводных (ОРАНЖЕВЫЙ) устройств на седалищном нерве. Регистрирующий электрод помещали в переднюю большеберцовую кость. (B) Сложные потенциалы мышечного действия, вызванные проводным имплантатом (ОРАНЖЕВЫЙ) по сравнению с беспроводным имплантатом (ЧЕРНЫЙ). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
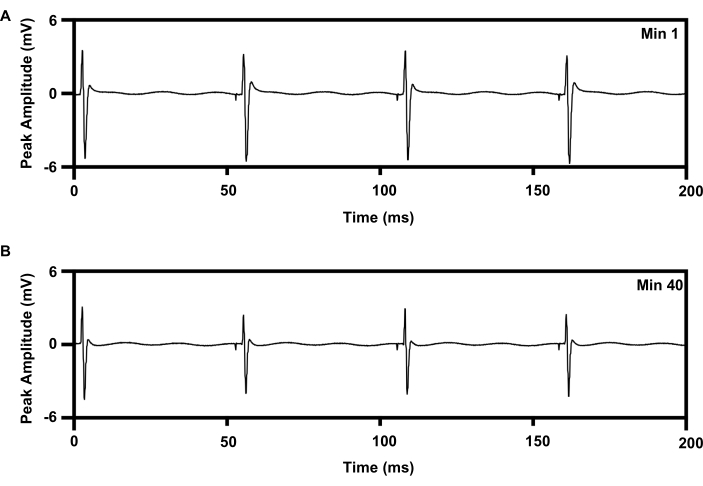
Рисунок 8: Запись ЭМГ из мышцы ТА с повторяющейся электрической стимуляцией 20 Гц в течение 1 ч от имплантатов. (A) След ЭМГ при мин. 1 e-stim. (B) След ЭМГ при мин. 40 e-stim. Сокращения: ЭМГ = электромиография; TA = большеберцовая кость передняя; e-stim = электрическая стимуляция; min = минута. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
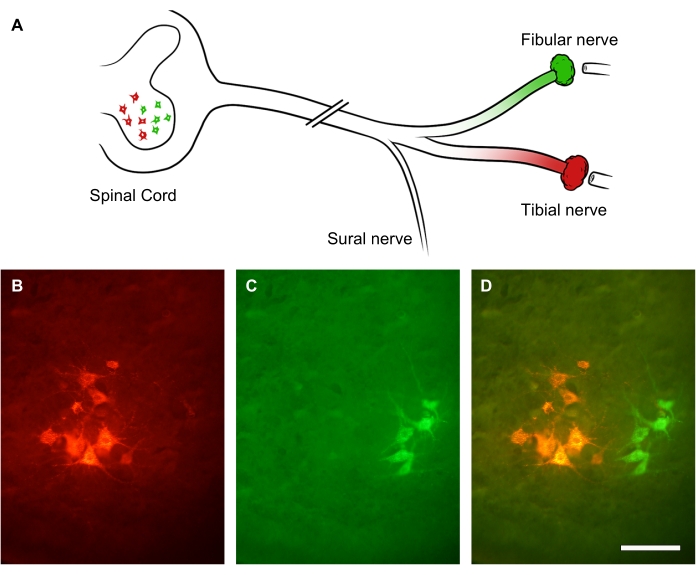
Рисунок 9: Репрезентативные изображения регенерации седалищного нерва. (А) Иллюстрация повреждения седалищного нерва и флуоресцентная ретроградная маркировка. Аксоны седалищного нерва были пересечены при размозжении. Через 3 недели восстановления его дистальные ветви — малоберцовый нерв (зеленый цвет) и большеберцовый нерв (красный) — были ретроградно помечены. (Б-Д) Изображения поясничного отдела спинного мозга, показывающие нейрональную сому в пределах ипсилезионного переднего рога. Масштабные линейки = 30 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этой статье описываются этапы хирургической имплантации и эксплуатации беспроводных, безбатарейных и полностью имплантируемых интерфейсов периферических нервов в модели седалищного и диафрагмального нервов крысы. Мы демонстрируем, как этот новый класс биомедицинских имплантатов может быть использован для создания терапевтической парадигмы электростимуляции, которая, как было показано, усиливает регенерацию аксонов в доклинических и клинических исследованиях (обзор см.в разделе 22). Этот протокол прост и может быть экстраполирован на более мелкие модели животных, таких как мыши21, а также на другие беспроводные, безбатарейные и полностью имплантируемые устройства с функциональностью, которая включает оптоэлектронные и микрофлюидные интерфейсы периферических нервов 18,23,24,25,26,27,28,29,30 . Также продемонстрирован подход с использованием седалищного нерва грызуна, который является наиболее распространенной экспериментальной моделью31.
Универсальность этого подхода была продемонстрирована, когда он был адаптирован к взаимодействию с диафрагмальным нервом, который редко используется в качестве модели повреждения периферических нервов32, возможно, потому, что это крайне недооцененная клиническая проблема 33,34,35. Диагностика и реабилитация при повреждении диафрагмального нерва стали важным вопросом во время пандемии COVID-19 36,37,38. В настоящее время неизвестно, может ли регенерация диафрагмальных аксонов и восстановление после паралича диафрагмы быть дополнена этой короткой парадигмой низкочастотной электростимуляции. Тем не менее, электрическая стимуляция диафрагмального нерва для стимуляции диафрагменных мышц является признанным вариантом лечения дыхательной недостаточности у пациентов с тетраплегией из-за высокой травмы шейного отдела спинного мозга 39,40,41,42,43. Изучаются и другие показания, в том числе отлучение от аппарата искусственной вентиляции легких после критического заболевания44.
Для обеспечения хорошей работы имплантируемой системы следует выделить несколько важных шагов. Во-первых, важно избегать приложения слишком больших усилий к тонким электронным компонентам устройств при обращении с ними, чтобы предотвратить деизоляцию свинца, перегиб или поломку. Далее важно точно отметить расположение катушки радиочастотного силового комбайна на вышележащей обшивке. В-третьих, тщательное совмещение передающей катушки внешнего радиочастотного источника питания с катушкой силового комбайна имплантируемого устройства с зажимом на гусиной стойке позволяет обеспечить стабильную работу. Наконец, для подтверждения электростимуляции в дополнение к визуальному наблюдению за мышечными подергиваниями рекомендуется периодический нейрофизиологический мониторинг. В случае более сложной анатомии диафрагмального нерва в области шеи электрофизиологическое подтверждение помогает продемонстрировать, что был выделен правильный нерв (рис. 6).
Помимо беспроводных, безбатарейных электростимуляторов, показанных в этой статье 18,19,21, многие другие устройства, потенциально использующие те же процедуры. Например, поскольку электроды, предназначенные для имплантации в языкоглоточный и блуждающий нервы для хронической регистрации сигналов от симпатической и парасимпатической нервных систем 30,45,46, имеют ту же хирургическую область, что и диафрагмальный нерв, этот протокол может быть адаптирован для их имплантации. Беспроводные долгосрочные биосовместимые стимуляторы для периферических нервов, такие как ReStore, являются отличными инструментами, чтобы оставаться на месте и стимулировать нервы по мере необходимости 25,47,48,49,50. Также сообщалось о соответствующих многоканальных имплантатах беспроводной записи51. В целом, мы считаем, что эти протоколы хирургической и электрической стимуляции могут быть адаптированы в качестве стандарта для всех беспроводных периферических нервов, связанных с электростимуляцией или записью.
Раскрытие информации
Конфликт интересов у авторов отсутствует.
Благодарности
В этой работе использовалась база NUFAB Центра NUANCE Северо-Западного университета, которая получила поддержку от SHyNE Resource (NSF ECCS-1542205), IIN и программы MRSEC Северо-Западного университета (NSF DMR-1720139). В этой работе использовалась установка MatCI, поддерживаемая программой MRSEC Национального научного фонда (DMR-1720139) в Центре исследования материалов Северо-Западного университета. C.K.F выражает признательность за поддержку со стороны Института детского здоровья и развития человека им. Юнис Кеннеди Шрайвер Национального института здоровья (NIH) (грант No R03HD101090) и Американского нервно-мышечного фонда (грант на развитие). Ю.Х. выражает признательность за поддержку со стороны NSF (грант No. CMMI1635443). Эта работа была поддержана Институтом биоэлектроники Куэрри Симпсона при Северо-Западном университете.
Материалы
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
Ссылки
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7(2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, Pt 6 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990(2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724(2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397(2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349(2018).
- Repair Brushart, M. Nerve Repair. , Oxford University Press. (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723(2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066(2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698(2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115(2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены