Method Article
Implantação e Controle de Sistemas Sem Fio e Sem Bateria para Interface de Nervos Periféricos
Neste Artigo
Resumo
Este é um protocolo para o implante cirúrgico e operação de uma interface sem fio para nervos periféricos. Demonstramos a utilidade dessa abordagem com exemplos de estimuladores de nervo colocados no nervo ciático ou frênico de ratos.
Resumo
Interfaces nervosas periféricas são frequentemente usadas em neurociência experimental e medicina regenerativa para uma ampla variedade de aplicações. Tais interfaces podem ser sensores, atuadores ou ambos. Os métodos tradicionais de interface de nervos periféricos devem ser conectados a um sistema externo ou depender da energia da bateria que limita o período de tempo para a operação. Com os recentes desenvolvimentos de interfaces nervosas periféricas sem fio, sem bateria e totalmente implantáveis, uma nova classe de dispositivos pode oferecer recursos que correspondem ou excedem os de seus precursores com fio ou alimentados por bateria. Este trabalho descreve métodos para (i) implantar cirurgicamente e (ii) alimentar e controlar sem fio este sistema em ratos adultos. Os modelos dos nervos isquiático e frênico foram selecionados como exemplos para destacar a versatilidade dessa abordagem. O artigo mostra como a interface nervosa periférica pode evocar potenciais compostos de ação muscular (PAMCs), fornecer um protocolo terapêutico de estimulação elétrica e incorporar um conduto para o reparo da lesão nervosa periférica. Tais dispositivos oferecem opções de tratamento expandidas para estimulação terapêutica em dose única ou dose repetida e podem ser adaptados a uma variedade de localizações nervosas.
Introdução
As lesões traumáticas dos nervos periféricos (RNPT) ocorrem nos EUA, com incidência anual de aproximadamente 200.000 porano1. A maioria dos pacientes que sofrem RNPT fica com prejuízos funcionais permanentes. Na pior das hipóteses, isso pode resultar em paralisia muscular e desencadear dor neuropática refratária ao tratamento tão intensa que os pacientes estão dispostos a se submeter a uma amputação de membro como tratamento2. O maior obstáculo para melhorar os resultados do PNI é que a regeneração do axônio é muito lenta em relação às distâncias que eles devem recrescer. Por exemplo, um axônio humano adulto cresce a 1 mm/dia, mas pode ter que se regenerar a distâncias >1000 mm no caso de uma lesão em um membro proximal.
Na prática clínica atual, ~50% dos RNPT necessitam de reparo cirúrgico3. Para uma regeneração nervosa bem-sucedida, os axônios devem (i) crescer através do local da lesão (i.e., cruzamento de lacunas) e, em seguida, (ii) regenerar-se ao longo do trajeto do nervo para atingir um alvo de órgão-alvo (i.e., recrescimento distal) (Figura 1). Não há medicamentos aprovados pela FDA comprovadamente para acelerar a regeneração nervosa. O status quo do manejo clínico dos RNPT mudou apenas progressivamente nas últimas décadas e limita-se a refinamentos técnicos de métodos cirúrgicos, como transferências de nervos motores distais para reduzir a distância que os axônios regeneradores devem percorrer4, ou condutos nervosos sintéticos "fora da prateleira" para os casos em que o nervo proximal se retrai e não pode ser diretamente suturado de volta5. No entanto, houve quatro ensaios clínicos randomizados sobre estimulação elétrica terapêutica aplicada a nervos no pós-operatório, que foram estudos unicêntricos liderados pelo Dr. K. Ming Chan na Universidade de Alberta que mostram melhora significativa da reinervação do músculo 6,7,8 ou da pele9. O trabalho fundamental para este protocolo de estimulação elétrica foi realizado emroedores10,11, onde foi demonstrado que a eletroestimulação funciona especificamente por meio do cruzamento de lacunas (Figura 1), mas não do recrescimento distal12,13,14,15.
A colocação cirúrgica dos eletrodos transcutâneos de fio utilizados nos quatro ensaios clínicos randomizados por estimulação elétrica foi necessária, pois seus efeitos dependem da liberação de corrente suficiente para despolarizar o corpo celular do neurônio a 20 Hz continuamente por 1 h11. Na prática clínica, esse protocolo de estimulação elétrica não é tolerável para a maioria dos pacientes nas intensidades necessárias por meio de eletrodos estimuladores de superfície na pele devido à dor. Existem riscos não triviais associados à execução de eletrodos transcutâneos no pós-operatório, como infecção profunda da ferida operatória ou deslocamento acidental de fios dos nervos durante o transporte do paciente da sala de cirurgia (SO). Além disso, o alto custo do tempo de SO em si é um desincentivo para tentar nesse ambiente e não durante a recuperação pós-operatória aguda. Uma nova classe de interfaces nervosas periféricas sem fio, sem bateria e totalmente implantáveis está surgindo para resolver essa deficiência das interfaces nervosas periféricas existentes.
Esta nova classe de sistemas eletrônicos implantáveis sem fio está pronta para aumentar a facilidade e a flexibilidade para a dosagem de estimulação elétrica e quebrar as barreiras que impedem sua implementação clínica mais ampla. Este trabalho descreve métodos para (i) implantar cirurgicamente e (ii) alimentar e controlar sem fio este sistema em modelos adultos de nervo ciático e frênico. Mostra como a interface nervosa periférica pode evocar CMAPs, fornecer um protocolo terapêutico de estimulação elétrica e até mesmo atuar como um conduto para o reparo de nervos periféricos. Os protocolos aqui apresentados podem ser adaptados para outras variantes dessa tecnologia que podem fornecer pulsos de luz para neuromodulação optogenética mediada16, liberação controlada de fármacos17 ou repetidas crises de estimulação elétrica ao longo do tempo18,19.
Protocolo
Todos os procedimentos descritos neste protocolo são realizados de acordo com o NIH Guide for the Care and Use of Laboratory Animals e foram aprovados pelo Institutional Animal Care and Use Committee (IACUC) da Northwestern University. Este protocolo segue as diretrizes de cuidados com animais do Centro de Medicina Comparada da Northwestern University e da IACUC. É necessário consultar a IACUC ao adaptar os protocolos.
1. Fabricação de estimulador eletrônico sem fio (Figura 2)
- Use cobre/poliimida/cobre (cobre superior e inferior de 18 μm de espessura, poliimida de 75 μm de espessura) como substrato para a bobina do coletor de energia de radiofrequência (ou seja, antena receptora sem fio).
- Use ablação direta a laser para modelar orifícios para os eletrodos nas camadas de cobre superior e inferior e modelar o dispositivo. Conecte eletricamente as camadas superior e inferior usando pasta de prata através dos orifícios.
- Fixar os componentes eletrônicos com embalagens comerciais, como diodo e capacitor, via solda.
- Utilizar como eletrodos de extensão esticáveis de poliuretano dinâmico covalente bioreabsorvível (b-DCPU; 200 μm de espessura) encapsulado em molibdênio (Mo; 15 μm de espessura; estrutura serpentina)19.
- Formar o eletrodo de cuff para a interface entre o dispositivo e o nervo usando filme de poli(ácido lático-co-glicólico) (PLGA) (300 μm de espessura).
- Depois de conectar a antena do receptor sem fio e o eletrodo de extensão esticável, encapsular a antena do receptor sem fio e a conexão com epóxi ou polidimetisiloxano (PDMS) à prova d'água comercializada. Consulte a Figura 2 (à direita) para obter o dispositivo totalmente montado.
- Confirme o funcionamento sem fio do dispositivo, usando um gerador de forma de onda para gerar impulsos elétricos monofásicos através da bobina primária (ou seja, bobina de transmissão).
OBS: Examinando o recrutamento de axônios periféricos e a indução de regeneração axonal por estímulos monofásicos e bifásicos, estudos anteriores relataram um efeito desprezível devido às diferenças na característica da forma de onda20, e este grupo foi capaz de alcançar aumento da estimulação elétrica terapêutica com os mesmos parâmetros de corrente monofásica em camundongos21 e ratos18. Além disso, estudos anteriores examinaram a biocompatibilidade in vivo e in vitro e não encontraram nenhuma evidência de dano tecidual dos efeitos do aquecimento ou dos próprios materiais. Devido a esses achados e à duração limitada da estimulação elétrica terapêutica no presente estudo, estímulos monofásicos e não bifásicos foram utilizados nesse protocolo. - Meça a tensão de saída de corrente contínua resultante com um osciloscópio conectado ao eletrodo do manguito.
2. Preparação do dispositivo para implantação
- Coloque os dispositivos de implante em uma placa de Petri estéril e sela-a com parafilme.
- Irradiar os dispositivos com luz UV por 30 min por lado.
3. Procedimento cirúrgico de implante de nervo ciático direito de rato de interface nervosa periférica sem bateria sem fio para estimulação elétrica (Figura 3)
NOTA: Manter condições estéreis. Realizar cirurgias dentro da área cirúrgica designada de uma sala de procedimentos de animais. O cirurgião usará máscara, casaco, touca e luvas estéreis durante a cirurgia. Se mais de uma cirurgia for realizada, troque luvas estéreis entre os animais e use instrumentos cirúrgicos limpos e estéreis para cada cirurgia. Esterilizar ferramentas entre cirurgias por esterilização térmica (autoclave ou esterilizador de esferas de vidro). Use ratos adultos Sprague-Dawley que pesam 200-250 g.
- Induzir anestesia com gás isoflurano (3% de indução, 1-3% de manutenção) em oxigênio (2 L/min), com administração subcutânea de meloxicam (1-2 mg/kg). Cubra os olhos dos ratos com pomada oftálmica designada para evitar o ressecamento.
- Colocar os ratos em decúbito ventral em mesas cirúrgicas desinfetadas para procedimentos subsequentes. Para o restante da duração cirúrgica, avaliar a frequência respiratória (deve ser ~2/s), a cor do tecido e a profundidade da anestesia não menos do que a cada 15 minutos e manter os níveis de isoflurano de acordo. Confirme a profundidade adequada da anestesia verificando o reflexo do pedal (falta de resposta a uma pinça firme do dedo do pé). Monitore as membranas mucosas, que devem permanecer rosas e úmidas.
- Faça a barba na área cirúrgica, incluindo a perna direita e a metade inferior das costas. Esfregue a área cirúrgica raspada com uma almofada de betadina, seguida de um swab de etanol medicinal a 70%, e repita esse processo de esfoliação três vezes para desinfecção da pele.
- Realizar uma incisão de 1,5 a 2 cm na pele paralela ao osso do fêmur direito com tesoura de tecido, seguida de separação romba do tecido conjuntivo subcutâneo no dorso (diretamente medial à incisão) para limpar uma bolsa subcutânea para a bobina receptora (Figura 4A). Fazer uma incisão subsequente (1,2-1,5 cm) no músculo glúteo direito paralelamente à incisão na pele.
- Isole suavemente o nervo ciático com sondas de dissecção metálicas com extremidades rombas (Figura 4B).
NOTA: O nervo ciático está localizado profundamente ao bíceps femoral e corre paralelo ao fêmur. Um escopo de dissecação é sugerido. - Implantar o dispositivo sem fio sem bateria no nervo ciático (Figura 4C) envolvendo o manguito ao redor do nervo ciático direito isolado, sem tensioná-lo ou distorcer seu trajeto 18,19,20. Marque na pele onde a bobina receptora é colocada para estimulação elétrica adicional.
- Sutura da incisão do músculo glúteo com pontos absorvíveis (Figura 4D).
NOTA: A metade superior da bobina receptora fica acima do músculo glúteo e a interface do manguito abaixo dele. - Fechar a incisão da pele com clipes da ferida (ou sutura enterrada; Figura 4E). Combine as bordas da pele.
- Aplicar 1 h de estimulação elétrica contínua pós-cirúrgica de 20 Hz com largura de pulso de 200 μs sob anestesia (Figura 4F). Devolva os animais às suas gaiolas domésticas depois de terem recuperado totalmente da anestesia.
NOTA: O protocolo detalhado é descrito abaixo. A bobina receptora é mostrada acima da pele na Figura 4F. - Tratamento pós-cirúrgico
- Coloque o rato numa gaiola de recuperação sem roupa de cama, forrada com papel toalha, com metade da gaiola colocada numa fonte de calor regulada por temperatura adequada (almofada de aquecimento aprovada).
- Monitore cuidadosamente o rato até que ele esteja deambulando. Uma vez deambulado e avaliado como estável, devolva o rato à gaiola domiciliar e observe a reintegração social.
- Após a recuperação aguda, monitore os ratos quanto à infecção no local da incisão e quanto aos sintomas de dor neurogênica, incluindo, mas não se limitando a, guarda, contorções, arranhões e automutilação. Monitorar os ratos diariamente durante o período de recuperação pós-cirúrgica de 5 dias, e pelo menos uma vez a cada três dias depois disso, se os ratos não forem sacrificados no dia 5.
- Administrar meloxicam (1-2 mg/kg) por via subcutânea uma vez ao dia por dois a três dias após a cirurgia, dependendo do nível de dor/desconforto apresentado pelo animal. Se houver suspeita de dor persistente, continuar meloxicam além deste período no pós-operatório e, se se provar refratário, eutanasiar o rato no início da consulta com a equipe veterinária.
- Remover as suturas de pele ou clipes da ferida 10-12 dias após a cirurgia.
4. Procedimento cirúrgico do implante de estimuladores sem fio do nervo frênico esquerdo de rato (Figura 5A)
NOTA: Manter condições estéreis, como na secção 3. Use ratos adultos Sprague-Dawley pesando 200-250 g. Esterilizar todas as ferramentas cirúrgicas antes do uso.
- Induzir anestesia com gás isoflurano (3% de indução, 1-3% de manutenção) em oxigênio (2 L/min), com administração subcutânea de meloxicam (1-2 mg/kg). Cubra os olhos do rato com pomada oftálmica designada para evitar a dessecação.
- Colocar os ratos em decúbito dorsal em mesas cirúrgicas desinfetadas para procedimentos subsequentes. Para o restante da duração cirúrgica, avaliar a frequência respiratória, a cor do tecido e a profundidade da anestesia não menos do que a cada 15 minutos e manter os níveis de isoflurano de acordo. Confirme a profundidade adequada da anestesia verificando o reflexo do pedal (falta de resposta a uma pinça firme do dedo do pé). Monitore as membranas mucosas, que devem permanecer rosas e úmidas.
- Depilar a área cirúrgica na face ventral do pescoço. Esfregue a área cirúrgica raspada com uma almofada de betadina, seguida de um swab de etanol medicinal a 70%, e repita esse processo de esfoliação três vezes para desinfecção da pele.
- Administrar bupivacaína (2 mg/kg, diluída em soro fisiológico não excedendo o volume total de 0,5mL) por via subcutânea na linha média do pescoço, visando a camada mais superficial. Realizar incisão mediana de 3 cm através da pele e fáscia cervical superficial para expor os músculos esterno-hioideo e esternocleidomastoideo (Figura 5B).
NOTA: Um escopo de dissecação é sugerido. - Elevar o esternocleidomastoideo com dissecção suave e romba com sonda e retraí-lo lateralmente com alça de vaso (Figura 5C). Solte suavemente e retraia o omo-hioideo. Em seguida, liberar suavemente e retrair medialmente o nervo vago e o feixe carotídeo abaixo do músculo omohioideo.
NOTA: A principal discriminação aqui é entre o nervo vago e o nervo frênico. Corte o omo-hióideo se for necessário expor as estruturas inferiores. - Isole o nervo frênico (Figura 5D).
NOTA: O nervo frênico corre ao longo da superfície do músculo escaleno anterior, funcionando como um nervo longitudinal notavelmente pequeno cruzando perpendicularmente ao plexo braquial. Ao contrário do nervo ciático, a anatomia ao redor do nervo frênico no pescoço é mais complexa. Realizar a confirmação eletrofisiológica (passo 4.7) antes do implante para obter melhores resultados. - Colocar o eletrodo de registro no subcutâneo, apenas caudalmente à caixa torácica, ipsilateral ao nervo frênico isolado (Figura 5E). Colocar os estimuladores sobre o nervo frênico e confirmar por sinalização síncrona (Figura 6).
NOTA: Evocar uma resposta máxima com uma intensidade de estímulo de ~3-6 mA e duração do estímulo de 0,02 ms é típico. - Verificar a transecção completa do nervo frênico mostrando abolição completa da resposta evocada quando um estímulo elétrico é aplicado na extremidade proximal do nervo em relação ao local da transecção (Figura 6).
- Implantar um dispositivo sem fio sem bateria no nervo frênico (Figura 5F) colocando a bobina receptora do dispositivo implantável sobre o esterno-hioideo, profundamente em relação aos músculos esternocleidomastoideos bilaterais, com o manguito ao redor do nervo frênico e os eletrodos de contato posicionados perpendicularmente ao nervo.
- Fechar a fáscia cervical superficial com pontos absorvíveis simples e contínuos (Figura 5G). Fechar a pele com pontos absorvíveis invertidos interrompidos na derme profunda. Devolver os animais às suas gaiolas domésticas apenas depois de terem recuperado totalmente da anestesia.
- Para o tratamento pós-cirúrgico, siga o passo 3.10.
5. Fornecimento sem fio de estimulação elétrica terapêutica
- Aplicar estimulação elétrica por 1 h nos ratos sob anestesia geral. Para a estimulação sem fio, coloque um gerador de forma de onda/função (tensão: 1-15 Vpp) e amplificador opcional acima do animal para fornecer energia elétrica a uma bobina indutiva externa (ou seja, bobina de transmissão) (bobina espiral bidimensional com 5 voltas; diâmetro: 2 cm) para garantir um bom acoplamento indutivo com a bobina receptora implantada. Forneça pulsos monofásicos de 200 μs a 20 Hz durante 1 h de duração.
- Para verificar e quantificar a oferta de estimulação elétrica, registre os PAMC do músculo tibial anterior, ajustando a voltagem da estimulação para liberar ativação supramáxima do nervo ciático. Use eletrodos de agulha concêntricos para todas as gravações.
NOTA: Se a tensão máxima gerada pela função for insuficiente para evocar uma resposta máxima, use um amplificador.
6. Eutanásia
- Método primário
- Coloque a gaiola sob uma câmara de entrega de CO2 , ajustada para uma taxa de 8-12 LPM (ou taxa de fluxo apropriada com base no tamanho da câmara). Monitorar os ratos para inconsciência e, em seguida, por pelo menos 1 minuto de cessação da respiração.
- Método secundário
- Realizar luxação cervical ou toracotomia bilateral.
Resultados
No modelo de lesão do nervo ciático, o implante é colocado ao redor do nervo ciático direito antes do reparo término-terminal do ramo do nervo tibial (Figura 3, Figura 4A e Figura 7A). Um eletrodo concêntrico de agulha 30G é colocado no músculo tibial anterior direito para definir os parâmetros de estímulo necessários para a estimulação elétrica de intensidade máxima. Esses experimentos incluem elevar a intensidade da estimulação até que a magnitude da resposta se platô no máximo. Como o tibial anterior é inervado pelo ramo fibular do nervo ciático, ele é poupado na lesão da transecção do nervo tibial. Assim, o registro a partir do tibial anterior permite a monitorização contínua do tratamento de estimulação elétrica.
Para um pulso de estímulo único liberado por um eletrodo de fio para o nervo ciático direito (5 mA, 0,02 ms), uma resposta máxima do CMAP é provocada com uma amplitude de pico negativo de 5,4 mV registrada no tibial anterior ipsilateral (Figura 7B; traço preto). Para um pulso de estímulo comparável fornecido pelo implante sem fio sem bateria, uma resposta CMAP comparável é provocada com uma amplitude de pico negativo de 4,6 mV (Figura 7B; traço laranja). Isso é consistente com um relato recente de que a estimulação nervosa sem fio atinge, em média, 88% da CMAP a partir da estimulação nervosa baseada em fio21, bem acima do limiar necessário para efeitos terapêuticos em estudos clínicos 6,7,8,9. No exemplo mostrado, a maior latência do estimulador sem fio versus estimulador com fio foi devido à sua maior distância do músculo registrado.
No modelo do nervo frênico, o implante é colocado ao redor do nervo frênico direito antes da transecção (Figura 5). Para definir os parâmetros de estímulo necessários para a estimulação elétrica de intensidade máxima, um eletrodo concêntrico de agulha de 30 G é colocado subcutaneamente no rebordo costal anterior direito (ipsilateral) para registro a partir do hemidiafragma direito. Os experimentos envolvem a elevação da voltagem de estimulação até que a magnitude da resposta se platô seja o máximo. Como o nervo frênico pode ser desafiador para se isolar das estruturas neurovasculares circundantes, sua identidade pode ser confirmada pela evocação de uma resposta de contração (Figura 6; traço laranja). A especificidade da estimulação pode ser verificada pela transecção do nervo frênico distal ao manguito do eletrodo nervoso, com subsequente abolição da resposta de contração (Figura 6; traço preto).
A terapia repetitiva de estimulação elétrica de baixa frequência pode ser aplicada ao nervo ciático por 1 h usando um protocolo estabelecido que aumenta a regeneração axonal (6,7,8,9,10,11; Gráfico 8). A interface do manguito do implante sem fio foi colocada no nervo ciático direito e o eletrodo concêntrico de agulha 30G foi colocado no músculo tibial anterior direito para monitorar o tratamento. A Figura 8A mostra quatro picos sequenciais na eletromiografia registrada no início (0 min) da estimulação elétrica de 1 h 20 Hz. A Figura 8B mostra outros quatro picos registrados aos 40 min da estimulação elétrica de 1 h com discreta diminuição da amplitude do pico, o que é consistente com o padrão de fadiga observado com a terapia de estimulação elétrica baseada em fios15,21.
O grau de regeneração do nervo periférico pode ser avaliado utilizando-se traçadores retrógrados aplicados distalmente ao local da lesão nervosa. Como os axônios periféricos brotam múltiplos brotos colaterais, o traçado retrógrado e a contagem do soma do neurônio motor na medula espinhal permitem uma avaliação mais precisa do número de neurônios em regeneração do que a contagem dos axônios regenerantes dentro do próprio nervo31. Para demonstrar isso, o tronco do nervo ciático foi transeccionado por uma lesão por esmagamento. Após 3 semanas de recuperação, dois corantes retrógrados fluorescentes diferentes foram administrados em dois ramos do nervo ciático: nervo fibular (verde) e nervo tibial (vermelho), respectivamente (Figura 9A). A Figura 9B-D mostra subgrupos iluminados de motoneurônios inferiores no corno anterior da medula espinhal lombar que formam o nervo tibial (Figura 9B) ou o nervo fibular (Figura 9C). A imagem de sobreposição mostra duas colunas distintas de neurônios marcados no corno anterior da medula espinhal, que podem ser quantificadas em termos de distribuição espacial e contagem de neurônios motores que regeneraram um axônio distal ao local da lesão (Figura 9D).
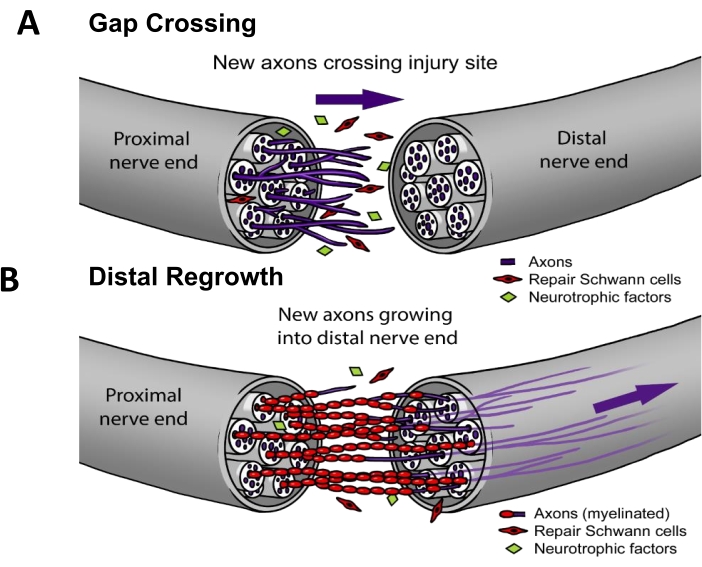
Figura 1: Modelo de regeneração nervosa. (A) O cruzamento de lacunas ocorre precocemente após o reparo do nervo, quando os axônios crescem da extremidade proximal para a distal após o reparo. (B) A duração do recrescimento distal está relacionada à distância ao órgão-alvo (por exemplo, pele, músculo) e à taxa de recrescimento do axônio. A maioria das terapias para melhorar o reparo do nervo tem como alvo um ou ambos os processos. Clique aqui para ver uma versão maior desta figura.
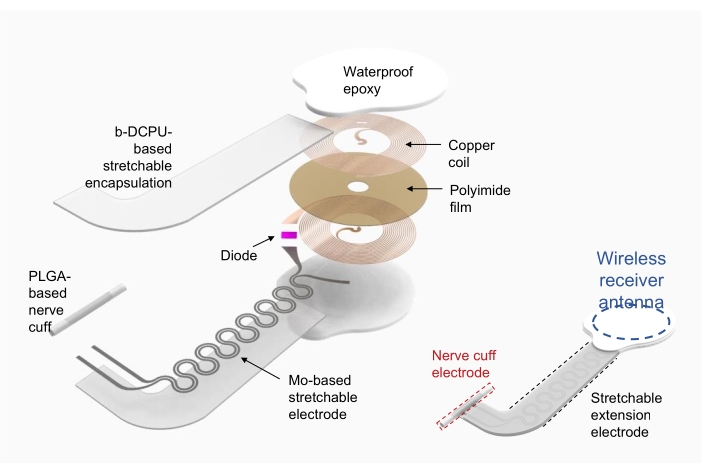
Figura 2: Ilustração da fabricação de um estimulador eletrônico sem fio. À esquerda, camadas detalhadas da estrutura do dispositivo, incluindo uma bobina circular de coleta de energia de radiofrequência, um eletrodo de extensão esticável e um manguito nervoso envolvendo um nervo de interesse. À direita, uma ilustração simplificada mostrando três partes do dispositivo. Abreviações: PLGA = poli(ácido lático-co-glicólico); b-DCPU = poliuretano covalente dinâmico bioreabsorvível. Clique aqui para ver uma versão maior desta figura.
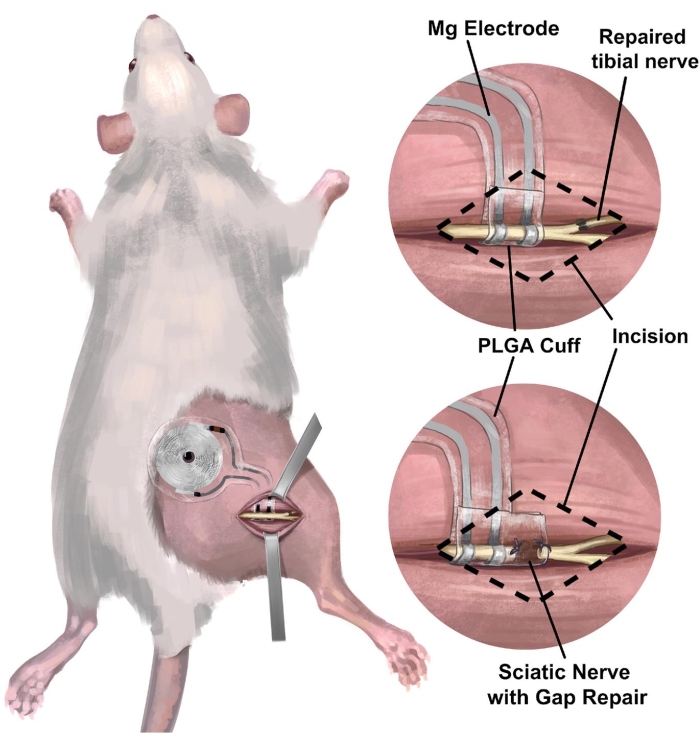
Figura 3: Implante de interface nervosa sem bateria sem fio no modelo de nervo ciático de ratos. (A) A ilustração mostra um sistema totalmente implantável no nervo ciático direito de um rato. (B) O painel superior mostra uma interface de eletrodo posicionada no nervo ciático apenas proximal ao reparo término-terminal do nervo tibial direito. O painel inferior mostra uma interface de eletrodo com um reparo estendido da lacuna de ponte do manguito nervoso entre a extremidade proximal e o coto do nervo distal. Abreviação: PLGA = poli(ácido lático-co-glicólico). Clique aqui para ver uma versão maior desta figura.
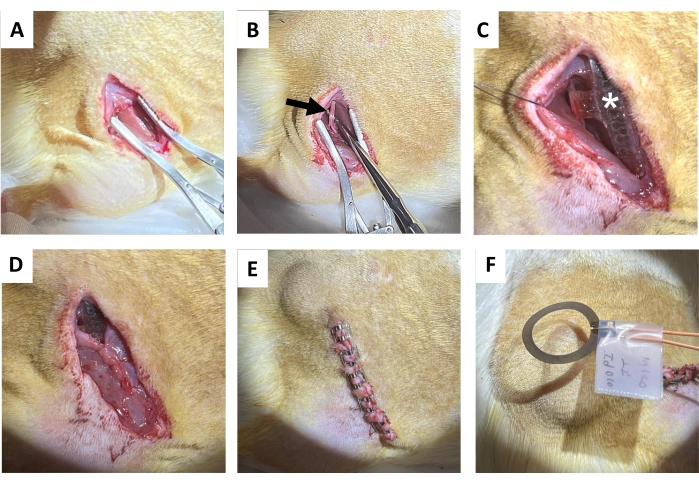
Figura 4: Procedimento de implante do nervo ciático. (A) Incisão na pele, tecido conjuntivo subcutâneo e músculo glúteo para exposição dos isquiotibiais. (B) Nervo ciático isolado (seta preta). (C) Dispositivo pós-implante com manguito nervoso, fios (asterisco branco) e implante visível (estrela). (D) Fechamento do tecido conjuntivo por sutura. (E) Fechamento da incisão por clipes de ferida. (F) Estimulação elétrica sem fio gerada por uma bobina acima da pele. Clique aqui para ver uma versão maior desta figura.
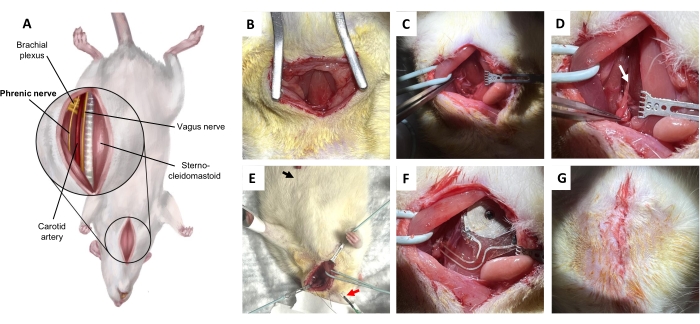
Figura 5: Procedimento de implante do nervo frênico. (A) Vista ventral do pescoço em decúbito dorsal. (B) Incisão na pele e tecido conjuntivo subcutâneo para exposição do músculo esterno-hioideo. (C) Dissecar o espaço potencial entre o músculo omo-hioideo e o músculo esternocleidomastoideo. (D) Nervo frênico (seta), isolado do plexo braquial. (E) Confirmação eletromiográfica diafragmática do nervo frênico. Seta preta, eletrodo de gravação. Seta vermelha, estimuladores. (F) Implantação. (G) Fechamento da pele com pontos dérmicos profundos. Clique aqui para ver uma versão maior desta figura.
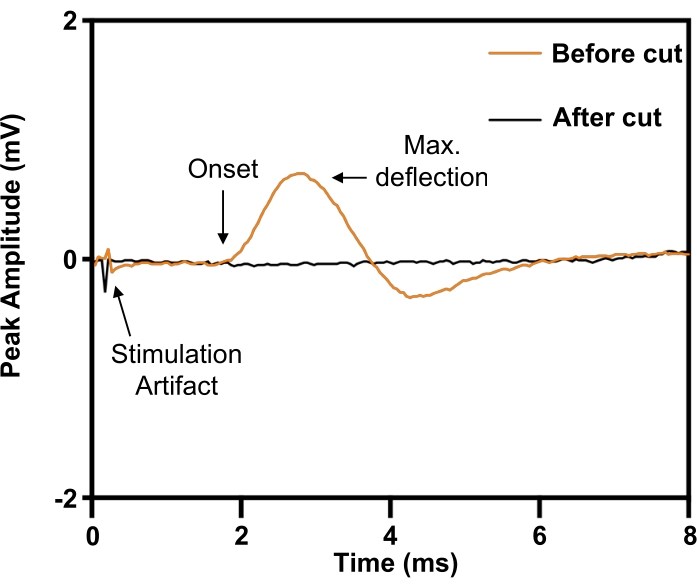
Figura 6: Confirmação da lesão completa da transecção do nervo frênico pelos potenciais de ação muscular compostos evocados do diafragma. Antes da transecção do nervo frênico (ORANGE), a estimulação elétrica do nervo frênico evocava potenciais compostos de ação muscular no diafragma ipsilateral, o que foi abolido pela transecção do nervo frênico (BLACK). Clique aqui para ver uma versão maior desta figura.
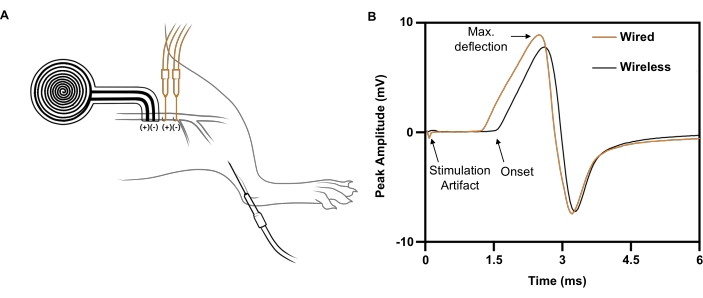
Figura 7: Estudos representativos de condução nervosa comparando a estimulação elétrica sem fio com a estimulação elétrica baseada em fio. (A) Ilustração da colocação de dispositivos sem fio (BLACK) e com fio (ORANGE) no nervo ciático. O eletrodo de registro foi posicionado no tibial anterior. (B) Potenciais compostos de ação muscular evocados por implante com fio (ORANGE) vs. implante sem fio (BLACK). Clique aqui para ver uma versão maior desta figura.
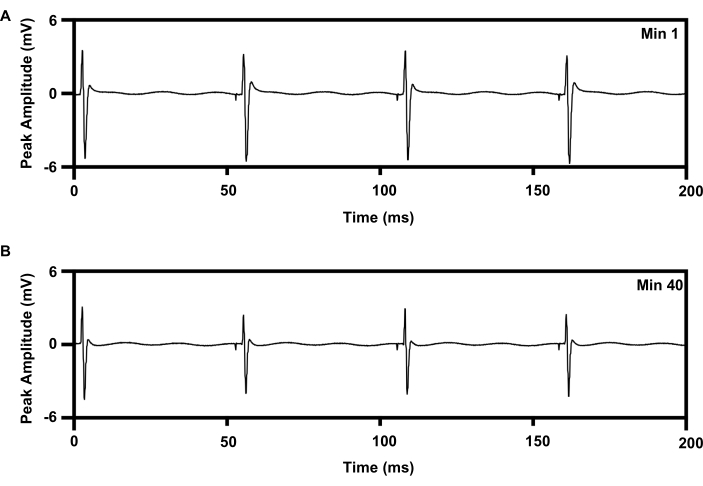
Figura 8: Registro EMG do músculo TA com estimulação elétrica repetitiva de 20 Hz por 1 h dos implantes. (A) Traço de EMG no minuto 1 do e-stim. (B) Traço de EMG no min 40 do e-stim. Abreviações: EMG = eletromiografia; AT = tibial anterior; e-stim = estimulação elétrica; min = minuto. Clique aqui para ver uma versão maior desta figura.
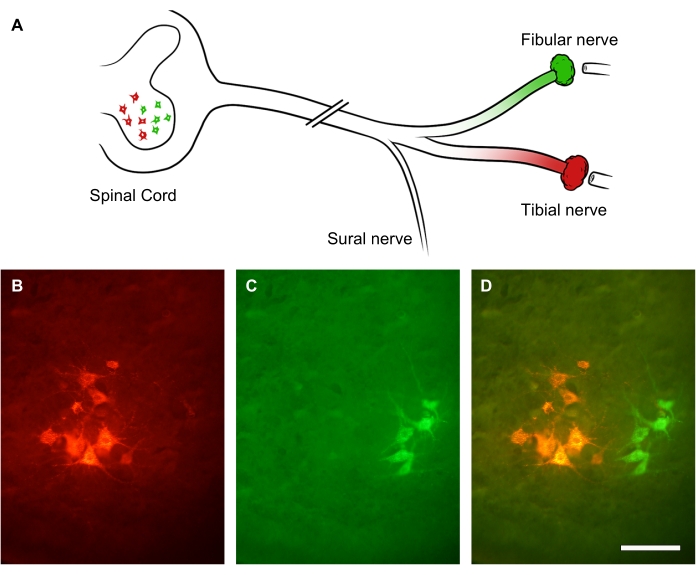
Figura 9: Imagens representativas da regeneração do nervo ciático. (A) Ilustração de lesão do nervo ciático e marcação retrógrada fluorescente. Os axônios do nervo ciático foram transeccionados por lesão por esmagamento. Após 3 semanas de recuperação, seus ramos distais - nervo fibular (verde) e tibial (vermelho) - foram marcados retrogradamente. (B-D) Imagens de uma medula espinhal lombar mostrando soma neuronal dentro do corno anterior ipsilesional. Barras de escala = 30 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreve as etapas do implante cirúrgico e operação de interfaces nervosas periféricas sem fio, sem bateria e totalmente implantáveis no modelo dos nervos isquiático e frênico de ratos. Demonstramos como esta nova classe de implantes biomédicos pode ser usada para fornecer um paradigma de estimulação elétrica terapêutica que demonstrou melhorar a regeneração axonal em estudos pré-clínicos e clínicos (para revisão, ver22). Esse protocolo não é complicado e pode ser extrapolado para modelos animais menores, como camundongos21, bem como outros dispositivos sem fio, sem bateria e totalmente implantáveis, com funcionalidade que inclui interfaces nervosas periféricas optoeletrônicas e microfluídicas 18,23,24,25,26,27,28,29,30 . Também é demonstrada a abordagem utilizando o nervo ciático de roedores, que é o modelo experimental maiscomum31.
A versatilidade dessa abordagem tem sido demonstrada quando adaptada para interface com o nervo frênico, que raramente é empregado como modelo de lesão nervosa periférica32, talvez por ser um problema clínico muito pouco reconhecido 33,34,35. O diagnóstico e a reabilitação da lesão do nervo frênico tornaram-se uma questão importante durante a pandemia de COVID-19 36,37,38. Atualmente, não se sabe se a regeneração dos axônios frênicos e a recuperação da paralisia diafragmática podem ser aumentadas por esse breve paradigma de estimulação elétrica de baixa frequência. Entretanto, a estimulação elétrica do nervo frênico para estimulação muscular diafragmática é uma opção estabelecida para insuficiência respiratória em pacientes com tetraplegia decorrente de lesão medular cervical alta 39,40,41,42,43. Outras indicações estão sendo exploradas, incluindo o desmame ventilatório após doença crítica44.
Várias etapas críticas devem ser enfatizadas para garantir o bom funcionamento do sistema implantado. Primeiro, é importante evitar aplicar muita força nos componentes eletrônicos finos dos dispositivos ao manuseá-los para evitar o desisolamento, o torto ou a quebra do chumbo. Em seguida, é importante marcar com precisão a localização da bobina do coletor de energia de radiofrequência na pele sobrejacente. Em terceiro lugar, o alinhamento cuidadoso da bobina de transmissão da fonte de alimentação de radiofrequência externa sobre a bobina do coletor de energia do dispositivo implantado com uma braçadeira de pescoço de ganso permite uma operação estável. Finalmente, para confirmar a estimulação elétrica, além da observação visual das contrações musculares, recomenda-se o monitoramento neurofisiológico periódico. No caso da anatomia mais complexa do nervo frênico no pescoço, a confirmação eletrofisiológica ajuda a demonstrar que o nervo correto foi isolado (Figura 6).
Além dos estimuladores elétricos sem fio e sem bateria mostrados neste trabalho 18,19,21, muitos outros dispositivos potencialmente compartilham os mesmos procedimentos. Por exemplo, como eletrodos projetados para implante nos nervos glossofaríngeo e vago para registrar cronicamente sinais dos sistemas nervosos simpático e parassimpático 30,45,46 compartilham uma área cirúrgica semelhante com o nervo frênico, esse protocolo pode ser adaptado para sua implantação. Estimuladores biocompatíveis sem fio de longa duração para nervos periféricos, como o ReStore, são ótimas ferramentas para permanecer no local e estimular os nervos conforme a necessidade 25,47,48,49,50. Implantes relevantes de gravação sem fio multicanal também foram relatados51. Em geral, acreditamos que esses protocolos de estimulação cirúrgica e elétrica podem ser adaptados como um padrão para toda interface nervosa periférica sem fio relacionada à estimulação elétrica ou gravação.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Este trabalho utilizou as instalações NUFAB do Centro NUANCE da Northwestern University, que recebeu apoio do SHyNE Resource (NSF ECCS-1542205), do IIN e do programa MRSEC da Northwestern (NSF DMR-1720139). Este trabalho fez uso do MatCI Facility apoiado pelo programa MRSEC da National Science Foundation (DMR-1720139) no Centro de Pesquisa em Materiais da Northwestern University. A C.K.F agradece o apoio do Instituto Eunice Kennedy Shriver de Saúde Infantil e Desenvolvimento Humano do NIH (bolsa nº R03HD101090) e da Fundação Neuromuscular Americana (Bolsa de Desenvolvimento). Y.H. reconhece o apoio da NSF (concessão nº. CMMI1635443). Este trabalho foi apoiado pelo Instituto Querrey Simpson de Bioeletrônica da Northwestern University.
Materiais
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
Referências
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7(2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, Pt 6 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990(2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724(2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397(2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349(2018).
- Repair Brushart, M. Nerve Repair. , Oxford University Press. (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723(2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066(2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698(2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115(2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562(2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados