Method Article
Impianto e controllo di sistemi wireless senza batteria per l'interfacciamento dei nervi periferici
In questo articolo
Riepilogo
Si tratta di un protocollo per l'impianto chirurgico e il funzionamento di un'interfaccia alimentata in modalità wireless per i nervi periferici. Dimostriamo l'utilità di questo approccio con esempi di stimolatori nervosi posizionati sul nervo sciatico o frenico del ratto.
Abstract
Le interfacce nervose periferiche sono spesso utilizzate nelle neuroscienze sperimentali e nella medicina rigenerativa per un'ampia varietà di applicazioni. Tali interfacce possono essere sensori, attuatori o entrambi. I metodi tradizionali di interfacciamento dei nervi periferici devono collegarsi a un sistema esterno o fare affidamento sull'alimentazione a batteria che limita il periodo di tempo per il funzionamento. Con i recenti sviluppi di interfacce nervose periferiche wireless, senza batteria e completamente impiantabili, una nuova classe di dispositivi può offrire capacità che eguagliano o superano quelle dei loro precursori cablati o alimentati a batteria. Questo documento descrive i metodi per (i) impiantare chirurgicamente e (ii) alimentare e controllare in modalità wireless questo sistema nei ratti adulti. I modelli di nervo sciatico e frenico sono stati selezionati come esempi per evidenziare la versatilità di questo approccio. Il documento mostra come l'interfaccia del nervo periferico possa evocare potenziali d'azione muscolari composti (CMAP), fornire un protocollo di stimolazione elettrica terapeutica e incorporare un condotto per la riparazione della lesione del nervo periferico. Tali dispositivi offrono opzioni di trattamento ampliate per la stimolazione terapeutica a dose singola o ripetuta e possono essere adattati a una varietà di posizioni nervose.
Introduzione
Le lesioni traumatiche dei nervi periferici (PNI) si verificano negli Stati Uniti con un'incidenza annuale di circa 200.000 all'anno1. La maggior parte dei pazienti che soffrono di PNI sono lasciati con menomazioni funzionali permanenti. Nel peggiore dei casi, questo può provocare paralisi muscolare e innescare un dolore neuropatico refrattario al trattamento così grave che i pazienti sono disposti a sottoporsi a un'amputazione dell'arto come trattamento2. Il più grande ostacolo per migliorare i risultati PNI è che la rigenerazione degli assoni è troppo lenta rispetto alle distanze che devono ricrescere. Ad esempio, un assone umano adulto cresce a 1 mm/giorno, ma potrebbe dover rigenerarsi su distanze >1000 mm nel caso di una lesione in un arto prossimale.
Nell'attuale pratica clinica, ~50% dei PNI richiede una riparazione chirurgica3. Per una rigenerazione nervosa di successo, gli assoni devono (i) crescere attraverso il sito della lesione (cioè l'attraversamento del gap) e quindi (ii) rigenerarsi lungo la via nervosa per raggiungere un bersaglio dell'organo terminale (cioè la ricrescita distale) (Figura 1). Non ci sono farmaci approvati dalla FDA che hanno dimostrato di accelerare la rigenerazione nervosa. Lo status quo della gestione clinica della PNI è cambiato solo in modo incrementale negli ultimi decenni ed è limitato a perfezionamenti tecnici di metodi chirurgici come i trasferimenti di nervi motori distali per ridurre la distanza che gli assoni rigeneranti devono percorrere4, o condotti nervosi sintetici "pronti all'uso" per i casi in cui il nervo prossimale si ritrae e non può essere suturato direttamente5. Tuttavia, ci sono stati quattro studi clinici randomizzati sulla stimolazione elettrica terapeutica applicata ai nervi dopo l'intervento, che erano studi monocentrici condotti dal Dr. K. Ming Chan presso l'Università di Alberta che mostrano un miglioramento significativo della reinnervazione del muscolo 6,7,8 o della pelle9. Il lavoro fondamentale per questo protocollo di stimolazione elettrica è stato eseguito nei roditori10,11, dove è stato dimostrato che la stimolazione elettrica funziona in modo specifico migliorando l'attraversamento delle lacune (Figura 1) ma non la ricrescita distale 12,13,14,15.
Il posizionamento chirurgico degli elettrodi a filo transcutaneo utilizzati in tutti e quattro gli studi clinici randomizzati di stimolazione elettrica è stato necessario perché i suoi effetti dipendono dall'erogazione di corrente sufficiente a depolarizzare il corpo cellulare del neurone a 20 Hz continuamente per 1 orae 11. Nella pratica clinica, questo protocollo di stimolazione elettrica non è tollerabile per la maggior parte dei pazienti alle intensità richieste tramite elettrodi di stimolazione superficiale sulla pelle a causa del dolore. Ci sono rischi non banali associati all'utilizzo di elettrodi transcutanei dopo l'intervento, come l'infezione profonda della ferita o lo spostamento accidentale dei fili dai nervi durante il trasporto del paziente dalla sala operatoria (OR). Inoltre, l'alto costo del tempo di sala operatoria è di per sé un disincentivo a tentarlo in quel contesto piuttosto che durante il recupero postoperatorio acuto. Una nuova classe di interfacce nervose periferiche wireless, senza batteria e completamente impiantabili sta emergendo per affrontare questa lacuna delle interfacce nervose periferiche esistenti.
Questa nuova classe di sistemi elettronici impiantabili wireless è pronta ad aumentare la facilità e la flessibilità per il dosaggio della stimolazione elettrica e ad abbattere le barriere che ne precludono una più ampia implementazione clinica. Questo documento descrive i metodi per (i) impiantare chirurgicamente e (ii) alimentare e controllare in modalità wireless questo sistema in modelli di nervo sciatico e frenico di ratto adulto. Mostra come l'interfaccia del nervo periferico possa evocare CMAP, fornire un protocollo di stimolazione elettrica terapeutica e persino fungere da condotto per la riparazione dei nervi periferici. I protocolli qui possono essere adattati per altre varianti di questa tecnologia in grado di fornire impulsi luminosi per la neuromodulazione mediata dall'optogenetica16, il rilascio controllato di farmaci17 o ripetuti attacchi di stimolazione elettrica nel tempo18,19.
Protocollo
Tutte le procedure descritte in questo protocollo sono eseguite in conformità con la Guida NIH per la cura e l'uso degli animali da laboratorio e sono state approvate dall'Institutional Animal Care and Use Committee (IACUC) della Northwestern University. Questo protocollo segue le linee guida per la cura degli animali del Center for Comparative Medicine della Northwestern University e dell'IACUC. È necessario consultare la IACUC quando si adattano i protocolli.
1. Fabbricazione di stimolatori elettronici wireless (Figura 2)
- Utilizzare rame/poliimmide/rame (rame superiore e inferiore di 18 μm di spessore, poliimmide spessa 75 μm) come substrato per la bobina del raccoglitore di potenza a radiofrequenza (ad esempio, antenna del ricevitore wireless).
- Utilizzare l'ablazione laser diretta per modellare i fori per gli elettrodi sugli strati di rame superiore e inferiore e modellare il dispositivo. Collegare elettricamente gli strati superiore e inferiore utilizzando pasta d'argento attraverso i fori.
- Collegare i componenti elettronici con l'imballaggio commerciale, come diodo e condensatore, tramite saldatura.
- Utilizzare il poliuretano covalente dinamico bioriassorbibile (b-DCPU; 200 μm di spessore) incapsulato molibdeno (Mo; 15 μm di spessore; struttura a serpentina) come elettrodi di estensione estensibili19.
- Formare l'elettrodo della cuffia per l'interfaccia tra il dispositivo e il nervo utilizzando una pellicola di poli(acido lattico-co-glicolico) (PLGA) (300 μm di spessore).
- Dopo aver collegato l'antenna del ricevitore wireless e l'elettrodo di estensione estensibile, incapsulare l'antenna del ricevitore wireless e il collegamento con resina epossidica o polidimetisilossano impermeabile (PDMS) commercializzata. Vedere la Figura 2 (a destra) per il dispositivo completamente assemblato.
- Confermare il funzionamento wireless del dispositivo, utilizzando un generatore di forme d'onda per generare impulsi elettrici monofasici tramite la bobina primaria (cioè la bobina di trasmissione).
NOTA: Esaminando il reclutamento di assoni periferici e l'induzione della rigenerazione assonale da parte di stimoli monofasici e bifasici, studi precedenti hanno riportato un effetto trascurabile a causa delle differenze nella caratteristica della forma d'onda20 e questo gruppo è stato in grado di ottenere un miglioramento della stimolazione elettrica terapeutica con gli stessi parametri di corrente monofasica nei topi21 e nei ratti18. Inoltre, studi precedenti hanno esaminato la biocompatibilità in vivo e in vitro e non hanno trovato alcuna prova di danni ai tessuti dovuti agli effetti del riscaldamento o ai materiali stessi. A causa di questi risultati e della durata limitata della stimolazione elettrica terapeutica nel presente studio, in questo protocollo sono stati utilizzati stimoli monofasici, piuttosto che bifasici. - Misurare la tensione di uscita in corrente continua risultante con un oscilloscopio collegato all'elettrodo del bracciale.
2. Preparazione del dispositivo per l'impianto
- Posizionare i dispositivi impiantabili in una capsula di Petri sterile e sigillarla con parafilm.
- Irradiare i dispositivi con luce UV per 30 minuti per lato.
3. Procedura chirurgica dell'impianto del nervo sciatico destro di ratto dell'interfaccia nervosa periferica wireless e senza batteria per la stimolazione elettrica (Figura 3)
NOTA: Mantenere le condizioni sterili. Eseguire interventi chirurgici all'interno dell'area chirurgica designata di una sala di procedura per animali. Il chirurgo indosserà una maschera facciale, un camice, un berretto e guanti sterili durante l'intervento chirurgico. Se viene eseguito più di un intervento chirurgico, cambiare i guanti sterili tra un animale e l'altro e utilizzare strumenti chirurgici puliti e sterili per ogni intervento chirurgico. Sterilizzare gli strumenti tra un intervento chirurgico e l'altro mediante sterilizzazione a caldo (sterilizzatore in autoclave o a microsfere di vetro). Utilizzare ratti adulti di Sprague-Dawley del peso di 200-250 g.
- Indurre l'anestesia mediante anestesia gassosa isoflurana (3% di induzione, 1-3% di mantenimento) in ossigeno (2 L/min), con somministrazione sottocutanea di meloxicam (1-2 mg/kg). Coprire gli occhi dei ratti con un unguento oftalmico designato per evitare che si secchino.
- Posizionare i ratti in posizione prona su tavoli chirurgici disinfettati per le procedure successive. Per la restante durata chirurgica, valutare la frequenza respiratoria (dovrebbe essere ~2/s), il colore dei tessuti e la profondità dell'anestesia non meno di ogni 15 minuti e mantenere i livelli di isoflurano di conseguenza. Confermare la profondità appropriata dell'anestesia controllando il riflesso del pedale (mancanza di risposta a un forte pizzicamento del dito del piede). Monitora le mucose, che devono rimanere rosa e umide.
- Radere l'area chirurgica, compresa la gamba destra e la metà inferiore della schiena. Strofinare l'area chirurgica rasata con un tampone betadine, seguito da un tampone di etanolo medico al 70% e ripetere questo processo di scrub tre volte per la disinfezione della pelle.
- Praticare un'incisione di 1,5 – 2 cm nella pelle parallela all'osso del femore destro utilizzando le forbici per tessuti, seguita da una separazione smussata del tessuto connettivo sottocutaneo sulla schiena (direttamente medialmente all'incisione) per liberare una tasca sottocutanea per la bobina ricevente (Figura 4A). Praticare un'incisione successiva (1,2-1,5 cm) sul muscolo gluteo destro parallelamente all'incisione cutanea.
- Isolare delicatamente il nervo sciatico con sonde metalliche di dissezione con estremità smussate (Figura 4B).
NOTA: Il nervo sciatico si trova in profondità rispetto al bicipite femorale e corre parallelo al femore. Si suggerisce un endoscopio da dissezione. - Impiantare il dispositivo wireless, privo di batteria, sul nervo sciatico (Figura 4C) avvolgendo la cuffia attorno al nervo sciatico destro isolato, senza mettere il nervo in tensione o distorcere il suo percorso 18,19,20. Segna sulla pelle dove è posizionata la bobina del ricevitore per un'ulteriore stimolazione elettrica.
- Suturare l'incisione del muscolo gluteo utilizzando punti di sutura riassorbibili (Figura 4D).
NOTA: La metà superiore della bobina ricevente si trova sopra il muscolo gluteo e l'interfaccia del bracciale sotto di esso. - Chiudere l'incisione cutanea con clip per ferite (o sutura sepolta; Figura 4E). Abbina i bordi della pelle.
- Erogare 1 ora di stimolazione elettrica postchirurgica continua a 20 Hz con un'ampiezza dell'impulso di 200 μs in anestesia (Figura 4F). Riportare gli animali nelle loro gabbie di casa dopo che si sono completamente ripresi dall'anestesia.
NOTA: Il protocollo dettagliato è descritto di seguito. La bobina del ricevitore è mostrata sopra la pelle nella Figura 4F. - Trattamento post-chirurgico
- Collocare il ratto in una gabbia di recupero senza lettiera, foderata con carta assorbente, con metà della gabbia posta su un'opportuna fonte di calore a temperatura controllata (termoforo omologato).
- Monitora attentamente il ratto fino a quando non è deambulante. Una volta deambulato e valutato come stabile, riportare il ratto nella gabbia di casa e osservare il reinserimento sociale.
- Dopo il recupero acuto, monitorare i ratti per l'infezione del sito di incisione e per i sintomi di dolore neurogeno, inclusi ma non limitati a guardia, contorcersi, grattarsi e automutilazione. Monitorare i ratti quotidianamente per il periodo di recupero post-chirurgico di 5 giorni e almeno una volta ogni tre giorni in seguito se i ratti non vengono sacrificati al giorno 5.
- Somministrare meloxicam (1-2 mg/kg) per via sottocutanea una volta al giorno per due o tre giorni dopo l'intervento, a seconda del livello di dolore/disagio dell'animale. Se si sospetta un dolore persistente, continuare con meloxicam oltre questo periodo postoperatorio e, se si rivela refrattario, sopprimere il ratto precocemente in consultazione con l'équipe veterinaria.
- Rimuovere i punti di sutura cutanei o le clip della ferita 10-12 giorni dopo l'intervento.
4. Procedura chirurgica di impianto del nervo frenico sinistro di ratto di stimolatori wireless (Figura 5A)
NOTA: Mantenere le condizioni di sterilità, come nella sezione 3. Utilizzare ratti Sprague-Dawley adulti del peso di 200-250 g. Sterilizzare tutti gli strumenti chirurgici prima dell'uso.
- Indurre l'anestesia mediante anestesia gassosa isoflurana (3% di induzione, 1-3% di mantenimento) in ossigeno (2 L/min), con somministrazione sottocutanea di meloxicam (1-2 mg/kg). Coprire gli occhi del ratto con un unguento oftalmico designato per prevenire l'essiccazione.
- Posizionare i ratti in posizione supina su tavoli chirurgici disinfettati per le procedure successive. Per la restante durata chirurgica, valutare la frequenza respiratoria, il colore dei tessuti e la profondità dell'anestesia non meno di ogni 15 minuti e mantenere i livelli di isoflurano di conseguenza. Confermare la profondità appropriata dell'anestesia controllando il riflesso del pedale (mancanza di risposta a un forte pizzicamento del dito del piede). Monitora le mucose, che devono rimanere rosa e umide.
- Radere l'area chirurgica sulla faccia ventrale del collo. Strofinare l'area chirurgica rasata con un tampone betadine, seguito da un tampone di etanolo medico al 70% e ripetere questo processo di scrub tre volte per la disinfezione della pelle.
- Somministrare bupivacaina (2 mg/kg, diluita in soluzione fisiologica non superiore a 0,5 ml di volume totale) per via sottocutanea sulla linea mediana del collo, mirando allo strato più superficiale. Praticare un'incisione di 3 cm sulla linea mediana attraverso la pelle e la fascia cervicale superficiale per esporre i muscoli sternoioideo e sternocleidomastoideo (Figura 5B).
NOTA: Si consiglia un endoscopio da dissezione. - Sollevare lo sternocleidomastoideo utilizzando una delicata dissezione smussata con una sonda e ritrarlo lateralmente utilizzando un anello del vaso (Figura 5C). Liberare e ritrarre delicatamente l'omoioide. Successivamente, liberare delicatamente e ritrarre medialmente il nervo vago e il fascio carotideo sotto il muscolo omoioideo.
NOTA: La principale discriminazione qui è tra il nervo vago e il nervo frenico. Tagliare l'omoioide se è necessario esporre le strutture sottostanti. - Isolare il nervo frenico (Figura 5D).
NOTA: Il nervo frenico corre lungo la superficie del muscolo scaleno anteriore, correndo come un nervo longitudinale notevolmente piccolo che attraversa perpendicolarmente al plesso brachiale. A differenza del nervo sciatico, l'anatomia intorno al nervo frenico al collo è più complessa. Eseguire la conferma elettrofisiologica (passaggio 4.7) prima dell'impianto per ottenere i migliori risultati. - Posizionare l'elettrodo di registrazione per via sottocutanea, appena caudalmente alla gabbia toracica, omolaterale al nervo frenico isolato (Figura 5E). Posizionare gli stimolatori sul nervo frenico e confermare tramite segnalazione sincrona (Figura 6).
NOTA: Evocare una risposta massimale con un'intensità dello stimolo di ~3-6 mA e una durata dello stimolo di 0,02 ms è tipico. - Verificare la completa transezione del nervo frenico mostrando la completa abolizione della risposta evocata quando uno stimolo elettrico viene applicato sull'estremità nervosa prossimale rispetto al sito di transezione (Figura 6).
- Impiantare un dispositivo wireless senza batteria sul nervo frenico (Figura 5F) posizionando la bobina ricevente del dispositivo impiantabile sullo sternoioideo, in profondità rispetto ai muscoli sternocleidomastoidei bilaterali, con la cuffia attorno al nervo frenico e gli elettrodi di contatto posizionati perpendicolarmente al nervo.
- Chiudere la fascia cervicale superficiale con semplici punti di sutura riassorbibili (Figura 5G). Chiudere la pelle con suture riassorbibili invertite interrotte nel derma profondo. Riportare gli animali nelle loro gabbie domestiche solo dopo che si sono completamente ripresi dall'anestesia.
- Per il trattamento post-chirurgico, seguire il passaggio 3.10.
5. Erogazione wireless della stimolazione elettrica terapeutica
- Applicare la stimolazione elettrica per 1 ora ai ratti in anestesia generale. Per la stimolazione wireless, posizionare un generatore di forme d'onda/funzioni (tensione: 1-15 Vpp) e un amplificatore opzionale sopra l'animale per fornire energia elettrica a una bobina induttiva esterna (cioè bobina di trasmissione) (bobina a spirale bidimensionale con 5 spire; diametro: 2 cm) per garantire un buon accoppiamento induttivo con la bobina ricevente impiantata. Eroga impulsi monofasici da 200 μs a 20 Hz per una durata di 1 ora.
- Per verificare e quantificare l'erogazione della stimolazione elettrica, registrare i CMAP dal muscolo tibiale anteriore, regolando la tensione di stimolazione per fornire l'attivazione sovramassimale del nervo sciatico. Utilizzare elettrodi ad ago concentrici per tutte le registrazioni.
NOTA: Se la tensione massima generata dalla funzione è insufficiente per evocare una risposta massima, utilizzare un amplificatore.
6. Eutanasia
- Metodo primario
- Posizionare la gabbia sotto una camera di erogazione di CO2 , impostata su una velocità di 8-12 LPM (o una portata appropriata in base alle dimensioni della camera). Monitorare i ratti per l'incoscienza e poi per almeno 1 minuto di cessazione della respirazione.
- Metodo secondario
- Eseguire la lussazione cervicale o la toracotomia bilaterale.
Risultati
Nel modello di lesione del nervo sciatico, l'impianto viene posizionato attorno al nervo sciatico destro prima della riparazione end-to-end del ramo del nervo tibiale (Figura 3, Figura 4A e Figura 7A). Un elettrodo ad ago concentrico da 30 G viene posizionato nel muscolo tibiale anteriore destro per definire i parametri di stimolo necessari per la stimolazione elettrica di massima intensità. Questi esperimenti includono l'aumento dell'intensità della stimolazione fino a quando l'entità della risposta non si stabilizza al massimo. Poiché il tibiale anteriore è innervato dal ramo peroneale del nervo sciatico, viene risparmiato nella lesione della transezione del nervo tibiale. Pertanto, la registrazione dal tibiale anteriore consente il monitoraggio continuo del trattamento di stimolazione elettrica.
Per un impulso a singolo stimolo erogato da un elettrodo a filo al nervo sciatico destro (5 mA, 0,02 ms), viene suscitata una risposta CMAP massimale con un'ampiezza di picco negativa di 5,4 mV registrata sulla tibiale anteriore omolaterale (Figura 7B; traccia nera). Per un impulso di stimolo comparabile erogato dall'impianto wireless senza batteria, viene suscitata una risposta CMAP comparabile con un'ampiezza di picco negativa di 4,6 mV (Figura 7B; traccia arancione). Ciò è coerente con un recente rapporto secondo cui la stimolazione nervosa wireless raggiunge in media l'88% della CMAP dalla stimolazione nervosa basata su filo21, ben al di sopra della soglia richiesta per gli effetti terapeutici negli studi clinici 6,7,8,9. Nell'esempio mostrato, la maggiore latenza dello stimolatore wireless rispetto allo stimolatore cablato era dovuta alla sua maggiore distanza dal muscolo registrato.
Nel modello di nervo frenico, l'impianto viene posizionato attorno al nervo frenico destro prima della transezione (Figura 5). Per definire i parametri di stimolo necessari per la stimolazione elettrica di massima intensità, un elettrodo ad ago concentrico da 30 G viene posizionato per via sottocutanea sul margine costale anteriore destro (omolaterale) per registrare dall'emidiaframma destro. Gli esperimenti prevedono l'aumento della tensione di stimolazione fino a quando l'entità della risposta non raggiunge il suo massimo. Poiché il nervo frenico può essere difficile da isolare dalle strutture neurovascolari circostanti, la sua identità può essere confermata evocando una risposta di contrazione (Figura 6; traccia arancione). La specificità della stimolazione può essere ulteriormente verificata mediante la transezione del nervo frenico distale alla cuffia dell'elettrodo nervoso con successiva abolizione della risposta di contrazione (Figura 6; traccia nera).
La terapia di stimolazione elettrica ripetitiva a bassa frequenza può essere somministrata al nervo sciatico per 1 ora utilizzando un protocollo stabilito che migliora la rigenerazione degli assoni (6,7,8,9,10,11; Figura 8). L'interfaccia della cuffia dell'impianto wireless è stata posizionata sul nervo sciatico destro e l'elettrodo ad ago concentrico da 30 G è stato posizionato sul muscolo tibiale anteriore destro per monitorare il trattamento. La Figura 8A mostra quattro picchi sequenziali nell'elettromiografia registrata all'inizio (0 min) della stimolazione elettrica di 1 ora e 20 Hz. La Figura 8B mostra altri quattro picchi registrati a 40 minuti della stimolazione elettrica di 1 ora con una leggera diminuzione dell'ampiezza del picco, che è coerente con il modello di affaticamento osservato con la terapia di stimolazione elettrica basata su filo15,21.
Il grado di rigenerazione dei nervi periferici può essere valutato utilizzando traccianti retrogradi applicati distalmente al sito della lesione nervosa. Poiché gli assoni periferici fanno germogliare più germogli collaterali, il tracciamento retrogrado e la conta del soma del motoneurone nel midollo spinale consentono una valutazione più accurata del numero di neuroni rigeneranti rispetto al conteggio degli assoni rigeneranti all'interno del nervo stesso31. Per dimostrarlo, il tronco del nervo sciatico è stato sezionato da una lesione da schiacciamento. Dopo 3 settimane di convalescenza, sono stati somministrati due diversi coloranti retrogradi fluorescenti su due rami del nervo sciatico: rispettivamente il nervo peroneale (verde) e il nervo tibiale (rosso) (Figura 9A). La Figura 9B-D mostra sottogruppi illuminati di motoneuroni inferiori nel corno anteriore del midollo spinale lombare che formano il nervo tibiale (Figura 9B) o il nervo peroneale (Figura 9C). L'immagine sovrapposta mostra due colonne distinte di neuroni marcati nel corno anteriore del midollo spinale, che possono essere quantificati in termini di distribuzione spaziale e conteggio dei motoneuroni che hanno rigenerato un assone distale al sito della lesione (Figura 9D).
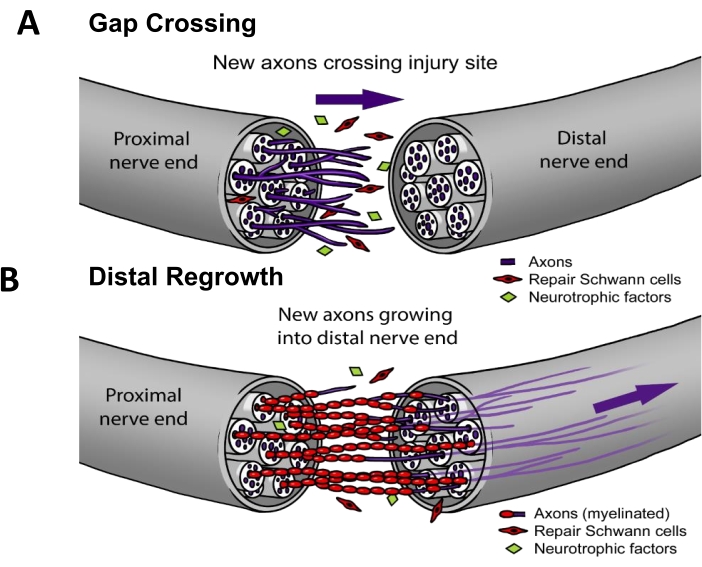
Figura 1: Modello di rigenerazione nervosa. (A) L'attraversamento delle lacune si verifica subito dopo la riparazione del nervo, quando gli assoni crescono dall'estremità nervosa prossimale a quella distale dopo la riparazione. (B) La durata della ricrescita distale è correlata alla distanza dall'organo terminale bersaglio (ad esempio, pelle, muscolo) e al tasso di ricrescita degli assoni. La maggior parte delle terapie per migliorare la riparazione nervosa si rivolge a uno o entrambi questi processi. Fare clic qui per visualizzare una versione più grande di questa figura.
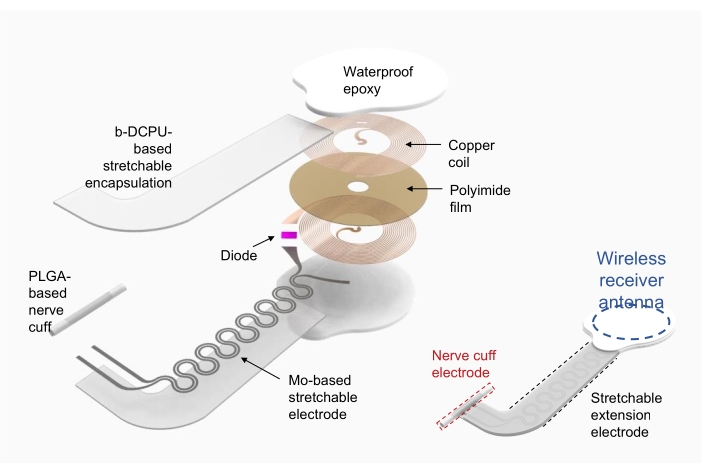
Figura 2: Illustrazione della fabbricazione di uno stimolatore elettronico wireless. A sinistra, strati dettagliati della struttura del dispositivo, tra cui una bobina circolare di raccolta di energia a radiofrequenza, un elettrodo di estensione estensibile e una cuffia nervosa che avvolge un nervo di interesse. A destra, un'illustrazione semplificata che mostra tre parti del dispositivo. Abbreviazioni: PLGA = acido poli(lattico-co-glicolico); b-DCPU = poliuretano covalente dinamico bioriassorbibile. Fare clic qui per visualizzare una versione più grande di questa figura.
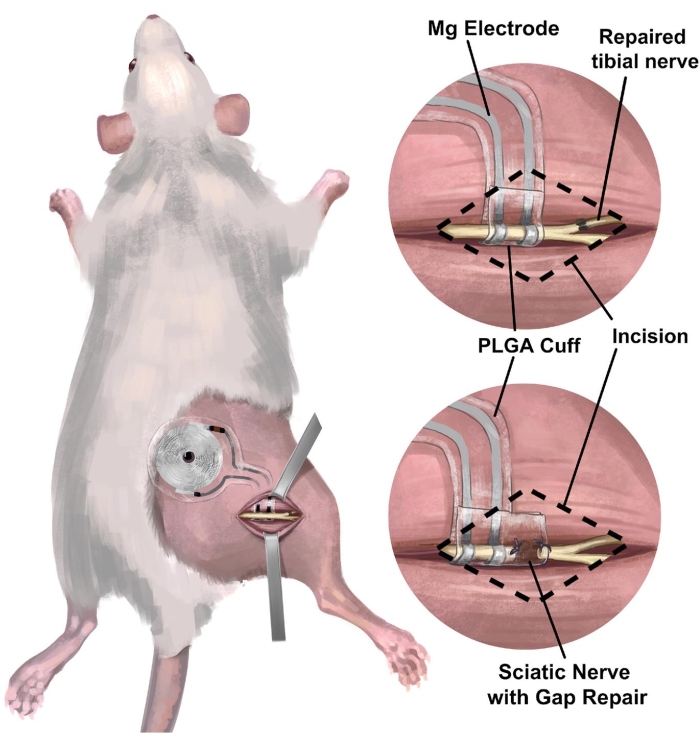
Figura 3: Impianto di un'interfaccia nervosa wireless senza batteria nel modello di nervo sciatico di ratto. (A) L'illustrazione raffigura un sistema completamente impiantabile nel nervo sciatico destro di un ratto. (B) Il pannello superiore mostra un'interfaccia elettrodica posizionata sul nervo sciatico appena prossimale alla riparazione end-to-end del nervo tibiale destro. Il pannello inferiore mostra un'interfaccia dell'elettrodo con una riparazione estesa dello spazio di collasso della cuffia nervosa tra l'estremità prossimale e il moncone del nervo distale. Abbreviazione: PLGA = acido poli(lattico-co-glicolico). Fare clic qui per visualizzare una versione più grande di questa figura.
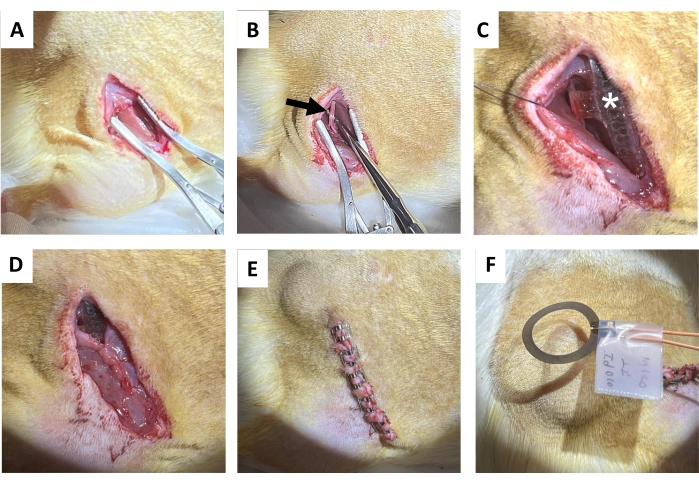
Figura 4: Procedura di impianto del nervo sciatico. (A) Incisione sulla pelle, sul tessuto connettivo sottocutaneo e sul muscolo gluteo per esporre il tendine del ginocchio. (B) Nervo sciatico isolato (freccia nera). (C) Dispositivo post-impianto con cuffia nervosa, fili (asterisco bianco) e impianto visibile (stella). (D) Chiusura del tessuto connettivo mediante sutura. (E) Chiusura dell'incisione mediante clip per ferite. (F) Stimolazione elettrica senza fili generata da una bobina sopra la pelle. Fare clic qui per visualizzare una versione più grande di questa figura.
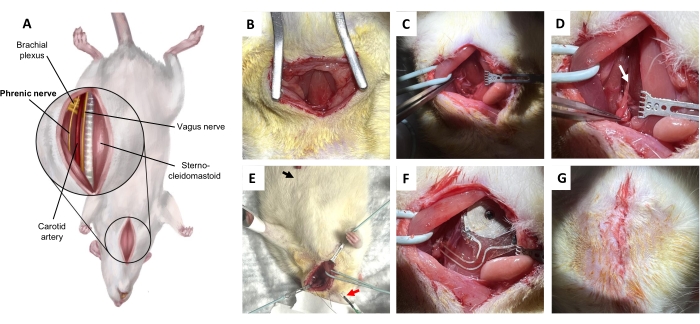
Figura 5: Procedura di impianto del nervo frenico. (A) Vista ventrale del collo in posizione supina. (B) Incisione sulla pelle e sul tessuto connettivo sottocutaneo per esporre il muscolo sternoioideo. (C) Sezionare attraverso lo spazio potenziale tra il muscolo omoioideo e il muscolo sternocleidomastoideo. (D) Nervo frenico (freccia), isolato dal plesso brachiale. (E) Conferma elettromiografica diaframmatica del nervo frenico. Freccia nera, elettrodo di registrazione. Freccia rossa, stimolatori. (F) Impianto. (G) Chiusura della pelle con punti dermici profondi. Fare clic qui per visualizzare una versione più grande di questa figura.
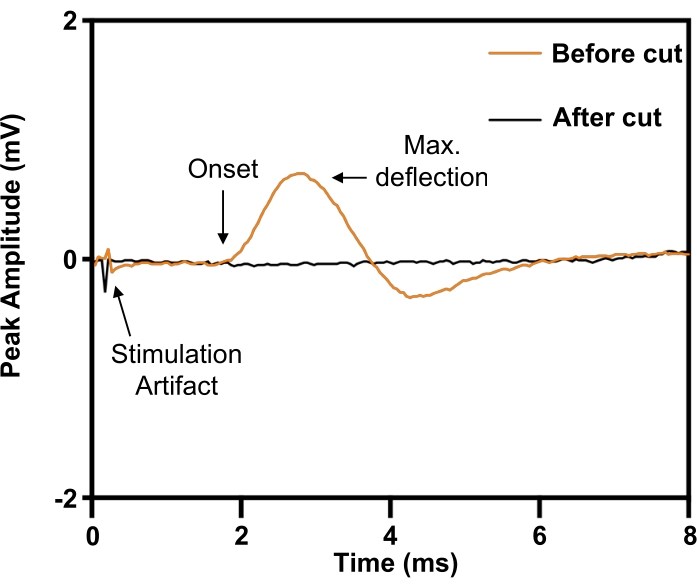
Figura 6: Conferma della lesione completa della transezione del nervo frenico mediante potenziali d'azione muscolari composti evocati dal diaframma. Prima della transezione del nervo frenico (ORANGE), la stimolazione elettrica del nervo frenico evocava potenziali d'azione muscolari composti sul diaframma omolaterale, che è stata abolita dalla transezione del nervo frenico (BLACK). Fare clic qui per visualizzare una versione più grande di questa figura.
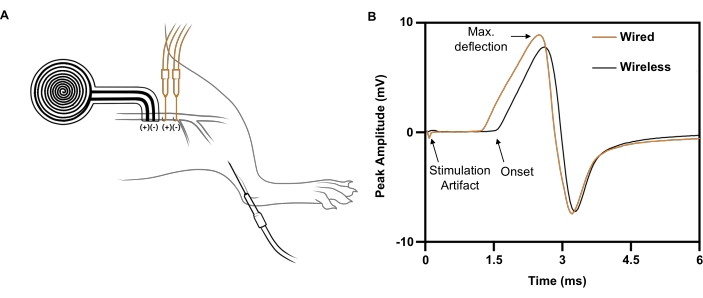
Figura 7: Studi rappresentativi sulla conduzione nervosa che confrontano la stimolazione elettrica wireless con quella basata su filo. (A) Illustrazione dei posizionamenti dei dispositivi wireless (NERO) e cablato (ARANCIONE) sul nervo sciatico. L'elettrodo di registrazione è stato posizionato nella parte anteriore del tibiale. (B) Potenziali d'azione muscolari composti evocati dall'impianto cablato (ARANCIONE) rispetto all'impianto wireless (NERO). Fare clic qui per visualizzare una versione più grande di questa figura.
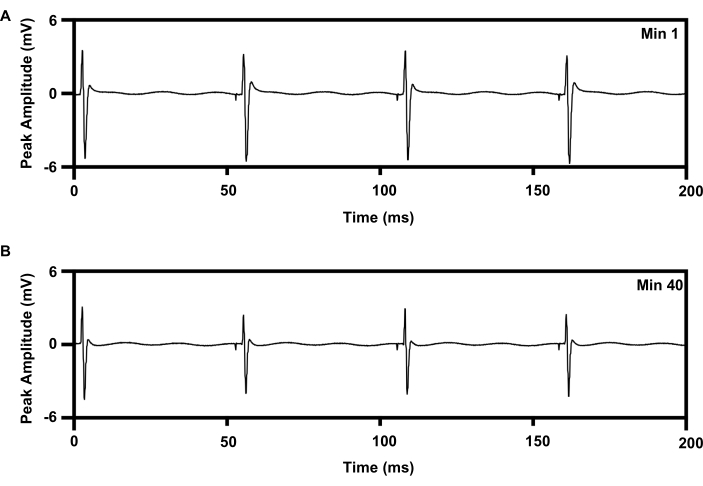
Figura 8: Registrazione EMG dal muscolo TA con stimolazione elettrica ripetitiva a 20 Hz per 1 ora da impianti. (A) Traccia di EMG al minimo 1 di e-stim. (B) Traccia di EMG a min 40 di e-stim. Abbreviazioni: EMG = elettromiografia; TA = tibiale anteriore; e-stim = stimolazione elettrica; min = minuto. Fare clic qui per visualizzare una versione più grande di questa figura.
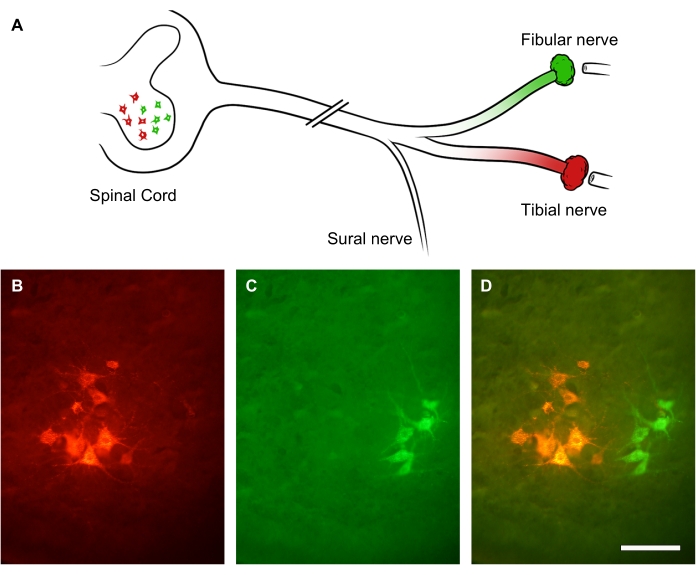
Figura 9: Immagini rappresentative della rigenerazione del nervo sciatico. (A) Illustrazione della lesione del nervo sciatico e dell'etichettatura retrograda fluorescente. Gli assoni del nervo sciatico sono stati tranciati da una lesione da schiacciamento. Dopo 3 settimane di recupero, i suoi rami distali - il nervo fibulare (in verde) e il nervo tibiale (in rosso) - sono stati marcati retrogradamente. (B-D) Immagini di un midollo spinale lombare che mostra il soma neuronale all'interno del corno anteriore ipsilesionale. Barre di scala = 30 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo documento descrive le fasi dell'impianto chirurgico e del funzionamento di interfacce nervose periferiche wireless, prive di batteria e completamente impiantabili nel modello di nervo sciatico e frenico di ratto. Dimostriamo come questa nuova classe di impianti biomedici possa essere utilizzata per fornire un paradigma di stimolazione elettrica terapeutica che ha dimostrato di migliorare la rigenerazione degli assoni in studi preclinici e clinici (per la revisione, vedere22). Questo protocollo è semplice e può essere estrapolato a modelli animali più piccoli, come i topi21, nonché ad altri dispositivi wireless, senza batteria e completamente impiantabili con funzionalità che includono interfacce nervose periferiche optoelettroniche e microfluidiche 18,23,24,25,26,27,28,29,30 . Viene anche dimostrato l'approccio che utilizza il nervo sciatico del roditore, che è il modello sperimentalepiù comune 31.
La versatilità di questo approccio è stata dimostrata quando è adattato per interfacciarsi con il nervo frenico, che è raramente impiegato come modello di lesione del nervo periferico32, forse perché è un problema clinico ampiamente sottovalutato 33,34,35. La diagnosi e la riabilitazione delle lesioni del nervo frenico sono diventate un problema importante durante la pandemia di COVID-19 36,37,38. Al momento non è noto se la rigenerazione degli assoni frenici e il recupero dalla paralisi del diaframma possano essere aumentati da questo breve paradigma di stimolazione elettrica a bassa frequenza. Tuttavia, la stimolazione elettrica del nervo frenico per la stimolazione muscolare del diaframma è un'opzione consolidata per l'insufficienza respiratoria nei pazienti con tetraplegia da lesione del midollo spinale cervicale elevato 39,40,41,42,43. Altre indicazioni sono in fase di studio, tra cui lo svezzamento ventilatorio dopo una malattia critica44.
Diversi passaggi critici devono essere sottolineati per garantire il buon funzionamento del sistema impiantato. Innanzitutto, è importante evitare di applicare troppa forza sui sottili componenti elettronici dei dispositivi quando li si maneggia per evitare il deisolamento, l'attorcigliamento o la rottura del piombo. Successivamente, è importante contrassegnare con precisione la posizione della bobina del raccoglitore di energia a radiofrequenza sulla pelle sovrastante. In terzo luogo, l'attento allineamento della bobina di trasmissione dell'alimentatore esterno a radiofrequenza sulla bobina dell'alimentatore del dispositivo impiantato con un morsetto a collo d'oca consente un funzionamento stabile. Infine, per confermare la stimolazione elettrica oltre all'osservazione visiva delle contrazioni muscolari, si raccomanda un monitoraggio neurofisiologico periodico. Nel caso dell'anatomia più complessa del nervo frenico nel collo, la conferma elettrofisiologica aiuta a dimostrare che il nervo corretto è stato isolato (Figura 6).
Oltre agli stimolatori elettrici wireless e senza batteria mostrati in questo documento 18,19,21, molti altri dispositivi condividono potenzialmente le stesse procedure. Ad esempio, poiché gli elettrodi progettati per essere impiantati nei nervi glossofaringeo e vago per registrare cronicamente i segnali provenienti dai sistemi nervosi simpatico e parasimpatico 30,45,46 condividono un'area chirurgica simile con il nervo frenico, questo protocollo può essere adattato per il loro impianto. Gli stimolatori biocompatibili wireless a lungo termine per i nervi periferici, come ReStore, sono ottimi strumenti per rimanere in posizione e stimolare i nervi secondo necessità 25,47,48,49,50. Sono stati segnalati anche impianti di registrazione wireless multicanalepertinenti 51. Nel complesso, riteniamo che questi protocolli di stimolazione chirurgica ed elettrica possano essere adattati come standard per tutte le interfacce nervose periferiche wireless relative alla stimolazione o alla registrazione elettrica.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Questo lavoro ha utilizzato la struttura NUFAB del NUANCE Center della Northwestern University, che ha ricevuto il supporto della SHyNE Resource (NSF ECCS-1542205), dell'IIN e del programma MRSEC della Northwestern (NSF DMR-1720139). Questo lavoro si è avvalso della struttura MatCI supportata dal programma MRSEC della National Science Foundation (DMR-1720139) presso il Materials Research Center della Northwestern University. Il C.K.F riconosce il sostegno dell'Eunice Kennedy Shriver Institute of Child Health and Human Development del NIH (sovvenzione n. R03HD101090) e dell'American Neuromuscular Foundation (Development Grant). Y.H. riconosce il sostegno di NSF (sovvenzione n. CMMI1635443). Questo lavoro è stato sostenuto dal Querrey Simpson Institute for Bioelectronics della Northwestern University.
Materiali
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
Riferimenti
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7 (2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990 (2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724 (2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397 (2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349 (2018).
- Repair Brushart, M. . Nerve Repair. , (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723 (2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066 (2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698 (2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115 (2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon