Method Article
末梢神経インターフェースのためのワイヤレス、バッテリーレスシステムの移植と制御
要約
これは、末梢神経用のワイヤレス給電インターフェースの外科的移植と操作のためのプロトコルです。ラットの坐骨神経または横隔神経のいずれかに配置された神経刺激装置の例を使用して、このアプローチの有用性を実証します。
要約
末梢神経界面は、実験神経科学や再生医療において、さまざまな用途で頻繁に使用されています。このようなインターフェースは、センサー、アクチュエーター、またはその両方です。従来の末梢神経インターフェースの方法では、外部システムにつなぐか、バッテリー電源に依存して動作の時間枠を制限する必要があります。ワイヤレス、バッテリー不要、完全埋め込み型の末梢神経インターフェースの最近の開発により、新しいクラスのデバイスは、有線またはバッテリー駆動の前駆体と同等またはそれ以上の機能を提供することができます。この論文では、成体ラットに(i)外科的に移植し、(ii)このシステムにワイヤレスで電力を供給し、制御する方法について説明します。坐骨神経モデルと横隔神経モデルは、このアプローチの汎用性を強調するために例として選択されました。この論文は、末梢神経インターフェースが複合筋活動電位(CMAP)を喚起し、治療用電気刺激プロトコルを提供し、末梢神経損傷の修復のための導管を組み込む方法を示しています。このようなデバイスは、単回投与または反復投与の治療刺激に対する治療の選択肢を拡大し、さまざまな神経部位に適合させることができます。
概要
外傷性末梢神経損傷(PNI)は米国で発生し、年間約200,000人の発生率があります1。PNIに苦しむほとんどの患者は、永続的な機能障害が残ります。最悪の場合、筋肉の麻痺を引き起こし、治療抵抗性の神経障害性疼痛を引き起こす可能性があり、患者は治療2として手足の切断を進んで受けることになります。PNIの結果を改善するための最大の障害は、軸索の再生が再生しなければならない距離に比べて遅すぎることです。例えば、成人のヒト軸索は1 mm/日で成長するが、近位肢の病変の場合、1000 mm>距離にわたって再生しなければならないことがある。
現在の臨床診療では、PNIの~50%が外科的修復を必要とします3。神経再生を成功させるには、軸索が(i)病変部位を横切って成長し(すなわち、ギャップ交差)、次に(ii)神経経路を下って再生して末端臓器標的に到達する(すなわち、遠位再成長)必要があります(図1)。神経再生を促進することが証明されているFDA承認の薬はありません。PNIの臨床管理の現状は、過去数十年にわたって漸進的に変化したに過ぎず、再生軸索が移動しなければならない距離を短縮するための遠位運動神経移植術4や、近位神経が収縮し、直接縫合できない場合に備えた「既製の」合成神経導管5などの外科的方法の技術的改良に限られています.しかし、術後に神経に適用される治療的電気刺激に関する4つのランダム化臨床試験があり、これらはアルバータ大学のK.Ming Chan博士が主導した単一施設研究であり、筋肉6,7,8または皮膚9の再神経支配が有意に改善されたことが示されています。この電気刺激プロトコルの基礎研究はげっ歯類で行われ10,11、電気刺激はギャップ交差(図1)を増強することによって特異的に機能するが、遠位再成長12,13,14,15は機能しないことが示されている。
4つの電気刺激無作為化臨床試験すべてで使用された経皮的ワイヤー電極の外科的配置は、その効果が20Hzでニューロン細胞体を1時間11秒間連続的に脱分極するのに十分な電流の供給に依存するため、必要でした。臨床現場では、この電気刺激プロトコルは、痛みのために皮膚の表面刺激電極を介して必要な強度では、ほとんどの患者にとって耐えられません。術後に経皮的電極を流すことには、深部創傷感染や、手術室(OR)からの患者搬送中の神経からのワイヤーの偶発的な変位など、重要なリスクがあります。さらに、手術時間自体のコストが高いことは、急性期の術後回復中ではなく、その環境でそれを試みることに対する阻害要因です。既存の末梢神経インターフェースの欠点に対処するために、ワイヤレスでバッテリー不要の完全埋め込み型の末梢神経インターフェースの新しいクラスが登場しています。
この新しいクラスのワイヤレス埋め込み型電子システムは、電気刺激の投与の容易さと柔軟性を高め、より広範な臨床実装を妨げる障壁を打ち破る態勢を整えています。この論文では、成体ラットの坐骨神経および横隔神経モデルにおいて、(i)外科的に移植し、(ii)このシステムをワイヤレスで駆動および制御する方法について説明します。末梢神経界面がCMAPを喚起し、治療用の電気刺激プロトコルを提供し、さらには末梢神経の修復のための導管としても機能できることを示しています。ここでのプロトコルは、光遺伝学的媒介性神経調節16、制御された薬物放出17、または時間の経過とともに繰り返される電気刺激18,19のための光パルスを送達できるこの技術の他の変種に適合させることができる。
プロトコル
このプロトコルに記載されているすべての手順は、実験動物のケアと使用に関するNIHガイドに従って実施され、ノースウェスタン大学の施設動物ケアおよび使用委員会(IACUC)によって承認されました。このプロトコルは、ノースウェスタン大学の比較医学センターおよびIACUCの動物ケアガイドラインに従います。プロトコルを適応させる際には、IACUCに相談する必要があります。
1. ワイヤレス電子刺激装置の作製(図2)
- 銅/ポリイミド/銅(厚さ18μmの上下銅、厚さ75μmのポリイミド)を無線周波数パワーハーベスタコイル(ワイヤレス受信アンテナ)の基板として使用します。
- 直接レーザーアブレーションを使用して、上下の銅層に電極用の穴をパターン化し、デバイスを成形します。上層と下層を銀ペーストで穴に通して電気的に接続します。
- ダイオードやコンデンサなどの電子部品を市販のパッケージにはんだ付けで取り付けます。
- 伸縮性延長電極19には、生体吸収性動的共有結合ポリウレタン(b-DCPU;厚さ200μm)を内包したモリブデン(Mo;厚さ15μm、蛇行構造)を用いる。
- デバイスと神経の界面に、ポリ乳酸-グリコール酸-co-グリコール酸(PLGA)フィルム(厚さ300μm)を用いてカフ電極を形成します。
- ワイヤレス受信アンテナと伸縮可能な延長電極を接続した後、ワイヤレス受信アンテナと接続部を市販の防水エポキシまたはポリジメチシロキサン(PDMS)で封入します。完全に組み立てられたデバイスについては、 図2 (右)を参照してください。
- 波形発生器を使用して、一次コイル(つまり、送信コイル)を介して単相性電気インパルスを生成して、デバイスのワイヤレス動作を確認します。
注:末梢軸索の動員と単相性および二相性刺激による軸索再生の誘導を調べたところ、以前の研究では、波形特性の違いによる影響は無視できる程度であると報告されており20、このグループは、マウス21 およびラット18において、同じ単相性電流パラメータで治療的電気刺激増強を達成することができた。さらに、以前の研究では、 in vivo および in vitro での生体適合性が調べられており、加熱効果や材料自体による組織損傷の証拠は見つかりませんでした。これらの発見と、本研究における治療的電気刺激の期間が限られているため、このプロトコルでは、二相性ではなく単相性の刺激が使用されました。 - 得られた直流出力電圧を、カフ電極に接続されたオシロスコープで測定します。
2.移植のためのデバイスの準備
- インプラントデバイスを滅菌シャーレに入れ、パラフィルムで密封します。
- デバイスに片面30分間UVライトを照射します。
3. ラット右坐骨神経移植による電気刺激用ワイヤレス・電池不要の末梢神経インターフェースの外科的処置(図3)
注意: 無菌状態を維持してください。動物処置室の指定された手術エリア内で手術を行います。外科医は、手術中、フェイスマスク、コート、キャップ、滅菌手袋を着用します。複数回の手術を行う場合は、動物間で滅菌手袋を交換し、手術ごとに清潔で滅菌された手術器具を使用してください。手術の合間には、加熱滅菌(オートクレーブまたはガラスビーズ滅菌器)で器具を滅菌します。体重200〜250gの成体のSprague-Dawleyラットを使用します。
- イソフルランガス麻酔(3%誘導、1〜3%維持)を使用して麻酔を誘発し、酸素(2 L / min)でメロキシカム(1〜2 mg / kg)を皮下投与します。.乾燥を防ぐために、指定された眼科用軟膏でラットの目を覆います。
- その後の処置のために、ラットを消毒された手術台の上に腹臥位に置きます。残りの手術期間中は、呼吸数(~2/s)、組織の色、麻酔の深さを15分ごとに評価し、それに応じてイソフルランレベルを維持します。ペダル反射(つま先を強くつまむことへの反応の欠如)をチェックして、適切な麻酔深度を確認します。ピンク色で湿ったままであるはずの粘膜を監視します。
- 右足と背中の下半分を含む手術部位を剃ります。剃った手術部位をベタジンパッドでこすり、続いて70%医療用エタノール綿棒でこすり、このスクラブプロセスを3回繰り返して皮膚を消毒します。
- 組織ハサミを使用して右大腿骨と平行に皮膚を1.5〜2cm切開し、続いて背中(切開部の真内側)の皮下結合組織を鈍く分離して、レシーバーコイルの皮下ポケットを取り除きます(図4A)。皮膚切開と平行に右臀筋を切開(1.2〜1.5 cm)します。
- 先端が鈍い金属製の解剖プローブで坐骨神経を静かに分離します(図4B)。
注:坐骨神経は大腿二頭筋の奥深くにあり、大腿骨と平行に走っています。解剖範囲が提案されます。 - 孤立した右坐骨神経にカフを巻き付けて、神経に緊張をかけたり、その経路を歪めたりすることなく、坐骨神経にワイヤレスのバッテリー不要のデバイスを埋め込みます(図4C)。レシーバーコイルが置かれている皮膚に印を付けて、さらに電気刺激を加えます。
- 吸収性縫合糸を使用して臀筋切開部を縫合します(図4D)。
注意: レシーバーコイルの上半分は臀筋の上にあり、その下のカフインターフェースがあります。 - 皮膚の切開部を創傷クリップ(または埋設縫合糸; 図4E)。スキンのエッジを一致させます。
- 麻酔下で、200μsのパルス幅で術後20Hzの電気刺激を1時間連続して行います(図4F)。麻酔から完全に回復した後、動物をホームケージに戻します。
メモ: 詳細なプロトコルについては、以下で説明します。レシーバーコイルは、 図4Fの表皮の上に示されています。 - 術後治療
- 寝具のない回収ケージにラットを入れ、ペーパータオルで裏打ちし、ケージの半分を適切な温度調節熱源(承認された加熱パッド)の上に置きます。
- ネズミが歩行可能になるまで注意深く監視します。歩行可能になり、安定していると評価されたら、ラットをホームケージに戻し、社会復帰を待ちます。
- 急性回復後、ラットの切開部位の感染と、警戒、身悶え、引っ掻き傷、自傷行為などの神経原性疼痛の症状を監視します。術後5日間の回復期間中はラットを毎日監視し、5日目にラットが犠牲にならない場合は、その後少なくとも3日に1回監視します。
- メロキシカム(1〜2 mg / kg)を1日1回、手術後2〜3日間皮下投与します。持続的な痛みが疑われる場合は、術後もこの期間を超えてメロキシカムを継続し、難治性であることが判明した場合は、獣医チームと相談してラットを早期に安楽死させます。.
- 手術後10〜12日で皮膚縫合糸または創傷クリップを取り外します。
4. ラット左横隔神経の無線刺激装置移植手術(図5A)
注意: セクション3のように、無菌状態を維持します。体重200〜250gの成体のSprague-Dawleyラットを使用します。使用前にすべての手術器具を滅菌してください。
- イソフルランガス麻酔(3%誘導、1〜3%維持)を使用して麻酔を誘発し、酸素(2 L / min)でメロキシカム(1〜2 mg / kg)を皮下投与します。.乾燥を防ぐために、指定された眼科用軟膏でラットの目を覆います。.
- その後の処置のために、ラットを消毒された手術台の上に仰臥位に置きます。残りの手術期間中は、呼吸数、組織の色、麻酔の深さを15分ごとに評価し、それに応じてイソフルランレベルを維持します。.ペダル反射(つま先を強くつまむことへの反応の欠如)をチェックして、適切な麻酔深度を確認します。ピンク色で湿ったままであるはずの粘膜を監視します。
- 首の腹側の手術部位を剃ります。剃った手術部位をベタジンパッドでこすり、続いて70%医療用エタノール綿棒でこすり、このスクラブプロセスを3回繰り返して皮膚を消毒します。
- ブピバカイン(2 mg / kg、生理食塩水で希釈して総量0.5mLを超えない)を首の正中線に皮下投与し、最も表層をターゲットにします。.皮膚と表在性頸部筋膜を3cmの正中線切開を行い、胸骨軟骨筋と胸鎖乳突筋を露出させます(図5B)。
注:解剖スコープが推奨されます。 - プローブによる穏やかな鈍的解剖を使用して胸鎖乳突筋を上昇させ、血管ループを使用して横方向に引っ込めます(図5C)。オモヒオイドを静かに解放し、引っ込めます。次に、迷走神経と舌骨筋の下にある頸動脈束を静かに解放し、内側に引っ込めます。
注:ここでの主な違いは、迷走神経と横隔神経の間です。下の構造を露出させる必要がある場合は、オモヒイドをカットします。 - 横隔神経を分離します(図5D)。
注:横隔神経は前斜角筋の表面に沿って走り、腕神経叢に垂直に交差する非常に小さな縦神経として走っています。坐骨神経とは異なり、首の横隔神経の周りの解剖学的構造はより複雑です。最良の結果を得るには、移植前に電気生理学的確認(ステップ4.7)を実行します。 - 記録電極を皮下、胸郭の尾側、孤立した横隔神経の同側に配置します(図5E)。横隔神経に刺激装置を置き、同期シグナル伝達で確認します(図6)。
注:刺激強度が3~6mA、刺激持続時間が0.02msの最大応答が一般的です。 - 横隔部位に対して近位神経端に電気刺激を加えた場合の誘発反応の完全な消失を示すことにより、横隔神経の完全な離断を確認します(図6)。
- 横隔神経の周囲にカフを配置し、神経に垂直に配置された接触電極を、両側の胸鎖乳突筋に対して深い胸骨舌骨に埋め込み型デバイスの受信コイルを配置して、横隔神経にワイヤレスのバッテリー不要のデバイスを埋め込みます(図5F)。
- 表在性頸部筋膜を単純なランニング吸収性縫合糸で閉じます(図5G)。真皮深部の中断された逆吸収性縫合糸で皮膚を閉じます。動物が麻酔から完全に回復した後にのみ、動物をホームケージに戻してください。
- 術後治療の場合は、手順3.10に従います。
5. 治療用電気刺激のワイヤレス送達
- 全身麻酔下のラットに1時間電気刺激を与える。ワイヤレス刺激の場合は、波形/関数発生器(電圧:1-15 Vpp)とオプションのアンプを動物の上に置き、外部誘導コイル(つまり、送信コイル)(5ターンの2次元スパイラルコイル、直径:2 cm)に電力を供給して、埋め込まれた受信コイルとの良好な誘導結合を確保します。単相性の200μsパルスを20Hzで1時間供給します。
- 電気刺激の送達を検証および定量化するために、前脛骨筋からのCMAPを記録し、刺激電圧を調整して坐骨神経を最大限活性化させます。すべての記録に同心円状の針電極を使用してください。
注意: 関数が生成する最大電圧が最大応答を呼び起こすのに不十分な場合は、 amplifier。
6.安楽死
- 主な方法
- ケージをCO2 デリバリーチャンバーの下に置き、8〜12 LPM(またはチャンバーサイズに基づく適切な流量)の速度に設定します。ラットの意識不明を監視し、その後、少なくとも1分間呼吸を停止します。.
- 第 2 の方法
- 子宮頸部脱臼または両側開胸術を行います。
結果
坐骨神経損傷モデルでは、脛骨神経枝のエンドツーエンド修復の前に、右坐骨神経の周囲にインプラントを留置します(図3、 図4A、 および図7A)。30Gの同心円状の針電極を右前脛骨筋に配置して、最大強度の電気刺激に必要な刺激パラメータを定義します。これらの実験には、反応の大きさが最大で横ばいになるまで刺激強度を上げることが含まれます。前脛骨筋は坐骨神経の腓骨枝によって神経支配されているため、脛骨神経離断損傷では免れます。したがって、前脛骨筋からの記録は、電気刺激治療の継続的なモニタリングを可能にする。
ワイヤー電極によって右坐骨神経に送達される単一刺激パルス(5 mA、0.02 ms)の場合、前脛骨筋同側に記録された5.4 mVの負のピーク振幅で最大のCMAP応答が誘発されます(図7B;黒いトレース)。ワイヤレスでバッテリ不要のインプラントによって供給される同等の刺激パルスの場合、4.6mVの負のピーク振幅で同等のCMAP応答が引き出されます(図7B、オレンジ色のトレース)。これは、無線神経刺激が有線神経刺激によるCMAPの平均88%を達成し21、臨床研究における治療効果に必要な閾値をはるかに上回るという最近の報告と一致しています6,7,8,9。示されている例では、ワイヤレス刺激装置と有線刺激装置の待ち時間が長いのは、記録された筋肉からの距離が長いためです。
横隔神経モデルでは、離断の前に右横隔神経の周囲にインプラントを配置します(図5)。最大強度の電気刺激に必要な刺激パラメータを定義するために、30Gの同心円状の針電極を右(同側)の前肋骨縁に皮下に配置して、右半隔膜から記録します。実験では、応答の大きさが最大になるまで刺激電圧を上昇させます。横隔神経は周囲の神経血管構造から分離することが困難な場合があるため、その同一性はけいれん反応を誘発することによって確認することができます(図6;オレンジ色の痕跡)。刺激の特異性は、神経電極カフから遠位の横隔神経を切断し、その後けいれん反応を消すことによってさらに検証できます(図6;黒い痕跡)。
反復的な低周波電気刺激療法は、軸索再生を促進する確立されたプロトコルを使用して、坐骨神経に1時間送達することができます(6,7,8,9,10,11;図8)。ワイヤレスインプラントのカフインターフェースを右坐骨神経に配置し、30G同心円状の針電極を右前脛骨筋に配置して治療を監視しました。図8Aは、1時間20Hzの電気刺激の開始時(0分)に記録された筋電図における4つの連続したスパイクを示しています。図8Bは、1時間の電気刺激の40分間に記録された他の4つのスパイクを示しており、ピーク振幅がわずかに減少しており、これはワイヤーベースの電気刺激療法で記録された疲労パターンと一致している15,21。
末梢神経再生の程度は、神経病変部位に遠位に適用される逆行性トレーサーを使用して評価できます。末梢軸索は複数の側副芽を生やすため、脊髄の運動ニューロン体細胞の逆行性追跡とカウントは、神経自体内の再生軸索を数えるよりも再生ニューロンの数をより正確に評価することを可能にします31。これを実証するために、坐骨神経幹は挫傷によって切除されました。回復から3週間後、坐骨神経の2つの枝、腓骨神経(緑)と脛骨神経(赤)に2種類の蛍光逆行性色素をそれぞれ投与しました(図9A)。図9B-Dは、脛骨神経(図9B)または腓骨神経(図9C)のいずれかを形成する腰髄前角の下部運動ニューロンの点灯サブグループを示しています。オーバーレイ画像は、脊髄の前角にある標識されたニューロンの2つの異なる列を示しており、空間分布と病変部位の遠位の軸索を再生した運動ニューロンの数の観点から定量化できます(図9D)。
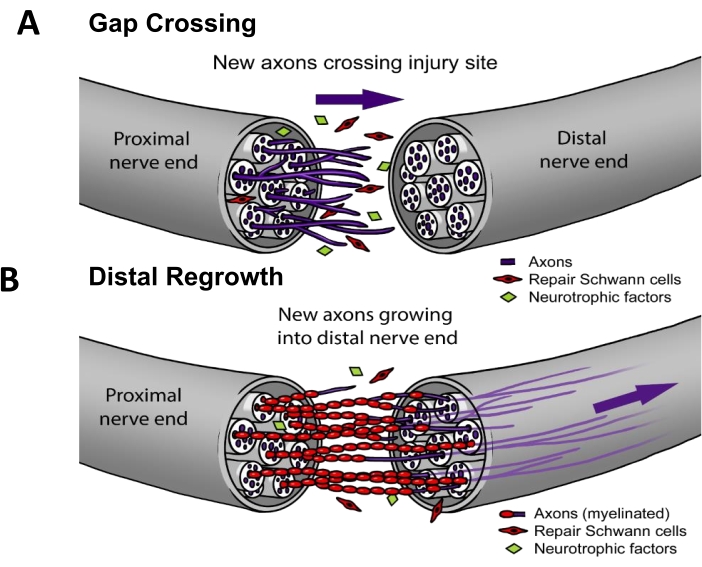
図1:神経再生モデル。 (A)ギャップ交差は、修復後に軸索が近位神経端から遠位神経端に成長するときに、神経修復後早期に発生します。(B)遠位再成長の持続時間は、標的末端器官(皮膚、筋肉など)までの距離および軸索再成長の速度に関連している。神経修復を改善するためのほとんどの治療法は、これらのプロセスの一方または両方を対象としています。 この図の拡大版をご覧になるには、ここをクリックしてください。
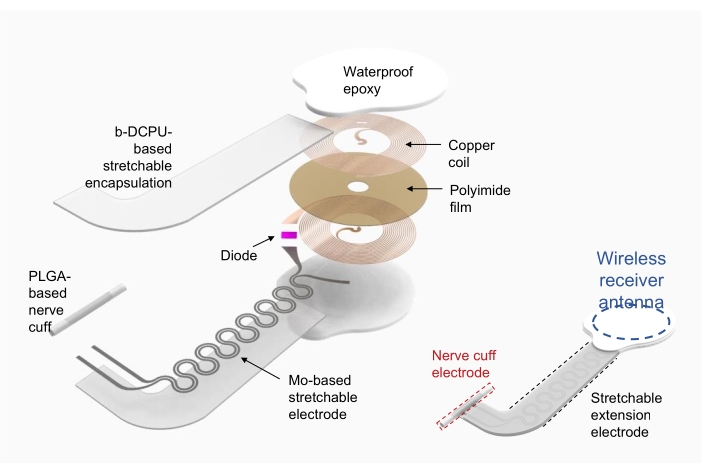
図2:ワイヤレス電子刺激装置製造の図。 左は、円形の無線周波数パワーハーベスタコイル、伸縮可能な延長電極、目的の神経を包む神経カフなど、デバイスの構造の詳細な層です。右は、デバイスの 3 つの部分を示す簡略化された図です。略語:PLGA =ポリ(乳酸-グリコール酸-co);b-DCPU = 生体吸収性動的共有結合ポリウレタン。 この図の拡大版をご覧になるには、ここをクリックしてください。
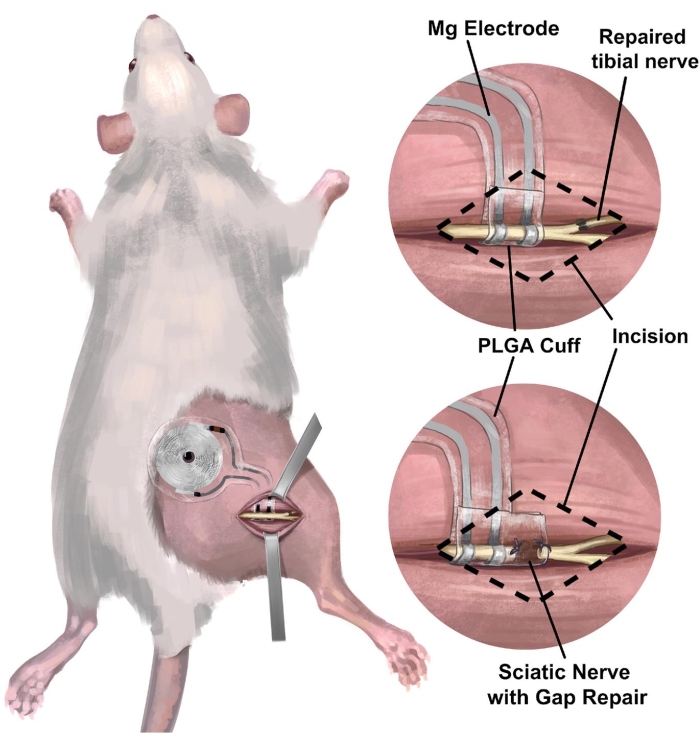
図3:ラット坐骨神経モデルへのワイヤレスで電池不要の神経インターフェースの移植。 (A)この図は、ラットの右坐骨神経に完全に埋め込まれたシステムを示しています。(B)上面は、右脛骨神経の末端から端までの修復のすぐ近位の坐骨神経上に位置する電極界面を示しています。底面パネルは、近位端と遠位神経断端の間のギャップ修復を橋渡しする延長神経カフを有する電極界面を示す。略語:PLGA =ポリ(乳酸-co-グリコール酸)。 この図の拡大版をご覧になるには、ここをクリックしてください。
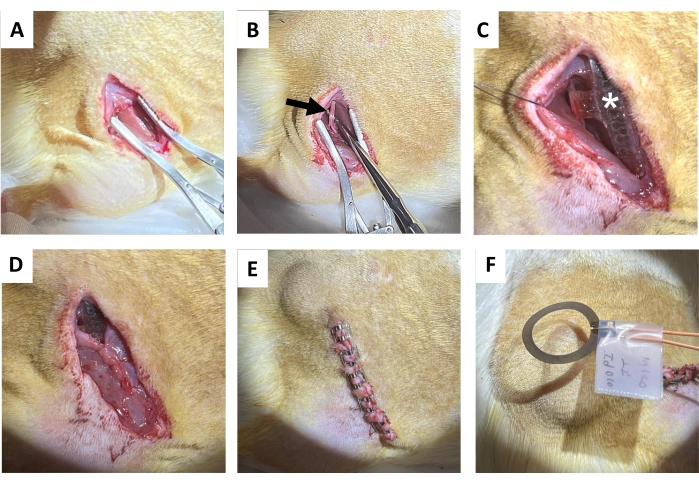
図4:坐骨神経移植術 (A)皮膚、皮下結合組織、臀筋を切開してハムストリングを露出させます。(B)孤立した坐骨神経(黒矢印)。(C)神経カフ、ワイヤー(白いアスタリスク)、およびインプラントが見える(星)を備えた移植後のデバイス。(D)縫合糸による結合組織の閉鎖。(E)創傷クリップによる切開部の閉鎖。(F)皮膚の上のコイルによって生成される無線電気刺激。 この図の拡大版をご覧になるには、ここをクリックしてください。
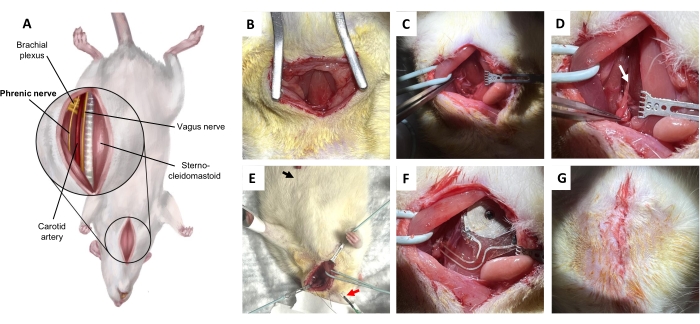
図5:横隔神経移植手術。 (A)仰臥位での頸部の腹側図。(B)胸骨舌骨筋を露出させるための皮膚および皮下結合組織を切開する。(C)舌骨筋と胸鎖乳突筋の間の潜在的な空間を解剖する。(D)横隔神経(矢印)、腕神経叢から分離。(E)横隔膜筋電図による横隔神経の確認。黒矢印、記録電極。赤い矢印、刺激装置。(f)移植。(G)深い皮膚縫合による皮膚の閉鎖。 この図の拡大版をご覧になるには、ここをクリックしてください。
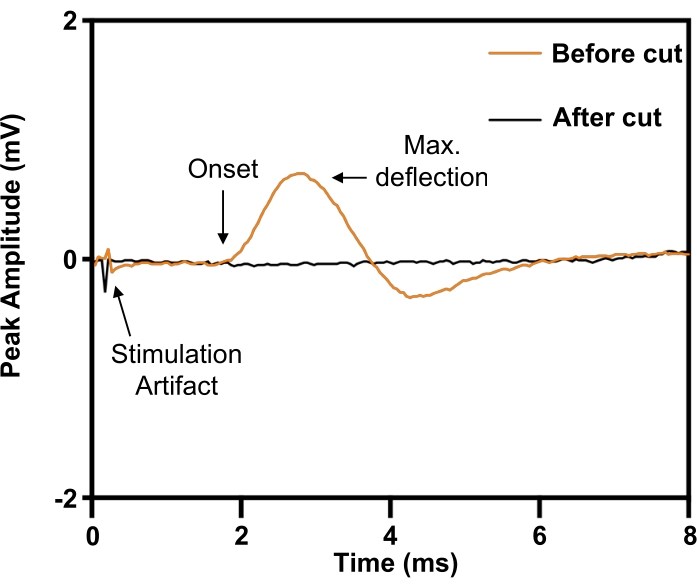
図6:横隔膜からの誘発された複合筋活動電位による横隔神経離断の完全損傷の確認。 横隔神経離断術(ORANGE)以前は、横隔神経の電気刺激により同側横隔膜に複合筋活動電位が誘発されていましたが、横隔神経離断術(BLACK)によって廃止されました。 この図の拡大版をご覧になるには、ここをクリックしてください。
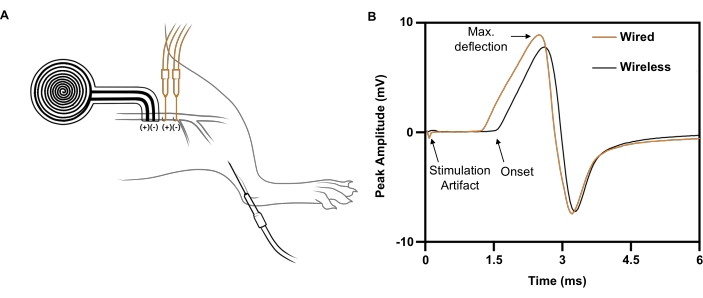
図7:無線と有線による電気刺激を比較した代表的な神経伝導研究。 (A)坐骨神経上の無線(BLACK)および有線(ORANGE)デバイスの配置の図。記録電極を前脛骨筋に配置した。(B)有線インプラント(ORANGE)とワイヤレスインプラント(BLACK)によって誘発される複合筋活動電位。 この図の拡大版をご覧になるには、ここをクリックしてください。
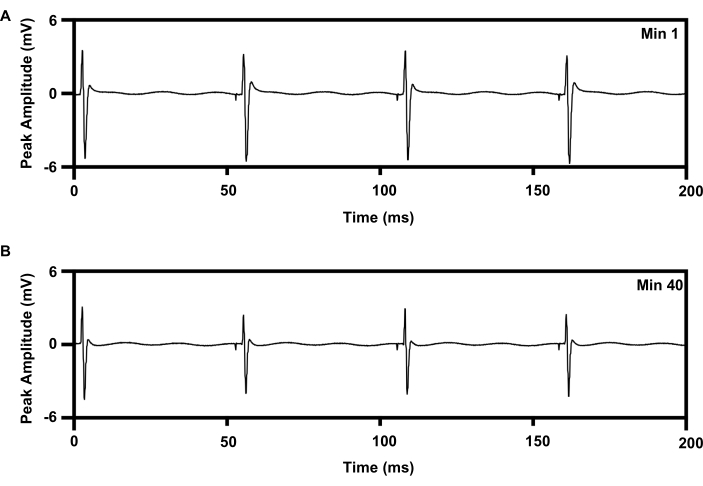
図8:インプラントから1時間、20Hzの反復電気刺激によるTA筋からの筋電図記録。 (A)e-stimの最小1でのEMGの痕跡。(B)e-stimの最小40でのEMGの痕跡。略語:EMG =筋電図;TA =前脛骨筋;e-stim = 電気刺激;min = 分。 この図の拡大版をご覧になるには、ここをクリックしてください。
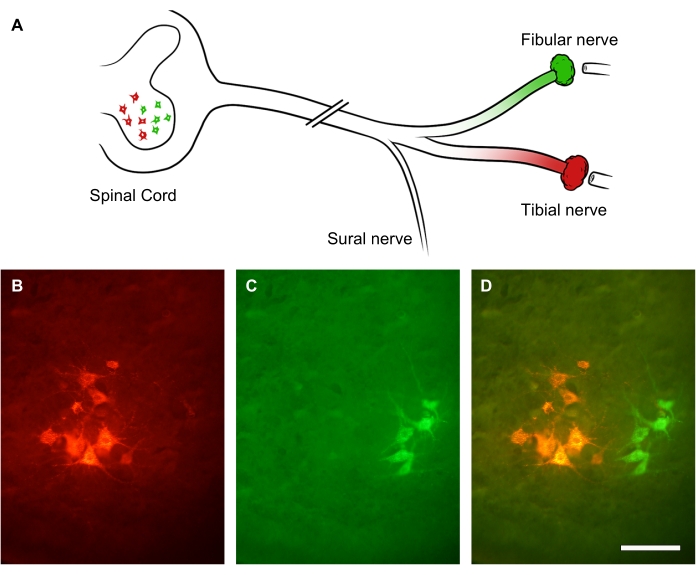
図9:坐骨神経再生の代表画像。 (A)坐骨神経損傷と蛍光逆行性標識の図解。坐骨神経軸索は挫傷によって切断された。3週間の回復後、遠位枝である腓骨神経(緑)と脛骨神経(赤)に逆行性標識が付けられました。(B-D)腰椎脊髄の画像は、前角のイプシレシオナル内のニューロン体細胞を示しています。スケールバー = 30 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
この論文では、ラットの坐骨神経および横隔神経モデルにおける、ワイヤレスでバッテリー不要の完全埋め込み可能な末梢神経インターフェースの外科的移植と操作の手順について説明します。この新しいクラスの生物医学インプラントを使用して、前臨床および臨床試験で軸索再生を促進することが示されている治療用電気刺激パラダイムを提供する方法を示します(レビューについては、22を参照)。このプロトコルは複雑ではなく、マウス21などの小動物モデル、ならびに光電子工学およびマイクロ流体末梢神経インターフェースを含む機能性を有する他のワイヤレス、バッテリフリー、および完全埋め込み型デバイス18、23、24、25、26、27、28、29、30に外挿することができる.また、最も一般的な実験モデルであるげっ歯類の坐骨神経を用いたアプローチも実証されています31。
このアプローチの汎用性は、末梢神経損傷のモデルとしてめったに採用されない横隔神経とのインターフェースに適応した場合に示されています32、おそらくそれは非常に認識されていない臨床的問題33,34,35であるためです。横隔神経損傷の診断とリハビリテーションは、COVID-19パンデミック36,37,38の間に重要な問題になっています。横隔軸索の再生と横隔膜麻痺からの回復が、この短時間の低周波電気刺激パラダイムによって増強できるかどうかは、現在のところ不明です。ただし、横隔膜筋ペーシングのための横隔神経電気刺激は、高頸髄損傷による四肢麻痺患者の呼吸不全の確立されたオプションです39,40,41,42,43。重篤な病気44の後の人工呼吸器の離脱など、他の適応症が調査されています。
植込みシステムの良好な動作を確保するために、いくつかの重要なステップを強調する必要があります。まず、デバイスの薄い電子部品を取り扱う際には、リードの脱絶縁、ねじれ、破損を防ぐために、力を入れすぎないようにすることが重要です。次に、上にある表皮上の無線周波数パワーハーベスタコイルの位置を正確にマークすることが重要です。第3に、グースネッククランプを備えた植込みデバイスのパワーハーベスタコイル上の外部無線周波数電源の送信コイルを注意深く位置合わせすると、安定した動作が可能になります。最後に、筋肉のけいれんの目視観察に加えて電気刺激を確認するために、定期的な神経生理学的モニタリングが推奨されます。頸部横隔神経のより複雑な解剖学的構造の場合、電気生理学的確認は、正しい神経が分離されていることを示すのに役立ちます(図6)。
本稿18,19,21で示したワイヤレスで電池不要の電気刺激装置以外にも、多くの機器が同じ手順を共有している可能性がある。例えば、交感神経系および副交感神経系30,45,46からの信号を慢性的に記録するために舌咽神経および迷走神経に埋め込むように設計された電極は、横隔神経と同様の手術領域を共有しているため、このプロトコルはそれらの移植に適合させることができる。ReStoreなどの末梢神経用のワイヤレス長期生体適合性刺激装置は、所定の位置に留まり、必要に応じて神経を刺激するための優れたツールです25,47,48,49,50。関連するマルチチャンネルワイヤレスレコーディングインプラントも報告されています51。全体として、これらの外科的および電気的刺激プロトコルは、電気刺激または記録に関連するすべてのワイヤレス末梢神経インターフェースの標準として適応できると考えています。
開示事項
著者に利益相反はありません。
謝辞
この作業では、SHyNE Resource (NSF ECCS-1542205)、IIN、およびノースウェスタン大学の MRSEC プログラム (NSF DMR-1720139) の支援を受けているノースウェスタン大学 NUANCE センターの NUFAB 施設を使用しました。この研究は、ノースウェスタン大学材料研究センターの米国国立科学財団のMRSECプログラム(DMR-1720139)が支援するMatCIファシリティを利用しました。C.K.Fは、米国国立衛生研究所(NIH)のユーニス・ケネディ・シュライバー小児保健・人間発達研究所(助成金番号R03HD101090)および米国神経筋財団(開発助成金)の支援に感謝しています。Y.H.はNSFからの支援に謝辞を述べる(grant no.CMMI1635443)。この研究は、ノースウェスタン大学のQuerrey Simpson Institute for Bioelectronicsの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
参考文献
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7(2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, Pt 6 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990(2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724(2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397(2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349(2018).
- Repair Brushart, M. Nerve Repair. , Oxford University Press. (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723(2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066(2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698(2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115(2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved