Method Article
Implantación y control de sistemas inalámbricos sin batería para la interfaz de nervios periféricos
En este artículo
Resumen
Se trata de un protocolo para la implantación quirúrgica y el funcionamiento de una interfaz alimentada de forma inalámbrica para los nervios periféricos. Demostramos la utilidad de este enfoque con ejemplos de estimuladores nerviosos colocados en el nervio ciático o frénico de rata.
Resumen
Las interfaces nerviosas periféricas se utilizan con frecuencia en neurociencia experimental y medicina regenerativa para una amplia variedad de aplicaciones. Dichas interfaces pueden ser sensores, actuadores o ambos. Los métodos tradicionales de interfaz de nervios periféricos deben conectarse a un sistema externo o depender de la energía de la batería que limita el marco de tiempo para la operación. Con los recientes desarrollos de interfaces de nervios periféricos inalámbricas, sin batería y totalmente implantables, una nueva clase de dispositivos puede ofrecer capacidades que igualan o superan las de sus precursores cableados o alimentados por baterías. Este artículo describe métodos para (i) implantar quirúrgicamente y (ii) alimentar y controlar de forma inalámbrica este sistema en ratas adultas. Los modelos de nervio ciático y frénico fueron seleccionados como ejemplos para resaltar la versatilidad de este enfoque. El artículo muestra cómo la interfaz nerviosa periférica puede evocar potenciales de acción muscular compuestos (CMAP), administrar un protocolo de estimulación eléctrica terapéutica e incorporar un conducto para la reparación de lesiones nerviosas periféricas. Estos dispositivos ofrecen opciones de tratamiento ampliadas para la estimulación terapéutica de dosis única o dosis repetida y pueden adaptarse a una variedad de ubicaciones nerviosas.
Introducción
Las lesiones traumáticas de los nervios periféricos (PNI, por sus siglas en inglés) ocurren en los EE. UU. con una incidencia anual de aproximadamente 200,000 por año1. La mayoría de los pacientes que sufren PNI quedan con deficiencias funcionales permanentes. En el peor de los casos, esto puede provocar parálisis muscular y desencadenar un dolor neuropático refractario al tratamiento tan intenso que los pacientes están dispuestos a someterse a una amputación de extremidadescomo tratamiento. El mayor obstáculo para mejorar los resultados de la PNI es que la regeneración de los axones es demasiado lenta en relación con las distancias a las que deben volver a crecer. Por ejemplo, un axón humano adulto crece a 1 mm/día, pero puede tener que regenerarse a distancias >1000 mm en el caso de una lesión en una extremidad proximal.
En la práctica clínica actual, ~50% de los PNI requieren reparación quirúrgica3. Para una regeneración nerviosa exitosa, los axones deben (i) crecer a través del sitio de la lesión (es decir, cruzar la brecha) y luego (ii) regenerarse por la vía nerviosa para alcanzar un objetivo del órgano terminal (es decir, el recrecimiento distal) (Figura 1). No hay medicamentos aprobados por la FDA que hayan demostrado acelerar la regeneración nerviosa. El statu quo del manejo clínico de la PNI solo ha cambiado gradualmente en las últimas décadas y se limita a refinamientos técnicos de los métodos quirúrgicos, como las transferencias de nervios motores distales para reducir la distancia que deben recorrer los axones regeneradores4, o conductos nerviosos sintéticos "listos para usar" para los casos en que el nervio proximal se retrae y no se puede volver a suturar directamente5. Sin embargo, se han realizado cuatro ensayos clínicos aleatorizados sobre la estimulación eléctrica terapéutica aplicada a los nervios en el postoperatorio, que fueron estudios unicéntricos dirigidos por el Dr. K. Ming Chan de la Universidad de Alberta que muestran una mejora significativa de la reinervación del músculo 6,7,8 o de la piel9. El trabajo fundamental para este protocolo de estimulación eléctrica se realizó en roedores10,11, donde se ha demostrado que la estimulación eléctrica funciona específicamente potenciando el cruce de brechas (Figura 1) pero no el rebrote distal 12,13,14,15.
La colocación quirúrgica de electrodos de alambre transcutáneo utilizados en los cuatro ensayos clínicos aleatorizados de estimulación eléctrica fue necesaria porque sus efectos dependen de la entrega de corriente suficiente para despolarizar el cuerpo de la célula neuronal a 20 Hz de forma continua durante 1 h11. En la práctica clínica, este protocolo de estimulación eléctrica no es tolerable para la mayoría de los pacientes a las intensidades requeridas a través de electrodos estimulantes de superficie en la piel debido al dolor. Existen riesgos no triviales asociados con la colocación de electrodos transcutáneos en el postoperatorio, como la infección profunda de la herida o el desplazamiento accidental de los cables de los nervios durante el transporte del paciente desde el quirófano. Además, el alto costo del tiempo en el quirófano en sí mismo es un desincentivo para intentarlo en ese entorno en lugar de durante la recuperación postoperatoria aguda. Está surgiendo una nueva clase de interfaces de nervios periféricos inalámbricas, sin batería y totalmente implantables para abordar esta deficiencia de las interfaces de nervios periféricos existentes.
Esta nueva clase de sistemas electrónicos implantables inalámbricos está preparada para aumentar la facilidad y flexibilidad de la dosificación de la estimulación eléctrica y romper las barreras que impiden su implementación clínica más amplia. Este artículo describe métodos para (i) implantar quirúrgicamente y (ii) alimentar y controlar de forma inalámbrica este sistema en modelos adultos de nervio ciático y frénico de rata. Muestra cómo la interfaz nerviosa periférica puede evocar CMAP, administrar un protocolo de estimulación eléctrica terapéutica e incluso actuar como un conducto para la reparación de los nervios periféricos. Los protocolos aquí se pueden adaptar para otras variantes de esta tecnología que pueden administrar pulsos de luz para la neuromodulación mediada por optogenética16, la liberación controlada de fármacos17 o episodios repetidos de estimulación eléctrica a lo largo del tiempo18,19.
Protocolo
Todos los procedimientos descritos en este protocolo se llevan a cabo de acuerdo con la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad Northwestern. Este protocolo sigue las pautas de cuidado animal del Centro de Medicina Comparativa de la Universidad Northwestern y la IACUC. Es necesario consultar con la IACUC a la hora de adaptar los protocolos.
1. Fabricación de estimuladores electrónicos inalámbricos (Figura 2)
- Utilice cobre/poliimida/cobre (cobre superior e inferior de 18 μm de espesor, poliimida de 75 μm de espesor) como sustrato para la bobina del recolector de energía de radiofrecuencia (es decir, la antena del receptor inalámbrico).
- Utilice la ablación directa con láser para modelar los orificios de los electrodos en las capas de cobre superior e inferior y dar forma al dispositivo. Conecte eléctricamente las capas superior e inferior con pasta de plata a través de los orificios.
- Fije los componentes electrónicos con embalajes comerciales, como diodos y condensadores, mediante soldadura.
- Utilice el poliuretano covalente dinámico biorreabsorbible (b-DCPU; 200 μm de espesor) encapsulado (Mo; 15 μm de espesor; estructura serpentina) como electrodos de extensión estirables19.
- Formar el electrodo del manguito para la interfaz entre el dispositivo y el nervio utilizando una película de poli(ácido láctico-co-glicólico) (PLGA) (300 μm de espesor).
- Después de conectar la antena receptora inalámbrica y el electrodo de extensión extensible, encapsule la antena receptora inalámbrica y la conexión con epoxi o polidimetisiloxano (PDMS) impermeable comercializado. Consulte la Figura 2 (derecha) para ver el dispositivo completamente ensamblado.
- Confirme el funcionamiento inalámbrico del dispositivo, utilizando un generador de forma de onda para generar impulsos eléctricos monofásicos a través de la bobina primaria (es decir, la bobina de transmisión).
NOTA: Al examinar el reclutamiento de axones periféricos y la inducción de la regeneración axonal por estímulos monofásicos y bifásicos, estudios previos informaron de un efecto insignificante debido a las diferencias en la característica de la forma de onda20, y este grupo ha sido capaz de lograr una mejora de la estimulación eléctrica terapéutica con los mismos parámetros de corriente monofásica en ratones21 y ratas18. Además, estudios anteriores examinaron la biocompatibilidad in vivo e in vitro y no encontraron ninguna evidencia de daño tisular por los efectos del calentamiento o los materiales en sí. Debido a estos hallazgos y a la duración limitada de la estimulación eléctrica terapéutica en el presente estudio, en este protocolo se utilizaron estímulos monofásicos en lugar de bifásicos. - Mida el voltaje de salida de corriente continua resultante con un osciloscopio conectado al electrodo del manguito.
2. Preparación del dispositivo para la implantación
- Coloque los dispositivos de implante en una placa de Petri estéril y séllela con parafilm.
- Irradie los dispositivos con luz ultravioleta durante 30 minutos por lado.
3. Procedimiento quirúrgico de implantación del nervio ciático derecho de rata de una interfaz nerviosa periférica inalámbrica y sin batería para estimulación eléctrica (Figura 3)
NOTA: Mantenga las condiciones estériles. Realizar cirugías dentro del área quirúrgica designada de una sala de procedimientos con animales. El cirujano se pondrá una mascarilla, un abrigo, una gorra y guantes estériles durante la cirugía. Si se realiza más de una cirugía, cambie los guantes estériles entre animales y use instrumentos quirúrgicos limpios y estériles para cada cirugía. Esterilice las herramientas entre cirugías mediante esterilización por calor (esterilizador en autoclave o con perlas de vidrio). Utilice ratas Sprague-Dawley adultas que pesen entre 200 y 250 g.
- Inducir la anestesia con gas isoflurano (3% de inducción, 1-3% de mantenimiento) en oxígeno (2 L/min), con administración subcutánea de meloxicam (1-2 mg/kg). Cubra los ojos de las ratas con un ungüento oftálmico designado para evitar que se sequen.
- Coloque a las ratas en posición prona sobre mesas quirúrgicas desinfectadas para procedimientos posteriores. Durante el resto de la duración de la cirugía, evalúe la frecuencia respiratoria (debe ser de ~2/s), el color del tejido y la profundidad de la anestesia no menos de cada 15 minutos, y mantenga los niveles de isoflurano en consecuencia. Confirme la profundidad adecuada de la anestesia comprobando el reflejo pedal (falta de respuesta a un pellizco firme en el dedo del pie). Controle las membranas mucosas, que deben permanecer rosadas y húmedas.
- Afeita el área quirúrgica, incluyendo la pierna derecha y la mitad inferior de la espalda. Frote el área quirúrgica afeitada con una almohadilla betadine, seguida de un hisopo de etanol médico al 70%, y repita este proceso de exfoliación tres veces para desinfectar la piel.
- Realice una incisión de 1,5 a 2 cm en la piel paralela al hueso del fémur derecho con unas tijeras de tejido, seguida de una separación roma del tejido conectivo subcutáneo en la espalda (directamente medial a la incisión) para despejar una bolsa subcutánea para la bobina receptora (Figura 4A). Realizar una incisión posterior (1,2-1,5 cm) en el músculo glúteo derecho paralelo a la incisión cutánea.
- Aísle suavemente el nervio ciático con sondas de disección metálicas con extremos romos (Figura 4B).
NOTA: El nervio ciático se encuentra en lo profundo del bíceps femoral y corre paralelo al fémur. Se sugiere un alcance de disección. - Implantar el dispositivo inalámbrico y sin pilas sobre el nervio ciático (Figura 4C) envolviendo el manguito alrededor del nervio ciático derecho aislado, sin poner el nervio bajo tensión ni distorsionar su trayectoria 18,19,20. Marque en la piel donde se coloca la bobina receptora para una mayor estimulación eléctrica.
- Suturar la incisión del músculo glúteo con suturas reabsorbibles (Figura 4D).
NOTA: La mitad superior de la bobina receptora se encuentra por encima del músculo glúteo y la interfaz del manguito por debajo. - Cierre la incisión en la piel con pinzas para heridas (o sutura enterrada; Figura 4E). Haz coincidir los bordes de la piel.
- Administrar 1 h de estimulación eléctrica postquirúrgica continua de 20 Hz con un ancho de pulso de 200 μs bajo anestesia (Figura 4F). Regrese a los animales a sus jaulas domésticas después de que se hayan recuperado completamente de la anestesia.
NOTA: El protocolo detallado se describe a continuación. La bobina receptora se muestra por encima de la piel en la Figura 4F. - Tratamiento postquirúrgico
- Coloque a la rata en una jaula de recuperación sin ropa de cama, forrada con toallas de papel, con la mitad de la jaula colocada sobre una fuente de calor adecuada con temperatura regulada (almohadilla térmica aprobada).
- Vigila a la rata cuidadosamente hasta que sea ambulatoria. Una vez ambulatoria y evaluada como estable, devuelva la rata a la jaula de la casa y observe la reintegración social.
- Después de la recuperación aguda, monitoree a las ratas para detectar la infección en el sitio de la incisión y los síntomas de dolor neurogénico, incluidos, entre otros, protegerse, retorcerse, rascarse y automutilarse. Monitoree las ratas diariamente durante el período de recuperación posquirúrgica de 5 días, y al menos una vez cada tres días después de eso si las ratas no se sacrifican en el día 5.
- Administrar meloxicam (1-2 mg/kg) por vía subcutánea una vez al día durante dos o tres días después de la cirugía, dependiendo del nivel de dolor/malestar mostrado por el animal. Si se sospecha un dolor persistente, se debe continuar con el meloxicam más allá de este período postoperatorio y, si resulta refractario, sacrificar a la rata de forma temprana en consulta con el equipo veterinario.
- Retire las suturas de piel o los clips de la herida 10-12 días después de la cirugía.
4. Procedimiento quirúrgico de implantación del nervio frénico izquierdo de rata de estimuladores inalámbricos (Figura 5A)
NOTA: Mantener condiciones estériles, como en la sección 3. Utilice ratas Sprague-Dawley adultas que pesen entre 200 y 250 g. Esterilice todos los instrumentos quirúrgicos antes de usarlos.
- Inducir la anestesia con gas isoflurano (3% de inducción, 1-3% de mantenimiento) en oxígeno (2 L/min), con administración subcutánea de meloxicam (1-2 mg/kg). Cubra los ojos de la rata con un ungüento oftálmico designado para evitar la desecación.
- Coloque a las ratas en posición supina sobre mesas quirúrgicas desinfectadas para procedimientos posteriores. Durante el resto de la duración quirúrgica, evalúe la frecuencia respiratoria, el color del tejido y la profundidad de la anestesia no menos de cada 15 minutos, y mantenga los niveles de isoflurano en consecuencia. Confirme la profundidad adecuada de la anestesia comprobando el reflejo pedal (falta de respuesta a un pellizco firme en el dedo del pie). Controle las membranas mucosas, que deben permanecer rosadas y húmedas.
- Afeitar el área quirúrgica en la cara ventral del cuello. Frote el área quirúrgica afeitada con una almohadilla betadine, seguida de un hisopo de etanol médico al 70%, y repita este proceso de exfoliación tres veces para desinfectar la piel.
- Administrar bupivacaína (2 mg/kg, diluida en solución salina que no exceda el volumen total de 0,5 ml) por vía subcutánea en la línea media del cuello, dirigiéndose a la capa más superficial. Realizar una incisión de 3 cm en la línea media a través de la piel y la fascia cervical superficial para exponer los músculos esternohioideo y esternocleidomastoideo (Figura 5B).
NOTA: Se sugiere un endoscopio de disección. - Elevar el esternocleidomastoideo mediante una disección roma suave con una sonda y retraerlo lateralmente con un asa vascular (Figura 5C). Libere y retraiga suavemente el omohioideo. A continuación, libere suavemente y retraiga medialmente el nervio vago y el haz carotídeo debajo del músculo omohioideo.
NOTA: La principal discriminación aquí es entre el nervio vago y el nervio frénico. Corte el omohyoid si es necesario exponer las estructuras inferiores. - Aísle el nervio frénico (Figura 5D).
NOTA: El nervio frénico corre a lo largo de la superficie del músculo escaleno anterior, corriendo como un nervio longitudinal notablemente pequeño que cruza perpendicularmente al plexo braquial. A diferencia del nervio ciático, la anatomía alrededor del nervio frénico en el cuello es más compleja. Realice la confirmación electrofisiológica (paso 4.7) antes de la implantación para obtener los mejores resultados. - Colocar el electrodo de registro por vía subcutánea, solo caudalmente a la caja torácica, ipsilateral al nervio frénico aislado (Figura 5E). Coloque los estimuladores en el nervio frénico y confirme a través de la señalización síncrona (Figura 6).
NOTA: Es típico evocar una respuesta máxima con una intensidad de estímulo de ~3-6 mA y una duración de estímulo de 0,02 ms. - Verificar la transección completa del nervio frénico mostrando la abolición completa de la respuesta evocada cuando se aplica un estímulo eléctrico en el extremo del nervio proximal en relación con el sitio de la transección (Figura 6).
- Implante un dispositivo inalámbrico sin batería en el nervio frénico (Figura 5F) colocando la bobina receptora del dispositivo implantable en el esternohioideo, profundo en relación con los músculos esternocleidomastoideos bilaterales, con el manguito alrededor del nervio frénico y los electrodos de contacto colocados perpendicularmente al nervio.
- Cierre la fascia cervical superficial con suturas reabsorbibles simples (Figura 5G). Cerrar la piel con suturas reabsorbibles invertidas interrumpidas en la dermis profunda. Regrese a los animales a sus jaulas domésticas solo después de que se hayan recuperado completamente de la anestesia.
- Para el tratamiento posquirúrgico, siga el paso 3.10.
5. Entrega inalámbrica de estimulación eléctrica terapéutica
- Aplicar estimulación eléctrica durante 1 h a las ratas bajo anestesia general. Para la estimulación inalámbrica, coloque un generador de forma de onda/función (voltaje: 1-15 Vpp) y un amplificador opcional sobre el animal para proporcionar energía eléctrica a una bobina inductiva externa (es decir, bobina de transmisión) (bobina en espiral bidimensional con 5 vueltas; diámetro: 2 cm) para garantizar un buen acoplamiento inductivo con la bobina receptora implantada. Suministre pulsos monofásicos de 200 μs a 20 Hz durante 1 h de duración.
- Para verificar y cuantificar la administración de estimulación eléctrica, registre los CMAP del músculo tibial anterior, ajustando el voltaje de estimulación para administrar la activación supramáxima del nervio ciático. Utilice electrodos de aguja concéntricos para todas las grabaciones.
NOTA: Si el voltaje máximo generado por la función es insuficiente para evocar una respuesta máxima, utilice un amplificador.
6. Eutanasia
- Método primario
- Coloque la jaula debajo de una cámara de suministro deCO2 , ajustada a una tasa de 8-12 LPM (o un caudal apropiado según el tamaño de la cámara). Vigile a las ratas para ver si están inconscientes y luego durante al menos 1 minuto de cese de la respiración.
- Método secundario
- Realizar luxación cervical o toracotomía bilateral.
Resultados
En el modelo de lesión del nervio ciático, el implante se coloca alrededor del nervio ciático derecho antes de la reparación de extremo a extremo de la rama del nervio tibial (Figura 3, Figura 4A y Figura 7A). Se coloca un electrodo de aguja concéntrica de 30 G en el músculo tibial anterior derecho para definir los parámetros de estímulo necesarios para la estimulación eléctrica de máxima intensidad. Estos experimentos incluyen elevar la intensidad de la estimulación hasta que la magnitud de la respuesta se estabilice en el máximo. Como el tibial anterior está inervado por la rama fibular del nervio ciático, se salva en la lesión de la transección del nervio tibial. Por lo tanto, el registro del tibial anterior permite la monitorización continua del tratamiento de estimulación eléctrica.
Para un pulso de estímulo único administrado por un electrodo de alambre al nervio ciático derecho (5 mA, 0,02 ms), se obtiene una respuesta CMAP máxima con una amplitud máxima de pico negativa de 5,4 mV registrada en el tibial anterior ipsilateral (Figura 7B; traza negra). Para un pulso de estímulo comparable administrado por el implante inalámbrico y sin batería, se obtiene una respuesta CMAP comparable con una amplitud máxima negativa de 4,6 mV (Figura 7B; traza naranja). Esto es consistente con un informe reciente de que la estimulación nerviosa inalámbrica logra en promedio el 88% de la CMAP a partir de la estimulación nerviosa basada en alambre21, muy por encima del umbral requerido para los efectos terapéuticos en estudios clínicos 6,7,8,9. En el ejemplo mostrado, la mayor latencia del estimulador inalámbrico frente al estimulador con cable se debió a su mayor distancia del músculo registrado.
En el modelo del nervio frénico, el implante se coloca alrededor del nervio frénico derecho antes de la transección (Figura 5). Para definir los parámetros de estímulo necesarios para la estimulación eléctrica de máxima intensidad, se coloca un electrodo de aguja concéntrico de 30 G por vía subcutánea en el margen costal anterior derecho (ipsilateral) para registrar desde el hemidiafragma derecho. Los experimentos consisten en elevar el voltaje de estimulación hasta que la magnitud de la respuesta se estabilice en su máximo. Dado que el nervio frénico puede ser difícil de aislar de las estructuras neurovasculares circundantes, su identidad puede confirmarse evocando una respuesta de contracción (Figura 6; trazo naranja). La especificidad de la estimulación puede verificarse aún más mediante la transección del nervio frénico distal al manguito del electrodo nervioso con la consiguiente abolición de la respuesta de contracción (Figura 6; traza negra).
Se puede administrar una terapia de estimulación eléctrica repetitiva de baja frecuencia al nervio ciático durante 1 h utilizando un protocolo establecido que mejora la regeneración axonal (6,7,8,9,10,11; Figura 8). La interfaz del manguito del implante inalámbrico se colocó en el nervio ciático derecho, y el electrodo de aguja concéntrica de 30 G se colocó en el músculo tibial anterior derecho para monitorizar el tratamiento. La figura 8A muestra cuatro picos secuenciales en la electromiografía registrada al comienzo (0 min) de la estimulación eléctrica de 1 h 20 Hz. La Figura 8B muestra otros cuatro picos registrados a los 40 min de la estimulación eléctrica de 1 h con una ligera disminución en la amplitud máxima, lo que es consistente con el patrón de fatiga observado con la terapia de estimulación eléctrica basada en alambre15,21.
El grado de regeneración de los nervios periféricos se puede evaluar utilizando trazadores retrógrados aplicados distalmente al sitio de la lesión nerviosa. Debido a que los axones periféricos brotan múltiples brotes colaterales, el rastreo retrógrado y los recuentos del soma de la neurona motora en la médula espinal permiten una evaluación más precisa del número de neuronas en regeneración que el recuento de axones en regeneración dentro del propio nervio31. Para demostrarlo, el tronco del nervio ciático fue seccionado por una lesión por aplastamiento. Después de 3 semanas de recuperación, se administraron dos colorantes retrógrados fluorescentes diferentes en dos ramas del nervio ciático: nervio fibular (verde) y nervio tibial (rojo), respectivamente (Figura 9A). La Figura 9B-D muestra subgrupos iluminados de motoneuronas inferiores en el asta anterior de la médula espinal lumbar que forman el nervio tibial (Figura 9B) o el nervio peroné (Figura 9C). La imagen superpuesta muestra dos columnas distintas de neuronas marcadas en el asta anterior de la médula espinal, que se pueden cuantificar en términos de distribución espacial y recuento de neuronas motoras que han regenerado un axón distal al sitio de la lesión (Figura 9D).
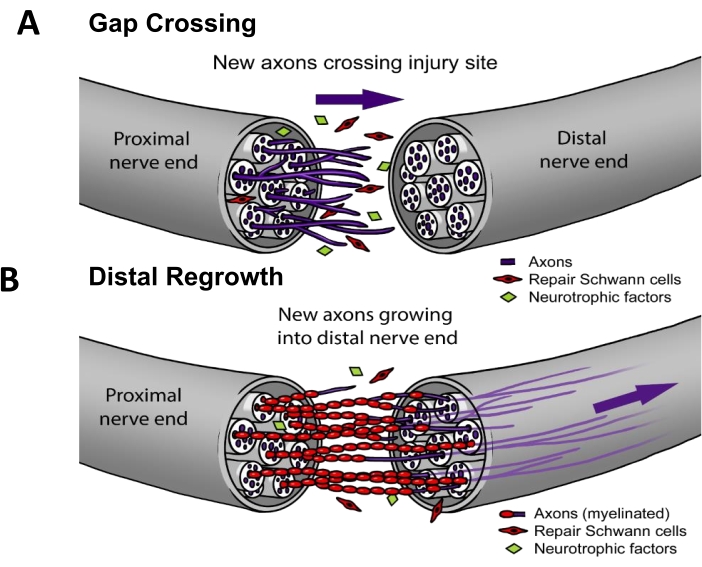
Figura 1: Modelo de regeneración nerviosa. (A) El cruce de brechas ocurre temprano después de la reparación del nervio, cuando los axones crecen desde el extremo nervioso proximal al distal después de la reparación. (B) La duración del recrecimiento distal está relacionada con la distancia al órgano terminal diana (por ejemplo, piel, músculo) y la tasa de recrecimiento de los axones. La mayoría de las terapias para mejorar la reparación nerviosa se dirigen a uno o ambos procesos. Haga clic aquí para ver una versión más grande de esta figura.
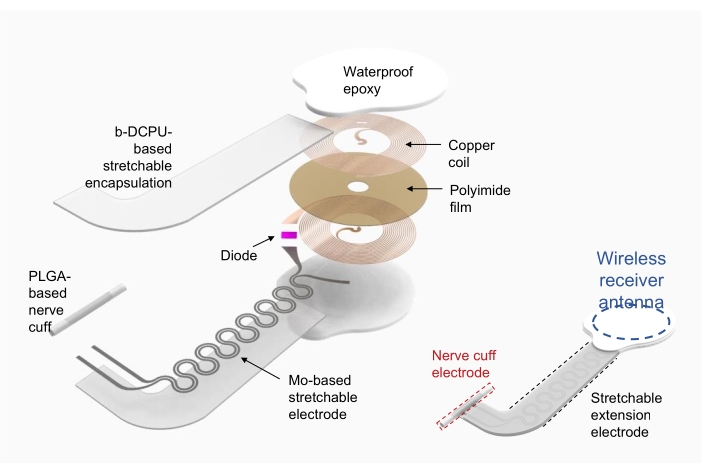
Figura 2: Ilustración de la fabricación de un estimulador electrónico inalámbrico. A la izquierda, capas detalladas de la estructura del dispositivo, incluida una bobina recolectora de energía de radiofrecuencia circular, un electrodo de extensión estirable y un manguito nervioso que envuelve un nervio de interés. A la derecha, una ilustración simplificada que muestra tres partes del dispositivo. Abreviaturas: PLGA = ácido poli(láctico-co-glicólico); b-DCPU = poliuretano covalente dinámico biorreabsorbible. Haga clic aquí para ver una versión más grande de esta figura.
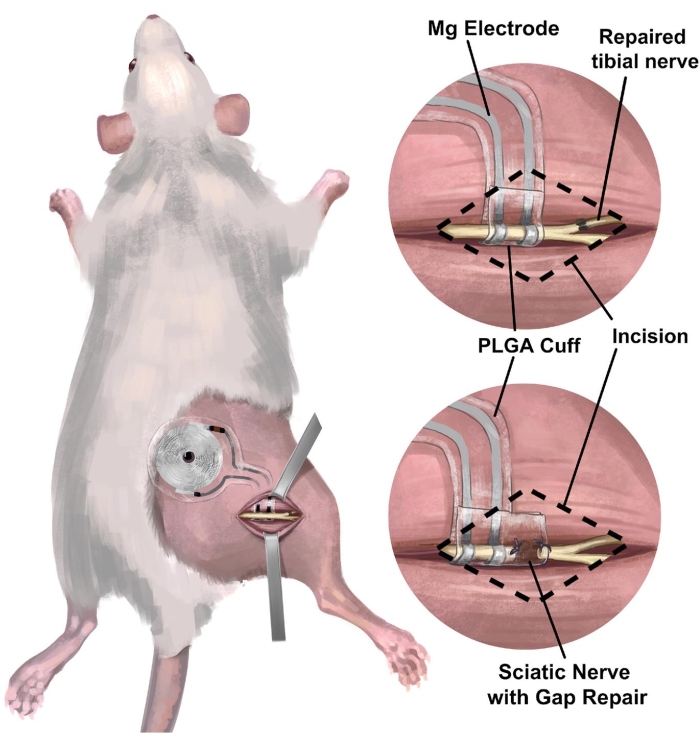
Figura 3: Implantación de una interfaz nerviosa inalámbrica y sin batería en el modelo de nervio ciático de rata. (A) La ilustración muestra un sistema totalmente implantable en el nervio ciático derecho de una rata. (B) El panel superior muestra una interfaz de electrodo colocada en el nervio ciático justo proximal a la reparación de extremo a extremo del nervio tibial derecho. El panel inferior muestra una interfaz de electrodo con un manguito nervioso extendido que cierra la reparación del espacio entre el extremo proximal y el muñón del nervio distal. Abreviatura: PLGA = ácido poli(láctico-co-glicólico). Haga clic aquí para ver una versión más grande de esta figura.
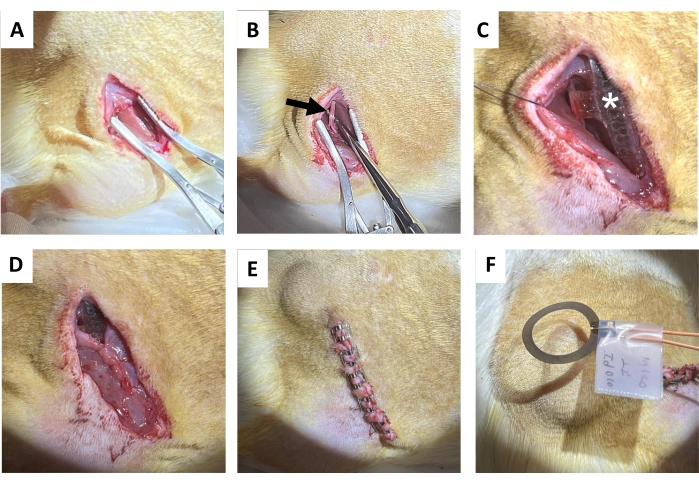
Figura 4: Procedimiento de implantación del nervio ciático. (A) Incisión en la piel, el tejido conectivo subcutáneo y el músculo glúteo para exponer el tendón de la corva. (B) Nervio ciático aislado (flecha negra). (C) Dispositivo post-implantación con manguito nervioso, alambres (asterisco blanco) e implante visible (estrella). (D) Cierre del tejido conectivo por sutura. (E) Cierre de la incisión mediante clips para heridas. (F) Estimulación eléctrica inalámbrica generada por una bobina sobre la piel. Haga clic aquí para ver una versión más grande de esta figura.
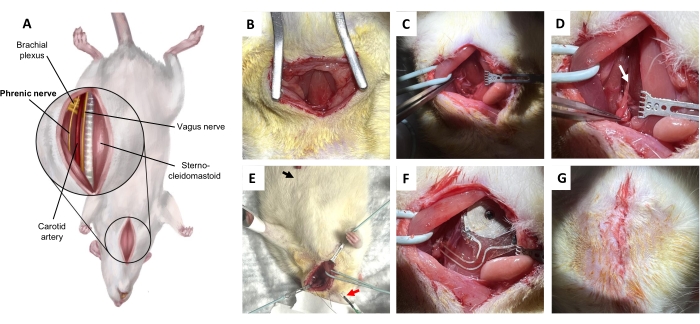
Figura 5: Procedimiento de implantación del nervio frénico. (A) Vista ventral del cuello en decúbito supino. (B) Incisión en la piel y el tejido conectivo subcutáneo para exponer el músculo esternohioideo. (C) Disección a través del espacio potencial entre el músculo omohioideo y el músculo esternocleidomastoideo. (D) Nervio frénico (flecha), aislado del plexo braquial. (E) Confirmación electromiográfica diafragmática del nervio frénico. Flecha negra, electrodo registrador. Flecha roja, estimuladores. f) Implantación. (G) Cierre de la piel con puntos dérmicos profundos. Haga clic aquí para ver una versión más grande de esta figura.
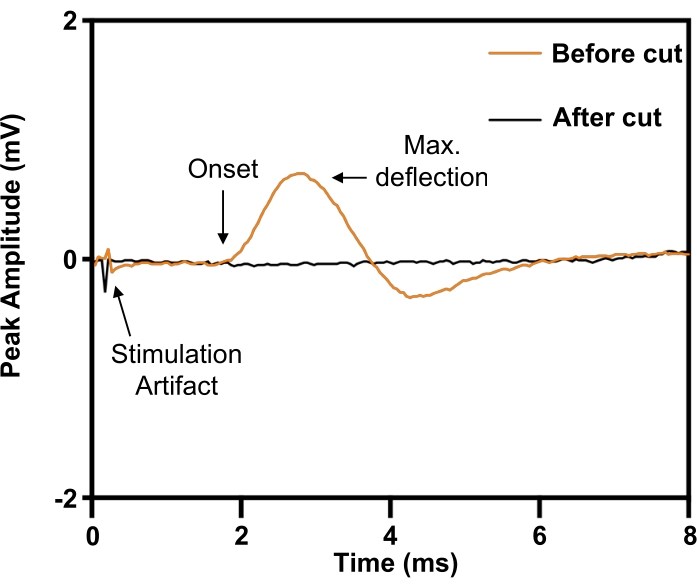
Figura 6: Confirmación de la lesión completa de la transección del nervio frénico mediante potenciales de acción muscular compuestos evocados desde el diafragma. Antes de la transección del nervio frénico (ORANGE), la estimulación eléctrica del nervio frénico evocaba potenciales de acción muscular compuestos en el diafragma ipsilateral, que fueron abolidos por la transección del nervio frénico (BLACK). Haga clic aquí para ver una versión más grande de esta figura.
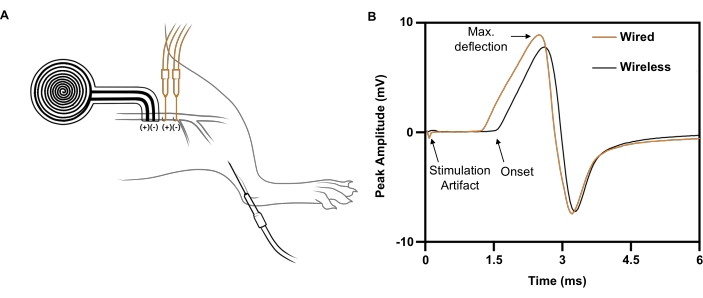
Figura 7: Estudios representativos de conducción nerviosa que comparan la estimulación eléctrica inalámbrica con la basada en cables. (A) Ilustración de la colocación de dispositivos inalámbricos (NEGRO) y cableados (NARANJA) en el nervio ciático. El electrodo de registro se colocó en el tibial anterior. (B) Potenciales de acción muscular compuestos evocados por el implante con alambre (NARANJA) frente al implante inalámbrico (NEGRO). Haga clic aquí para ver una versión más grande de esta figura.
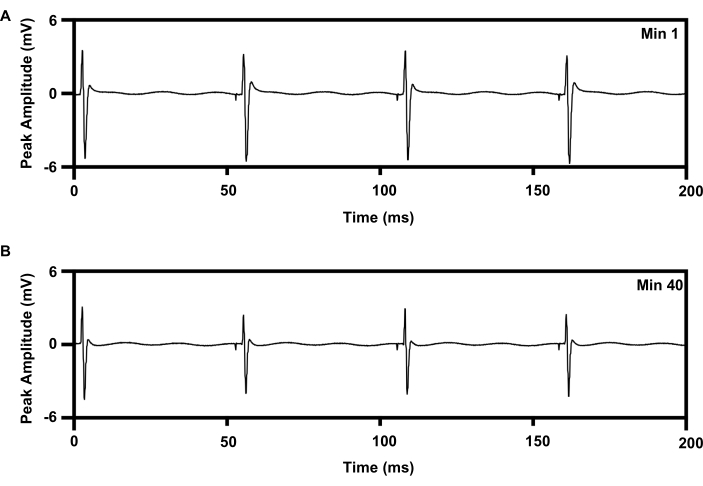
Figura 8: Registro de EMG del músculo TA con estimulación eléctrica repetitiva de 20 Hz durante 1 h desde implantes. (A) Traza de EMG en el mínimo 1 de e-stim. (B) Traza de EMG en el mínimo 40 de e-stim. Abreviaturas: EMG = electromiografía; TA = tibial anterior; e-stim = estimulación eléctrica; min = minuto. Haga clic aquí para ver una versión más grande de esta figura.
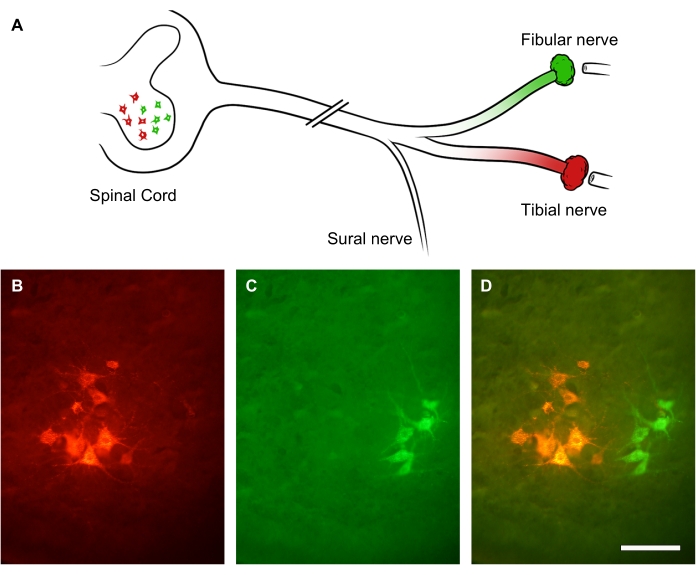
Figura 9: Imágenes representativas de la regeneración del nervio ciático. (A) Ilustración de lesión del nervio ciático y marcaje retrógrado fluorescente. Los axones del nervio ciático fueron seccionados por lesión por aplastamiento. Después de 3 semanas de recuperación, sus ramas distales, el nervio fibular (en verde) y el nervio tibial (en rojo), fueron marcadas retrógradamente. (B-D) Imágenes de una médula espinal lumbar que muestra soma neuronal dentro del asta anterior ipsilesional. Barras de escala = 30 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe los pasos en la implantación quirúrgica y el funcionamiento de una interfaz nerviosa periférica inalámbrica, sin batería y totalmente implantable en el modelo de nervio ciático y frénico de rata. Demostramos cómo se puede utilizar esta nueva clase de implantes biomédicos para administrar un paradigma de estimulación eléctrica terapéutica que ha demostrado mejorar la regeneración de axones en estudios preclínicos y clínicos (para una revisión, ver22). Este protocolo no es complicado y se puede extrapolar a modelos animales más pequeños, como ratones21, así como a otros dispositivos inalámbricos, sin batería y totalmente implantables con funcionalidad que incluye interfaces de nervios periféricos optoelectrónicos y microfluídicos 18,23,24,25,26,27,28,29,30 . También se ha demostrado el abordaje con el nervio ciático de roedores, que es el modelo experimental más común31.
La versatilidad de este abordaje se ha demostrado cuando se adapta a la interfaz con el nervio frénico, que rara vez se emplea como modelo de lesión del nervio periférico32, tal vez porque es un problema clínico muy poco reconocido 33,34,35. El diagnóstico y la rehabilitación de las lesiones del nervio frénico se han convertido en un tema importante durante la pandemia de COVID-19 36,37,38. Actualmente se desconoce si la regeneración de los axones frénicos y la recuperación de la parálisis del diafragma pueden aumentarse con este breve paradigma de estimulación eléctrica de baja frecuencia. Sin embargo, la estimulación eléctrica del nervio frénico para la estimulación del músculo diafragma es una opción establecida para la insuficiencia respiratoria en pacientes con tetraplejia por lesión medular cervical alta 39,40,41,42,43. Se están explorando otras indicaciones, como el desconexión del ventilador después de una enfermedad crítica44.
Se deben enfatizar varios pasos críticos para garantizar el buen funcionamiento del sistema implantado. En primer lugar, es importante evitar aplicar demasiada fuerza sobre los componentes electrónicos delgados de los dispositivos al manipularlos para evitar que el plomo se desaísle, se retuerza o se rompa. A continuación, es importante marcar con precisión la ubicación de la bobina del recolector de energía de radiofrecuencia en la piel suprayacente. En tercer lugar, la alineación cuidadosa de la bobina de transmisión de la fuente de alimentación de radiofrecuencia externa sobre la bobina de recolección de energía del dispositivo implantado con una abrazadera de cuello de cisne permite un funcionamiento estable. Por último, para confirmar la estimulación eléctrica además de la observación visual de los espasmos musculares, se recomienda una monitorización neurofisiológica periódica. En el caso de la anatomía más compleja del nervio frénico en el cuello, la confirmación electrofisiológica ayuda a demostrar que se ha aislado el nervio correcto (Figura 6).
Además de los estimuladores eléctricos inalámbricos y sin batería que se muestran en este documento 18,19,21, muchos otros dispositivos comparten potencialmente los mismos procedimientos. Por ejemplo, debido a que los electrodos diseñados para implantarse en los nervios glosofaríngeo y vago para registrar crónicamente las señales de los sistemas nerviosos simpático y parasimpático 30,45,46 comparten un área quirúrgica similar con el nervio frénico, este protocolo puede adaptarse para su implantación. Los estimuladores biocompatibles inalámbricos a largo plazo para los nervios periféricos, como ReStore, son excelentes herramientas para permanecer en su lugar y estimular los nervios según sea necesario 25,47,48,49,50. También se han reportado implantes de grabación inalámbrica multicanal relevantes51. En general, creemos que estos protocolos de estimulación quirúrgica y eléctrica se pueden adaptar como estándar para todas las interfaces inalámbricas de nervios periféricos relacionadas con la estimulación eléctrica o la grabación.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo utilizó las instalaciones NUFAB del Centro NUANCE de la Universidad Northwestern, que ha recibido apoyo del SHyNE Resource (NSF ECCS-1542205), el IIN y el programa MRSEC de Northwestern (NSF DMR-1720139). Este trabajo hizo uso de la instalación MatCI apoyada por el programa MRSEC de la National Science Foundation (DMR-1720139) en el Centro de Investigación de Materiales de la Universidad Northwestern. C.K.F agradece el apoyo del Instituto Eunice Kennedy Shriver de Salud Infantil y Desarrollo Humano de los NIH (subvención n.º R03HD101090) y de la Fundación Neuromuscular Americana (subvención para el desarrollo). Y.H. agradece el apoyo de NSF (subvención no. CMMI1635443). Este trabajo fue apoyado por el Instituto Querrey Simpson de Bioelectrónica de la Universidad Northwestern.
Materiales
| Name | Company | Catalog Number | Comments |
| Amplifier | Electronics & Innovation | 201L | |
| Arbitrary Waveform Generator | RIGOL | DG1032Z | 30 MHz, 2 Channel, 200 MS/s, 14bit Resolution, 8 Mpts |
| Bupivacaine | Pfizer | 655317 | Marcaine, 0.5% |
| Copper/polyimide/copper | Pyralux | AP8535R | 18 µm thick top and bottom copper, 75 µm thick polyimide |
| EMG recording device | Natus | Nicolet VikingQuest | |
| EPOXY MARINE | Loctite | ||
| Isoflurane, USP | Butler Schein Animal Health | 1040603 | ISOTHESIA |
| Meloxicam | covetrus | 5mg/ml | |
| Needle electrodes | Technomed USA Inc. | TE/B50600- 001 | |
| PDMS (Silicone Elastomer Kit) | DOW | SYLGARD™ 184 | |
| ProtoLaser U4 | LPKF | U4 | |
| Puralube Vet Ointment Sterile Ocular Lubricant | Puralube | 83592 | |
| Waveform generator | Agilent Technologies | Agilent 33250A |
Referencias
- Scholz, T., et al. Peripheral nerve injuries: an international survey of current treatments and future perspectives. Journal of Reconstructive Microsurgery. 25 (6), 339-344 (2009).
- Ayyaswamy, B., et al. Quality of life after amputation in patients with advanced complex regional pain syndrome: a systematic review. EFORT Open Reviews. 4 (9), 533-540 (2019).
- Kim, D. H., et al. Management and outcomes in 353 surgically treated sciatic nerve lesions. Journal of Neurosurgery. 101 (1), 8-17 (2004).
- Mackinnon, S. E. Donor distal, recipient proximal and other personal perspectives on nerve transfers. Hand Clinics. 32 (2), 141-151 (2016).
- Safa, B., Buncke, G. Autograft substitutes: conduits and processed nerve allografts. Hand Clinics. 32 (2), 127-140 (2016).
- Barber, B., et al. Intraoperative Brief Electrical Stimulation of the Spinal Accessory Nerve (BEST SPIN) for prevention of shoulder dysfunction after oncologic neck dissection: a double-blinded, randomized controlled trial. Journal of Otolaryngology - Head & Neck Surgery. 47 (1), 7(2018).
- Power, H. A., et al. Postsurgical electrical stimulation enhances recovery following surgery for severe cubital tunnel syndrome: a double-blind randomized controlled trial. Neurosurgery. 86 (6), 769-777 (2020).
- Gordon, T., et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinnervation without affecting the functional measures in carpal tunnel syndrome patients. Experimental Neurology. 223 (1), 192-202 (2010).
- Wong, J. N., et al. Electrical stimulation enhances sensory recovery: a randomized controlled trial. Annals of Neurology. 77 (6), 996-1006 (2015).
- Nix, W. A., Hopf, H. C. Electrical stimulation of regenerating nerve and its effect on motor recovery. Brain Research. 272 (1), 21-25 (1983).
- Al-Majed, A. A., et al. Brief electrical stimulation promotes the speed and accuracy of motor axonal regeneration. Journal of Neuroscience. 20 (7), 2602-2608 (2000).
- Witzel, C., et al. Electrical nerve stimulation enhances perilesional branching after nerve grafting but fails to increase regeneration speed in a murine model. Journal of Reconstructive Microsurgery. 32 (6), 491-497 (2016).
- Witzel, C., Rohde, C., Brushart, T. M. Pathway sampling by regenerating peripheral axons. Journal of Comparative Neurology. 485 (3), 183-190 (2005).
- Brushart, T. M., et al. Electrical stimulation promotes motoneuron regeneration without increasing its speed or conditioning the neuron. Journal of Neuroscience. 22 (15), 6631-6638 (2002).
- Franz, C. K., Rutishauser, U., Rafuse, V. F. Intrinsic neuronal properties control selective targeting of regenerating motoneurons. Brain. 131, Pt 6 1492-1505 (2008).
- Park, S. I., et al. stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nature Biotechnology. 33 (12), 1280-1286 (2015).
- Koo, J., et al. Wirelessly controlled, bioresorbable drug delivery device with active valves that exploit electrochemically triggered crevice corrosion. Science Advances. 6 (35), (2020).
- Koo, J., et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nature Medicine. 24 (12), 1830-1836 (2018).
- Choi, Y. S., et al. Stretchable, dynamic covalent polymers for soft, long-lived bioresorbable electronic stimulators designed to facilitate neuromuscular regeneration. Nature Communications. 11 (1), 5990(2020).
- Hingne, P. M., Sluka, K. A. Differences in waveform characteristics have no effect on the antihyperalgesia produced by transcutaneous electrical nerve stimulation (TENS) in rats with joint inflammation. Journal of Pain. 8, 251-255 (2007).
- Guo, H., et al. Advanced materials in wireless, implantable electrical stimulators that offer rapid rates of bioresorption for peripheral axon regeneration. Advanced Functional Materials. 31 (29), 2102724(2021).
- Zuo, K. J., et al. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Experimental Neurology. 332, 113397(2020).
- Zhang, Y., et al. Battery-free, fully implantable optofluidic cuff system for wireless optogenetic and pharmacological neuromodulation of peripheral nerves. Science Advances. 5 (7), (2019).
- Montgomery, K. L., et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice. Nature Methods. 12 (10), 969-974 (2015).
- Seo, D., et al. Wireless recording in the peripheral nervous system with ultrasonic neural dust. Neuron. 91 (3), 529-539 (2016).
- Neely, R. M., et al. Recent advances in neural dust: towards a neural interface platform. Current Opinion in Neurobiology. 50, 64-71 (2018).
- Mickle, A. D., et al. A wireless closed-loop system for optogenetic peripheral neuromodulation. Nature. 565 (7739), 361-365 (2019).
- Khalifa, A., et al. The microbead: a 0.009 mm(3) implantable wireless neural stimulator. IEEE Transactions on Biomedical Circuits and Systems. 13 (3), 971-985 (2019).
- Jeong, J. W., et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics. Cell. 162 (3), 662-674 (2015).
- Yao, G., et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nature Communications. 9 (1), 5349(2018).
- Repair Brushart, M. Nerve Repair. , Oxford University Press. (2012).
- Laskowski, M. B., Sanes, J. R. Topographically selective reinnervation of adult mammalian skeletal muscles. Journal of Neuroscience. 8 (8), 3094-3099 (1988).
- Boon, A. J., et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 83 (14), 1264-1270 (2014).
- Farr, E., D'Andrea, D., Franz, C. K. Phrenic nerve involvement in neuralgic amyotrophy (Parsonage-Turner syndrome). Sleep Medicine Clinics. 15 (4), 539-543 (2020).
- Mandoorah, S., Mead, T. Phrenic Nerve Injury. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- Patel, Z., et al. Diaphragm and phrenic nerve ultrasound in COVID-19 patients and beyond: imaging technique, findings, and clinical applications. Journal of Ultrasound in Medicine. , (2021).
- Farr, E., et al. Short of breath for the long haul: diaphragm muscle dysfunction in survivors of severe COVID-19 as determined by neuromuscular ultrasound. medRxiv. , (2020).
- Fernandez, C. E., et al. Imaging review of peripheral nerve injuries in patients with COVID-19. Radiology. 298 (3), 117-130 (2021).
- Elefteriades, J. A., et al. Long-term follow-up of bilateral pacing of the diaphragm in quadriplegia. New England Journal of Medicine. 326 (21), 1433-1444 (1992).
- Elefteriades, J. A., et al. Long-term follow-up of pacing of the conditioned diaphragm in quadriplegia. Pacing and Clinical Electrophysiology: PACE 2002. 25 (6), 897-906 (2002).
- Glenn, W. W., et al. Ventilatory support by pacing of the conditioned diaphragm in quadriplegia. New England Journal of Medicine. 310 (18), 1150-1155 (1984).
- Garrido-Garcia, H., et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord. 36 (5), 310-314 (1998).
- Romero, F. J., et al. Long-term evaluation of phrenic nerve pacing for respiratory failure due to high cervical spinal cord injury. Spinal Cord. 50 (12), 895-898 (2012).
- Vashisht, R., Chowdhury, Y. S. Diaphragmatic Pacing. StatPearls. , StatPearls Publishing. Treasure Island, FL. (2021).
- McCallum, G. A., et al. Chronic interfacing with the autonomic nervous system using carbon nanotube (CNT) yarn electrodes. Scientific Reports. 7 (1), 11723(2017).
- Zhang, Y., et al. Climbing-inspired twining electrodes using shape memory for peripheral nerve stimulation and recording. Science Advances. 5 (4), 1066(2019).
- Sivaji, V., et al. ReStore: A wireless peripheral nerve stimulation system. Journal of Neuroscience Methods. 320, 26-36 (2019).
- Tanabe, Y., et al. High-performance wireless powering for peripheral nerve neuromodulation systems. PLoS One. 12 (10), 0186698(2017).
- MacEwan, M. R., et al. Therapeutic electrical stimulation of injured peripheral nerve tissue using implantable thin-film wireless nerve stimulators. Journal of Neurosurgery. 130 (2), 486-495 (2019).
- Lee, B., et al. An implantable peripheral nerve recording and stimulation system for experiments on freely moving animal subjects. Scientific Reports. 8 (1), 6115(2018).
- Deshmukh, A., et al. Fully implantable neural recording and stimulation interfaces: Peripheral nerve interface applications. Journal of Neuroscience Methods. 333, 108562(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados