A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج ثقب الأوعية الدموية الداخلية للنزيف تحت العنكبوتية جنبا إلى جنب مع التصوير بالرنين المغناطيسي (MRI)
* These authors contributed equally
In This Article
Summary
نقدم هنا نموذجا موحدا للفأر SAH ، الناجم عن ثقب خيوط الأوعية الدموية ، جنبا إلى جنب مع التصوير بالرنين المغناطيسي (MRI) بعد 24 ساعة من العملية لضمان موقع النزيف الصحيح واستبعاد الأمراض الأخرى ذات الصلة داخل الجمجمة.
Abstract
نموذج ثقب الخيوط داخل الأوعية الدموية لتقليد النزيف تحت العنكبوتية (SAH) هو نموذج شائع الاستخدام - ومع ذلك ، يمكن أن تسبب هذه التقنية معدل وفيات مرتفعا بالإضافة إلى حجم لا يمكن السيطرة عليه من SAH والمضاعفات الأخرى داخل الجمجمة مثل السكتة الدماغية أو النزيف داخل الجمجمة. في هذا البروتوكول ، يتم تقديم نموذج فأر SAH موحد ، مستحث عن ثقب خيوط داخل الأوعية الدموية ، جنبا إلى جنب مع التصوير بالرنين المغناطيسي (MRI) بعد 24 ساعة من العملية لضمان موقع النزيف الصحيح واستبعاد الأمراض الأخرى ذات الصلة داخل الجمجمة. باختصار ، يتم تخدير الفئران C57BL / 6J بحقن الكيتامين / الزيلازين داخل الصفاق (70 ملغ / 16 ملغ / كغ من وزن الجسم) ووضعها في وضع ضعيف. بعد شق الرقبة في خط الوسط ، يتم الكشف عن الشريان السباتي المشترك (CCA) والتشعب السباتي ، ويتم إدخال خياطة البولي بروبيلين أحادية الخيوط غير القابلة للامتصاص 5-0 بطريقة رجعية في الشريان السباتي الخارجي (ECA) والتقدم إلى الشريان السباتي المشترك. بعد ذلك ، يتم غزو الخيوط في الشريان السباتي الداخلي (ICA) ودفعها إلى الأمام لثقب الشريان الدماغي الأمامي (ACA). بعد الشفاء من الجراحة ، تخضع الفئران للتصوير بالرنين المغناطيسي 7.0 T بعد 24 ساعة. يمكن تحديد حجم النزيف وتصنيفه عن طريق التصوير بالرنين المغناطيسي بعد العملية الجراحية ، مما يتيح مجموعة SAH تجريبية قوية مع خيار إجراء المزيد من تحليلات المجموعة الفرعية بناء على كمية الدم.
Introduction
يحدث النزيف تحت العنكبوتية (SAH) بسبب تمزق تمدد الأوعية الدموية داخل الجمجمة ويشكل حالة طوارئ تهدد الحياة ، مرتبطة بأمراض ووفيات كبيرة ، وهو ما يمثل حوالي 5٪ من السكتات الدماغية 1,2. مرضى SAH الذين يعانون من صداع شديد ، وخلل وظيفي عصبي ، واضطراب تدريجي في الوعي3. يموت حوالي 30٪ من مرضى SAH خلال أول 30 يوما بعد حدث النزيف الأولي4. سريريا ، يعاني 50٪ من المرضى من إصابات الدماغ المتأخرة (DBI) بعد إصابة الدماغ المبكرة. يتميز DBI بنقص التروية الدماغية المتأخر والعجز العصبي المتأخر. أظهرت الدراسات الحالية أن الآثار التآزرية للعديد من العوامل المختلفة تؤدي إلى فقدان الوظيفة العصبية ، بما في ذلك تدمير الحاجز الدموي الدماغي ، وتقلص الشرايين الصغيرة ، وخلل الدورة الدموية الدقيقة ، وتجلط الدم 5,6.
أحد الجوانب الفريدة ل SAH هو أن الإمراض ينشأ من موقع خارج المتني ولكنه يؤدي بعد ذلك إلى شلالات ضارة داخل الحمة: يبدأ علم الأمراض بتراكم الدم في الفضاء تحت العنكبوتية ، مما يؤدي إلى العديد من التأثيرات داخل الأروقيات ، مثل الالتهاب العصبي ، موت الخلايا المبرمج العصبي والبطاني ، إزالة الاستقطاب القشري الانتشار ، وتشكيل وذمة الدماغ7 ، 8.
البحث السريري محدود بعدة عوامل ، مما يجعل النموذج الحيواني عنصرا حاسما في محاكاة التغيرات الباثومية للمرض باستمرار ودقة. تم اقتراح بروتوكولات نموذج SAH مختلفة ، على سبيل المثال ، حقن الدم الذاتي في الصهريج الضخم (ACM). أيضا ، طريقة معدلة مع حقن مزدوج من الدم الذاتي في صهريجنا ماجنا وصهريج chiasm البصري (APC) على التوالي 9,10. في حين أن حقن الدم الذاتي هو وسيلة بسيطة لمحاكاة العملية المرضية للتشنج الوعائي والتفاعلات الالتهابية بعد النزيف تحت العنكبوتية ، فإن الارتفاع التالي للضغط داخل الجمجمة (ICP) بطيء نسبيا ، ولا يتم تحفيز أي تغييرات جديرة بالملاحظة في نفاذية الحاجز الدموي الدماغي11,12. طريقة أخرى ، وضع الدم حول الشرايين ، وعادة ما تستخدم في نماذج SAH الكبيرة (على سبيل المثال ، القرود والكلاب) ، تتضمن وضع دم ذاتي مضاد للتخثر أو منتجات دم مماثلة حول الوعاء. يمكن ملاحظة تغيرات قطر الشريان باستخدام المجهر ، ليكون بمثابة مؤشر على التشنج الوعائي الدماغي بعد SAH13.
وصف باري وآخرون لأول مرة نموذج ثقب داخل الأوعية الدموية في عام 1979 حيث يتعرض الشريان القاعدي بعد إزالة الجمجمة. ثم يتم ثقب الشريان بأقطاب التنغستن الدقيقة ، باستخدام تقنية مجسمة مجهرية14. في عام 1995 ، قام بيدرسون وفيلكين بتعديل نموذج Zea-Longa لنقص التروية الدماغية وأنشأا ثقب الأوعية الدموية الداخلية ، والذي تم تحسينه باستمرار منذ15,16. تعتمد هذه الطريقة على حقيقة أن الفئران والبشر يشتركون في شبكة وعائية مماثلة داخل الجمجمة ، والمعروفة باسم دائرة ويليس.
لتقييم ما بعد الجراحة وتصنيف SAH في نموذج الماوس ، تم اقتراح نهج مختلفة. طور سوغاوارا وآخرون مقياس تصنيف تم استخدامه على نطاق واسع منذ عام 200817. تقوم هذه الطريقة بتقييم شدة SAH بناء على التغيرات المورفولوجية. ومع ذلك ، بالنسبة لهذه الطريقة ، يجب فحص مورفولوجيا أنسجة دماغ الفأر تحت الرؤية المباشرة ، وبالتالي ، يجب التضحية بالفأر للتقييم. علاوة على ذلك ، تم إنشاء عدة طرق لتحديد شدة SAH في الجسم الحي. تتراوح الأساليب من التسجيل العصبي البسيط إلى مراقبة الضغط داخل الجمجمة (ICP) إلى تقنيات التصوير الإشعاعي المختلفة. علاوة على ذلك ، تم عرض تصنيف التصوير بالرنين المغناطيسي كأداة جديدة غير جراحية لتقدير شدة SAH ، المرتبطة بالنتيجة العصبية18,19.
هنا ، يتم تقديم بروتوكول لنموذج SAH الناجم عن ثقب الأوعية الدموية ، جنبا إلى جنب مع التصوير بالرنين المغناطيسي بعد العملية الجراحية. في محاولة لإنشاء نظام لتجسيد كمية النزيف في بيئة في الجسم الحي ، قمنا أيضا بتطوير نظام لتصنيف SAH وتحديد حجم الدم الكلي بناء على التصوير بالرنين المغناطيسي عالي الدقة T2 عالي الدقة 7.0 T. يضمن هذا النهج الحث الصحيح ل SAH واستبعاد الأمراض الأخرى مثل السكتة الدماغية أو استسقاء الرأس أو النزيف داخل المخ (ICH) والمضاعفات.
Protocol
أجريت التجارب وفقا للمبادئ التوجيهية واللوائح التي وضعتها Landesamt fuer Gesundheit und Soziales (LaGeSo) ، برلين ، ألمانيا (G0063/18). في هذه الدراسة ، تم استخدام الفئران C57Bl / 6J الذكور (8-12 أسابيع) بوزن 25 ± 0.286 جم (متوسط ± s.e.m).
1. إعداد الحيوان
- الحث على التخدير عن طريق حقن الكيتامين (70 ملغم / كغ) والزيلازين (16 ملغ / كغ) داخل الصفاق. الحفاظ على درجة حرارة الجسم الطبيعية، مما يساهم في الحث السريع للتخدير العميق. اختبر التخدير الكافي باستخدام محفز الألم ، مثل قرصة إصبع القدم ، وتحقق من عدم وجود رد فعل.
- حلق شعر عنق الفأر بعناية باستخدام ماكينة حلاقة ، ونظفه بالإيثانول بنسبة 70٪ متبوعا بالبيتادين / الكلورهيكسيدين ، وتطبيق 1٪ ليدوكائين على سطح الجلد للسيطرة على الألم المحلي.
- ضع الماوس في وضع ضعيف. استخدم شريطا لاصقا لإصلاح الأطراف والذيل ، مع تمديد جلد الرقبة بلطف إلى الجانب الآخر من الجراحة. في وقت واحد ، ارفع الرقبة قليلا.
- استخدم مرهم العيون (على سبيل المثال ، 5٪ ديكسبانثينول) لمنع جفاف العينين أثناء العملية.
2. تحريض SAH
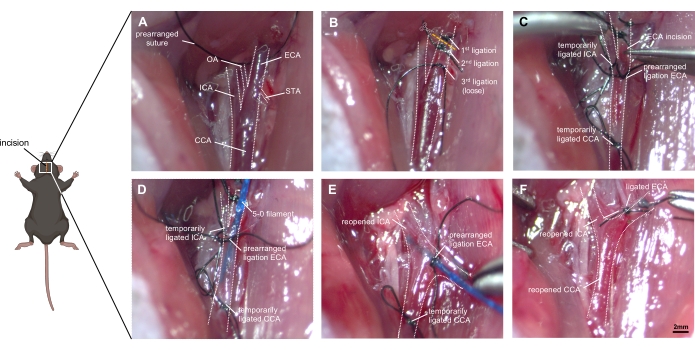
الشكل 1: صور خطوة بخطوة للتقنية الجراحية. (أ) تصوير تشريح الشريان السباتي الأيمن المكشوف: يتم تحديد CCA وتشعبه إلى ICA و ECA ، وكذلك الفروع الصغيرة من ECA (OA و STA). (ب) يتم تعبئة ECA من الأنسجة المحيطة وربطها بخيطين قبل قطعها. يجب وضع ربط ثالث بشكل فضفاض بالقرب من التشعب دون انسداده. (ج) يتم إغلاق ICA و CCA مؤقتا (إما بالربط أو المقاطع) لمنع النزيف المفرط عندما يتم شق ECA بعناية. (دال) تدرج الخيوط في اللجنة الاقتصادية لأفريقيا وتتدرج في التقييم القطري المشترك. يجب تشديد الربط المرتب مسبقا بعناية حتى لا يحدث أي انصباب دم ولكن يبقى تقدم الخيوط ممكنا. (هاء) يعاد فتح ال ICA و CCA ، ويجب تعديل جذع ECA إلى اتجاه الجمجمة. عن طريق دفع الخيط ~ 9 مم إلى الأمام في ICA ، سيتم الوصول إلى تشعب ACA-MCA ، ثم يتم ثقب السفينة عن طريق دفع الخيط ~ 3 مم إلى أبعد من ذلك. (و) يسحب الخيط بعد ضمان إعادة الربط الزمني للتقييم القطري المشترك. يتم إغلاق الربط المرتب مسبقا ل ECA بسرعة ، ويتم إعادة فتح CCA للسماح بإعادة التروية. الاختصارات: ACA = الشريان الدماغي الأمامي ، CCA = الشريان السباتي المشترك ، ECA = الشريان السباتي الخارجي ، MCA = الشريان الدماغي الأوسط ، ICA = الشريان السباتي الداخلي ، OA = الشريان القذالي ، PPA = الشريان الظفري ، STA = الشريان الدرقي العلوي. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- افتح جلد الرقبة بمشرط معقم ، من الذقن إلى الحافة العليا لعظم الصدر (1.5 سم) ، وافصل الغدد اللعابية بصراحة عن النسيج الضام المحيط بها.
- افصل مجموعة العضلات على طول جانب واحد [في هذه الحالة ، الجانب الأيمن] من القصبة الهوائية ، مما يعرض غمد الشريان السباتي الشائع (CCA) المغطى بالأوعية الدموية والأوردة المغذية. يقع CCA والعصب المبهمي على مقربة من بعضهما البعض.
- فصل CCA وترك 8-0 مجانا خياطة الحرير حول CCA دون ربطه مقدما. انتبه إلى حماية العصب المبهم ، لأنه يتلف بسهولة (الشكل 1A).
- يمكن رؤية تشعب ثلاثي ل CCA و ICA و ECA على طول الثلث الخلفي السفلي من الانبساط . تشريح الطرف البعيد من ECA و ligate السفينة مرتين بقدر الإمكان.
- افصل ECA عند نقطة منتصف الجزء المربوط مرتين ، مما أدى إلى إنشاء جذع سفينة.
- قم بترتيب ربط واحد مسبقا للخيوط حول جذع ECA ، ولا تغلقه حتى يتم إدخال خيوط ناجحة.
- استخدم خياطة أو مشبك صغير لحجب ICA و CCA مؤقتا (الشكل 1B).
- قم بعمل شق صغير (حوالي نصف قطر ECA) في ECA باستخدام مقص الأوعية الدموية الدقيقة. أدخل خيوط برولين 5-0 (بدلا من ذلك 4-0) في اللجنة الاقتصادية لأفريقيا وقدمها في التقييم القطري المشترك.
- أغلق الرباط على ECA قليلا أثناء تخفيف المشبك الصغير على ICA و CCA (الشكل 1C).
- اسحب الخيط برفق واضبط جذع ECA في اتجاه الجمجمة ، وقم بغزو الخيوط من خلال التشعب إلى ICA (الشكل 1D).
- وجه طرف الخيوط إنسيابيا بزاوية ~ 30 درجة إلى خط الوسط القصبي و ~ 30 درجة إلى المستوى الأفقي. ادفع الخيوط إلى الأمام داخل ICA. بعد الوصول إلى تشعب ACA-MCA ، تتم مواجهة المقاومة (~ 9 مم).
- قم بدفع الخيوط بمقدار 3 مم ، مما أدى إلى ثقب ACA الأيمن. اسحب الخيوط على الفور إلى جذع ECA ، مما يسمح بتدفق الدم إلى الفضاء تحت العنكبوتية.
- حافظ على الخيط في هذا الموضع لمدة 10 ثوان تقريبا (الشكل 1E). يمكن أن يكون وجود هزات العضلات ، والاختزال الجانبي ، واللهاث من أجل التنفس ، وتغير إيقاع القلب ، وسلس البول دليلا على نجاح الجراحة.
- أغلق CCA مؤقتا لتجنب فقدان الدم الزائد. اسحب الخيوط على الفور وقم بربط ECA بالخياطة المعدة مسبقا. إعادة فتح التقييم القطري المشترك والسماح بإعادة التروية والمزيد من انصباب الدم في الفضاء تحت العنكبوتية (الشكل 1F).
- بعد التحقق من تسرب النزيف ، قم بتطهير الجلد المحيط بالجرح لمنع الالتهابات الجلدية بعد العملية الجراحية ، وخياطة الجرح باستخدام خياطة ألياف البوليستر 4-0 غير القابلة للامتصاص.
- ضع الماوس في صندوق حراري حتى يتم استعادة الوعي. انتظر حتى يستيقظ الحيوان تماما وتأكد من أنه استعاد وعيه الكافي للحفاظ على الاستلقاء الصارم. لا تقم بإعادة الحيوانات إلى شركة الفئران الأخرى حتى تتعافى تماما.
- إدارة 200-300 مغ / كغ من الباراسيتامول من وزن الجسم لتخفيف الألم بعد العملية الجراحية.
- تحقق من الفئران يوميا بعد الجراحة.
3. قياس التصوير بالرنين المغناطيسي
- 24 ساعة بعد الجراحة ، قم بإجراء التصوير بالرنين المغناطيسي باستخدام ماسح ضوئي للقوارض (جدول المواد) ومرنان مخصص لرأس الماوس - هنا ، تم استخدام مرنان حجم التربيعي 20 مم للإرسال / الاستقبال.
- ضع الماوس على بطانية مياه ساخنة متداولة لضمان درجة حرارة ثابتة للجسم تبلغ ~ 37 درجة مئوية. حث التخدير مع 2.5 ٪ من الايزوفلوران في خليط O2 / N2O (30 ٪ / 70 ٪) والحفاظ على 1.5-2 ٪ من الايزوفلوران عبر قناع الوجه تحت مراقبة التهوية المستمرة.
- قم أولا بإجراء مسح مرجعي سريع للحصول على 3 حزم شرائح متعامدة (Tri-Pilot-Multi ، FLASH مع وقت التكرار TR / echo time TE = 200 مللي ثانية / 3 مللي ثانية ، 1 متوسط ، زاوية الوجه FA = 30 درجة ، مجال الرؤية FOV = 28 مم × 28 مم ، مصفوفة MTX = 256 × 256 ، سمك الشريحة 1 مم ، إجمالي وقت الاكتساب TA = 30 ثانية).
- ثم استخدم تسلسل T2D turbo spin-echo عالي الدقة للتصوير (معلمات التصوير TR / TE = 5505 مللي ثانية / 36 مللي ثانية ، عامل RARE 8 ، 6 متوسطات ، 46 شريحة محورية متجاورة بسماكة شريحة 0.35 مم لتغطية الدماغ بأكمله ، FOV = 25.6 مم × 25.6 مم ، MTX = 256 × 256 ، TA = 13 دقيقة).
- إذا كانت النتيجة غير واضحة ، فاستخدم تسلسل صدى التدرج المرجح T2 * الذي يتم تشغيله بالتنفس بنفس المسافة مثل فحص T2W (فلاش 2D ، TR / TE = 600 مللي ثانية / 6.3 مللي ثانية ، FA = 30 درجة ، 1 متوسط ، 20 شريحة محورية بسماكة 0.35 مم ، FOV و MTX متطابقان مع T2w ، TA = 5-10 دقيقة اعتمادا على معدل التنفس).
- انقل البيانات إلى تنسيق صورة DICOM واستخدم برنامج ImageJ لتصنيف SAH وقياس حجم جلطات الدم. وترد تفاصيل القياس الكمي كدليل خطوة بخطوة في المواد التكميلية (الشكل التكميلي 1).
النتائج
وفيات
بالنسبة لهذه الدراسة ، خضع ما مجموعه 92 من ذكور الفئران C57Bl / 6J الذين تتراوح أعمارهم بين 8-12 أسبوعا لعملية SAH. في هذه ، لاحظنا معدل وفيات إجمالي قدره 11.9 ٪ (n = 12). حدثت الوفيات حصريا خلال أول 6-24 ساعة بعد الجراحة ، مما يشير إلى الوفيات المحيطة بالجراحة وكذلك نزيف SAH نفسه كعوامل مساه?...
Discussion
باختصار ، يتم تقديم نموذج فأر SAH موحد ناجم عن عملية ثقب خيوط الأوعية الدموية مع غزو طفيف ، ووقت تشغيل قصير ، ومعدلات وفيات مقبولة. يتم إجراء التصوير بالرنين المغناطيسي على مدار 24 ساعة بعد العملية الجراحية لضمان موقع النزيف الصحيح واستبعاد الأمراض الأخرى ذات الصلة داخل الجمجمة. علاوة على ذل...
Disclosures
عدم وجود تضارب في المصالح
Acknowledgements
تم دعم SL من قبل مجلس المنح الدراسية الصيني. تم دعم KT من خلال منحة BIH-MD من معهد برلين للصحة و Sonnenfeld-Stiftung. يتم دعم RX من قبل برنامج BIH-Charité Clinician Scientist Program ، بتمويل من Charité - Universitätsmedizin Berlin ومعهد برلين للصحة. نحن نقدر الدعم المقدم من مؤسسة الأبحاث الألمانية (DFG) وصندوق النشر المفتوح الوصول التابع ل Charité - Universitätsmedizin Berlin.
Materials
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
References
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved