JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자기 공명 영상(MRI)과 결합된 Subarachnoid 출혈에 대한 혈관 내 천공 모델
* 이 저자들은 동등하게 기여했습니다
요약
여기서 우리는 정확한 출혈 부위를 보장하고 다른 관련 두개내 병리를 배제하기 위해 수술 후 24 시간 동안 자기 공명 영상 (MRI)과 결합 된 혈관 내 필라멘트 천공에 의해 유도 된 표준화 된 SAH 마우스 모델을 제시합니다.
초록
지주막하 출혈 (SAH)을 모방하는 혈관 내 필라멘트 천공 모델은 일반적으로 사용되는 모델입니다 - 그러나, 기술은 높은 사망률뿐만 아니라 SAH 및 뇌졸중 또는 두개내 출혈과 같은 다른 두개내 합병증의 통제 할 수없는 부피를 유발할 수 있습니다. 이 프로토콜에서, 표준화된 SAH 마우스 모델이 제시되고, 혈관 내 필라멘트 천공에 의해 유도되고, 수술 후 24시간 후에 자기 공명 영상(MRI)과 결합되어 정확한 출혈 부위를 보장하고 다른 관련 두개내 병리를 배제한다. 간단히 말해서, C57BL / 6J 마우스는 복강 내 케타민 / 자일라진 (70mg / 16mg / kg 체중) 주사로 마취되어 수핀 위치에 놓입니다. 미드라인 목 절개 후, 일반적인 경동맥 (CCA) 및 경동맥 분기가 노출되고, 5-0 비흡수성 모노필라멘트 폴리프로필렌 봉합사가 역행 방식으로 외부 경동맥 (ECA)으로 삽입되고 일반적인 경동맥으로 진행된다. 이어서, 필라멘트는 내부 경동맥(ICA)으로 질내 내로 들어가고, 전방 대뇌동맥(ACA)을 천공하기 위해 앞으로 밀려난다. 수술에서 회복 한 후, 마우스는 24 시간 후에 7.0 T MRI를 겪습니다. 출혈의 양은 수술 후 MRI를 통해 정량화되고 등급화 될 수 있으므로 혈액량에 따라 추가 하위 그룹 분석을 수행 할 수있는 옵션을 갖춘 강력한 실험 SAH 그룹이 가능합니다.
서문
Subarachnoid 출혈 (SAH)은 두개내 동맥류의 파열로 인해 발생하며 뇌졸중 1,2의 약 5 %를 차지하는 상당한 이환률 및 사망률과 관련하여 생명을 위협하는 응급 상황을 초래합니다. SAH 환자는 심한 두통, 신경 학적 기능 장애 및 의식의 진행성 장애를 가지고 있습니다3. SAH 환자의 약 30 %가 초기 출혈 사건4 후 처음 30 일 이내에 사망합니다. 임상적으로, 환자의 50 %는 초기 뇌 손상 후 지연 뇌 손상 (DBI)을 경험합니다. DBI는 지연된 뇌 허혈 및 지연된 신경학적 결핍을 특징으로 한다. 현재의 연구에 따르면 여러 가지 요인의 상승 효과는 혈액 - 뇌 장벽의 파괴, 작은 동맥의 수축, 미세 순환 기능 장애 및 혈전증 5,6을 포함한 신경 기능의 상실로 이어진다는것을 보여주었습니다.
SAH의 한 가지 독특한 측면은 병인이 실질 외 위치에서 유래하지만 실질 내부의 해로운 캐스케이드로 이어진다는 것입니다 : 병리학은 지주막하 공간에 혈액이 축적되어 신경 염증, 신경 및 내피 세포 아폽토시스, 피질 확산 탈분극 및 뇌 부종 형성과 같은 많은 사각 부근 효과를 유발합니다7, 8.
임상 연구는 여러 가지 요인에 의해 제한되며, 동물 모델은 질병의 pathomechanistic 변화를 일관되고 정확하게 모방하는 데 중요한 요소입니다. 상이한 SAH 모델 프로토콜, 예를 들어, 시스테르나 마그나(ACM)로의 자가 혈액 주입이 제안되었다. 또한, 시스테르나 마그나 및 시신경 치아즘 수조(APC)에 자가 혈액을 각각 9,10개로 이중 주사하는 변형된 방법이다. 자가 혈액 주입은 지주막하 출혈 후 혈관 경련 및 염증 반응의 병리학 적 과정을 시뮬레이션하는 간단한 방법이지만, 두개내 압력 (ICP)의 다음과 같은 상승은 상대적으로 느리고 혈액 뇌 장벽의 투과성에 주목할만한 변화는 유도되지 않습니다11,12. 또 다른 방법은, 큰 SAH 모델(예를 들어, 원숭이 및 개)에서 일반적으로 사용되는 동맥주위 혈액 배치는 항응고된 자가 혈액 또는 유사한 혈액 생성물을 혈관 주위에 배치하는 것을 포함한다. 동맥의 직경 변화는 현미경으로 관찰 할 수 있으며 SAH13 이후 뇌 혈관 경련의 지표 역할을합니다.
Barry et al. 먼저 1979년에 두개골을 제거한 후 바질라 동맥이 노출되는 혈관 내 천공 모델을 기술하였다; 동맥은 그 후 미세한 입체 전술 기술(14)을 사용하여 텅스텐 미세전극으로 구멍을 뚫는다. 1995년, 베더슨과 벨켄은 뇌허혈의 Zea-Longa 모델을 수정하고 혈관 내 천공을 확립하였으며, 이는15,16년 이래 지속적으로 개선되고 있다. 이 방법은 생쥐와 인간이 윌리스의 원으로 알려진 유사한 두개내 혈관 네트워크를 공유한다는 사실에 기초합니다.
마우스 모델에서 SAH의 수술 후 평가 및 등급을 매기기 위해 다양한 접근법이 제안되었습니다. Sugawara et al.은 200817 이후 널리 사용 된 등급 척도를 개발했습니다. 이 방법은 형태학적 변화에 기초하여 SAH의 심각도를 평가한다. 그러나이 방법의 경우 마우스의 뇌 조직 형태를 직접 시력으로 검사해야하므로 평가를 위해 마우스를 희생해야합니다. 또한, 생체내에서 SAH 중증도를 결정하기 위한 몇 가지 방법이 확립되었다. 접근법은 간단한 신경 학적 채점에서 두개내 압력 (ICP)의 모니터링에 이르기까지 다양한 방사선 이미징 기술에 이르기까지 다양합니다. 또한, MRI 등급은 SAH 중증도를 등급화하는 새로운 비침습적 도구로 밝혀졌으며, 이는 신경학적 점수18,19와 상관관계가 있다.
여기에서, 혈관 내 천공에 의해 야기된 SAH 모델에 대한 프로토콜이 제시되고, 수술 후 MRI와 결합된다. 생체 내 환경에서 출혈량을 객관화하는 시스템을 구축하기 위한 시도로, 우리는 또한 7.0 T 고해상도 T2 가중 MRI를 기반으로 총 혈액량의 SAH 등급 및 정량화를 위한 시스템을 개발하였다. 이 접근법은 SAH의 올바른 유도와 뇌졸중, 뇌수종 또는 뇌출혈 (ICH) 및 합병증과 같은 다른 병리를 배제합니다.
프로토콜
실험은 Landesamt fuer Gesundheit und Soziales (LaGeSo), Berlin, Germany (G0063/18)에 의해 규정된 지침 및 규정에 따라 수행되었다. 본 연구에서, 체중이 25 ± 0.286 g (평균 ± s.e.m.)인 C57Bl/6J 수컷 (8-12주령) 마우스를 사용하였다.
1. 동물 준비
- 케타민 (70 mg / kg)과 자일라진 (16 mg / kg)을 복강 내로 주사하여 마취를 유도하십시오. 정상 체온을 유지하여 깊은 마취의 빠른 유도에 기여합니다. 발가락 꼬집음과 같은 통증 자극으로 적절한 진정 작용을 테스트하고 반응이 없는지 확인하십시오.
- 면도기로 마우스의 목 머리카락을 조심스럽게 면도하고 베타 딘 / 클로르헥시딘을 70 % 에탄올로 닦은 다음 피부 표면에 1 % 리도카인을 바르면 국소 통증 조절이 가능합니다.
- 마우스를 수핀 위치에 놓습니다. 테이프를 사용하여 팔다리와 꼬리를 고정시키고 목의 피부를 수술의 반대쪽으로 부드럽게 스트레칭하십시오. 동시에 목을 약간 들어 올립니다.
- 수술 중 눈의 탈수를 방지하기 위해 안과 연고 (예 : 5 % dexpanthenol)를 사용하십시오.
2. SAH 유도
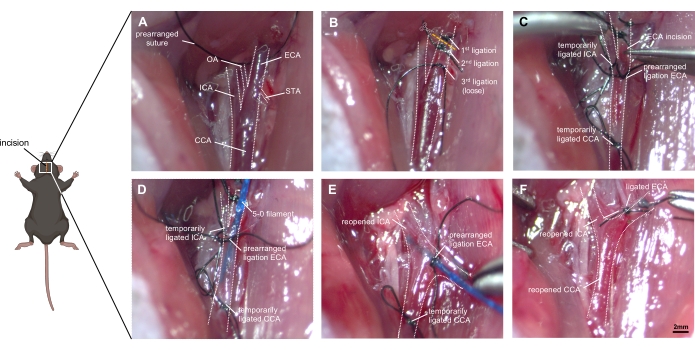
그림 1 : 수술 기술의 단계별 이미지. (A) 노출 된 오른쪽 경동맥 해부학의 묘사 : CCA와 ICA 및 ECA로의 분기는 ECA (OA 및 STA)의 작은 가지뿐만 아니라 식별됩니다. (B) ECA는 주변 조직에서 동원되어 절단하기 전에 두 개의 봉합사로 결찰됩니다. 세 번째 결찰은 분기를 막지 않고 분기 근처에 느슨하게 배치해야합니다. (C) ICA와 CCA는 ECA가 조심스럽게 절개될 때 과도한 출혈을 방지하기 위해 일시적으로 (결찰 또는 클립 포함) 폐색됩니다. (D) 필라멘트가 ECA에 삽입되고 CCA로 진행된다. 혈액 유출이 발생하지 않도록 미리 배열 된 결찰을 조심스럽게 조여야하지만 필라멘트를 전진시키는 것은 가능합니다. (E) ICA와 CCA가 다시 열리고, ECA 그루터기는 두개골 방향으로 조정되어야 한다. 필라멘트를 ICA로 ~ 9mm 앞으로 밀어 넣으면 ACA-MCA 분기에 도달하고 필라멘트를 ~ 3mm 더 밀어 용기를 천공합니다. (F) 필라멘트는 CCA의 시간적 재결찰을 보장한 후에 철회된다. ECA의 미리 배열된 라이게이션은 신속하게 폐색되고, CCA는 재관류를 허용하도록 다시 개방된다. 약어: ACA = 전방 대뇌 동맥, CCA = 일반 경동맥, ECA = 외부 경동맥, MCA = 중간 대뇌 동맥, ICA = 내부 경동맥, OA = 후두 동맥, PPA = 익상편 동맥, STA = 우수한 갑상선 동맥. 배율 막대 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 턱에서 가슴뼈의 위쪽 가장자리 (1.5cm)까지 멸균 메스로 목 피부를 열고 타액선을 주변 결합 조직에서 무뚝뚝하게 분리하십시오.
- 기관의 한쪽 [이 경우 오른쪽]을 따라 근육 그룹을 분리하여 영양 혈관과 정맥으로 덮인 일반적인 경동맥 (CCA) 외피를 노출시킵니다. CCA와 미주 신경은 서로 근접하게 위치합니다.
- CCA를 분리하고 무료 8-0을 남겨 둡니다. CCA 주위에 실크 봉합사를 미리 붙이지 않고 봉합합니다. 미주 신경이 쉽게 손상되기 때문에 미주 신경의 보호에주의를 기울이십시오 (그림 1A).
- CCA, ICA 및 ECA의 삼중 분기는 디아스타시스의 하부 후부 세 번째를 따라 볼 수 있습니다. ECA의 원위 단부를 해부하고 가능한 한 두 배나 멀리 떨어진 선박을 절제하십시오.
- 두 번 결찰 된 세그먼트의 중간 지점에서 ECA를 분리하여 용기 그루터기를 만듭니다.
- ECA 그루터기 주위의 필라멘트에 대한 하나의 결찰을 미리 배열하고, 필라멘트 삽입이 성공할 때까지 닫지 마십시오.
- 봉합사 또는 마이크로 클립을 사용하여 ICA 및 CCA를 일시적으로 차단합니다(그림 1B).
- 미세 혈관 가위를 사용하여 ECA에서 작은 절개 (ECA 직경의 약 절반)를 만드십시오. 5-0 (대안으로 4-0) 프롤렌 필라멘트를 ECA에 삽입하고 CCA로 전진시킵니다.
- ICA 및 CCA의 마이크로 클립을 풀면서 ECA의 합자를 약간 닫습니다(그림 1C).
- 필라멘트를 부드럽게 뒤로 당기고 ECA 그루터기를 두개골 방향으로 조정하여 ICA로의 분기를 통해 필라멘트를 질화합니다 (그림 1D).
- 필라멘트 팁을 기관 중앙선에 ~30°, 수평면에 ~30°의 각도로 중앙으로 가리킵니다. ICA 내부에서 필라멘트를 앞으로 밀어 넣습니다. ACA-MCA 분기에 도달하면 저항이 발생합니다 (~ 9mm).
- 필라멘트를 3mm 더 전진시켜 오른쪽 ACA에 구멍을 뚫습니다. 필라멘트를 ECA 그루터기로 즉시 철수시켜 지주막하 공간으로 혈류를 허용합니다.
- 필라멘트를 약 10초 동안 이 위치에 두십시오(그림 1E). 근육 떨림, 동측성 흉막증, 호흡 헐떡거림, 심장 리듬 변화 및 요실금의 존재는 성공적인 수술의 증거를 뒷받침 할 수 있습니다.
- 과도한 혈액 손실을 피하기 위해 CCA를 일시적으로 닫으십시오. 필라멘트를 즉시 꺼내 미리 배열 된 봉합사로 ECA를 리게이트하십시오. CCA를 다시 열고 재관류 및 지주막하 공간으로의 혈액의 추가 삼출을 허용하십시오 (그림 1F).
- 출혈 누출을 확인한 후 수술 후 피부 감염을 방지하기 위해 상처 주위의 피부를 소독하고 비 흡수성 4-0 폴리 에스테르 섬유 봉합사로 상처를 봉합합니다.
- 의식이 회복 될 때까지 마우스를 열 상자에 넣으십시오. 동물이 완전히 깨어날 때까지 기다렸다가 흉골 잔해를 유지하기에 충분한 의식을 회복했는지 확인하십시오. 완전히 회복 될 때까지 동물을 다른 생쥐의 회사로 돌려 보내지 마십시오.
- 수술 후 통증 완화를 위해 200-300 mg / kg 체중 파라세타몰을 투여하십시오.
- 수술 후 매일 마우스를 확인하십시오.
3. MRI 측정
- 수술 후 24 시간 후, 설치류 스캐너 (재료 표)와 전용 마우스 머리 공진기를 사용하여 MRI를 수행 - 여기에서, 20mm 전송 / 수신 직교 볼륨 공진기가 사용되었습니다.
- 마우스를 가열된 순환수 담요 위에 올려 놓고 ~37°C의 일정한 체온을 보장한다. O2 / N2O 혼합물 (30 % / 70 %)에서 2.5 % 이소 플루란으로 마취를 유도하고 연속 환기 모니터링하에 안면 마스크를 통해 1.5-2 % 이소 플루란으로 유지하십시오.
- 먼저 3개의 직교 슬라이스 패키지를 획득하는 빠른 참조 스캔을 수행합니다(트라이파일럿 멀티, 반복 시간 TR/에코 시간 TE = 200ms/3ms, 평균 1개, 플립 각도 FA = 30°, 시야각 FOV = 28mm x 28mm, 매트릭스 MTX = 256 x 256, 슬라이스 두께 1mm, 총 획득 시간 TA = 30초).
- 그런 다음 이미징을 위해 고해상도 T2 가중치 2D 터보 스핀 에코 시퀀스를 사용하십시오 (이미징 매개 변수 TR / TE = 5505 ms / 36ms, RARE 요소 8, 6 평균, 전체 뇌를 덮기 위해 0.35 mm의 슬라이스 두께를 가진 46 개의 연속 축 슬라이스, FOV = 25.6 mm x 25.6 mm, MTX = 256 x 256, TA = 13 분).
- 결과가 불분명하면 T2w 스캔과 동일한 등거리(2D FLASH, TR/TE = 600ms/6.3ms, FA = 30°, 평균 1개, 두께가 0.35mm인 축방향 슬라이스 20개, FOV 및 MTX가 T2w와 동일함, 호흡률에 따라 TA = 5-10분)를 추가로 호흡 트리거한 T2*가중 그라디언트 에코 시퀀스를 사용합니다.
- 데이터를 DICOM 이미지 형식으로 전송하고 혈전의 SAH 등급 및 체적 측정을 위해 ImageJ 소프트웨어를 사용하십시오. 정량화에 대한 자세한 내용은 보충 자료에 단계별 가이드로 나열되어 있습니다 (보충 그림 1).
결과
사망률
본 연구를 위해, 8-12주 사이에 숙성된 총 92마리의 수컷 C57Bl/6J 마우스가 SAH 수술을 받았다; 이들에서, 우리는 11.9 %의 전체 사망률을 관찰했다 (n = 12). 사망률은 수술 후 처음 6-24 시간 이내에 독점적으로 발생했으며, 이는 수술 전 사망률과 SAH 출혈 자체가 가장 큰 기여 요인임을 시사합니다.
SAH 출혈 등급
총 50 마리의 마우스가 수술 후 24 시...
토론
요약하면, 혈관 내 필라멘트 천공 조작에 의해 유도된 표준화된 SAH 마우스 모델은 경미한 침윤, 짧은 수술 시간, 및 허용가능한 사망률로 제시된다. MRI는 올바른 출혈 부위와 다른 관련 두개내 병리를 배제하기 위해 수술 후 24 시간 동안 수행됩니다. 또한, 우리는 다른 SAH 출혈 등급을 분류하고 출혈량을 측정하여 출혈 등급에 따라 추가 하위 그룹 분석을 가능하게했습니다.
마...
공개
이해 상충 없음
감사의 말
SL은 중국 장학금위원회의 지원을 받았다. KT는 베를린보건원과 소넨펠트-스티프퉁의 BIH-MD 장학금의 지원을 받았다. RX는 BIH-Charité Clinician Scientist Program의 지원을 받으며, Charité -Universitätsmedizin Berlin과 Berlin Institute of Health가 자금을 지원합니다. 우리는 독일 연구 재단 (DFG)과 Charité - Universitätsmedizin Berlin의 Open Access Publication Fund의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
참고문헌
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유