Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель эндоваскулярной перфорации субарахноидального кровоизлияния в сочетании с магнитно-резонансной томографией (МРТ)
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем стандартизированную модель мыши SAH, индуцированную перфорацией эндоваскулярной нити, в сочетании с магнитно-резонансной томографией (МРТ) через 24 ч после операции для обеспечения правильного места кровотечения и исключения других соответствующих внутричерепных патологий.
Аннотация
Модель перфорации эндоваскулярной нити для имитации субарахноидального кровоизлияния (SAH) является широко используемой моделью, однако этот метод может вызвать высокий уровень смертности, а также неконтролируемый объем SAH и другие внутричерепные осложнения, такие как инсульт или внутричерепное кровоизлияние. В этом протоколе представлена стандартизированная модель мыши SAH, индуцированная перфорацией эндоваскулярной нити, в сочетании с магнитно-резонансной томографией (МРТ) через 24 ч после операции для обеспечения правильного места кровотечения и исключения других соответствующих внутричерепных патологий. Вкратце, мышей C57BL/6J анестезируют внутрибрюшинной инъекцией кетамина/ксилазина (70 мг/16 мг/кг массы тела) и помещают в лежачее положение. После разреза средней линии шеи обнажаются общая сонная артерия (CCA) и каротидная бифуркация, и нерассасывающийся монофиламентный полипропиленовый шов 5-0 вводится ретроградным способом в наружную сонную артерию (ECA) и продвигается в общую сонную артерию. Затем нить инвагинируется во внутреннюю сонную артерию (ICA) и выдвигается вперед для перфорации передней мозговой артерии (ACA). После восстановления после операции мыши проходят МРТ 7,0 Т через 24 ч. Объем кровотечения может быть количественно определен и оценен с помощью послеоперационной МРТ, что позволяет создать надежную экспериментальную группу SAH с возможностью выполнения дальнейших анализов подгрупп на основе количества крови.
Введение
Субарахноидальное кровоизлияние (SAH) вызвано разрывом внутричерепной аневризмы и представляет собой опасную для жизни чрезвычайную ситуацию, связанную со значительной заболеваемостью и смертностью, что составляет около 5% инсультов 1,2. Пациенты с САГ с выраженными головными болями, неврологической дисфункцией и прогрессирующим нарушением сознания3. Около 30% пациентов с САГ умирают в течение первых 30 дней после первоначального кровотечения4. Клинически 50% пациентов испытывают отсроченную черепно-мозговую травму (DBI) после ранней черепно-мозговой травмы. ДБИ характеризуется отсроченной ишемией головного мозга и отсроченным неврологическим дефицитом. Современные исследования показали, что синергетические эффекты нескольких различных факторов приводят к потере неврологической функции, включая разрушение гематоэнцефалического барьера, сокращение мелких артерий, микроциркуляторную дисфункцию и тромбоз 5,6.
Одним из уникальных аспектов SAH является то, что патогенез возникает из экстрапаренхимального расположения, но затем приводит к пагубным каскадам внутри паренхимы: патология начинается с накопления крови в субарахноидальном пространстве, вызывая множество внутрипаренхимальных эффектов, таких как нейровоспаление, апоптоз нейронных и эндотелиальных клеток, кортикальная распространяющаяся деполяризация и образование отека мозга7, См. 8.
Клинические исследования ограничены несколькими факторами, что делает животную модель критическим элементом в последовательной и точной имитации патомеханистических изменений заболевания. Были предложены различные протоколы модели SAH, например, аутологичная инъекция крови в cisterna magna (ACM). Также модифицирован метод с двойной инъекцией аутологичной крови в цистерну магна и зрительный хиазм цистерны (БТР) соответственно 9,10. В то время как аутологичная инъекция в кровь является простым способом имитации патологического процесса спазма сосудов и воспалительных реакций после субарахноидального кровоизлияния, последующее повышение внутричерепного давления (ВЧД) происходит относительно медленно, и никаких заметных изменений проницаемости гематоэнцефалического барьера индуцируется11,12. Другой метод, периартериальное размещение крови, обычно используемый в больших моделях SAH (например, обезьяны и собаки), включает размещение антикоагулянтной аутологичной крови или сопоставимых продуктов крови вокруг сосуда. Изменения диаметра артерии можно наблюдать с помощью микроскопа, служащего индикатором церебрального спазма сосудов после SAH13.
Barry et al. впервые описали модель эндоваскулярной перфорации в 1979 году, в которой базилярная артерия обнажается после удаления черепа; затем артерию прокалывают вольфрамовыми микроэлектродами с использованием микроскопической стереотаксической техники14. В 1995 году Бедерсон и Велкен модифицировали модель Зеа-Лонга церебральной ишемии и установили эндоваскулярную перфорацию, которая постоянно улучшалась с 15,16. Этот метод основан на том, что мыши и люди имеют схожую внутричерепную сосудистую сеть, известную как круг Уиллиса.
Для послеоперационной оценки и классификации SAH в мышиной модели были предложены различные подходы. Sugawara et al. разработали шкалу оценок, которая широко используется с 2008 года17. Этот метод оценивает тяжесть САГ на основе морфологических изменений. Однако для этого метода морфология мозговой ткани мыши должна быть исследована под непосредственным зрением, и поэтому мышь должна быть принесена в жертву для оценки. Кроме того, было установлено несколько методов определения тяжести САГ in vivo. Подходы варьируются от простой неврологической оценки до мониторинга внутричерепного давления (ICP) и различных методов радиологической визуализации. Кроме того, оценка МРТ была показана как новый, неинвазивный инструмент для оценки тяжести SAH, коррелирующий с неврологическим баллом18,19.
Здесь представлен протокол для модели SAH, вызванной эндоваскулярной перфорацией, в сочетании с послеоперационной МРТ. В попытке создать систему для объективизации количества кровотечений в условиях in vivo , мы также разработали систему для классификации SAH и количественной оценки общего объема крови на основе МРТ с высоким разрешением 7,0 Т с высоким разрешением T2. Такой подход обеспечивает правильную индукцию САГ и исключение других патологий, таких как инсульт, гидроцефалия или внутримозговое кровоизлияние (ICH) и осложнения.
протокол
Эксперименты проводились в соответствии с руководящими принципами и правилами, установленными Landesamt fuer Gesundheit und Soziales (LaGeSo), Берлин, Германия (G0063/18). В этом исследовании использовали самцов мышей C57Bl/6J (8-12 недель) весом 25 ± 0,286 г (средняя ± т.е. м.).
1. Подготовка животных
- Индуцировать анестезию путем введения кетамина (70 мг/кг) и ксилазина (16 мг/кг) внутрибрюшинно. Поддерживать нормальную температуру тела, способствуя быстрому введению глубокой анестезии. Проверьте адекватную седацию с болевым стимулом, таким как защемление пальца ноги, и проверьте отсутствие реакции.
- Тщательно сбрите волосы шеи мыши бритвой, очистите их 70% этанолом с последующим бетадином / хлоргексидином и нанесите 1% лидокаина на поверхность кожи для местного контроля боли.
- Поместите мышь в положение лежа на спине. Используйте ленту для фиксации конечностей и хвоста, осторожно растягивая кожу шеи на противоположную сторону операции. Одновременно немного приподнимите шею.
- Используйте офтальмологическую мазь (например, 5% декспантенол) для предотвращения обезвоживания глаз во время операции.
2. Индукция SAH
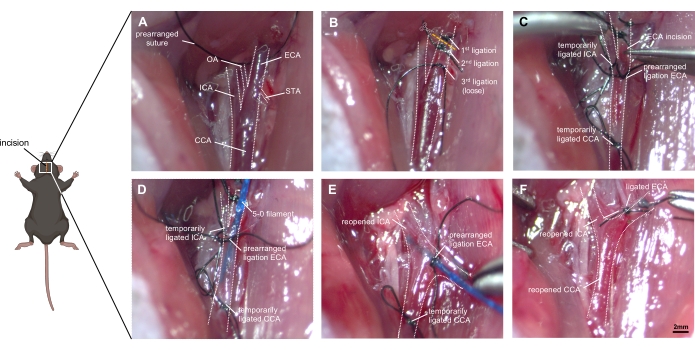
Рисунок 1: Пошаговые изображения хирургической техники. (А) Изображение обнаженной анатомии правой сонной артерии: идентифицированы ОАС и ее бифуркация в ИКА и ЭКА, а также небольшие ветви ЭКА (ОА и СТА). (B) ЭКА мобилизуется из окружающих тканей и перевязывается двумя швами перед ее разрезанием. Третья перевязка должна быть размещена свободно рядом с бифуркацией, не закупоривая ее. (C) ICA и CCA временно закупориваются (либо с перевязкой, либо клипсами) для предотвращения чрезмерного кровотечения при тщательном надрезе ЭКА. D) нить накала вставляется в ЭКА и переносится в ОАС. Предварительно организованная перевязка должна быть тщательно затянута, чтобы не возникало выпота крови, но продвижение нити остается возможным. (E) МКА и ОАС вновь открываются, а пень ЭКА необходимо отрегулировать в сторону черепа. Проталкивая нить ~ 9 мм вперед в ICA, бифуркация ACA-MCA будет достигнута, и сосуд затем перфорируется путем проталкивания нити накала ~ 3 мм дальше. (F) Нить накала изымается после обеспечения временной религации ОАС. Предварительно организованная лигирование ЭКА быстро закупоривается, и ОАС вновь открывается, чтобы разрешить реперфузию. Сокращения: ACA = передняя мозговая артерия, CCA = общая сонная артерия, ECA = наружная сонная артерия, MCA = средняя мозговая артерия, ICA = внутренняя сонная артерия, OA = затылочная артерия, PPA = крылогопалатиновая артерия, STA = верхняя щитовидная артерия. Шкала = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Откройте кожу шеи стерильным скальпелем, от подбородка до верхнего края грудины (1,5 см), и тупо отделите слюнные железы от окружающей их соединительной ткани.
- Отделите группу мышц вдоль одной стороны [в данном случае правой стороны] трахеи, обнажив оболочку общей сонной артерии (ОАС), покрытую питательными кровеносными сосудами и венулами. ОАС и блуждающий нерв расположены в непосредственной близости друг от друга.
- Диссоциировать ВСС и оставить свободным 8-0 шелковый шов вокруг КЦА без его перевязки заранее. Обратите внимание на защиту блуждающего нерва, так как он легко повреждается (рисунок 1А).
- Тройная бифуркация CCA, ICA и ECA видна вдоль нижней задней трети диастаза. Рассекните дистальный конец ЭКА и сажайте сосуд в два раза дальше, насколько это возможно.
- Отсоедините ЭКА в средней точке дважды перевязанного сегмента, создав культю сосуда.
- Предварительно организуйте одну перевязку нити накала вокруг культи ЭКА, не закрывайте ее до успешного введения нити накаливания.
- Используйте шов или микрозажим для временного закрытия ICA и CCA (рисунок 1B).
- Сделайте небольшой разрез (примерно половину диаметра ЭКА) в ЭКА с помощью микрососудистых ножниц. Вставьте проленовую нить 5-0 (альтернативно 4-0) в ЭКА и перенесите ее в ОАС.
- Слегка закройте лигатуру на ЭКА, ослабив микрозажим на ICA и CCA (рисунок 1C).
- Осторожно оттяните нить накаливания и отрегулируйте культю ECA в черепном направлении, инвагинируя нить через бифуркацию в ICA (рисунок 1D).
- Направьте наконечник нити медиально под углом ~30° к средней линии трахеи и ~30° к горизонтальной плоскости. Вытолкните нить накаливания вперед внутри ICA. После достижения бифуркации ACA-MCA встречается сопротивление (~9 мм).
- Продвиньте нить на 3 мм дальше, перфорируя правый ACA. Быстро выводят нить на культю ЭКА, позволяя крови течь в субарахноидальное пространство.
- Держите нить накала в этом положении около 10 с (рисунок 1Е). Наличие мышечного тремора, ипсилатерального миоза, задыхания, измененного сердечного ритма и недержания мочи может быть подтверждающим свидетельством успешной операции.
- Временно закройте ККА, чтобы избежать избыточной кровопотери. Вытащите нить мгновенно и обжарьте ЭКА заранее подготовленным швом. Вновь открыть ОАС и разрешить реперфузию и дальнейший выпот крови в субарахноидальное пространство (рисунок 1F).
- После проверки на утечку кровотечения продезинфицируйте кожу, окружающую рану, чтобы предотвратить послеоперационные инфекции кожи, и зашить рану нерассасывающимся швом из полиэфирного волокна 4-0.
- Поместите мышь в термобокс до тех пор, пока сознание не восстановится. Подождите, пока животное полностью проснется, и убедитесь, что оно восстановило достаточное сознание для поддержания грудинного покоя. Не возвращайте животных в компанию других мышей до полного выздоровления.
- Вводят 200-300 мг/кг парацетамола с массой тела для послеоперационного обезболивания.
- Проверяйте мышей ежедневно после операции.
3. Измерение МРТ
- Через 24 часа после операции выполните МРТ с помощью сканера грызунов (Таблица материалов) и специального резонатора головы мыши - здесь использовался 20-миллиметровый квадратурный объемный резонатор передачи/приема.
- Поместите мышь на подогретое одеяло для циркуляции воды, чтобы обеспечить постоянную температуру тела ~ 37 °C. Индуцировать анестезию 2,5% изофлурана в смеси O2/N2O (30%/70%) и поддерживать 1,5-2% изофлурана через лицевую маску под непрерывным контролем вентиляции.
- Сначала выполните быстрое эталонное сканирование, получив 3 ортогональных пакета срезов (Tri-Pilot-Multi, FLASH со временем повторения TR/echo TE = 200 мс/3 мс, 1 среднее, угол сальто FA = 30°, поле зрения FOV = 28 мм x 28 мм, матрица MTX = 256 x 256, толщина среза 1 мм, общее время захвата TA = 30 с).
- Затем для визуализации используйте для визуализации 2D-взвешенную T2-взвешенную 2D-спин-эхо-последовательность (параметры визуализации TR/TE = 5505 мс/36 мс, коэффициент RARE 8, 6 средних значений, 46 смежных осевых срезов толщиной среза 0,35 мм для покрытия всего мозга, FOV = 25,6 мм x 25,6 мм, MTX = 256 x 256, TA = 13 мин).
- Если результат неясен, используйте дополнительную градиентную эхо-последовательность, вызванную дыханием T2*, с той же изодантностью, что и при сканировании T2w (2D FLASH, TR/TE = 600 мс/6,3 мс, FA = 30°, 1 среднее, 20 осевых срезов толщиной 0,35 мм, FOV и MTX идентичны T2w, TA = 5-10 мин в зависимости от скорости дыхания).
- Перенесите данные в формат изображения DICOM и используйте программное обеспечение ImageJ для классификации SAH и объемной обработки сгустков крови. Подробная информация о количественной оценке приведена в качестве пошагового руководства в дополнительном материале (дополнительный рисунок 1).
Результаты
Смертность
Для этого исследования в общей сложности 92 самца мышей C57Bl/6J в возрасте от 8 до 12 недель были подвергнуты операции SAH; в них мы наблюдали общий уровень смертности 11,9% (n = 12). Смертность наблюдалась исключительно в течение первых 6-24 ч после операции, предполагая периопе...
Обсуждение
Таким образом, стандартизированная модель мыши SAH, индуцированная операцией перфорации эндоваскулярной нити, представлена с незначительной инвазией, коротким оперативным временем и приемлемыми показателями смертности. МРТ проводится 24 ч после операции для обеспечения правильного м?...
Раскрытие информации
Отсутствие конфликта интересов
Благодарности
SL был поддержан Китайским советом по стипендиям. КТ была поддержана стипендией БИГ-МД Берлинского института здравоохранения и Фонда Зонненфельда. RX поддерживается Программой ученых-клиницистов БИГ-Шарите, финансируемой Charité-Universitätsmedizin Berlin и Берлинским институтом здравоохранения. Мы признаем поддержку со стороны Немецкого исследовательского фонда (DFG) и Фонда публикаций открытого доступа Charité - Universitätsmedizin Berlin.
Материалы
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
Ссылки
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены