A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל ניקוב אנדווסקולרי לדימום תת-עכבישי בשילוב עם דימום תהודה מגנטית (MRI)
* These authors contributed equally
In This Article
Summary
כאן אנו מציגים מודל עכבר SAH סטנדרטי, המושרה על ידי ניקוב נימה אנדווסקולרית, בשילוב עם הדמיית תהודה מגנטית (MRI) 24 שעות לאחר הניתוח כדי להבטיח את אתר הדימום הנכון ולא לכלול פתולוגיות תוך גולגולתיות רלוונטיות אחרות.
Abstract
מודל הניקוב האנדווסקולרי לחיקוי דימום תת-גולגולתי (SAH) הוא מודל נפוץ - עם זאת, הטכניקה עלולה לגרום לשיעור תמותה גבוה, כמו גם לנפח בלתי נשלט של SAH וסיבוכים תוך גולגולתיים אחרים כגון שבץ או דימום תוך גולגולתי. בפרוטוקול זה מוצג מודל עכבר SAH סטנדרטי, המושרה על ידי ניקוב נימה אנדווסקולרית, בשילוב עם הדמיית תהודה מגנטית (MRI) 24 שעות לאחר הניתוח כדי להבטיח את אתר הדימום הנכון ולא לכלול פתולוגיות תוך גולגולתיות רלוונטיות אחרות. בקצרה, עכברי C57BL/6J מורדמים בזריקת קטמין/קסילאזין תוך-צפקית (משקל גוף של 70 מ"ג/16 מ"ג/ק"ג) ומונחים בתנוחת שכיבה. לאחר חתך הצוואר האמצעי, עורק הצוואר המשותף (CCA) והביפורקציה של הצוואר נחשפים, ותפר פוליפרופילן מונופילמנטי 5-0 שאינו נספג מוחדר באופן מדרדר לתוך עורק הצוואר החיצוני (ECA) ומתקדם לתוך עורק הצוואר המשותף. לאחר מכן, החוט הוא invagined לתוך העורק הצווארי הפנימי (ICA) ונדחף קדימה כדי לנקב את עורק המוח הקדמי (ACA). לאחר ההחלמה מניתוח, עכברים עוברים MRI 7.0 T 24 שעות מאוחר יותר. ניתן לכמת את נפח הדימום ולדרג אותו באמצעות MRI לאחר הניתוח, מה שמאפשר לקבוצת SAH ניסיונית חזקה עם אפשרות לבצע ניתוחים נוספים של תת-קבוצות בהתבסס על כמות הדם.
Introduction
דימום תת-גולגולתי (SAH) נגרם על ידי קרע של מפרצת תוך גולגולתית ומהווה מצב חירום מסכן חיים, הקשור לתחלואה ותמותה משמעותיות, המהוות כ-5% מהשבץ 1,2. חולי SAH סובלים מכאבי ראש קשים, תפקוד נוירולוגי לקוי והפרעה הדרגתית לתודעה3. כ-30% מחולי ה-SAH מתים במהלך 30 הימים הראשונים לאחר אירוע הדימום הראשוני4. מבחינה קלינית, 50% מהמטופלים חווים פגיעה מוחית מאוחרת (DBI) לאחר פגיעה מוחית מוקדמת. DBI מאופיין באיסכמיה מוחית מושהית ובליקויים נוירולוגיים מושהים. מחקרים עדכניים הראו כי ההשפעות הסינרגטיות של מספר גורמים שונים מובילות לאובדן התפקוד הנוירולוגי, כולל הרס מחסום הדם-מוח, התכווצות של עורקים קטנים, תפקוד לקוי של מיקרו-סירקולציה ופקקת 5,6.
היבט ייחודי אחד של SAH הוא שהפתוגנזה מקורה במיקום חוץ-פרנצ'ימלי, אך לאחר מכן מובילה למפלים מזיקים בתוך הפרנכימה: הפתולוגיה מתחילה בהצטברות הדם במרחב התת-קרקעי, ומפעילה שפע של השפעות תוך-פרנצ'ימליות, כגון דלקת עצבית, אפופטוזיס של תאי עצב ואנדותל, דה-פולריזציה של התפשטות קליפת המוח והיווצרות בצקת מוח7, 8.
המחקר הקליני מוגבל על ידי מספר גורמים, מה שהופך את המודל החי למרכיב קריטי בחיקוי עקבי ומדויק של השינויים הפתומכניסטיים של המחלה. הוצעו פרוטוקולים שונים של מודל SAH, למשל, הזרקת דם אוטולוגית לתוך הציסטרנה מגנה (ACM). כמו כן, שיטה שונה עם הזרקה כפולה של דם אוטולוגי לתוך cisterna magna ו בור כיאסם אופטי (APC) בהתאמה 9,10. בעוד שהזרקת דם אוטולוגית היא דרך פשוטה לדמות את התהליך הפתולוגי של vasospasm ותגובות דלקתיות לאחר דימום תת-עכבישי, העלייה הבאה של לחץ תוך גולגולתי (ICP) היא איטית יחסית, ואין שינויים ראויים לציון בחדירות של מחסום הדם-מוח נגרמים11,12. שיטה אחרת, מיקום הדם הפריארטריאלי, המשמשת בדרך כלל במודלים גדולים של SAH (למשל, קופים וכלבים), כוללת הצבת דם אוטולוגי נוגד קרישה או מוצרי דם דומים סביב כלי הדם. את שינויי הקוטר של העורק ניתן לראות עם מיקרוסקופ, המשמש אינדיקטור עבור vasospasm המוח לאחר SAH13.
Barry et al. תיארו לראשונה מודל ניקוב אנדווסקולרי בשנת 1979 שבו עורק הבזילרי נחשף לאחר הסרת הגולגולת; לאחר מכן מנקבים את העורק במיקרו-אלקטרוניקה של טונגסטן, תוך שימוש בטכניקה סטריאוטקטית מיקרוסקופית14. בשנת 1995, בדרסון וולקן שינו את מודל Zea-Longa של איסכמיה מוחית והקימו את הניקוב האנדווסקולרי, אשר שופר ברציפות מאז15,16. שיטה זו מבוססת על העובדה כי עכברים ובני אדם חולקים רשת כלי דם תוך גולגולתית דומה, המכונה המעגל של ויליס.
להערכה לאחר הניתוח ולציון של SAH במודל העכבר, הוצעו גישות שונות. Sugawara et al. פיתחו סולם דירוג שנמצא בשימוש נרחב מאז 200817. שיטה זו מעריכה את חומרת ה-SAH בהתבסס על שינויים מורפולוגיים. עם זאת, עבור שיטה זו, יש לבחון את המורפולוגיה של רקמת המוח של העכבר תחת ראייה ישירה, ולכן יש להקריב את העכבר לצורך הערכה. יתר על כן, נקבעו מספר שיטות לקביעת חומרת SAH in vivo. הגישות נעות בין ניקוד נוירולוגי פשוט לניטור של לחץ תוך גולגולתי (ICP) ועד טכניקות הדמיה רדיולוגיות שונות. יתר על כן, דירוג MRI הוכח ככלי חדש ולא פולשני לדירוג חומרת SAH, בקורלציה לציון נוירולוגי18,19.
כאן מוצג פרוטוקול למודל SAH הנגרם על ידי ניקוב אנדווסקולרי, בשילוב עם MRI לאחר הניתוח. בניסיון להקים מערכת שתחפצן את כמות הדימום בסביבת in vivo , פיתחנו גם מערכת לדירוג SAH וכימות של נפח הדם הכולל בהתבסס על MRI משוקלל T2 ברזולוציה גבוהה של 7.0 T. גישה זו מבטיחה אינדוקציה נכונה של SAH והדרה של פתולוגיות אחרות כגון שבץ, הידרוצפלוס, או דימום תוך-מוחי (ICH) וסיבוכים.
Protocol
הניסויים בוצעו בהתאם להנחיות ולתקנות שנקבעו על ידי Landesamt fuer Gesundheit und Soziales (LaGeSo), ברלין, גרמניה (G0063/18). במחקר זה נעשה שימוש בעכברים זכרי C57Bl/6J (בני 8-12 שבועות) במשקל של 25 ± 0.286 גרם (ממוצע ± s.e.m.).
1. הכנת בעלי חיים
- לגרום להרדמה על ידי הזרקת קטמין (70 מ"ג/ק"ג) וקסילזין (16 מ"ג/ק"ג) באופן תוך-צפקי. לשמור על טמפרטורת גוף תקינה, ותורם להשראה מהירה של הרדמה עמוקה. בדוק טשטוש נאות עם גירוי כאב, כגון צביטה בבוהן, ואמת את היעדר התגובה.
- גילחו בזהירות את שיער הצוואר של העכבר באמצעות סכין גילוח, נקו אותו עם 70% אתנול ואחריו בטאדין/כלורהקסידין, והניחו 1% לידוקאין על פני העור לשליטה מקומית בכאב.
- מקם את העכבר במצב שכיבה. השתמש בסרט כדי לתקן את הגפיים והזנב, מותח בעדינות את עור הצוואר לצד הנגדי של הניתוח. במקביל, הרם מעט את הצוואר.
- השתמש במשחה אופתלמית (למשל, 5% דקספנטנול) כדי למנוע התייבשות של העיניים במהלך הניתוח.
2. אינדוקציה של SAH
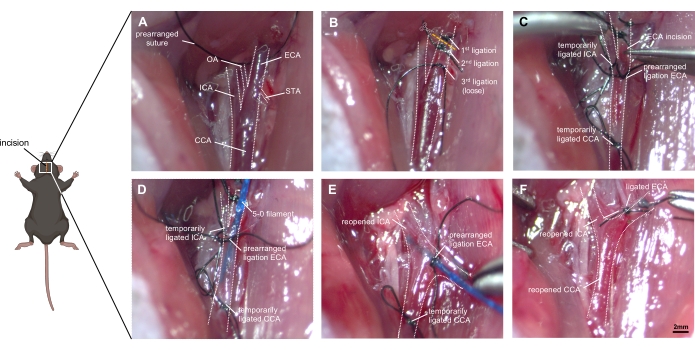
איור 1: תמונות שלב אחר שלב של טכניקה כירורגית. (A) תיאור האנטומיה של עורק הצוואר הימני החשוף: ה-CCA והביפורקציה שלו ל-ICA ול-ECA מזוהים, כמו גם הענפים הקטנים של ה-ECA (OA ו-STA). (B) ה-ECA מגויס מהרקמה הסובבת אותו ונקשר לשני תפרים לפני שהוא חותך אותו. יש למקם קשירה שלישית באופן רופף ליד הביפורקציה מבלי לחסום אותה. (C) ה-ICA וה-CCA מוסתרים באופן זמני (עם קשירת קשר או קליפים) כדי למנוע דימום מוגזם כאשר ה-ECA מסתתר בקפידה. (D) החוט מוכנס לתוך ה-ECA ומתקדם לתוך ה-CCA. יש להדק בזהירות את הקשירה שנקבעה מראש, כך שלא תתרחש התלקחות דם, אך קידום החוט נותר אפשרי. (E) ה-ICA וה-CCA נפתחים מחדש, ויש להתאים את גדם ה-ECA לכיוון הגולגולת. על ידי דחיפת החוט ~ 9 מ"מ קדימה לתוך ה- ICA, תגיע ל- ACA-MCA bifurcation, ולאחר מכן כלי השיט מחורר על ידי דחיפת החוט ~ 3 מ"מ עוד יותר. (ו) החוט נסוג לאחר שהבטיח קשירת קשר מחדש זמנית של ה-CCA. הקשירה שנקבעה מראש של ה-ECA נחסמת במהירות, וה-CCA נפתח מחדש כדי לאפשר רה-פוזה. קיצורים: ACA = עורק מוחי קדמי, CCA = עורק הצוואר הנפוץ, ECA = עורק הצוואר החיצוני, MCA = עורק המוח האמצעי, ICA = עורק הצוואר הפנימי, OA = עורק העורק העורפי, PPA = עורק פטריגופאלטין, STA = עורק בלוטת התריס העליון. סרגל קנה מידה = 2 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- פתחו את עור הצוואר עם אזמל סטרילי, מהסנטר ועד לקצה העליון של עצם החזה (1.5 ס"מ), והפרידו באופן בוטה את בלוטות הרוק מרקמת החיבור הסובבת אותן.
- הפרד את קבוצת השרירים לאורך צד אחד [במקרה זה, הצד הימני] של קנה הנשימה, וחושף את נדן עורק הצוואר הנפוץ (CCA) המכוסה בכלי דם מזינים ובצמחים. ה- CCA והעצב הוואגלי ממוקמים בסמיכות זה לזה.
- נתקו את ה-CCA והשאירו 8-0 חופשי תפר משי סביב ה-CCA מבלי לקשור אותו מראש. שימו לב להגנה על העצב הוואגלי, מכיוון שהוא ניזוק בקלות (איור 1A).
- ביפורקציה משולשת של ה-CCA, ה-ICA וה-ECA נראית לאורך השליש האחורי התחתון של הדיאסטזיס. נתחו את הקצה הדיסטלי של ה-ECA וליקטו את כלי השיט פי שניים ככל האפשר בצורה דיסטלית.
- נתקו את ה-ECA בנקודת האמצע של הקטע שנקשר פעמיים, ויצרו גדם כלי שיט.
- קבעו מראש קשירת קשירת נימה אחת עבור החוט סביב גדם ה-ECA, אל תסגרו אותה עד להחדרת נימה מוצלחת.
- השתמשו בתפר או במיקרו קליפ כדי לחסום את ה-ICA וה-CCA באופן זמני (איור 1B).
- בצע חתך קטן (כמחצית מקוטר ה- ECA) ב- ECA באמצעות מספריים מיקרו-וסקולריים. הכנס נימה של 5-0 (לחלופין 4-0) לתוך ה-ECA והקדם אותה ל-CCA.
- סגור מעט את הליגטורה ב-ECA תוך שחרור קליפ המיקרו ב-ICA וב-CCA (איור 1C).
- משכו בעדינות לאחור את החוט והתאימו את גדם ה-ECA לכיוון הגולגולת, והכניסו את החוט דרך הביפורקציה לתוך ה-ICA (איור 1D).
- כוון את קצה הנימה בזווית של ~30° לקו האמצע של קנה הנשימה ו~30° למישור האופקי. לדחוף את החוט קדימה בתוך ה- ICA. לאחר ההגעה לביפורקציה ACA-MCA, נתקלים בהתנגדות (~9 מ"מ).
- הקדמו את החוט 3 מ"מ עוד יותר, תוך ניקוב ה-ACA הנכון. מיד למשוך את החוטים לגדם ECA, ומאפשר זרימת דם לתוך החלל subarachnoid.
- שמור את החוט במצב זה למשך כ-10 שניות (איור 1E). נוכחות של רעידות שרירים, מיוזה איפסילטרלית, גזים לנשימה, שינוי בקצב הלב ובריחת שתן יכולים לתמוך בעדות לניתוח מוצלח.
- סגור באופן זמני את ה- CCA כדי למנוע אובדן דם עודף. שלפו את החוטים באופן מיידי ושחררו את ה-ECA עם התפר שנקבע מראש. פתחו מחדש את ה-CCA ואפשרו רפרפוזיה והתפשטות נוספת של דם לתוך החלל התת-עכבישי (איור 1F).
- לאחר בדיקת דליפת דימום, יש לחטא את העור המקיף את הפצע כדי למנוע זיהומים בעור לאחר הניתוח, ולתפור את הפצע בתפר שאינו נספג מסיבי פוליאסטר 4-0.
- מניחים את העכבר בקופסה תרמית עד שהתודעה חוזרת. המתן עד שהחיה תהיה ערה לחלוטין וודא שהיא חזרה להכרה מספקת כדי לשמור על התאוששות החזה. אל תחזירו בעלי חיים לחברתם של עכברים אחרים עד להתאוששות מלאה.
- תנו אקמול במשקל גוף של 200-300 מ"ג/ק"ג לשיכוך כאבים לאחר הניתוח.
- בדקו את העכברים מדי יום לאחר הניתוח.
3. מדידת MRI
- 24 שעות לאחר הניתוח, בצעו MRI באמצעות סורק מכרסמים (טבלת חומרים) ותהודת ראש עכבר ייעודית - כאן נעשה שימוש בתהודה מרובעת של 20 מ"מ של שידור/קליטה.
- הניחו את העכבר על שמיכת מים מחוממת במחזור כדי להבטיח טמפרטורת גוף קבועה של כ-37 מעלות צלזיוס. לגרום הרדמה עם 2.5% איזופלורן בתערובת O2/N2O (30%/70%) ולשמור עם 1.5-2% איזופלורן באמצעות מסכת פנים תחת ניטור אוורור רציף.
- תחילה בצע סריקת ייחוס מהירה לרכישת 3 חבילות פרוסה אורתוגונליות (Tri-Pilot-Multi, FLASH עם זמן חזרה TR/echo time TE = 200 ms/3 ms, 1 ממוצע, זווית היפוך FA = 30°, שדה ראייה FOV = 28 מ"מ x 28 מ"מ, מטריצה MTX = 256 x 256, עובי פרוסה 1 מ"מ, זמן רכישה כולל TA = 30 s).
- לאחר מכן השתמש ברצף ספין-הד טורבו דו-ממדי משוקלל T2 להדמיה (פרמטרי הדמיה TR/TE = 5505 ms/36 ms, גורם נדיר 8, 6 ממוצעים, 46 פרוסות ציריות רציפות עם עובי פרוסה של 0.35 מ"מ כדי לכסות את כל המוח, FOV = 25.6 מ"מ x 25.6 מ"מ, MTX = 256 x 256, TA = 13 דקות).
- אם התוצאה אינה ברורה, השתמש ברצף הדים הדרגתי משוקלל T2* משוקלל המופעל על ידי נשימה נוספת עם אותה איזודיסטנציה כמו סריקת T2w (2D FLASH, TR/TE = 600 ms/6.3 ms, FA = 30°, 1 ממוצע, 20 פרוסות ציריות בעובי של 0.35 מ"מ, FOV ו- MTX זהים ל- T2w, TA = 5-10 דקות בהתאם לקצב הנשימה).
- העבר את הנתונים לפורמט התמונה DICOM והשתמש בתוכנת ImageJ לדירוג SAH ונפח של קרישי דם. פרטים על הכימות מפורטים כמדריך שלב אחר שלב בחומר המשלים (איור משלים 1).
תוצאות
התמותה
לצורך מחקר זה, 92 עכברי C57Bl/6J זכרים בגילאי 8-12 שבועות עברו ניתוח SAH; באלה ראינו שיעור תמותה כולל של 11.9% (n = 12). התמותה התרחשה אך ורק בתוך 6-24 השעות הראשונות לאחר הניתוח, מה שמרמז על תמותה פריאופרטיבית כמו גם על דימום SAH עצמו כגורמים התורמים הסבירים ביותר.
ציון ד...
Discussion
לסיכום, מודל עכבר SAH סטנדרטי המושרה על ידי פעולת ניקוב נימה אנדווסקולרית מוצג עם פלישה קלה, זמן ניתוח קצר ושיעורי תמותה מקובלים. MRI מתבצע 24 שעות לאחר הניתוח כדי להבטיח את אתר הדימום הנכון ואת ההדרה של פתולוגיות תוך גולגולתיות רלוונטיות אחרות. יתר על כן, סיווגנו ציוני דימום שונים של SAH ומדדנו ...
Disclosures
אין ניגודי עניינים
Acknowledgements
SL נתמכה על ידי מועצת המלגות הסינית. KT נתמך על ידי מלגת BIH-MD של המכון לבריאות בברלין וקרן זוננפלד. RX נתמך על ידי תוכנית המדענים הקלינאים BIH-Charité, הממומנת על ידי ארגון הצדקה -Universitätsmedizin ברלין והמכון לבריאות של ברלין. אנו מכירים בתמיכה של קרן המחקר הגרמנית (DFG) וקרן הפרסום בגישה פתוחה של צדקה - אוניברסיטת ברלין.
Materials
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
References
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved