Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Endovaskuläres Perforationsmodell für Subarachnoidalblutungen in Kombination mit Magnetresonanztomographie (MRT)
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein standardisiertes SAH-Mausmodell, induziert durch endovaskuläre Filamentperforation, kombiniert mit Magnetresonanztomographie (MRT) 24 h nach der Operation, um die korrekte Blutungsstelle zu gewährleisten und andere relevante intrakranielle Pathologien auszuschließen.
Zusammenfassung
Das endovaskuläre Filamentperforationsmodell zur Nachahmung von Subarachnoidalblutungen (SAH) ist ein häufig verwendetes Modell - die Technik kann jedoch eine hohe Sterblichkeitsrate sowie ein unkontrollierbares Volumen von SAH und anderen intrakraniellen Komplikationen wie Schlaganfall oder intrakranielle Blutung verursachen. In diesem Protokoll wird ein standardisiertes SAH-Mausmodell vorgestellt, das durch endovaskuläre Filamentperforation induziert wird, kombiniert mit Magnetresonanztomographie (MRT) 24 Stunden nach der Operation, um die korrekte Blutungsstelle sicherzustellen und andere relevante intrakranielle Pathologien auszuschließen. Kurz gesagt, C57BL / 6J-Mäuse werden mit einer intraperitonealen Ketamin / Xylazin-Injektion (70 mg / 16 mg / kg Körpergewicht) betäubt und in Rückenlage gebracht. Nach dem Mittellinienhalsschnitt werden die gemeinsame Halsschlagader (CCA) und die Carotis-Bifurkation freigelegt, und eine 5-0 nicht resorbierbare monofile Polypropylennaht wird retrograd in die äußere Halsschlagader (ECA) eingeführt und in die gemeinsame Halsschlagader vorgeschoben. Dann wird das Filament in die innere Halsschlagader (ICA) eindringt und nach vorne gedrückt, um die vordere Hirnarterie (ACA) zu perforieren. Nach der Genesung von der Operation unterziehen sich die Mäuse 24 Stunden später einer 7,0-T-MRT. Das Blutungsvolumen kann über die postoperative MRT quantifiziert und abgestuft werden, was eine robuste experimentelle SAH-Gruppe mit der Möglichkeit ermöglicht, weitere Subgruppenanalysen basierend auf der Blutmenge durchzuführen.
Einleitung
Die Subarachnoidalblutung (SAH) wird durch den Bruch eines intrakraniellen Aneurysmas verursacht und stellt einen lebensbedrohlichen Notfall dar, der mit einer erheblichen Morbidität und Mortalität verbunden ist und ca. 5% der Schlaganfälle ausmacht 1,2. SAH-Patienten mit starken Kopfschmerzen, neurologischen Funktionsstörungen und fortschreitenden Bewusstseinsstörungen3. Rund 30% der SAH-Patienten sterben innerhalb der ersten 30 Tage nach dem ersten Blutungsereignis4. Klinisch erleben 50% der Patienten eine verzögerte Hirnverletzung (DBI) nach einer frühen Hirnverletzung. DBI ist gekennzeichnet durch verzögerte zerebrale Ischämie und verzögerte neurologische Defizite. Aktuelle Studien haben gezeigt, dass die synergistischen Effekte mehrerer verschiedener Faktoren zum Verlust der neurologischen Funktion führen, einschließlich der Zerstörung der Blut-Hirn-Schranke, der Kontraktion kleiner Arterien, mikrozirkulatorischer Dysfunktion und Thrombose 5,6.
Ein einzigartiger Aspekt von SAH ist, dass die Pathogenese von einer extraparenchymalen Stelle ausgeht, dann aber zu schädlichen Kaskaden innerhalb des Parenchyms führt: Die Pathologie beginnt mit der Ansammlung von Blut im Subarachnoidalraum, die eine Vielzahl von intraparenchymalen Effekten auslöst, wie Neuroinflammation, neuronale und Endothelzellapoptose, kortikale Ausbreitungsdepolarisation und Hirnödembildung7, 8.
Die klinische Forschung ist durch mehrere Faktoren begrenzt, was das Tiermodell zu einem kritischen Element macht, um die pathomechanistischen Veränderungen der Krankheit konsistent und genau nachzuahmen. Verschiedene SAH-Modellprotokolle wurden vorgeschlagen, z.B. autologe Blutinjektion in die Cisterna magna (ACM). Auch eine modifizierte Methode mit einer doppelten Injektion von autologem Blut in die Cisterna magna und die optische Chiasmzisterne (APC) bzw. 9,10. Während die autologe Blutinjektion eine einfache Möglichkeit ist, den pathologischen Prozess des Vasospasmus und der Entzündungsreaktionen nach Subarachnoidalblutungen zu simulieren, ist der folgende Anstieg des intrakraniellen Drucks (ICP) relativ langsam, und es werden keine nennenswerten Veränderungen der Durchlässigkeit der Blut-Hirn-Schranke induziert11,12. Eine andere Methode, die periarterielle Blutplatzierung, die normalerweise in großen SAH-Modellen (z. B. Affen und Hunden) verwendet wird, besteht darin, antikoaguliertes Eigenblut oder vergleichbare Blutprodukte um das Gefäß herum zu platzieren. Die Durchmesseränderungen der Arterie können mit einem Mikroskop beobachtet werden, das als Indikator für den zerebralen Vasospasmus nach SAH13 dient.
Barry et al. beschrieben erstmals 1979 ein endovaskuläres Perforationsmodell, bei dem die Arteria basilaris nach Entfernung des Schädels freigelegt wird; Die Arterie wird dann mit Wolfram-Mikroelektroden punktiert, wobei eine mikroskopische stereotaktische Technik14 verwendet wird. 1995 modifizierten Bederson und Veelken das Zea-Longa-Modell der zerebralen Ischämie und etablierten die endovaskuläre Perforation, die seit15,16 kontinuierlich verbessert wurde. Diese Methode basiert auf der Tatsache, dass Mäuse und Menschen ein ähnliches intrakranielles Gefäßnetzwerk teilen, das als Kreis von Willis bekannt ist.
Für die postoperative Auswertung und Einstufung von SAH im Mausmodell wurden verschiedene Ansätze vorgeschlagen. Sugawara et al. entwickelten eine Notenskala, die seit 2008 weit verbreitet ist17. Diese Methode bewertet den Schweregrad von SAH basierend auf morphologischen Veränderungen. Für diese Methode muss jedoch die Morphologie des Hirngewebes der Maus unter direkter Sicht untersucht werden, und daher muss die Maus für die Beurteilung geopfert werden. Darüber hinaus wurden mehrere Methoden zur Bestimmung des SAH-Schweregrads in vivo etabliert. Die Ansätze reichen von der einfachen neurologischen Bewertung über die Überwachung des intrakraniellen Drucks (ICP) bis hin zu verschiedenen radiologischen Bildgebungsverfahren. Darüber hinaus hat sich gezeigt, dass die MRT-Einstufung ein neues, nicht-invasives Werkzeug zur Einstufung des SAH-Schweregrads ist, das mit dem neurologischen Score18,19 korreliert.
Hier wird ein Protokoll für ein SAH-Modell vorgestellt, das durch endovaskuläre Perforation verursacht wird, kombiniert mit postoperativer MRT. In einem Versuch, ein System zur Objektivierung der Blutungsmenge in einer In-vivo-Umgebung zu etablieren, entwickelten wir auch ein System zur SAH-Einstufung und Quantifizierung des Gesamtblutvolumens basierend auf einer hochauflösenden T2-gewichteten MRT von 7,0 T. Dieser Ansatz gewährleistet die korrekte Induktion von SAH und den Ausschluss anderer Pathologien wie Schlaganfall, Hydrocephalus oder intrazerebraler Blutung (ICH) und Komplikationen.
Protokoll
Die Experimente wurden nach den Richtlinien und Vorschriften des Landesamtes für Gesundheit und Soziales (LaGeSo), Berlin, Deutschland (G0063/18), durchgeführt. In dieser Studie wurden C57Bl/6J männliche (8-12 Wochen alte) Mäuse mit einem Gewicht von 25 ± 0,286 g (durchschnittlich ± s.e.m.) verwendet.
1. Tierpräparation
- Induzieren Sie eine Anästhesie, indem Sie Ketamin (70 mg/kg) und Xylazin (16 mg/kg) intraperitoneal injizieren. Halten Sie eine normale Körpertemperatur aufrecht und tragen Sie zur schnellen Einführung einer tiefen Anästhesie bei. Testen Sie eine angemessene Sedierung mit einem Schmerzreiz, wie z. B. einer Zehenklemme, und überprüfen Sie das Fehlen einer Reaktion.
- Rasieren Sie vorsichtig die Nackenhaare der Maus mit einem Rasierer, reinigen Sie sie mit 70% Ethanol, gefolgt von Betadin / Chlorhexidin, und tragen Sie 1% Lidocain auf die Hautoberfläche zur lokalen Schmerzkontrolle auf.
- Stellen Sie die Maus in Rückenlage. Verwenden Sie Klebeband, um die Gliedmaßen und den Schwanz zu fixieren, und dehnen Sie die Haut des Halses sanft auf die gegenüberliegende Seite der Operation. Heben Sie gleichzeitig den Hals leicht an.
- Verwenden Sie Augensalbe (z. B. 5% Dexpanthenol), um eine Austrocknung der Augen während der Operation zu verhindern.
2. SAH-Induktion
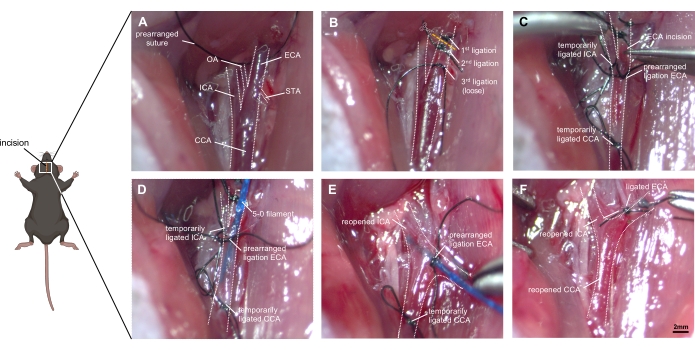
Abbildung 1: Schritt-für-Schritt-Bilder der Operationstechnik. (A) Darstellung der exponierten Anatomie der rechten Halsschlagader: Die CCA und ihre Verzweigung in ICA und ECA werden ebenso identifiziert wie die kleinen Zweige der ECA (OA und STA). (B) Die ECA wird aus dem umgebenden Gewebe mobilisiert und mit zwei Nähten ligiert, bevor sie geschnitten wird. Eine dritte Ligatur muss lose in der Nähe der Bifurkation platziert werden, ohne sie zu verschließen. (C) Die ICA und CCA werden vorübergehend (entweder mit Ligatur oder Clips) verschlossen, um übermäßige Blutungen zu verhindern, wenn die ECA sorgfältig eingeschnitten wird. D) Das Filament wird in den EuRH eingefügt und in das CCA aufgenommen. Die vorarrangierte Ligatur muss vorsichtig angezogen werden, damit kein Bluterguss auftritt, aber das Vorrücken des Filaments möglich bleibt. (E) Die ICA und CCA werden wieder geöffnet, und der ECA-Stumpf muss in eine Schädelrichtung angepasst werden. Durch Drücken des Filaments ~ 9 mm nach vorne in die ICA wird die ACA-MCA-Bifurkation erreicht, und das Gefäß wird dann perforiert, indem das Filament ~ 3 mm weiter gedrückt wird. (F) Das Filament wird zurückgezogen, nachdem eine zeitliche Religation des CCA sichergestellt wurde. Die vorab vereinbarte Ligatur der ECA wird schnell verschlossen, und die CCA wird wieder geöffnet, um eine Reperfusion zu ermöglichen. Abkürzungen: ACA = Arteria cerebralis anterior, CCA = gemeinsame Halsschlagader, ECA = Arteria carotis externe, MCA = mittlere Hirnarterie, ICA = Arteria carotis interna, OA = Arteria occipitalis, PPA = Arteria pterygopalatine, STA = Arteria thyreoidea superior. Maßstabsleiste = 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Öffnen Sie die Halshaut mit einem sterilen Skalpell vom Kinn bis zum oberen Rand des Brustbeins (1,5 cm) und trennen Sie die Speicheldrüsen stumpf von ihrem umgebenden Bindegewebe.
- Trennen Sie die Muskelgruppe entlang einer Seite [in diesem Fall der rechten Seite] der Luftröhre und legen Sie die Scheide der gemeinsamen Halsschlagader (CCA) frei, die mit nährenden Blutgefäßen und Venolen bedeckt ist. Der CCA und der Vagusnerv befinden sich in unmittelbarer Nähe zueinander.
- Dissoziieren Sie die CCA und lassen Sie ein freies 8-0 Seidennaht um den CCA, ohne ihn vorher zu befestigen. Achten Sie auf den Schutz des Vagusnervs, da er leicht beschädigt wird (Abbildung 1A).
- Eine dreifache Verzweigung der CCA, der ICA und der ECA ist entlang des unteren hinteren Drittels der Diastase sichtbar. Sezieren Sie das distale Ende des ECA und ligrieren Sie das Gefäß doppelt so weit wie möglich.
- Trennen Sie die ECA in der Mitte des doppelt ligierten Segments, wodurch ein Gefäßstumpf entsteht.
- Ordnen Sie eine Ligatur für das Filament um den ECA-Stumpf vor, schließen Sie sie nicht bis zum erfolgreichen Einsetzen des Filaments.
- Verwenden Sie eine Naht oder einen Mikroclip, um die ICA und CCA vorübergehend zu verschließen (Abbildung 1B).
- Machen Sie einen kleinen Schnitt (etwa die Hälfte des ECA-Durchmessers) in der ECA mit einer Mikrogefäßschere. Fügen Sie ein 5-0 (alternativ 4-0) Prolene-Filament in die ECA ein und schieben Sie es in die CCA.
- Schließen Sie die Ligatur auf der ECA leicht, während Sie den Mikroclip am ICA und CCA lösen (Abbildung 1C).
- Ziehen Sie das Filament vorsichtig zurück und stellen Sie den ECA-Stumpf in Schädelrichtung ein, wobei Sie das Filament durch die Bifurkation in die ICA eindringen (Abbildung 1D).
- Richten Sie die Filamentspitze medial in einem Winkel von ~30° zur trachealen Mittellinie und ~30° zur horizontalen Ebene. Schieben Sie das Filament im ICA nach vorne. Nach Erreichen der ACA-MCA-Bifurkation trifft man auf Widerstand (~9 mm).
- Schieben Sie das Filament 3 mm weiter vor, perforieren Sie den richtigen ACA. Ziehen Sie das Filament sofort in den ECA-Stumpf zurück, damit Blut in den Subarachnoidalraum fließen kann.
- Halten Sie das Filament etwa 10 s in dieser Position (Abbildung 1E). Das Vorhandensein von Muskelzittern, ipsilateraler Miose, Atemgassen, verändertem Herzrhythmus und Harninkontinenz kann ein Beweis für eine erfolgreiche Operation sein.
- Schließen Sie die CCA vorübergehend, um einen übermäßigen Blutverlust zu vermeiden. Ziehen Sie das Filament sofort heraus und ligiieren Sie die ECA mit der vorgefertigten Naht. Öffnen Sie die CCA erneut und lassen Sie die Reperfusion und den weiteren Erguss von Blut in den Subarachnoidalraum zu (Abbildung 1F).
- Nach der Überprüfung auf Blutungsleckagen desinfizieren Sie die Haut, die die Wunde umgibt, um postoperative Hautinfektionen zu verhindern, und nähen Sie die Wunde mit einer nicht resorbierbaren 4-0-Polyesterfasernaht.
- Legen Sie die Maus in eine Thermobox, bis das Bewusstsein wiedererlangt ist. Warten Sie, bis das Tier vollständig wach ist, und stellen Sie sicher, dass es wieder genügend Bewusstsein erlangt hat, um die sternale Liege aufrechtzuerhalten. Geben Sie die Tiere erst dann in die Gesellschaft anderer Mäuse zurück, wenn sie vollständig genesen sind.
- Verabreichen Sie 200-300 mg / kg Körpergewicht Paracetamol zur postoperativen Schmerzlinderung.
- Überprüfen Sie die Mäuse täglich nach der Operation.
3. MRT-Messung
- Führen Sie 24 Stunden nach der Operation eine MRT mit einem Nagetierscanner (Table of Materials) und einem speziellen Mauskopfresonator durch - hier wurde ein 20 mm Sende- / Empfangsquadraturvolumenresonator verwendet.
- Legen Sie die Maus auf eine beheizte Umlaufwasserdecke, um eine konstante Körpertemperatur von ~37 °C zu gewährleisten. Induzieren Sie eine Anästhesie mit 2,5 % Isofluran in einem O2/N2O-Gemisch (30 %/70 %) und halten Sie mit 1,5-2 % Isofluran über Gesichtsmaske unter kontinuierlicher Beatmungsüberwachung aufrecht.
- Führen Sie zunächst einen schnellen Referenzscan durch, indem Sie 3 orthogonale Slice-Pakete erfassen (Tri-Pilot-Multi, FLASH mit Wiederholungszeit TR/Echo-Zeit TE = 200 ms/3 ms, 1 Durchschnitt, Flip-Winkel FA = 30°, Sichtfeld FOV = 28 mm x 28 mm, Matrix MTX = 256 x 256, Schichtdicke 1 mm, Gesamterfassungszeit TA = 30 s).
- Verwenden Sie dann eine hochauflösende T2-gewichtete 2D-Turbo-Spin-Echo-Sequenz für die Bildgebung (Bildgebungsparameter TR/TE = 5505 ms/36 ms, RARE-Faktor 8, 6 Mittelwerte, 46 zusammenhängende axiale Scheiben mit einer Schichtdicke von 0,35 mm, um das gesamte Gehirn abzudecken, FOV = 25,6 mm x 25,6 mm, MTX = 256 x 256, TA = 13 min).
- Wenn das Ergebnis unklar ist, verwenden Sie eine zusätzliche durch Atmung ausgelöste T2*-gewichtete Gradientenechosequenz mit dem gleichen Isoabstand wie der T2w-Scan (2D-BLITZ, TR/TE = 600 ms/6,3 ms, FA = 30°, 1 Durchschnitt, 20 axiale Scheiben mit 0,35 mm Dicke, FOV und MTX identisch mit T2w, TA = 5-10 min je nach Atemfrequenz).
- Übertragen Sie die Daten in das DICOM-Bildformat und verwenden Sie die ImageJ-Software für die SAH-Sortierung und Volumetrie von Blutgerinnseln. Details zur Quantifizierung sind als Schritt-für-Schritt-Anleitung im Ergänzungsmaterial aufgeführt (Ergänzende Abbildung 1).
Ergebnisse
Sterblichkeit
Für diese Studie wurden insgesamt 92 männliche C57Bl/6J-Mäuse im Alter zwischen 8 und 12 Wochen einer SAH-Operation unterzogen; In diesen beobachteten wir eine Gesamtsterblichkeitsrate von 11,9% (n = 12). Die Mortalität trat ausschließlich innerhalb der ersten 6-24 Stunden nach der Operation auf, was auf die perioperative Mortalität sowie die SAH-Blutung selbst als die wahrscheinlichsten beitragenden Faktoren hindeutet.
SAH Blutungsgrad<...
Diskussion
Zusammenfassend lässt sich sagen, dass ein standardisiertes SAH-Mausmodell, das durch endovaskuläre Filamentperforationsoperationen induziert wird, mit geringer Invasion, kurzer Operationszeit und akzeptablen Mortalitätsraten präsentiert wird. Die MRT wird 24 h postoperativ durchgeführt, um die korrekte Blutungsstelle und den Ausschluss anderer relevanter intrakranieller Pathologien zu gewährleisten. Darüber hinaus klassifizierten wir verschiedene SAH-Blutungsgrade und maßen Blutungsvolumina, was weitere Subgrupp...
Offenlegungen
Keine Interessenkonflikte
Danksagungen
SL wurde vom Chinese Scholarship Council unterstützt. KT wurde durch das BIH-MD-Stipendium des Berliner Instituts für Gesundheitsforschung und der Sonnenfeld-Stiftung gefördert. RX wird durch das BIH-Charité Clinician Scientist Program gefördert, das von der Charité-Universitätsmedizin Berlin und dem Berliner Institut für Gesundheitsforschung gefördert wird. Wir bedanken uns für die Unterstützung der Deutschen Forschungsgemeinschaft (DFG) und des Open-Access-Publikationsfonds der Charité - Universitätsmedizin Berlin.
Materialien
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
Referenzen
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten