Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Manyetik Rezonans Görüntüleme (MRG) ile Kombine Subaraknoid Kanama için Endovasküler Perforasyon Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, doğru kanama bölgesini sağlamak ve diğer ilgili intrakraniyal patolojileri dışlamak için operasyondan 24 saat sonra manyetik rezonans görüntüleme (MRG) ile kombine edilen endovasküler filament perforasyonu ile indüklenen standartlaştırılmış bir SAH fare modeli sunulmaktadır.
Özet
Subaraknoid kanamayı (SAK) taklit etmek için endovasküler filament perforasyon modeli yaygın olarak kullanılan bir modeldir - ancak teknik, yüksek mortalite oranının yanı sıra kontrol edilemeyen bir SAH hacmine ve inme veya intrakraniyal kanama gibi diğer intrakraniyal komplikasyonlara neden olabilir. Bu protokolde, doğru kanama bölgesini sağlamak ve diğer ilgili intrakraniyal patolojileri dışlamak için ameliyattan 24 saat sonra manyetik rezonans görüntüleme (MRG) ile kombine edilmiş, endovasküler filament perforasyonu ile indüklenen standartlaştırılmış bir SAH fare modeli sunulmaktadır. Kısaca C57BL/6J fareler intraperitoneal ketamin/ksilazin (70 mg/16 mg/kg vücut ağırlığı) enjeksiyonu ile uyuşturulur ve sırtüstü pozisyona yerleştirilir. Orta hat boyun insizyonundan sonra, ortak karotis arter (CCA) ve karotis bifurkasyonu açığa çıkar ve 5-0 emilemeyen monofilament polipropilen sütür, retrograd bir şekilde eksternal karotis artere (ECA) yerleştirilir ve ortak karotis artere ilerletilir. Daha sonra, filament internal karotis artere (ICA) invagine edilir ve anterior serebral arteri (ACA) delmek için ileri itilir. Ameliyattan iyileştikten sonra, fareler 24 saat sonra 7.0 T MRG'ye tabi tutulur. Kanama hacmi, postoperatif MRG ile ölçülebilir ve derecelendirilebilir, bu da kan miktarına göre daha fazla alt grup analizi yapma seçeneği ile sağlam bir deneysel SAH grubu sağlar.
Giriş
Subaraknoid kanama (SAK), intrakraniyal anevrizmanın rüptürü sonucu oluşur ve hayatı tehdit eden acil bir durum oluşturur ve inmelerin yaklaşık %5'ini oluşturan önemli morbidite ve mortalite ile ilişkilidir1,2. SAH hastaları şiddetli baş ağrısı, nörolojik disfonksiyon ve ilerleyici bilinç bozukluğu ile başvururlar3. SAH hastalarının yaklaşık% 30'u ilk kanama olayından sonraki ilk 30 gün içinde ölür4. Klinik olarak, hastaların% 50'si erken beyin hasarından sonra gecikmiş beyin hasarı (DBI) yaşamaktadır. DBI gecikmiş serebral iskemi ve gecikmiş nörolojik defisitler ile karakterizedir. Mevcut çalışmalar, birkaç farklı faktörün sinerjik etkilerinin, kan-beyin bariyerinin tahrip olması, küçük arterlerin kasılması, mikrodolaşım bozukluğu ve tromboz dahil olmak üzere nörolojik fonksiyon kaybına yol açtığını göstermiştir 5,6.
SAH'ın benzersiz bir yönü, patogenezin ekstraparankimal bir lokalizasyondan kaynaklanması, ancak daha sonra parankim içinde zararlı kaskadlara yol açmasıdır: patoloji, subaraknoid boşlukta kan birikmesi ile başlar ve nöroinflamasyon, nöronal ve endotel hücre apoptozisi, kortikal yayılan depolarizasyon ve beyin ödemi oluşumu7 gibi çok sayıda intraparankimal etkiyi tetikler, 8.
Klinik araştırmalar çeşitli faktörlerle sınırlıdır ve hayvan modelini hastalığın pathomechanistic değişikliklerini tutarlı ve doğru bir şekilde taklit etmede kritik bir unsur haline getirmektedir. Farklı SAH model protokolleri önerilmiştir, örneğin, sarnıç magna (ACM) içine otolog kan enjeksiyonu. Ayrıca, sırasıyla 9,10 sarnıç magna ve optik kiazm sarnıcına (APC) otolog kan enjeksiyonu ile modifiye bir yöntem. Otolog kan enjeksiyonu, subaraknoid kanama sonrası vazospazm ve inflamatuar reaksiyonların patolojik sürecini simüle etmenin basit bir yolu olsa da, aşağıdaki kafa içi basınç (ICP) artışı nispeten yavaştır ve kan-beyin bariyerinin geçirgenliğinde kayda değer bir değişiklik indüklenmemiştir11,12. Başka bir yöntem, genellikle büyük SAH modellerinde (örneğin, maymunlar ve köpekler) kullanılan periarteriyel kan yerleşimi, damarın etrafına antikoagüle otolog kan veya karşılaştırılabilir kan ürünleri yerleştirmeyi içerir. Arterin çap değişiklikleri, SAH13'ten sonra serebral vazospazm için bir gösterge görevi gören mikroskopla gözlemlenebilir.
Barry ve ark. ilk olarak 1979'da kafatasını çıkardıktan sonra baziler arterin açığa çıktığı bir endovasküler perforasyon modelini tanımladılar; arter daha sonra mikroskobik stereotaktik teknik14 kullanılarak tungsten mikroelektrotlarla delinir. 1995 yılında Bederson ve Veelken, Zea-Longa serebral iskemi modelini değiştirdi ve 15,16'dan beri sürekli olarak iyileştirilen endovasküler perforasyonu kurdu. Bu yöntem, farelerin ve insanların, Willis'in çemberi olarak bilinen benzer bir kafa içi vasküler ağı paylaştığı gerçeğine dayanmaktadır.
Fare modelinde SAH'ın postoperatif değerlendirilmesi ve derecelendirilmesi için farklı yaklaşımlar önerilmiştir. Sugawara ve ark. 2008'den beri yaygın olarak kullanılan bir derecelendirme ölçeği geliştirmiştir17. Bu yöntem, morfolojik değişikliklere dayanarak SAH'ın şiddetini değerlendirir. Ancak bu yöntem için farenin beyin dokusu morfolojisi doğrudan görme altında incelenmeli ve bu nedenle farenin değerlendirme için feda edilmesi gerekir. Ayrıca, in vivo SAH şiddetini belirlemek için çeşitli yöntemler oluşturulmuştur. Yaklaşımlar basit nörolojik skorlamadan kafa içi basıncın (ICP) izlenmesine ve çeşitli radyolojik görüntüleme tekniklerine kadar uzanmaktadır. Ayrıca, MRG derecelendirmesi, nörolojik skor18,19 ile ilişkili olarak, SAH şiddetini derecelendirmek için yeni, invaziv olmayan bir araç olarak gösterilmiştir.
Burada, endovasküler perforasyonun neden olduğu bir SAH modeli için postoperatif MRG ile birlikte bir protokol sunulmaktadır. İn vivo bir ortamda kanama miktarını nesnelleştirmek için bir sistem kurmak amacıyla, 7.0 T yüksek çözünürlüklü T2 ağırlıklı MRG'ye dayanarak toplam kan hacminin SAH derecelendirilmesi ve nicelleştirilmesi için bir sistem geliştirdik. Bu yaklaşım, SAH'ın doğru indüklenmesini ve inme, hidrosefali veya intraserebral kanama (ICH) ve komplikasyonlar gibi diğer patolojilerin dışlanmasını sağlar.
Protokol
Deneyler, Landesamt fuer Gesundheit und Soziales (LaGeSo), Berlin, Almanya (G0063/18) tarafından belirlenen kılavuz ilkelere ve düzenlemelere uygun olarak gerçekleştirilmiştir. Bu çalışmada, 25 ± 0.286 g (ortalama ± s.e.m.) ağırlığında C57Bl/6J erkek (8-12 haftalık) fareler kullanılmıştır.
1. Hayvan hazırlığı
- İntraperitoneal olarak ketamin (70 mg/kg) ve ksilazin (16 mg/kg) enjekte edilerek anesteziyi indükleyin. Normal vücut ısısını koruyun, derin anestezinin hızlı indüksiyonuna katkıda bulunun. Ayak parmağı sıkışması gibi bir ağrı uyaranı ile yeterli sedasyonu test edin ve bir reaksiyonun yokluğunu doğrulayın.
- Farenin boyun kıllarını bir tıraş bıçağı ile dikkatlice tıraş edin,% 70 etanol ve ardından betadin / klorheksidin ile temizleyin ve lokal ağrı kontrolü için cilt yüzeyine% 1 lidokain uygulayın.
- Fareyi sırtüstü konuma getirin. Uzuvları ve kuyruğu sabitlemek için bant kullanın, boynun derisini ameliyatın karşı tarafına hafifçe gerin. Aynı zamanda, boynu hafifçe yükseltin.
- Operasyon sırasında gözlerin dehidrasyonunu önlemek için oftalmik merhem (örneğin,% 5 dekspantenol) kullanın.
2. SAH indüksiyonu
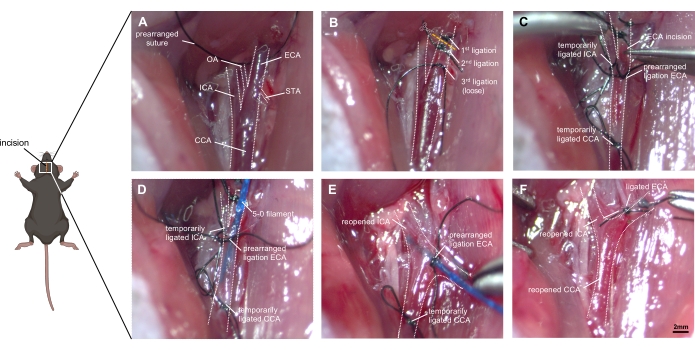
Şekil 1: Cerrahi tekniğin adım adım görüntüleri. (A) Maruz kalan sağ karotis arter anatomisinin tasviri: CCA ve ICA ve ECA'ya çatallanmasının yanı sıra ECA'nın küçük dalları (OA ve STA) tanımlanmıştır. (B) ECA, çevre dokudan mobilize edilir ve kesilmeden önce iki dikişle bağlanır. Üçüncü bir ligasyonun, çatallanmanın yakınında, tıkanmadan gevşek bir şekilde yerleştirilmesi gerekir. (C) ICAA ve CCA, ECA dikkatli bir şekilde kesildiğinde aşırı kanamayı önlemek için geçici olarak (ligasyon veya klipslerle) tıkanır. (D) Filament ECA'ya yerleştirilir ve CCA'ya ilerletilir. Önceden düzenlenmiş ligasyon dikkatlice sıkılmalıdır, böylece kan efüzyonu meydana gelmez, ancak filamentin ilerlemesi mümkün kalır. (E) ICA ve CCA yeniden açılır ve ECA kütüğünün kafatası yönüne ayarlanması gerekir. Filamenti ~9 mm ileriye doğru ICA'ya iterek, ACA-MCA çatallanmasına ulaşılacak ve daha sonra filaman ~ 3mm daha itilerek kap delinecektir. (F) Filament, CCA'nın zamansal olarak yeniden bağlanmasını sağladıktan sonra geri çekilir. ECA'nın önceden düzenlenmiş ligasyonu hızla tıkanır ve CCA reperfüzyona izin vermek için yeniden açılır. Kısaltmalar: ACA = anterior serebral arter, CCA = ortak karotis arter, ECA = eksternal karotis arter, MCA = orta serebral arter, ICA = internal karotis arter, OA = oksipital arter, PPA = pterygopalatine arter, STA = superior tiroid arter. Ölçek çubuğu = 2 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Boyun derisini çeneden göğüs kemiğinin üst kenarına (1,5 cm) kadar steril bir neşterle açın ve tükürük bezlerini çevreleyen bağ dokusundan açıkça ayırın.
- Kas grubunu trakeanın bir tarafı boyunca ayırın [bu durumda, sağ taraf] ve besleyici kan damarları ve venüllerle kaplı ortak karotis arter (CCA) kılıfını açığa çıkarın. CCA ve vagal sinir birbirine yakın konumdadır.
- CCA'yı ayrıştırın ve 8-0'lık ücretsiz bir skor bırakın CCA'nın etrafına önceden bağlamadan ipek dikiş. Vagal sinirin korunmasına dikkat edin, çünkü kolayca hasar görür (Şekil 1A).
- CCA, ICA ve ECA'nın üçlü çatallanması, diastazın alt posterior üçte biri boyunca görülebilir. ECA'nın distal ucunu disseke edin ve kabı mümkün olduğunca iki kat daha distaal olarak bağlayın.
- ECA'yı iki kez bağlanmış segmentin orta noktasında ayırın ve bir gemi kütüğü oluşturun.
- ECA kütüğünün etrafındaki filament için bir ligasyonu önceden ayarlayın, başarılı filament yerleştirmeye kadar kapatmayın.
- ICA ve CCA'yı geçici olarak tıkamak için bir dikiş veya mikro klips kullanın (Şekil 1B).
- Mikrovasküler makas kullanarak ECA'da küçük bir kesi (ECA çapının yaklaşık yarısı) yapın. ECA'ya 5-0 (alternatif olarak 4-0) prolene filament yerleştirin ve CCA'ya ilerletin.
- ICA ve CCA üzerindeki mikro klipsi gevşetirken ECA üzerindeki bağı hafifçe kapatın (Şekil 1C).
- Filamenti yavaşça geri çekin ve ECA kütüğünü kraniyal yönde ayarlayın, filamenti çatallanma yoluyla ICA'ya invagine edin (Şekil 1D).
- Filament ucunu medial olarak trakeal orta çizgiye ~30° ve yatay düzleme ~30° açıyla doğrultun. Filamenti ICA içinde ileri doğru itin. ACA-MCA bifurkasyonuna ulaştıktan sonra dirençle (~9 mm) karşılaşılır.
- Filamenti 3 mm daha ileri götürerek sağ ACA'yı delin. Filamenti derhal ECA kütüğüne çekin ve subaraknoid boşluğa kan akışına izin verin.
- Filamenti yaklaşık 10 s boyunca bu konumda tutun (Şekil 1E). Kas titremeleri, ipsilateral miyoz, nefes nefese kalma, değişmiş kalp ritmi ve idrar kaçırma varlığı başarılı cerrahinin kanıtlarını destekleyebilir.
- Aşırı kan kaybını önlemek için CCA'yı geçici olarak kapatın. Filamenti anında dışarı çekin ve ECA'yı önceden düzenlenmiş dikişle bağlayın. CCA'yı yeniden açın ve kanın subaraknoid boşluğa reperfüzyonuna ve daha fazla efüzyonuna izin verin (Şekil 1F).
- Kanama sızıntısını kontrol ettikten sonra, ameliyat sonrası cilt enfeksiyonlarını önlemek için yarayı çevreleyen cildi dezenfekte edin ve emilemeyen 4-0 polyester elyaf dikiş ile yarayı dikin.
- Bilinç yeniden kazanılana kadar fareyi termal bir kutuya yerleştirin. Hayvan tamamen uyanık olana kadar bekleyin ve sternal yassılığı korumak için yeterli bilinci yeniden kazandığından emin olun. Tamamen iyileşene kadar hayvanları diğer farelerin şirketine iade etmeyin.
- Postoperatif ağrı kesici için 200-300 mg / kg vücut ağırlığı parasetamol uygulayın.
- Ameliyattan sonra fareleri günlük olarak kontrol edin.
3. MRG ölçümü
- Ameliyattan 24 saat sonra, bir kemirgen tarayıcı (Malzeme Tablosu) ve özel bir fare kafası rezonatörü kullanarak MRG yapın - burada, 20 mm'lik bir gönderme / alma dörtgen hacim rezonatörü kullanıldı.
- ~37 °C'lik sabit bir vücut ısısı sağlamak için fareyi ısıtılmış bir dolaşımdaki su battaniyesinin üzerine yerleştirin. Bir O2/N2O karışımında (%30/%70) %2,5 izofluran ile anestezi indükleyin ve sürekli ventilasyon monitörizasyonu altında yüz maskesi aracılığıyla %1,5-2 izofluran ile devam ettirin.
- İlk önce 3 ortogonal dilim paketi elde ederek hızlı bir referans taraması yapın (Tri-Pilot-Multi, tekrarlama süresi TR/yankı süresi TE = 200 ms/3 ms, 1 ortalama, çevirme açısı FA = 30°, görüş alanı FOV = 28 mm x 28 mm, matris MTX = 256 x 256, dilim kalınlığı 1 mm, toplam edinme süresi TA = 30 s).
- Daha sonra görüntüleme için yüksek çözünürlüklü T2 ağırlıklı 2D turbo spin-echo dizisi kullanın (görüntüleme parametreleri TR/TE = 5505 ms/36 ms, RARE faktörü 8, 6 ortalama, tüm beyni kapsayacak şekilde 0,35 mm dilim kalınlığında 46 bitişik eksenel dilim, FOV = 25,6 mm x 25,6 mm, MTX = 256 x 256, TA = 13 dakika).
- Sonuç belirsizse, T2w taraması ile aynı izomesafeye sahip ek bir solunum tetiklemeli T2* ağırlıklı gradyan yankı dizisi kullanın (2D FLASH, TR/TE = 600 ms/6,3 ms, FA = 30°, 1 ortalama, 0,35 mm kalınlığında 20 eksenel dilim, T2w ile aynı FOV ve MTX, solunum hızına bağlı olarak TA = 5-10 dakika).
- Verileri DICOM görüntü formatına aktarın ve SAH derecelendirmesi ve kan pıhtılarının hacimlendirilmesi için ImageJ yazılımını kullanın. Nicelemeyle ilgili ayrıntılar, ek materyalde adım adım kılavuz olarak listelenmiştir (Ek Şekil 1).
Sonuçlar
Ölümlülük
Bu çalışmada 8-12 haftalık toplam 92 erkek C57Bl/6J faresi SAH operasyonuna tabi tutuldu; bunlarda ise genel mortalite oranı %11,9 (n=12) olarak gözlenmiştir. Mortalite sadece ameliyattan sonraki ilk 6-24 saat içinde meydana geldi ve perioperatif mortalitenin yanı sıra SAH kanamasının kendisini en olası katkıda bulunan faktörler olarak düşündürdü.
SAH kanama derecesi
Toplam 50 fare, SAH'yi doğrulamak ve subakut iskemik ...
Tartışmalar
Özetle, endovasküler filament perforasyon operasyonunun neden olduğu standartlaştırılmış bir SAH fare modeli, minör invazyon, kısa ameliyat süresi ve kabul edilebilir mortalite oranları ile sunulmaktadır. MRG, doğru kanama bölgesini ve diğer ilgili intrakraniyal patolojilerin dışlanmasını sağlamak için postoperatif 24 saat yapılır. Ayrıca, farklı SAH kanama derecelerini sınıflandırdık ve kanama hacimlerini ölçtük, böylece kanama derecesine göre daha fazla alt grup analizine izin verdik....
Açıklamalar
Çıkar çatışması yok
Teşekkürler
SL, Çin Burs Konseyi tarafından desteklendi. KT, Berlin Sağlık Enstitüsü ve Sonnenfeld-Stiftung'un BIH-MD bursu ile desteklendi. RX, Charité -Universitätsmedizin Berlin ve Berlin Sağlık Enstitüsü tarafından finanse edilen BIH-Charité Klinisyen Bilim İnsanı Programı tarafından desteklenmektedir. Alman Araştırma Vakfı (DFG) ve Charité Açık Erişim Yayın Fonu - Universitätsmedizin Berlin'in desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Eye cream | Bayer | 815529836 | Bepanthen |
| Images analysis software | ImageJ | Bundled with Java 1.8.0_172 | |
| Ligation suture (5-0) | SMI | Silk black USP | |
| Light source for microscope | Zeiss | CL 6000 LED | |
| Ketamine | CP-pharma | 797-037 | 100 mg/mL |
| MRI | Bruker | Pharmascan 70/16 | 7 Tesla |
| MRI images acquired software | Bruker | Bruker Paravision 5.1 | |
| Paracetamol (40 mg/mL) | bene Arzneimittel | 4993736 | |
| Prolene filament (5-0) | Erhicon | EH7255 | |
| Razor | Wella | HS61 | |
| Surgical instrument (Fine Scissors) | FST | 14060-09 | |
| Surgical instrument (forceps#1) | AESCULAP | FM001R | |
| Surgical instrument (forceps#2) | AESCULAP | FD2855R | |
| Surgical instrument (forceps#3) | Hammacher | HCS 082-12 | |
| Surgical instrument (Needle holder) | FST | 91201-13 | |
| Surgical instrument (Vannas Spring Scissors) | FST | 15000-08 | |
| Surgical microscope | Zeiss | Stemi 2000 C | |
| Ventilation monitoring | Stony Brook | Small Animal Monitoring & Gating System | |
| Wounding suture(4-0) | Erhicon | CB84D | |
| Xylavet | CP-pharma | 797-062 | 20 mg/mL |
Referanslar
- Macdonald, R. L., Schweizer, T. A. Spontaneous subarachnoid haemorrhage. The Lancet. 389 (10069), 655-666 (2017).
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. The Lancet. 369 (9558), 306-318 (2007).
- Abraham, M. K., Chang, W. -. T. W. Subarachnoid hemorrhage. Emergency Medicine Clinics of North America. 34 (4), 901-916 (2016).
- Schertz, M., Mehdaoui, H., Hamlat, A., Piotin, M., Banydeen, R., Mejdoubi, M. Incidence and mortality of spontaneous subarachnoid hemorrhage in martinique. PLOS ONE. 11 (5), 0155945 (2016).
- Okazaki, T., Kuroda, Y. Aneurysmal subarachnoid hemorrhage: intensive care for improving neurological outcome. Journal of Intensive Care. 6 (1), 28 (2018).
- Kilbourn, K. J., Levy, S., Staff, I., Kureshi, I., McCullough, L. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage. Clinical Neurology and Neurosurgery. 115 (7), 909-914 (2013).
- de Oliveira Manoel, A. L., et al. The critical care management of spontaneous intracranial hemorrhage: a contemporary review. Critical Care. 20 (1), 272 (2016).
- Schneider, U. C., et al. Microglia inflict delayed brain injury after subarachnoid hemorrhage. Acta Neuropathologica. 130 (2), 215-231 (2015).
- Delgado, T. J., Brismar, J., Svendgaard, N. A. Subarachnoid haemorrhage in the rat: angiography and fluorescence microscopy of the major cerebral arteries. Stroke. 16 (4), 595-602 (1985).
- Piepgras, A., Thomé, C., Schmiedek, P. Characterization of an anterior circulation rat subarachnoid hemorrhage model. Stroke. 26 (12), 2347-2352 (1995).
- Suzuki, H., et al. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. Journal of Clinical Investigation. 104 (1), 59-66 (1999).
- Dudhani, R. V., Kyle, M., Dedeo, C., Riordan, M., Deshaies, E. M. A Low mortality rat model to assess delayed cerebral vasospasm after experimental subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (71), e4157 (2013).
- Iuliano, B. A., Pluta, R. M., Jung, C., Oldfield, E. H. Endothelial dysfunction in a primate model of cerebral vasospasm. Journal of Neurosurgery. 100 (2), 287-294 (2004).
- Barry, K. J., Gogjian, M. A., Stein, B. M. Small animal model for investigation of subarachnoid hemorrhage and cerebral vasospasm. Stroke. 10 (5), 538-541 (1979).
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26 (6), 1086-1092 (1995).
- Veelken, J. A., Laing, R. J. C., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26 (7), 1279-1284 (1995).
- Sugawara, T., Ayer, R., Jadhav, V., Zhang, J. H. A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model. Journal of Neuroscience Methods. 167 (2), 327-334 (2008).
- Egashira, Y., Shishido, H., Hua, Y., Keep, R. F., Xi, G. New grading system based on magnetic resonance imaging in a mouse model of subarachnoid hemorrhage. Stroke. 46 (2), 582-584 (2015).
- Mutoh, T., Mutoh, T., Sasaki, K., Nakamura, K., Taki, Y., Ishikawa, T. Value of three-dimensional maximum intensity projection display to assist in magnetic resonance imaging (MRI)-based grading in a mouse model of subarachnoid hemorrhage. Medical Science Monitor. 22, 2050-2055 (2016).
- Kothari, R. U., et al. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 27 (8), 1304-1305 (1996).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71 (2018).
- Titova, E., Ostrowski, R. P., Zhang, J. H., Tang, J. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm. Neurological Research. 31 (6), 568-581 (2009).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: Species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Marbacher, S., Fandino, J., Kitchen, N. D. Standard intracranial in vivo animal models of delayed cerebral vasospasm. British Journal of Neurosurgery. 24 (4), 415-434 (2010).
- Thompson, J. W., et al. In vivo cerebral aneurysm models. Neurosurgical Focus. 47 (1), 1-8 (2019).
- Frontera, J. A., et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: The modified fisher scale. Neurosurgery. 59 (1), 21-26 (2006).
- Fisher, C. M., Kistler, J. P., Davis, J. M. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 6 (1), 1-9 (1980).
- Wilson, D. A., et al. A simple and quantitative method to predict symptomatic vasospasm after subarachnoid hemorrhage based on computed tomography: Beyond the fisher scale. Neurosurgery. 71 (4), 869-875 (2012).
- Schüller, K., Bühler, D., Plesnila, N. A murine model of subarachnoid hemorrhage. Journal of Visualized Experiments: JoVE. (81), e50845 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır