Method Article
إنتاج فعال وقابل للتطوير لمتغيرات هنتنغتين البشرية كاملة الطول في خلايا الثدييات باستخدام نظام تعبير عابر
In This Article
Summary
نحن نقدم بروتوكولات قابلة للتطوير تغطي تصميم البناء ، والنقل العابر ، والتعبير عن وتنقية متغيرات بروتين هنتنغتين البشري الكامل الطول في خلايا HEK293.
Abstract
هنتنغتين كامل الطول (FL HTT) هو بروتين كبير (aa 1-3,144) ، يتم التعبير عنه في كل مكان ، يحتوي على بروتين متعدد الجلوتامين (polyQ) بكتلة تبلغ حوالي 350 كيلو دالتون. في حين أن الوظيفة الخلوية ل FL HTT ليست مفهومة تماما ، فإن التوسع الطافر في قناة polyQ فوق ~ 36 تكرارا يرتبط بمرض هنتنغتون (HD) ، مع ارتباط طول polyQ تقريبا بعمر البداية. لفهم تأثير الهيكل على وظيفة HTT الطافرة (mHTT) بشكل أفضل ، يلزم وجود كميات كبيرة من البروتين. تم تحقيق إنتاج تحت المليغرام من FL HTT في خلايا الثدييات باستخدام تعبير خط الخلية المستقرة المحرض بالدوكسيسيكلين. ومع ذلك ، فإن إنتاج البروتين من خطوط الخلايا المستقرة له قيود يمكن التغلب عليها بطرق النقل العابرة.
يقدم هذا البحث طريقة قوية لإنتاج كمية منخفضة من ملليغرام من FL HTT ومتغيراته من البلازميدات المحسنة للكودون عن طريق النقل العابر باستخدام البولي إيثيلينيمين (PEI). الطريقة قابلة للتطوير (>10 مجم) وتنتج باستمرار 1-2 مجم / لتر من زراعة الخلايا من FL HTT عالي النقاء. تمشيا مع التقارير السابقة ، وجد أن حالة المحلول المنقى ل FL HTT ديناميكية للغاية. يميل البروتين إلى تكوين ثنائيات وأوليغومرات عالية الترتيب. مفتاح إبطاء تكوين oligomer هو العمل بسرعة لعزل الكسور الأحادية عن الكسور قليلة القسيمات ثنائية وعالية الترتيب أثناء كروماتوغرافيا استبعاد الحجم.
تم استخدام كروماتوغرافيا استبعاد الحجم مع تشتت الضوء متعدد الزوايا (SEC-MALS) لتحليل محتوى قليل القسيمات الباهت والأعلى مرتبة ل HTT المنقى. لم يلاحظ أي ارتباط بين طول FL HTT polyQ (Q23 و Q48 و Q73) ومحتوى oligomer. أظهر البناء المحذوف exon1 (aa 91-3,144) ميلا مشابها لقلة القلة إلى FL HTT (aa 1-3,144). يتم وصف طرق الإنتاج والتنقية والتوصيف بواسطة معامل الانكسار SEC / MALS (RI) ، والرحلان الكهربائي لهلام دوديسيل سلفات بولي أكريلاميد الصوديوم (SDS-PAGE) ، واللطخة الغربية ، والصفحة الأصلية ، والصفحة الأصلية الزرقاء هنا.
Introduction
مرض هنتنغتون (HD) هو مرض تنكسي عصبي نادر يتميز في المقام الأول بالحركة الحركية غير المستقرة وغير الطوعية ، بالإضافة إلى التغيرات المعرفية والنفسية ، مثل تغيرات الشخصية واللامبالاة 1,2. يرتبط داء هنتنغتون بتوسع مسار تكرار CAG الموجود في إكسون 1 من جين هنتنغتين (HTT) إلى أكثر من 35 تكرارا ، مع ارتباط عدد أكبر من تكرارات CAG ببداية مبكرة للمرض 3,4. المنتج الانتقالي ل HTT ، بروتين هنتنغتين (HTT) ، متورط في صلاحية الخلايا العصبية ونمو الدماغ5،6،7،8،9.
HTT هو بروتين سقالات تم الإبلاغ عنه للمشاركة في مجموعة واسعة من العمليات الخلوية ، ونقل الحويصلة ، وانقسام الخلايا ، وتكوين الأهداب ، والالتهام الذاتي10,11. ومع ذلك ، فإن التسبب الجزيئي ل HD ليس واضحا تماما ، ولا يوجد تحديد متفاعلات البروتين الرئيسية التي تتوسط في التأثير المرضي ل mHTT الموسع polyQ. تشير بعض الأبحاث إلى اكتساب وظيفة سامة من mHTT مدفوعة بميل قلة البروتين HTT الموسع ، حيث تم تحديد مجاميع HTT في الخلايا العصبية والدبقية في مرضى HD والنماذج الحيوانية للمرض12،13،14،15،16،17 . لتغذية التحقيق في وظيفة وهيكل متغيرات FL HTT و mHTT وتزويد الباحثين بمعايير بروتين عالية الجودة لتطوير الفحص ، هناك حاجة إلى إمدادات قوية وقابلة للتطوير من البروتين المؤتلف المتجانس.
نظرا لحجمه (aa 1-3,144 ، الترقيم على أساس طول polyQ Q23) ، وعدم الاستقرار المحلل للبروتين ، والميل إلى التجميع ، فقد ثبت أن FL HTT يصعب التعبير عنه وعزله كبروتين قابل للذوبان. في السابق ، تم التعبير عن منطقة exon 1 (aa 2-90) من HTT وتنقيتها على نطاق واسع باستخدام علامات مختلفة يمكن أن تزيد من قابلية ذوبان البروتين في الإشريكية القولونية18،19،20. تم التعبير عن FL HTT وتنقيته لأول مرة في نظام تعبير خلية الحشرات باستخدام baculovirus 21,22 ، وتم الإبلاغ عن هياكل المجهر الإلكتروني 30 Å (EM) منخفضة الدقة ل FL Q23-HTT و Q78-HTT المتشابكة كيميائيا23. تم تطوير التحقيق في بنية HTT بشكل أكبر عندما تم تحقيق إنتاج FL Q17 و Q46 و Q128-HTT مع تعديلات ما بعد الترجمة الأصلية (PTMs) في الخلايا البشرية باستخدام خطوط الخلايا المستقرة أو أنظمة التعبير عن الفيروسات الغدية24. تشير هذه الدراسات إلى أنه على الرغم من وجود HTT المنقى بشكل أساسي في الحالة الأحادية ، إلا أنه يميل أيضا إلى تكوين أوليغومرات ومجاميع عالية الترتيب.
يوفر الطرد المركزي التحليلي الفائق ل FL Q128-HTT ، مع منطقة polyQ واسعة للغاية ، كسور قليلة القسيمات ومجمعة أكثر من البروتين مع منطقة polyQ غير الموسعة24. باستخدام خط خلية مستقر ، تم تكييف استراتيجية بنجاح لتثبيت FL HTT عن طريق التعبير المشترك مع شريك التفاعل HAP40. تم حل بنية cryo-EM لمركب FL HTT و HAP40 بمتوسط دقة 4 Å باستخدام مركب البروتين المنقى (PDB: 6EZ8) 25. تم تكييف استراتيجية التعبير المشترك هذه بنجاح مع نظام الفيروس البقعي ، وتم التعبير عن سلسلة من متغيرات HTT عالية الجودة بأطوال polyQ مختلفة وتنقيتها من خلايا الحشرات26. منذ ذلك الحين ، تم حل المزيد من هياكل cryo-EM لمجمع HTT بأطوال polyQ متغيرة و HAP40 وهياكل عالية الدقة وترسبها في قاعدة بيانات البروتين27,28 (PDB: 7DXK ، 7DXH ، 6X9O).
قمنا بتحسين طريقة النقل والتعبير في خلايا HEK293 ، باستخدام polyethylenimine (PEI) ، للتعبير العابر السريع عن FL HTT. كدليل على المبدأ ، تم تنقية متغيرات FL HTT التي تحتوي على 23 غلوتامين (FL Q23-HTT) أولا وتوصيفها باستخدام تعديل طريقة تنقية موصوفة سابقا24. طريقة النقل العابر هذه مريحة وعالية الكفاءة وقابلة للتطوير ؛ يمكن أن تنتج HTT المنقى مع غلة من 1-2 ملغ / لتر ، مماثلة لطريقة خط الخلية المستقرة المبلغ عنها24. نظرا لأن البروتين يتم إنتاجه في خط خلية بشرية ، فمن المرجح أن يحتوي HTT المنتج على PTMs بشرية أصلية عند خضوعه لتحليل بروتينات قياس الطيف الكتلي11،29،30،31. تم إنتاج كميات مليغرام من متغيرات FL Q48-HTT و FL Q73-HTT و exon1-delete (ΔExon1-HTT) من FL HTT ، مما يدل على أن طريقة التعبير العابر مفيدة بشكل خاص في الإنتاج السريع لمتغيرات بديلة من HTT دون الاعتماد على الجهد الذي يستغرق وقتا طويلا لإنشاء خطوط خلايا مستقرة للإنتاج.
يجسد البروتوكول التالي الطريقة القياسية المستخدمة في مختبر هؤلاء المؤلفين لزراعة الخلايا ، والنقل ، وتنقية البروتين ، وتوصيف البروتين بعد التنقية لإنتاج FL Q23-HTT من مزرعة خلية 2 لتر. يمكن توسيع نطاق البروتوكول إلى ثقافات أكبر أو تكييفه لتنقية متغيرات HTT الأخرى. تم إجراء ما يصل إلى 10 مزارع خلايا من FL HTT وطفرات مختلفة في الموقع أو الاقتطاع لمتجانسات HTT و HTT بنجاح في المختبر باستخدام نفس البروتوكول. يحتوي FL HTT المنقى على نسبة عالية من المونومرات جنبا إلى جنب مع الدايمرات والأوليغومرات ذات الترتيب الأعلى. لوحظ نفس ملف التعريف الكلي بين المتغيرات المنتجة (Q23 و Q48 و Q73 و Exon1 المحذوفة). نظرا لأن التجميع يمكن أن يحدث عندما لا يتم اتخاذ العناية المناسبة ، فقد تم إجراء دراسة لاستقرار التركيبة والتجميد والذوبان لتحديد أفضل الظروف للتعامل مع البروتين. يتم أيضا وصف الطرق ، مثل Blue Native PAGE و SEC / MALS-RI ، لتحليل محتوى oligomer HTT كجزء من عملية مراقبة الجودة. لإفادة مجتمع أبحاث HD ، يتم أيضا إيداع البلازميدات وبروتينات HTT الموصوفة في هذه الدراسة في مستودع مجتمع HD في معهد كوريل (www.coriell.org/1/CHDI).
Protocol
1. تصميم وإنتاج تركيبات لتعبير الثدييات HTT الموسوم بالعلم
- استرجع تسلسل بروتين HTT البشري الكامل الطول (P42858) من المركز الوطني لمعلومات التكنولوجيا الحيوية (https://www.ncbi.nlm.nih.gov/).
ملاحظة: يحتاج الباحثون إلى أن يكونوا على دراية بمنظمات مجال HTT والحفاظ على هيكل HTT Core 3D عند تصميم التركيبات لمتحولات HTT. - اطلب خدمة تخليق الجينات لإجراء تحسين الكودون للتعبير عن الخلايا البشرية بناء على تسلسل P42858. قم بتغيير رقم polyQ من Q16 إلى طول Q المطلوب (تم اختيار Q23 كأول بناء هنا) وتوليف جين HTT كامل الطول.
ملاحظة: تم تسليم بنية Q23-HTT كاملة الطول المحسنة للكودون كملحق في بلازميد pUC18 في هذه الدراسة. - اختياري: أضف ميزات لتسهيل استنساخ أطوال Q المختلفة وتنقيتها في البنيات.
ملاحظة: تمت إضافة موقع انقسام فيروس حفر التبغ (TEV) وعلامة تنقية العلم (AAAENLYFQGDYKDDDDK) إلى الطرف الطرفي C للبنيات. تم تصميم موقعين من HindIII في التركيبات لتشمل منطقة polyQ (لا يتم تغيير تسلسل البروتين المترجم عن طريق إدخال مواقع HindIII). يسمح هذا للباحث بتغيير طول Q الخاص ب HTT عن طريق هضم إنزيم التقييد وربطه دون إعادة تخليق جين HTT الكامل.
2. استنساخ بنيات HTT المركبة في pcDNA3.1.
- اهضم 5 ميكروغرام من pUC18-Q23-HTT و 5 ميكروغرام من pcDNA3.1 باستخدام 2 ميكرولتر من NheI و PmeI لكل منهما عند 37 درجة مئوية لمدة 2 ساعة.
- قم بتشغيل 0.5٪ w / v agarose gel وتنقية جزء Q23-HTT وناقل pcDNA3.1 المهضوم باستخدام مجموعة استخراج هلام agarose. قم بقياس تركيزات الحمض النووي المنقى بواسطة OD280 باستخدام مطياف الأشعة فوق البنفسجية الذي يمكنه قياس ميكرولتر من العينات.
ملاحظة: عادة ما يتم ملاحظة OD260/280 التي تتراوح من 1.8 إلى 2.0. يتم توفير FL HTT المركب كملحق مع NheI و PmeI في كلا الطرفين في بلازميد pUC18. استخدم إنزيمات تقييد أخرى إذا تم تصنيع HTT بشكل مختلف. - استخدم 10 نانوغرام من متجه pcDNA3.1 المهضوم في التفاعل. قم بتوصيل الحمض النووي المنقى عند نسبة مولار 1: 1 (HTT: pcDNA3.1) في تفاعل 10 ميكرولتر في درجة حرارة الغرفة لمدة 5 دقائق باستخدام T4 DNA ligase.
- قم بتحويل المنتج المربوط إلى خلايا الإشريكية القولونية المختصة (انظر جدول المواد) باستخدام البروتوكول المحدد من قبل الشركة المصنعة لليجاز.
- التقط 6 مستعمرات مفردة وقم بعمل مزارع ليلية في 4-6 مل من LB مكملة ب 100 ميكروغرام / مل كاربينيسيلين عند 37 درجة مئوية.
- تخصيص 1 مل من كل ثقافة بين عشية وضحاها. أضف الجلسرين إلى 25٪ v / v واحفظ مخزون الجلسرين عند -80 درجة مئوية. قم بتنقية المزرعة الليلية المتبقية باستخدام مجموعة أدوات تحضير صغيرة وفقا للخطوات المحددة في دليل المستخدم.
- تسلسل جميع البلازميدات باستخدام بادئات التسلسل الممتدة عبر منطقة النسخ للبلازميد. اختر مخزونا واحدا من الجلسرين يحتوي على التسلسل الصحيح مثل مخزون الجلسرين الرئيسي وتخلص من الباقي.
- اختياري: اطلب خدمة تخليق الجينات لتخليق الحمض النووي بأطوال Q المختلفة (Q48 و Q73 و Exon1) التي تمتد عبر موقعي HindIII في بلازميد pcDNA3.1-Q23-HTT. اهضم pcDNA3.1-Q23-HTT والحمض النووي المركب حديثا باستخدام HindIII ، وقم باعتمادها مع T4 ligase كما في الخطوات 2.2-2.7 لجعل FL HTT بأطوال polyQ مختلفة في بلازميد pcDNA3.1.
ملاحظة: تتوفر أيضا تركيبات البلازميد المستخدمة في هذه الدراسة مباشرة من مستودع مجتمع HD في معهد كوريل (www.coriell.org/1/CHDI) ؛ انظر جدول المواد.
3. GIGA تحضير الحمض النووي البلازميد الخالي من السموم الداخلية للنقل على نطاق واسع
- ضع خط على مخزون الجلسرين البكتيري من pcDNA3.1-Q23-HTT-TEV-FLAG على صفيحة أجار LB مع كاربينيسيلين (100 ميكروغرام / مل). احتضان الصفيحة عند 37 درجة مئوية لمدة 16-24 ساعة حتى تظهر مستعمرات مفردة.
- التقط مستعمرة واحدة ، وقم بتلقيح مزرعة بداية سعة 5 مل في وسط غني مصمم لتضخيم البلازميد باستخدام الكاربينيسيلين (100 ميكروغرام / مل) ، وينمو عند 37 درجة مئوية لمدة 8 ساعات.
- اختر مجموعة تنقية البلازميد GIGA الخالية من السموم الداخلية. اتبع الخطوات الموضحة في دليل مجموعة GIGA البلازميد لتنقية بلازميد pcDNA3.1-Q23-HTT-TEV-FLAG.
- قم بقياس مستويات الذيفان الداخلي البلازميد باستخدام مجموعة أدوات قياس كمية الأميبوكسين القائمة على الخلايا الأميبية (LAL). اتبع الإجراء المحدد في دليل الشركة المصنعة.
ملاحظة: تعد تنقية البلازميد عالية الجودة ومنخفضة الذيفان الداخلي ضرورية للحصول على كفاءة نقل جيدة. باستخدام هذا البروتوكول ، يمكن الحصول على 20-40 مجم من البلازميد (شكل فائق اللف >80٪) لكل لتر من الثقافة البكتيرية بتركيزات بلازميد > 4 مجم / مل. يجب أن يحتوي البلازميد المنقى بشكل صحيح على مستوى ذيفان داخلي < 30 EU / mg. عادة ما يتم ملاحظة OD260/280 يتراوح من 1.8 إلى 2.0.
4. نقل واسع النطاق ل 2 لتر من خلايا HEK293 بواسطة البولي إيثيلين (PEI)
- أضف 1 جم من PEI 25K إلى 1 لتر من الماء الخالي من السموم الداخلية مع التحريك. اضبط الرقم الهيدروجيني على 2.0 باستخدام 100 مللي مول حمض الهيدروكلوريك وحركه حتى يذوب كل PEI 25K. اضبط الأس الهيدروجيني على 7.0 باستخدام محلول NaOH 100 mM وقم بالتصفية من خلال مرشح 0.2 ميكرومتر. القسمة وتخزينها في -20 درجة مئوية لمدة تصل إلى عام.
ملاحظة: يمكن الاحتفاظ بحصص جزيرة الأمير إدوارد عند 4 درجات مئوية لمدة تصل إلى أسبوعين ولكن لا ينبغي أبدا إعادة تجميدها بعد الذوبان. - نشر خلايا HEK293 في وسط النمو (انظر جدول المواد) مكملة بالبنسلين-الستربتومايسين (التركيز النهائي عند 5 وحدة / مل للبنسلين و 5 ميكروغرام / مل للستربتومايسين) في حاضنة شاكر مرطبة عند 37 درجة مئوية ، 90 دورة في الدقيقة ، 5٪ CO2 لمدة 18-24 ساعة. تمييع الخلايا إلى 2 L بكثافة ~ 1.2 × 106 خلايا / مل باستخدام وسط النمو في 5 L قوارير Erlenmeyer قبل يوم واحد من النقل.
- استمر في نمو الخلايا عند 37 درجة مئوية ، 90 دورة في الدقيقة ، 5٪ CO2 لمدة 18-24 ساعة. قم بقياس معلمات الخلية باستخدام عداد خلايا تلقائي قادر على قياس كثافة الخلية وصلاحيتها باتباع دليل المستخدم.
ملاحظة: يجب أن تتضاعف كثافة الخلية ، ويجب أن تكون الصلاحية >95٪. يجب أن تكون كثافة الخلية قبل النقل حوالي 2.0 × 10 6-2.4 × 106 خلايا / مل. تمييع الخلايا إلى الكثافة المطلوبة قبل النقل عند الضرورة. - حساب كميات البلازميد و PEI اللازمة للنقل ؛ استخدم 1 ملغ من البلازميد و 3 ملغ من جزيرة الأمير إدوارد لنقل كل لتر من ثقافة الخلية. تخصيص 2 ملغ من البلازميد و 6 ملغ من جزيرة الأمير إدوارد اللازمة لنقل 2 لتر.
- قم بتخفيف البلازميد و PEI بشكل فردي إلى حجم من المحلول الملحي المخزن بالفوسفات يساوي 1/20عشر من الحجم الكلي لزراعة الخلايا (100 مل لكل منهما لنقل 2 لتر) واحتضانه في درجة حرارة الغرفة لمدة 5 دقائق. اخلطي البلازميد المخفف و PEI عن طريق الدوران اللطيف واحتضان الخليط في درجة حرارة الغرفة لمدة 30 دقيقة.
ملاحظة: سيبدو الخليط غائما قليلا بعد الحضانة. - أضف الخليط إلى مزرعة الخلايا وحركه برفق لخلطها.
- تنمو الخلايا عند 37 درجة مئوية ، 5٪ CO2 ، 90 دورة في الدقيقة لمدة 24 ساعة.
- أضف 2 M محلول زبدات الصوديوم إلى تركيز نهائي مقداره 2 mM. أضف 1: 1000 (v / v) عامل مضاد للتكتل و 1: 1000 (v / v) مضاد للرغوة إلى الثقافة.
- انقل القارورة إلى حاضنة شاكر مرطبة عند 32 درجة مئوية ، 90 دورة في الدقيقة ، 5٪ CO2 ، واستمر في النمو لمدة 48 ساعة.
- قم بقياس معلمات الخلية ، بما في ذلك كثافة الخلية وصلاحيتها ، باستخدام عداد الخلايا التلقائي باتباع دليل المستخدم.
- نقل 2.0 × 10 6 خلايا (المجلد = 2.0 × 106 / كثافة الخلية) في أنبوب طرد مركزي دقيق. قم بتكوير الخلايا عند 2000 × جم لمدة 1 دقيقة في جهاز طرد مركزي للنشاف الغربي في القسم 5.
- احصد الخلايا بالطرد المركزي عند 2000 × جم لمدة 30 دقيقة وقم بتخزين حبيبات الخلية عند -80 درجة مئوية قبل التنقية.
5. SDS-PAGE واللطخة الغربية لمحلول خلية HEK293 لتقدير مستوى تعبير HTT
- خذ حصة 2.0 × 106 خلايا مجمدة مسبقا (الخطوة 4.11) من النقل واسع النطاق لثقافة خلايا HEK293. أضف 250 ميكرولتر من محلول ملحي مخزن بواسطة Tris (TBS) مكمل ب 50 ميكروغرام / مل ديجيتونين ، و 5 مللي مول EDTA ، وكوكتيل مثبط للبروتياز 1x ، وأعد تعليق حبيبات الخلية عن طريق الشفط عدة مرات باستخدام ماصة.
- قم بتدوير الأنابيب برفق لمدة 30 دقيقة عند 4 درجات مئوية باستخدام دوار صغير لتحليل الخلايا. قم بتكوير المادة غير القابلة للذوبان عن طريق الطرد المركزي عند 17000 × جم لمدة 5 دقائق.
- أضف 1/3rd حجم 4x تقليل الليثيوم دوديسيل سلفات (LDS) تحميل المخزن المؤقت إلى الطافي والحرارة عند 70 درجة مئوية لمدة 10 دقائق.
- قم بتحميل 5-20 ميكرولتر من محللة الخلايا على هلام PAGE ثلاثي الأسيتات 3-8٪ مسبق الصب. باستخدام المخزن المؤقت لتشغيل SDS 1x Tris-acetate المتوافق مع الهلام ، قم بتشغيل الجل في وضع الجهد الثابت عند 150 فولت لمدة 60 دقيقة.
ملاحظة: تم استخدام Tris-acetate SDS-PAGE لتحليل FL HTT لأنه يولد دقة أعلى من الأنواع الأخرى من SDS-PAGE للبروتينات ذات الوزن الجزيئي فوق 300 كيلو دالتون. البروتينات المستخدمة في هذه الدراسة متاحة أيضا مباشرة من مستودع مجتمع HD في معهد كوريل (www.coriell.org/1/CHDI) ؛ انظر جدول المواد. - لإجراء النشاف الغربي ، قم بتجميع شطيرة نقل باستخدام ورق نقل سميك متوازن بمحلول نقل ، وغشاء فلوريد البولي فينيليدين المنشط بالميثانول (PVDF) ، وهلام SDS-PAGE. انقل البروتينات إلى غشاء PVDF باستخدام نشافة غربية شبه جافة وفقا لدليل مستخدم الشركة المصنعة.
ملاحظة: عادة ما تكون 20-30 دقيقة عند 135 مللي أمبير كافية لغشاء 10 سم × 10 سم. - قم بتفكيك شطيرة النقل وسد الغشاء في TBST (20 mM Tris pH 7.4 و 150 mM NaCl و 0.1٪ v / v Tween-20) مكملة ب 5٪ وزن / فولت حليب خالي الدسم.
- احتضان الغشاء على هزاز لمدة ساعة واحدة في درجة حرارة الغرفة مع 15 مل من الجسم المضاد الأولي (1: 2500 تخفيف للجسم المضاد أحادي النسيلة المضاد ل FLAG و 1: 2000 لجميع الأجسام المضادة الأولية الأخرى).
ملاحظة: الأجسام المضادة الأولية المستخدمة في هذه الدراسة هي anti-FLAG M2 و MAB5492 و MAB5490 و MAB2166 و MAB3E10 و MAB4E10 و MAB2168 و MAB8A4 (انظر جدول المواد). - اغسل الغشاء 3 × 5 دقائق باستخدام 30-50 مل من TBST.
- احتضان الغشاء على هزاز مع جسم مضاد ثانوي IgG للماعز الفلوري المقترن بصبغة الفلورسنت عند 1: 15000 ، درجة حرارة الغرفة ، في 15 مل من TBST تحتوي على 5٪ وزن / فولت حليب جاف.
- تصور نطاقات اللطخة الغربية على جهاز تصوير فلوري باستخدام الطول الموجي الخاص بالجسم المضاد الثانوي. قم بقياس إشارة النطاق باستخدام البرنامج المصاحب لجهاز التصوير وفقا لدليل المستخدم.
ملاحظة: يمكن إجراء النشاف الغربي الكمي باستخدام HTT المنقى كمعيار. النطاق القياسي الخطي ل HTT خاص بالأدوات وقد تم إنشاؤه في هذا المختبر من 25 نانوغرام إلى 250 نانوغرام من HTT لكل ممر باستخدام جسم مضاد مضاد ل FLAG. يجب أن تكون اللطخة الغربية ل HTT خالية من التدهور ؛ عادة ما يتم ملاحظة مستوى تعبير HTT الكلي من 2-4 بيكوغرام / خلية. ارجع إلى البروتوكول32 المنشور مسبقا للحصول على تفاصيل حول كيفية إجراء لطخة غربية كمية.
6. تنقية كروماتوغرافيا البروتين السائل السريع (FPLC) ل HTT باستخدام عمود مضاد للعلم و SEC
- تنقية مكافحة العلم
- تقدير كمية راتنج FLAG اللازمة للتنقية (عادة ، 12 مل من راتنج التقارب المضاد ل FLAG M2 لتنقية 2-4 لتر من زراعة الخلايا المنقولة). قم بتعبئة 12-25 مل من الراتنج المضاد للعلم في عمود فارغ (انظر جدول المواد) باستخدام FPLC بمعدل تدفق 4 مل / دقيقة باستخدام المخزن المؤقت A (الجدول 1). اضبط ارتفاع المكبس ، بحيث لا توجد فجوة بين نهاية المكبس وسرير الراتنج.
- باستخدام نسبة 10 مل من Lysis Buffer لكل 1 غرام من حبيبات الخلية, قم بإذابة وتعليق حبيبات الخلية في محلول التحلل البارد (الجدول 1).
- مرر معلق الخلية مرة واحدة من خلال خالط عالي القص عند 10000 رطل / بوصة مربعة. توضيح المحللة عن طريق الطرد المركزي عند 20000 × جم لمدة 1 ساعة في جهاز طرد مركزي مجهز بدوار ثابت الزاوية متوافق.
- قم ببرمجة FPLC (انظر جدول المواد للبرنامج المستخدم في الدراسة) وقم بتشغيل التسلسلات التالية.
- قم بتحميل المحللة الموضحة عبر مضخة العينة.
- اغسل ب 4 أحجام أعمدة (CVs) من المخزن المؤقت أ (الجدول 1).
- اغسل ب 4 سير ذاتية من المخزن المؤقت ب (الجدول 1).
- اغسل ب 8 سير ذاتية من المخزن المؤقت C (الجدول 1).
- اغسل ب 3 سير ذاتية من المخزن المؤقت D (الجدول 1).
- اغسل ب 3 CVs من المخزن المؤقت للشطف (الجدول 1).
- تحليل 10 ميكرولتر من كسور الذروة باستخدام SDS-PAGE. جمع والجمع بين كسور الذروة مع النقاء المطلوب. حفظ ~ 50 ميكرولتر من الشطف المشترك لتحليل SDS-PAGE.
ملاحظة: عادة ، ستظهر قمة واحدة ، وجميع الكسور المستخلصة في الذروة تحتوي على ~ 90٪ HTT نقي. - أعد إنشاء عمود مضاد ل FLAG باستخدام 5 سير ذاتية من المخزن المؤقت للتجديد (الجدول 1) وأعد موازنة العمود باستخدام 5 سير ذاتية من المخزن المؤقت A.
ملاحظة: يمكن إعادة استخدام الراتنج المضاد للعلم حتى خمس مرات أو حتى ينخفض العائد النسبي / اللتر إلى 50٪ من التنقية الأولى.
- تنقية عمود استبعاد الحجم (SEC) باستخدام عمود SEC
- قم بموازنة عمود SEC الذي يسمح بفصل البروتينات ذات الوزن الجزيئي (MW) > 500 كيلو دالتون (انظر جدول المواد للعمود المستخدم) باستخدام 2 × CV من SEC Buffer (الجدول 1).
- قم بتحميل مضاد FLAG مباشرة (من الخطوة 6.1.5) عبر superloop سعة 50 مل. قم بتشغيل 1.2 × CV من المخزن المؤقت SEC لكل حقنة. قم بتشغيل فصل SEC طوال الليل عند 4 درجات مئوية.
ملاحظة: يمكن تحميل 5 مل أو 15 مل كحد أقصى من عينة البروتين على أعمدة SEC المحددة في هذه الدراسة. قم ببرمجة FPLC بحيث يمكن إجراء حقن متعددة تلقائيا. يتم أيضا تضمين البرامج النصية لأسلوب العينة كملف تكميلي 1 وملف تكميلي 2. - قارن ملف تعريف الشطف مع ملف تعريف شطف HTT القياسي لتمييز قمم المونومر والدايمر والقمم قليلة القسيمات الأعلى ترتيبا. قم بتجميع كسور HTT الأحادية بناء على ملف تعريف الشطف لعمود SEC. إذا رغبت في ذلك ، قم بتجميع كسور HTT قليلة القسيمات والثنائية ذات الترتيب الأعلى بشكل منفصل.
- ركز بروتين HTT المجمع باستخدام مكثف طرد مركزي 100 كيلو دالتون عند 4 درجات مئوية. احسب تركيزات البروتين بقسمة قيم OD280 على معاملات الانقراض ذات الصلة (معاملات الانقراض النظرية ل Q23-HTT و Q48-HTT و Q73-HTT و ΔExon1-HTT هي 0.776 و 0.769 و 0.762 و 0.798 (مجم / مل) -1 سم -1، على التوالي ، للحساب). الحفاظ على تركيز HTT ≤ 1.0 ملغ / مل.
ملاحظة: من الضروري مراقبة عملية التركيز لأن التركيز الزائد سيؤدي إلى التجميع. - احصل على بروتين HTT المنقى في أنابيب طرد مركزي دقيقة آمنة للتبريد بحجم < 100 ميكرولتر. قم بتجميد القسمة باستخدام النيتروجين السائل وتخزينها في -80 درجة مئوية.
7. تحليلي HPLC SEC-MALS-dRI لتحليل تشتت HTT
- قم بإجراء جميع SEC-MALS التحليلية عند 4 درجات مئوية على نظام كروماتوغرافيا سائلة عالي الأداء (HPLC) مقترنا بكاشف للأشعة فوق البنفسجية وكاشف تشتت الضوء متعدد الزوايا وكاشف معامل الانكسار التفاضلي (dRI).
- قبل توصيل عمود UHPLC بالنظام ، قم بتطهير المضخة وأجهزة الكشف بمياه مفلترة (0.1 ميكرومتر) من فئة HPLC.
- قم بتوصيل عمود UHPLC (انظر جدول المواد للعمود المستخدم) بالنظام. قم بموازنة العمود بالماء المصفى (0.1 ميكرومتر) ثم المخزن المؤقت SEC-MALS (الجدول 1) حتى تصل جميع إشارات الكاشف إلى خط الأساس.
- حقن 2 ميكرولتر من 6 ملغ / مل من ألبومين مصل الأبقار (BSA) بمعدل تدفق 0.3 مل / دقيقة لمدة 15 دقيقة لكل حقنة وفحص جودة البيانات. قم بإجراء التسوية ومحاذاة الذروة وتصحيح توسيع النطاق بناء على ملف تعريف BSA ، وقم بإنشاء قالب لعمليات تشغيل عينة HTT التالية.
- قم بإذابة قارورة من عينة FL Q23-HTT بسرعة في حمام مائي بدرجة حرارة الغرفة باستخدام عوامة. قم بتصفية HTT من خلال مرشح دوران 0.1 ميكرومتر. حقن 2-4 ميكرولتر من عينة HTT وتشغيلها لمدة 15 دقيقة عند 4 درجات مئوية بمعدل تدفق 0.3 مل / دقيقة.
- قم بتحليل البيانات الكروماتوغرافية وتشتت الضوء باستخدام البرامج المصاحبة (انظر جدول المواد). استخدم كاشف dRI ككاشف تركيز واستخدم 0.185 كزيادة معامل الانكسار (dn / dc) ل HTT. قم بإنشاء مخطط Zimm لتحديد الكتلة الجزيئية المتوسطة للوزن لكل ذروة33,34.
ملاحظة: يتم حساب زيادة معامل الانكسار ل HTT على أنها 0.185 باستخدام برنامج SEDFIT35 وتسلسل الأحماض الأمينية الأولية ل HTT كمدخل.
ملاحظة: يتم تحديد مونومر HTT MW بواسطة SEC-MALS عند ~ 370 كيلو دالتون ± 30 كيلو دالتون. يحتوي HTT المنقى عادة على محتوى مونومر يتراوح بين 60 و 75٪ (في هذا المختبر). قد يشير المحتوى المنخفض من المونومر إلى ضرورة توخي المزيد من الحذر في المناولة لمنع التجميع.
8. صفحة أصلية زرقاء لتحليل تشتت HTT
- قم بإعداد 1 لتر من المخزن المؤقت للأنود عن طريق خلط 50 مل من المخزن المؤقت لتشغيل 20x Blue Native PAGE (انظر جدول المواد) مع 950 مل من H 2 O. قم بإعداد 2 لتر من المخزن المؤقت للكاثود الأزرق الداكن عن طريق خلط 100 مل من 20x Blue Native PAGE تشغيل المخزن المؤقت و 100 مل من مضافات الكاثود Blue Native PAGE (20x) مع 1800 مل من H2O. برد المخازن المؤقتة إلى 4 درجات مئوية قبل الاستخدام.
- قم بإذابة قارورة من عينة FL Q23-HTT بسرعة في حمام مائي بدرجة حرارة الغرفة باستخدام عوامة. احتفظ بالبروتين المذاب على الثلج قبل الاستخدام.
- امزج 5 ميكروغرام من FL Q23-HTT (~ 1 مجم / مل) ، 1 ميكرولتر من مادة 0.5٪ G250 المضافة ، 2.5 ميكرولتر من 4x المخزن المؤقت لعينة Blue Native PAGE ، والماء ليصل الحجم النهائي إلى 10 ميكرولتر.
- قم بتحميل عينة FL Q23-HTT المختلطة على جل Bis-Tris مسبق الصب بنسبة 3-12٪. تحميل 7.5 ميكرولتر من معيار البروتين غير الملوث في نفس هلام المعيار.
- املأ الجزء الأمامي من الخزان بمخزن مؤقت كاثود أزرق داكن والجزء الخلفي من الخزان بمخزن مؤقت للأنود.
ملاحظة: املأ المخازن المؤقتة بعد تحميل العينة للسماح بالرؤية السهلة عند تحميل العينات. - قم بتشغيل الجل عند 150 فولت لمدة 120 دقيقة في غرفة باردة.
- إزالة البقع هلام مع حل إزالة البقع (الجدول 1) حتى يتم ملاحظة الأربطة. نقل الجل إلى الماء. تصور وتوثيق الجل على محطة التصوير.
ملاحظة: تم تصميم Blue Native PAGE في الأصل لتحليل البروتينات الغشائية. تم تكييفه في هذا المختبر كطريقة بديلة لتقدير محتوى HTT الأحادي. يرتبط بالمناطق الكارهة للماء في HTT ويمنعها من تكوين الركام في ظل ظروف عازلة تفتقر إلى المنظفات. يتسبب Native PAGE التقليدي بدون استخدام Coomassie blue G250 في تكوين HTT لأوليغومرات ومجاميع قابلة للذوبان ، ويرجع ذلك على الأرجح إلى العديد من الجيوب الكارهة للماء الموجودة في HTT.
9. صفحة SDS متبوعة ب Coomassie أو تلطيخ الفضة لتحليل نقاء HTT
- أضف 4x LDS عينة عازلة وكاشف تقليل 10x إلى FL Q23-HTT المنقى لجعل التركيز النهائي للمخزن المؤقت للتحميل وتقليل الكاشف ليكون 1x.
- سخني العينة على كتلة تسخين جافة عند 70 درجة مئوية لمدة 10 دقائق.
- قم بتحميل 1 ميكروغرام كحد أقصى من البروتين لكل بئر على جل أسيتات Tris بنسبة 3-8٪ وقم بتشغيله بسرعة 150 فولت لمدة 1 ساعة باستخدام المخزن المؤقت لتشغيل Tris-acetate SDS.
ملاحظة: البروتينات المستخدمة في هذه الدراسة متاحة أيضا مباشرة من مستودع مجتمع HD في معهد كوريل (www.coriell.org/1/CHDI) ؛ انظر جدول المواد. - كوماسي وصمة عار
- اغسل الجل ب H2O لمدة 5 دقائق.
- قم بتلطيخ الجل في محلول تلطيخ Coomassie (الجدول 1) عن طريق هز الجل في 30 مل من محلول التلوين لمدة 15 دقيقة.
- قم بإزالة البقع عن طريق هز الجل في 50 مل من H2O لمدة 5 دقائق. كرر مرتين. تصور وتوثيق الجل الملون ب Coomassie على محطة التصوير.
- صبغة فضية باستخدام مجموعة بقع فضية تجارية.
- بعد SDS-PAGE ، ثبت الجل باستخدام محلول التثبيت (الجدول 1) لمدة ساعة واحدة إلى ليلة واحدة في درجة حرارة الغرفة.
- قم بإجراء البقعة وغسلها وتطويرها وفقا لتعليمات المجموعة.
- أوقف خطوة التطوير فورا بمجرد وصول النطاقات إلى الكثافة المطلوبة.
- قم بتوثيق الجل في نظام توثيق هلام مجهز بمصدر ضوء مرئي.
ملاحظة: يمكن الكشف عن HTT المنقى بنسبة >95٪ بواسطة Coomassie وتلطيخ الفضة باستخدام هذا البروتوكول. ارجع إلى البروتوكول32 المنشور مسبقا للحصول على تفاصيل حول كيفية إجراء تحليل البروتين الكمي.
النتائج
تم تصميم متجه تعبير عابر (pcDNA3.1-Q23-HTT-TEV-FLAG ، الشكل 1A) للإنتاج السريع في خلايا الثدييات ل FL Q23-HTT (aa 1-3,144 ، بناء على ترقيم Q23). يحتوي هذا البناء على ميزات مصممة لتوليد تركيبات طفرة HTT المختلفة بسرعة عن طريق استنساخ الكاسيت ، وتسهيل تنقية بروتين HTT بجودة عالية وتجانس مع الحد الأدنى من الخطوات الكروماتوغرافية ، ولديه خيار إنتاج FL HTT غير موسوم. تتضمن قائمة الميزات 1. يمكن استخدام مواقع هضم تقييد HindIII ، المحيطة بتكرار CAG في HTT exon 1 ، لتوليد طفرات FL HTT مع امتداد polyQ بأطوال مختلفة عن طريق هضم إنزيم التقييد وربطه. 2. تم تمييز الطرف الطرفي C ل FL HTT ب FLAG epitope مع موقع التعرف على البروتياز TEV لتنقية التقارب بخطوة واحدة ل FL HTT بنقاوة عالية وتوليد اختياري من بروتين FL HTT الخالي من العلامات باستخدام انقسام الأنزيم البروتيني TEV ؛ 3. تسلسل FL HTT المحسن للكودون لاستخدام كودون الخلية البشرية للتعبير عالي المستوى في خلايا HEK293. يستخدم ناقل pcDNA 3.1 (+) كعمود فقري للبناء للاستفادة من نشاط تنشيط النسخ العالي لمروج CMV في خطوط خلايا الثدييات.
باستخدام pcDNA3.1-Q23-HTT-TEV-FLAG كقالب البداية ، تم إنتاج بنيات Q48 و Q73 FL HTT عن طريق توليف شظايا الحمض النووي بطول Q المناسب الذي يمتد على موقعين لإنزيم تقييد HindIII ومبادلة نفس المنطقة في القالب. تم إنتاج متحولة ΔExon1 من FL HTT (aa 91-3,144) (الشكل 1B) باستخدام مواد أولية موجهة إلى المخلفات المحذوفة التي تمتد عبر منطقة exon 1 في القالب. نمت خلايا HEK293 المنقولة باستخدام pcDNA3.1-Q23-HTT-TEV-FLAG باستخدام PEI في قوارير شاكر سعة 5 لتر أقل من 5٪ CO2. تستخدم التنقية النموذجية واسعة النطاق حبيبات خلية 2-10 لتر تحتوي على 6.0 × 10 9-3.0 × 1010 خلايا. قبل الشروع في التنقية ، تم تقدير مستوى تعبير HTT من كل عملية نقل عن طريق النشاف الغربي الكمي باستخدام HTT المنقى المؤتلف الموسوم بالعلم كجسم مضاد قياسي ومضاد ل FLAG كأول جسم مضاد. تم استخدام الكريات ذات مستوى تعبير HTT المقدر عند ≥2 بيكوغرام HTT / خلية للتنقية.
تتكون تنقية FL HTT من عملية عمود من خطوتين ، أولا مع تنقية التقارب المضاد ل FLAG ثم مع SEC على عمود ترشيح الهلام مع نطاق فصل مناسب ل HTT (الشكل 2A ؛ انظر جدول المواد للحصول على أمثلة). بعد كلتا الخطوتين ، تم الحصول على HTT عند نقاء عينة >95٪ ، على النحو الذي حدده SDS-PAGE مع محتوى Coomassie الأزرق ومونومر >65٪ بناء على SEC-MALS التحليلي. نظرا لأن كلا من وقت التنقية المطول ودرجة الحرارة لهما تأثير سلبي على محتوى مونومر HTT النهائي ، فقد تم استخدام FPLC في كل من خطوات التنقية لتقليل المناولة والحصول على جودة عينة متسقة. كان الملوث الرئيسي أثناء التنقية المضادة ل FLAG هو المرافق Hsp70 كما هو محدد بواسطة قياس الطيف الكتلي (الشكل 2B ، الممر 2). هذا يتفق مع النتيجة التي تفيد بأن Hsp70 يتم تنقيته بشكل مشترك مع FL HTT معبرا عنه بثبات في خطوط الخلايا البشرية24 ، مما يشير إلى أن Hsp70 قد يكون مثبتا شائعا ل FL HTT في الجسم الحي.
يمكن القضاء على تلوث Hsp70 عن طريق الغسيل المكثف باستخدام كلوريد المغنيسيوم و ATP أثناء خطوة تنقية التقارب المضاد ل FLAG (الشكل 2B ، الممر 1). عند إزالة Hsp70 ، يكون FL HTT عرضة لتشكيل أوليغومرات أعلى مرتبة24 ويجب الحفاظ عليه بتركيز ≤ 1 مجم / مل. غالبا ما تؤدي خطوة التركيز قبل SEC إلى تجميع كبير. لذلك ، فإن أفضل ممارسة هي تحميل كسور الذروة مباشرة من تنقية anti-FLAG على عمود استبعاد الحجم دون التركيز. بعد SEC ، تم تركيز العينة على ≤1 مجم / مل لتحقيق أقصى قدر من استرداد FL HTT الأحادي. تم تقدير كمية HTT المستردة من كل خطوة تنقية إما عن طريق النشاف الأزرق Coomassie أو الغربي الكمي باستخدام FL HTT المنقى كمعيار كمي (الجدول 2). يبلغ العائد النموذجي لبروتينات FL HTT المنقاة التي تنتجها الطريقة الموصوفة حوالي 1 مجم / لتر من زراعة الخلايا ولكنه قد يقل كثيرا عن ذلك (الجدول 3) بسبب التباين من دفعة إلى أخرى ، أو إذا تم إعادة استخدام راتنج التنقية المضاد ل FLAG عدة مرات.
يمكن أن يؤدي الإفراط في التعبير عن FL HTT إلى تجزئة البروتين22. تم حل FL Q23-HTT الناتج بالطريقة الموضحة هنا كنطاق واحد ب MW الصحيح البالغ 350 كيلو دالتون بواسطة SDS PAGE ، ملطخا إما بواسطة Coomassie G250 أو بواسطة تلطيخ الفضة (الشكل 2C). من خلال النشاف الغربي ، تفاعل FL Q23-HTT مع الأجسام المضادة المرفوعة ضد الحلقات في N-terminal و C-terminal والعديد من المجالات الوسيطة ، مع عدم ملاحظة أي نطاقات إضافية مرتبطة بالشظايا ، مما يشير إلى أن البروتين تم عزله دون اقتطاعات كبيرة يمكن اكتشافها (الشكل 3A). تفاعلت متغيرات طول FL HTT polyQ Q23 و Q48 و Q73 كما هو متوقع في اللطخة الغربية ، مما يدل على إشارة أقوى تدريجيا ل mAb MW1 الموجه polyQ المرتبط بزيادة طول Q: Q23-HTT < Q48-HTT < Q73-HTT (الشكل 3B). لم تلاحظ أي إشارة ل ΔExon1-HTT (aa 91-3,144) عند فحصها باستخدام الأجسام المضادة MW1 و MAB549 ، والتي تستهدف المحطة N exon 1 (الشكل 3B).
تم استخدام SEC-MALS لتحليل حالة التجميع والكتلة الجزيئية لبروتين HTT المنقى. تم تحليل العينات بواسطة SEC التحليلي الذي تمت مراقبته بواسطة كاشفات الأشعة فوق البنفسجية و MALS و dRI. لا تعتمد الكتلة المولية المطلقة التي تم الحصول عليها من SEC-MALS على شكل الجزيئات33,34 ؛ لذلك ، يوفر SEC-MALS تقديرا غير متحيز ل MW للكسور الأحادية والقلة عندما تكون منفصلة جيدا. من بين أعمدة HPLC التي تم اختبارها ، أظهر عمود SEC (انظر جدول المواد) دقة كافية بين مونومر HTT و dimer بحيث يمكن تمييز الكتل المولية (الشكل 4). تم تحديد تركيز البروتين عن طريق الكشف عن dRI. زيادات معامل الانكسار (dn / dc) ل FL HTT هي 0.1853 مل / جم كما تم حسابها بواسطة برنامج SEDFIT35. لوحظت أنماط شطف تحليلية مماثلة ل ΔExon1 HTT (91-3,144) و FL Q23 و Q48 و Q73 HTT (1-3,144) ، كل منها يتكون من قمة مونومر رئيسية مع قمم ثنائية وقليلة القسيمات طفيفة (الجدول 4). MW المحسوب للشكل الأحادي أكبر من MW النظري. ربما يحدث هذا بسبب تداخل الأنواع من قمم قليلة القسيمات ذات الترتيب الأعلى والأخطاء الناتجة عن إشارات dRI الضعيفة حيث يتم الحفاظ على بروتينات HTT بتركيز منخفض لتجنب تكوين أوليغومرات أعلى ترتيبا. من خلال دمج قمم الأشعة فوق البنفسجية لعدة دفعات من متغيرات FL HTT المنقاة ، لم يلاحظ أي ارتباط واضح بين طول polyQ وملف تعريف الركام (الجدول 4).
بالإضافة إلى SEC التحليلي ، تم إجراء PAGE الأصلي التقليدي لتحديد ما إذا كان يمكن استخدامه كطريقة تكميلية لتوصيف حالة قلة القسيمات FL HTT. تم حل oligomers ذات الترتيب الأعلى من خلال 3-8٪ من المواد الهلامية Tris-acetate باستخدام مخزن مؤقت أصلي بدون منظف. أظهر FL HTT المنقى من SEC نطاقات متعددة تتوافق مع حالات قلة القلة (الشكل 5 أ). كان النطاق الأدنى يقع بين العلامة الأصلية 480 كيلو دالتون و 720 كيلو دالتون ، على غرار النتائج السابقة المبلغ عنها ل FL HTT المنقى من خلايا الحشرات22. ومع ذلك ، لم يكن مونومر HTT هو النطاق الأكثر وفرة عند استخدام PAGE الأصلي التقليدي ، ولا ترتبط النتائج بالملف الشخصي الإجمالي الذي يحدده SEC-MALS التحليلي. من المحتمل أن تساهم العديد من البقع الكارهة للماء الموجودة في FL HTT36،37،38 ، وخاصة الواجهة الكارهة للماء بين HAP40 و FL HTT25 ، في تكوين أوليغومرات أعلى مرتبة أثناء الهجرة داخل الهلام. وذلك لأنه من المعروف أن المناطق الكارهة للماء تتفاعل مع بعضها البعض في غياب المنظفات أو تفاعلات البروتين والبروتين المستقرة. تمشيا مع الخصائص الكارهة للماء ل HTT ، يشكل FL HTT كميات متزايدة من الكسور قليلة القسيمات ذات الترتيب الأعلى في غياب CHAPS أثناء خطوة تنقية SEC.
تمت مقارنة Blue Native PAGE ، الذي يستخدم على نطاق واسع للتحقيق في البروتينات الغشائية ومجمعات البروتين الكبيرة التي تحتوي على بقع كارهة للماء39 ، ب PAGE الأصلي التقليدي. أظهر HTT المنقى ثلاثة نطاقات رئيسية على Blue Native PAGE مع MW المقدرة ب 643 و 927 و 1070 كيلو دالتون (الشكل 5B) والتي من المحتمل أن تمثل الأنواع الأحادية والثنائية والثلاثية من HTT ، على التوالي. ظل نطاق المونومر هو النطاق الأكثر وفرة في Blue Native PAGE ، وهو ما يتوافق بشكل جيد مع ملف تعريف SEC التحليلي لنفس العينات. قد ينتج المبالغة في تقدير MW لمونومر HTT بواسطة Blue Native PAGE عن البنية الكروية المجوفة الفريدة أو المناطق الكارهة للماء ل HTT التي تسبب هجرة أبطأ بالنسبة لعلامات الوزن الجزيئي المقابلة11،23،25. بشكل عام ، FL Q23-HTT و FL Q48-HTT و FL Q73-HTT و ΔExon1-HTT لها ملفات تعريف Blue Native PAGE متشابهة مع اختلافات طفيفة فقط في هجرة نطاق البروتين بسبب اختلافات الوزن الجزيئي.
كفحص إضافي لجودة البروتينات المنقاة ، يمكن إزالة علامة C-terminal FLAG من FL HTT عن طريق العلاج بالبروتياز TEV. بعد الانقسام المحلل للبروتين ، تم تحليل العينات بواسطة اللطخة الغربية باستخدام أربعة أجسام مضادة لتأكيد إزالة علامة FLAG والكشف عن تدهور HTT. أظهر التفاعل المناعي لمضاد FLAG M2 وثلاثة أجسام مضادة خاصة بهنتنغتين مع حوائط إلى N-terminus ، والمجالات الوسيطة ، و C-terminus من HTT إزالة علامة FLAG بنجاح وعدم وجود منتجات تحلل خاصة ب HTT (الشكل التكميلي S1).
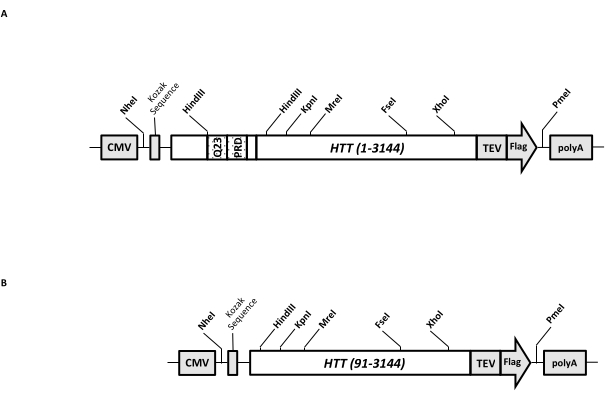
الشكل 1: بناء لتعبير HTT كامل الطول. (أ) تم تحسين Q23 HTT كامل الطول واستنساخه في بلازميد pcDNA3.1 (+). تم وضع علامة على نهاية 3 'من HTT مع Flag epitope وموقع انقسام البروتياز TEV لإنتاج بروتين HTT خال من العلامات. تم تصميم امتداد polyglutamine والمجال الغني بالبرولين مع مواقع endonuclease تقييد HindIII محاطة لإدخال تكرارات CAG إضافية باستخدام استنساخ الكاسيت ، أي Q48 و Q73 ، لإنتاج متغيرات HTT بأطوال polyQ مختلفة. (ب) تم إجراء بناء ΔExon1 بطفرات تفاعل البوليميراز المتسلسل باستخدام pcDNA3.1-Q23-HTT كقالب. بقيت المخلفات 91-3,144 من HTT في بنية ΔExon1 للتعبير. الاختصارات: HTT = هنتنغتين. CMV = الفيروس المضخم للخلايا. Q23 = تمدد بولي جلوتامين ؛ PRD = مجال غني بالبرولين ؛ TEV = موقع انقسام فيروس حفر التبغ. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
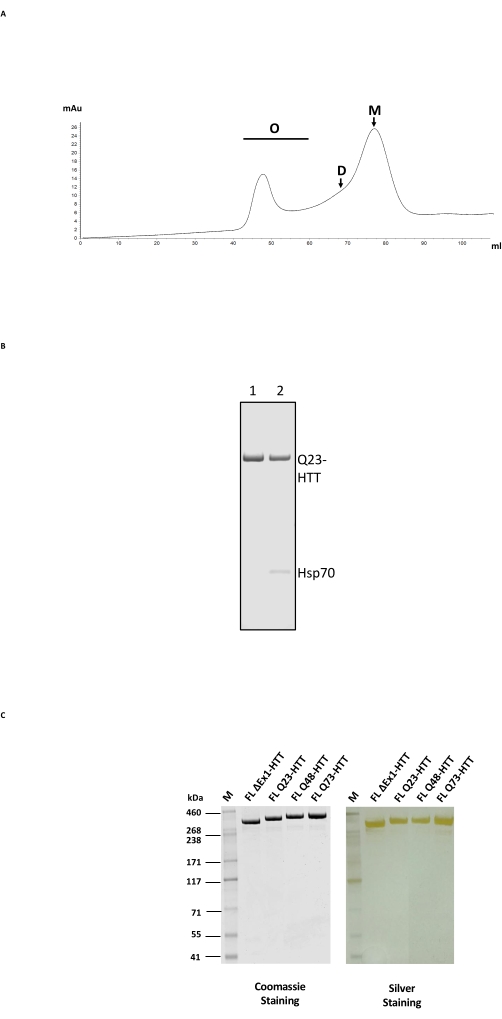
الشكل 2: تنقية HTT على نطاق واسع . (أ) ملف تعريف SEC ل Q23-HTT كامل الطول المضاد للعلم المنقى على عمود FPLC. يتم تصنيف قمم oligomers عالية الترتيب ، و dimer ، و monomer ل Q23-HTT. تم جمع الكسور التي تحتوي على مونومر كعينة HTT النهائية. (B) SDS-PAGE ل Q23-HTT المنقى مع خطوة غسيل ATP / المغنيسيوم (الممر 1) أو بدون غسيل ATP / المغنيسيوم ينتج عنه شطف مشترك Hsp70 (الممر 2). (C) متغيرات HTT النهائية المنقاة كاملة الطول على SDS-PAGE ملطخة ب Coomassie Blue G-250 أو صبغة فضية. الاختصارات: FL = الطول الكامل ؛ HTT = هنتنغتين. SEC = كروماتوغرافيا استبعاد الحجم ؛ FPLC = كروماتوغرافيا البروتين السائل السريع ؛ O = أوليغومر. D = ديمر. م = مونومر ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي. Hsp70 = بروتين الصدمة الحرارية 70. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
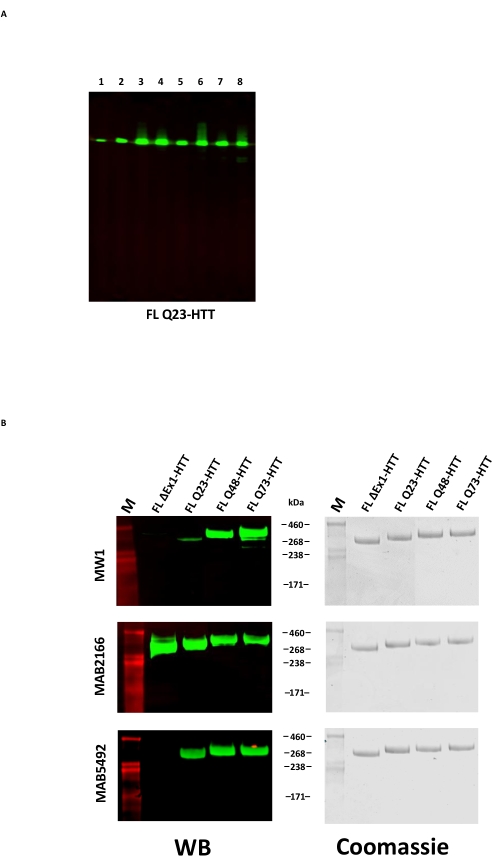
الشكل 3: تحليل اللطخة الغربية لمتغيرات HTT النقية . (أ) تم تشغيل FL Q23-HTT المنقى على SDS-PAGE وتم نقله إلى غشاء PVDF. الأجسام المضادة الأولية والحواتم المتفاعلة هي Lane 1 و α-FLAG M2 و FLAG tag. لين 2 ، MAB5492 ، HTT aa. 1-82; لين 3 ، MAB5490 ، HTT aa 115-129 ؛ لين 4 ، MAB2166 ، HTT aa 181-810 ؛ لين 5 ، MAB3E10 ، HTT aa 1,171-1,177 ؛ لين 6 ، MAB4E10 ، HTT aa 1,844-2,131 ؛ لين 7 ، MAB2168 ، HTT aa 2,146-2,541 ؛ لين 8 ، MAB8A4 ، HTT aa 2,703-2,911. (B) تم تشغيل 1 ميكروغرام من متغيرات FL HTT المنقاة على SDS-PAGE ونقلها إلى PVDF (يسار) ، وتم تشغيل هلام SDS مكرر وصبغه باللون الأزرق Coomassie (يمين). الأجسام المضادة الأولية والحواتم المتفاعلة هي الصف 1 ، MW1 ، تكرار PolyQ الموسع. الصف 2 ، MAB2166 ، HTT aa 181-810 ؛ الصف 3 ، MAB5492 ، HTT aa 1-82. الاختصارات: FLL Q23-HTT = بروتين هنتنغتين كامل الطول يحتوي على 23 بقايا جلوتامين ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي. WB = لطخة الغربية. م = علامة ؛ PVDF = فلوريد البولي فينيلدين. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
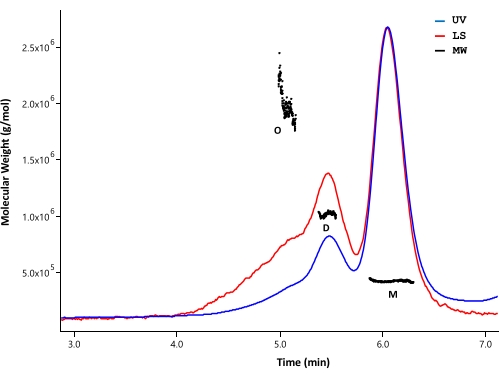
الشكل 4: تحليل SEC-MALS ل HTT كامل الطول. تم استخلاص Q23-HTT كامل الطول المنقى على عمود UPLC. يشار إلى مواضع الذروة للمونومر والدايمر والأوليغومر المتوقع. تم حساب الأوزان الجزيئية لقمم المونومر والديمر والتشذيب والمدرجة في الجدول 5. لوحظت ملفات تعريف شطف مماثلة ل Q48 و Q73 و ΔExon1 HTT ، مع محتويات مونومر ودايمر و oligomer متغيرة في كل تنقية. الاختصارات: SEC-MALS = كروماتوغرافيا استبعاد الحجم مع تشتت الضوء متعدد الزوايا ؛ الأشعة فوق البنفسجية = الأشعة فوق البنفسجية. LS = تشتت الضوء ؛ MW = الوزن الجزيئي ؛ Q23-HTT = بروتين هنتنغتين يحتوي على 23 بقايا جلوتامين ؛ م = مونومر ؛ D = ديمر. O = أوليغومر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
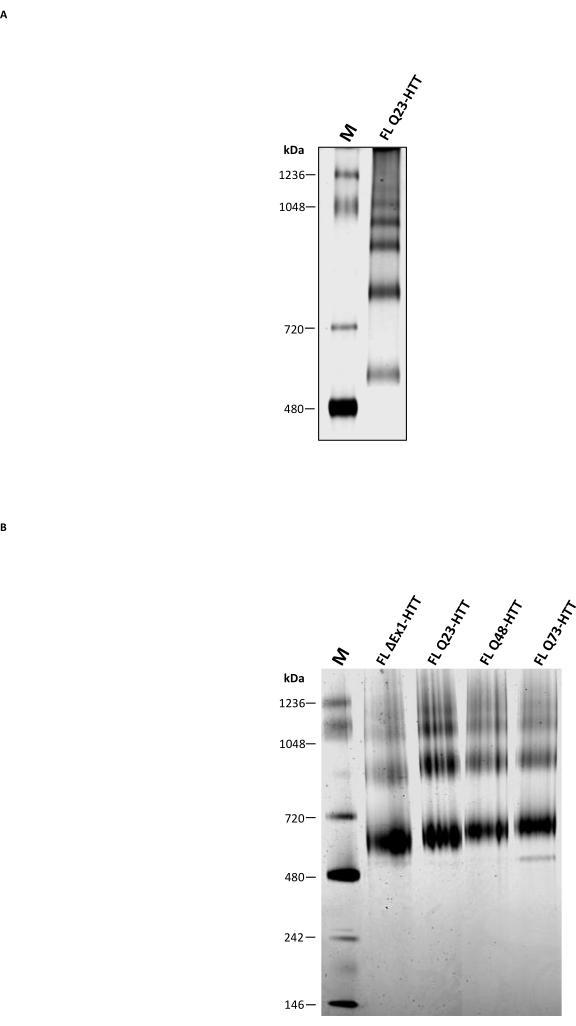
الشكل 5: توصيف HTT المنقى باستخدام Native PAGE واضح أو جل Blue Native PAGE. تم حل العلامة الأصلية و Q23-HTT الأحادي الظاهر من SEC على 3-8٪ من المواد الهلامية Tris-acetate في نظام PAGE غير مسخ (A) ونظام Blue Native PAGE (B). الاختصارات: FL = كامل الطول ؛ Q23-HTT = بروتين هنتنغتين يحتوي على 23 بقايا جلوتامين ؛ PAGE = بولي أكريلاميد هلام الكهربائي. م = علامة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| درج | اسم | تكوين | ||
| 6.1.1 | المخزن المؤقت أ | 50 ملي مللي متر تريس، 500 ملليمتر كلوريد الصوديوم، 5٪ فولت/فولت جليسرول، 5 مليمتر إيدتا، 0.01٪ فولت/فولت توين -20، درجة حموضة 8.0. | ||
| 6.1.2 | تحلل العازلة | 50 مللي مول تريس، 500 ملليمتر كلوريد الصوديوم، 5٪ فولت / فولت الجلسرين، 5 مليمتر EDTA، و 1x كوكتيل مثبط للأنزيم البروتيني | ||
| 6.1.4.2 | المخزن المؤقت أ | 50 ملي مللي متر تريس، 500 ملليمتر كلوريد الصوديوم، 5٪ فولت/فولت جليسرول، 5 مليمتر إيدتا، 0.01٪ فولت/فولت توين -20، درجة حموضة 8.0. | ||
| 6.1.4.3 | المخزن المؤقت ب | 50 ملي متر تريس. 500 مللي متر KCl ؛ 5 mM MgCl2 ؛ 5٪ V / V الجلسرين. 0.01٪ v / v Tween-20 ، درجة الحموضة 8.0 | ||
| 6.1.4.4 | العازلة ج | 20 ملي متر تريس. 200 مللي متر KCl ؛ 5 mM MgCl2 ؛ 5 مليمتر ATP ؛ 0.01٪ v / v Tween-20 ؛ 5٪ فولت / فولت الجلسرين ، درجة الحموضة 8.0 | ||
| 6.1.4.5 | العازلة د | 50 ملي متر تريس. 500 مللي متر كلوريد الصوديوم ؛ 5٪ V / V الجلسرين. 5 مللي متر EDTA ؛ 0.5٪ وزن / حجم CHAPS ، درجة الحموضة 8.0 | ||
| 6.1.4.6 | العازلة للشطف | 50 ملي متر تريس. 500 مللي متر كلوريد الصوديوم ؛ 5٪ V / V الجلسرين. 0.5٪ ث / فولت CHAPS ؛ 0.2 ملغ / مل DYKDDDDK الببتيد ، درجة الحموضة 8.0 | ||
| 6.1.6 | العازلة للتجديد | 0.1 م جليكاين حمض الهيدروكلوريك ، درجة الحموضة 3.5 ؛ 0.01٪ v / v Tween-20 | ||
| 6.2.1 | SEC العازلة | 50 مللي أمبير Tris، 500 مللي متر كلوريد الصوديوم، 5٪ فولت/فولت جليسرول، 0.5٪ مع CHAPS، 1 مليمتر TCEP | ||
| 7.3 | SEC-MALS العازلة | 50 ملي مللي متر HEPES ، درجة حموضة 7.2 ، 500 مللي متر كلوريد الصوديوم ، 5٪ فولت / فولت جليسرول ، 0.5٪ وزن / فولت CHAPS | ||
| 8.7 | حل إزالة البقع | 40٪ V / V الميثانول و 7٪ V / V حمض الخليك | ||
| 9.4.2 | حل تلطيخ كوماسي | 0.01٪ وزن / فولت كوماسي G250 ، 50٪ فولت / ف / ميثانول ، 10٪ فولت / فولت حمض الخليك | ||
| 9.5.1 | حل التثبيت | 50٪ v / v ميثانول ، 10٪ v / v حمض الخليك ، 50 ميكرولتر من الفورمالديهايد / 100 مل من المحلول | ||
الجدول 1: تكوين المخازن المؤقتة والحلول
| الخطوات | تركيز HTT (ملغم / مل) | الحجم الكلي (مل) | محتوى HTT (ملغ) | إنتاجية HTT لكل خلية (pg / cell) | ٪ العائد |
| طافي | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| مكافحة العلم | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| ثانيه | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
الجدول 2: عائد HTT من حبيبات HEK293 سعة 2 لتر منقولة باستخدام pcDNA3.1-Q23-HTT-TEV-Flag. الاختصارات: FL Q23-HTT = بروتين هنتنغتين كامل الطول يحتوي على 23 بقايا جلوتامين ؛ TEV = موقع انقسام فيروس حفر التبغ ؛ SEC = كروماتوغرافيا استبعاد الحجم.
| عينة HTT | HTT العائد (ملغم / لتر) | متوسط النقاء (٪) | ||
| بي سي أ | أ280 | |||
| 1 | FL DEx1-HTT (N = 3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N = 3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N = 3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N = 3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
الجدول 3: ملخص لمحصول البروتين لأربعة تنقيات متغيرة FL HTT ونقاوتها النهائية. اختصار: FLL HTT = بروتين هنتنغتين كامل الطول.
| عينة HTT | A | D | M |
| فلوريدا Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| فلوريدا Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| فلوريدا Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
الجدول 4: ملخص للمحتوى الكلي والدايمر والمونومر التمثيلي لمتغيرات FL HTT من التنقية. الاختصارات: FL HTT = بروتين هنتنغتين كامل الطول ؛ أ = إجمالي ؛ D = ديمر. م = مونومر ؛ SEC = كروماتوغرافيا استبعاد الحجم.
الشكل التكميلي S1: تحليل اللطخة الغربية بعد هضم الأنزيم البروتيني TEV. تم تشغيل FL Q23-HTT المنقى و FL Q48-HTT على SDS-PAGE ، وتم نقلهما إلى أغشية PVDF ، وتحليلهما بواسطة النشاف الغربي بعد هضم TEV. كانت الأجسام المضادة الأولية المستخدمة هي المضادة للعلم M2 (علامة العلم) ، MAB5492 (HTT aa 1-82) ، MAB3E10 (HTT aa 997-1,276) ، و MAB2168 (HTT aa 2,146-2,541). لين 1 ، معيار البروتين ؛ حارة 2 ، Q23-HTT-TEV-العلم ؛ حارة 3 ، Q48-HTT-TEV-العلم ؛ حارة 4 ، Q23-HTT-TEV-Flag تعامل مع البروتياز TEV في 1:5 ، بين عشية وضحاها في 4 درجة مئوية. حارة 5 ، Q48-HTT-TEV-Flag تعامل مع البروتياز TEV في 1:5 ، بين عشية وضحاها عند 4 درجات مئوية. الاختصارات: FL HTT = بروتين هنتنغتين كامل الطول ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي. TEV = فيروس حفر التبغ ؛ PVDF = فلوريد البولي فينيلدين. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S2: تحليل SEC-MALS لمتغيرات FL HTT المعرضة لدورات التجميد والذوبان. تم تجميد Q23-HTT (A) و Q48-HTT (B) المنقى عند -80 درجة مئوية وإذابتهما في درجة حرارة الغرفة لمدة تصل إلى 6 مرات. ثم تم تحليل Q23-HTT و Q48-HTT بعد دورات التجميد والذوبان الأولى ودورات التجميد والذوبان السادسة بواسطة SEC-MALS. لوحظ انخفاض طفيف في جزء المونومر وزيادة في كسور الدايمر والأوليغومر عالية الترتيب عن طريق تشتت الضوء بعد دورات التجميد والذوبان المتكررة. يشار إلى مواضع الذروة للمونومر المتوقع ، والدايمر ، والأوليغومر عالي الترتيب. الاختصارات: FL HTT = بروتين هنتنغتين كامل الطول ؛ O = أوليغومر. D = ديمر. م = مونومر ؛ SEC-MALS = كروماتوغرافيا استبعاد الحجم مع تشتت الضوء متعدد الزوايا. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S3: صفحة SDS لمتغيرات FL HTT المعرضة لدورات التجميد والذوبان. تم تجميد Q23-HTT المنقى (الممرات 2-7) و Q48-HTT (الممرات 9-14) عند -80 درجة مئوية وإذابتها في درجة حرارة الغرفة لمدة تصل إلى 6 مرات. تم تخزين حصص Q23-HTT و Q48-HTT بعد كل دورة تجميد وذوبان ثم تم تحليلها بواسطة SDS PAGE. ولم تلاحظ أي زيادة في الناتج الكلي أو المتحلل؛ تم اعتبار العينات مستقرة ونقية بنسبة >95٪ عن طريق قياس كثافة النطاق. الاختصارات: FL HTT = بروتين هنتنغتين كامل الطول ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي الكهربائي. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: البرنامج النصي FPLC 15 مل لمكافحة FLAG HTT. الاختصارات = FPLC = كروماتوغرافيا البروتين السائل السريع ؛ HTT = بروتين هنتنغتين. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: FPLC SEC_MALS برنامج نصي HTT. الاختصارات: SEC-MALS = كروماتوغرافيا استبعاد الحجم مع تشتت الضوء متعدد الزوايا ؛ FPLC = كروماتوغرافيا البروتين السائل السريع ؛ HTT = بروتين هنتنغتين. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
وصفنا هنا طريقة نقل وتعبير وتنقية عابرة لتوليد تركيبات بروتين FL HTT متعددة بنقاوة وتجانس مناسبين لاستخدامها كمعايير للمقايسة المناعية وتطوير مقايسة MS ، وضوابط لتحليل اللطخة الغربية ، ولدراسات وظيفة الهيكل. طريقة التعبير العابر هذه قابلة للتطوير ومتعددة الاستخدامات وتمكن المستخدم من توليد كميات منخفضة ملليغرام من متغيرات FL HTT بشكل أكثر كفاءة من استخدام خطوط الخلايا المستقرة أو الطرق القائمة على الفيروسات الموصوفة سابقا21،22،23،24. بشكل روتيني ، يمكن توليد 2-5 ملغ من FL HTT عالي النقاء من إنتاج بروتين على نطاق 2 لتر يتم تشغيله في أقل من أسبوع باستخدام طريقة التعبير العابر بمجرد بناء البلازميد ، مع عائد نموذجي من 1-2.5 مجم من FL HTT لكل لتر من زراعة الخلايا.
تتغلب طريقة التعبير العابر الموصوفة هنا على العديد من العقبات في التعبير عن خط الخلية المستقر ، مثل الوقت الطويل اللازم لإنشاء خطوط الخلايا والصعوبات في تخزين خطوط الخلايا المستقرة والحفاظ عليها. كما أن جزيرة الأمير إدوارد غير مكلفة نسبيا مقارنة بكواشف النقل الأخرى في السوق ، مما يجعل النقل على نطاق واسع مجديا اقتصاديا. هناك أيضا قيود في البروتوكول: تعتمد كفاءة النقل إلى حد كبير على جودة البلازميدات ، والنمو الأمثل للخلايا ، ومدى جودة تخزين جزيرة الأمير إدوارد وإعدادها. يحتاج المشغلون إلى توخي الحذر بشكل خاص وتنفيذ ضوابط الجودة في تلك الخطوات الحاسمة لتجنب الانخفاض الحاد في غلة البروتين. الراتنج المضاد للعلم المستخدم في البروتوكول مكلف نسبيا أيضا ويظهر انخفاضا في التقاط FL HTT بعد عدة عمليات تنقية وتجديد. قد يجد بعض الباحثين أنه من العملي أكثر التبديل إلى علامة مختلفة للسماح بتجديد أكثر قوة لراتنج التقارب.
تم اختبار خطوط الخلايا المختلفة وظروف التعبير لتحسين مستويات تعبير FL HTT. تم اختيار خلايا HEK293 للتعبير عن FL HTT بسبب التعبير العالي للبروتين وسهولة التعامل معها في شكل ثقافة التعليق ، مما يجعل الطريقة مناسبة للتعبير على نطاق واسع في الهزازات أو المفاعلات الحيوية. يمكن تحقيق مستوى أعلى من تعبير بروتين FL HTT في درجات حرارة زراعة منخفضة مثل 32 درجة مئوية بدلا من استخدام درجة الحرارة المعتادة البالغة 37 درجة مئوية. من الممكن أن تؤدي درجة الحرارة المنخفضة إلى إبطاء تخليق البروتين وتعزيز الطي الصحيح ل FL HTT40. ومع ذلك ، فإن هذه الظاهرة ليست خاصة ب FL HTT أو خطوط الخلايا التي تم اختبارها. تم استخدام درجة حرارة ما بعد النقل المنخفضة على نطاق واسع في التعبير عن البروتين الصيدلاني في خلايا CHO. على الرغم من أن الآلية ليست مفهومة تماما ، إلا أنه يعتقد أن درجات الحرارة المنخفضة توقف دورة الخلية في المرحلة G1 وتحول الطاقة الخلوية إلى إنتاج البروتين41.
يذوب HTT كامل الطول المنقى من خلايا الثدييات مع المرافق Hsp7024 ، ويمكن لخطوات الغسيل Mg-ATP إزالة بروتين Hsp70. ومن المثير للاهتمام ، أن Hsp70 المشترك لم يلاحظ في FL HTT المنقى من نظام تعبير خلية الحشرات21،22،23. قد يعكس هذا اختلافا في PTMs ل FL HTT أو استجابات بروتين الصدمة الحرارية للتعبير المفرط ل FL HTT في خلايا الثدييات والحشرات. بمجرد تجريد البروتين المؤتلف من Hsp70 ، يلزم وجود منظفات غير أيونية مثل CHAPS أو DDM لتثبيت الشكل الأحادي ل FL HTT.
تم تحليل حالات قلة القلة لمتغيرات FL HTT باستخدام Blue Native PAGE و SEC-MALS. كان جزء صغير من HTT قليل القسيمات ثنائي الترتيب وأعلى رتبة موجودا عند تحليله إما بواسطة Blue Native PAGE أو SEC-MALS. وتجدر الإشارة إلى أن الأوليغومرات ذات الترتيب الأعلى التي شكلتها FL HTT لا يبدو أنها ترتبط بطول polyQ ، وحتى متحولة حذف Exon1 تعرض نسبة أحادية - ديمر - مونومر مماثلة. من المحتمل أن تكون الاختلافات الفعلية في محتوى oligomer بين هذه التركيبات بسبب الاختلافات الطفيفة في إنتاج كل دفعة والتعامل معها. على عكس الركام والألياف التي شكلتها HTT Exon140,41 ، ظلت الأوليغومرات الأعلى مرتبة من FL HTT قابلة للذوبان ويمكن تحليلها بواسطة SEC و Native PAGE.
أحادي المنقى FL HTT مستقر نسبيا فقط. التخزين المطول عند 4 درجات مئوية ، أو الحضانة القصيرة في درجة حرارة الغرفة ، أو التركيزات > 1 مجم / مل ستحول جميعها FL HTT أحادي إلى أشكال قليلة القسيمات ثنائية ومرتبة أعلى على الرغم من عدم وجود هطول مرئي لوحظ في ظل هذه الظروف. ظل FL HTT الأحادي المنقى الذي تم الحفاظ عليه عند ≤1 مجم / مل مستقرا نسبيا عند -80 درجة مئوية في مخزن التخزين المؤقت (50 mM Tris ، الرقم الهيدروجيني 8.0 ، 500 mM NaCl ، 5٪ v / v glycerol ، 0.5٪ w / v CHAPS ، و 5 mM DTT) كما هو موضح سابقا24. ما يصل إلى 6 دورات تجميد ذوبان من FL HTT المحضرة والمخزنة بهذه الطريقة لم تتسبب في ترسيب مرئي للبروتين ، على الرغم من ملاحظة تحول طفيف إلى حالة قلة القسيمات الأعلى بواسطة SEC-MALS (الشكل التكميلي S2). كما تم تحليل العينات بواسطة SDS PAGE بعد دورات التجميد والذوبان المتكررة. ولم تلاحظ أي رواسب مرئية؛ لم يشاهد SDS-PAGE أي مجاميع أو منتجات تحلل إضافية (الشكل التكميلي S3). لا يزال الاستقرار طويل المدى ل FL HTT المنقى قيد التحقيق. في حالة عدم وجود بيانات قاطعة طويلة الأجل ، نوصي بتخزين FL HTT المنقى عند -80 درجة مئوية لمدة لا تزيد عن 6 أشهر.
هناك طلب كبير على متغيرات بروتين FL HTT عالية الجودة والمؤتلف وطرق إنتاجها من قبل مجتمع أبحاث HD. تستخدم هذه البروتينات كمقايسة مناعية ومعايير تحليلية لمرض التصلب العصبي المتعدد ، وفي الدراسات الهيكلية ، ولتطوير مقايسات جديدة خاصة ب FL HTT. أنتجت طرق التعبير العابر واسعة النطاق الموصوفة هنا باستمرار كميات مليغرام من متغيرات FL HTT بنقاوة >95٪ ، مما يوفر أدوات أساسية لدراسات HTT. أصبح إنتاج عشرات المليغرامات من متغيرات FL HTT polyQ عالية النقاء وغيرها من الطفرات لدعم أبحاث HD أمرا روتينيا.
Disclosures
يعلن المؤلفون أنه ليس لديهم تضارب في المصالح مع محتويات هذه المقالة.
Acknowledgements
نشكر قسم العلوم الصيدلانية ، جامعة ولاية نيويورك في بوفالو ، لإجراء تحليل MS ل HTT. كان هذا العمل جهدا تعاونيا مع مؤسسة CHDI. نشكر على وجه التحديد إليزابيث م. دوهرتي. إغناسيو مونوز سانجوان ؛ دوغلاس ماكدونالد ، مؤسسة CHDI ؛ وروري كورتيس، كوريا، لمساهمتهما القيمة أثناء إعداد هذه المخطوطة. نحن ممتنون أيضا لميشيل لوش وميثرا محمودي وستيفاني فوكس لدعمهم لهذا الجهد البحثي.
Materials
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
References
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved