Method Article
Geçici İfade Sistemi Kullanarak Memeli Hücrelerinde Tam Boy İnsan Huntingtin Varyantlarının Verimli ve Ölçeklenebilir Üretimi
Bu Makalede
Özet
HEK293 hücrelerinde yapı tasarımı, geçici transfeksiyon ve tam uzunlukta insan huntingtin protein varyantlarının ekspresyonu ve saflaştırılmasını kapsayan ölçeklenebilir protokoller sunuyoruz.
Özet
Tam uzunlukta huntingtin (FL HTT), yaklaşık 350 kDa'lık bir kütleye sahip, her yerde eksprese edilen, poliglutamin (poliQ) içeren büyük (aa 1-3,144) bir proteindir. FL HTT'nin hücresel fonksiyonu tam olarak anlaşılmamış olsa da, ~ 36 tekrarın üzerindeki poliQ yolunun mutant bir genişlemesi, Huntington hastalığı (HD) ile ilişkilidir ve poliQ uzunluğu kabaca başlangıç yaşı ile ilişkilidir. Yapının mutant HTT'nin (mHTT) işlevi üzerindeki etkisini daha iyi anlamak için, büyük miktarlarda protein gereklidir. Memeli hücrelerinde FL HTT'nin miligram altı üretimi, doksisiklin ile indüklenebilir stabil hücre hattı ekspresyonu kullanılarak elde edildi. Bununla birlikte, kararlı hücre hatlarından protein üretimi, geçici transfeksiyon yöntemleriyle üstesinden gelinebilecek sınırlamalara sahiptir.
Bu yazıda, FL HTT'nin düşük miligramlık miktarda üretimi ve kodon ile optimize edilmiş plazmidlerden polietilenimin (PEI) kullanılarak geçici transfeksiyon yoluyla varyantları için sağlam bir yöntem sunulmaktadır. Yöntem ölçeklenebilir (>10 mg) ve sürekli olarak yüksek saflaştırılmış FL HTT'nin 1-2 mg / L hücre kültürünü verir. Önceki raporlarla tutarlı olarak, FL HTT'nin saflaştırılmış çözelti durumunun oldukça dinamik olduğu bulunmuştur; proteinin dimerler ve yüksek dereceli oligomerler oluşturma eğilimi vardır. Oligomer oluşumunu yavaşlatmanın bir anahtarı, boyut dışlama kromatografisi sırasında monomerik fraksiyonları dimerik ve yüksek dereceli oligomerik fraksiyonlardan izole etmek için hızlı bir şekilde çalışmaktır.
Saflaştırılmış HTT'nin dimer ve daha yüksek dereceli oligomerik içeriğini analiz etmek için çok açılı ışık saçılımlı (SEC-MALS) boyut dışlama kromatografisi kullanıldı. FL HTT poliQ uzunluğu (Q23, Q48 ve Q73) ile oligomer içeriği arasında korelasyon gözlenmedi. Ekzon1-silinmiş yapı (aa 91-3,144), FL HTT (aa 1-3,144) ile karşılaştırılabilir oligomerizasyon eğilimi gösterdi. SEC/MALS-kırılma indisi (RI), sodyum dodesilsülfat-poliakrilamid jel elektroforezi (SDS-PAGE), western blot, Native PAGE ve Blue Native PAGE ile üretim, saflaştırma ve karakterizasyon yöntemleri burada açıklanmıştır.
Giriş
Huntington hastalığı (HD), esas olarak kararsız ve istemsiz motor hareketin yanı sıra kişilik değişiklikleri ve ilgisizlik gibi bilişsel ve psikiyatrik değişikliklerle karakterize nadir görülen bir nörodejeneratif hastalıktır 1,2. HD, huntingtin geninin (HTT) ekzon 1'inde bulunan CAG tekrarlama yolunun 35'ten fazla tekrara genişlemesi ile ilişkilidir ve hastalığın daha erken bir başlangıcı ile ilişkili daha fazla sayıda CAG tekrarı 3,4'tür. HTT'nin translasyonel ürünü olan huntingtin proteini (HTT), nöronal canlılık ve beyin gelişimi 5,6,7,8,9 ile ilişkilidir.
HTT, çok çeşitli hücresel süreçlere, vezikül transportuna, hücre bölünmesine, siliyogeneze ve otofajiye katıldığı bildirilen bir iskele proteinidir10,11. Bununla birlikte, HD'nin moleküler patogenezi tam olarak açık değildir ve poliQ-genleşmiş mHTT'nin patolojik etkisine aracılık eden anahtar protein ara aktörlerinin tanımlanması eksiktir. Bazı araştırmalar, genişlemiş HTT proteininin oligomerizasyon eğilimi tarafından yönlendirilen mHTT'den toksik fonksiyon kazanımını önermektedir, çünkü HTT agregaları HD hastalarında nöronlarda ve glialarda ve hastalığın hayvan modellerinde tanımlanmıştır 12,13,14,15,16,17 . FL HTT ve mHTT varyantlarının fonksiyon ve yapısının araştırılmasını hızlandırmak ve araştırmacılara tahlil geliştirme için yüksek kaliteli protein standartları sağlamak için, sağlam ve ölçeklenebilir bir homojen rekombinant protein tedarikine ihtiyaç vardır.
Büyüklüğü (aa 1-3.144, poliQ uzunluğu Q23'e göre numaralandırma), proteolitik instabilite ve agrega eğilimi nedeniyle, FL HTT'nin çözünür bir protein olarak ifade edilmesinin ve izole edilmesinin zor olduğu kanıtlanmıştır. Daha önce, HTT'nin ekzon 1 bölgesi (aa 2-90), Escherichia coli 18,19,20'deki proteinin çözünürlüğünü artırabilen çeşitli etiketler kullanılarak büyük ölçekte ifade edilmiş ve saflaştırılmıştır. FL HTT ilk olarak bakülovirüs 21,22 kullanılarak bir böcek hücresi ekspresyon sisteminde eksprese edildi ve saflaştırıldı ve kimyasal olarak çapraz bağlı FL Q23-HTT ve Q78-HTT'nin düşük çözünürlüklü 30 şelektron mikroskobu (EM) yapıları23 rapor edildi. HTT yapısının araştırılması, kararlı hücre hatları veya adenovirüs ekspresyonsistemleri 24 kullanılarak insan hücrelerinde doğal posttranslasyonel modifikasyonlar (PTM'ler) ile FL Q17, Q46 ve Q128-HTT üretimi elde edildiğinde daha da ilerlemiştir. Bu çalışmalar, saflaştırılmış HTT'nin esas olarak monomerik durumda bulunmasına rağmen, aynı zamanda yüksek dereceli oligomerler ve agregalar oluşturma eğiliminde olduğunu göstermektedir.
FL Q128-HTT'nin oldukça genişlemiş bir poliQ bölgesi ile analitik ultrasantrifüjlenmesi, genişlememiş poliQ bölgesi24'e sahip proteinden daha fazla oligomerik ve agrega fraksiyonu sağladı. Kararlı bir hücre hattı kullanılarak, etkileşim ortağı HAP40 ile birlikte ekspresyon yoluyla FL HTT'yi stabilize etmek için bir strateji başarıyla uyarlanmıştır. FL HTT ve HAP40 kompleksinin kriyo-EM yapısı, saflaştırılmış protein kompleksi (PDB: 6EZ8)25 kullanılarak ortalama 4 şçözünürlükte çözülmüştür. Bu birlikte ekspresyon stratejisi bir bakülovirüs sistemine başarıyla uyarlanmıştır ve farklı poliQ uzunluklarına sahip bir dizi yüksek kaliteli HTT varyantı böcek hücrelerinden eksprese edilmiş ve saflaştırılmıştır26. O zamandan beri, HTT kompleksinin değişken poliQ uzunluklarına ve HAP40 ve daha yüksek çözünürlüklü yapılara sahip daha fazla kriyo-EM yapısı çözüldü ve Protein Veri Tabanı27,28'de (PDB: 7DXK, 7DXH, 6X9O) biriktirildi.
FL HTT'nin hızlı geçici ekspresyonu için HEK293 hücrelerinde polietilenimin (PEI) kullanarak bir transfeksiyon ve ekspresyon yöntemini optimize ettik. Bir prensip kanıtı olarak, 23 glutamin (FL Q23-HTT) içeren FL HTT varyantları ilk önce saflaştırıldı ve daha önce tarif edilen bir saflaştırma yönteminin modifikasyonu kullanılarak karakterize edildi24. Bu geçici transfeksiyon yöntemi kullanışlı, yüksek verimli ve ölçeklenebilirdir; 1-2 mg / L verim ile saflaştırılmış HTT üretebilir,24 bildirilen kararlı hücre hattı yöntemiyle karşılaştırılabilir. Protein bir insan hücre hattında üretildiğinden, üretilen HTT'nin kütle spektrometrisi proteomik analizine tabi tutulduğunda yerli insan PTM'lerine sahip olma olasılığı daha yüksektir 11,29,30,31. FL HTT'nin FL Q48-HTT, FL Q73-HTT ve ekzon1-silinmiş (ΔExon1-HTT) varyantlarının miligram miktarları üretildi ve geçici ekspresyon yönteminin, üretim için kararlı hücre hatları oluşturmak için gereken zaman alıcı çabaya bağlı kalmadan HTT'nin alternatif varyantlarının hızla üretilmesinde özellikle yararlı olduğunu gösterdi.
Aşağıdaki protokol, bu yazarların laboratuvarında hücre kültürü, transfeksiyon, protein saflaştırma ve 2 L hücre kültüründen FL Q23-HTT üretmek için saflaştırma sonrası protein karakterizasyonu için kullanılan standart yöntemi örneklemektedir. Protokol daha büyük kültürlere ölçeklendirilebilir veya diğer HTT varyantlarını saflaştırmak için uyarlanabilir. FL HTT'nin 10 L'ye kadar hücre kültürü ve HTT ve HTT homologlarının çeşitli bölge veya kesme mutasyonları aynı protokol kullanılarak laboratuvarda başarıyla gerçekleştirilmiştir. Saflaştırılmış FL HTT, dimerler ve daha yüksek dereceli oligomerlerle birlikte yüksek oranda monomer içerir. Aynı toplama profili, üretilen değişkenler arasında da gözlenir (Q23, Q48, Q73 ve silinmiş Exon1). Uygun bakım yapılmadığında agregasyon meydana gelebileceğinden, protein kullanımı için en iyi koşulları belirlemek için bir formülasyon ve donma-çözülme stabilitesi çalışması yapılmıştır. Blue Native PAGE ve SEC/MALS-RI gibi yöntemler, HTT oligomer içeriğini kalite kontrol sürecinin bir parçası olarak analiz etmek için de açıklanmaktadır. HD araştırma topluluğuna fayda sağlamak için, bu çalışmada açıklanan plazmidler ve HTT proteinleri de Coriell Enstitüsü'ndeki HD Topluluk Deposunda (www.coriell.org/1/CHDI) biriktirilmiştir.
Protokol
1. BAYRAK etiketli HTT memeli ifadesi için yapıların tasarımı ve üretimi
- Ulusal Biyoteknoloji Bilgi Merkezi'nden (https://www.ncbi.nlm.nih.gov/) tam uzunlukta insan HTT protein dizisini (P42858) alın.
NOT: Araştırmacıların HTT'nin etki alanı organizasyonlarına aşina olmaları ve HTT mutantları için yapılar tasarlarken HTT çekirdek 3D yapısını korumaları gerekir. - P42858 dizisine dayanan insan hücresi ekspresyonu için kodon optimizasyonu gerçekleştirmek üzere bir gen sentezi hizmeti isteyin. PoliQ sayısını Q16'dan istenen Q uzunluğuna değiştirin (Q23 burada ilk yapı olarak seçildi) ve tam uzunlukta HTT genini sentezleyin.
NOT: Bu çalışmada sentezlenmiş kodon için optimize edilmiş tam uzunlukta Q23-HTT yapısı, pUC18 plazmidinde bir kesici uç olarak teslim edilmiştir. - İsteğe bağlı: Farklı Q uzunluklarının klonlanmasını ve yapılarda saflaştırmayı kolaylaştırmak için özellikler ekleyin.
NOT: Yapıların C-terminal ucuna bir tütün aşındırma virüsü (TEV) bölünme bölgesi ve FLAG saflaştırma etiketi (AAAENLYFQGDYKDDDDK) eklenmiştir. Yapılarda poliQ bölgesini kapsayacak şekilde iki HindIII bölgesi tasarlanmıştır (çevrilmiş protein dizisi, HindIII bölgeleri tanıtılarak değiştirilmez). Bu, araştırmacının HTT'nin Q uzunluğunu, tam HTT genini yeniden sentezlemeden kısıtlama enzimi sindirimi ve ligasyonu ile değiştirmesine izin verir.
2. Sentezlenmiş HTT yapılarını pcDNA3.1'e klonlayın.
- Her biri 37 °C'de 2 saat boyunca 2 μL NheI ve PmeI kullanarak 5 μg pUC18-Q23-HTT ve 5 μg pcDNA3.1'i sindirin.
- % 0.5 w / v agaroz jeli çalıştırın ve Q23-HTT fragmanını ve sindirilmiş pcDNA3.1 vektörünü bir agaroz jeli ekstraksiyon kiti kullanarak saflaştırın. Saflaştırılmış DNA konsantrasyonlarını, numunelerin mikrolitrelerini ölçebilen bir UV spektrometresi kullanarak OD280 ile sayısallaştırın.
NOT: OD260/280 1,8 ile 2,0 arasında değişir tipik olarak gözlenir. Sentezlenmiş FL HTT, bir pUC18 plazmidinde her iki ucunda NheI ve PmeI bulunan bir kesici uç olarak tedarik edilir. HTT farklı şekilde sentezlenirse diğer kısıtlama enzimlerini kullanın. - Reaksiyonda 10 ng sindirilmiş pcDNA3.1 vektörü kullanın. Saflaştırılmış DNA'ları, T4 DNA ligaz kullanarak oda sıcaklığında 10 μL reaksiyonda 1: 1 (HTT: pcDNA3.1) molar oranında 5 dakika boyunca bağlayın.
- Ligaz üreticisi tarafından belirtilen protokolü kullanarak bağlı ürünü yetkili E. coli hücrelerine dönüştürün ( Malzeme Tablosuna bakınız).
- 6 tek koloni toplayın ve 37 ° C'de 100 μg / mL karbenikilin ile desteklenmiş 4-6 mL LB içinde gece kültürleri yapın.
- Her gece kültüründen 1 mL ayırın. % 25 v / v'ye gliserol ekleyin ve gliserol stokunu -80 ° C'de kaydedin. Kullanım kılavuzunda belirtilen adımlara göre bir mini hazırlık kiti kullanarak kalan gece kültürünü arındırın.
- Plazmidin transkripsiyon bölgesi boyunca uzanan dizileme primerlerini kullanarak tüm plazmidleri sıralayın. Ana gliserol stoğu olarak doğru sıraya sahip bir gliserol stoğu seçin ve gerisini atın.
- İsteğe bağlı: PCDNA3.1-Q23-HTT plazmidindeki iki HindIII bölgesini kapsayan farklı Q uzunluklarına (Q48, Q73 ve Exon1) sahip DNA'yı sentezlemek için bir gen sentezi hizmeti isteyin. PCDNA3.1-Q23-HTT'yi ve yeni sentezlenen DNA'ları HindIII kullanarak sindirin ve pcDNA3.1 plazmidinde farklı poliQ uzunluklarına sahip FL HTT yapmak için 2.2-2.7 adımlarında olduğu gibi T4 ligaz ile güvenin.
NOT: Bu çalışmada kullanılan plazmid yapıları doğrudan Coriell Enstitüsü'ndeki HD Topluluk Deposundan da edinilebilir (www.coriell.org/1/CHDI); Malzeme Tablosu'na bakınız.
3. Büyük ölçekli transfeksiyon için GIGA prep endotoksin içermeyen plazmid DNA'sı
- pcDNA3.1-Q23-HTT-TEV-FLAG'in bakteriyel gliserol stoklarını karbenisilin (100 μg / mL) ile bir LB agar plakasına çizin. Tek koloniler ortaya çıkana kadar plakayı 16-24 saat boyunca 37 ° C'de inkübe edin.
- Tek bir koloni alın, karbenisilin (100 μg / mL) ile plazmid amplifikasyonu için formüle edilmiş zengin bir ortamda 5 mL'lik bir başlangıç kültürünü aşılayın ve 8 saat boyunca 37 ° C'de büyüyün.
- Endotoksin içermeyen bir GIGA plazmid saflaştırma kiti seçin. PCDNA3.1-Q23-HTT-TEV-FLAG plazmidini saflaştırmak için plazmid GIGA kitinin kılavuzunda belirtilen adımları izleyin.
- Limuztuls amiposit lizat (LAL) bazlı endotoksin niceleme kiti kullanarak plazmid endotoksin seviyelerini ölçün. Üreticinin el kitabında belirtilen yordamı izleyin.
NOT: İyi bir transfeksiyon verimliliği elde etmek için yüksek kaliteli, düşük endotoksin seviyeli plazmid saflaştırması şarttır. Bu protokolü kullanarak, 4 mg / mL'> plazmid konsantrasyonlarında L bakteri kültürü başına 20-40 mg plazmid (süper sarmal form >% 80) elde edilebilir. Düzgün saflaştırılmış bir plazmid, 30 AB / mg'< bir endotoksin seviyesine sahip olmalıdır. OD260/280 tipik olarak 1.8 ila 2.0 arasında değişir.
4. Polietilenimin (PEI) ile 2 L HEK293 hücresinin büyük ölçekli transfeksiyonu
- Karıştırarak 1 L endotoksin içermeyen suya 1 g PEI 25K ekleyin. 100 mM HCl kullanarak pH'ı 2,0'a ayarlayın ve tüm PEI 25K çözünene kadar karıştırın. 100 mM NaOH çözeltisi kullanarak pH'ı 7,0'a ayarlayın ve 0,2 μm'lik bir filtreden süzün. Aliquot ve bir yıla kadar -20 ° C'de saklayın.
NOT: PEI alikotları iki haftaya kadar 4 ° C'de tutulabilir, ancak çözüldükten sonra asla tekrar dondurulmamalıdır. - HEK293 hücrelerini, penisilin-streptomisin ( penisilin için 5 U / mL'de son konsantrasyon ve streptomisin için 5 μg / mL'de son konsantrasyon) ile desteklenmiş büyüme ortamında, 37 ° C, 90 rpm,18-24 saat boyunca% 5 CO 2'de nemlendirilmiş bir çalkalayıcı inkübatörde yayınlayın. Transfeksiyondan bir gün önce 5 L Erlenmeyer şişesindeki büyüme ortamını kullanarak hücreleri ~ 1.2 × 106 hücre / mL yoğunlukta 2 L'ye kadar seyreltin.
- Hücreleri18-24 saat boyunca 37 °C, 90 rpm, 5% CO 2'de büyütmeye devam edin. Kullanım kılavuzunu izleyerek hücre yoğunluğunu ve canlılığını ölçebilen bir otomatik hücre sayacı kullanarak hücre parametrelerini ölçün.
NOT: Hücre yoğunluğu iki katına çıkmalı ve canlılık% >95 olmalıdır. Transfeksiyondan önceki hücre yoğunluğu yaklaşık 2.0 × 10 6-2.4 × 106 hücre / mL olmalıdır. Gerektiğinde transfeksiyondan önce hücreleri istenen yoğunluğa kadar seyreltin. - Transfeksiyon için gerekli plazmid ve PEI miktarlarını hesaplayın; Her litre hücre kültürünün transfeksiyonu için 1 mg plazmid ve 3 mg PEI kullanın. 2 L transfeksiyon için gerekli 2 mg plazmid ve 6 mg PEI tahsis edin.
- Plazmid ve PEI'yi ayrı ayrı toplam hücre kültürü hacminin 1 /20'sine eşit bir fosfat tamponlu salin hacmine (2 L transfeksiyon için her biri 100 mL) seyreltin ve oda sıcaklığında 5 dakika boyunca inkübe edin. Seyreltilmiş plazmid ve PEI'yi hafifçe döndürerek karıştırın ve karışımı oda sıcaklığında 30 dakika boyunca inkübe edin.
NOT: Karışım inkübasyondan sonra biraz bulutlu görünecektir. - Karışımı hücre kültürüne ekleyin ve karıştırmak için hafifçe döndürün.
- Hücreleri 37 °C'de,% 5 CO2, 24 saat boyunca 90 rpm'de büyütün.
- 2 mM'lik son konsantrasyona 2 M sodyum bütirat çözeltisi ekleyin. Kültüre 1:1000 (v/v) antiklübasyon maddesi ve 1:1000 (v/v) köpük önleyici madde ekleyin.
- Şişeyi 32 °C, 90 rpm, %5 CO 2'de nemlendirilmiş bir çalkalayıcı inkübatöre taşıyın ve 48 saat boyunca büyümeye devam edin.
- Kullanım kılavuzunu izleyerek otomatik hücre sayacını kullanarak hücre yoğunluğu ve canlılığı dahil olmak üzere hücre parametrelerini ölçün.
- Bir mikrosantrifüj tüpünde 2.0 × 10 6 hücre (Vol = 2.0 × 106 / hücre yoğunluğu) aktarın. Bölüm 5'te batı lekelenmesi için bir santrifüjde 2.000 × g'daki hücreleri 1 dakika boyunca pelet edin.
- Hücreleri 30 dakika boyunca 2.000 × g'da santrifüjleme ile toplayın ve saflaştırmadan önce hücre peletini -80 ° C'de saklayın.
5. HTT ekspresyon seviyesini tahmin etmek için SDS-PAGE ve HEK293 hücre lizatının batı lekesi
- HEK293 hücre kültürünün büyük ölçekli transfeksiyonundan daha önce dondurulmuş 2.0 × 106 hücreden (adım 4.11) oluşan bir aliquot alın. 50 μg/mL digitonin, 5 mM EDTA ve 1x proteaz inhibitörü kokteyli ile desteklenmiş 250 μL Tris tamponlu salin (TBS) ekleyin ve bir pipet kullanarak birkaç kez aspire ederek hücre peletini yeniden askıya alın.
- Hücreleri lize etmek için bir minirotatör kullanarak tüpleri 4 ° C'de 30 dakika boyunca yavaşça döndürün. Çözünmeyen malzemeyi 5 dakika boyunca 17.000 × g'da santrifüj yaparak pelet edin.
- 4x indirgeyici lityum dodesilsülfat (LDS) yükleme tamponunun hacminin 1/3'ünü süpernatanta ekleyin ve 10 dakika boyunca 70 ° C'de ısıtın.
- Prekast% 3-8'lik bir Tris-asetat PAGE jeli üzerine 5-20 μL hücre lizatı yükleyin. Jel uyumlu 1x Tris-asetat SDS çalışma arabelleğini kullanarak, jeli 60 dakika boyunca 150 V'ta sabit voltaj modunda çalıştırın.
NOT: Tris-asetat SDS-PAGE, FL HTT analizi için kullanılmıştır, çünkü moleküler ağırlığı 300 kDa'nın üzerinde olan proteinler için diğer SDS-PAGE türlerinden daha yüksek çözünürlük üretir. Bu çalışmada kullanılan proteinler doğrudan Coriell Enstitüsü'ndeki HD Topluluk Deposundan da temin edilebilir (www.coriell.org/1/CHDI); Malzeme Tablosu'na bakınız. - Batı lekelemesi yapmak için, transfer tamponu ile dengelenmiş kalın transfer kağıdı, metanol ile aktive edilmiş bir poliviniliden florür (PVDF) membranı ve bir SDS-PAGE jeli kullanarak bir transfer sandviçi monte edin. Proteinleri, üreticinin kullanım kılavuzuna göre yarı kuru bir batı bloğu kullanarak PVDF membranına aktarın.
NOT: Tipik olarak, 10 cm x 10 cm'lik bir membran için 135 mA'da 20-30 dakika yeterlidir. - Transfer sandviçini sökün ve membranı TBST'de (20 mM Tris pH 7.4, 150 mM NaCl ve% 0.1 v / v Ara-20) bloke edin,% 5 yağsız sütle desteklenmiştir.
- Membranı oda sıcaklığında 15 mL primer antikor ile 1 saat boyunca bir rocker üzerinde inkübe edin (anti-FLAG antikoru monoklonal antikoru için 1:2.500 seyreltme ve diğer tüm primer antikorlar için 1:2.000).
NOT: Bu çalışmada kullanılan birincil antikorlar anti-FLAG M2, MAB5492, MAB5490, MAB2166, MAB3E10, MAB4E10, MAB2168, MAB8A4'tür (bkz. - Membranı 30-50 mL TBST kullanarak 3 x 5 dakika yıkayın.
- Membranı, floresan boya konjuge keçi anti-fare IgG sekonder anti-fare IgG sekonder antikoru ile bir rocker üzerinde, oda sıcaklığında,% 5 w / v kuru süt içeren 15 mL TBST'de inkübe edin.
- İkincil antikora özgü dalga boyunu kullanarak bir floresan görüntüleyici üzerindeki batı leke bantlarını görselleştirin. Kullanım kılavuzuna göre görüntüleyiciye eşlik eden yazılımı kullanarak bant sinyalini sayısallaştırın.
NOT: Kantitatif batı lekeleme, standart olarak saflaştırılmış HTT kullanılarak gerçekleştirilebilir. HTT'nin lineer standart aralığı cihaza özgüdür ve bu laboratuvarda bir anti-FLAG antikoru kullanılarak şerit başına 25 ng ila 250 ng HTT arasında kurulmuştur. HTT'nin batı lekesi bozulmadan arındırılmış olmalıdır; tipik olarak 2-4 pg / hücrenin toplam HTT ekspresyon seviyesi gözlenir. Kantitatif bir batı lekesinin nasıl gerçekleştirileceğine dair ayrıntılar için daha önce yayınlanmış bir protokol32'ye bakın.
6. Anti-FLAG kolon ve SEC kullanarak HTT'nin hızlı protein sıvı kromatografisi (FPLC) saflaştırılması
- Anti-FLAG saflaştırma
- Saflaştırma için gereken FLAG reçinesinin miktarını tahmin edin (tipik olarak, 2-4 L transfekte hücre kültürünün saflaştırılması için 12 mL anti-FLAG M2 afinite reçinesi). 12-25 mL anti-FLAG reçinesini, FPLC kullanarak Tampon A (Tablo 1) kullanılarak 4 mL/dak akış hızında boş bir sütuna (Malzeme Tablosuna bakınız) paketleyin. Pistonun yüksekliğini ayarlayın, böylece pistonun ucu ile reçine yatağı arasında boşluk kalmaz.
- 1 g hücre peleti başına 10 mL Lizis Tamponu oranı kullanarak, hücre peletini soğuk Lizis Tamponunda çözün ve askıya alın (Tablo 1).
- Hücre süspansiyonunu 10.000 psi'de yüksek parçalayıcı homojenizatörden bir kez geçirin. Uyumlu bir sabit açılı rotorla donatılmış bir santrifüjde 1 saat boyunca 20.000 × g'da santrifüjleme ile lizatı netleştirin.
- FPLC'yi programlayın (etütte kullanılan yazılım için Malzeme Tablosuna bakın) ve aşağıdaki dizileri çalıştırın.
- Arıtılmış lizatı numune pompası aracılığıyla yükleyin.
- 4 sütun hacmi (CV) Tampon A ile yıkayın (Tablo 1).
- 4 CV tampon B ile yıkayın (Tablo 1).
- 8 CV Tampon C ile yıkayın (Tablo 1).
- 3 CV tampon D ile yıkayın (Tablo 1).
- 3 CV Elüsyon Tamponu ile yıkayın (Tablo 1).
- SDS-PAGE kullanarak tepe fraksiyonlarının 10 μL'sini analiz edin. Tepe fraksiyonlarını toplayın ve istenen saflıkla birleştirin. SDS-PAGE analizi için kombine elüatların ~50 μL'sini kaydedin.
NOT: Normalde, tek bir tepe noktası görünecektir ve zirvede salınan tüm fraksiyonlar ~% 90 saf HTT içerir. - 5 CV Rejenerasyon Arabelleği (Tablo 1) kullanarak bir anti-FLAG sütunu yeniden oluşturun ve 5 Tampon A CV'si kullanarak sütunu yeniden dengeleyin.
NOT: Anti-FLAG reçinesi, beş defaya kadar veya bağıl verim / litre ilk saflaştırmanın% 50'sine düşene kadar tekrar kullanılabilir.
- SEC sütunu kullanarak boyut hariç tutma sütunu (SEC) saflaştırma
- Moleküler ağırlığa (MW) sahip proteinlerin 500 kDa'> ayrılmasına izin veren bir SEC sütununu önceden dengeleyin (kullanılan sütun için Malzeme Tablosuna bakın) 2 × SEC Tamponu CV'si (Tablo 1) kullanarak.
- Anti-FLAG eluate'i (adım 6.1.5'ten itibaren) 50 mL'lik bir süper döngü aracılığıyla doğrudan yükleyin. Enjeksiyon başına 1,2 × CV SEC tamponu çalıştırın. SEC ayrımını gece boyunca 4 °C'de çalıştırın.
NOT: Bu çalışmada seçilen SEC sütunlarına maksimum 5 mL veya 15 mL protein örneği yüklenebilir. FPLC'yi, birden fazla enjeksiyonun otomatik olarak gerçekleştirilebileceği şekilde programlayın. Örnek yöntem komut dosyaları Ek Dosya 1 ve Ek Dosya 2 olarak da dahil edilmiştir. - Monomer, dimer ve daha yüksek dereceli oligomerik pikleri ayırt etmek için elüsyon profilini standart HTT elüsyon profiliyle karşılaştırın. Monomerik HTT fraksiyonlarını SEC sütununun elüsyon profiline göre havuzlayın. İstenirse, daha yüksek dereceli oligomerik ve dimerik HTT fraksiyonlarını ayrı ayrı toplayın.
- Havuzlanmış HTT proteinini 4 ° C'de 100 kDa santrifüjlü bir yoğunlaştırıcı kullanarak konsantre edin. OD280 değerlerini ilgili yok olma katsayılarına bölerek protein konsantrasyonlarını hesaplayın (hesaplama için sırasıyla Q23-HTT, Q48-HTT, Q73-HTT ve ΔExon1-HTT'nin teorik yok olma katsayıları 0.776, 0.769, 0.762 ve 0.798 (mg / mL)-1 cm-1'dir). HTT konsantrasyonunu 1.0 mg / mL≤ tutun.
NOT: Aşırı konsantrasyon kümelenmeye neden olacağından konsantre olma sürecini izlemek önemlidir. - Aliquot, kriyo-güvenli mikrosantrifüj tüplerinde saflaştırılmış HTT proteinini 100 μL'lik bir hacimde <. Alikotları sıvı azot kullanarak flaşla dondurun ve -80 ° C'de saklayın.
7. HTT polidispersitesini analiz etmek için analitik HPLC SEC-MALS-dRI
- Tüm analitik SEC-MALS'yi 4 °C'de UV dedektörü, çok açılı ışık saçılma dedektörü ve diferansiyel kırılma indisi (dRI) dedektörü ile birleştirilmiş yüksek performanslı bir sıvı kromatografisi (HPLC) sisteminde gerçekleştirin.
- UHPLC kolonunu sisteme bağlamadan önce, pompayı ve dedektörleri filtrelenmiş (0,1 μm) HPLC sınıfı suyla temizleyin.
- UHPLC sütununu sisteme bağlayın (kullanılan sütun için Malzeme Tablosu'na bakın). Tüm dedektör sinyalleri taban çizgisine ulaşana kadar sütunu filtrelenmiş (0,1 μm) su ve ardından SEC-MALS tamponu (Tablo 1) ile dengeleyin.
- Enjeksiyon başına 15 dakika boyunca 0,3 mL/dak akış hızında 2 μL 6 mg/mL sığır serum albümini (BSA) enjekte edin ve veri kalitesini kontrol edin. BSA profiline göre normalleştirme, tepe hizalama ve bant genişletme düzeltmesi gerçekleştirin ve aşağıdaki HTT örnek çalıştırmaları için bir şablon oluşturun.
- FL Q23-HTT numunesinin bir şişesini şamandıra kullanarak oda sıcaklığındaki bir su banyosunda hızla çözün. HTT'yi 0,1 μm'lik bir spin filtresinden süzün. HTT numunesinden 2-4 μL enjekte edin ve 4 ° C'de 0,3 mL / dak akış hızında 15 dakika boyunca çalıştırın.
- Kromatografik ve ışık saçılma verilerini beraberindeki yazılımı kullanarak analiz edin (bkz. dRI dedektörünü konsantrasyon dedektörü olarak kullanın ve HTT için kırılma indisi artışı (dn/dc) olarak 0,185 kullanın. Her zirve33,34 için ağırlık ortalaması moleküler kütlesini belirlemek için bir Zimm grafiği oluşturun.
NOT: HTT'nin kırılma indisi artışı, SEDFIT yazılımı35 programı ve HTT'nin birincil amino asit dizisi giriş olarak kullanılarak 0,185 olarak hesaplanır.
NOT: HTT monomer MW, SEC-MALS tarafından ~ 370 kDa ± 30 kDa'da belirlenir. Saflaştırılmış HTT tipik olarak% 60 ila% 75 arasında monomer içeriğine sahiptir (bu laboratuvarda). Düşük monomer içeriği, kümelenmeyi önlemek için elleçlemede daha fazla özen gösterilmesi gerektiğini gösterebilir.
8. HTT polidispersitesini analiz etmek için Mavi Yerel SAYFA
- 50 mL 20x Mavi Doğal PAGE çalışma tamponunu (Malzeme Tablosuna bakın) 950 mL H 2 O ile karıştırarak 1 L Anot Tamponu hazırlayın 100 mL 20x Mavi Doğal PAGE çalışma tamponunu ve 100 mL Mavi Doğal PAGE katot katkı maddesini (20x) 1.800 mL H2O ile karıştırarak2L koyu mavi katot tamponu hazırlayın.
- Bir şişe FL Q23-HTT örneğini bir şamandıra kullanarak oda sıcaklığındaki bir su banyosunda hızla çözün. Çözülmemiş proteini kullanmadan önce buz üzerinde tutun.
- 5 μg FL Q23-HTT (~1 mg/mL), 1 μL %0,5 G250 katkı maddesi, 2,5 μL 4x Mavi Doğal PAGE numune tamponu ve son hacmi 10 μL'ye getirmek için su karıştırın.
- Karışık FL Q23-HTT numunesini %3-12 prekast Bis-Tris jel üzerine yükleyin. Lekesiz protein standardının 7,5 μL'sini standartla aynı jele yükleyin.
- Tankın önünü Koyu Mavi Katot tamponu ve tankın arkasını Anot tamponu ile doldurun.
NOT: Numuneleri yüklerken kolay görselleştirme sağlamak için numune yüklendikten sonra tamponları doldurun. - Jeli soğuk bir odada 120 dakika boyunca 150 V'ta çalıştırın.
- Jeli Destaining Solution (Tablo 1) ile bantlar gözlenene kadar destain yapın; jeli suya aktarın. Jeli bir görüntüleme istasyonunda görselleştirin ve belgeleyin.
NOT: Blue Native PAGE başlangıçta membran proteinlerini analiz etmek için tasarlanmıştır. Bu laboratuvarda HTT'nin monomerik içeriğini tahmin etmek için alternatif bir yöntem olarak uyarlanmıştır. HTT'nin hidrofobik bölgelerine bağlanır ve tampon koşullarında deterjansız agrega oluşturmasını önler. Coomassie mavisi G250 kullanmadan Geleneksel Yerli PAGE, HTT'nin çözünür oligomerler ve agregalar oluşturmasına neden olur, muhtemelen HTT'de bulunan birçok hidrofobik cep nedeniyle.
9. HTT saflığını analiz etmek için SDS PAGE ve ardından Coomassie veya gümüş boyama
- Yükleme tamponunun son konsantrasyonunu yapmak ve reaktifi 1x azaltmak için saflaştırılmış FL Q23-HTT'ye 4x LDS numune tamponu ve 10x azaltıcı reaktif ekleyin.
- Numuneyi kuru bir ısıtma bloğunda 70 °C'de 10 dakika ısıtın.
- % 3-8'lik bir Tris asetat jeli üzerine kuyucuk başına maksimum 1 μg protein yükleyin ve Tris-asetat SDS çalışma tamponunu kullanarak 1 saat boyunca 150 V'ta çalıştırın.
NOT: Bu çalışmada kullanılan proteinler doğrudan Coriell Enstitüsü'ndeki HD Topluluk Deposundan da temin edilebilir (www.coriell.org/1/CHDI); Malzeme Tablosu'na bakınız. - Coomassie lekesi
- Jeli 5 dakika boyuncaH2O ile yıkayın.
- Jeli Coomassie boyama çözeltisinde (Tablo 1) 30 mL boyama çözeltisinde 15 dakika boyunca sallayarak sabitleyin.
- Jeli 50 mL'likH2O'da 5 dakika sallayarak lekeyi temizleyin. Coomassie lekeli jeli bir görüntüleme istasyonunda görselleştirin ve belgeleyin.
- Ticari bir gümüş leke kiti kullanarak gümüş boyama.
- SDS-PAGE'den sonra, jeli Sabitleme Çözeltisini (Tablo 1) kullanarak oda sıcaklığında gece boyunca 1 saat boyunca sabitleyin.
- Lekeyi uygulayın, yıkayın ve kitin talimatlarına göre geliştirin.
- Bantlar istenen yoğunluğa ulaştığında gelişen adımı hemen durdurun.
- Jeli görünür bir ışık kaynağı ile donatılmış bir jel dokümantasyon sistemine yerleştirin.
NOT: %>95'te saflaştırılan HTT, bu protokol ile Coomassie ve gümüş boyama ile tespit edilebilir. Kantitatif protein analizinin nasıl yapılacağına dair ayrıntılar için daha önce yayınlanmış bir protokol32'ye bakın.
Sonuçlar
Geçici bir ekspresyon vektörü (pcDNA3.1-Q23-HTT-TEV-FLAG, Şekil 1A), FL Q23-HTT'nin memeli hücrelerinde (Q23 numaralandırmasına dayanan aa 1-3,144) hızlı üretim için tasarlanmıştır. Bu yapı, kaset klonlama yoluyla çeşitli HTT mutasyon yapılarını hızlı bir şekilde üretmek, HTT proteininin minimum kromatografik adımlarla yüksek kalite ve homojenliğe saflaştırılmasını kolaylaştırmak ve etiketsiz FL HTT üretme seçeneğine sahip olmak için tasarlanmış özelliklere sahiptir. Özelliklerin listesi 1'i içerir. HTT ekzon 1'deki CAG tekrarını çevreleyen HindIII kısıtlama sindirim bölgeleri, kısıtlama enzimi sindirimi ve ligasyonu ile çeşitli uzunluklarda bir poliQ gerilmesine sahip FL HTT mutantları üretmek için kullanılabilir; 2. FL HTT'nin C-terminal ucu, FL HTT'nin yüksek saflıkta tek adımlı afinite saflaştırılması ve TEV proteaz bölünmesi kullanılarak isteğe bağlı etiketsiz FL HTT proteini üretimi için TEV proteaz tanıma bölgesine sahip bir FLAG epitopu ile etiketlenmiştir; 3. HEK293 hücrelerinde üst düzey ekspresyon için insan hücresi kodonu kullanımı için kodon için kodon optimize edilmiş FL HTT dizisi. pcDNA 3.1 (+) vektörü, memeli hücre hatlarında CMV promotörünün yüksek transkripsiyonel aktivasyon aktivitesinden yararlanmak için yapının omurgası olarak kullanılır.
Başlangıç şablonu olarak pcDNA3.1-Q23-HTT-TEV-FLAG kullanılarak, Q48 ve Q73 FL HTT yapıları, iki HindIII kısıtlama enzim bölgesini kapsayan uygun Q uzunluğuna sahip DNA fragmanlarının sentezlenmesi ve şablondaki aynı bölgenin değiştirilmesiyle üretildi. FL HTT'nin ΔExon1 mutantı (aa 91-3,144) (Şekil 1B), şablondaki ekzon 1 bölgesini kapsayan silinmiş kalıntılara yönlendirilen primerler kullanılarak üretilmiştir. PEI kullanılarak pcDNA3.1-Q23-HTT-TEV-FLAG ile transfekte edilen HEK293 hücreleri,% 5 CO2 altında 5 L çalkalayıcı şişelerde yetiştirildi. Tipik bir büyük ölçekli saflaştırma, 6.0 × 10 9-3.0 × 10 10 hücre içeren 2-10 L hücre peleti kullanır. Saflaştırmaya geçmeden önce, her transfeksiyondan HTT ekspresyon seviyesi, standart olarak saflaştırılmış rekombinant FLAG etiketli HTT ve ilk antikor olarak anti-FLAG antikoru kullanılarak kantitatif batı lekelenmesi ile tahmin edildi. Saflaştırma için tahmini HTT ekspresyon seviyesi ≥2 pg HTT/hücre olan peletler kullanıldı.
FL HTT'nin saflaştırılması, önce anti-FLAG afinite saflaştırması ve daha sonra HTT için uygun bir ayırma aralığına sahip bir jel filtrasyon sütunu üzerinde SEC ile 2 adımlı bir sütun prosesinden oluşur (Şekil 2A; örnekler için Malzeme Tablosuna bakınız). Her iki adımdan sonra HTT, Coomassie mavisi ve analitik SEC-MALS'a dayalı %>65 monomer içeriğine sahip SDS-PAGE tarafından belirlendiği gibi, %>95 numune saflığında elde edildi. Hem uzun saflaştırma süresi hem de sıcaklığın nihai HTT monomer içeriği üzerinde olumsuz bir etkisi olduğundan, FPLC her iki saflaştırma adımında da elleçlemeyi en aza indirmek ve tutarlı numune kalitesi elde etmek için kullanılmıştır. Anti-FLAG saflaştırma sırasındaki ana kirletici, kütle spektrometresi tarafından belirlenen şaperon Hsp70 idi (Şekil 2B, şerit 2). Bu, Hsp70'in insan hücre hatları24'te kararlı bir şekilde eksprese edilen FL HTT ile birlikte saflaştırıldığı bulgusuyla tutarlıdır, bu da Hsp70'in in vivo FL HTT için ortak bir stabilizatör olabileceğini düşündürmektedir.
Hsp70 kontaminasyonu, anti-FLAG afinite saflaştırma adımı sırasında magnezyum klorür ve ATP ile kapsamlı bir şekilde yıkanarak ortadan kaldırılabilir (Şekil 2B, şerit 1). Hsp70'in çıkarılmasından sonra, FL HTT daha yüksek dereceli oligomerler24 oluşturmaya eğilimlidir ve 1 mg / mL'≤ bir konsantrasyonda tutulmalıdır. SEC'den önceki konsantrasyon adımı genellikle önemli bir toplamaya neden olabilir. Bu nedenle, en iyi uygulama, anti-FLAG saflaştırmasından tepe fraksiyonlarını konsantre olmadan doğrudan boyut hariç tutma sütununa yüklemektir. SEC'den sonra, monomerik FL HTT'nin maksimum geri kazanımı için numune ≤1 mg / mL'ye konsantre edildi. Her saflaştırma adımından elde edilen HTT miktarı, bir niceleme standardı olarak saflaştırılmış FL HTT kullanılarak Coomassie mavisi veya kantitatif batı lekelenmesi ile tahmin edilmiştir (Tablo 2). Tarif edilen yöntemle üretilen saflaştırılmış FL HTT proteinlerinin tipik verimi yaklaşık 1 mg / L hücre kültürüdür, ancak partiden partiye değişkenlik nedeniyle veya anti-FLAG saflaştırma reçinesinin birden çok kez yeniden kullanılması durumunda bunun çok altına düşebilir (Tablo 3).
FL HTT'nin aşırı ekspresyonu, protein22'nin parçalanmasına neden olabilir. Burada açıklanan yöntemle üretilen FL Q23-HTT, SDS PAGE tarafından 350 kDa'lık doğru MW'a sahip, Coomassie G250 veya gümüş boyama ile boyanmış tek bir bant olarak çözülmüştür (Şekil 2C). Batı lekelenmesi ile, FL Q23-HTT, N-terminali, C-terminali ve birkaç ara alandaki epitoplara karşı yükseltilmiş antikorlarla reaksiyona girdi, ek fragmanla ilgili bantlar gözlenmedi, bu da proteinin önemli tespit edilebilir kesilmeler olmadan izole edildiğini gösterdi (Şekil 3A). FL HTT poliQ uzunluk varyantları Q23, Q48 ve Q73, batı lekesinde beklendiği gibi tepki gösterdi ve artan Q-uzunluğu ile ilişkili poliQ yönlendirilmiş mAb MW1 için giderek daha güçlü bir sinyal gösterdi: Q23-HTT < Q48-HTT < Q73-HTT (Şekil 3B). N terminal ekzon 1'i hedef alan MW1 ve MAB549 antikorları ile incelendiğinde ΔExon1-HTT (aa 91-3,144) için sinyal gözlenmedi (Şekil 3B).
SEC-MALS, saflaştırılmış HTT proteininin agregasyon durumunu ve moleküler kütlesini analiz etmek için kullanıldı. Numuneler, UV, MALS ve dRI dedektörleri tarafından izlenen analitik SEC ile analiz edildi. SEC-MALS'den elde edilen mutlak molar kütle, moleküllerin şekline bağlı değildir33,34; bu nedenle, SEC-MALS, iyi ayrıldıklarında monomerik ve oligomerik fraksiyonlar için MW'ın tarafsız bir tahminini sağlar. Test edilen HPLC sütunları arasında, SEC sütunu (Malzeme Tablosuna bakınız), HTT monomeri ile dimer arasında, molar kütlelerin ayırt edilebilmesi için yeterli çözünürlük göstermiştir (Şekil 4). Protein konsantrasyonu dRI tespiti ile belirlendi. FL HTT'nin kırılma indisi artışları (dn/dc), SEDFIT yazılımı 35 tarafından hesaplandığı gibi 0,1853 mL/g'dir. ΔExon1 HTT (91-3,144), FL Q23, Q48 ve Q73 HTT (1-3,144) için benzer analitik SEC elüsyon paternleri gözlenmiştir ve her biri minör dimerik ve oligomerik piklere sahip majör bir monomer pikinden oluşmaktadır (Tablo 4). Monomerik form için hesaplanan MW, teorik MW'den daha büyüktür. Bu muhtemelen daha yüksek dereceli oligomerik zirvelerden üst üste binen türlerden ve HTT proteinleri daha yüksek dereceli oligomerler oluşturmamak için düşük konsantrasyonda tutulduğundan zayıf dRI sinyallerinden kaynaklanan hatalardan kaynaklanır. Saflaştırılmış FL HTT varyantlarının birkaç partisinin UV piklerini entegre ederek, poliQ uzunluğu ile agrega profili arasında net bir korelasyon gözlenmemiştir (Tablo 4).
Analitik SEC'e ek olarak, FL HTT oligomerik durumunu karakterize etmek için tamamlayıcı bir yöntem olarak kullanılıp kullanılamayacağını belirlemek için geleneksel yerel PAGE gerçekleştirildi. Daha yüksek mertebeli oligomerler, deterjansız doğal tampon kullanılarak% 3-8 Tris-asetat jelleri ile çözüldü. SEC'den saflaştırılmış FL HTT, oligomerizasyon durumlarına karşılık gelen çoklu bantlar gösterdi (Şekil 5A). En düşük bant, böcek hücrelerinden saflaştırılmış FL HTT için bildirilen önceki sonuçlara benzer şekilde, doğal belirteç 480 kDa ile720 kDa arasında bulunuyordu. Bununla birlikte, HTT monomeri geleneksel yerel PAGE kullanıldığında en bol bant değildi ve sonuçlar analitik SEC-MALS tarafından belirlenen toplam profille ilişkili değildi. FL HTT36,37,38'de bulunan çeşitli hidrofobik yamaların, özellikle HAP40 ve FL HTT25 arasındaki hidrofobik arayüzün, jel içindeki göç sırasında daha yüksek dereceli oligomerlerin oluşumuna katkıda bulunması muhtemeldir. Bunun nedeni, hidrofobik bölgelerin deterjan yokluğunda veya protein-protein etkileşimlerini stabilize etmede birbirleriyle etkileşime girdiği bilinmektedir. HTT'NIN HIDROFOBIK ÖZELLIKLERI ILE TUTARLI OLARAK, FL HTT, SEC SAFLAŞTıRMA ADıMı SıRASıNDA CHAPS'NIN YOKLUĞUNDA ARTAN MIKTARDA YÜKSEK DERECELI OLIGOMERIK FRAKSIYONLAR OLUŞTURUR.
Membran proteinlerini ve hidrofobik yamalar içeren büyük protein komplekslerini araştırmak için yaygın olarak kullanılan Mavi DoğalPAGE, geleneksel doğal PAGE ile karşılaştırılmıştır. Saflaştırılmış HTT, Blue Native PAGE'de, sırasıyla HTT'nin monomerik, dimerik ve trimerik türlerini temsil eden tahmini MW 643, 927 ve 1070 kDa (Şekil 5B) ile üç ana bant gösterdi. Monomer bandı, aynı örneklerin analitik SEC profiline iyi karşılık gelen Blue Native PAGE'deki en bol bant olarak kaldı. HTT monomerinin MW'ının Blue Native PAGE tarafından abartılması, HTT'nin benzersiz içi boş küresel yapısından veya hidrofobik bölgelerinden, karşılık gelen moleküler ağırlık belirteçleri 11,23,25'e göre daha yavaş göçe neden olmasından kaynaklanabilir. Genel olarak, FL Q23-HTT, FL Q48-HTT, FL Q73-HTT ve ΔExon1-HTT, moleküler ağırlık farklılıkları nedeniyle protein bandı göçünde sadece küçük farklılıklar olan benzer Mavi Doğal SAYFA profillerine sahiptir.
Saflaştırılmış proteinlerin kalitesinin ek bir kontrolü olarak, C-terminal FLAG etiketi TEV proteaz ile muamele edilerek FL HTT'den çıkarılabilir. Proteolitik bölünmeden sonra, örnekler FLAG etiketinin çıkarılmasını doğrulamak ve HTT bozulmasını tespit etmek için dört antikor kullanılarak western blot ile analiz edildi. Anti-FLAG M2'ye immünoreaktivite ve HTT'nin N-terminus, ara alanları ve C-terminusuna epitopları olan üç huntingtin-spesifik antikor, başarılı bir FLAG etiketi çıkarma ve HTT'ye özgü bozunma ürünü göstermedi (Ek Şekil S1).
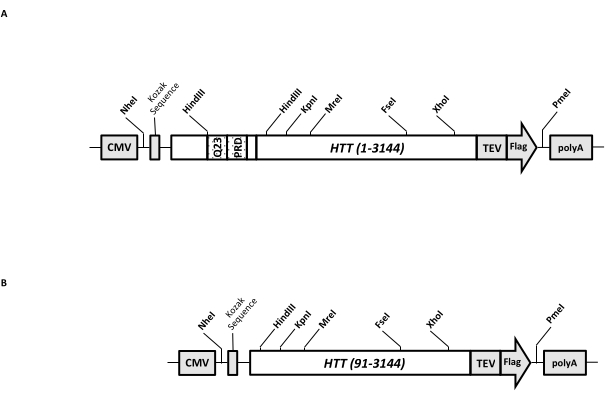
Şekil 1: Tam uzunlukta HTT ifadesi için yapı. (A) Tam uzunlukta Q23 HTT , kodon için optimize edildi ve pcDNA3.1 (+) plazmidine klonlandı. HTT'nin 3' ucu, etiketsiz HTT proteini üretmek için Bayrak epitopu ve TEV proteaz bölünme bölgesi ile etiketlendi. Poliglutamin streç ve prolin bakımından zengin alan, farklı poliQ uzunluklarına sahip HTT varyantları üretmek için kaset klonlaması, yani Q48 ve Q73 kullanılarak ek CAG tekrarları eklemek için yan taraftaki HindIII kısıtlama endonükleaz bölgeleri ile tasarlanmıştır. (B) ΔExon1 yapısı, şablon olarak pcDNA3.1-Q23-HTT kullanılarak PCR mutagenezisi yapıldı. HTT'nin 91-3.144 kalıntısı ifade için ΔExon1 yapısında kaldı. Kısaltmalar: HTT = huntingtin; CMV = sitomegalovirüs; Q23 = poliglutamin gerilmesi; PRD = prolin bakımından zengin etki alanı; TEV = tütün aşındırma virüsü bölünme bölgesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
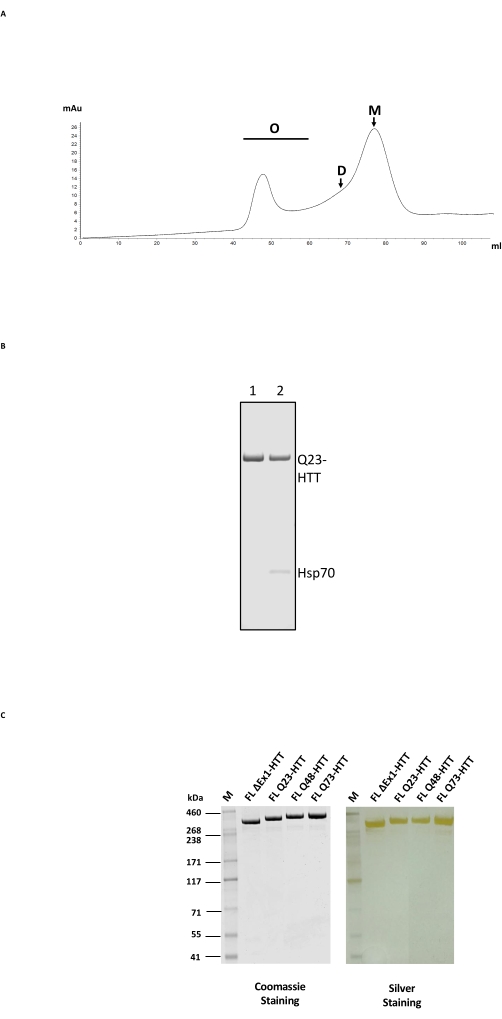
Şekil 2: HTT'nin büyük ölçekli saflaştırılması . (A) Bir FPLC sütunu üzerinde anti-Bayrak saflaştırılmış tam uzunlukta Q23-HTT'nin SEC profili. Q23-HTT'nin yüksek sıralı oligomerleri, dimer ve monomer zirveleri etiketlenmiştir. Monomer içeren fraksiyonlar son HTT örneği olarak toplandı. (B) ATP/magnezyum yıkama adımlı (şerit 1) veya ATP/magnezyum yıkama olmadan saflaştırılmış Q23-HTT'nin SDS-PAGE'i Hsp70 ko-elüsyonu (şerit 2) ile sonuçlanır. (C) Coomassie mavisi G-250 veya gümüş leke ile boyanmış SDS-PAGE üzerindeki nihai saflaştırılmış tam uzunlukta HTT varyantları. Kısaltmalar: FL = tam uzunluk; HTT = avcılık; SEC = boyut dışlama kromatografisi; FPLC = hızlı protein sıvı kromatografisi; O = oligomer; D = dimer; M = monomer; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; Hsp70 = ısı şoku proteini 70. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
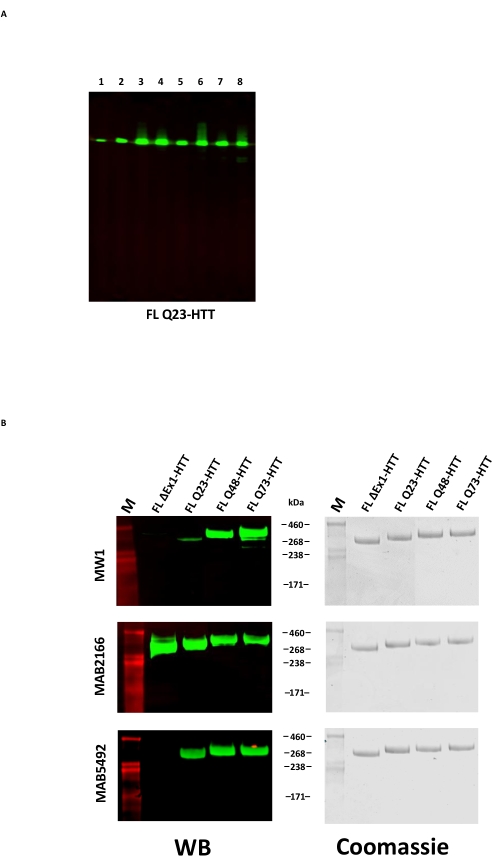
Şekil 3: Saflaştırılmış HTT Varyantlarının Batı leke analizi . (A) Saflaştırılmış FL Q23-HTT, SDS-PAGE üzerinde çalıştırıldı ve PVDF membranına aktarıldı. Birincil antikorlar ve etkileşen epitoplar Lane 1, α-FLAG M2, FLAG etiketidir; Şerit 2, MAB5492, HTT aa. 1-82; Şerit 3, MAB5490, HTT aa 115-129; Şerit 4, MAB2166, HTT aa 181-810; Şerit 5, MAB3E10, HTT aa 1,171-1,177; Şerit 6, MAB4E10, HTT aa 1,844-2,131; Şerit 7, MAB2168, HTT aa 2,146-2,541; Şerit 8, MAB8A4, HTT aa 2.703-2.911. (B) 1 μg saflaştırılmış FL HTT varyantları SDS-PAGE üzerinde çalıştırıldı ve PVDF'ye (solda) aktarıldı ve çift bir SDS jeli çalıştırıldı ve Coomassie Blue (sağda) ile boyandı. Birincil antikorlar ve etkileşen epitoplar Sıra 1, MW1, genişletilmiş PolyQ tekrarlarıdır; Satır 2, MAB2166, HTT aa 181-810; Satır 3, MAB5492, HTT aa 1-82. Kısaltmalar: FLL Q23-HTT = 23 glutamin kalıntısı içeren tam uzunlukta huntingtin proteini; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; Dünya Bankası = batı lekesi; M = işaretleyici; PVDF = poliviniliden florür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
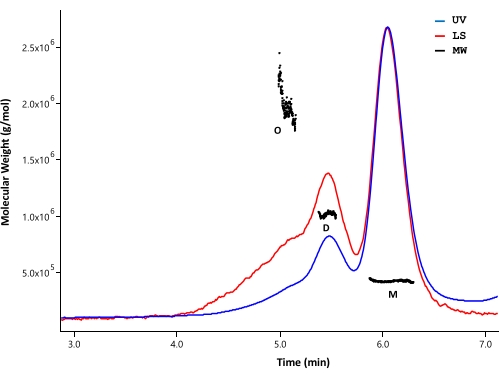
Şekil 4: Tam uzunlukta HTT'nin SEC-MALS analizi. Saflaştırılmış tam uzunlukta Q23-HTT, bir UPLC sütunu üzerinde salındı. Tahmin edilen monomer, dimer ve oligomerin tepe pozisyonları belirtilmiştir. Monomer, dimer ve trimer pikleri için moleküler ağırlıklar hesaplanmış ve Tablo 5'te listelenmiştir. Q48, Q73 ve ΔExon1 HTT için benzer elüsyon profilleri, her saflaştırmada değişken monomer, dimer ve oligomer içerikleri ile gözlenir. Kısaltmalar: SEC-MALS = Çok açılı ışık saçılımlı boyut dışlama kromatografisi; UV = Ultra Viyole; LS = Işık Saçılması; MW = Moleküler Ağırlık; Q23-HTT = 23 glutamin kalıntısı içeren huntingtin proteini; M = monomer; D = dimer; O = oligomer. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
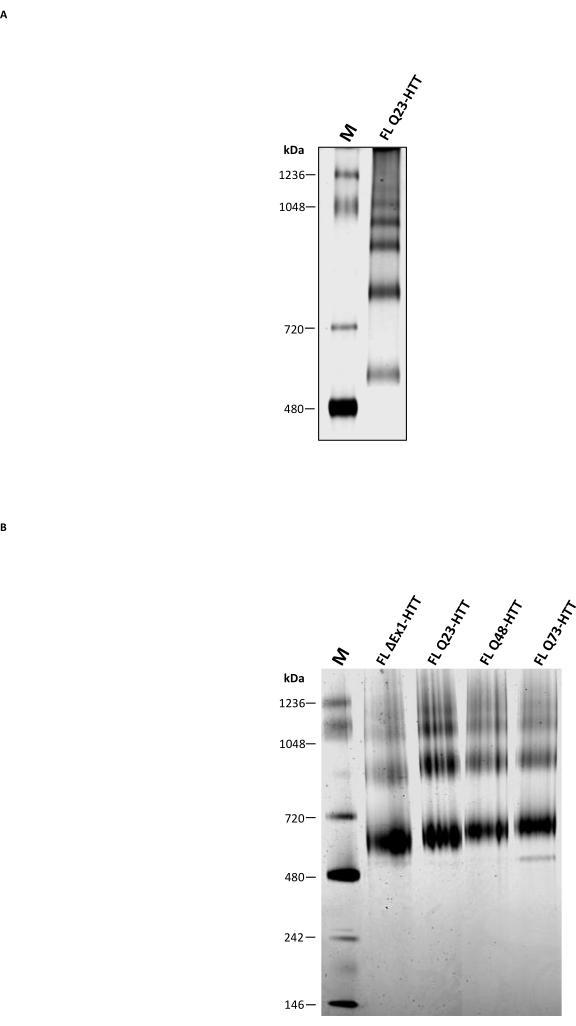
Şekil 5: Berrak Native PAGE veya Blue Native PAGE jeli kullanılarak saflaştırılmış HTT'nin karakterizasyonu. SEC'den gelen doğal Marker ve görünür monomerik Q23-HTT, denatüre olmayan bir PAGE sisteminde (A) ve Mavi Native PAGE sisteminde (B) % 3-8 Tris-asetat jellerinde çözüldü. Kısaltmalar: FL = tam uzunlukta; Q23-HTT = 23 glutamin kalıntısı içeren huntingtin proteini; PAGE = poliakrilamid jel elektroforezi; M = işaretleyici. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Adım | Ad | Kompozisyon | ||
| 6.1.1 | Arabellek A | 50 mM Tris, 500 mM NaCl, %5 v/v gliserol, 5 mM EDTA, %0,01 v/v Ara-20, pH 8,0. | ||
| 6.1.2 | Lizis Tamponu | 50 mM Tris, 500 mM NaCl, %5 v/v gliserol, 5 mM EDTA ve 1x proteaz inhibitörü kokteyli | ||
| 6.1.4.2 | Arabellek A | 50 mM Tris, 500 mM NaCl, %5 v/v gliserol, 5 mM EDTA, %0,01 v/v Ara-20, pH 8,0. | ||
| 6.1.4.3 | Tampon B | 50 mM Tris; 500 mM KCl; 5 mM MgCl2; % 5 v / v gliserol; %0,01 v/v Ara-20, pH 8,0 | ||
| 6.1.4.4 | Tampon C | 20 mM Tris; 200 mM KCl; 5 mM MgCl2; 5 mM ATP; %0,01 v/v Ara-20; %5 v/v gliserol, pH 8.0 | ||
| 6.1.4.5 | Tampon D | 50 mM Tris; 500 mM NaCl; % 5 v / v gliserol; 5 mM EDTA; V CHAPS ile %0,5, pH 8,0 | ||
| 6.1.4.6 | Elüsyon Tamponu | 50 mM Tris; 500 mM NaCl; % 5 v / v gliserol; CHAPS ile %0,5; 0.2 mg/mL DYKDDDDK peptid, pH 8.0 | ||
| 6.1.6 | Rejenerasyon Tamponu | 0,1 M glisin HCl, pH 3,5; %0.01 v/v Ara-20 | ||
| 6.2.1 | SEC Arabellek | 50 mM Tris, 500 mM NaCl, %5 v/v gliserol, CHAPS ile %0,5, 1 mM TCEP | ||
| 7.3 | SEC-MALS Arabellek | 50 mM HEPES, pH 7,2, 500 mM NaCl, %5 v/v gliserol, CHAPS ile %0,5 | ||
| 8.7 | Destaining Çözümü | %40 v/v metanol ve %7 v/v asetik asit | ||
| 9.4.2 | Coomassie Boyama Çözeltisi | %0,01 w /v Coomassie G250, %50 v/v/metanol, %10 v/v asetik asit | ||
| 9.5.1 | Sabitleme Çözümü | %50 v/v metanol , %10 v/v asetik asit, 50 μL formaldehit/100 mL çözelti | ||
Tablo 1: Tamponların ve çözeltilerin bileşimi
| Adım -ları | HTT konsantrasyonu (mg/ml) | Toplam Hacim (mL) | HTT içeriği (mg) | Hücre başına HTT verimi (pg/hücre) | % Verim |
| Süpernatant | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| Anti-Bayrak | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| SN | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
Tablo 2: pcDNA3.1-Q23-HTT-TEV-Flag ile transfekte edilen 2 L HEK293 peletinden HTT verimi. Kısaltmalar: FL Q23-HTT = 23 glutamin kalıntısı içeren tam uzunlukta huntingtin proteini; TEV = tütün aşındırma virüsü bölünme bölgesi; SEC = boyut hariç tutma kromatografisi.
| HTT Örneği | HTT Verimi (mg/L) | Ortalama Saflık (%) | ||
| cesaret | A280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
Tablo 3: Dört FL HTT varyantı saflaştırmasının protein veriminin ve bunların nihai saflığının özeti. Kısaltma: FLL HTT = tam boy huntingtin proteini.
| HTT Örneği | A | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
Tablo 4: FL HTT varyantlarının saflaştırmadan elde edilen temsili agrega, dimer ve monomer içeriğinin özeti. Kısaltmalar: FL HTT = tam boy huntingtin proteini; A = agrega; D = dimer; M = monomer; SEC = boyut hariç tutma kromatografisi.
Ek Şekil S1: TEV proteaz sindirimini takiben batı leke analizi. Saflaştırılmış FL Q23-HTT ve FL Q48-HTT, SDS-PAGE üzerinde çalıştırıldı, PVDF membranlarına aktarıldı ve TEV sindirimini takiben batı lekelenmesi ile analiz edildi. Kullanılan birincil antikorlar anti-Bayrak M2 (Bayrak etiketi), MAB5492 (HTT aa 1-82), MAB3E10 (HTT aa 997-1,276) ve MAB2168 (HTT aa 2,146-2,541) idi. Şerit 1, Protein Standardı; Şerit 2, Q23-HTT-TEV-Bayrağı; Şerit 3, Q48-HTT-TEV-Bayrağı; Şerit 4, Q23-HTT-TEV-Bayrak TEV proteaz ile 1:5'te, gece boyunca 4 °C'de tedavi edilir; Şerit 5, Q48-HTT-TEV-Bayrağı TEV proteaz ile 1:5'te, gece boyunca 4 °C'de tedavi edilir. Kısaltmalar: FL HTT = tam boy huntingtin proteini; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; TEV = tütün aşındırma virüsü; PVDF = poliviniliden florür. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S2: Donma-çözülme döngülerine tabi tutulan FL HTT varyantlarının SEC-MALS analizi. Saflaştırılmış Q23-HTT (A) ve Q48-HTT (B) -80 ° C'de donduruldu ve oda sıcaklığında 6 kata kadar çözüldü. İlk donma-çözülme ve altıncı donma-çözülme döngülerinden sonra Q23-HTT ve Q48-HTT daha sonra SEC-MALS tarafından analiz edildi. Monomer fraksiyonunda hafif bir azalma ve dimer ve yüksek dereceli oligomer fraksiyonlarında artış, tekrarlanan donma-çözülme döngülerinden sonra ışık saçılması ile gözlendi. Tahmin edilen monomer, dimer ve yüksek dereceli oligomerin tepe pozisyonları belirtilmiştir. Kısaltmalar: FL HTT = tam boy huntingtin proteini; O = oligomer; D = dimer; M = monomer; SEC-MALS = Çok açılı ışık saçılımlı boyut dışlama kromatografisi. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S3: Donma-çözülme döngülerine tabi tutulan FL HTT varyantlarının SDS PAGE'i. Saflaştırılmış Q23-HTT (şerit 2-7) ve Q48-HTT (şerit 9-14) -80 °C'de donduruldu ve oda sıcaklığında 6 kata kadar çözüldü. Q23-HTT ve Q48-HTT Alikotları her donma-çözülme döngüsünden sonra saklandı ve daha sonra SDS PAGE tarafından analiz edildi. Agrega veya bozunma ürünlerinde herhangi bir artış gözlenmemiştir; Numuneler stabil ve bant dansitometrisi ile %>95 saf olarak kabul edildi. Kısaltmalar: FL HTT = tam boy huntingtin proteini; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 1: FPLC 15 mL anti-FLAG HTT komut dosyası. Kısaltmalar = FPLC = hızlı protein sıvı kromatografisi; HTT = huntingtin proteini. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: FPLC SEC_MALS HTT komut dosyası. Kısaltmalar: SEC-MALS = Çok açılı ışık saçılımlı boyut dışlama kromatografisi; FPLC = hızlı protein sıvı kromatografisi; HTT = huntingtin proteini. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada, immünoassay ve MS tahlili gelişimi, batı leke analizi kontrolleri ve yapı-fonksiyon çalışmaları için standartlar olarak kullanılmak üzere uygun saflık ve homojenliğe sahip çoklu FL HTT protein yapıları üretmek için geçici bir transfeksiyon, ekspresyon ve saflaştırma yöntemi tanımlamaktayız. Bu geçici ifade yöntemi ölçeklenebilir ve çok yönlüdür ve kullanıcının daha önce21,22,23,24 açıklanan kararlı hücre hatları veya virüs tabanlı yöntemler kullanmaktan daha verimli bir şekilde düşük miligramlık FL HTT varyantları üretmesini sağlar. Rutin olarak, plazmid oluşturulduktan sonra geçici ekspresyon yöntemi kullanılarak bir haftadan kısa sürede çalıştırılan 2 L ölçekli bir protein üretiminden 2-5 mg yüksek saflaştırılmış FL HTT üretilebilir ve hücre kültürünün litresi başına tipik 1-2.5 mg FL HTT verimi elde edilebilir.
Burada açıklanan geçici ekspresyon yöntemi, hücre hatlarını oluşturmak için gereken uzun süre ve kararlı hücre hatlarının depolanması ve korunmasındaki zorluklar gibi kararlı hücre hattı ekspresyonundaki birçok engelin üstesinden gelir. PEI ayrıca piyasadaki diğer transfeksiyon reaktiflerine kıyasla nispeten ucuzdur ve bu da büyük ölçekli transfeksiyonu ekonomik olarak uygulanabilir kılar. Protokolde sınırlamalar da vardır: transfeksiyon verimliliği büyük ölçüde plazmidlerin kalitesine, optimal hücre büyümesine ve PEI'nin ne kadar iyi depolandığına ve hazırlandığına bağlıdır. Operatörlerin, protein veriminde ciddi bir düşüşü önlemek için bu kritik adımlarda özel dikkat göstermeleri ve kalite kontrolleri yapmaları gerekir. Protokolde kullanılan Anti-FLAG reçinesi de nispeten pahalıdır ve birkaç saflaştırma ve rejenerasyondan sonra FL HTT'nin daha az yakalandığını gösterir. Bazı araştırmacılar, afinite reçinesinin daha sağlam bir şekilde yenilenmesini sağlamak için farklı bir etikete geçmeyi daha pratik bulabilirler.
FL HTT ekspresyon seviyelerini optimize etmek için çeşitli hücre çizgileri ve ekspresyon koşulları test edildi. HEK293 hücreleri, proteinin yüksek ekspresyonu ve süspansiyon kültürü formatında kullanım kolaylığı nedeniyle FL HTT ekspresyonu için seçildi ve bu da yöntemi çalkalayıcılarda veya biyoreaktörlerde büyük ölçekli ekspresyon için uygun hale getirdi. Daha yüksek bir FL HTT protein ekspresyon seviyesi, 37 ° C'lik geleneksel sıcaklık yerine 32 ° C gibi daha düşük kültür sıcaklıklarında elde edilebilir. Düşük sıcaklığın protein sentezini yavaşlatması ve FL HTT40'ın doğru katlanmasını teşvik etmesi mümkündür. Bununla birlikte, bu fenomen FL HTT'ye veya test edilen hücre hatlarına özgü değildir. İndirgenmiş posttransfeksiyon sıcaklığı, CHO hücrelerinde farmasötik protein ekspresyonunda yaygın olarak kullanılmaktadır. Mekanizma tam olarak anlaşılamamış olsa da, düşük sıcaklıkların G1 fazındaki hücre döngüsünü durdurduğu ve hücresel enerjiyi protein üretimine yönlendirdiği düşünülmektedir41.
Memeli hücrelerinden saflaştırılan tam uzunlukta HTT, şaperon Hsp7024 ile birlikte süzülür ve Mg-ATP yıkama adımları Hsp70 proteinini kaldırabilir. İlginç bir şekilde, birlikte salınan Hsp70, bir böcek hücre ekspresyon sistemi21,22,23'ten saflaştırılmış FL HTT'de gözlenmez. Bu, FL HTT'nin PTM'lerindeki bir farkı veya memeli ve böcek hücrelerinde FL HTT'nin aşırı ekspresyonuna ısı şoku proteini tepkilerini yansıtabilir. Rekombinant protein Hsp70'ten sıyrıldıktan sonra, FL HTT'nin monomerik formunu stabilize etmek için CHAPS veya DDM gibi iyonik olmayan deterjanlar gereklidir.
FL HTT varyantlarının oligomerizasyon durumları Blue Native PAGE ve SEC-MALS kullanılarak analiz edildi. Dimerik ve yüksek dereceli oligomerik HTT'nin küçük bir kısmı, Blue Native PAGE veya SEC-MALS tarafından analiz edildiğinde mevcuttu. Not olarak, FL HTT tarafından oluşturulan daha yüksek dereceli oligomerlerin poliQ uzunluğu ile ilişkili görünmediği görülmektedir ve Exon1 silme mutantı bile benzer bir oligomer-dimer-monomer oranı göstermektedir. Bu yapılar arasındaki oligomer içeriğindeki gerçek farklılıklar muhtemelen her partinin üretimi ve işlenmesindeki küçük farklılıklardan kaynaklanmaktadır. HTT Exon140,41 tarafından oluşturulan agregaların ve fibrillerin aksine, FL HTT'nin daha yüksek dereceli oligomerleri çözünür kaldı ve SEC ve Native PAGE tarafından analiz edilebildi.
Saflaştırılmış monomerik FL HTT sadece nispeten kararlıdır. 4 ° C'de uzun süreli depolama, oda sıcaklığında kısa inkübasyonlar veya 1 mg / mL'> konsantrasyonlar, monomerik FL HTT'yi, bu koşullar altında gözlemlenen görünür bir yağış olmamasına rağmen, dimerik ve daha yüksek dereceli oligomerik formlara dönüştürecektir. ≤1 mg / mL'de tutulan saflaştırılmış monomerik FL HTT, daha önce tarif edildiği gibi depolama tamponunda (50 mM Tris, pH 8.0, 500 mM NaCl,% 5 v / v gliserol,% 0.5 w / v CHAPS ve 5 mM DTT) -80 ° C'de nispeten sabit kalmıştır24. Bu şekilde hazırlanan ve depolanan FL HTT'nin 6 adede kadar donma-çözülme döngüsü, proteinin gözle görülür bir şekilde çökelmesine neden olmadı, ancak SEC-MALS tarafından daha yüksek oligomerik duruma hafif bir kayma gözlendi (Ek Şekil S2). Örnekler ayrıca tekrarlanan donma-çözülme döngülerini takiben SDS PAGE ile analiz edildi. Görünür çökelti gözlenmedi; SDS-PAGE tarafından agrega veya ek bozunma ürünü görülmemiştir (Ek Şekil S3). Saflaştırılmış FL HTT'nin uzun vadeli stabilitesi hala araştırılmaktadır. Kesin uzun vadeli verilerin yokluğunda, saflaştırılmış FL HTT'yi -80 ° C'de 6 aydan fazla olmamak üzere saklamanızı öneririz.
Yüksek kaliteli, rekombinant FL HTT protein varyantları ve bunları üretme yöntemleri, HD araştırma topluluğu tarafından yüksek talep görmektedir. Bu proteinler immünoassay ve MS analitik standartları olarak, yapısal çalışmalarda ve yeni FL HTT-spesifik testlerin geliştirilmesi için kullanılmaktadır. Burada açıklanan büyük ölçekli geçici ekspresyon yöntemleri, HTT çalışmaları için gerekli araçları sağlayan% >95 saflıkta FL HTT varyantlarının miligram miktarlarını tutarlı bir şekilde üretmiştir. HD araştırmalarını desteklemek için onlarca miligram yüksek saflığa sahip FL HTT polyQ varyantlarının ve diğer mutantların üretimi rutin hale gelmiştir.
Açıklamalar
Yazarlar bu makalenin içeriği ile çıkar çatışması olmadığını beyan ederler.
Teşekkürler
HTT'nin MS analizini yaptıkları için Buffalo'daki New York Eyalet Üniversitesi Farmasötik Bilimler Bölümü'ne teşekkür ederiz. Bu çalışma, CHDI Vakfı ile işbirliğine dayalı bir çabaydı. Elizabeth M. Doherty'ye özellikle teşekkür ederiz; Ignacio Munoz-Sanjuan; Douglas Macdonald, CHDI Vakfı; ve Rory Curtis, Curia, bu el yazmasının hazırlanması sırasındaki paha biçilmez katkıları için. Michele Luche, Mithra Mahmoudi ve Stephanie Fox'a da bu araştırma çabasına verdikleri destek için minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
Referanslar
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır