Method Article
Produção Eficiente e Escalável de Variantes de Huntingtina Humana de Comprimento Completo em Células de Mamíferos utilizando um Sistema de Expressão Transitória
Neste Artigo
Resumo
Fornecemos protocolos escaláveis que abrangem a conceção de construções, transfecção transitória e expressão e purificação de variantes da proteína huntingtina humana de comprimento total em células HEK293.
Resumo
A huntingtina de comprimento total (FL HTT) é uma proteína grande (aa 1-3.144), onipresente e contendo poliglutamina (polyQ), com uma massa de aproximadamente 350 kDa. Embora a função celular da FL HTT não seja totalmente compreendida, uma expansão mutante do trato poliQ acima de ~36 repetições está associada à doença de Huntington (DH), com o comprimento do poliQ a correlacionar-se aproximadamente com a idade de início. Para entender melhor o efeito da estrutura na função do HTT mutante (mHTT), são necessárias grandes quantidades da proteína. A produção de submiligramas de FL HTT em células de mamíferos foi obtida usando a expressão estável da linhagem celular induzível por doxiciclina. No entanto, a produção de proteínas a partir de linhagens celulares estáveis tem limitações que podem ser superadas com métodos de transfecção transitória.
Este trabalho apresenta um método robusto para a produção de baixa quantidade de miligramas de FL HTT e suas variantes a partir de plasmídeos otimizados para códons por transfecção transitória utilizando polietilenimina (PEI). O método é escalável (>10 mg) e produz consistentemente 1-2 mg/L de cultura celular de FL HTT altamente purificado. Consistente com relatórios anteriores, o estado da solução purificada de FL HTT foi considerado altamente dinâmico; a proteína tem uma propensão a formar dímeros e oligômeros de alta ordem. Uma chave para retardar a formação de oligômeros é trabalhar rapidamente para isolar as frações monoméricas das frações oligoméricas diméricas e de alta ordem durante a cromatografia de exclusão de tamanho.
Cromatografia de exclusão de tamanho com espalhamento de luz multiângulo (SEC-MALS) foi utilizada para analisar o dímero e o teor oligomérico de ordem superior do HTT purificado. Não foi observada correlação entre o comprimento do poliQ do HTT FL (Q23, Q48 e Q73) e o teor de oligômeros. O construto exon1-deletado (aa 91-3.144) mostrou propensão à oligomerização comparável à FL HTT (aa 1-3.144). Os métodos de produção, purificação e caracterização por índice de refração (IR) SEC/MALS, eletroforese em gel de dodecilsulfato de sódio-poliacrilamida (SDS-PAGE), western blot, Native PAGE e Blue Native PAGE são aqui descritos.
Introdução
A doença de Huntington (HD) é uma doença neurodegenerativa rara, caracterizada principalmente por movimentos motores instáveis e involuntários, bem como alterações cognitivas e psiquiátricas, como alterações de personalidade e apatia 1,2. A DH está associada a uma expansão do trato de repetição CAG localizado no éxon 1 do gene huntingtina (HTT) para mais de 35 repetições, com um maior número de repetições CAG correlacionando-se com um início mais precoce da doença 3,4. O produto translacional da HTT, a proteína huntingtina (HTT), está implicado na viabilidade neuronal e no desenvolvimento cerebral 5,6,7,8,9.
A HTT é uma proteína scaffolding relatada como participante de uma ampla gama de processos celulares, transporte de vesículas, divisão celular, ciliogênese e autofagia10,11. No entanto, a patogénese molecular da DH não é totalmente clara, e falta a identificação dos principais interatores proteicos que mediam o impacto patológico da mHTT poliQ-expandida. Algumas pesquisas sugerem um ganho de função tóxica da mHTT impulsionado pela propensão à oligomerização da proteína HTT expandida, uma vez que agregados de HTT têm sido identificados em neurônios e glia em pacientes em HD e modelos animais da doença 12,13,14,15,16,17 . Para alimentar a investigação da função e estrutura das variantes FL HTT e mHTT e fornecer aos pesquisadores padrões de proteína de alta qualidade para o desenvolvimento de ensaios, é necessário um suprimento robusto e escalável de proteína recombinante homogênea.
Devido ao seu tamanho (aa 1-3.144, numeração baseada no comprimento Q23 do poliQ), instabilidade proteolítica e propensão a agregar, o FL HTT tem se mostrado difícil de expressar e isolar como uma proteína solúvel. Anteriormente, a região do éxon 1 (aa 2-90) da HTT foi expressa e purificada em larga escala utilizando várias etiquetas que podem aumentar a solubilidade da proteína em Escherichia coli18,19,20. FL HTT foi primeiramente expresso e purificado em um sistema de expressão de células de insetos usando baculovírus 21,22, e estruturas de microscopia eletrônica (EM) de baixa resolução de 30 Å de FL Q23-HTT e Q78-HTT quimicamente reticuladas foram relatadas23. A investigação da estrutura da HTT avançou ainda mais quando a produção de FL Q17, Q46 e Q128-HTT com modificações pós-traducionais nativas (PTMs) foi alcançada em células humanas utilizando linhagens celulares estáveis ou sistemas de expressão de adenovírus24. Esses estudos sugerem que, embora a HTT purificada exista principalmente no estado monomérico, ela também tende a formar oligômeros e agregados de alta ordem.
A ultracentrifugação analítica de FL Q128-HTT, com uma região poliQ altamente expandida, proporcionou mais frações oligoméricas e agregadas do que a proteína com a região poliQ não expandida24. Usando uma linhagem celular estável, uma estratégia foi adaptada com sucesso para estabilizar FL HTT por co-expressão com o parceiro de interação HAP40. Uma estrutura crio-EM do complexo FL HTT e HAP40 foi resolvida a uma resolução média de 4 Å usando o complexo proteico purificado (PDB:6EZ8)25. Essa estratégia de coexpressão foi adaptada com sucesso a um sistema de baculovírus, e uma série de variantes HTT de alta qualidade com diferentes comprimentos de poliQ foram expressas e purificadas a partir de células de insetos26. Desde então, mais estruturas crio-EM do complexo de HTT com comprimentos variáveis de poliQ e HAP40 e estruturas de maior resolução foram resolvidas e depositadas na Base de Dados de Proteínas27,28 (PDB: 7DXK, 7DXH, 6X9O).
Otimizamos um método de transfecção e expressão em células HEK293, utilizando polietilenimina (PEI), para rápida expressão transitória de FL HTT. Como prova de princípio, variantes FL HTT contendo 23 glutaminas (FL Q23-HTT) foram primeiramente purificadas e caracterizadas usando uma modificação de um método de purificação descrito anteriormente24. Este método de transfecção transitória é conveniente, altamente eficiente e escalável; pode produzir HTT purificado com rendimentos de 1-2 mg/L, comparáveis ao método de linhagem celular estável relatado24. Como a proteína é produzida em uma linhagem celular humana, a HTT produzida tem maior probabilidade de ter PTMs humanos nativos quando submetida à análise proteômica por espectrometria de massa 11,29,30,31. Quantidades miligramaticais das variantes FL Q48-HTT, FL Q73-HTT e exon1-deleted (ΔExon1-HTT) de FL HTT foram produzidas, demonstrando que o método de expressão transitória é especialmente útil na produção rápida de variantes alternativas de HTT sem depender do esforço demorado necessário para estabelecer linhagens celulares estáveis para produção.
O protocolo a seguir exemplifica o método padrão utilizado no laboratório desses autores para cultura celular, transfecção, purificação de proteínas e caracterização de proteínas pós-purificação para produzir FL Q23-HTT a partir de uma cultura de células de 2 L. O protocolo pode ser ampliado para culturas maiores ou adaptado para purificar outras variantes de HTT. Até 10 L de culturas de células de FL HTT e várias mutações de local ou truncamento de homólogos de HTT e HTT foram realizadas com sucesso no laboratório usando o mesmo protocolo. FL HTT purificado contém uma alta porcentagem de monômeros, juntamente com dímeros e oligômeros de ordem superior. O mesmo perfil agregado é observado entre as variantes produzidas (Q23, Q48, Q73 e Exon1 excluído). Como a agregação pode ocorrer quando os devidos cuidados não são tomados, um estudo de formulação e estabilidade congelamento-descongelamento foi realizado para identificar as melhores condições para o manuseio de proteínas. Métodos, como Blue Native PAGE e SEC/MALS-RI, também são descritos para analisar o conteúdo do oligômero HTT como parte do processo de controle de qualidade. Para beneficiar a comunidade de investigação da DH, os plasmídeos e as proteínas HTT descritos neste estudo são também depositados no Repositório da Comunidade HD do Coriell Institute (www.coriell.org/1/CHDI).
Protocolo
1. Projeto e produção de construções para expressão de mamíferos HTT marcados com FLAG
- Recupere a sequência de proteínas HTT humanas de comprimento total (P42858) do Centro Nacional de Informações sobre Biotecnologia (https://www.ncbi.nlm.nih.gov/).
NOTA: Os pesquisadores precisam estar familiarizados com as organizações de domínio da HTT e manter a estrutura 3D do núcleo da HTT ao projetar construções para mutantes HTT. - Solicite um serviço de síntese gênica para realizar a otimização de códons para a expressão de células humanas com base na sequência de P42858. Altere o número poliQ de Q16 para o comprimento Q desejado (Q23 foi escolhido como a primeira construção aqui) e sintetize o gene HTT de comprimento total.
NOTA: O construto Q23-HTT de comprimento total otimizado para códons sintetizado foi entregue como uma inserção no plasmídeo pUC18 neste estudo. - Opcional: Adicione recursos para facilitar a clonagem de diferentes comprimentos Q e a purificação nas construções.
NOTA: Um local de clivagem do vírus da gravura do tabaco (TEV) e a etiqueta de purificação FLAG (AAAENLYFQGDYKDDDDK) foram adicionados à extremidade C-terminal dos construtos. Dois sítios HindIII foram projetados nos construtos para abranger a região poliQ (a sequência de proteínas traduzida não é alterada pela introdução de sítios HindIII). Isso permite que o pesquisador altere o comprimento Q do HTT por digestão e ligadura de enzimas de restrição sem ressintetizar o gene HTT completo.
2. Clone as construções de HTT sintetizado em pcDNA3.1.
- Digerir 5 μg de pUC18-Q23-HTT e 5 μg de pcDNA3.1 usando 2 μL de NheI e PmeI cada um a 37 °C por 2 h.
- Execute um gel de agarose a 0,5% p/v e purifique o fragmento Q23-HTT e o vetor pcDNA3.1 digerido usando um kit de extração de gel de agarose. Quantificar as concentrações de DNA purificado por OD280 usando um espectrômetro UV que pode medir microlitros de amostras.
NOTA: OD260/280 variando de 1,8 a 2,0 é tipicamente observado. O FL HTT sintetizado é fornecido como uma inserção com NheI e PmeI em ambas as extremidades em um plasmídeo pUC18. Use outras enzimas de restrição se o HTT for sintetizado de forma diferente. - Use 10 ng de vetor pcDNA3.1 digerido na reação. Ligue os DNAs purificados na proporção molar de 1:1 (HTT:pcDNA3.1) em uma reação de 10 μL à temperatura ambiente por 5 min usando T4 DNA ligase.
- Transformar o produto ligado em células de E. coli competentes (ver Tabela de Materiais) utilizando o protocolo especificado pelo fabricante da ligase.
- Pegar 6 colônias únicas e fazer culturas noturnas em 4-6 mL de LB suplementado com 100 μg/mL de carbenicilina a 37 °C.
- Alocar 1 mL de cada cultura durante a noite. Adicione o glicerol a 25% v/v e guarde o stock de glicerol a -80 °C. Purifice a cultura noturna restante usando um mini-kit de preparação de acordo com as etapas especificadas no manual do usuário.
- Sequencie todos os plasmídeos usando iniciadores de sequenciamento que abrangem toda a região de transcrição do plasmídeo. Escolha um estoque de glicerol que tenha a sequência correta como o estoque mestre de glicerol e descarte o resto.
- Opcional: Solicite um serviço de síntese gênica para sintetizar DNA com os diferentes comprimentos Q (Q48, Q73 e Exon1) que abrangem os dois locais HindIII no plasmídeo pcDNA3.1-Q23-HTT. Digerir o pcDNA3.1-Q23-HTT e os DNAs recém-sintetizados usando HindIII e relacioná-los com T4 ligase como nas etapas 2.2-2.7 para fazer FL HTT com diferentes comprimentos poliQ no plasmídeo pcDNA3.1.
NOTA: Os construtos plasmídicos utilizados neste estudo também estão disponíveis directamente no Repositório da Comunidade HD do Coriell Institute (www.coriell.org/1/CHDI); consulte a Tabela de Materiais.
3. DNA plasmidial livre de endotoxinas de preparação GIGA para transfecção em larga escala
- Estrie os estoques de glicerol bacteriano de pcDNA3.1-Q23-HTT-TEV-FLAG em uma placa de ágar LB com carbenicilina (100 μg/mL). Incubar a placa a 37 °C durante 16-24 h até aparecerem colónias únicas.
- Pegar uma única colônia, inocular uma cultura inicial de 5 mL em meio rico formulado para amplificação plasmídica com carbenicilina (100 μg/mL) e crescer a 37 °C por 8 h.
- Escolha um kit de purificação de plasmídeos GIGA livre de endotoxinas. Siga as etapas descritas no manual do kit plasmídeo GIGA para purificar o plasmídeo pcDNA3.1-Q23-HTT-TEV-FLAG.
- Meça os níveis de endotoxina plasmídica usando um kit de quantificação de endotoxinas à base de lisado de amebócitos de limulus (LAL). Siga o procedimento especificado no manual do fabricante.
NOTA: Uma purificação plasmídica de alta qualidade e baixo nível de endotoxina é essencial para obter uma boa eficiência de transfecção. Usando este protocolo, 20-40 mg de plasmídeo (forma superenrolada >80%) podem ser obtidos por L de cultura bacteriana em concentrações plasmídicas > 4 mg/mL. Um plasmídeo devidamente purificado deve ter um nível de endotoxina < 30 EU/mg. OD260/280 variando de 1,8 a 2,0 é tipicamente observado.
4. Transfecção em larga escala de 2 L de células HEK293 por polietilenoimina (PEI)
- Adicione 1 g de PEI 25K a 1 L de água livre de endotoxinas com agitação. Ajustar o pH para 2,0 utilizando HCl 100 mM e mexer até que todos os PEI 25K se dissolvam. Ajustar o pH para 7,0 utilizando uma solução de NaOH de 100 mM e filtrar através de um filtro de 0,2 μm. Alíquota e conservar a -20 °C até um ano.
NOTA: As alíquotas de IPE podem ser mantidas a 4 °C durante um período máximo de duas semanas, mas nunca devem ser recongeladas após o descongelamento. - Propagar células HEK293 no meio de crescimento (ver Tabela de Materiais) suplementadas com penicilina-estreptomicina (concentração final a 5 U/ml para a penicilina e 5 μg/ml para a estreptomicina) numa incubadora agitadora humidificada a 37 °C, 90 rpm, 5% CO2 durante 18-24 h. Diluir as células a 2 L a uma densidade de ~1,2 × 106 células/ml utilizando o meio de crescimento em frascos de 5 L de Erlenmeyer um dia antes da transfecção.
- Continue a crescer as células a 37 °C, 90 rpm, 5% de CO2 por 18-24 h. Meça os parâmetros da célula usando um contador automático de células capaz de medir a densidade e a viabilidade da célula seguindo o manual do usuário.
NOTA: A densidade celular deve dobrar e a viabilidade deve ser >95%. A densidade celular antes da transfecção deve ser de aproximadamente 2,0 × 10 6-2,4 × 106 células/mL. Diluir as células para a densidade desejada antes da transfecção, quando necessário. - Calcular as quantidades de plasmídeo e PEI necessárias para a transfecção; utilizar 1 mg de plasmídeo e 3 mg de PEI para transfecção de cada litro de cultura celular. Alocar 2 mg de plasmídeo e 6 mg de PEI necessários para uma transfecção de 2 L.
- Diluir o plasmídeo e o PEI individualmente em um volume de solução salina tamponada com fosfato igual a 1/20th do volume total de cultura celular (100 mL cada para uma transfecção de 2 L) e incubar à temperatura ambiente por 5 min. Misture o plasmídeo diluído e o PEI por turbilhão suave e incube a mistura à temperatura ambiente durante 30 minutos.
NOTA: A mistura aparecerá ligeiramente turva após a incubação. - Adicione a mistura à cultura de células e gire suavemente para misturá-las.
- Crescer as células a 37 °C, 5% de CO2, 90 rpm durante 24 h.
- Adicionar 2 M de solução de butirato de sódio a uma concentração final de 2 mM. Adicionar 1:1000 (v/v) antiaglomerante e 1:1000 (v/v) antiespumante à cultura.
- Deslocar o balão para uma incubadora agitadora humidificada a 32 °C, 90 rpm, 5% de CO2 e continuar a crescer durante 48 h.
- Meça os parâmetros da célula, incluindo a densidade e a viabilidade da célula, usando o contador automático de células seguindo o manual do usuário.
- Transferência de 2,0 × 10 6 células (Vol = 2,0 × 106/densidade celular) em um tubo de microcentrífuga. Pellet as células a 2.000 × g durante 1 min numa centrífuga para western blotting na secção 5.
- Colher as células por centrifugação a 2.000 × g durante 30 min e conservar o pellet celular a -80 °C antes da purificação.
5. SDS-PAGE e western blot de lisado de células HEK293 para estimar o nível de expressão de HTT
- Tome uma alíquota de 2,0 × 106 células previamente congeladas (etapa 4.11) da transfecção em larga escala da cultura de células HEK293. Adicione 250 μL de solução salina tamponada com Tris (TBS) suplementada com 50 μg/mL de digilonina, EDTA de 5 mM e coquetel inibidor de protease 1x, e ressuspenda o pellet celular aspirando várias vezes usando uma pipeta.
- Girar os tubos suavemente durante 30 minutos a 4 °C utilizando um mini-rotador para lisar as células. Pellet o material insolúvel por centrifugação a 17.000 × g durante 5 min.
- Adicionar 1/3do volume de 4x redutor de dodecilsulfato de lítio (LDS) tampão de carga ao sobrenadante e aquecer a 70 °C durante 10 min.
- Carregue 5-20 μL de lisado celular em um gel pré-moldado 3-8% Tris-acetato PAGE. Usando o buffer de funcionamento 1x Tris-acetato SDS compatível com gel, execute o gel em um modo de tensão constante a 150 V por 60 min.
NOTA: O tris-acetato SDS-PAGE foi utilizado para a análise FL HTT por gerar maior resolução do que outros tipos de SDS-PAGE para as proteínas com peso molecular acima de 300 kDa. As proteínas utilizadas neste estudo também estão disponíveis directamente no Repositório da Comunidade HD do Coriell Institute (www.coriell.org/1/CHDI); consulte a Tabela de Materiais. - Para realizar o western blotting, monte um sanduíche de transferência usando um papel de transferência grosso equilibrado com tampão de transferência, uma membrana de fluoreto de polivinilideno ativado por metanol (PVDF) e um gel SDS-PAGE. Transfira as proteínas para a membrana PVDF usando uma mancha ocidental semi-seca de acordo com o manual do usuário do fabricante.
NOTA: Normalmente, 20-30 min a 135 mA é suficiente para uma membrana de 10 cm x 10 cm. - Desmontar o sanduíche de transferência e bloquear a membrana em TBST (20 mM Tris pH 7,4, 150 mM NaCl e 0,1% v/v Tween-20) suplementado com 5% p/v leite desnatado.
- Incubar a membrana em um balancim por 1 h à temperatura ambiente com 15 mL de anticorpo primário (diluição de 1:2.500 para anticorpo monoclonal anticorpo anti-FLAG e 1:2.000 para todos os outros anticorpos primários).
NOTA: Os anticorpos primários utilizados neste estudo são anti-FLAG M2, MAB5492, MAB5490, MAB2166, MAB3E10, MAB4E10, MAB2168, MAB8A4 (ver Tabela de Materiais). - Lave a membrana 3 x 5 min usando 30-50 mL de TBST.
- Incubar a membrana em um balancim com um anticorpo secundário IgG IgG conjugado com corante fluorescente de cabra a 1:15.000, temperatura ambiente, em 15 mL de TBST contendo 5% p/v de leite em pó.
- Visualize as bandas de western blot em um imageador fluorescente usando o comprimento de onda específico do anticorpo secundário. Quantifique o sinal de banda usando o software que acompanha o gerador de imagens de acordo com o manual do usuário.
NOTA: O western blotting quantitativo pode ser realizado usando HTT purificado como padrão. Uma faixa padrão linear de HTT é específica do instrumento e foi estabelecida neste laboratório de 25 ng a 250 ng de HTT por pista usando um anticorpo anti-FLAG. A mancha ocidental de HTT deve estar livre de degradação; um nível de expressão total de HTT de 2-4 pg/célula é tipicamente observado. Consulte um protocolo32 publicado anteriormente para obter detalhes de como executar um western blot quantitativo.
6. Cromatografia líquida de proteína rápida (FPLC) purificação de HTT usando coluna anti-FLAG e SEC
- Purificação anti-FLAG
- Estimar a quantidade de resina FLAG necessária para a purificação (normalmente, 12 mL de resina de afinidade anti-FLAG M2 para purificação de 2-4 L de cultura de células transfectadas). Embale 12-25 mL de resina anti-FLAG em uma coluna vazia (consulte a Tabela de Materiais) usando FPLC a uma taxa de fluxo de 4 mL/min usando o Tampão A (Tabela 1). Ajuste a altura do êmbolo, para que não haja espaço entre a extremidade do êmbolo e o leito de resina.
- Usando uma proporção de 10 mL de tampão de lise por 1 g de pellet celular, descongelar e suspender o pellet celular em tampão de lise frio (Tabela 1).
- Passe a suspensão celular uma vez através de um homogeneizador de alto cisalhamento a 10.000 psi. Clarificar o lisado por centrifugação a 20.000 × g durante 1 h numa centrífuga equipada com um rotor de ângulo fixo compatível.
- Programe o FPLC (consulte a Tabela de Materiais para o software utilizado no estudo) e execute as seguintes sequências.
- Carregue o lisado clarificado através da bomba de amostragem.
- Lavar com 4 volumes de coluna (CVs) de tampão A (Tabela 1).
- Lavar com 4 CVs de tampão B (Tabela 1).
- Lavar com 8 CVs de tampão C (Tabela 1).
- Lavar com 3 CVs de tampão D (Tabela 1).
- Lavar com 3 CVs de Buffer de Eluição (Tabela 1).
- Analise 10 μL das frações de pico usando SDS-PAGE. Coletar e combinar as frações de pico com a pureza desejada. Salve ~50 μL dos eluídos combinados para análise SDS-PAGE.
NOTA: Normalmente, um único pico aparecerá, e todas as frações eluídas no pico contêm ~ 90% HTT puro. - Regenere uma coluna anti-FLAG usando 5 CVs de Buffer de Regeneração (Tabela 1) e reequilibre a coluna usando 5 CVs de Buffer A.
NOTA: A resina anti-FLAG pode ser reutilizada até cinco vezes ou até que o rendimento relativo/litro caia para 50% da primeira purificação.
- Purificação da coluna de exclusão de tamanho (SEC) usando uma coluna SEC
- Pré-equilibre uma coluna SEC que permita a separação de proteínas com peso molecular (MW) > 500 kDa (ver Tabela de Materiais para a coluna utilizada) utilizando 2 × CV do Tampão SEC (Tabela 1).
- Carregue diretamente o eluato anti-FLAG (a partir da etapa 6.1.5) através de uma superalça de 50 ml. Execute 1,2 × CV do tampão SEC por injeção. Execute a separação SEC durante a noite a 4 °C.
NOTA: Um máximo de 5 mL ou 15 mL de amostra de proteína pode ser carregado nas colunas SEC selecionadas neste estudo. Programe o FPLC para que várias injeções possam ser realizadas automaticamente. Os scripts de método de exemplo também estão incluídos como Arquivo Suplementar 1 e Arquivo Suplementar 2. - Compare o perfil de eluição com o perfil de eluição HTT padrão para distinguir os picos de monômero, dímero e oligomérico de ordem superior. Agrupe as frações HTT monoméricas com base no perfil de eluição da coluna SEC. Se desejar, agrupe as frações HTT oligoméricas e diméricas de ordem superior separadamente.
- Concentrar a proteína HTT agrupada utilizando um concentrador centrífugo de 100 kDa a 4 °C. Calcule as concentrações de proteína dividindo seus valores de OD280 pelos respectivos coeficientes de extinção (os coeficientes teóricos de extinção de Q23-HTT, Q48-HTT, Q73-HTT e ΔExon1-HTT são 0,776, 0,769, 0,762 e 0,798 (mg/mL)-1 cm-1, respectivamente, para o cálculo). Manter a concentração de HTT ≤ 1,0 mg/mL.
NOTA: É essencial monitorar o processo de concentração, pois a superconcentração resultará em agregação. - Aliquotar a proteína HTT purificada em tubos de microcentrífuga crio-seguros num volume < 100 μL. Congelar rapidamente as alíquotas utilizando azoto líquido e armazená-las a -80 °C.
7. Analítico HPLC SEC-MALS-dRI para analisar a polidispersão HTT
- Execute todos os SEC-MALS analíticos a 4 °C em um sistema de cromatografia líquida de alta eficiência (HPLC) acoplado a um detector UV, um detector de dispersão de luz multiângulo e um detector de índice de refração diferencial (dRI).
- Antes de conectar a coluna UHPLC ao sistema, limpe a bomba e os detectores com água filtrada (0,1 μm) de grau HPLC.
- Conecte a coluna UHPLC (consulte a Tabela de Materiais para a coluna usada) ao sistema. Equilibre a coluna com água filtrada (0,1 μm) e, em seguida, tampão SEC-MALS (Tabela 1) até que todos os sinais do detector atinjam a linha de base.
- Injetar 2 μL de 6 mg/ml de albumina sérica bovina (BSA) a um caudal de 0,3 ml/min durante 15 min por injeção e inspecionar a qualidade dos dados. Execute a normalização, o alinhamento de pico e a correção de ampliação de banda com base no perfil BSA e crie um modelo para as seguintes execuções de amostra HTT.
- Descongele rapidamente um frasco para injetáveis da amostra FL Q23-HTT num banho-maria à temperatura ambiente utilizando um flutuador. Filtre o HTT através de um filtro de spin de 0,1 μm. Injetar 2-4 μL da amostra de HTT e correr por 15 min a 4 °C a uma taxa de fluxo de 0,3 mL/min.
- Analise os dados cromatográficos e de dispersão de luz usando o software que o acompanha (consulte a Tabela de Materiais). Use o detector dRI como um detector de concentração e use 0,185 como o incremento do índice de refração (dn/dc) para HTT. Gerar um gráfico de Zimm para determinar a massa molecular média de peso para cada pico33,34.
NOTA: O incremento do índice de refração do HTT é calculado como 0,185 usando o programa SEDFIT software35 e a sequência de aminoácidos primários do HTT como entrada.
NOTA: O monômero HTT MW é determinado pela SEC-MALS a ~370 kDa ± 30 kDa. HTT purificado normalmente tem conteúdo de monômero entre 60 e 75% (neste laboratório). O baixo teor de monômeros pode indicar que é necessário tomar mais cuidado no manuseio para evitar a agregação.
8. PAGE Nativa Azul para analisar a polidispersão HTT
- Prepare 1 L de tampão de ânodo misturando 50 mL de 20x tampão de execução Blue Native PAGE (consulte a Tabela de Materiais) com 950 mL de H 2 O. Prepare 2 L de tampão catódico azul escuro misturando 100 mL de buffer de corrida Blue Native PAGE e 100 mL de aditivo de cátodo Blue Native PAGE (20x) com 1.800 mL de H2O. Resfrie os tampões a 4 °C antes do uso.
- Descongele rapidamente um frasco para injetáveis de amostra FL Q23-HTT num banho de água à temperatura ambiente utilizando um flutuador. Mantenha a proteína descongelada no gelo antes de usar.
- Misture 5 μg de FL Q23-HTT (~1 mg/mL), 1 μL de aditivo G250 a 0,5%, 2,5 μL de 4x tampão de amostra Blue Native PAGE e água para levar o volume final a 10 μL.
- Carregue a amostra mista FL Q23-HTT em um gel Bis-Tris pré-moldado a 3-12%. Carregar 7,5 μL do padrão proteico não corado no mesmo gel que o padrão.
- Encha a frente do tanque com tampão de cátodo azul escuro e a parte de trás do tanque com tampão de ânodo.
NOTA: Preencha os buffers depois que a amostra for carregada para permitir uma visualização fácil ao carregar as amostras. - Execute o gel a 150 V por 120 min em uma câmara fria.
- Desestabilizar o gel com Solução de Coloração (Tabela 1) até que as bandas sejam observadas; transfira o gel para a água. Visualize e documente o gel em uma estação de imagem.
NOTA: Blue Native PAGE foi originalmente projetado para analisar proteínas de membrana. Foi adaptado neste laboratório como um método alternativo para estimar o teor de monomerismo da HTT. Liga-se às regiões hidrofóbicas da HTT e impede que forme agregados em condições tampão sem detergente. O PAGE nativo tradicional sem usar o azul de Coomassie G250 faz com que o HTT forme oligômeros e agregados solúveis, provavelmente devido às muitas bolsas hidrofóbicas existentes no HTT.
9. SDS PAGE seguido de Coomassie ou coloração de prata para analisar a pureza do HTT
- Adicione 4x tampão de amostra LDS e 10x reagente redutor a FL Q23-HTT purificado para tornar a concentração final do tampão de carga e o reagente redutor de 1x.
- Aquecer a amostra num bloco de aquecimento seco a 70 °C durante 10 minutos.
- Carregue um máximo de 1 μg de proteína por poço em um gel de acetato Tris a 3-8% e corra a 150 V por 1 h usando o tampão de corrida Tris-acetato SDS.
NOTA: As proteínas utilizadas neste estudo também estão disponíveis directamente no Repositório da Comunidade HD no Coriell Institute (www.coriell.org/1/CHDI); consulte a Tabela de Materiais. - Mancha de Coomassie
- Lave o gel com H2O por 5 min.
- Coloração do gel na solução de coloração de Coomassie (Tabela 1) balançando o gel em 30 mL de solução corante por 15 min.
- Descolorir balançando o gel em 50 mL de H2O por 5 min. Repita duas vezes. Visualize e documente o gel corado de Coomassie em uma estação de imagem.
- Mancha de prata usando um kit comercial de coloração de prata.
- Após SDS-PAGE, fixar o gel utilizando Solução de Fixação (Tabela 1) durante 1 h durante a noite à temperatura ambiente.
- Realize a mancha, lave e desenvolva de acordo com as instruções do kit.
- Pare a etapa de desenvolvimento imediatamente quando as bandas atingirem a intensidade desejada.
- Documente o gel em um sistema de documentação de gel equipado com uma fonte de luz visível.
NOTA: HTT purificado a >95% pode ser detectado por coloração de Coomassie e prata com este protocolo. Consulte um protocolo32 publicado anteriormente para obter detalhes de como realizar a análise quantitativa de proteínas.
Resultados
Um vetor de expressão transitória (pcDNA3.1-Q23-HTT-TEV-FLAG, Figura 1A) é projetado para produção rápida em células de mamíferos de FL Q23-HTT (aa 1-3.144, com base na numeração Q23). Esta construção tem as características projetadas para gerar rapidamente várias construções de mutação HTT por clonagem de, facilitar a purificação da proteína HTT para alta qualidade e homogeneidade com etapas cromatográficas mínimas, e ter a opção de produzir FL HTT não marcado. A lista de recursos inclui 1. Os locais de digestão de restrição HindIII, em torno da repetição CAG no éxon 1 de HTT, podem ser usados para gerar mutantes FL HTT com um trecho poliQ de vários comprimentos por digestão e ligadura de enzimas de restrição; 2. A extremidade C-terminal do FL HTT é marcada com um epítopo FLAG com um local de reconhecimento de protease TEV para purificação de afinidade de uma etapa do FL HTT com alta pureza e geração opcional de proteína FL HTT livre de tags usando clivagem de protease TEV; 3. Sequência FL HTT otimizada para códon para uso de códon de célula humana para expressão de alto nível em células HEK293. O vetor pcDNA 3.1 (+) é usado como a espinha dorsal do construto para aproveitar a alta atividade de ativação transcricional do promotor de CMV em linhagens celulares de mamíferos.
Usando pcDNA3.1-Q23-HTT-TEV-FLAG como modelo inicial, as construções Q48 e Q73 FL HTT foram produzidas sintetizando fragmentos de DNA com comprimento Q adequado, abrangendo dois locais de enzimas de restrição HindIII e trocando a mesma região no modelo. O mutante ΔExon1 do FL HTT (aa 91-3.144) (Figura 1B) foi produzido por meio de primers direcionados a resíduos deletados abrangendo a região do éxon 1 no molde. As células HEK293 transfectadas com pcDNA3.1-Q23-HTT-TEV-FLAG utilizando PEI foram cultivadas em frascos agitadores de 5 L sob CO2 a 5%. Uma purificação típica em larga escala usa um pellet de célula de 2-10 L contendo 6,0 × 10 9-3,0 × 1010 células. Antes de proceder à purificação, o nível de expressão de HTT de cada transfecção foi estimado por western blotting quantitativo usando HTT recombinante purificado marcado com FLAG como padrão e anticorpo anti-FLAG como o primeiro anticorpo. Pellets com um nível estimado de expressão de HTT em ≥2 pg HTT/célula foram utilizados para purificação.
A purificação de FL HTT consiste em um processo de coluna de 2 etapas, primeiro com purificação de afinidade anti-FLAG e, em seguida, com SEC em uma coluna de filtração de gel com uma faixa de separação adequada para HTT (Figura 2A; consulte Tabela de Materiais para exemplos). Após ambas as etapas, a HTT foi obtida com >95% de pureza da amostra, conforme determinado pelo SDS-PAGE com azul de Coomassie e teor de monômero de >65% com base no SEC-MALS analítico. Como o tempo de purificação prolongado e a temperatura têm um impacto negativo no teor final de monômero HTT, o FPLC foi usado em ambas as etapas de purificação para minimizar o manuseio e obter uma qualidade consistente da amostra. O principal contaminante durante a purificação anti-FLAG foi a chaperona Hsp70, determinada por espectrometria de massas (Figura 2B, pista 2). Isso é consistente com a descoberta de que a Hsp70 é copurificada com FL HTT de forma estável expressa em linhagens celulares humanas24, sugerindo que a Hsp70 pode ser um estabilizador comum para FL HTT in vivo.
A contaminação por Hsp70 pode ser eliminada por lavagem extensiva com cloreto de magnésio e ATP durante a etapa de purificação por afinidade anti-FLAG (Figura 2B, faixa 1). Após a remoção de Hsp70, FL HTT é propenso a formar oligômeros de ordem mais alta24 e deve ser mantido em uma concentração ≤ 1 mg/mL. A etapa de concentração antes da SEC muitas vezes pode resultar em agregação significativa. Portanto, a prática recomendada é carregar diretamente as frações de pico da purificação anti-FLAG na coluna de exclusão de tamanho sem se concentrar. Após a SEC, a amostra foi concentrada em ≤1 mg/mL para máxima recuperação do HTT FL monomérico. A quantidade de HTT recuperada de cada etapa de purificação foi estimada por azul de Coomassie ou western blotting quantitativo usando FL HTT purificado como padrão de quantificação (Tabela 2). O rendimento típico de proteínas FL HTT purificadas produzidas pelo método descrito é de aproximadamente 1 mg/L de cultura celular, mas pode ficar bem abaixo disso (Tabela 3) devido à variabilidade lote a lote, ou se a resina de purificação anti-FLAG for reutilizada várias vezes.
A superexpressão de FL HTT pode resultar na fragmentação da proteína22. FL Q23-HTT produzido pelo método aqui descrito resolvido como uma única banda com o MW correto de 350 kDa por SDS PAGE, corada por Coomassie G250 ou por coloração de prata (Figura 2C). Por western blotting, FL Q23-HTT reagiu com anticorpos levantados contra epítopos nos domínios N-terminal, C-terminal e vários intermediários, sem nenhuma banda adicional relacionada a fragmentos observados, indicando que a proteína foi isolada sem truncamentos detectáveis significativos (Figura 3A). As variantes de comprimento poliQ FL HTT Q23, Q48 e Q73 reagiram como esperado no western blot, mostrando um sinal progressivamente mais forte para mAb MW1 dirigido por poliQ, correlacionando-se com o aumento do comprimento Q: Q23-HTT < Q48-HTT < Q73-HTT (Figura 3B). Nenhum sinal foi observado para ΔExon1-HTT (aa 91-3.144) quando sondado com os anticorpos MW1 e MAB549, que têm como alvo o éxon terminal N 1 (Figura 3B).
O SEC-MALS foi empregado para analisar o estado de agregação e a massa molecular da proteína HTT purificada. As amostras foram analisadas por SEC analítica monitorada por detectores UV, MALS e dRI. A massa molar absoluta obtida a partir de SEC-MALS não depende da forma das moléculas33,34; portanto, o SEC-MALS fornece uma estimativa imparcial de MW para frações monoméricas e oligoméricas quando elas estão bem separadas. Entre as colunas de HPLC testadas, a coluna SEC (ver Tabela de Materiais) apresentou resolução suficiente entre o monômero HTT e o dímero para que as massas molares pudessem ser distinguidas (Figura 4). A concentração de proteína foi determinada pela detecção de dRI. Os incrementos do índice de refração (dn/dc) do HTT FL são de 0,1853 mL/g, conforme calculado pelo software SEDFIT35. Padrões analíticos semelhantes de eluição SEC foram observados para ΔExon1 HTT (91-3.144), FL Q23, Q48 e Q73 HTT (1-3.144), cada um consistindo de um pico de monômero maior com picos diméricos e oligoméricos menores (Tabela 4). O MW calculado para a forma monomérica é maior que o MW teórico. Isso provavelmente é causado pela sobreposição de espécies de picos oligoméricos de ordem mais alta e erros resultantes de sinais fracos de dRI, pois as proteínas HTT são mantidas em baixa concentração para evitar a formação de oligômeros de ordem superior. Ao integrar os picos UV de vários lotes de variantes purificadas de FL HTT, não foi observada correlação clara entre o comprimento do poliQ e o perfil agregado (Tabela 4).
Além da SEC analítica, a PAGE nativa tradicional foi realizada para determinar se ela pode ser usada como método complementar para caracterizar o estado oligomérico FL HTT. Oligômeros de maior ordem foram resolvidos através de géis de tris-acetato a 3-8% usando tampão nativo sem detergente. FL HTT purificado da SEC mostrou múltiplas bandas correspondentes aos estados de oligomerização (Figura 5A). A menor faixa foi localizada entre o marcador nativo 480 kDa e 720 kDa, semelhante aos resultados anteriores relatados para FL HTT purificado a partir de células de insetos22. No entanto, o monômero HTT não foi a banda mais abundante quando se utilizou o PAGE nativo tradicional, e os resultados não se correlacionam com o perfil agregado determinado pela SEC-MALS analítica. Vários remendos hidrofóbicos presentes no FL HTT36,37,38, especialmente a interface hidrofóbica entre HAP40 e FL HTT25, provavelmente contribuirão para a formação de oligômeros de ordem superior durante a migração dentro do gel. Isso ocorre porque as regiões hidrofóbicas são conhecidas por interagir umas com as outras na ausência de detergente ou estabilizar as interações proteína-proteína. Consistente com as propriedades hidrofóbicas do HTT, FL HTT forma quantidades crescentes de frações oligoméricas de ordem superior na ausência de CHAPS durante a etapa de purificação da SEC.
O Blue Native PAGE, que é amplamente utilizado para investigar proteínas de membrana e grandes complexos proteicos contendo manchas hidrofóbicas39, foi comparado ao PAGE nativo tradicional. O HTT purificado mostrou três bandas principais no Blue Native PAGE com MW estimado de 643, 927 e 1070 kDa (Figura 5B) que provavelmente representam as espécies monomérica, dimérica e trimérica do HTT, respectivamente. A banda de monômeros permaneceu a banda mais abundante na PAGE Nativa Azul, correspondendo bem ao perfil analítico SEC das mesmas amostras. A superestimação do MW do monômero HTT pelo Blue Native PAGE pode resultar da estrutura esférica oca única ou regiões hidrofóbicas do HTT que causam migração mais lenta em relação aos marcadores de peso molecular correspondentes 11,23,25. No geral, FL Q23-HTT, FL Q48-HTT, FL Q73-HTT e ΔExon1-HTT têm perfis PAGE Blue Native semelhantes com apenas pequenas diferenças na migração da banda de proteínas devido às suas diferenças de peso molecular.
Como uma verificação adicional da qualidade das proteínas purificadas, a etiqueta C-terminal FLAG pode ser removida do FL HTT por tratamento com protease TEV. Após a clivagem proteolítica, as amostras foram analisadas por western blot utilizando quatro anticorpos para confirmar a remoção da etiqueta FLAG e detectar a degradação da HTT. A imunorreatividade ao anti-FLAG M2 e três anticorpos específicos da huntingtina com epítopos para o N-terminal, domínios intermediários e C-terminal de HTT mostraram remoção bem-sucedida da tag FLAG e nenhum produto de degradação específico de HTT (Figura Suplementar S1).
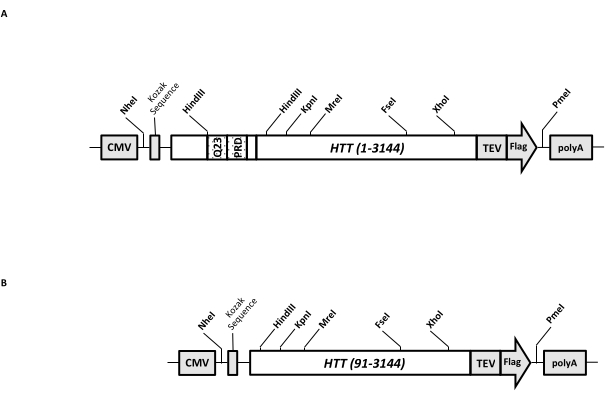
Figura 1: Construção para expressão HTT de comprimento total. (A) O HTT Q23 de comprimento total foi otimizado para códons e clonado no plasmídeo pcDNA3.1 (+). A extremidade 3' do HTT foi marcada com epítopo Flag e local de clivagem da protease TEV para produzir proteína HTT livre de tags. O estiramento de poliglutamina e o domínio rico em prolina foram projetados com sítios de endonuclease de restrição HindIII flanqueados para inserir repetições CAG adicionais usando clonagem em , ou seja , Q48 e Q73, para produzir variantes de HTT com diferentes comprimentos de poliQ. (B) O construto ΔExon1 foi feito mutagênese por PCR usando pcDNA3.1-Q23-HTT como modelo. Os resíduos 91-3.144 de HTT permaneceram no construto ΔExon1 para expressão. Abreviaturas: HTT = huntingtina; CMV = citomegalovírus; Q23 = estiramento de poliglutamina; PRD = domínio rico em prolina; TEV = local de clivagem do vírus da gravação do tabaco. Por favor, clique aqui para ver uma versão maior desta figura.
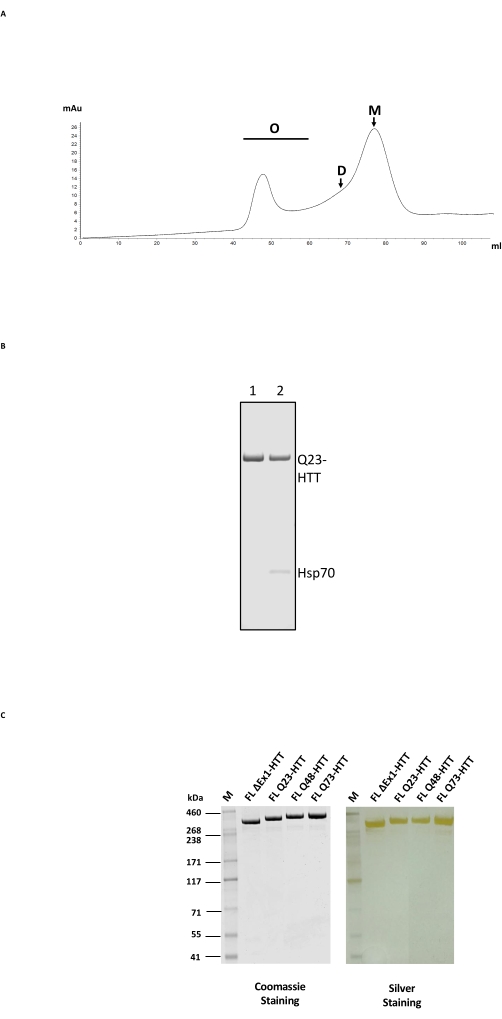
Figura 2: Purificação em larga escala do perfil HTT. (A) SEC do Q23-HTT de comprimento total purificado anti-Flag em uma coluna FPLC. Os picos de oligômeros, dímeros e monômeros de Q23-HTT de alta ordem são rotulados. Frações contendo monômero foram coletadas como amostra final de HTT. (B) SDS-PAGE de Q23-HTT purificado com etapa de lavagem ATP/magnésio (faixa 1) ou sem lavagem ATP/magnésio resulta em co-eluição Hsp70 (faixa 2). (C) Variantes finais de HTT de comprimento total purificadas em SDS-PAGE coradas com azul Coomassie G-250 ou mancha de prata. Abreviaturas: FL = comprimento total; HTT = huntingtina; SEC = cromatografia de exclusão de tamanho; FPLC = cromatografia líquida de proteína rápida; O = oligômero; D = dímero; M = monômero; SDS-PAGE = eletroforese em gel de poliacrilamida de dodecilsulfato de sódio; Hsp70 = proteína de choque térmico 70. Por favor, clique aqui para ver uma versão maior desta figura.
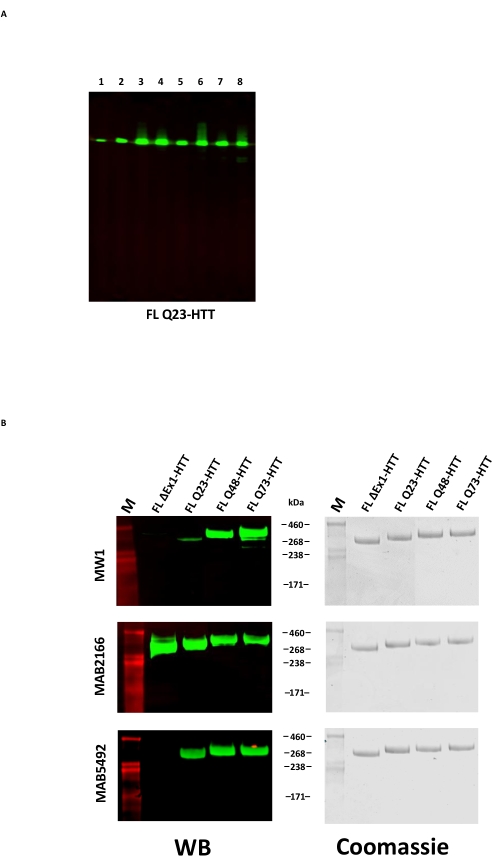
Figura 3: Análise de Western blot de variantes de HTT purificadas . (A) FL Q23-HTT purificado foi executado em SDS-PAGE e transferido para membrana PVDF. Os anticorpos primários e epítopos que interagem são Lane 1, α-FLAG M2, tag FLAG; Pista 2, MAB5492, HTT aa. 1-82; Pista 3, MAB5490, HTT aa 115-129; Pista 4, MAB2166, HTT aa 181-810; Pista 5, MAB3E10, HTT aa 1.171-1.177; Pista 6, MAB4E10, HTT aa 1.844-2.131; Pista 7, MAB2168, HTT aa 2.146-2.541; Pista 8, MAB8A4, HTT aa 2.703-2.911. (B) 1 μg de variantes FL HTT purificadas foram executadas em SDS-PAGE e transferidas para PVDF (esquerda), e um gel SDS duplicado foi executado e corado com Coomassie Blue (direita). Os anticorpos primários e epítopos que interagem são Row 1, MW1, repetições PolyQ expandidas; Linha 2, MAB2166, HTT aa 181-810; Linha 3, MAB5492, HTT aa 1-82. Abreviaturas: FLL Q23-HTT = proteína huntingtina de comprimento total contendo 23 resíduos de glutamina; SDS-PAGE = eletroforese em gel de poliacrilamida de dodecilsulfato de sódio; WB = western blot; M = marcador; PVDF = fluoreto de polivinilideno. Por favor, clique aqui para ver uma versão maior desta figura.
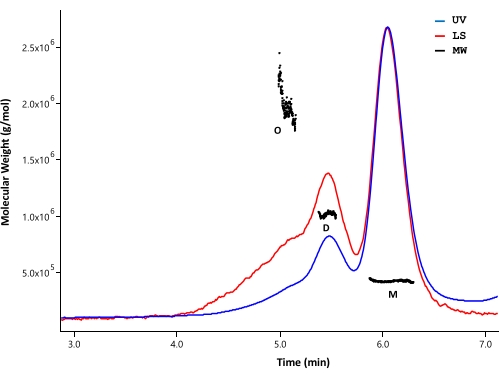
Figura 4: Análise SEC-MALS do HTT completo. Q23-HTT de comprimento total purificado foi eluído em uma coluna UPLC. Posições de pico de monômero, dímero e oligômero previstos são indicadas. Os pesos moleculares foram calculados para os picos de monômero, dímero e trímero e listados na Tabela 5. Perfis de eluição semelhantes são observados para Q48, Q73 e ΔExon1 HTT, com teores variáveis de monômeros, dímeros e oligômeros em cada purificação. Abreviaturas: SEC-MALS = Cromatografia de exclusão de tamanho com dispersão de luz multi-ângulo; UV = Ultra Violeta; LS = Dispersão de Luz; MW = Peso Molecular; Q23-HTT = proteína huntingtina contendo 23 resíduos de glutamina; M = monômero; D = dímero; O = oligômero. Por favor, clique aqui para ver uma versão maior desta figura.
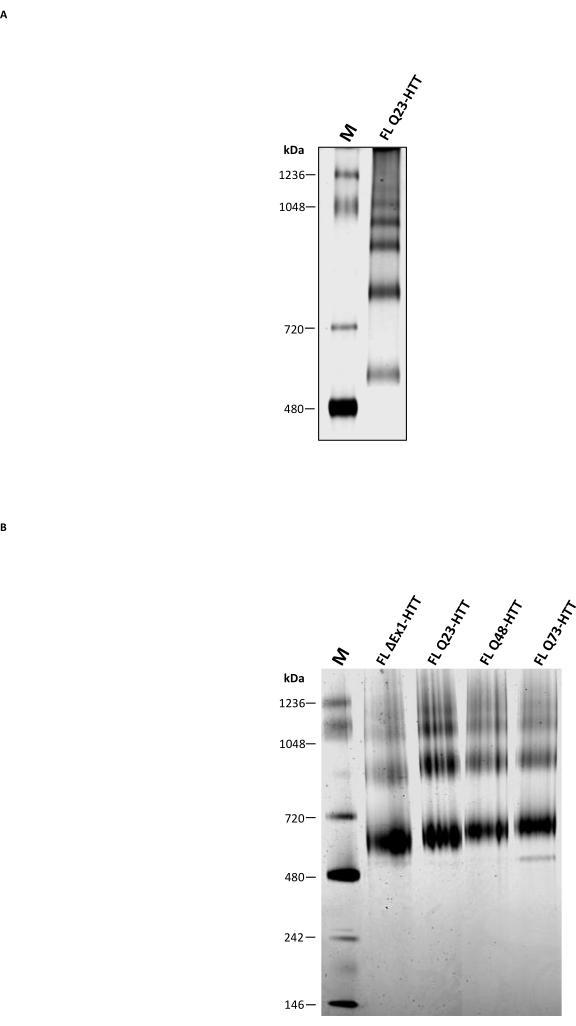
Figura 5: Caracterização do HTT purificado usando o gel Native PAGE claro ou Blue Native PAGE. O marcador nativo e o Q23-HTT monomérico aparente da SEC foram resolvidos em géis de tris-acetato a 3-8% em um sistema PAGE não desnaturante (A) e um sistema Blue Native PAGE (B). Abreviaturas: FL = full-length; Q23-HTT = proteína huntingtina contendo 23 resíduos de glutamina; PAGE = eletroforese em gel de poliacrilamida; M = marcador. Por favor, clique aqui para ver uma versão maior desta figura.
| Passo | Nome | Composição | ||
| 6.1.1 | Buffer A | 50 mM Tris, 500 mM NaCl, 5% v/v glicerol, 5 mM EDTA, 0,01% v/v Tween-20, pH 8,0. | ||
| 6.1.2 | Buffer de lise | 50 mM Tris, 500 mM NaCl, 5% v/v glicerol, 5 mM EDTA e 1x coquetel inibidor de protease | ||
| 6.1.4.2 | Buffer A | 50 mM Tris, 500 mM NaCl, 5% v/v glicerol, 5 mM EDTA, 0,01% v/v Tween-20, pH 8,0. | ||
| 6.1.4.3 | Buffer B | Tris de 50 mM; 500 mM KCl; 5 mM MgCl2; 5% v/v glicerol; 0,01% v/v Tween-20, pH 8,0 | ||
| 6.1.4.4 | Buffer C | Tris de 20 mM; 200 mM KCl; 5 mM MgCl2; 5 mM ATP; 0,01% v/v Tween-20; 5% v/v glicerol, pH 8,0 | ||
| 6.1.4.5 | Buffer D | Tris de 50 mM; 500 mM de NaCl; 5% v/v glicerol; 5 mM EDTA; 0,5% p/v CHAPS, pH 8,0 | ||
| 6.1.4.6 | Buffer de eluição | Tris de 50 mM; 500 mM de NaCl; 5% v/v glicerol; 0,5% p/v CHAPS; Peptídeo DYKDDDDK 0,2 mg/mL, pH 8,0 | ||
| 6.1.6 | Buffer de regeneração | 0,1 M de glicina HCl, pH 3,5; 0,01% v/v interpolação-20 | ||
| 6.2.1 | SEC Buffer | 50 mM Tris, 500 mM NaCl, 5% v/v glicerol, 0,5% p/v CHAPS, 1 mM TCEP | ||
| 7.3 | SEC-MALS Buffer | 50 mM HEPES, pH 7,2, 500 mM NaCl, 5% v/v glicerol, 0,5% p/v CHAPS | ||
| 8.7 | Solução de Coloração | 40% v/v metanol e 7% v/v ácido acético | ||
| 9.4.2 | Solução de coloração Coomassie | 0.01% w /v Coomassie G250, 50% v/v/ metanol, 10% v/v ácido acético | ||
| 9.5.1 | Solução de Fixação | 50% v/v metanol, 10% v/v ácido acético, 50 μL de formaldeído/100 mL de solução | ||
Quadro 1: Composição dos tampões e das soluções
| Passos | Concentração de HTT (mg/ml) | Volume Total (mL) | Teor de HTT (mg) | Rendimento de HTT por célula (pg/célula) | % Rendimento |
| Sobrenadante | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| Anti-Bandeira | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| SEGUNDO | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
Tabela 2: Rendimento de HTT de um pellet HEK293 de 2 L transfectado com pcDNA3.1-Q23-HTT-TEV-Flag. Abreviaturas: FL Q23-HTT = proteína huntingtina de comprimento total contendo 23 resíduos de glutamina; TEV = local de clivagem do vírus da etch do tabaco; SEC = cromatografia de exclusão de tamanho.
| Amostra HTT | Rendimento de HTT (mg/L) | Pureza média (%) | ||
| BCA | A280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
Tabela 3: Resumo do rendimento proteico de quatro purificações da variante FL HTT e sua pureza final. Abreviatura: FLL HTT = proteína huntingtina de comprimento total.
| Amostra HTT | Um | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
Tabela 4: Resumo do teor representativo de agregados, dímeros e monômeros das variantes FL HTT da purificação. Abreviaturas: FL HTT = proteína huntingtina de comprimento total; A = agregado; D = dímero; M = monômero; SEC = cromatografia de exclusão de tamanho.
Figura suplementar S1: Análise de Western blot após a digestão da protease TEV. FL Q23-HTT purificado e FL Q48-HTT foram executados em SDS-PAGE, transferidos para membranas PVDF e analisados por western blotting após digestão TEV. Os anticorpos primários utilizados foram anti-Flag M2 (Flag tag), MAB5492 (HTT aa 1-82), MAB3E10 (HTT aa 997-1.276) e MAB2168 (HTT aa 2.146-2.541). Faixa 1, Padrão de Proteína; Pista 2, Q23-HTT-TEV-Bandeira; Faixa 3, Q48-HTT-TEV-Bandeira; Faixa 4, Q23-HTT-TEV-Flag tratada com protease TEV a 1:5, durante a noite a 4 °C; Faixa 5, Q48-HTT-TEV-Flag tratada com protease TEV a 1:5, durante a noite a 4 °C. Abreviaturas: FL HTT = proteína huntingtina de comprimento total; SDS-PAGE = eletroforese em gel de poliacrilamida de dodecilsulfato de sódio; TEV = vírus da gravura do tabaco; PVDF = fluoreto de polivinilideno. Clique aqui para baixar este arquivo.
Figura Suplementar S2: Análise SEC-MALS de variantes FL HTT submetidas a ciclos de congelamento-descongelamento. Q23-HTT (A) e Q48-HTT (B) purificados foram congelados a -80 °C e descongelados à temperatura ambiente por até 6 vezes. Q23-HTT e Q48-HTT após o primeiro ciclo de congelamento-descongelamento e o sexto ciclo de congelamento-descongelamento foram então analisados por SEC-MALS. Uma ligeira diminuição na fração de monômeros e aumento nas frações de dímero e oligômero de alta ordem foram observadas por espalhamento de luz após repetidos ciclos de congelamento-descongelamento. Posições de pico de monômero, dímero e oligômero de alta ordem previstos são indicadas. Abreviaturas: FL HTT = proteína huntingtina de comprimento total; O = oligômero; D = dímero; M = monômero; SEC-MALS = Cromatografia de exclusão de tamanho com dispersão de luz multi-ângulo. Clique aqui para baixar este arquivo.
Figura suplementar S3: SDS PAGE de variantes FL HTT submetidas a ciclos de congelamento-descongelamento. Q23-HTT purificados (faixas 2-7) e Q48-HTT (faixas 9-14) foram congelados a -80 °C e descongelados à temperatura ambiente por até 6 vezes. As alíquotas de Q23-HTT e Q48-HTT foram armazenadas após cada ciclo de congelamento-descongelamento e, em seguida, analisadas pelo SDS PAGE. Não foi observado aumento de agregados ou produtos de degradação; as amostras foram consideradas estáveis e >95% puras por densitometria de banda. Abreviaturas: FL HTT = proteína huntingtina de comprimento total; SDS-PAGE = eletroforese em gel de poliacrilamida de dodecilsulfato de sódio. Clique aqui para baixar este arquivo.
Arquivo suplementar 1: FPLC 15 mL anti-FLAG HTT script. Abreviaturas = FPLC = cromatografia líquida de proteína rápida; HTT = proteína huntingtina. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: FPLC SEC_MALS HTT script. Abreviaturas: SEC-MALS = Cromatografia de exclusão de tamanho com dispersão de luz multi-ângulo; FPLC = cromatografia líquida de proteína rápida; HTT = proteína huntingtina. Clique aqui para baixar este arquivo.
Discussão
Descrevemos aqui um método transitório de transfecção, expressão e purificação para gerar múltiplos construtos de proteína FL HTT com pureza e homogeneidade adequadas para uso como padrões para imunoensaio e desenvolvimento de ensaios de EM, controles para análise de western blot e para estudos de estrutura-função. Esse método de expressão transitória é escalável e versátil e permite que o usuário gere quantidades baixas de miligramas de variantes FL HTT de forma mais eficiente do que usando linhagens celulares estáveis ou métodos baseados em vírus descritos anteriormente21,22,23,24. Rotineiramente, 2-5 mg de FL HTT altamente purificado podem ser gerados a partir de uma produção de proteína em escala de 2 L em menos de uma semana usando o método de expressão transitória, uma vez que o plasmídeo é construído, com um rendimento típico de 1-2,5 mg de FL HTT por litro de cultura celular.
O método de expressão transitória descrito aqui supera muitos obstáculos na expressão de linhagens celulares estáveis, como o longo tempo necessário para estabelecer linhagens celulares e dificuldades no armazenamento e manutenção de linhagens celulares estáveis. O PEI também é relativamente barato em comparação com outros reagentes de transfecção no mercado, tornando a transfecção em larga escala economicamente viável. Há também limitações no protocolo: a eficiência da transfecção depende em grande parte da qualidade dos plasmídeos, do crescimento celular ideal e de quão bem o PEI é armazenado e preparado. Os operadores precisam tomar cuidado especial e realizar controles de qualidade nessas etapas críticas para evitar uma queda drástica nos rendimentos de proteínas. A resina anti-FLAG usada no protocolo também é relativamente cara e mostra redução da captura de FL HTT após várias purificações e regenerações. Alguns pesquisadores podem achar mais prático mudar para uma tag diferente para permitir uma regeneração mais robusta da resina de afinidade.
Várias linhagens celulares e condições de expressão foram testadas para otimizar os níveis de expressão de FL HTT. As células HEK293 foram escolhidas para a expressão de FL HTT devido à alta expressão de proteínas e à facilidade de manuseio em formato de cultura de suspensão, tornando o método adequado para expressão em larga escala em agitadores ou biorreatores. Um nível mais alto de expressão da proteína FL HTT pode ser alcançado em temperaturas de cultivo mais baixas, como 32 °C, em vez de usar a temperatura habitual de 37 °C. É possível que a temperatura mais baixa possa retardar a síntese de proteínas e promover o dobramento correto do FL HTT40. No entanto, esse fenômeno não é específico do FL HTT ou das linhagens celulares testadas. A temperatura pós-transfecção reduzida tem sido amplamente utilizada na expressão de proteínas farmacêuticas em células CHO. Embora o mecanismo não seja totalmente compreendido, acredita-se que as baixas temperaturas interrompam o ciclo celular na fase G1 e desviem a energia celular para a produção de proteínas41.
O HTT de comprimento total purificado a partir de células de mamíferos co-elui com a chaperona Hsp7024, e as etapas de lavagem de Mg-ATP podem remover a proteína Hsp70. Curiosamente, a Hsp70 co-eluída não é observada em FL HTT purificada a partir de um sistema de expressão de células de insetos21,22,23. Isso pode refletir uma diferença nos PTMs de FL HTT ou respostas de proteína de choque térmico à superexpressão de FL HTT em células de mamíferos e insetos. Uma vez que a proteína recombinante tenha sido despojada de Hsp70, detergentes não iônicos, como CHAPS ou DDM, são necessários para estabilizar a forma monomérica de FL HTT.
Os estados de oligomerização das variantes FL HTT foram analisados utilizando Blue Native PAGE e SEC-MALS. Uma pequena fração de HTT oligomérico dimérico e de ordem superior estava presente quando analisada pelo Blue Native PAGE ou SEC-MALS. É importante notar que os oligômeros de ordem superior formados por FL HTT não parecem se correlacionar com o comprimento do poliQ, e até mesmo o mutante de deleção Exon1 exibe uma relação oligômero-dímero-monômero semelhante. As variações reais no teor de oligômeros entre esses construtos são provavelmente devidas a pequenas diferenças na produção e manuseio de cada lote. Em contraste com agregados e fibrilas formados por HTT Exon140,41, os oligômeros de maior ordem de FL HTT permaneceram solúveis e puderam ser analisados por SEC e Native PAGE.
FL HTT monomérico purificado é apenas relativamente estável. O armazenamento prolongado a 4 °C, incubações curtas à temperatura ambiente ou concentrações > 1 mg/mL converterão o HTT FL monomérico em formas oligoméricas diméricas e de ordem superior, embora não haja precipitação visível observada nessas condições. O HTT FL monomérico purificado mantido a ≤1 mg/mL permaneceu relativamente estável a -80 °C em tampão de armazenamento (50 mM Tris, pH 8,0, 500 mM NaCl, 5% v/v glicerol, 0,5% p/v CHAPS e 5 mM TDT), conforme descrito anteriormente24. Até 6 ciclos de congelamento-descongelamento de FL HTT preparados e armazenados dessa maneira não causaram precipitação visível da proteína, embora um ligeiro deslocamento para um estado oligomérico mais alto tenha sido observado pelo SEC-MALS (Figura Suplementar S2). As amostras também foram analisadas pelo SDS PAGE após repetidos ciclos de congelamento-descongelamento. Não foram observados precipitados visíveis; não foram observados agregados ou produtos de degradação adicionais pelo SDS-PAGE (Figura Suplementar S3). A estabilidade a longo prazo do FL HTT purificado ainda está sob investigação. Na ausência de dados conclusivos a longo prazo, recomendamos o armazenamento de FL HTT purificado a -80 °C por não mais de 6 meses.
As variantes da proteína FL HTT recombinante e de alta qualidade e os métodos para as produzir são altamente procurados pela comunidade de investigação da DH. Essas proteínas estão em uso como imunoensaio e padrões analíticos de EM, em estudos estruturais e para o desenvolvimento de novos ensaios específicos de FL HTT. Os métodos de expressão transitória em larga escala aqui descritos produziram consistentemente quantidades de miligramas de variantes FL HTT com >95% de pureza, fornecendo ferramentas essenciais para estudos de HTT. A produção de dezenas de miligramas de variantes poliQ FL HTT altamente purificadas e outros mutantes em apoio à investigação da DH tornou-se rotina.
Divulgações
Os autores declaram que não têm conflitos de interesse com o conteúdo deste artigo.
Agradecimentos
Agradecemos ao Departamento de Ciências Farmacêuticas da Universidade Estadual de Nova York em Buffalo, por realizar a análise de EM de HTT. Este trabalho foi um esforço colaborativo com a Fundação CHDI. Agradecemos especificamente a Elizabeth M. Doherty; Ignacio Munoz-Sanjuan; Douglas Macdonald, Fundação CHDI; e Rory Curtis, Curia, por sua inestimável contribuição durante a preparação deste manuscrito. Também somos gratos a Michele Luche, Mithra Mahmoudi e Stephanie Fox por seu apoio a este esforço de pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
Referências
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados