Method Article
일시적 발현 시스템을 사용한 포유류 세포에서 전장 인간 헌팅틴 변이체의 효율적이고 확장 가능한 생산
요약
자사는 HEK293 세포에서 구조체 설계, 일시적 형질감염, 전장 인간 헌팅틴 단백질 변이체의 발현 및 정제를 포괄하는 확장 가능한 프로토콜을 제공합니다.
초록
전장 헌팅틴 (FL HTT)은 대략 350 kDa의 질량을 갖는 큰 (aa 1-3,144), 유비쿼터스 발현, 폴리글루타민 (polyQ) 함유 단백질이다. FL HTT의 세포 기능이 완전히 이해되지는 않았지만 ~36회 반복 이상의 polyQ 관의 돌연변이 확장은 헌팅턴병(HD)과 관련이 있으며 polyQ 길이는 대략 발병 연령과 관련이 있습니다. 돌연변이 HTT(mHTT)의 기능에 대한 구조의 영향을 더 잘 이해하려면 다량의 단백질이 필요합니다. 포유동물 세포에서 FL HTT의 서브밀리그램 생산은 독시사이클린-유도성 안정한 세포주 발현을 사용하여 달성하였다. 그러나, 안정한 세포주로부터의 단백질 생산은 일시적인 형질감염 방법으로 극복할 수 있는 한계를 갖는다.
이 논문은 폴리에틸렌이민(PEI)을 사용한 일시적 형질감염에 의한 코돈 최적화 플라스미드로부터 FL HTT 및 그 변이체의 저밀리그램 소량 생산을 위한 강력한 방법을 제시합니다. 이 방법은 확장 가능하고(>10mg) 고도로 정제된 FL HTT의 세포 배양 1-2mg/L를 지속적으로 산출합니다. 이전 보고와 일치하여, FL HTT의 정제된 용액 상태는 매우 동적인 것으로 밝혀졌다; 단백질은 이량 체 및 고차 올리고머를 형성하는 경향이있다. 올리고머 형성을 늦추는 열쇠는 크기 배제 크로마토그래피 중에 이량체 및 고차 올리고머 분획에서 단량체 분획을 분리하기 위해 신속하게 작업하는 것입니다.
다각도 광산란(SEC-MALS)을 사용한 크기 배제 크로마토그래피를 사용하여 정제된 HTT의 이량체 및 고차 올리고머 함량을 분석했습니다. FL HTT polyQ 길이 (Q23, Q48, 및 Q73)와 올리고머 함량 사이에는 상관관계가 관찰되지 않았다. exon1-결실된 작제물 (aa 91-3,144)은 FL HTT (aa 1-3,144)에 필적하는 올리고머화 성향을 나타내었다. SEC/MALS-굴절률(RI), 나트륨 도데실설페이트-폴리아크릴아미드 겔 전기영동(SDS-PAGE), 웨스턴 블롯, 네이티브 PAGE 및 블루 네이티브 PAGE에 의한 생산, 정제 및 특성화 방법이 본원에 기재되어 있다.
서문
헌팅턴병(HD)은 주로 불안정하고 비자발적 운동 운동뿐만 아니라 성격 변화 및 무관심과 같은 인지 및 정신과적 변화를 특징으로 하는 희귀 신경퇴행성 질환입니다1,2. 헌팅턴병은 헌팅틴 유전자(HTT)의 엑손 1에 위치한 CAG 반복 관을 35회 이상으로 확장하는 것과 관련이 있으며, 더 많은 수의 CAG 반복은 질병의 조기 발병과 관련이 있습니다3,4. 헌팅틴 단백질 (HTT) 인 HTT의 번역 산물은 신경 세포 생존 능력 및 뇌 발달 5,6,7,8,9와 관련이 있습니다.
HTT는 광범위한 세포 과정, 소포 수송, 세포 분열, 섬모 생성 및 자가포식10,11에 참여하는 것으로 보고된 스캐폴딩 단백질입니다. 그러나 HD의 분자 병인은 완전히 명확하지 않으며 polyQ 확장 mHTT의 병리학 적 영향을 매개하는 주요 단백질 상호 작용자의 식별이 부족합니다. 일부 연구는 HD 환자 및 질병의 동물 모델의 뉴런 및 아교세포에서 HTT 응집체가 확인되었기 때문에 확장된 HTT 단백질의 올리고머화 성향에 의해 구동되는 mHTT의 독성 기능의 이득을 시사합니다.12,13,14,15,16,17 . FL HTT 및 mHTT 변이체의 기능과 구조에 대한 조사를 촉진하고 연구자에게 분석 개발을 위한 고품질 단백질 표준물질을 공급하려면 균질한 재조합 단백질의 강력하고 확장 가능한 공급이 필요합니다.
FL HTT는 크기 (aa 1-3,144, polyQ 길이 Q23에 따른 번호 매기기), 단백질 분해 불안정성 및 응집 성향으로 인해 가용성 단백질로 발현 및 분리하기가 어렵다는 것이 입증되었습니다. 이전에는 HTT의 엑손 1 영역(aa2-90)을 대장균18,19,20에서 단백질의 용해도를 증가시킬 수 있는 다양한 태그를 사용하여 대규모로 발현 및 정제하였다. FL HTT는 바쿨로바이러스21,22를 사용하는 곤충 세포 발현 시스템에서 최초로 발현 및 정제되었으며, 화학적으로 가교결합된 FL Q23-HTT 및 Q78-HTT의 저분해능 30Å 전자 현미경(EM) 구조가 보고되었다(23). HTT 구조의 조사는 안정한 세포주 또는 아데노바이러스 발현 시스템24를 사용하여 인간 세포에서 천연 번역후 변형(PTM)을 갖는 FL Q17, Q46 및 Q128-HTT의 생산이 달성되었을 때 더욱 발전되었습니다. 이러한 연구는 정제된 HTT가 주로 단량체 상태로 존재하지만 고차 올리고머 및 응집체를 형성하는 경향이 있음을 시사합니다.
고도로 확장된 polyQ 영역을 갖는 FL Q128-HTT의 분석적 초원심분리는 비확장 polyQ 영역24를 갖는 단백질보다 더 많은 올리고머 및 응집체 분획을 제공하였다. 안정한 세포주를 사용하여, 상호작용 파트너 HAP40과의 동시 발현에 의해 FL HTT를 안정화시키는 전략이 성공적으로 적응되었다. FL HTT 및 HAP40 복합체의 Cryo-EM 구조는 정제된 단백질 복합체(PDB:6EZ8)25를 사용하여 평균 4Å 분해능으로 해결되었습니다. 이러한 공동발현 전략은 바쿨로바이러스 시스템에 성공적으로 적응되었고, 상이한 polyQ 길이를 갖는 일련의 고품질 HTT 변이체가 곤충 세포로부터 발현 및 정제되었다(26). 그 이후로, 가변 polyQ 길이와 HAP40 및 더 높은 분해능 구조를 갖는 HTT 복합체의 더 많은 Cryo-EM 구조가 해결되어 단백질 데이터베이스27,28(PDB: 7DXK, 7DXH, 6X9O)에 침착되었습니다.
FL HTT의 빠른 과도 발현을 위해 폴리에틸렌이민(PEI)을 사용하여 HEK293 세포에서 형질감염 및 발현 방법을 최적화했습니다. 원리 증명으로서, 23개의 글루타민(FL Q23-HTT)을 함유하는 FL HTT 변이체를 먼저 정제하고, 앞서 기술된 정제 방법의 변형을 사용하여 특성화하였다(24). 이 일시적 형질주입 방법은 편리하고 매우 효율적이며 확장 가능합니다. 보고된 안정적인 세포주 방법에 필적하는 1-2mg/L의 수율로 정제된 HTT를 생산할 수 있습니다.24. 단백질이 인간 세포주에서 생산되기 때문에, 생산된 HTT는 질량 분광분석 단백질체학 분석 11,29,30,31을 받을 때 천연 인간 PTM을 가질 가능성이 더 높다. FL HTT의 FL Q48-HTT, FL Q73-HTT 및 엑손1-결실(ΔExon1-HTT) 변이체의 밀리그램 양이 생산되었으며, 이는 일시적인 발현 방법이 생산을 위한 안정적인 세포주를 확립하는 데 필요한 시간 소모적인 노력에 의존하지 않고 HTT의 대체 변이체를 신속하게 생산하는 데 특히 유용하다는 것을 입증했습니다.
다음 프로토콜은 2L 세포 배양으로부터 FL Q23-HTT를 생산하기 위해 세포 배양, 형질감염, 단백질 정제 및 정제 후 단백질 특성화를 위해 이들 저자의 실험실에서 사용되는 표준 방법을 예시한다. 이 프로토콜은 더 큰 배양으로 확장하거나 다른 HTT 변이체를 정제하도록 조정할 수 있습니다. FL HTT의 최대 10L 세포 배양과 HTT 및 HTT 동족체의 다양한 부위 또는 절단 돌연변이가 동일한 프로토콜을 사용하여 실험실에서 성공적으로 수행되었습니다. 정제된 FL HTT는 이량체 및 고차 올리고머와 함께 높은 비율의 단량체를 함유한다. 생성된 변이체(Q23, Q48, Q73 및 결실된 Exon1) 간에 동일한 응집체 프로파일이 관찰됩니다. 적절한 주의를 기울이지 않을 때 응집이 발생할 수 있으므로 단백질 취급을 위한 최상의 조건을 식별하기 위해 제형 및 동결-해동 안정성 연구가 수행되었습니다. Blue Native PAGE 및 SEC/MALS-RI와 같은 방법도 품질 관리 프로세스의 일부로 HTT 올리고머 함량을 분석하는 방법에 대해 설명합니다. HD 연구 커뮤니티에 혜택을 주기 위해 이 연구에서 설명된 플라스미드 및 HTT 단백질도 Coriell Institute(www.coriell.org/1/CHDI)의 HD 커뮤니티 저장소에 기탁됩니다.
프로토콜
1. FLAG-태그된 HTT 포유류 발현을 위한 구조물의 설계 및 생산
- 전장 인간 HTT 단백질 서열(P42858)을 국립 생명공학 정보 센터(https://www.ncbi.nlm.nih.gov/)로부터 회수한다.
참고: 연구원은 HTT 돌연변이에 대한 구조를 설계할 때 HTT의 도메인 조직에 대해 잘 알고 HTT 핵심 3D 구조를 유지해야 합니다. - P42858의 서열을 기반으로 인간 세포 발현에 대한 코돈 최적화를 수행하기 위한 유전자 합성 서비스를 요청합니다. polyQ 번호를 Q16에서 원하는 Q 길이로 변경하고(여기서 Q23이 첫 번째 구성물로 선택됨) 전장 HTT 유전자를 합성합니다.
참고: 합성된 코돈-최적화된 전장 Q23-HTT 구축물은 본 연구에서 pUC18 플라스미드에 삽입물로서 전달되었다. - 선택 사항: 다양한 Q 길이의 클로닝과 컨스트럭트에서의 정제를 용이하게 하는 특징을 추가합니다.
참고: 담배 에칭 바이러스(TEV) 절단 부위 및 FLAG 정제 태그(AAAENLYFQGDYKDDDK)를 구축물의 C-말단 말단에 첨가하였다. 2개의 HindIII 부위가 polyQ 영역을 포괄하도록 작제물에서 설계되었다(번역된 단백질 서열은 HindIII 부위를 도입함으로써 변경되지 않음). 이를 통해 연구원은 전체 HTT 유전자를 재합성하지 않고 제한 효소 소화 및 결찰을 통해 HTT 의 Q 길이를 변경할 수 있습니다.
2. 합성된 HTT 구축물을 pcDNA3.1로 복제합니다.
- 37°C에서 각각 2μL의 NheI 및 PmeI를 사용하여 5μg의 pUC18-Q23-HTT 및 5μg의 pcDNA3.1을 2시간 동안 분해합니다.
- 0.5% w/v 아가로스 겔을 실행하고 아가로스 겔 추출 키트를 사용하여 Q23-HTT 단편과 소화된 pcDNA3.1 벡터를 정제합니다. 마이크로리터의 샘플을 측정할 수 있는 UV 분광계를 사용하여 OD280으로 정제된 DNA의 농도를 정량화합니다.
참고: 1.8에서2.0 사이의 OD 260/280 이 일반적으로 관찰됩니다. 합성된 FL HTT는 pUC18 플라스미드의 양쪽 말단에 NheI 및 PmeI와 함께 삽입물로서 공급된다. HTT 가 다르게 합성되는 경우 다른 제한 효소를 사용하십시오. - 반응에 10ng의 소화된 pcDNA3.1 벡터를 사용합니다. 정제된 DNA를 T4 DNA 리가아제를 사용하여 실온에서 5분 동안 10μL 반응에서 1:1(HTT:pcDNA3.1) 몰비로 라이게이트합니다.
- 결찰된 제품을 리가아제 제조업체가 지정한 프로토콜을 사용하여 유능한 대장균 세포( 재료 표 참조)로 변환합니다.
- 6개의 단일 콜로니를 선택하고 37°C에서 100μg/mL 카베니실린이 보충된 4-6mL의 LB에서 하룻밤 배양을 만듭니다.
- 각 하룻밤 배양에서 1mL를 할당합니다. 글리세롤을 25% v/v에 첨가하고 글리세롤 스톡을 -80°C에서 저장합니다. 사용 설명서에 지정된 단계에 따라 미니 준비 키트를 사용하여 남은 야간 배양을 정제합니다.
- 플라스미드의 전사 영역에 걸쳐 있는 시퀀싱 프라이머를 사용하여 모든 플라스미드를 서열화합니다. 마스터 글리세롤 스톡으로 올바른 순서를 가진 글리세롤 스톡을 하나 선택하고 나머지는 폐기하십시오.
- 선택 사항: pcDNA3.1-Q23-HTT 플라스미드의 두 HindIII 부위에 걸쳐 있는 서로 다른 Q 길이(Q48, Q73 및 Exon1)를 가진 DNA를 합성하기 위해 유전자 합성 서비스를 요청하십시오. HindIII를 사용하여 pcDNA3.1-Q23-HTT 및 새로 합성된 DNA를 분해하고, 2.2-2.7단계에서와 같이 T4 리가아제로 재현하여 pcDNA3.1 플라스미드에서 상이한 polyQ 길이를 갖는 FL HTT를 만든다.
참고: 이 연구에 사용된 플라스미드 구축물은 Coriell 연구소(www.coriell.org/1/CHDI)의 HD 커뮤니티 저장소에서 직접 구할 수도 있습니다. 재료 표를 참조하십시오.
3. 대규모 형질감염을 위한 GIGA 준비 내독소가 없는 플라스미드 DNA
- pcDNA3.1-Q23-HTT-TEV-FLAG의 박테리아 글리세롤 스톡을 카르베니실린(100μg/mL)이 함유된 LB 한천 플레이트에 표시합니다. 단일 콜로니가 나타날 때까지 플레이트를 37°C에서 16-24시간 동안 배양합니다.
- 단일 콜로니를 집어 들고 카베니실린(100μg/mL)으로 플라스미드 증폭용으로 제조된 풍부한 배지에 5mL 스타터 배양을 접종하고 37°C에서 8시간 동안 성장시킵니다.
- 내독소가 없는 GIGA 플라스미드 정제 키트를 선택하십시오. 플라스미드 GIGA 키트의 매뉴얼에 설명된 단계에 따라 pcDNA3.1-Q23-HTT-TEV-FLAG 플라스미드를 정제합니다.
- 리물루스 아메보사이트 용해물(LAL) 기반 내독소 정량화 키트를 사용하여 플라스미드 내독소 수준을 측정합니다. 제조업체 설명서에 지정된 절차를 따르십시오.
참고: 고품질의 낮은 내독소 수준의 플라스미드 정제는 우수한 형질주입 효율을 얻기 위해 필수적입니다. 이 프로토콜을 사용하면 4mg/mL > 플라스미드 농도에서 박테리아 배양 L당 20-40mg의 플라스미드(슈퍼코일 형태 >80%)를 얻을 수 있습니다. 적절하게 정제된 플라스미드는 내독소 수준이 30 EU/mg< 있어야 하며, OD260/280 범위는 전형적으로 1.8 내지 2.0으로 관찰된다.
4. 폴리에틸렌이민(PEI)에 의한 HEK293 세포 2L의 대규모 형질감염
- 1 g의 PEI 25K를 내독소가 없는 물 1 L에 넣고 교반합니다. 100mM HCl을 사용하여 pH를 2.0으로 조정하고 모든 PEI 25K가 용해될 때까지 저어줍니다. 100 mM NaOH 용액을 사용하여 pH를 7.0으로 조정하고 0.2 μm 필터를 통해 여과한다. 분취량을 분취하여 -20°C에서 최대 1년 동안 보관합니다.
알림: PEI의 분취량은 최대 2주 동안 4°C에서 보관할 수 있지만 해동 후 다시 냉동해서는 안 됩니다. - 293-37시간 동안 가습 셰이커 인큐베이터에서 페니실린-스트렙토 마이신 (페니실린의 경우 5 U / mL 및 스트렙토 마이신의 경우 5 μg / mL의 최종 농도)이 보충 된 성장 배지 (재료 표 참조)에서 HEK24 세포를 전파합니다. 형질주입 하루 전에 5L 삼각 플라스크에서 성장 배지를 사용하여 ~1.2 ×10 6 cells/mL의 밀도로 세포를 2 L로 희석합니다.
- 세포를 37°C, 90 rpm, 5%CO2 에서 18-24 h 동안 계속 성장시킨다. 사용 설명서에 따라 세포 밀도와 생존력을 측정할 수 있는 자동 세포 계수기를 사용하여 세포 파라미터를 측정합니다.
참고: 세포 밀도는 두 배여야 하며 생존율은 >95%여야 합니다. 형질주입 전의 세포 밀도는 대략 2.0 × 10 6-2.4 × 106 cells/mL이어야 한다. 필요한 경우 형질주입 전에 세포를 원하는 밀도로 희석한다. - 형질감염에 필요한 플라스미드 및 PEI의 양을 계산하고; 세포 배양의 각 리터의 형질감염을 위해 1mg의 플라스미드와 3mg의 PEI를 사용하십시오. 2 L 형질감염에 필요한 플라스미드 2 mg 및 PEI 6 mg을 할당한다.
- 플라스미드와 PEI를 세포 배양 총부피의 1 /20에 해당하는 부피의 인산염 완충 식염수(2L 형질주입의 경우 각각 100mL)로 개별적으로 희석하고 실온에서 5분 동안 배양합니다. 희석된 플라스미드와 PEI를 부드러운 소용돌이로 혼합하고 혼합물을 실온에서 30분 동안 배양합니다.
알림: 혼합물은 배양 후 약간 흐린 것처럼 보입니다. - 혼합물을 세포 배양에 추가하고 부드럽게 소용돌이치며 혼합합니다.
- 세포를 37°C, 5%CO2, 90 rpm에서 24 h 동안 성장시킨다.
- 2 M 나트륨 부티레이트 용액을 2 mM의 최종 농도로 첨가한다. 1:1000(v/v) 응집 방지제와 1:1000(v/v) 소포제를 배양물에 추가합니다.
- 플라스크를 32°C, 90 rpm, 5%CO2에서 가습된 쉐이커 인큐베이터로 옮기고, 48 h 동안 계속 성장시킨다.
- 세포 밀도 및 생존력을 포함한 세포 파라미터를 측정하고 사용 설명서에 따라 자동 세포 계수기를 사용합니다.
- 마이크로 원심분리 튜브에서 2.0 × 10 6 세포 (Vol = 2.0 ×10 6 / 세포 밀도)를 옮깁니다. 섹션 5의 웨스턴 블로팅을 위해 원심분리기에서 2,000×g에서 1분 동안 세포를 펠릿화합니다.
- 2,000 × g 에서 30분 동안 원심분리하여 세포를 수확하고 정제 전에 세포 펠릿을 -80°C에 보관합니다.
5. HTT 발현 수준을 추정하기 위한 HEK293 세포 용해물의 SDS-PAGE 및 웨스턴 블롯
- HEK293 세포 배양물의 대규모 형질감염으로부터 이전에 동결된6 개의 세포(단계 4.11)로부터 2.0 × 10개의 분취량을 취한다. 50μg/mL 디지토닌, 5mM EDTA 및 1x 프로테아제 억제제 칵테일이 보충된 250μL의 트리스 완충 식염수(TBS)를 추가하고 피펫을 사용하여 여러 번 흡인하여 세포 펠릿을 다시 현탁시킵니다.
- 세포를 용해시키기 위해 미니로테이터를 사용하여 4°C에서 30분 동안 튜브를 부드럽게 회전시킵니다. 불용성 물질을 17,000 ×g에서 5 분 동안 원 심분리하여 펠릿화합니다.
- 상청액에 4x 환원 리튬 도데실설페이트(LDS) 로딩 버퍼의 1/3 부피를 추가하고 70°C에서 10분 동안 가열합니다.
- 5-20 μL의 세포 용해물을 프리캐스트된 3-8% 트리스-아세테이트 PAGE 겔에 로드합니다. 겔 호환 가능한 1x 트리스-아세테이트 SDS 실행 버퍼를 사용하여 150V에서 60분 동안 정전압 모드에서 겔을 실행합니다.
참고: 트리스-아세테이트 SDS-PAGE는 분자량이 300kDa 이상인 단백질에 대해 다른 유형의 SDS-PAGE보다 높은 분해능을 생성하기 때문에 FL HTT 분석에 사용되었습니다. 이 연구에 사용 된 단백질은 Coriell Institute (www.coriell.org/1/CHDI)의 HD Community Repository에서 직접 구할 수도 있습니다. 재료 표를 참조하십시오. - 웨스턴 블로팅을 수행하려면 전사 완충액 평형 두꺼운 전사지, 메탄올 활성화 폴리비닐리덴 플루오라이드(PVDF) 멤브레인 및 SDS-PAGE 겔을 사용하여 전사 샌드위치를 조립합니다. 제조업체의 사용 설명서에 따라 반건식 웨스턴 블로터를 사용하여 단백질을 PVDF 막으로 옮깁니다.
알림: 일반적으로 10cm x 10cm 멤브레인의 경우 135mA에서 20-30분이면 충분합니다. - 전사 샌드위치를 분해하고 5% w/v 무지방 우유가 보충된 TBST(20mM 트리스 pH 7.4, 150mM NaCl 및 0.1% v/v 트윈-20)에서 멤브레인을 차단합니다.
- 멤브레인을 실온에서 15mL의 1차 항체(항-FLAG 항체 단클론 항체의 경우 1:2,500 희석, 다른 모든 1차 항체의 경우 1:2,000)로 실온에서 1시간 동안 배양합니다.
참고: 이 연구에 사용된 1차 항체는 항-FLAG M2, MAB5492, MAB5490, MAB2166, MAB3E10, MAB4E10, MAB2168, MAB8A4입니다( 재료 표 참조). - TBST의 30-50 mL를 사용하여 멤브레인을 3 x 5 분 세척하십시오.
- 5% w/v 분유를 함유한 TBST 15mL에 형광 염료 접합 염소 항-마우스 IgG 2차 항체와 함께 로커에서 막을 1:15,000, 실온에서 배양합니다.
- 2차 항체에 특이적인 파장을 사용하여 형광 이미저에서 웨스턴 블롯 밴드를 시각화합니다. 사용 설명서에 따라 이미저와 함께 제공되는 소프트웨어를 사용하여 대역 신호를 정량화합니다.
참고: 정량적 웨스턴 블로팅은 정제된 HTT를 표준으로 사용하여 수행할 수 있습니다. HTT의 선형 표준 범위는 기기에 따라 다르며 항-FLAG 항체를 사용하여 레인당 25ng에서 250ng의 HTT까지 이 실험실에서 설정되었습니다. HTT의 서쪽 얼룩은 분해가 없어야합니다. 2-4 pg/세포의 총 HTT 발현 수준이 전형적으로 관찰된다. 정량적 웨스턴 블롯을 수행하는 방법에 대한 세부사항은 이전에 공개된 프로토콜(32 )을 참조한다.
6. 안티 플래그 컬럼 및 SEC를 사용한 HTT의 빠른 단백질 액체 크로마토 그래피 (FPLC) 정제
- 안티 플래그 정화
- 정제에 필요한 FLAG 레진의 양을 추정합니다(일반적으로 형질감염된 세포 배양 2-4L의 정제를 위한 항-FLAG M2 친화성 레진 12mL). 버퍼 A를 사용하여 12-25mL의 항-FLAG 수지를 FPLC를 사용하여 4mL/분의 유속으로 빈 컬럼( 재료 표 참조)에 포장합니다(표 1). 플런저의 높이를 조정하여 플런저 끝과 수지 베드 사이에 틈이 없도록하십시오.
- 세포 펠릿 1g 당 용해 완충액 10mL의 비율을 사용하여 세포 펠릿을 저온 용해 완충액에서 해동 및 현탁시킵니다(표 1).
- 세포 현탁액을 10,000psi에서 고전단 균질화기를 통해 한 번 통과시킨다. 호환되는 고정각 로터가 장착된 원심분리기에서 20,000× g 에서 1시간 동안 원심분리하여 용해물을 정화합니다.
- FPLC를 프로그래밍하고(스터디에 사용된 소프트웨어는 재료 표 참조) 다음 시퀀스를 실행합니다.
- 샘플 펌프를 통해 정화된 용해물을 로드합니다.
- 버퍼 A의 4 컬럼 부피 (CV)로 세척하십시오 (표 1).
- 버퍼 B의 4CV로 세척하십시오 (표 1).
- 8CV의 버퍼 C로 세척합니다(표 1).
- 버퍼 D CV 3개로 세척합니다(표 1).
- 3CV의 용리 완충액으로 세척합니다(표 1).
- SDS-PAGE를 사용하여 피크 분획의 10μL를 분석합니다. 피크 분획을 수집하고 원하는 순도로 결합하십시오. SDS-PAGE 분석을 위해 ~50μL의 결합된 용리액을 저장합니다.
참고: 일반적으로 단일 피크가 나타나고 피크에서 용리된 모든 분획에는 ~90% 순수 HTT가 포함됩니다. - 5CV의 재생 버퍼(표 1)를 사용하여 FLAG 방지 컬럼을 재생성하고 버퍼 A의 CV 5개를 사용하여 컬럼을 재평형화합니다.
참고: Anti-FLAG 수지는 최대 5회까지 또는 상대 수율/리터가 첫 번째 정제의 50%로 떨어질 때까지 재사용할 수 있습니다.
- SEC 컬럼을 사용한 크기 배제 컬럼(SEC) 정제
- 2 × CV의 SEC 버퍼를 사용하여 분자량(MW>)이 500kDa(사용된 컬럼의 재료 표 참조)인 단백질을 분리할 수 있는 SEC 컬럼의 균형을 설정합니다(표 1).
- 50mL 수퍼루프를 통해 항-FLAG 용리액(6.1.5단계에서)을 직접 로드합니다. 주입당 1.2× CV의 SEC 버퍼를 실행합니다. 4°C에서 밤새 SEC 분리를 실행한다.
참고: 최대 5mL 또는 15mL의 단백질 샘플을 이 연구에서 선택한 SEC 컬럼에 로드할 수 있습니다. 다중 주입이 자동으로 수행될 수 있도록 FPLC를 프로그래밍하십시오. 샘플 메서드 스크립트는 보충 파일 1 및 보충 파일 2로도 포함되어 있습니다. - 용리 프로파일을 표준 HTT 용리 프로파일과 비교하여 단량체, 이량체 및 고차 올리고머 피크를 구별합니다. 단량체 HTT 분획을 SEC 컬럼의 용리 프로파일에 기초하여 풀링한다. 원하는 경우, 고차 올리고머 및 이량체 HTT 분획을 별도로 풀링한다.
- 풀링된 HTT 단백질을 4°C에서 100 kDa 원심 농축기를 사용하여 농축한다. OD280 값을 각각의 흡광 계수로 나누어 단백질 농도를 계산합니다 (Q23-HTT, Q48-HTT, Q73-HTT 및 ΔExon1-HTT의 이론적 흡광 계수는 각각 0.776, 0.769, 0.762 및 0.798 (mg / mL) -1 cm-1입니다). HTT 농도를 1.0 mg / mL≤ 유지하십시오.
알림: 집중 과정을 모니터링하는 것은 과농도로 인해 응집이 발생하므로 중요합니다. - 정제된 HTT 단백질을 100μL< 부피로 극저온 안전 마이크로원심분리 튜브에 분취합니다. 액체 질소를 사용하여 분취량을 급속 냉동하고 -80°C에서 보관합니다.
7. HTT 다분산성을 분석하기 위한 분석적 HPLC SEC-MALS-dRI
- UV 검출기, 다각도 광산란 검출기 및 시차 굴절률(dRI) 검출기와 결합된 고성능 액체 크로마토그래피(HPLC) 시스템에서 4°C에서 모든 분석 SEC-MALS를 수행합니다.
- UHPLC 컬럼을 시스템에 연결하기 전에 여과된(0.1μm) HPLC 등급 물로 펌프와 검출기를 퍼지합니다.
- UHPLC 컬럼(사용된 컬럼에 대한 재료 표 참조)을 시스템에 연결합니다. 모든 검출기 신호가 기준선에 도달할 때까지 여과된(0.1μm) 물과 SEC-MALS 버퍼(표 1)로 컬럼을 평형화합니다.
- 주사당 15분 동안 6mg/mL 소 혈청 알부민(BSA) 2μL를 0.3mL/분의 유속으로 주입하고 데이터 품질을 검사합니다. BSA 프로파일을 기반으로 정규화, 피크 정렬 및 대역 확장 보정을 수행하고 다음 HTT 샘플 실행을 위한 템플릿을 생성합니다.
- 플로트를 사용하여 실온의 수조에서 FL Q23-HTT 샘플의 바이알을 신속하게 해동시킨다. 0.1μm 스핀 필터를 통해 HTT를 필터링합니다. 2-4 μL의 HTT 샘플을 주입하고 0.3 mL/min의 유속으로 4°C에서 15분 동안 실행합니다.
- 함께 제공되는 소프트웨어를 사용하여 크로마토그래피 및 광산란 데이터를 분석합니다(재료 표 참조). dRI 검출기를 농도 검출기로 사용하고 HTT의 굴절률 증분(dn/dc)으로 0.185를 사용합니다. 각 피크33,34에 대한 중량 평균 분자량을 결정하기 위해 Zimm 플롯을 생성합니다.
참고: HTT의 굴절률 증가는 프로그램 SEDFIT 소프트웨어35 및 HTT의 1차 아미노산 서열을 입력으로 사용하여 0.185로 계산됩니다.
참고 : HTT 단량체 MW는 ~ 370 kDa ± 30 kDa에서 SEC-MALS에 의해 결정됩니다. 정제된 HTT는 일반적으로 60%에서 75% 사이의 단량체 함량을 가지고 있습니다(이 실험실에서). 모노머 함량이 낮으면 응집을 방지하기 위해 취급에 더 많은주의가 필요함을 나타낼 수 있습니다.
8. HTT 다분산성을 분석하기 위한 파란색 네이티브 PAGE
- 50mL의 20x Blue Native PAGE 실행 완충액( 재료 표 참조)을 950mL의H2O와 혼합하여 1L의 양극 완충액을 준비합니다. 100mL의 20x Blue Native PAGE 실행 완충액 및 100mL의 청색 네이티브 PAGE 음극 첨가제(20x)를 1,800mL의 H 2O와 혼합하여2L의 진한 파란색 음극 완충액을 준비합니다.
- 플로트를 사용하여 실온의 수조에서 FL Q23-HTT 샘플의 바이알을 신속하게 해동합니다. 사용하기 전에 해동된 단백질을 얼음 위에 보관하십시오.
- 5μg의 FL Q23-HTT(~1mg/mL), 1μL의 0.5% G250 첨가제, 2.5μL의 4x Blue Native PAGE 샘플 버퍼 및 물을 혼합하여 최종 부피를 10μL로 만듭니다.
- 혼합된 FL Q23-HTT 샘플을 3-12% 프리캐스트 Bis-Tris 겔에 로딩합니다. 염색되지 않은 단백질 표준물질 7.5μL를 표준물질과 동일한 겔에 로드합니다.
- 탱크 전면을 진한 파란색 음극 버퍼로 채우고 탱크 뒷면을 양극 버퍼로 채 웁니다.
참고: 샘플을 로드할 때 쉽게 시각화할 수 있도록 샘플이 로드된 후 버퍼를 채우십시오. - 차가운 방에서 150V에서 120 분 동안 젤을 실행하십시오.
- 밴드가 관찰될 때까지 탈지처리 용액(표 1)으로 겔을 염색합니다. 젤을 물로 옮깁니다. 이미징 스테이션에서 젤을 시각화하고 문서화합니다.
참고: Blue Native PAGE는 원래 막 단백질을 분석하도록 설계되었습니다. 이 실험실에서 HTT의 단량체 함량을 추정하기 위한 대체 방법으로 채택되었습니다. HTT의 소수성 영역에 결합하여 세제가 부족한 완충 조건에서 응집체를 형성하는 것을 방지합니다. 쿠마시 블루 G250을 사용하지 않는 기존의 네이티브 PAGE는 HTT에 존재하는 많은 소수성 포켓으로 인해 HTT가 가용성 올리고머 및 응집체를 형성하도록 합니다.
9. SDS PAGE 후 쿠마시 또는 은 염색을 하여 HTT 순도 분석
- 정제된 FL Q23-HTT에 4x LDS 샘플 버퍼와 10x 환원 시약을 추가하여 로딩 버퍼 및 환원 시약의 최종 농도를 1x로 만듭니다.
- 샘플을 70°C의 건식 가열 블록에서 10분 동안 가열합니다.
- 웰당 최대 1μg의 단백질을 3-8% 트리스 아세테이트 젤에 로드하고 트리스-아세테이트 SDS 실행 버퍼를 사용하여 150V에서 1시간 동안 실행합니다.
참고: 이 연구에 사용된 단백질은 Coriell 연구소(www.coriell.org/1/CHDI)의 HD 커뮤니티 저장소에서 직접 구할 수도 있습니다. 재료 표를 참조하십시오. - 쿠마시 염색
- H2O로 젤을 5 분 동안 씻으십시오.
- 30mL의 염색 용액에 겔을 흔들어 Coomassie 염색 용액(표 1)에서 겔을 15분 동안 염색합니다.
- 겔을 50mL의 H2O에서 5 분 동안 흔들어 염색을 제거하십시오. 이미징 스테이션에서 Coomassie로 염색된 젤을 시각화하고 문서화합니다.
- 실버 얼룩은 시판의 실버 얼룩 키트를 사용합니다.
- SDS-PAGE 후, 고정 용액(표 1)을 사용하여 실온에서 1시간 내지 밤새 겔을 고정한다.
- 키트의 지침에 따라 염색, 세척 및 현상하십시오.
- 밴드가 원하는 강도에 도달하면 즉시 현상 단계를 중지하십시오.
- 가시 광선이 장착 된 젤 문서화 시스템에 젤을 문서화하십시오.
참고: >95%로 정제된 HTT는 이 프로토콜을 사용하여 Coomassie 및 은 염색으로 검출할 수 있습니다. 정량적 단백질 분석을 수행하는 방법에 대한 세부사항은 이전에 공개된 프로토콜(32 )을 참조한다.
결과
일시적인 발현 벡터 (pcDNA3.1-Q23-HTT-TEV-FLAG, 도 1A)는 FL Q23-HTT (aa 1-3,144, Q23 넘버링에 기초)의 포유동물 세포에서 신속한 생산을 위해 조작된다. 이 작제물은 카세트 클로닝에 의해 다양한 HTT 돌연변이 구축물을 신속하게 생성하고, 최소한의 크로마토그래피 단계로 HTT 단백질을 고품질 및 균질성으로 정제하도록 설계된 특징을 가지며, 태그가 지정되지 않은 FL HTT를 생산할 수 있는 옵션이 있습니다. 기능 목록에는 1이 포함됩니다. HTT 엑손 1에서 CAG 반복을 둘러싸는 HindIII 제한 소화 부위는 제한 효소 소화 및 결찰에 의해 다양한 길이의 polyQ 스트레치를 갖는 FL HTT 돌연변이를 생성하는 데 사용할 수 있습니다. 2. FL HTT의 C-말단은 TEV 프로테아제 절단을 사용하여 태그가 없는 FL HTT 단백질의 고순도 및 선택적 생성을 갖는 FL HTT의 원스텝 친화성 정제를 위해 TEV 프로테아제 인식 부위를 갖는 FLAG 에피토프로 태그되고; 3. HEK293 세포에서 높은 수준의 발현을 위한 인간 세포 코돈 사용을 위한 코돈 최적화된 FL HTT 서열. pcDNA 3.1(+) 벡터는 포유동물 세포주에서 CMV 프로모터의 높은 전사 활성화 활성을 이용하기 위해 작제물의 중추로서 사용된다.
pcDNA3.1-Q23-HTT-TEV-FLAG를 시작 주형으로 사용하여, Q48 및 Q73 FL HTT 구축물은 2개의 HindIII 제한 효소 부위에 걸쳐 적절한 Q 길이를 갖는 DNA 단편을 합성하고 주형에서 동일한 영역을 교환함으로써 생성되었다. FL HTT (aa 91-3,144)의 ΔExon1 돌연변이체 (도 1B)는 주형 내의 엑손 1 영역에 걸쳐 있는 결실된 잔기로 향하는 프라이머를 사용하여 생산하였다. PEI를 사용하여 pcDNA3.1-Q23-HTT-TEV-FLAG로 형질감염된 HEK293 세포를 5%CO2 하에 5 L 쉐이커 플라스크에서 성장시켰다. 전형적인 대규모 정제는 6.0 × 10 9-3.0 ×10 세포를 포함하는 2-10 L 세포 펠릿을 사용합니다. 정제를 진행하기 전에, 각각의 형질감염으로부터의 HTT 발현 수준을 정제된 재조합 FLAG-태그된 HTT를 표준으로 사용하고 항-FLAG 항체를 제1 항체로서 사용하는 정량적 웨스턴 블롯팅에 의해 추정하였다. 추정된 HTT 발현 수준이 ≥2 pg HTT/cell인 펠렛을 정제에 사용하였다.
FL HTT의 정제는 먼저 안티-FLAG 친화성 정제를 사용한 다음 HTT에 적합한 분리 범위를 가진 겔 여과 컬럼에서 SEC를 사용하는 2단계 컬럼 공정으로 구성됩니다(그림 2A, 예는 재료 표 참조). 두 단계 모두, HTT는 분석 SEC-MALS에 기초한 쿠마시 블루 및 >65% 단량체 함량을 갖는 SDS-PAGE에 의해 측정된 바와 같이, >95% 샘플 순도로 수득되었다. 연장된 정제 시간과 온도 모두 최종 HTT 단량체 함량에 부정적인 영향을 미치기 때문에 취급을 최소화하고 일관된 샘플 품질을 얻기 위해 두 정제 단계 모두에서 FPLC를 사용했습니다. 안티-FLAG 정제 중 주요 오염 물질은 질량 분석법에 의해 결정된 샤페론 Hsp70이었다(그림 2B, 레인 2). 이는 Hsp70이 인간 세포주24에서 안정적으로 발현되는 FL HTT와 공동정제된다는 발견과 일치하며, 이는 Hsp70이 생체내에서 FL HTT에 대한 일반적인 안정화제일 수 있음을 시사한다.
Hsp70 오염은 안티-FLAG 친화성 정제 단계 동안 염화마그네슘 및 ATP로 광범위하게 세척함으로써 제거할 수 있습니다(그림 2B, 레인 1). Hsp70의 제거시, FL HTT는 고차 올리고머(24 )를 형성하는 경향이 있고, 1 mg/mL≤ 농도로 유지되어야 한다. SEC 이전의 농축 단계는 종종 상당한 집계를 초래할 수 있습니다. 따라서 가장 좋은 방법은 농축하지 않고 anti-FLAG 정제의 피크 분획을 크기 제외 컬럼에 직접 로드하는 것입니다. SEC 후, 샘플을 단량체 FL HTT의 최대 회수를 위해 ≤1 mg/mL로 농축하였다. 각각의 정제 단계로부터 회수된 HTT의 양은 정량화 표준으로서 정제된 FL HTT를 사용하여 쿠마시 블루 또는 정량적 웨스턴 블로팅에 의해 추정하였다(표 2). 설명된 방법으로 생산된 정제된 FL HTT 단백질의 일반적인 수율은 세포 배양의 약 1mg/L이지만 배치 간 변동성 또는 FLAG 방지 정제 수지를 여러 번 재사용하는 경우 그보다 훨씬 낮을 수 있습니다(표 3).
FL HTT의 과발현은 단백질22의 단편화를 초래할 수 있다. 여기에 설명된 방법에 의해 생성된 FL Q23-HTT는 Coomassie G250 또는 은 염색에 의해 염색된 SDS PAGE에 의해 350kDa의 정확한 MW를 갖는 단일 밴드로 해결되었습니다(그림 2C). 웨스턴 블롯팅에 의해, FL Q23-HTT는 N-말단, C-말단 및 여러 중간 도메인에서 에피토프에 대해 상승된 항체와 반응했으며, 추가적인 단편-관련 밴드는 관찰되지 않았으며, 이는 단백질이 유의한 검출 가능한 절단없이 분리되었음을 나타낸다 (도 3A). FL HTT polyQ 길이 변이체 Q23, Q48 및 Q73은 웨스턴 블롯에서 예상대로 반응하여, Q-길이 증가와 상관관계가 있는 polyQ-지향 mAb MW1에 대해 점진적으로 더 강한 신호를 보여줍니다: Q23-HTT < Q48-HTT < Q73-HTT(그림 3B). N 말단 엑손 1을 표적으로 하는 항체 MW1 및 MAB549로 프로빙했을 때 ΔExon1-HTT(aa 91-3,144)에 대한 신호가 관찰되지 않았습니다(그림 3B).
정제된 HTT 단백질의 응집 상태 및 분자 질량을 분석하기 위해 SEC-MALS를 사용하였다. 샘플은 UV, MALS 및 dRI 검출기에 의해 모니터링되는 분석 SEC에 의해 분석되었다. SEC-MALS로부터 수득 된 절대 몰 질량은 분자(33,34)의 형태에 의존하지 않는다; 따라서 SEC-MALS는 단량체 및 올리고머 분획이 잘 분리 될 때 MW의 편향되지 않은 추정을 제공합니다. 테스트된 HPLC 컬럼 중 SEC 컬럼(재료 표 참조)은 몰 질량을 구별할 수 있을 정도로 HTT 단량체와 이량체 사이에 충분한 분리능을 보였습니다(그림 4). 단백질 농도는 dRI 검출에 의해 결정되었다. FL HTT의 굴절률 증분(dn/dc)은 SEDFIT 소프트웨어(35)에 의해 계산된 바와 같이 0.1853 mL/g이다. ΔExon1 HTT (91-3,144), FL Q23, Q48 및 Q73 HTT (1-3,144)에 대해 유사한 분석 SEC 용리 패턴이 관찰되었으며, 각각은 작은 이량체 및 올리고머 피크를 갖는 주요 단량체 피크로 구성되었습니다 (표 4). 단량체 형태에 대해 계산된 MW는 이론적인 MW보다 큽니다. 이는 고차 올리고머 피크의 종이 겹치고 HTT 단백질이 고차 올리고머 형성을 피하기 위해 저농도로 유지되기 때문에 약한 dRI 신호로 인한 오류로 인해 발생할 수 있습니다. 정제된 FL HTT 변이체의 여러 배치의 UV 피크를 적분함으로써, polyQ 길이와 응집체 프로파일 사이의 명확한 상관관계가 관찰되지 않았다(표 4).
분석 SEC 이외에, 전통적인 천연 PAGE가 FL HTT 올리고머 상태를 특성화하기 위한 상보적 방법으로서 사용될 수 있는지 여부를 결정하기 위해 수행되었다. 고차 올리고머는 세제 없이 천연 완충액을 사용하여 3-8% 트리스-아세테이트 겔을 통해 분해되었습니다. SEC로부터 정제된 FL HTT는 올리고머화 상태에 상응하는 다수의 밴드를 나타내었다(도 5A). 가장 낮은 밴드는 천연 마커 480 kDa와 720 kDa 사이에 위치하였고, 이는 곤충 세포22로부터 정제된 FL HTT에 대해 보고된 이전 결과와 유사하였다. 그러나, HTT 단량체는 전통적인 네이티브 PAGE를 사용할 때 가장 풍부한 밴드가 아니었고, 결과는 분석적 SEC-MALS에 의해 결정된 응집체 프로파일과 상관관계가 없었다. FL HTT36,37,38에 존재하는 몇몇 소수성 패치, 특히 HAP40과 FL HTT25 사이의 소수성 계면은 겔 내에서 이동하는 동안 고차 올리고머의 형성에 기여할 가능성이 있다. 이는 소수성 영역이 세제가 없거나 안정화 단백질-단백질 상호 작용이없는 경우 서로 상호 작용하는 것으로 알려져 있기 때문입니다. HTT의 소수성 특성과 일치하게, FL HTT는 SEC 정제 단계 동안 CHAPS가 없는 상태에서 고차 올리고머 분획의 양을 증가시킨다.
막 단백질과 소수성 패치39를 포함하는 큰 단백질 복합체를 조사하는 데 널리 사용되는 Blue Native PAGE를 기존의 네이티브 PAGE와 비교했습니다. 정제된 HTT는 각각 HTT의 단량체, 이량체 및 삼량체 종을 나타낼 가능성이 있는 643, 927 및 1070kDa의 추정 MW(그림 5B)를 갖는 Blue Native PAGE에서 세 가지 주요 밴드를 보여주었습니다. 단량체 밴드는 Blue Native PAGE에서 가장 풍부한 밴드로 남아 있었으며 동일한 샘플의 분석 SEC 프로파일에 잘 대응했습니다. Blue Native PAGE에 의한 HTT 단량체의 MW의 과대 평가는 상응하는 분자량 마커 11,23,25에 비해 느린 이동을 야기하는 HTT의 독특한 중공 구형 구조 또는 소수성 영역으로부터 발생할 수 있다. 전반적으로, FL Q23-HTT, FL Q48-HTT, FL Q73-HTT 및 ΔExon1-HTT는 분자량 차이로 인해 단백질 밴드 이동에 약간의 차이만 있는 유사한 청색 네이티브 PAGE 프로파일을 갖는다.
정제된 단백질의 품질에 대한 추가의 검사로서, C-말단 FLAG 태그는 TEV 프로테아제로 처리함으로써 FL HTT로부터 제거될 수 있다. 단백질 분해 절단 후, 샘플을 4개의 항체를 사용하여 웨스턴 블롯으로 분석하여 FLAG 태그 제거를 확인하고 HTT 분해를 검출했습니다. 항-FLAG M2 및 HTT의 N-말단, 중간 도메인 및 C-말단에 대한 에피토프를 갖는 3개의 헌팅틴 특이적 항체에 대한 면역반응성은 성공적인 FLAG 태그 제거를 나타내었고 HTT-특이적 분해 생성물은 없었다(보충 그림 S1).
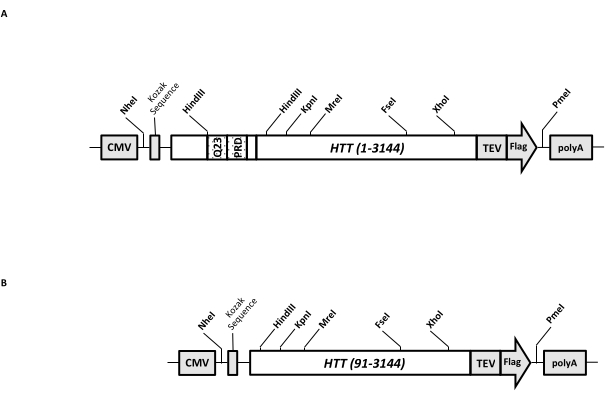
그림 1: 전체 길이 HTT 표현식을 위한 구성. (A) 전장 Q23 HTT 를 코돈-최적화하고, pcDNA3.1(+) 플라스미드 내로 클로닝하였다. HTT의 3' 말단을 플래그 에피토프 및 TEV 프로테아제 절단 부위로 태그하여 태그가 없는 HTT 단백질을 생성하였다. 폴리글루타민 스트레치 및 프롤린-풍부 도메인은 상이한 polyQ 길이를 갖는 HTT 변이체를 생성하기 위해 카세트 클로닝, 즉 Q48 및 Q73을 사용하여 추가 CAG 반복을 삽입하기 위해 측면 HindIII 제한 엔도뉴클레아제 부위로 설계되었다. (b) ΔExon1 구축물을 주형으로서 pcDNA3.1-Q23-HTT를 사용하여 PCR 돌연변이유발을 만들었다. HTT의 잔기 91-3,144는 발현을 위해 ΔExon1 구축물에 남아있었습니다. 약어 : HTT = 헌팅틴; CMV = 거대 세포 바이러스; Q23 = 폴리글루타민 스트레치; PRD = 프롤린이 풍부한 도메인; TEV = 담배 에칭 바이러스 절단 부위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
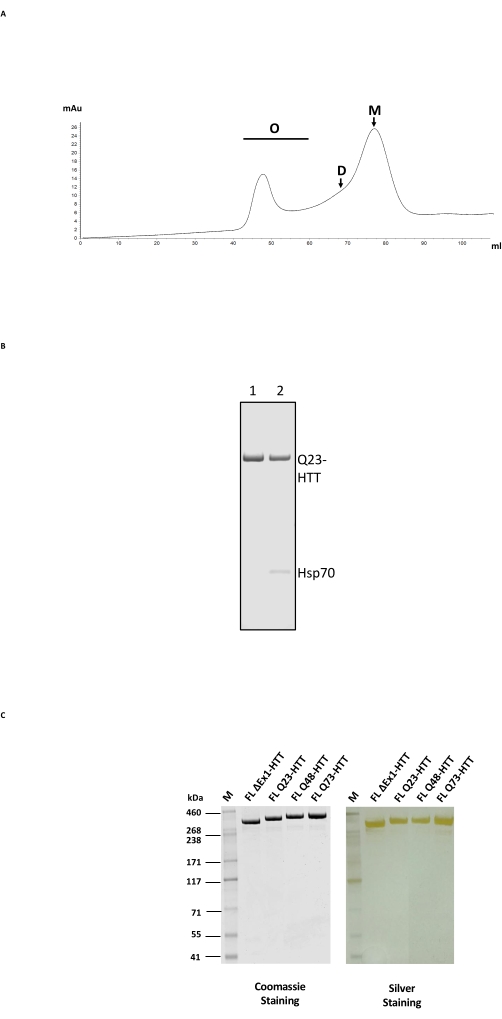
그림 2: HTT의 대규모 정제. (A) FPLC 컬럼에서 플래그 방지 정제된 전장 Q23-HTT의 SEC 프로파일. Q23-HTT의 고차 올리고머, 이량체 및 단량체 피크가 라벨링됩니다. 단량체를 함유하는 분획을 최종 HTT 샘플로서 수집하였다. (B) ATP/마그네슘 세척 단계(레인 1) 또는 ATP/마그네슘 세척 없이 정제된 Q23-HTT의 SDS-PAGE는 Hsp70 동시 용출(레인 2)을 초래합니다. (C) 쿠마시 블루 G-250 또는 실버 염색으로 염색된 SDS-PAGE 상의 최종 정제된 전장 HTT 변이체. 약어 : FL = 전체 길이; HTT = 헌팅틴; SEC = 크기 배제 크로마토그래피; FPLC = 고속 단백질 액체 크로마토 그래피; O = 올리고머; D = 이량체; M = 단량체; SDS-PAGE = 나트륨 도데실설페이트 폴리아크릴아미드 겔 전기영동; Hsp70 = 열충격 단백질 70. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
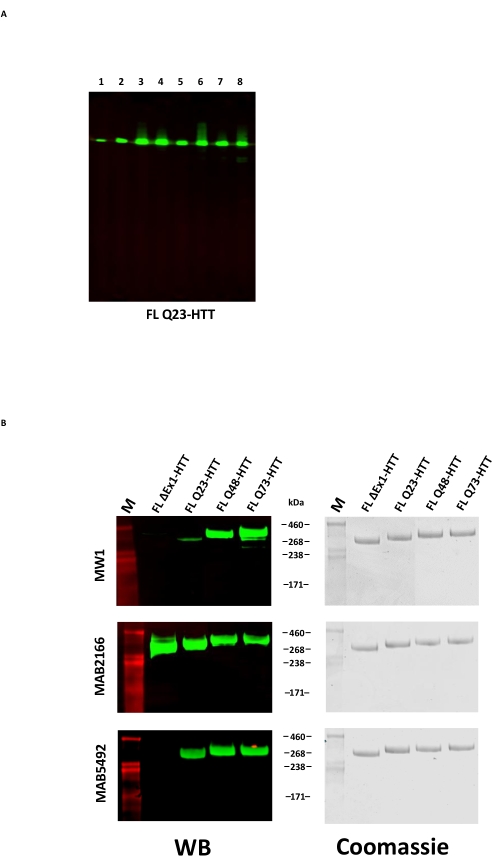
그림 3: 정제된 HTT 변이체의 웨스턴 블롯 분석. (A) 정제된 FL Q23-HTT를 SDS-PAGE 상에서 실행하고 PVDF 막으로 옮겼다. 1차 항체 및 상호작용하는 에피토프는 레인 1, α-FLAG M2, FLAG 태그; 레인 2, MAB5492, HTT aa. 1-82; 레인 3, MAB5490, HTT aa 115-129; 레인 4, MAB2166, HTT aa 181-810; 레인 5, MAB3E10, HTT aa 1,171-1,177; 레인 6, MAB4E10, HTT aa 1,844-2,131; 레인 7, MAB2168, HTT aa 2,146-2,541; 레인 8, MAB8A4, HTT aa 2,703-2,911. (B) 정제된 FL HTT 변이체 1μg을 SDS-PAGE 상에서 실행하고 PVDF로 옮겼고(왼쪽), 중복된 SDS 겔을 실행하고 쿠마시 블루(오른쪽)로 염색하였다. 1차 항체 및 상호작용하는 에피토프는 행 1, MW1, 확장된 PolyQ 반복; 행 2, MAB2166, HTT aa 181-810; 행 3, MAB5492, HTT aa 1-82. 약어: FLL Q23-HTT = 23개의 글루타민 잔기를 함유하는 전장 헌팅틴 단백질; SDS-PAGE = 나트륨 도데실설페이트 폴리아크릴아미드 겔 전기영동; WB = 웨스턴 블롯; M = 마커; PVDF = 폴리 비닐 리덴 플루오 라이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
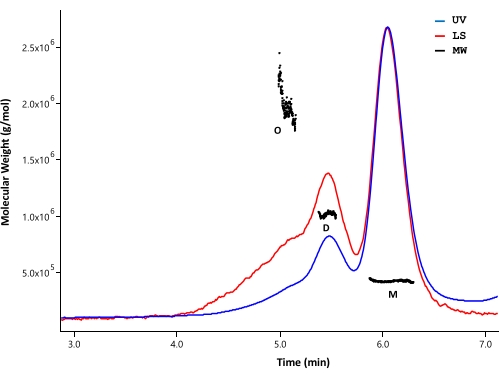
그림 4: 전체 길이 HTT의 SEC-MALS 분석. 정제된 전장 Q23-HTT를 UPLC 컬럼 상에서 용리시켰다. 예측된 단량체, 이량체 및 올리고머의 피크 위치가 표시됩니다. 분자량은 단량체, 이량체 및 삼량체 피크에 대해 계산하고 표 5에 나열하였다. Q48, Q73 및 ΔExon1 HTT에 대해 유사한 용리 프로파일이 관찰되며, 각 정제에서 가변 단량체, 이량체 및 올리고머 함량이 있습니다. 약어: SEC-MALS = 다각도 광산란을 이용한 크기 배제 크로마토그래피; UV = 자외선; LS = 광산란; MW = 분자량; Q23-HTT = 23개의 글루타민 잔기를 함유하는 헌팅틴 단백질; M = 단량체; D = 이량체; O = 올리고머. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
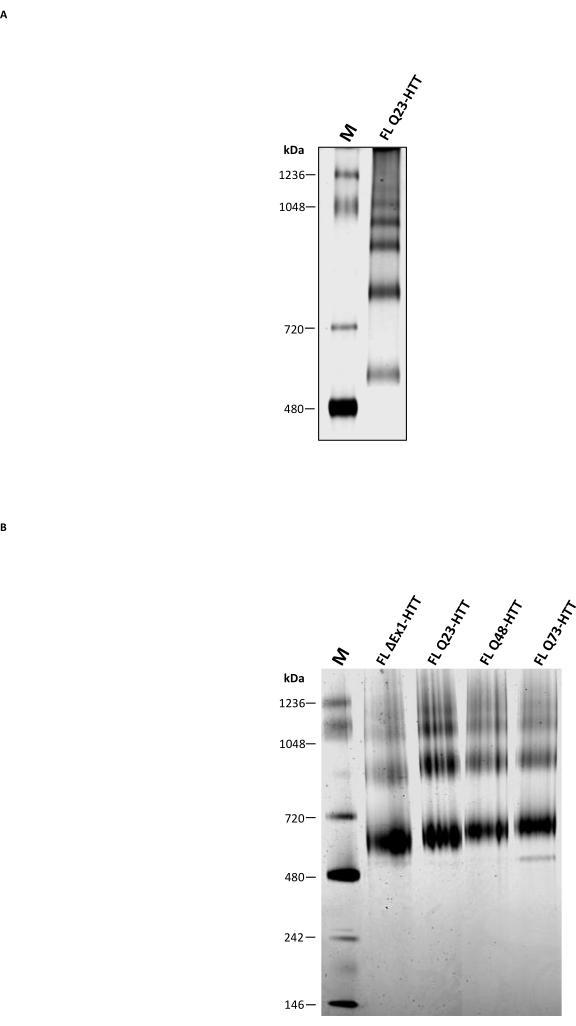
그림 5: 투명 네이티브 PAGE 또는 블루 네이티브 PAGE 젤을 사용한 정제된 HTT의 특성 분석. SEC로부터의 천연 마커 및 겉보기 단량체 Q23-HTT는 비변성 PAGE 시스템(A) 및 청색 네이티브 PAGE 시스템(B)에서 3-8% 트리스-아세테이트 겔 상에서 분해되었다. 약어 : FL = 전체 길이; Q23-HTT = 23개의 글루타민 잔기를 함유하는 헌팅틴 단백질; PAGE = 폴리아크릴아미드 겔 전기영동; M = 마커. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 걸음 | 이름 | 구성 | ||
| 6.1.1 | 버퍼 A | 50 mM 트리스, 500 mM NaCl, 5 % v / v 글리세롤, 5 mM EDTA, 0.01 % v / v 트윈 -20, pH 8.0. | ||
| 6.1.2 | 용해 버퍼 | 50 mM 트리스, 500 mM NaCl, 5% v/v 글리세롤, 5 mM EDTA 및 1x 프로테아제 억제제 칵테일 | ||
| 6.1.4.2 | 버퍼 A | 50 mM 트리스, 500 mM NaCl, 5 % v / v 글리세롤, 5 mM EDTA, 0.01 % v / v 트윈 -20, pH 8.0. | ||
| 6.1.4.3 | 버퍼 B | 50 mM 트리스; 500 mM KCl; 5 mM MgCl2; 5 % v / v 글리세롤; 0.01% v/v 트윈-20, pH 8.0 | ||
| 6.1.4.4 | 버퍼 C | 20 mM 트리스; 200 mM KCl; 5 mM MgCl2; 5 mM ATP; 0.01% v/v 트윈-20; 5% v/v 글리세롤, pH 8.0 | ||
| 6.1.4.5 | 버퍼 D | 50 mM 트리스; 500 mM NaCl; 5 % v / v 글리세롤; 5 mM EDTA; 0.5% w/v 챕스, pH 8.0 | ||
| 6.1.4.6 | 용리 버퍼 | 50 mM 트리스; 500 mM NaCl; 5 % v / v 글리세롤; 0.5% w/v 챕스; 0.2 밀리그램/mL 다이크디디크 펩타이드, pH 8.0 | ||
| 6.1.6 | 재생 버퍼 | 0.1 M 글리신 HCl, pH 3.5; 0.01% v/v 트윈-20 | ||
| 6.2.1 | 초 버퍼 | 50 mM 트리스, 500 mM NaCl, 5% v/v 글리세롤, 0.5% w/v CHAPS, 1 mM TCEP | ||
| 7.3 | 초몰 버퍼 | 50 mM hepes, pH 7.2, 500 mM NaCl, 5% v/v 글리세롤, 0.5% w/v CHAPS | ||
| 8.7 | 얼룩 제거 솔루션 | 40% v/v 메탄올 및 7% v/v 아세트산 | ||
| 9.4.2 | 쿠마시 염색 솔루션 | 0.01 % w / v 쿠마시 G250, 50 % v / v / 메탄올, 10 % v / v 아세트산 | ||
| 9.5.1 | 고정 솔루션 | 50% v/v 메탄올, 10% v/v 아세트산, 50μL의 포름알데히드/100mL의 용액 | ||
표 1: 완충액과 용액의 조성
| 단계 | HTT 농도 (밀리그램 / 밀리람베르트) | 총 부피 (mL) | HTT 함량 (밀리그램) | 셀당 HTT 수율(페이지/셀) | % 수율 |
| 상쾌한 | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| 안티 플래그 | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| 초 | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
표 2: pcDNA3.1-Q23-HTT-TEV-플래그로 형질감염된 2L HEK293 펠릿으로부터의 HTT 수율. 약어: FL Q23-HTT = 23개의 글루타민 잔기를 함유하는 전장 헌팅틴 단백질; TEV = 담배 에칭 바이러스 절단 부위; SEC = 크기 배제 크로마토 그래피.
| HTT 샘플 | HTT 수율 (밀리그램 / L) | 평균 순도 (%) | ||
| 증권 시세 표시기 | A280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | 플로리다 Q23-HTT (N = 3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | 플로리다 Q48-HTT (N = 3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | 플로리다 Q73-HTT (N = 3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
표 3: 4개의 FL HTT 변이체 정제의 단백질 수율 및 이들의 최종 순도의 요약. 약어 : FLL HTT = 전장 헌팅틴 단백질.
| HTT 샘플 | A | D | M |
| 플로리다 Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| 플로리다 Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| 플로리다 Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
표 4: 정제로부터의 FL HTT 변이체의 대표적인 응집체, 이량체 및 단량체 함량의 요약. 약어 : FL HTT = 전장 헌팅틴 단백질; A = 집계; D = 이량체; M = 단량체; SEC = 크기 배제 크로마토 그래피.
보충 그림 S1: TEV 프로테아제 소화에 따른 웨스턴 블롯 분석. 정제된 FL Q23-HTT 및 FL Q48-HTT를 SDS-PAGE 상에서 실행하고, PVDF 막으로 옮기고, TEV 분해에 따른 웨스턴 블로팅에 의해 분석하였다. 사용된 1차 항체는 항-플래그 M2 (플래그 태그), MAB5492 (HTT aa 1-82), MAB3E10 (HTT aa 997-1,276), 및 MAB2168 (HTT aa 2,146-2,541)이었다. 레인 1, 단백질 표준; 레인 2, Q23-HTT-TEV-플래그; 레인 3, Q48-HTT-TEV-플래그; 레인 4, Q23-HTT-TEV-플래그는 1:5에서, 4°C에서 밤새 TEV 프로테아제로 처리; 레인 5, Q48-HTT-TEV-플래그는 1:5에서, 4°C에서 밤새 TEV 프로테아제로 처리하였다. 약어 : FL HTT = 전장 헌팅틴 단백질; SDS-PAGE = 나트륨 도데실설페이트 폴리아크릴아미드 겔 전기영동; TEV = 담배 에칭 바이러스; PVDF = 폴리 비닐 리덴 플루오 라이드. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 동결-해동 주기를 거친 FL HTT 변이체의 SEC-MALS 분석. 정제된 Q23-HTT(A) 및 Q48-HTT(B)를 -80°C에서 동결시키고 실온에서 최대 6배 동안 해동시켰다. Q23-HTT 및 Q48-HTT를 1차 동결-해동 및 6차 동결-해동 주기 후에 SEC-MALS로 분석하였다. 단량체 분획의 약간의 감소 및 이량체 및 고차 올리고머 분획의 증가는 반복된 동결-해동 주기 후에 광 산란에 의해 관찰되었다. 예측된 단량체, 이량체 및 고차 올리고머의 피크 위치가 표시됩니다. 약어 : FL HTT = 전장 헌팅틴 단백질; O = 올리고머; D = 이량체; M = 단량체; SEC-MALS = 다각도 광산란을 이용한 크기 배제 크로마토그래피. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S3: 동결-해동 주기를 거친 FL HTT 변이체의 SDS PAGE. 정제된 Q23-HTT(레인 2-7) 및 Q48-HTT(레인 9-14)를 -80°C에서 동결시키고 실온에서 최대 6회 동안 해동시켰다. Q23-HTT 및 Q48-HTT의 분취량을 각각의 동결-해동 주기 후에 저장한 다음, SDS PAGE로 분석하였다. 골재 또는 분해 생성물의 증가는 관찰되지 않았다. 샘플은 밴드 농도계에 의해 안정적이고 >95% 순수한 것으로 간주되었습니다. 약어 : FL HTT = 전장 헌팅틴 단백질; SDS-PAGE = 나트륨 도데 실 설페이트 폴리 아크릴 아미드 겔 전기 영동. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: FPLC 15 mL 안티-플래그 HTT 스크립트. 약어 = FPLC = 빠른 단백질 액체 크로마토 그래피; HTT = 헌팅틴 단백질. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: FPLC SEC_MALS HTT 스크립트. 약어: SEC-MALS = 다각도 광산란을 이용한 크기 배제 크로마토그래피; FPLC = 고속 단백질 액체 크로마토 그래피; HTT = 헌팅틴 단백질. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 면역분석 및 MS 분석 개발, 웨스턴 블롯 분석을 위한 대조군 및 구조-기능 연구를 위한 표준으로 사용하기 위해 적절한 순도와 균질성을 갖는 여러 FL HTT 단백질 구축물을 생성하기 위한 일시적인 형질감염, 발현 및 정제 방법을 설명합니다. 이 일시적인 발현 방법은 확장 가능하고 다목적이며, 사용자가 이전에 기술된 안정한 세포주 또는 바이러스 기반 방법을 사용하는 것보다 더 효율적으로 낮은 밀리그램 양의 FL HTT 변이체를 생성할 수 있게 한다 21,22,23,24. 일상적으로, 플라스미드가 구축되면 일시적 발현 방법을 사용하여 일주일 이내에 2L 규모의 단백질 생산에서 2-5mg의 고도로 정제된 FL HTT를 생성할 수 있으며, 일반적으로 세포 배양 리터당 1-2.5mg의 FL HTT를 얻을 수 있습니다.
여기에서 설명하는 일시적 발현 방법은 세포주를 확립하는데 오랜 시간이 소요되고 안정적인 세포주의 보관 및 유지에 어려움이 있는 등 안정적인 세포주 발현에 있어서 많은 장애를 극복한다. PEI는 또한 시중의 다른 형질주입 시약에 비해 상대적으로 저렴하여 대규모 형질주입을 경제적으로 실행 가능하게 만듭니다. 또한 프로토콜에는 한계가 있습니다: 형질주입 효율은 주로 플라스미드의 품질, 최적의 세포 성장 및 PEI가 얼마나 잘 저장되고 준비되는지에 달려 있습니다. 작업자는 단백질 수율의 급격한 감소를 피하기 위해 이러한 중요한 단계에서 특별한 주의를 기울이고 품질 관리를 수행해야 합니다. 프로토콜에 사용되는 Anti-FLAG 수지는 또한 상대적으로 고가이며, 여러 정제 및 재생 후에 FL HTT의 감소된 포획을 나타낸다. 일부 연구자들은 친화성 수지의 보다 강력한 재생을 허용하기 위해 다른 태그로 전환하는 것이 더 실용적이라는 것을 알게 될 수 있습니다.
다양한 세포주 및 발현 조건을 시험하여 FL HTT 발현 수준을 최적화하였다. HEK293 세포는 단백질의 높은 발현과 현탁 배양 형식에서의 취급 용이성으로 인해 FL HTT의 발현을 위해 선택되었으며, 이 방법은 셰이커 또는 바이오리액터에서 대규모 발현에 적합합니다. 더 높은 FL HTT 단백질 발현 수준은 37°C의 통상적인 온도를 사용하는 대신 32°C와 같은 더 낮은 배양 온도에서 달성될 수 있다. 낮은 온도는 단백질 합성을 늦추고 FL HTT40의 올바른 폴딩을 촉진할 수 있습니다. 그러나, 이러한 현상은 FL HTT 또는 시험된 세포주에 특이적이지 않다. 감소된 형질감염 후 온도는 CHO 세포에서 약제학적 단백질 발현에 널리 사용되어 왔다. 비록 그 메카니즘이 완전히 이해되지는 않았지만, 저온은 G1 단계에서 세포 주기를 정지시키고 세포 에너지를 단백질 생산으로 전환시키는 것으로 생각된다41.
포유동물 세포로부터 정제된 전장 HTT는 샤페론 Hsp7024와 함께 공동 용리되고, Mg-ATP 세척 단계는 Hsp70 단백질을 제거할 수 있다. 흥미롭게도, 공동-용출된 Hsp70은 곤충 세포 발현 시스템21,22,23으로부터 정제된 FL HTT에서 관찰되지 않는다. 이는 포유동물 및 곤충 세포에서 FL HTT의 과발현에 대한 FL HTT의 PTMs 또는 열 쇼크 단백질 반응의 차이를 반영할 수 있다. 재조합 단백질에서 Hsp70이 제거되면 FL HTT의 단량체 형태를 안정화하기 위해 CHAPS 또는 DDM과 같은 비이온성 세제가 필요합니다.
FL HTT 변이체의 올리고머화 상태는 블루 네이티브 PAGE 및 SEC-MALS를 사용하여 분석하였다. 이량체 및 고차 올리고머 HTT의 작은 부분은 Blue Native PAGE 또는 SEC-MALS로 분석할 때 존재했습니다. 참고로, FL HTT에 의해 형성된 고차 올리고머는 polyQ 길이와 상관관계가 없는 것으로 보이며, Exon1 결실 돌연변이체조차도 유사한 올리고머-이량체-단량체 비율을 나타낸다. 이들 구축물 사이의 올리고머 함량의 실제 변동은 각 배치의 생산 및 취급에서의 사소한 차이 때문일 수 있다. HTT Exon140,41에 의해 형성된 응집체 및 원섬유와는 대조적으로, FL HTT의 고차 올리고머는 용해성을 유지했으며 SEC 및 Native PAGE에 의해 분석될 수 있었다.
정제된 단량체 FL HTT는 단지 비교적 안정하다. 4°C에서 장기간 보관, 실온에서 짧은 배양 또는 1mg/mL > 농도는 이러한 조건에서 눈에 띄는 침전이 관찰되지 않더라도 모두 단량체 FL HTT를 이량체 및 고차 올리고머 형태로 변환합니다. ≤1 mg/mL로 유지된 정제된 단량체 FL HTT는 이전에 기술된 바와 같이 저장 완충액 (50 mM 트리스, pH 8.0, 500 mM NaCl, 5% v/v 글리세롤, 0.5% w/v CHAPS, 및 5 mM DTT) 중에서 -80°C에서 비교적 안정하게 유지되었다24. 이러한 방식으로 제조 및 저장된 FL HTT의 최대 6회의 동결-해동 주기는 SEC-MALS에 의해 더 높은 올리고머 상태로의 약간의 이동이 관찰되었지만 단백질의 가시적인 침전을 일으키지 않았습니다(보충 그림 S2). 샘플은 또한 반복된 동결-해동 주기 후에 SDS PAGE에 의해 분석되었다. 눈에 보이는 침전물은 관찰되지 않았다. SDS-PAGE에서 응집체 또는 추가 분해 생성물이 보이지 않았습니다 (보충 그림 S3). 정제된 FL HTT의 장기 안정성은 아직 조사 중입니다. 결정적인 장기 데이터가 없는 경우 정제된 FL HTT를 -80°C에서 6개월 이상 보관하지 않는 것이 좋습니다.
고품질의 재조합 FL HTT 단백질 변이체와 이를 생산하는 방법은 HD 연구 커뮤니티에서 수요가 높습니다. 이러한 단백질은 면역 분석 및 MS 분석 표준, 구조 연구 및 새로운 FL HTT 특이적 분석의 개발로 사용됩니다. 여기에 설명된 대규모 과도 발현 방법은 >95% 순도의 밀리그램 양의 FL HTT 변이체를 일관되게 생산하여 HTT 연구에 필수적인 도구를 제공합니다. HD 연구를 지원하기 위해 수십 밀리그램의 고도로 정제된 FL HTT polyQ 변이체 및 기타 돌연변이의 생산이 일상화되었습니다.
공개
저자는이 기사의 내용과 이해 상충이 없음을 선언합니다.
감사의 말
HTT의 MS 분석을 수행 한 버팔로에있는 뉴욕 주립 대학의 제약 과학과에 감사드립니다. 이 작업은 CHDI 재단과의 공동 노력이었습니다. 엘리자베스 엠 도허티에게 특별히 감사드립니다. 이그나시오 무 노즈-산후안; 더글라스 맥도날드, CHDI 재단; 그리고 Rory Curtis, Curia, 이 원고를 준비하는 동안 귀중한 의견을 주셨습니다. 우리는 또한이 연구 노력을 지원 한 Michele Luche, Mithra Mahmoudi 및 Stephanie Fox에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
참고문헌
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유