A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام مطياف حركة الأيونات الدورية لتجارب التنقل الأيوني الترادفي
In This Article
Summary
يعد مطياف الحركة الأيونية (IMS) مكملا مثيرا للاهتمام لقياس الطيف الكتلي لتوصيف الجزيئات الحيوية ، لا سيما لأنه حساس للأيزومريا. يصف هذا البروتوكول تجربة IMS (IMS / IMS) جنبا إلى جنب ، والتي تسمح بعزل الجزيء وتوليد ملفات تعريف التنقل لشظاياه.
Abstract
التوصيف الدقيق للهياكل الكيميائية مهم لفهم آلياتها البيولوجية الأساسية وخصائصها الوظيفية. يعد قياس الطيف الكتلي (MS) أداة شائعة ولكنها ليست كافية دائما للكشف تماما عن جميع الميزات الهيكلية. على سبيل المثال ، على الرغم من أن الكربوهيدرات ذات صلة بيولوجية ، إلا أن توصيفها معقد بسبب مستويات عديدة من الأيزومريا. يعد مطياف الحركة الأيونية (IMS) مكملا مثيرا للاهتمام لأنه حساس لتشكيلات الأيونات ، وبالتالي للأيزومرية.
وعلاوة على ذلك، أدت التطورات الأخيرة إلى تحسين هذه التقنية تحسينا كبيرا: فالجيل الأخير من أدوات نظام الرصد الدولي الدوري يوفر قدرات إضافية مقارنة بأدوات نظام الرصد الدولي الخطي، مثل زيادة قدرة الحل أو إمكانية إجراء تجارب التنقل الأيوني جنبا إلى جنب (IMS/IMS). خلال IMS / IMS ، يتم اختيار أيون بناء على حركته الأيونية ، مجزأة ، وإعادة تحليلها للحصول على معلومات حركة الأيونات حول شظاياه. وأظهرت الأعمال التي أجريت مؤخرا أن ملامح التنقل للشظايا الواردة في بيانات نظام الرصد الدولي/نظام الرصد الدولي هذه يمكن أن تكون بمثابة بصمة لجليكان معين ويمكن استخدامها في استراتيجية الشبكات الجزيئية لتنظيم مجموعات بيانات الغليكوميكس بطريقة ذات صلة هيكلية.
وبالتالي فإن الهدف من هذا البروتوكول هو وصف كيفية توليد بيانات IMS/IMS، من إعداد العينات إلى معايرة المقطع العرضي النهائي للتصادم (CCS) لبعد الحركة الأيونية الذي ينتج عنه أطياف قابلة للتكرار. وإذا أخذنا على سبيل المثال جليكان تمثيلي واحد، سيبين هذا البروتوكول كيفية بناء تسلسل تحكم IMS/IMS على أداة نظام إدارة معلومات إدارية دورية، وكيفية حساب تسلسل التحكم هذا لترجمة وقت وصول نظام الرصد الدولي إلى وقت الانجراف (أي وقت الفصل الفعال المطبق على الأيونات)، وكيفية استخراج معلومات التنقل ذات الصلة من البيانات الأولية. تم تصميم هذا البروتوكول لشرح النقاط الحرجة لتجربة IMS / IMS بوضوح ، وبالتالي مساعدة مستخدمي IMS الدوريين الجدد على إجراء عمليات اكتساب مباشرة وقابلة للتكرار.
Introduction
التوصيف الكيميائي الكامل للجزيئات الحيوية هو المفتاح لفهم خصائصها البيولوجية والوظيفية الأساسية. تحقيقا لهذه الغاية ، تطورت علوم "omics" في السنوات الأخيرة ، بهدف توصيف واسع النطاق للهياكل الكيميائية بتركيزات بيولوجية. في علم البروتينات والأيض ، أصبح التصلب العصبي المتعدد أداة أساسية لكشف عدم التجانس الهيكلي الموجود في الوسائط البيولوجية - لا سيما بفضل حساسيته وقدرته على توفير المعلومات الهيكلية من خلال MS (MS / MS). في استراتيجيات MS / MS ، يتم اختيار الأيون وفقا لكتلته ، ثم يتم تجزئته ، وأخيرا ، يتم الحصول على كتل شظاياه لإنشاء بصمة للجزيء. ويمكن استخدام أطياف MS/MS، على وجه الخصوص، لمطابقة قواعد البيانات الطيفية1،2، أو إعادة بناء الهياكل الأصلية مؤقتا3،4. على افتراض أن الأطياف المتشابهة تنتمي إلى مركبات مماثلة ، يمكن أيضا استخدام بيانات MS / MS لبناء شبكات جزيئية (MNs) تربط الأنواع ذات الصلة من خلال درجة التشابه 5,6.
ومع ذلك ، بسبب الخاصية المتأصلة في MS للكشف عن نسبة الكتلة إلى الشحنة (m / z) للأيونات ، فإن التقنية عمياء عن عدد من الميزات الهيكلية التي تقع ضمن نطاق الأيزومرية (الاستريو). على سبيل المثال ، تتكون الكربوهيدرات من عدة وحدات فرعية أحادية السكاريد ، وكثير منها عبارة عن أيزومرات مجسمة أو حتى إبيمرات (على سبيل المثال ، Glc مقابل Gal أو Glc مقابل Man). ترتبط هذه الوحدات الفرعية بروابط جليكوزيدية ، والتي يمكن أن تختلف حسب موضع الارتباط (regioisomerism) والتكوين الستيري للكربون الشاذ (anomerism). هذه الخصائص تجعل من الصعب على التصلب المتعدد المستقل التمييز بين أيزومرات الكربوهيدرات7، ويمكن معالجة الأيزومرية الريجيوميرية فقط باستخدام طرق التنشيط عالية الطاقة8،9،10. وعلى الرغم من أن الاشتقاق هو خيار لتعطيل تكافؤ المجموعات الأيزومرية النمطية11، فإنه يتطلب إعدادا مكثفا للعينات. وثمة خيار آخر أكثر وضوحا هو إقران التصلب المتعدد ببعد تحليلي حساس للأيزومرية، مثل نظام الرصد الدولي.
نظرا لأن هذا البروتوكول مصمم للمستخدمين الذين هم بالفعل على دراية بالمفاهيم الأساسية لنظام IMS ، ولأن المراجعات التفصيلية متوفرة في مكان آخر12,13 ، يتم تقديم نظرة عامة موجزة فقط على مبادئ IMS هنا. IMS هي طريقة فصل الطور الغازي التي تعتمد على تفاعل الأيونات مع غاز عازل ومجال كهربائي ، مما يؤدي في النهاية إلى فصل الأيونات وفقا لتشكيلاتها في الطور الغازي. يمكن العثور على مبادئ مختلفة لنظام الرصد الدولي مقترنة ب MS على الأدوات التجارية: بعضها يعمل في حقول كهربائية عالية ومنخفضة بالتناوب (IMS غير متماثلة المجال ، FAIMS) ، في حين أن معظمها يعمل ضمن حد المجال المنخفض - ولا سيما IMS أنبوب الانجراف (DTIMS ، المجال الكهربائي المتناقص خطيا) ، وموجة السفر IMS (TWIMS ، موجات الجهد المتماثلة) ، و IMS المحاصرة (TIMS ، التدفق العالي لأيونات احتجاز الغاز العازل ضد المجالات الكهربائية)13 . تسمح طرق المجال المنخفض بالوصول إلى ما يسمى CCS ، وهي خاصية لزوج الغاز الأيوني الذي يمثل السطح (في Å2 أو nm2) للأيون الذي يتفاعل مع الغاز العازل أثناء الفصل. ومن الناحية النظرية، فإن احتجاز الكربون وتخزينه مستقل عن الأجهزة، وبالتالي فهو مفيد لتوليد البيانات التي يمكن استنساخها بين المختبرات المختلفة14. يمكن أن تتأثر عمليات فصل الحركة الأيونية بمعلمات مختلفة ، وعلى وجه الخصوص ، بتقلبات ضغط الغاز ودرجة حرارة الغاز في خلية التنقل. وتعد معايرة احتجاز الكربون وتخزينه وسيلة لعلاج ذلك، حيث سيتأثر كل من العيار والأنواع ذات الأهمية بالمثل13. ومع ذلك ، من الضروري تثبيت الجهاز في غرفة يتم التحكم في درجة حرارتها والحصول على نظام موثوق به للتحكم في ضغط الغاز.
تطور مثير للاهتمام من IMS هو IMS / IMS ، الذي تم تقديمه لأول مرة في عام 2006 من قبل مجموعة Clemmer كتناظرية ل MS / MS15,16. وفي نظام الرصد الدولي/نظام الرصد الدولي، يعزل أيون الاهتمام بصورة انتقائية استنادا إلى حركته الأيونية؛ ثم يتم تنشيطه (حتى التجزئة المحتملة) ، ويتم إجراء تحليل IMS جديد للأيون أو الشظايا المنشطة. في التصميم الآلي الأول ، تم وضع خليتين IMS في سلسلة ، مفصولة بواسطة قمع أيون حيث يقف التنشيط. ومنذ ذلك الحين، وعلى الرغم من اقتراح عدد من إعدادات نظام الرصد الدولي/نظام إدارة المعلومات (للاطلاع على الاستعراض، انظر Eldrid و Thalassinos17)، فإن أول مقياس الطيف الكتلي التجاري مع قدرة IMS/IMS لم يصبح متاحا إلا في عام 201918. وقد حسنت هذه الأداة المفهوم الأولي تحسينا كبيرا من خلال دمجها مع طفرة تكنولوجية أخرى: تصميم دوري لخلية IMS.
تسمح خلية IMS الدورية نظريا بزيادة طول مسار الانجراف إلى ما لا نهاية تقريبا ، وبالتالي ، قوة حل الأداة19. وقد تحقق ذلك عن طريق هندسة أداة معينة ، حيث يتم وضع خلية TWIMS الدورية بشكل متعامد على المحور البصري الأيوني الرئيسي. تسمح منطقة الصفيف متعددة الوظائف عند مدخل خلية IMS بالتحكم في اتجاه المسار الأيوني: (i) إرسال الأيونات جانبيا لفصل IMS ، (ii) إلى الأمام للكشف عن MS ، أو (iii) إلى الخلف من خلية IMS ليتم تخزينها في خلية ما قبل الصفيف. ومن خلية التخزين المصفوفة الأولية هذه، يمكن تنشيط الأيونات وإعادة حقن الشظايا في خلية IMS لقياس حركة الأيونات، وهو نهج استخدم بنجاح لتوصيف الأيزومرات المجسمة20. وفي نهاية المطاف، تحتوي البيانات المجمعة على معلومات عن حركة الأيونات ومعلومات m/z عن السلائف وشظاياها.
في منشور حديث استخدم هذا التصميم الدوري لتحليلات الجليكان (Ollivier et al.21) ، أظهرنا أن ملف تعريف التنقل للشظايا الموجودة في بيانات IMS / IMS هذه يعمل كبصمة لجزيء حيوي يمكن استخدامه في استراتيجية الشبكات الجزيئية. وأدت الشبكة الناتجة، المسماة IM-MN، إلى تنظيم مجموعات بيانات الغليكوميكس بطريقة ذات صلة هيكلية، في حين أن الشبكة المبنية فقط من بيانات MS/MS (MS-MN) كشفت عن القليل من المعلومات. لاستكمال هذا المنشور ومساعدة مستخدمي Cyclic IMS على تنفيذ سير العمل هذا ، يوفر هذا البروتوكول وصفا كاملا للبروتوكول المستخدم لجمع البيانات. يركز هذا البروتوكول فقط على توليد بيانات IMS/IMS التي يمكن للمستخدمين استخدامها بعد ذلك لإنشاء شبكات IM-MN (see21) - أو لأي تطبيق آخر من اختيارهم. لن يتم النظر في بناء IM-MN هنا ، حيث أن بروتوكولات الشبكات الجزيئية متاحة بالفعل22. ويسلط الضوء على النقاط الحاسمة التي يجب اتباعها لتوليد عمليات اقتناء قيمة وقابلة للتكرار لنظام الرصد الدولي/نظام الرصد الدولي. مع أخذ مثال أحد السكريات القليلة التي درسها أوليفييه وآخرون. 21 ، الخطوات التالية مفصلة: (i) إعداد العينات ، (ii) ضبط أداة IMS الدورية ، (iii) الانتقاء الآلي للذروة للبيانات ، و (iv) معايرة CCS.
Protocol
ملاحظة: يرد في الشكل 1 لمحة عامة عن البروتوكول. ويمكن الاطلاع على البارامترات المستخدمة في التجارب الموصوفة في هذا البروتوكول في الجدول التكميلي S1 والجدول التكميلي S2.
1. إعداد حل العينة
ملاحظة: يتم وصف البروتوكول باستخدام خماسي السكاريد أرابينوكسيلان (23-α-L-arabinofuranosyl-xylotetraose أو XA2XX ؛ انظر جدول المواد) كمثال.
- تحضير المذيب: 500 ميكرومتر LiCl في 50:50 H2O:MeOH (المجلد / المجلد).
- قم بإعداد محلول مخزون 100 mM من كلوريد الليثيوم (LiCl) في H2O بوزن 212 ملغ من LiCl وإضافة 50 مل من الماء منزوع الأيونات عالي النقاء (H2O) في أنبوب مخروطي من البولي بروبيلين سعة 50 مل. رجه حتى يذوب تماما.
ملاحظة: يتم تخدير المذيب بملح الليثيوم لتعزيز تكوين قنوات [M+Li]+ في المصدر الأيوني لمقياس الطيف، لأنه عادة ما ينتج أطياف تجزئة أفضل جودة مقارنة بالقنوات القلوية الأخرى. يوصى باستخدام LiCl لأن الأحماض العضوية (وبالتالي أملاحها) قد وجد سابقا أنها تؤثر على ملفات تعريف IMS23. - في زجاجة زجاجية ، قم بتخفيف محلول مخزون LiCl 200x: إلى 250 ميكرولتر من محلول المخزون ، أضف 24.75 مل من H2O. أضف 25 مل من الميثانول (MeOH) للوصول إلى تركيز نهائي من LiCl من 500 ميكرومتر في 50:50 H2O: MeOH (v / v). سونيكات لمدة 2 دقيقة لتفريغ المذيب.
ملاحظة: يشكل MeOH خطرا صحيا (H225 و H301 و H311 و H331 و H370) ؛ التلاعب تحت غطاء الاستخراج يرتدي معطف المختبر والقفازات وحماية العين. ويبدو أن نسبة 50:50 MeOH/H2O (v/v) هي أفضل مذيب لتأين السكريات القليلة؛ ومع ذلك ، يمكن استبدال MeOH بالأسيتونيتريل (ACN) إذا لزم الأمر.
- قم بإعداد محلول مخزون 100 mM من كلوريد الليثيوم (LiCl) في H2O بوزن 212 ملغ من LiCl وإضافة 50 مل من الماء منزوع الأيونات عالي النقاء (H2O) في أنبوب مخروطي من البولي بروبيلين سعة 50 مل. رجه حتى يذوب تماما.
- في أنبوب البولي بروبيلين 1.5 مل ، يزن 1 ملغ من الكربوهيدرات. تذوب بحجم مناسب من 500 ميكرومتر LiCl للوصول إلى تركيز 1 ملغ / مل. تمييع إلى تركيز نهائي من 10 ميكروغرام / مل في 50:50 MeOH/H2O + 500 ميكرومتر LiCl. يخزن على درجة حرارة 4 درجات مئوية.
ملاحظة: تم اختيار تركيز 10 ميكروغرام/مل لتحسين الإشارة على جميع أيونات الشظايا خلال IMS/IMS-MS (هذا لمركب نقي؛ زيادة التركيز عند العمل على المخاليط). للحصول على أطياف IMS/IMS المرجعية، لا تخفف العينة أكثر: من المتوقع تشبع كاشف MS قبل التجزئة، على الرغم من أن الأداة توفر خيارات لتصحيحها (انظر الخطوة 3.2).
2. ضبط مطياف الكتلة الدوري IMS
ملاحظة: يتم تمييز الإرشادات المتعلقة بالبرامج (النوافذ والقوائم والأوامر) بخط غامق.
- افتح وحدة التحكم في العدادات من برنامج التحكم في الأجهزة (صفحة MS tune ، راجع تفاصيل البرنامج في جدول المواد)، وضع الجهاز في وضع التشغيل . انتظر لمدة 3 ساعات على الأقل حتى تستقر الفولتية العالية في خلية IMS.
ملاحظة: للحصول على أفضل قابلية للتكرار ، يجب تثبيت الفولتية في خلية IMS تماما. قم بتشغيل الفولتية العالية واترك الأداة تستقر بين عشية وضحاها قبل أي تحليل دوري لنظام IMS. علاوة على ذلك ، يجب الحفاظ على الضغط ودرجة الحرارة في خلية التنقل الأيوني ثابتة قدر الإمكان. على الرغم من توفر إعادة قراءة للضغط في علامة التبويب Vacuum ، إلا أنه لا تتوفر إعادة قراءة لدرجة الحرارة. احتفظ بالأداة في مختبر حراري. تعمل الأداة المستخدمة في هذا العمل عند 1.75 مللي بار في المختبر الحراري عند 20 درجة مئوية. - إعداد أداة IMS الدورية
ملاحظة: يجب غرس الحلول القياسية باستخدام نظام الموائع المدمج لإعداد الجهاز.- ضع حاويات الموائع المملوءة بالمعايير المناسبة التي توفرها الشركة المصنعة على نظام الموائع: الخزان B ("Lockmass"): 10 pg / μL leucine enkephaline (LEU ENK) في 50: 50 ACN / H2O + 0.1٪ من حمض الفورميك ؛ الخزان C ("المعايرة"): MajorMix.
ملاحظة: في هذا البروتوكول، سيتم استخدام حل معايرة MajorMix لمعايرة كل من أبعاد m/z وCCS. ولأسباب عملية، ستجرى معايرة خارجية لاحتجاز الكربون وتخزينه (انظر الخطوة 5 من البروتوكول)؛ وبالتالي ، من الممكن أيضا استخدام خليط عيار داخلي ل CCS ومعايرة أخرى ل m / z (على سبيل المثال ، فورمات الصوديوم أو يوديد الصوديوم). - في صفحة Tune في وحدة تحكم Quartz، انتقل إلى علامة التبويب Fluidics . اضبط سائل العينة على الخزان C والموائع المرجعية على الخزان B. قم ببث كلا المحاللين على التوالي في مصدر الأيونات للتحقق من إشارة MS.
- قم بإجراء إعداد ADC وإعداد الكاشف (باستخدام LEU ENK) ومعايرة الكتلة (راجع جدول المواد للحصول على حل المعايرة) من صفحة إعداد الجهاز وفقا لتعليمات الشركة المصنعة.
- ضع حاويات الموائع المملوءة بالمعايير المناسبة التي توفرها الشركة المصنعة على نظام الموائع: الخزان B ("Lockmass"): 10 pg / μL leucine enkephaline (LEU ENK) في 50: 50 ACN / H2O + 0.1٪ من حمض الفورميك ؛ الخزان C ("المعايرة"): MajorMix.
- سجل اكتساب IMS لحل المعايرة باستخدام فصل تمرير واحد (استخدم هذا لمعايرة IMS الخارجية).
ملاحظة: يجب أن يظل المصدر الأيوني ومعلمات الموجة المتنقلة (TW) (ارتفاع الموجة الثابتة وسرعة الموجة) ثابتين أثناء جميع عمليات الاستحواذ (المعايرة والاستحواذ). إذا لم يكن لدى المستخدم معرفة مسبقة بالمعلمات المثلى لعينته ، فيمكن تنفيذ هذه الخطوة بعد الخطوة 3 من البروتوكول (بالنسبة لقنوات [M + Li] + من السكريات قليلة السكريات المحايدة ، تستخدم النتائج التمثيلية ارتفاع TW 16 V وسرعة TW 350 m / s ، والتي تعطي أفضل النتائج).- من علامة التبويب Fluidics ، حدد موضع الحيرة العينة وغرس المعايرة (انظر جدول المواد) في مصدر الأيونات (باستخدام نظام الموائع المدمج) من خلال مسبار "العينة" بمعدل تدفق 10 ميكرولتر / دقيقة.
- إعداد تسلسل IMS أحادي التمرير. من صفحة الضبط ، ضع الأداة في وضع التنقل ، وافتح نافذة التحكم في التسلسل الدوري . حدد الوضع المتقدم . من علامة التبويب الوظائف الدورية في هذه النافذة الجديدة، حدد إضافة حزمة، ثم تمرير واحد/متعدد التمريرات. انتظر حتى يظهر تسلسل من أحداث التنقل في علامة التبويب تسلسل في النافذة نفسها.
ملاحظة: لتنشيط الشاشة في الوقت الفعلي ، يجب على المستخدم تطبيق معلمات الأداة: انقر فوق Tune في وضع TOF أو Run in Mobility . قبل تبديل الأداة بين وضعي TOF و Mobility ، من الضروري إجهاض أي عملية اكتساب جارية (بما في ذلك عرض صفحة Tune ). قد تختلف الوفرة النسبية للأيونات بين وضع TOF ووضع التنقل بسبب التغيرات في معلمات انتقال الأيونات. - قم بتكييف التسلسل بحيث تقوم جميع أيونات العيار بتمرير واحد حول مضمار سباق IMS الدوري. لا تغير وقت الحقن أو الإخراج واكتساب الوقت ؛ ومع ذلك، خفض الوقت المنفصل إلى 1 مللي ثانية (في علامة التبويب تسلسل ). إذا لم تكن بعض أيونات خليط المعايرة مناسبة في نافذة وقت الوصول المعروضة، فقم بتغيير مزامنة IMS مع دافع محلل TOF للتسارع المتعامد عن طريق زيادة عدد الدفعات لكل سلة في علامة التبويب إعدادات ADC .
ملاحظة: الأوقات في تسلسل التحكم تتحكم فقط في الصفيف متعدد الوظائف لبوابة الأيونات. طالما أن الأيونات منخرطة في تمريرها الأول (أو nth) حول مضمار السباق ، فسوف تنهي التمريرة المذكورة حتى لو تغير اتجاه TW في الصفيف في هذه الأثناء. يعني خفض وقت الفصل إلى 1 مللي ثانية أن الصفيف سيتحول إلى وضع الطرد بعد 1 مللي ثانية. وهذا يضمن أن الأيونات الأسرع لن يكون لديها الوقت الكافي للمرور عبر الصفيف والانخراط في تمريرة ثانية قبل أن تنتهي الأيونات الأبطأ من تمريرتها الأولى. لذلك ، ستخضع جميع الأيونات لنفس العدد من التمريرات (أي تمريرة واحدة) ، وهو أمر ضروري لإجراء معايرة IMS. - سجل عملية استحواذ لمدة 2 دقيقة. في نافذة التحكم في التسلسل الدوري ، انقر فوق اكتساب لفتح النافذة المنبثقة إعدادات الاستحواذ . أدخل اسم الملف والوصف ومدة الاكتساب (دقائق) وانقر فوق حفظ.
- سجل الحصول على حل المعايرة لمدة دقيقتين في ظل نفس ظروف الخطوة 2.3 (استخدم هذا للتحقق من جودة معايرة CCS). في نافذة التحكم في التسلسل الدوري ، انقر فوق اكتساب لفتح النافذة المنبثقة إعدادات الاستحواذ . أدخل اسم الملف والوصف ومدة الاكتساب (دقائق) وانقر فوق حفظ.
- اغسل نظام الموائع جيدا باستخدام 50:50 H2O / ACN لتجنب تبلور المعايرة في أنابيب النظرة الخاطفة.
3. اكتساب IMS / IMS-MS
- باستخدام مضخة حقنة ، قم بغرس العينة (المنشطة بالليثيوم) عند 10 ميكروغرام / مل من خلال مسبار العينة بمعدل تدفق 10 ميكرولتر / دقيقة.
- قم بتبديل الجهاز إلى وضع TOF (من صفحة MS tune ) للتحقق من استقرار الإشارة. تسجيل اكتساب كامل للتصلب المتعدد (1 دقيقة) من العينة، والتي ستكون مفيدة للتحقق من نمط النظائر ووجود الملوثات المحتملة.
ملاحظة: نظرا لاختيار تركيز العينة للحصول على إشارة أيون جيدة للشظايا، يمكن ملاحظة تشبع TOF في هذه الخطوة. يمكن تحديد تشبع TOF باستخدام القطع الأثرية التالية: (i) زيادة مصطنعة في دقة MS ، (ii) تغيير في نسب النظائر ، و (iii) العديد من القمم منخفضة الوفرة بين النظائر. استخدم عدسة DRE (تحسين النطاق الديناميكي، علامة التبويب ملف تعريف رباعي/MS/DRE في صفحة Tune الرئيسية) لتخفيف انتقال الأيونات وتجاهل التشبع في وضع TOF (الشكل 2A,B). - ضع الأداة في وضع MSMS (علامة التبويب ملف تعريف رباعي / MS في صفحة Tune الرئيسية) وحدد كتلة الأيون المستهدف في حقل كتلة MSMS للعزل في رباعي القطب (في المثال: m / z من 685.2 ، المقابلة للأنواع الأيونية [M + Li] + من أرابينوكسيلان خماسي السكاريد). سجل عملية اقتناء مدتها 1 دقيقة للتحقق من عزل السلائف عند معالجة البيانات.
ملاحظة: تحتوي قنوات الليثيوم على نظير عند -1 Da من ذروة النظير الأحادي ، والذي يجب إزالته من نافذة اختيار MS / MS حتى لا يتداخل مع خطوات المعالجة. يمكن إزالته عن طريق تضييق نطاق التحديد باستخدام معلمات دقة LM و HM Resolution في علامة التبويب ملف تعريف Quad / MS (الشكل 2C). - قم بإعداد تسلسل IMS "تقطيع" لإجراء اختيار قائم على التنقل للأيزومر محل الاهتمام.
- قم بتبديل الجهاز إلى وضع التنقل (انظر الخطوة 2.3.2). في نافذة التحكم في التسلسل الدوري ، من علامة التبويب الوظائف الدورية ، حدد إضافة حزمة ثم تقطيع الشرائح. انتظر حتى يظهر تسلسل معقد من أحداث التنقل في علامة التبويب تسلسل (الشكل 3).
ملاحظة: من الممكن تصور كل خطوة من خطوات عملية IMS/IMS: انقر فوق الحدث إخراج واكتساب في علامة التبويب تسلسل. بمجرد تمييزه باللون الأحمر ، انقله إلى الموضع المناسب داخل التسلسل باستخدام الزرين لأعلى ولأسفل. - ضع الحدث إخراج واكتساب مباشرة بعد الحدث المنفصل الأول (أي حركه في الصف 3 بدلا من الصف 8 في التسلسل كما هو موضح في الشكل 3) ثم انقر فوق تشغيل. ابحث عن نتائج الفصل الأولي ليتم عرضها في الوقت الفعلي. قم بزيادة مدة الحدث المنفصل الأول لفصل متعدد المسارات عن طريق تغيير القيمة الزمنية لهذا الحدث في التسلسل حتى يكون حل قمم IMS مرضيا. سجل عملية اقتناء لمدة 1 دقيقة للرجوع إليها.
ملاحظة: لاحظ قيمة تأخير بدء ADC في علامة التبويب إعداد ADC : سيكون من المفيد التحقق من جودة العزل. - انقر على إيقاف مؤقت. لاحظ أنه يتم عرض نتائج الفصل الأولي، على الرغم من أنه لن يتم تطبيق التعديلات في تسلسل عنصر التحكم حتى ينقر المستخدم فوق تشغيل مرة أخرى. ضع حدث الإخراج والاكتساب أسفل الإخراج، وقم بالإخراج إلى التخزين المسبق، واحتفظ بالأحداث وأخرجها. اضبط مدة الأحداث بحيث تكون الذروة المستهدفة في منطقة الإخراج إلى ما قبل التخزين، وأي أيون آخر إما في منطقة الإخراج أو الانتظار والإخراج.
ملاحظة: يمكن تصور مدة هذه الأحداث الثلاثة مقارنة بتوزيعات وقت الوصول (ATDs) باستخدام الشريط المرمز بالألوان أسفل طيف التنقل في علامة التبويب Mobilogram (الشكل 3). - ضع الحدث إخراج واكتساب في نهاية التسلسل، أسفل إعادة الحقن من التخزين المسبق والأحداث المنفصلة الثانية. انقر فوق تشغيل لعرض المجموعة السكانية المحددة.
ملاحظة: نظرا لأن المجموعة المحددة قد غادرت خلية IMS، فقد تم فقدان كل الفصل السابق، وعادت إلى فصل أحادي المرور (وهو أمر مرغوب فيه). - تحقق من جودة العزل. للتحقق من أنه تم تحديد ذروة الاهتمام فقط ، قم بإجراء نفس الفصل بعد إعادة الحقن كما كان قبل إعادة الحقن (أي نفس الوقت المنفصل ) كما هو موضح في الشكل 4. سجل عملية اقتناء لمدة 1 دقيقة للرجوع إليها.
ملاحظة: يتم تشجيع المستخدمين على التحقق من السكان المطرودين. يجب أن تكون النافذة الزمنية "إخراج إلى ما قبل التخزين " هي مستوى خط الأساس (الشكل 4B). للتحقق من ذلك، ضع تأخير بدء ADC في الوضع اليدوي في علامة التبويب إعدادات ADC ، وأدخل وقت التأخير المشار إليه في الخطوة 3.4.2. سجل عملية اقتناء لمدة 1 دقيقة للرجوع إليها. - في علامة التبويب تسلسل ، في العمود المجاور لأوقات الأحداث المعرفة من قبل المستخدم (عمود Time Abs ، المميز باللون الأحمر)، ابحث عن الأوقات المجمعة لجميع الأحداث. لاحظ الوقت الذي تم العثور عليه على خط حدث Reinject from Pre-Store لإجراء معايرة CCS.
- قم بتبديل الجهاز إلى وضع التنقل (انظر الخطوة 2.3.2). في نافذة التحكم في التسلسل الدوري ، من علامة التبويب الوظائف الدورية ، حدد إضافة حزمة ثم تقطيع الشرائح. انتظر حتى يظهر تسلسل معقد من أحداث التنقل في علامة التبويب تسلسل (الشكل 3).
- تجزئة الذروة المستهدفة بين جولتي IMS. تغيير الجهد الكهربي لخطوة إعادة الحقن لزيادة الطاقة الحركية للأيونات ، وتفتيتها عند الاصطدام بغاز الحركة الأيونية.
- قم بتعيين مدة الحدث المنفصل الذي يسبق الإخراج والاكتساب مباشرة إلى 1 مللي ثانية (راجع الشرح في الخطوة 2.3.3).
- في السطر إعادة الحقن من ما قبل التخزين ، حدد المربع تمكين التنشيط ، وقم بتحسين التجزئة باستخدام عنصر التحكم المضمن. إذا كان الطيف مرضيا (على سبيل المثال، تكون الذروة الأساسية جزءا)، فانتقل مباشرة إلى الخطوة 4.5.3.
ملاحظة: عند تمكين التنشيط، ستتحول ثلاثة فولتيات على الخط إلى اللون الرمادي: هذه هي الفولتية التي يحتاج المستخدم إلى تغييرها إذا كان التحسين اليدوي للجهد مطلوبا (انظر الخطوة التالية). تشكل هذه الفولتية الثلاثة (تدرج ما قبل الصفيف ، تحيز ما قبل الصفيف ، وإزاحة الصفيف) التدرج المستخدم لتنشيط الأيونات. ستزداد الطاقة الحركية للأيونات مع الميل بين تحيز ما قبل الصفيف وإزاحة الصفيف (انظر الشكل 5). القيم الافتراضية لقيم إزاحة → التحيز → التدرج هي: بدون تنشيط 85 → 70 → 45 فولت ؛ الحد الأقصى لتنشيط الوظيفة المدمجة 185 → 170 → -5 فولت (+150 فولت). بعد التجزئة ، لا تنس إعادة ضبط إرسال الأيونات باستخدام عدسة DRE (تقليل توهين الإشارة) (انظر الخطوة 3.2). - إذا لم يكن التجزئة مرضيا مع عنصر التحكم المضمن، فقم بإلغاء تحديد المربع تمكين التنشيط والمتابعة لتحسين فولتية إعادة الحقن يدويا. قم بزيادة جهد تدرج ما قبل الصفيف (يجب دائما الاحتفاظ بجهد تحيز ما قبل الصفيف بمقدار 15 فولت أسفل تدرج ما قبل الصفيف) ، وخفض جهد إزاحة الصفيف (الذي يمكن ضبطه على أنه سلبي) حتى تكون النتائج مرضية.
ملاحظة: عند ضبط فولتية الصفيف متعدد الوظائف يدويا، يمكن للمستخدم التبديل من طريقة عرض "Mobilogram" إلى مخططات تفاعلية للجهد المطبق في الصفيف متعدد الوظائف (مخطط PE) لتصور إعدادات الجهد بشكل أفضل (الشكل 5A). - سجل عملية استحواذ لمدة 2 دقيقة. في نافذة الاكتساب المنبثقة، حدد الخيار الاحتفاظ بوقت الانجراف لإنشاء ملف يحتوي فقط على أوقات الوصول مقابل m/z (تتم إزالة وقت الاكتساب المستخدم للتحليلات الكروماتوغرافية - وقت الاحتفاظ - من الملف). لاحظ أن هذا الملف يحمل علامة *_dt. الخام.
ملاحظة: إذا نسي المستخدم التحقق من الخيار الاحتفاظ بوقت الانجراف ، فلا يزال من الممكن استخراج بعد IMS باستخدام برنامج Driftscope 2.9 (ملف | تصدير إلى | ماسلينكس الاحتفاظ بوقت الانجراف).
- أعد تشغيل الجهاز إلى وضع TOF في صفحة Tune الرئيسية ، واشطف النظام جيدا باستخدام 50:50 MeOH / H2O قبل المتابعة مع العينة التالية.
4. معالجة IMS / IMS-MS باستخدام MZmine 224
ملاحظة: يتوفر MZmine 2 من عنوان URL الوارد في جدول المواد. يوصى باستخدام MZmine 2.51. في وقت إعداد هذه المخطوطة، لا يمكن للإصدارات الأحدث فتح ملفات RAW من أدوات IMS الدورية بسبب تغيير في وظيفة الاستيراد.
- استيراد الملف (الملفات) الخام الذي يحتوي فقط على أبعاد IMS وm/z (*_dt. RAW) باستخدام أساليب بيانات Raw | استيراد البيانات الأولية.
ملاحظة: ستظهر الملفات الخام على الجانب الأيسر من نافذة MZmine الرئيسية. لا تقم باستيراد النسخة الأصلية *. ملفات RAW التي لا تزال تحتوي على بعد وقت الاستبقاء. لا يميز MZmine وقت الاحتفاظ بالبيانات عن وقت وصول IMS ، وسوف تتداخل نقاط البيانات لكلا البعدين. - تحسين معلمات سير العمل على ملف تمثيلي عن طريق تحديده في ملفات البيانات الخام قائمة.
- تقييم مستوى الضوضاء في البيانات. انقر بزر الماوس الأيمن فوق الملف في قائمة ملفات البيانات الخام ، وحدد إظهار TIC واعرض الذروة الأساسية "chromatogram" (BPC). انقر نقرا مزدوجا فوق أصغر قمة يمكن ملاحظتها بالعين لعرض طيف كتلتها. ضع في اعتبارك أن مستوى الضوضاء في البيانات يكون حول مستوى النظير الثاني للقمة الأساسية في هذا الطيف ، واستخدم هذه القيمة نفسها لجميع عتبات الكثافة في خطوات المعالجة التالية.
ملاحظة: تم الحصول على البيانات باستخدام عزل رباعي الأضلاع وبالتالي تعتبرها MZmine MS / MS. طوال معالجة MZmine بأكملها ، تأكد من العمل على مستوى MS = 2. - قم بإجراء الكشف الشامل باستخدام أساليب بيانات Raw | | اكتشاف الميزات الكشف الجماعي. بالنسبة للبيانات التي يتم الحصول عليها في وضع ملف التعريف، استخدم خوارزمية تحويل Wavelet . لإعداد معلمات الخوارزميات في MZmine ، انقر فوق الزر [...] بجوار الخوارزمية واستخدم خيار إظهار المعاينة لتصور البيانات أثناء تحسين المعلمات.
ملاحظة: في هذه المرحلة، ستظهر القمم المحددة بواسطة الخوارزمية باللون الأحمر في نافذة المعاينة. عند استخدام خوارزمية تحويل المويجات على ملفات RAW الخاصة ، فإن MZmine في بعض الأحيان يخطئ في نقاط بيانات الملف الشخصي للقمم المركزية. سيعرض البرنامج رسالة تفيد بأن المستخدم يقوم بتشغيل خوارزمية ملف تعريف على أطياف مركزية: تجاهل هذه الرسالة وانقر فوق موافق. - إعادة بناء أطياف التنقل الأيوني المستخرج (EIM) لكل كتلة شظية باستخدام طرق بيانات Raw | | اكتشاف الميزات منشئ ADAP Chromatogram على قائمة كتلة "الجماهير" التي تم إنشاؤها بواسطة الخطوة السابقة. نظرا لأن مدخل التسامح m/z في هذه المرحلة هو تسامح مع المسح الضوئي إلى المسح الضوئي، تأكد من تركه أعلى ب 3-4 مرات على الأقل من الدقة الإجمالية المتوقعة.
- نظرا لأن الخطوة السابقة لا تحتوي على خيار معاينة ، تحقق من جودة اختيار الذروة مباشرة باستخدام قائمة الميزات التي ظهرت على اللوحة اليمنى من نافذة MZmine الرئيسية. افتح قائمة الميزات، وحدد جميع الصفوف، وانقر بزر الماوس الأيمن، وحدد إظهار/XIC (مربع حوار). انقر فوق الكل لعرض كافة الأيونات على طيف التنقل. افحص القمم المختارة التي تظهر بالألوان للتأكد من عدم وجود قمم مفقودة واضحة.
- قم بفك رموز EIM لتقسيم m/z التي تحتوي على قمم مختلفة في ميزات متعددة. استخدم أساليب قائمة الميزات | | اكتشاف الميزات قم بفك الالتفاف اللوني ، واختر خوارزمية Wavelets (ADAP ). قم بتحسين الخوارزمية للبيانات باستخدام خيار إظهار المعاينة والمعلمات الرئيسية التالية: عتبة S/N وعتبة المعامل / المساحة ونطاق المويجات RT.
ملاحظة: يوصى بالتحقق من جانب الطيف غير المعقد. استخدم أداة تصور كروماتوجرام، كما هو موضح في الخطوة 4.2.4. ستظهر القمم غير المعقدة بالألوان ، ويجب تقسيم قمم الكتلة نفسها ، كما هو موضح في الشكل 6A. - إزالة النظائر من EIMs غير المعقدة باستخدام أساليب قائمة الميزات | | النظائر النظير قمم الهامور. استخدم الدقة المتوقعة للأداة لقيمة التسامح m/z ، واضبط تسامح وقت الوصول على 0.1 مللي ثانية (معروضة في MZmine كتسامح وقت الاحتفاظ 0.1 دقيقة)، حيث لا يتم حل النظائر أثناء فصل IMS. تحقق من قائمة الميزات: إذا بقيت أي نظائر ، فقم بزيادة قيم التسامح.
ملاحظة: على الرغم من أنه يمكن نظريا إجراء إزالة النظائر في أي لحظة من معالجة قائمة الميزات، إلا أنه من المهم القيام بذلك بشكل دائم حتى يمكن تصدير قيم الشحنة (ستقوم الخوارزميات المستخدمة في الخطوات الأخرى أحيانا بإزالة معلومات حالة الشحنة).
- تقييم مستوى الضوضاء في البيانات. انقر بزر الماوس الأيمن فوق الملف في قائمة ملفات البيانات الخام ، وحدد إظهار TIC واعرض الذروة الأساسية "chromatogram" (BPC). انقر نقرا مزدوجا فوق أصغر قمة يمكن ملاحظتها بالعين لعرض طيف كتلتها. ضع في اعتبارك أن مستوى الضوضاء في البيانات يكون حول مستوى النظير الثاني للقمة الأساسية في هذا الطيف ، واستخدم هذه القيمة نفسها لجميع عتبات الكثافة في خطوات المعالجة التالية.
- في حالة معالجة أطياف IMS/IMS-MS متعددة، كرر المعالجة باستخدام هذه المعلمات المحسنة. حافظ على نفس المعلمات لجميع الأطياف.
- في حالة تعدد الأطياف ، قم بتجميعها في جدول واحد لتصديرها ؛ إذا لم يكن الأمر كذلك ، فانتقل مباشرة إلى الخطوة 4.5. لتجميع الأطياف، استخدم أساليب قائمة الميزات | | المحاذاة انضم إلى المصفف. نظرا لأن الهدف ليس محاذاة القمم فعليا ، استخدم قيم التسامح التقييدية لكل من m / z ووقت الوصول. أعط نفس الوزن لكلا البعدين.
- تصدير قائمة الميزات النهائية إلى ملف *.csv . استخدم أساليب قائمة الميزات | | التصدير/الاستيراد تصدير إلى ملف CSV وتصدير القيم التالية: تصدير الصف m/z ووقت الاحتفاظ بصف التصدير (وقت وصول IMS الفعلي) وذروة m/z وارتفاع الذروة. استخدم فاصلة كفاصل حقل.
5. TWCCSN2 من أطياف IMS / IMS المركزية
ملاحظة: في هذا البروتوكول ، سيتم استخدام معايرة لوغاريتمية مناسبة 25,26 ، والتي تميل إلى إعطاء نتائج أفضل من المعايرة الخطية وسهلة التنفيذ في جدول بيانات أو برنامج نصي للمعالجة الداخلية. يتوفر برنامج نصي داخلي (مكتوب بحرف R) على عنوان URL الوارد في جدول المواد.
- اختر قيم وقت الوصول المرجعي من اكتساب المعايرة (راجع الخطوة 2.3). قم بذلك يدويا باستخدام برنامج المنشئ (انظر جدول المواد) للتحقق من جانب جميع قمم معايرة IMS.
- في نافذة Chromatogram ، افتح *_dt. ملف RAW المقابل للمعايرة.
- لكل نقطة معايرة، قم بإنشاء EIM باستخدام شاشة العرض | خيار الكتلة .
- تحقق من ملف تعريف EIMs. إذا كان بعضها غير محدد بشكل جيد ، فقم بتنعيمها باستخدام العملية | خيار سلس (حيث يتم الحصول على أفضل النتائج عادة باستخدام خوارزمية Savitzky-Golay ، على نحو سلس 2 مرات على 3 سلال). الإبلاغ عن قيم القمة في جدول بيانات.
ملاحظة: نظرا لأن النقاط المرجعية يتم الحصول عليها بشكل عام باستخدام أجهزة DTIMS منخفضة الاستبانة، فقد تظهر بعض التوزيعات متعددة الوسائط في نظام IMS الدوري اعتمادا على المعاير. قم بإزالة أي ذروة تقدم مثل هذا التوزيع من قائمة المعايرة.
- احسب معلمات الملاءمة اللوغاريتمية من المعاير.
- بالنسبة لجميع نقاط المعايرة، احسب ما يلي.
- حساب وقت الانجراف باستخدام Eq (1):
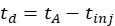 (1)
(1)
مع td وقت الانجراف ، tA وقت الوصول المقاس ، و tinj وقت الحقن في خلية IMS (كل ذلك في مللي ثانية).
ملاحظة: بالنسبة للجزيئات الصغيرة، مثل شظايا السكريات قليلة، يكون التباين في الوقت الميت (وقت الرحلة بين الخروج من خلية IMS والكاشف) بين الكتل المختلفة ضمن نطاق الخطأ في معايرة CCS ويمكن تجاهله. - احسب الكتلة المحايدة للأيونات باستخدام Eq (2):
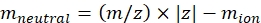 (2)
(2)
مع z حالة شحنة الأيون، وميون كتلة الأيون المضاد (في دا). استخدم الكتل الدقيقة لتجنب إدخال عدم اليقين. إذا كان هناك فقدان ذرة بدلا من أيون مضاد، فاستخدم قيم ميون سالبة (على سبيل المثال، ل [M-H]-mneutral = (m/z) * |z| - (- 1.007276) = (m/z) * |z| + 1.007276). - احسب معلمة CCS باستخدام Eq (3):
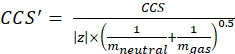 (3)
(3)
مع CCS ، قيمة أنبوب الانجراف المرجعي DTCCSN2 (في nm2) ، و mgas كتلة غاز الانجراف (في Da ؛ على سبيل المثال للنيتروجين: mgas = 28.01 Da). - احسب معلمة td' باستخدام Eq (4):
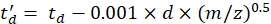 (4)
(4)
مع d تأخير بدء الكاشف المستخدم تجريبيا لتصحيح الوقت الميت (عادة ~ 1.5 مللي ثانية). - حساب لوغاريتم المعلمات المذكورة أعلاه:
ln (CCS') و ln (t'd)
- حساب وقت الانجراف باستخدام Eq (1):
- قم بإجراء انحدار خطي لتحديد معامل R2 ومعلمات x و y للملاءمة اللوغاريتمية (مع x الميل و ln(y) الاعتراض) باستخدام Eq (5):
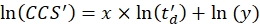 (5)
(5)
ملاحظة: يمكن للمستخدم رسم قيم ln(CCS') مقابل ln (td') للتحقق بصريا من نتائج المعايرة، على الرغم من أن هذا اختياري.
- بالنسبة لجميع نقاط المعايرة، احسب ما يلي.
- قم بتطبيق المعايرة على البيانات التجريبية لمعايرة القمم التي اختارتها MZmine لكل طيف IMS / IMS يتم تصديره إلى ملف *.csv. لكل نقطة، احسب ما يلي.
- حساب وقت الانجراف باستخدام Eq (6):
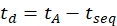 (6)
(6)
مع tseq الوقت السابق لفصل IMS النهائي (القيمة المضافة "Time Abs" المشار إليها في الخطوة 3.4.6).
ملاحظة: في حالة معايرة أطياف IMS/IMS متعددة تم الحصول عليها بتسلسلات مختلفة، فتحقق بعناية من قيم tseq. - احسب الكتلة المحايدة للأيونات باستخدام Eq (7):
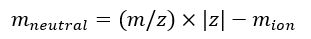 (7)
(7) - احسب معلمات td و td باستخدام Eq (8) و Eq (9):
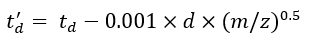 (8)
(8)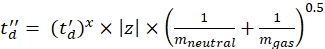 (9)
(9) - حساب قيم CCS النهائية المعايرة (TWCCSN2 بالنانومتر2) باستخدام Eq (10):
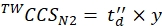 (10)
(10)
ملاحظة: على الرغم من الخطوة 5.2.2. يعطي ln(y) كاعتراض ، y يجب استخدامه للحصول على قيمة CCS النهائية. لا تنس تطبيق دالة أسية.
- حساب وقت الانجراف باستخدام Eq (6):
- تحقق من دقة المعايرة عن طريق تطبيق المعايرة على الاقتناء الثاني لمحلول المعايرة الذي تم الحصول عليه في الخطوة 2.4.
ملاحظة: يجب أن تسفر المعايرة عن نتائج بخطأ ~ 1-2٪.
النتائج
تم اختيار أرابينوكسيلان بنتاساشاريد ، XA2XX ، كمثال لتوضيح هذا البروتوكول. هذا المركب متاح تجاريا ، ولكن فقط كخليط مع أرابينوكسيلان بنتاساشاريد آخر ، XA3XX (XA3XX النقي متاح أيضا تجاريا). وترد هياكل XA2XX وXA3XX في الشكل التكميلي S1. نظرا لأن نسبة XA2XX و XA3XX في ...
Discussion
يعد نظام IMS الدوري من سلسلة SELECT أداة قوية تسمح باختيار مجموعة أيون محددة - من m/z معين وحركة أيون - دون الحاجة إلى الفصل الكروماتوغرافي في المنبع. ويتيح هذا الصك إمكانية إنشاء خريطة تجزئة ثنائية الأبعاد لهذه المجموعة الأيونية، يمكن من خلالها استخراج أطياف MS/MS وIMS/IMS. ومع ذلك ، يجب على المس?...
Disclosures
وليس لدى صاحبي البلاغ أي تضارب في المصالح للإفصاح عنهما.
Acknowledgements
S.O. ممتنة للوكالة الوطنية الفرنسية للبحوث لتمويل درجة الدكتوراه (منحة ANR-18-CE29-0006).
Materials
| Name | Company | Catalog Number | Comments |
| 33-α-L- plus 23-α-L-Arabinofuranosyl-xylotetraose (XA3XX/XA2XX) mixture | Megazyme Ltd., Wicklow, Ireland | O-XAXXMIX | XA2XX + XA3XX mixture |
| 33-α-L-Arabinofuranosyl-xylotetraose (XA3XX) | Megazyme Ltd., Wicklow, Ireland | O-XA3XX | Pure XA3XX standard |
| Eppendorf Safe-Lock Tubes, 1.5 mL, Eppendorf Quality, colorless, 1,000 tubes | Eppendorf, Hamburg, Germany | 0030120086 | Used to prepare the carbohydrate stock solution and dilution |
| FALCON 50 mL Polypropylene Conical Tube 30 x 115 mm | Corning Science México S.A. de C.V., Reynosa, Tamaulipas, Mexico | 352070 | Used to prepare the aqueous stock solution of 100 mM LiCl |
| Lithium Chloride (ACS reagent, ≥99 %) | Sigma-Aldrich Inc., Saint Quentin Fallavier, France | 310468 | Used to dope the sample with lithium |
| Major Mix IMS/Tof Calibration Kit | Waters Corp., Wilmslow, UK | 186008113 | Calibration solution for MS and IMS |
| MassLynx 4.2 SCN1016 Release 6 (Waters Embedded Analyser Platform for Cyclic IMS 2.9.1 Release 9) | Waters Corp., Wilmslow, UK | 721022377 | Cyclic IMS vendor software for instrument control and data processing |
| Methanol for HPLC PLUS Gradient grade | Carlo-Erba Reagents, Val de Reuil, France | 412383 | High-purity solvent |
| MS Leucine Enkephaline Kit | Waters Corp., Wilmslow, UK | 700002456 | Reference compound used for tuning of the mass spectrometer |
| SCHOTT DURAN 100 mL borosilicate glass bottle | VWR INTERNATIONAL, Radnor, Pennsylvania, US | 218012458 | Used to prepare the solution of 500 µM LiCl in 50:50 MeOH/Water |
| SELECT SERIES Cyclic IMS | Waters Corp., Wilmslow, UK | 186009432 | Ion mobility-mass spectrometer equipped with a cylic IMS cell |
| Website: http://mzmine.github.io/ | MZmine Development Team | - | Link to download the MZmine software |
| Website: https://github.com/siollivier/IM-MN | INRAE, UR BIA, BIBS Facility, Nantes, France | - | Link to an in-house R script containing a CCS calibration function |
References
- Allard, P. -. M., et al. Integration of molecular networking and in-silico MS/MS fragmentation for natural products dereplication. Analytical Chemistry. 88 (6), 3317-3323 (2016).
- Wang, M., et al. Mass spectrometry searches using MASST. Nature Biotechnology. 38 (1), 23-26 (2020).
- David, M., Fertin, G., Rogniaux, H., Tessier, D. SpecOMS: a full open modification search method performing all-to-all spectra comparisons within minutes. Journal of Proteome Research. 16 (8), 3030-3038 (2017).
- Dührkop, K., et al. SIRIUS 4: a rapid tool for turning tandem mass spectra into metabolite structure information. Nature Methods. 16 (4), 299-302 (2019).
- Wang, M., et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nature Biotechnology. 34 (8), 828-837 (2016).
- Nothias, L. -. F., et al. Feature-based molecular networking in the GNPS analysis environment. Nature Methods. 17 (9), 905-908 (2020).
- Gray, C. J., et al. Advancing solutions to the Carbohydrate Sequencing Challenge. Journal of the American Chemical Society. 141 (37), 14463-14479 (2019).
- Ropartz, D., et al. Online coupling of high-resolution chromatography with extreme UV photon activation tandem mass spectrometry: Application to the structural investigation of complex glycans by dissociative photoionization. Analytica Chimica Acta. 933, 1-9 (2016).
- Wolff, J. J., et al. Negative electron transfer dissociation of glycosaminoglycans. Analytical Chemistry. 82 (9), 3460-3466 (2010).
- Ropartz, D., et al. Charge transfer dissociation of complex oligosaccharides: comparison with collision-induced dissociation and extreme ultraviolet dissociative photoionization. Journal of the American Society for Mass Spectrometry. 27 (10), 1614-1619 (2016).
- Morelle, W., et al. Fragmentation characteristics of permethylated oligosaccharides using a matrix-assisted laser desorption/ionization two-stage time-of-flight (TOF/TOF) tandem mass spectrometer. Rapid Communications in Mass Spectrometry. 18 (22), 2637-2649 (2004).
- Gabelica, V., Marklund, E. Fundamentals of ion mobility spectrometry. Current Opinion in Chemical Biology. 42, 51-59 (2018).
- Gabelica, V., et al. Recommendations for reporting ion mobility mass spectrometry measurements. Mass Spectrometry Reviews. 38 (3), 291-320 (2019).
- Hernandez-Mesa, M., et al. Interlaboratory and interplatform study of steroids collision cross section by traveling wave ion mobility spectrometry. Analytical Chemistry. 92 (7), 5013-5022 (2020).
- Koeniger, S. L., et al. An IMS-IMS analogue of MS-MS. Analytical Chemistry. 78 (12), 4161-4174 (2006).
- Merenbloom, S. I., Koeniger, S. L., Valentine, S. J., Plasencia, M. D., Clemmer, D. E. IMS−IMS and IMS−IMS−IMS/MS for separating peptide and protein fragment ions. Analytical Chemistry. 78 (8), 2802-2809 (2006).
- Eldrid, C., Thalassinos, K. Developments in tandem ion mobility mass spectrometry. Biochemical Society Transactions. 48 (6), 2457-2466 (2020).
- Giles, K., et al. A cyclic ion mobility-mass spectrometry system. Analytical Chemistry. 91 (13), 8564-8573 (2019).
- Merenbloom, S. I., Glaskin, R. S., Henson, Z. B., Clemmer, D. E. High-resolution ion cyclotron mobility spectrometry. Analytical Chemistry. 81 (4), 1482-1487 (2009).
- Ollivier, S., et al. Anomeric retention of carbohydrates in multistage cyclic ion mobility (IMSn): de novo structural elucidation of enzymatically produced mannosides. Analytical Chemistry. 93 (15), 6254-6261 (2021).
- Ollivier, S., Fanuel, M., Rogniaux, H., Ropartz, D. Molecular networking of high-resolution tandem ion mobility spectra: a structurally relevant way of organizing data in glycomics. Analytical Chemistry. 93 (31), 10871-10878 (2021).
- Aron, A. T., et al. Reproducible molecular networking of untargeted mass spectrometry data using GNPS. Nature Protocols. 15 (6), 1954-1991 (2020).
- McKenna, K. R., Li, L., Krishnamurthy, R., Liotta, C. L., Fernández, F. M. Organic acid shift reagents for the discrimination of carbohydrate isobars by ion mobility-mass spectrometry. The Analyst. 145 (24), 8008-8015 (2021).
- Pluskal, T., Castillo, S., Villar-Briones, A., Orešič, M. MZmine 2: Modular framework for processing, visualizing, and analyzing mass spectrometry-based molecular profile data. BMC Bioinformatics. 11, 395 (2010).
- Ruotolo, B. T., Benesch, J. L. P., Sandercock, A. M., Hyung, S. -. J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Bush, M. F., Hall, Z., Giles, K., Hoyes, J., Robinson, C. V., Ruotolo, B. T. Collision cross sections of proteins and their complexes: a calibration framework and database for gas-phase structural biology. Analytical Chemistry. 82 (22), 9557-9565 (2010).
- Ropartz, D., et al. Structure determination of large isomeric oligosaccharides of natural origin through multipass and multistage cyclic traveling-wave ion mobility mass spectrometry. Analytical Chemistry. 91 (18), 12030-12037 (2019).
- Tolmachev, A. V., et al. Characterization of ion dynamics in structures for lossless ion manipulations. Analytical Chemistry. 86 (18), 9162-9168 (2014).
- Arndt, J. R., et al. High-resolution ion-mobility-enabled peptide mapping for high-throughput critical quality attribute monitoring. Journal of the American Society for Mass Spectrometry. 32 (8), 2019-2032 (2021).
- Le Fèvre, A., Dugourd, P., Chirot, F. Exploring conformational landscapes using trap and release tandem ion mobility spectrometry. Analytical Chemistry. 93 (9), 4183-4190 (2021).
- Ohshimo, K., He, X., Ito, R., Misaizu, F. Conformer separation of dibenzo-crown-ether complexes with Na+ and K+ ions studied by cryogenic ion mobility-mass spectrometry. The Journal of Physical Chemistry A. 125 (17), 3718-3725 (2021).
- Purves, R. W., Barnett, D. A., Ells, B., Guevremont, R. Gas-phase conformers of the [M + 2H]2+ ion of bradykinin investigated by combining high-field asymmetric waveform ion mobility spectrometry, hydrogen/deuterium exchange, and energy-loss measurements. Rapid Communications in Mass Spectrometry. 15 (16), 1453-1456 (2001).
- Ujma, J., et al. Cyclic ion mobility mass spectrometry distinguishes anomers and open-ring forms of pentasaccharides. Journal of the American Society for Mass Spectrometry. 30 (6), 1028-1037 (2019).
- Warnke, S., Faleh, A. B., Scutelnic, V., Rizzo, T. R. Separation and identification of glycan anomers using ultrahigh-resolution ion-mobility spectrometry and cryogenic ion spectroscopy. Journal of The American Society for Mass Spectrometry. 30 (11), 2204-2211 (2019).
- Williamson, D. L., Bergman, A. E., Nagy, G. Investigating the structure of α/β carbohydrate linkage isomers as a function of group I metal adduction and degree of polymerization as revealed by cyclic ion mobility separations. Journal of the American Society for Mass Spectrometry. 32 (10), 2573-2582 (2021).
- Myers, O. D., Sumner, S. J., Li, S., Barnes, S., Du, X. One step forward for reducing false positive and false negative compound identifications from mass spectrometry metabolomics data: new algorithms for constructing extracted ion chromatograms and detecting chromatographic peaks. Analytical Chemistry. 89 (17), 8696-8703 (2017).
- Marchand, A., Livet, S., Rosu, F., Gabelica, V. Drift tube ion mobility: how to reconstruct collision cross section distributions from arrival time distributions. Analytical Chemistry. 89 (23), 12674-12681 (2017).
- Davis, D. M., et al. Analysis of ion mobility spectra for mixed vapors using Gaussian deconvolution. Analytica Chimica Acta. 289 (3), 263-272 (1994).
- Polasky, D. A., Dixit, S. M., Fantin, S. M., Ruotolo, B. T. CIUSuite 2: next-generation software for the analysis of gas-phase protein unfolding data. Analytical Chemistry. 91 (4), 3147-3155 (2019).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Gelb, A. S., Jarratt, R. E., Huang, Y., Dodds, E. D. A study of calibrant selection in measurement of carbohydrate and peptide ion-neutral collision cross sections by traveling wave ion mobility spectrometry. Analytical Chemistry. 86 (22), 11396-11402 (2014).
- Richardson, K., Langridge, D., Dixit, S. M., Ruotolo, B. T. An improved calibration approach for traveling wave ion mobility spectrometry: robust, high-precision collision cross sections. Analytical Chemistry. 93 (7), 3542-3550 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved