Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tandem İyon Hareketlilik Deneyleri için Döngüsel İyon Hareketlilik Spektrometresi Kullanma
Bu Makalede
Özet
İyon hareketlilik spektrometresi (IMS), biyomoleküllerin karakterizasyonu için kütle spektrometrisinin ilginç bir tamamlayıcısıdır, özellikle izomerizme duyarlı olduğu için. Bu protokol, bir molekülün izolasyonuna ve parçalarının hareketlilik profillerinin oluşturulmasına izin veren bir tandem IMS (IMS / IMS) deneyini tanımlar.
Özet
Kimyasal yapıların doğru karakterizasyonu, altta yatan biyolojik mekanizmaları ve fonksiyonel özelliklerini anlamak için önemlidir. Kütle spektrometresi (MS) popüler bir araçtır, ancak tüm yapısal özellikleri tamamen ortaya çıkarmak için her zaman yeterli değildir. Örneğin, karbonhidratlar biyolojik olarak alakalı olmasına rağmen, karakterizasyonları sayısız izomerizm seviyesi ile karmaşıktır. İyon hareketlilik spektrometresi (IMS) ilginç bir tamamlayıcıdır çünkü iyon konformasyonlarına ve dolayısıyla izomerizme duyarlıdır.
Ayrıca, son gelişmeler tekniği önemli ölçüde geliştirmiştir: son nesil Döngüsel IMS cihazları, doğrusal IMS cihazlarına kıyasla, artan çözme gücü veya tandem iyon hareketliliği (IMS / IMS) deneyleri gerçekleştirme olasılığı gibi ek yetenekler sunmaktadır. IMS / IMS sırasında, bir iyon iyon hareketliliğine göre seçilir, parçalanır ve parçaları hakkında iyon hareketliliği bilgisi elde etmek için yeniden analiz edilir. Son zamanlarda yapılan çalışmalar, bu tür IMS / IMS verilerinde bulunan parçaların hareketlilik profillerinin, belirli bir glikanın parmak izi olarak hareket edebileceğini ve glikomik veri kümelerini yapısal olarak ilgili bir şekilde düzenlemek için moleküler bir ağ stratejisinde kullanılabileceğini göstermiştir.
Bu protokolün amacı, numune hazırlamadan, tekrarlanabilir spektrumlar veren iyon hareketlilik boyutunun son Çarpışma Kesiti (CCS) kalibrasyonuna kadar IMS / IMS verilerinin nasıl üretileceğini tanımlamaktır. Bir temsili glikan örneğini alarak, bu protokol bir Döngüsel IMS cihazı üzerinde bir IMS / IMS kontrol dizisinin nasıl oluşturulacağını, IMS varış zamanını sürüklenme zamanına (yani, iyonlara uygulanan etkili ayırma süresi) çevirmek için bu kontrol dizisinin nasıl hesaplanacağını ve ham verilerden ilgili hareketlilik bilgilerinin nasıl çıkarılacağını gösterecektir. Bu protokol, bir IMS/IMS deneyinin kritik noktalarını açıkça açıklamak ve böylece yeni Döngüsel IMS kullanıcılarının basit ve tekrarlanabilir alımlar gerçekleştirmesine yardımcı olmak için tasarlanmıştır.
Giriş
Biyomoleküllerin tam kimyasal karakterizasyonu, altta yatan biyolojik ve fonksiyonel özelliklerini anlamanın anahtarıdır. Bu amaçla, son yıllarda kimyasal yapıların biyolojik konsantrasyonlarda büyük ölçekli karakterizasyonunu amaçlayan "omik" bilimleri gelişmiştir. Proteomik ve metabolomikte MS, biyolojik ortamda bulunan yapısal heterojenliği çözmek için temel bir araç haline gelmiştir - özellikle duyarlılığı ve tandem MS (MS / MS) yoluyla yapısal bilgi sağlama yeteneği sayesinde. MS / MS stratejilerinde, bir iyon kütlesine göre seçilir, daha sonra parçalanır ve son olarak, molekülün parmak izini oluşturmak için parçalarının kütleleri elde edilir. MS/MS spektrumları, özellikle, spektral veritabanlarını1,2 eşleştirmek veya üst yapıları geçici olarak yeniden yapılandırmak için kullanılabilir3,4. Benzer spektrumların benzer bileşiklere ait olduğu varsayımı altında, MS / MS verileri, ilgili türleri benzerlik skoru ile birbirine bağlayan moleküler ağlar (MN'ler) oluşturmak için de kullanılabilir5,6.
Bununla birlikte, MS'in iyonların kütle-yük oranını (m / z) tespit etme konusundaki doğal özelliği nedeniyle, teknik (stereo) izomerizm aralığına giren bir dizi yapısal özelliğe kördür. Örneğin, karbonhidratlar, çoğu stereoizomerler veya hatta epimerler olan birkaç monosakkarit alt biriminden oluşur (örneğin, Glc vs Gal veya Glc vs Man). Bu alt birimler, bağlantının konumuna (regioizomerizm) ve anomerik karbonun sterik konfigürasyonuna (anomerizm) göre farklılık gösterebilen glikosidik bağlarla bağlanır. Bu özellikler, bağımsız MS'in karbonhidrat izomerleri arasında ayrım yapmasını zorlaştırır7 ve yüksek enerjili aktivasyon yöntemleri kullanılarak yalnızca regioizomerizm ele alınabilir8,9,10. Derevcilleştirme, stereoizomerik grupların eşdeğerliğini bozmak için bir seçenek olsa da11, kapsamlı numune hazırlama gerektirir. Bir başka, daha basit seçenek, MS'i IMS gibi izomerizme duyarlı analitik bir boyutla birleştirmektir.
Bu protokol, IMS'nin temel kavramlarına zaten aşina olan kullanıcılar için tasarlandığından ve ayrıntılı incelemeler başka bir yerde mevcut olduğundan12,13, IMS ilkelerine yalnızca kısa bir genel bakış burada verilmiştir. IMS, iyonların bir tampon gaz ve bir elektrik alanı ile etkileşimine dayanan ve sonuçta iyonları gaz fazı konformasyonlarına göre ayıran bir gaz fazı ayırma yöntemidir. Ticari aletlerde MS'e bağlı farklı IMS prensipleri bulunabilir: bazıları alternatif yüksek ve düşük elektrik alanlarında (alan asimetrik IMS, FAIMS) çalışırken, çoğu düşük alan sınırı içinde çalışır - özellikle sürüklenme tüpü IMS (DTIMS, doğrusal olarak azalan elektrik alanı), hareketli dalga IMS (TWIMS, simetrik potansiyel dalgalar) ve sıkışmış IMS (TIMS, elektrik alanlarına karşı tampon gazı yakalama iyonlarının yüksek akışı)13 . Düşük alan yöntemleri, ayırma sırasında tampon gazı ile etkileşime giren iyonun yüzeyini (Å2 veya nm2 cinsinden) temsil eden iyon-gaz çiftinin bir özelliği olan CCS'ye erişime izin verir. CCS teorik olarak cihazdan bağımsızdır ve bu nedenle farklı laboratuvarlar arasında çoğaltılabilecek veriler üretmek için yararlıdır14. İyon hareketliliği ayırmaları, çeşitli parametrelerden ve özellikle hareketlilik hücresindeki gaz basıncı ve gaz sıcaklığındaki dalgalanmalardan etkilenebilir. CCS kalibrasyonu bunu düzeltmenin bir yoludur, çünkü hem kalibrant hem de ilgili türler benzer şekilde etkilenecektir13. Bununla birlikte, cihazın sıcaklık kontrollü bir odaya monte edilmesi ve güvenilir bir gaz basıncı kontrol sistemine sahip olması zorunludur.
IMS'nin ilginç bir evrimi, ilk olarak 2006 yılında Clemmer'in grubu tarafından MS / MS15,16'nın bir analoğu olarak tanıtılan IMS / IMS'dir. IMS / IMS'de, ilgilenilen bir iyon, iyon hareketliliğine bağlı olarak seçici olarak izole edilir; daha sonra aktive edilir (olası parçalanmaya kadar) ve aktive edilen iyonun veya parçaların yeni bir IMS analizi gerçekleştirilir. İlk enstrümantal tasarımda, aktivasyonun durduğu bir iyon hunisi ile ayrılan iki IMS hücresi seri olarak yerleştirildi. O zamandan beri, bir dizi IMS / IMS kurulumu önerilmiş olsa da (bir inceleme için Eldrid ve Thalassinos17'ye bakınız), IMS / IMS özelliğine sahip ilk ticari kütle spektrometresi yalnızca 201918'de kullanıma sunuldu. Bu cihaz, ilk konsepti başka bir teknolojik atılımla birleştirerek önemli ölçüde geliştirdi: IMS hücresinin döngüsel tasarımı.
Döngüsel IMS hücresi teorik olarak sürüklenme yolu uzunluğunun ve dolayısıyla cihazın çözme gücünün neredeyse sonsuz olarak artmasına izin verir19. Bu, döngüsel TWIMS hücresinin ana iyon optik eksenine ortogonal olarak yerleştirildiği belirli bir alet geometrisi ile elde edildi. IMS hücresinin girişindeki çok işlevli bir dizi bölgesi, iyon yolunun yönünü kontrol etmeyi sağlar: (i) iyonları IMS ayrımı için yana doğru göndermek, (ii) MS algılaması için ileri veya (iii) IMS hücresinden geriye doğru bir dizi öncesi hücrede saklanmak. Bu ön dizi depo hücresinden, iyonlar aktive edilebilir ve fragmanlar, stereoizomerleri20 karakterize etmek için başarıyla kullanılan bir yaklaşım olan iyon hareketliliği ölçümü için IMS hücresine yeniden enjekte edilebilir. Nihayetinde, toplanan veriler öncü ve parçaları için iyon hareketliliği ve m / z bilgilerini içerir.
Bu döngüsel tasarımı glikan analizleri için kullanan yakın tarihli bir yayında (Ollivier ve ark.21), bu tür IMS / IMS verilerinde bulunan parçaların hareketlilik profilinin, moleküler bir ağ stratejisinde kullanılabilecek bir biyomolekülün parmak izi gibi davrandığını gösterdik. IM-MN adı verilen ortaya çıkan ağ, glikomik veri kümelerinin yapısal olarak ilgili bir şekilde düzenlenmesine yol açarken, yalnızca MS / MS verilerinden (MS-MN) oluşturulan ağ çok az bilgi ortaya çıkardı. Bu yayını tamamlamak ve Döngüsel IMS kullanıcılarının bu iş akışını uygulamasına yardımcı olmak için bu protokol, verileri toplamak için kullanılan protokolün tam bir açıklamasını sağlar. Bu protokol yalnızca kullanıcıların IM-MN ağları oluşturmak için kullanabilecekleri IMS/IMS verilerinin oluşturulmasına odaklanır (bkz. 21) veya seçtikleri başka bir uygulama için. IM-MN'nin oluşturulması burada dikkate alınmayacaktır, çünkü moleküler ağ protokolleri zaten mevcuttur22. Değerli ve tekrarlanabilir IMS/IMS satın alımları oluşturmak için uyulması gereken önemli noktalar vurgulanmaktadır. Ollivier ve ark. tarafından incelenen oligosakkaritlerden birinin örneğini ele alalım. 21, aşağıdaki adımlar detaylandırılmıştır: (i) numune hazırlama, (ii) Döngüsel IMS cihazının ayarı, (iii) verilerin otomatik pik toplama ve (iv) CCS kalibrasyonu.
Protokol
NOT: Protokole genel bir bakış Şekil 1'de verilmiştir. Bu protokolde açıklanan deneyler için kullanılan parametreler Ek Tablo S1 ve Ek Tablo S2'de bulunabilir.
1. Numune çözeltisinin hazırlanması
NOT: Protokol, örnek olarak bir arabinoksilan pentasakkarit (23-α-L-arabinofuranosil-ksilotetraoz veya XA2XX; Malzeme Tablosuna bakınız) kullanılarak tanımlanmıştır.
- Çözücünün hazırlanması: 50:50 H2O:MeOH'da 500 μM LiCl (cilt/hacim.).
- 212 mg LiCl ağırlığında H2O'da 100 mM'lik bir lityum klorür (LiCl) stok çözeltisi hazırlayın ve 50 mL'lik bir polipropilen konik tüpe 50 mL yüksek saflıkta deiyonize su (H2O) ekleyin. Tamamen eriyene kadar çalkalayın.
NOT: Çözücü, spektrometrenin iyon kaynağında [M + Li] + addüktörlerinin oluşumunu teşvik etmek için bir lityum tuzu ile katkılıdır, çünkü genellikle diğer alkali addüktörlere kıyasla daha kaliteli parçalanma spektrumları verir. LiCl kullanımı tavsiye edilir, çünkü organik asitlerin (ve dolayısıyla tuzlarının) daha önce IMS profillerini etkilediği bulunmuştur23. - Bir cam şişede, LiCl stok çözeltisini 200x seyreltin: stok çözeltisinin 250 μL'sine kadar, 24.75 mL H2O ekleyin. 50:50 H2O: MeOH (v / v) içinde 500 μM'lik son LiCl konsantrasyonuna ulaşmak için 25 mL metanol (MeOH) ekleyin. Çözücüyü gazdan arındırmak için 2 dakika boyunca sonikat.
NOT: MeOH sağlık açısından tehlike arz eder (H225, H301, H311, H331, H370); laboratuvar önlüğü, eldiven ve göz koruması giyen bir çıkarıcı başlığın altında manipüle edin. 50:50 MeOH / H2O (v / v) oranı, oligosakaritlerin iyonlaşması için en iyi çözücü gibi görünmektedir; Bununla birlikte, MeOH gerekirse asetonitril (ACN) ile değiştirilebilir.
- 212 mg LiCl ağırlığında H2O'da 100 mM'lik bir lityum klorür (LiCl) stok çözeltisi hazırlayın ve 50 mL'lik bir polipropilen konik tüpe 50 mL yüksek saflıkta deiyonize su (H2O) ekleyin. Tamamen eriyene kadar çalkalayın.
- 1.5 mL'lik bir polipropilen tüpte, 1 mg karbonhidrat ağırlığındadır. 1 mg / mL'lik bir konsantrasyona ulaşmak için uygun bir hacim olan 500 μM LiCl ile çözün. 50:50 MeOH/H2O + 500 μM LiCl'de 10 μg/mL'lik son konsantrasyona kadar seyreltin. 4 °C'de saklayın.
NOT: 10 μg/mL konsantrasyonu, IMS/IMS-MS sırasında tüm fragman iyonları üzerindeki sinyali optimize etmek için seçilmiştir (bu saf bir bileşik içindir; karışımlar üzerinde çalışırken konsantrasyonu arttırın). Referans IMS/IMS spektrumlarının elde edilmesi için numuneyi daha fazla seyreltmeyin: Cihaz düzeltmek için seçenekler sunsa da, parçalanmadan önce MS dedektörünün doygunluğu beklenmektedir (bkz. adım 3.2.).
2. Döngüsel IMS kütle spektrometresinin ayarlanması
NOT: Yazılımla ilgili talimatlar (pencereler, menüler ve komutlar) kalın harflerle vurgulanır.
- Cihaz kontrol yazılımından enstrüman konsolunu açın (MS tune sayfası, Malzeme Tablosundaki yazılım ayrıntılarına bakın) ve cihazı Çalıştırma moduna getirin. IMS hücresinde yüksek voltajların dengelenmesi için en az 3 saat bekleyin.
NOT: En iyi tekrarlanabilirlik için, IMS hücresindeki voltajların tamamen stabilize edilmesi gerekir. Yüksek voltajları açın ve herhangi bir döngüsel IMS analizinden önce cihazın gece boyunca dengelenmesine izin verin. Ayrıca, iyon hareketlilik hücresindeki basınç ve sıcaklık mümkün olduğunca sabit tutulmalıdır. Vakum sekmesinde basınç için bir geri okuma bulunsa da, sıcaklık için geri okuma yoktur. Cihazı termostatif bir laboratuvarda saklayın. Bu çalışmada kullanılan cihaz, 20 ° C'de termostatize edilmiş bir laboratuvarda 1.75 mbar'da çalışır. - Döngüsel IMS cihazı kurulumu
NOT: Standart çözümler, cihaz kurulumu için dahili akışkan sistemi kullanılarak aşılanmalıdır.- Üretici tarafından sağlanan uygun standartlarla doldurulmuş akışkan kapları akışkan sistemine yerleştirin: Rezervuar B ('Kilit kütlesi'): 10 pg/μL lösin enkephaline (LEU ENK) 50:50 ACN/H2O + %0,1 formik asit içinde; C Rezervuarı ('Calibrant'): MajorMix.
NOT: Bu protokolde, hem m/z hem de CCS boyutlarını kalibre etmek için MajorMix kalibrasyon çözeltisi kullanılacaktır. Pratik nedenlerden dolayı, harici bir CCS kalibrasyonu gerçekleştirilecektir (protokolün 5. adımına bakınız); Bu nedenle, CCS için şirket içi bir kalibrant karışımı ve m / z için başka bir kalibrant (örneğin, sodyum format veya sodyum iyodür) kullanmak da mümkündür. - Kuvars konsolunun Ayar sayfasında, Fluidics sekmesine gidin. Numune akışkanlarını C rezervuarına ve referans akışkanlarını B rezervuarına ayarlayın. MS sinyalini kontrol etmek için her iki çözeltiyi de iyon kaynağında art arda infüze edin.
- ADC kurulumunu, dedektör kurulumunu (LEU ENK kullanarak) ve kütle kalibrasyonunu (kalibrasyon çözeltisi için Malzeme Tablosuna bakın) üreticinin talimatlarına göre Cihaz Kurulumu sayfasından gerçekleştirin.
- Üretici tarafından sağlanan uygun standartlarla doldurulmuş akışkan kapları akışkan sistemine yerleştirin: Rezervuar B ('Kilit kütlesi'): 10 pg/μL lösin enkephaline (LEU ENK) 50:50 ACN/H2O + %0,1 formik asit içinde; C Rezervuarı ('Calibrant'): MajorMix.
- Tek geçişli ayırma ile kalibrasyon çözeltisinin IMS alımını kaydedin (harici IMS kalibrasyonu için bunu kullanın).
NOT: İyon kaynağı ve hareketli dalga (TW) parametreleri (statik dalga yüksekliği ve dalga hızı) tüm kazanımlar (kalibrasyon ve edinimler) sırasında sabit tutulmalıdır. Kullanıcının numunesi için en uygun parametreler hakkında önceden bilgisi yoksa, bu adım protokolün 3. adımından sonra gerçekleştirilebilir ([M + Li] + nötr oligosakkaritlerin katkıları için, temsili sonuçlar 16 V'luk bir TW yüksekliği ve en iyi sonuçları veren 350 m / s'lik bir TW hızı kullanır).- Akışkanlar sekmesinden, saptırma konumu Numune'yi seçin ve kalibrantı (dahili akışkanlar sistemini kullanarak) iyon kaynağında (dahili akışkanlar sistemini kullanarak) 10 μL/dak akış hızında 'Numune' probu aracılığıyla infüze edin.
- Tek geçişli bir IMS dizisi ayarlayın. Ayar sayfasından, aleti Mobilite moduna getirin ve Döngüsel Sıra Denetimi penceresini açın. Gelişmiş mod'u seçin. Bu yeni pencerenin Döngüsel İşlevler sekmesinden Paket Ekle'yi ve ardından Tekli/Çok Geçişli'yi seçin. Aynı pencerenin Sıra sekmesinde bir dizi mobilite olayının görünmesini bekleyin.
NOT: Gerçek zamanlı ekranı etkinleştirmek için kullanıcının cihaz parametrelerini uygulaması gerekir: TOF modunda ayarla veya Mobilite modunda çalıştır'a tıklayın. Cihazı TOF ve Mobilite modları arasında değiştirmeden önce, çalışan herhangi bir alımı (Ayar sayfası ekranı dahil) iptal etmek gerekir. İyonların göreceli bolluğu, iyon iletim parametrelerindeki değişiklikler nedeniyle TOF modu ve Mobilite modu arasında değişebilir. - Sekansı, tüm kalibrant iyonlarının döngüsel IMS yarış pistinin etrafında tek bir geçiş yapması için uyarlayın. Enjekte etme süresini veya Çıkarma ve zaman kazanma süresini değiştirmeyin; ancak, Ayrı süreyi 1 ms'ye düşürün (Sıra sekmesinde). Kalibrasyon karışımının bazı iyonları görüntülenen varış zamanı penceresine sığmazsa, ADC Ayarları sekmesindeki Kutu Başına İtme sayısını artırarak IMS'nin ortogonal ivmeli TOF analizörünün iticisiyle senkronizasyonunu değiştirin.
NOT: Kontrol dizisindeki süreler yalnızca iyon geçidi için çok işlevli diziyi kontrol eder. İyonlar, yarış pistinin etrafındaki ilk (veya n'inci) geçişlerine girdikleri sürece, bu arada dizide TW'nin yönü değişmiş olsa bile, söz konusu geçişi bitireceklerdir. Ayırma süresini 1 ms'ye düşürmek, dizinin 1 ms sonra ejeksiyon moduna geçeceği anlamına gelir. Bu, daha hızlı iyonların diziden geçmek için yeterli zamana sahip olmamasını ve daha yavaş iyonlar ilk geçişlerini bitirmeden önce ikinci bir geçişe girmesini sağlar. Bu nedenle, tüm iyonlar, IMS kalibrasyonunu gerçekleştirmek için gerekli olan aynı sayıda geçişe (yani bir geçiş) tabi tutulacaktır. - 2 dakikalık bir satın alma kaydedin. Döngüsel Sıra Kontrolü penceresinde, Edinme Ayarları açılır penceresini açmak için Al'a tıklayın. Dosya Adı, Açıklama ve Edinme Uzunluğu'nu (dakika) girin ve Kaydet'i tıklatın.
- Adım 2.3 ile aynı koşullar altında kalibrasyon çözeltisinin 2 dakikalık bir alımını daha kaydedin (CCS kalibrasyonunun kalitesini kontrol etmek için bunu kullanın). Döngüsel Sıra Kontrolü penceresinde, Edinme Ayarları açılır penceresini açmak için Al'a tıklayın. Dosya Adı, Açıklama ve Edinme Uzunluğu'nu (dakika) girin ve Kaydet'i tıklatın.
- Göz atma borusundaki kalibrantın kristalleşmesini önlemek için akışkan sistemini 50:50 H2O/ACN ile iyice yıkayın.
3. IMS/IMS-MS satın alınması
- Bir şırınga pompası kullanarak, (lityum katkılı) numuneyi 10 μg / mL'de numune probundan 10 μL / dak akış hızında infüze edin.
- Sinyalin kararlılığını kontrol etmek için cihazı TOF moduna ( MS ayar sayfasından) geçirin. İzotopik paterni ve potansiyel kirleticilerin varlığını kontrol etmek için yararlı olacak numunenin tam bir MS alımını (1 dakika) kaydedin.
NOT: Numune konsantrasyonu, parçalar için iyi bir iyon sinyali elde etmek üzere seçildiğinden, bu adımda bir TOF doygunluğu gözlemlenebilir. TOF doygunluğu, aşağıdaki eserler kullanılarak tanımlanabilir: (i) yapay olarak artmış bir MS çözünürlüğü, (ii) izotopik oranlarda bir değişiklik ve (iii) izotoplar arasında çok sayıda düşük bolluk zirvesi. İyonların iletimini azaltmak ve TOF modunda doygunluğu atmak için DRE Lensini (Dinamik Aralık geliştirmesi, ana Ayar sayfasının Dörtlü/MS Profili/DRE sekmesi) kullanın (Şekil 2A,B). - Cihazı MSMS moduna geçirin (ana Ayar sayfasının Quad/MS Profile sekmesi) ve quadrupole izolasyon için MSMS Mass alanında hedeflenen iyonun kütlesini seçin (örnekte: arabinoksilan pentasakkaritin [M+Li]+ iyonik türlerine karşılık gelen 685.2'nin m/z'si). Verileri işlerken öncü yalıtımı kontrol etmek için 1 dakikalık bir alım kaydedin.
NOT: Lityum katkıları, monoizotopik tepenin -1 Da'sında bir izotopa sahiptir, bu da işleme adımlarına müdahale etmemesi için MS / MS seçim penceresinden çıkarılması gerekir. Quad/MS Profile sekmesindeki LM Resolution ve HM Resolution parametreleri kullanılarak seçim aralığı daraltılarak kaldırılabilir (Şekil 2C). - İlgilenilen izomerin mobilite tabanlı seçimini gerçekleştirmek için bir "dilimleme" IMS dizisi ayarlayın.
- Cihazı Mobilite moduna geçirin (bkz. adım 2.3.2). Döngüsel Sıra Denetimi penceresinde, Döngüsel İşlevler sekmesinden Paket ekle'yi ve ardından Dilimleme'yi seçin. Dizi sekmesinde karmaşık bir mobilite olayları dizisinin görünmesini bekleyin (Şekil 3).
NOT: IMS/IMS işleminin her adımını görselleştirmek mümkündür: Sıra sekmesindeki Çıkar ve Al olayına tıklayın. Kırmızı renkle vurgulandıktan sonra, Yukarı ve Aşağı düğmelerini kullanarak dizi içinde uygun konuma getirin. - Eject and Acquire olayını ilk Ayrı olaydan hemen sonra konumlandırın (yani, Şekil 3'te gösterildiği gibi sıradaki satır 8 yerine 3. satırda taşıyın) ve ardından Çalıştır'ı tıklatın. Gerçek zamanlı olarak görüntülenecek ilk ayrımın sonuçlarını arayın. IMS tepe noktalarının çözünürlüğü tatmin edici olana kadar dizideki bu olayın zaman değerini değiştirerek çok geçişli bir ayırma için ilk Ayrı olayın süresini artırın. Referans için 1 dakikalık bir alım kaydedin.
NOT: ADC Kurulumu sekmesindeki ADC Başlangıç Gecikmesi değerini not alın: yalıtımın kalitesini denetlemek yararlı olacaktır. - Duraklat'ı tıklayın. İlk ayırmanın sonuçlarının görüntülendiğini, ancak kullanıcı Çalıştır'ı yeniden tıklatana kadar denetim sırasındaki değişikliklerin uygulanmayacağını unutmayın. Eject and Acquire olayını Eject, Eject to Pre-Store ve Hold and Eject olaylarının altına yerleştirin. Olayların süresini, hedeflenen tepe noktası Ön Depoya Çıkar bölgesinde ve diğer iyonlar Çıkar veya Beklet ve Çıkar bölgesinde olacak şekilde ayarlayın.
NOT: Bu üç olayın varış zamanı dağılımlarına (ATD'ler) kıyasla süresi, Mobilogram sekmesindeki hareketlilik spektrumunun altındaki renk kodlu çubuk kullanılarak görselleştirilebilir (Şekil 3). - Eject and Acquire olayını dizinin sonunda, Ön Mağazadan Yeniden Enjekte Et ve ikinci Ayrı olaylarının altına yerleştirin. Seçili popülasyonu görüntülemek için Çalıştır'ı tıklatın.
NOT: Seçilen popülasyon IMS hücresinden ayrıldığından, önceki tüm ayrımlar kaybolmuştur ve tek geçişli bir ayrıma (istenen şekilde) geri dönmüştür. - İzolasyonun kalitesini kontrol edin. Yalnızca ilgilenilen zirvenin seçildiğini doğrulamak için, Şekil 4'te gösterildiği gibi reenjeksiyondan önce olduğu gibi reenjeksiyondan sonra aynı ayrımı (yani, aynı Ayrı zaman) gerçekleştirin. Referans için 1 dakikalık bir alım kaydedin.
NOT: Kullanıcıların atılan popülasyonu kontrol etmeleri önerilir; Depo Öncesi Çıkarma zaman penceresi taban çizgisi düzeyinde olmalıdır (Şekil 4B). Bunu denetlemek için, ADC Ayarları sekmesine ADC Başlat Gecikmesi'ni El ile moduna getirin ve adım 3.4.2'de belirtilen gecikme süresini girin. Referans için 1 dakikalık bir alım kaydedin. - Sıra sekmesinde, kullanıcı tanımlı olay zamanlarının yanındaki sütunda (kırmızıyla vurgulanmış Time Abs sütunu), tüm olayların toplam zamanlarını arayın. CCS kalibrasyonunu gerçekleştirmek için Pre-Store'dan Reinject etkinliğinin hattında bulunan Time Abs'yi not alın.
- Cihazı Mobilite moduna geçirin (bkz. adım 2.3.2). Döngüsel Sıra Denetimi penceresinde, Döngüsel İşlevler sekmesinden Paket ekle'yi ve ardından Dilimleme'yi seçin. Dizi sekmesinde karmaşık bir mobilite olayları dizisinin görünmesini bekleyin (Şekil 3).
- Hedeflenen zirveyi iki IMS turu arasında parçalayın. İyonların kinetik enerjisini arttırmak için reenjeksiyon adımının voltajlarını değiştirin ve iyon hareketlilik gazı ile çarpıştığında bunları parçalayın.
- Eject and Acquire olayından hemen önceki Ayrı olayının süresini 1 ms'ye ayarlayın (bkz. adım 2.3.3'teki açıklama).
- Mağaza Öncesinden Yeniden Enjekte Et satırında, Etkinleştirmeyi Etkinleştir kutusunu işaretleyin ve yerleşik denetimle parçalanmayı en iyi duruma getirin. Spektrum tatmin ediciyse (örneğin, taban tepe noktası bir parçadır), doğrudan adım 3.5.4'e geçin.
NOT: Etkinleştirmeyi etkinleştirirken, hat üzerindeki üç voltaj griye döner: voltajların manuel olarak optimize edilmesi gerekiyorsa kullanıcının değiştirmesi gereken voltajlar bunlardır (bir sonraki adıma bakın). Bu üç voltaj (Pre-Array Degrade, Pre-Array Bias, ve Array Ofset), iyonları aktive etmek için kullanılan gradyanı oluşturur. İyonların kinetik enerjisi, Dizi Öncesi Önyargı ve Dizi Ofseti arasındaki eğimle artacaktır (bkz. Şekil 5). Degrade → Önyargı → Ofset değerlerinin varsayılan değerleri şunlardır: etkinleştirme olmadan 85 → 70 → 45 V; dahili fonksiyonun maksimum aktivasyonu 185 → 170 → -5 V (+150 V). Parçalanmadan sonra, DRE lensini kullanarak iyon iletimini yeniden ayarlamayı unutmayın (sinyalin zayıflamasını azaltın) (bkz. adım 3.2.). - Parçalanma yerleşik kontrol ile tatmin edici değilse, Etkinleştirmeyi Etkinleştir kutusunun işaretini kaldırın ve reenjeksiyon voltajlarını manuel olarak optimize etmeye devam edin. Pre-Array Degrade voltajını artırın (Pre-Array Bias voltajı her zaman Pre-Array Degradesinin 15 V altında tutulmalıdır) ve sonuçlar tatmin edici olana kadar Array Offset voltajını (negatif olarak ayarlanabilir) düşürün.
NOT: Çok fonksiyonlu dizinin voltajlarını manuel olarak ayarlarken, kullanıcı voltaj ayarlarını daha iyi görselleştirmek için 'Mobilogram' görünümünden çok fonksiyonlu dizide (PE diyagramı) uygulanan voltajların etkileşimli şemalarına geçebilir (Şekil 5A). - 2 dakikalık bir satın alma kaydedin. Edinme açılır penceresinde, yalnızca varış zamanlarını ve m/z'yi (kromatografik analizler için kullanılan edinme süresi (saklama süresi) içeren bir dosya oluşturmak için Sapma Süresini Koru seçeneğini işaretleyin. Bu dosyanın *_dt etiketli olduğunu unutmayın. RAW.
NOT: Kullanıcı Sapma Süresini Koru seçeneğini işaretlemeyi unutursa, Driftscope 2.9 yazılımını kullanarak IMS boyutunu ayıklamak hala mümkündür (Dosya | MassLynx |'e dışa aktarma Sürüklenme Süresini Koru).
- Cihazı ana Ayar sayfasında TOF moduna geri döndürün ve bir sonraki numuneye geçmeden önce sistemi 50:50 MeOH/H2O ile iyice durulayın.
4. MZmine 224 ile IMS/IMS-MS işleme
NOT: MZmine 2, Malzeme Tablosunda verilen URL'den edinilebilir. MZmine 2.51 kullanımı önerilir. Bu makalenin hazırlanması sırasında, sonraki sürümler içe aktarma işlevindeki bir değişiklik nedeniyle Döngüsel IMS araçlarından RAW dosyalarını açamaz.
- Yalnızca IMS ve m/z boyutlarını (*_dt içeren ham dosyaları içe aktarın. RAW) Raw veri yöntemlerini kullanarak | Ham veri içe aktarma.
NOT: Ham dosyalar ana MZmine penceresinin sol tarafında görünecektir. Orijinal * dosyasını içe aktarmayın. Hala bekletme süresi boyutunu içeren RAW dosyaları. MZmine, bekletme süresini IMS varış zamanından ayırmaz ve her iki boyutun veri noktaları çakışacaktır. - Temsili bir dosyadaki iş akışı parametrelerini, Ham veri dosyaları liste.
- Verilerdeki gürültü düzeyini değerlendirin. Ham veri dosyaları listesinde dosyaya sağ tıklayın, TIC'yi Göster'i seçin ve temel tepe noktası "kromatogram" (BPC) 'yi görüntüleyin. Kütle spektrumunu görüntülemek için gözle gözlemlenebilen en küçük zirveye çift tıklayın. Verilerdeki gürültü seviyesinin, bu spektrumdaki taban zirvesinin ikinci izotopunun etrafında olduğunu düşünün ve aşağıdaki işleme adımlarında tüm yoğunluk eşikleri için aynı değeri kullanın.
NOT: Veriler quadrupole izolasyonu kullanılarak elde edilmiştir ve bu nedenle MZmine tarafından MS / MS olarak kabul edilir. - Ham veri yöntemlerini kullanarak toplu algılamayı gerçekleştirin | Özellik algılama | Kütle algılama. Profil modunda alınan veriler için Wavelet dönüştürme algoritmasını kullanın. MZmine'daki algoritmaların parametrelerini ayarlamak için, algoritmanın yanındaki [...] düğmesine tıklayın ve parametreleri optimize ederken verileri görselleştirmek için Önizlemeyi göster seçeneğini kullanın.
NOT: Bu aşamada, algoritma tarafından seçilen tepe noktaları önizleme penceresinde kırmızı renkte görünecektir. Özel RAW dosyalarında dalgacık dönüştürme algoritmasını kullanırken, MZmine bazen profil veri noktalarını merkezlenmiş zirvelerle karıştırır. Yazılım, kullanıcının merkezlenmiş spektrumlarda bir profil algoritması çalıştırdığını belirten bir mesaj görüntüler: bu mesajı görmezden gelin ve Tamam'a tıklayın. - Ham veri yöntemlerini kullanarak her parça kütlesi için çıkarılan iyon hareketlilik spektrumlarını (EIM) yeniden yapılandırın | Özellik algılama | ADAP Kromatogram oluşturucu önceki adımda oluşturulan 'kütleler' kütle listesinde. Bu aşamadaki m/z tolerans girişi taramadan taramaya tolerans olduğundan, beklenen genel doğruluktan en az 3-4 kat daha yüksek bıraktığınızdan emin olun.
- Önceki adımda önizleme seçeneği olmadığından, ana MZmine penceresinin sağ panelinde görünen Özellik listesini kullanarak tepe noktası çekme işleminin kalitesini doğrudan kontrol edin. Özellik listesini açın, tüm satırları seçin, sağ tıklayın ve Göster/XIC (iletişim kutusu) seçeneğini belirleyin. Mobilite spektrumundaki tüm iyonları görüntülemek için Tümü'nü tıklatın. Belirgin bir şekilde kaçırılmış tepe noktası olmadığından emin olmak için renkli görünen seçilmiş tepe noktalarını inceleyin.
- Birden fazla özellikte farklı pikler içeren m/z'yi bölmek için EIM'leri deconvolve edin. Özellik listesi yöntemlerini | kullanma Özellik algılama | Chromatogram deconvolution, ve Wavelets (ADAP) algoritmasını seçin. Önizlemeyi göster seçeneğini ve aşağıdaki anahtar parametreleri kullanarak veriler için algoritmayı optimize edin: S/N eşiği , katsayı/alan eşiği ve RT dalgacık aralığı.
NOT: Çözülmüş spektrumun yönünün kontrol edilmesi önerilir. Adım 4.2.4'te açıklandığı gibi kromatogram görselleştirme aracını kullanın. Ayrışmış tepe noktaları renkli olarak görünecek ve Şekil 6A'da gösterildiği gibi aynı kütlenin zirveleri bölünmelidir. - Özellik listesi yöntemlerini kullanarak dekonvolved EIM'leri deizotop | İzotoplar | İzotopik zirveler orfoz. IMS ayrımı sırasında izotoplar çözümlenmediğinden, m/z tolerans değeri için cihazın beklenen doğruluğunu kullanın ve varış zamanı toleransını 0,1 ms'ye (MZmine'da Tutma süresi toleransı 0,1 dakika olarak görüntülenir) ayarlayın. Özellik listesini kontrol edin: herhangi bir izotop kalırsa, tolerans değerlerini artırın.
NOT: İzotopu kaldırma teorik olarak özellik listesi işlemenin herhangi bir anında gerçekleştirilebilse de, şarj değerlerinin dışa aktarılabilmesi için bunu en son yapmak önemlidir (diğer adımlar için kullanılan algoritmalar bazen şarj durumu bilgilerini kaldırır).
- Verilerdeki gürültü düzeyini değerlendirin. Ham veri dosyaları listesinde dosyaya sağ tıklayın, TIC'yi Göster'i seçin ve temel tepe noktası "kromatogram" (BPC) 'yi görüntüleyin. Kütle spektrumunu görüntülemek için gözle gözlemlenebilen en küçük zirveye çift tıklayın. Verilerdeki gürültü seviyesinin, bu spektrumdaki taban zirvesinin ikinci izotopunun etrafında olduğunu düşünün ve aşağıdaki işleme adımlarında tüm yoğunluk eşikleri için aynı değeri kullanın.
- Birden fazla IMS/IMS-MS spektrumu işliyorsanız, işlemeyi bu optimize edilmiş parametrelerle tekrarlayın. Tüm spektrumlar için aynı parametreleri saklayın.
- Birden çok spektrum söz konusu olduğunda, bunları dışa aktarmak için tek bir tabloda gruplandırın; değilse, doğrudan adım 4.5'e atlayın. Spektrumları gruplandırmak için, Özellik listesi yöntemlerini | Hizalama | Hizalayıcıya katılın. Amaç aslında pikleri hizalamak olmadığından, hem m / z hem de varış zamanı için kısıtlayıcı tolerans değerleri kullanın. Her iki boyuta da aynı ağırlığı verin.
- Son özellik listesini *.csv dosyasına dışa aktarın. Özellik listesi yöntemlerini | kullanma İhracat/İthalat | CSV dosyasına dışa aktarma ve şu değerleri dışa aktarma: Satır m/ z'yi dışa aktarma, Satır saklama süresini dışa aktarma (gerçek IMS varış süresi), En yüksek m/z ve Tepe yüksekliği. Alan ayırıcı olarak virgül kullanın.
5. Merkezlenmiş IMS/IMS spektrumlarının TWCCSN2'si
NOT: Bu protokolde, doğrusal kalibrasyondan daha iyi sonuçlar verme eğiliminde olan ve bir elektronik tabloda veya şirket içi bir işleme komut dosyasında uygulanması kolay olan logaritmik bir uyum kalibrasyonu25,26 kullanılacaktır. Şirket içi bir senaryo (R ile yazılmış), Malzeme Tablosunda verilen URL'de mevcuttur.
- Kalibrant alımından referans varış zamanı değerlerini seçin (bkz. adım 2.3). Tüm IMS kalibrant piklerinin yönünü kontrol etmek için oluşturucu yazılımını kullanarak bunu manuel olarak yapın ( Malzeme Tablosuna bakın).
- Chromatogram penceresinde *_dt açın. Kalibrana karşılık gelen RAW dosyası.
- Her kalibrasyon noktası için, Display | kullanarak EIM'yi oluşturun Kütle seçeneği.
- EIM'lerin profilini kontrol edin. Bazıları kötü tanımlanmışsa, İşlem | kullanarak bunları düzeltin Pürüzsüz seçenek (en iyi sonuçlar tipik olarak Savitzky-Golay algoritması ile elde edildiğinden, 3 kutu üzerinde 2 kez pürüzsüz). Bir e-tablodaki tepe değerlerini bildirin.
NOT: Referans noktaları genellikle düşük çözünürlüklü DTIMS cihazları kullanılarak elde edildiğinden, kalibrantlara bağlı olarak Döngüsel IMS'de bazı multimodal dağılımlar görünebilir. Böyle bir dağılımı gösteren tepe noktalarını kalibrasyon listesinden kaldırın.
- Kalibrantlardan logaritmik uyum parametrelerini hesaplayın.
- Tüm kalibrasyon noktaları için aşağıdakileri hesaplayın.
- Eq (1) kullanarak sürüklenme süresini hesaplayın:
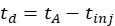 (1)
(1)
td ile sürüklenme süresi, tA ölçülen varış zamanı ve IMS hücresindeki enjeksiyon zamanını tinj (hepsi ms cinsinden).
NOT: Oligosakkarit parçaları gibi küçük moleküller için, farklı kütleler arasındaki ölü zaman (IMS hücresinden çıkış ile dedektör arasındaki uçuş süresi) varyasyonu, CCS kalibrasyonunun hata aralığındadır ve göz ardı edilebilir. - Eq (2) kullanarak iyonların nötr kütlesini hesaplayın:
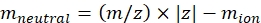 (2)
(2)
z ile iyonun yük durumu ve karşı iyonun kütlesi (Da'da) mion. Belirsizlik yaratmamak için tam kütleler kullanın. Karşı iyon yerine atom kaybı varsa, negatif miyon değerleri kullanın (örneğin, [M-H]-mnötr = (m/z) * |z| - (- 1.007276) = (m/z) * |z| + 1.007276 için). - Eq (3) kullanarak CCS parametresini hesaplayın:
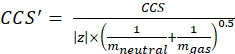 (3)
(3)
CCS ile referans sürüklenme tüpü DTCCSN2 değeri (nm2 cinsinden) ve sürüklenme gazının kütlesi mgas (Da'da; örneğin azot için: mgas = 28.01 Da). - Eq (4) kullanarak td' parametresini hesaplayın:
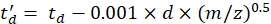 (4)
(4)
d ile dedektör başlangıç gecikmesi, ölü zamanı düzeltmek için deneysel olarak kullanılır (tipik olarak ~ 1,5 ms). - Yukarıdaki parametrelerin logaritmasını hesaplayın:
ln (CCS') ve ln (t'd)
- Eq (1) kullanarak sürüklenme süresini hesaplayın:
- Eq (5) kullanarak R2 katsayısını ve logaritmik uyumun x ve y parametrelerini (x eğim ve ln (y) kesişme ile) belirlemek için doğrusal bir regresyon gerçekleştirin:
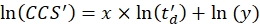 (5)
(5)
NOT: Kullanıcı, kalibrasyon sonuçlarını görsel olarak kontrol etmek için ln(CCS') ve ln(td') değerlerini grafiklendirebilir, ancak bu isteğe bağlıdır.
- Tüm kalibrasyon noktaları için aşağıdakileri hesaplayın.
- *.csv dosyasına dışa aktarılan her IMS/IMS spektrumu için MZmine tarafından seçilen tepe noktalarını kalibre etmek üzere kalibrasyonu deneysel verilere uygulayın. Her nokta için aşağıdakileri hesaplayın.
- Eq (6) kullanarak sürüklenme süresini hesaplayın:
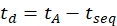 (6)
(6)
tseq ile son IMS ayrımından önceki zaman (adım 3.4.6'da belirtilen 'Time Abs' değeri).
NOT: Farklı dizilerle elde edilen birden fazla IMS/IMS spektrumunu kalibre ediyorsanız, tseq değerlerini dikkatlice kontrol edin. - Eq (7) kullanarak iyonların nötr kütlesini hesaplayın:
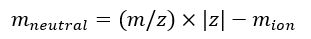 (7)
(7) - Eq (8) ve Eq (9) kullanarak td' ve td'' parametrelerini hesaplayın:
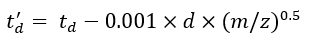 (8)
(8)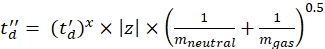 (9)
(9) - Eq (10) kullanarak son kalibre edilmiş CCS değerlerini (nm2'de TWCCSN2) hesaplayın:
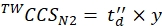 (10)
(10)
NOT: Adım 5.2.2 olmasına rağmen. kesişme olarak ln(y) verir, son CCS değerini elde etmek için y kullanılmalıdır. Üstel bir fonksiyon uygulamayı unutmayın.
- Eq (6) kullanarak sürüklenme süresini hesaplayın:
- Kalibrasyonu, adım 2.4'te elde edilen kalibrasyon çözeltisinin ikinci edinimine uygulayarak kalibrasyonun doğruluğunu kontrol edin.
NOT: Kalibrasyon ~%1-2 hata ile sonuç vermelidir.
Sonuçlar
Bu protokolü göstermek için örnek olarak bir arabinoksilan pentasakkarit, XA2XX seçildi. Bu bileşik ticari olarak temin edilebilir, ancak yalnızca başka bir arabinoksilan pentasakkarit, XA3XX (saf XA3XX de ticari olarak temin edilebilir) ile bir karışım olarak temin edilebilir. XA2XX ve XA3XX'in yapıları Ek Şekil S1'de verilmiştir. Ticari karışımdaki XA2XX ve XA3XX oranı ~ 50:50 olduğundan, karışımın 20 μg / mL'sin...
Tartışmalar
SELECT SERİSİ Döngüsel IMS, yukarı akış kromatografik ayrımına gerek kalmadan belirli bir m/z ve iyon hareketliliğinin tanımlanmış bir iyon popülasyonunun seçilmesini sağlayan güçlü bir araçtır. Cihaz, hem MS / MS hem de IMS / IMS spektrumlarının çıkarılabileceği bu iyon popülasyonunun iki boyutlu parçalanma haritasını oluşturma imkanı sunar. Bununla birlikte, kullanıcı deneysel süreç sırasında dikkat edilmesi gereken birkaç kritik noktaya dikkat etmelidir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
S.O., doktorasını finanse ettiği için Fransız Ulusal Araştırma Ajansı'na müteşekkirdir (hibe ANR-18-CE29-0006).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 33-α-L- plus 23-α-L-Arabinofuranosyl-xylotetraose (XA3XX/XA2XX) mixture | Megazyme Ltd., Wicklow, Ireland | O-XAXXMIX | XA2XX + XA3XX mixture |
| 33-α-L-Arabinofuranosyl-xylotetraose (XA3XX) | Megazyme Ltd., Wicklow, Ireland | O-XA3XX | Pure XA3XX standard |
| Eppendorf Safe-Lock Tubes, 1.5 mL, Eppendorf Quality, colorless, 1,000 tubes | Eppendorf, Hamburg, Germany | 0030120086 | Used to prepare the carbohydrate stock solution and dilution |
| FALCON 50 mL Polypropylene Conical Tube 30 x 115 mm | Corning Science México S.A. de C.V., Reynosa, Tamaulipas, Mexico | 352070 | Used to prepare the aqueous stock solution of 100 mM LiCl |
| Lithium Chloride (ACS reagent, ≥99 %) | Sigma-Aldrich Inc., Saint Quentin Fallavier, France | 310468 | Used to dope the sample with lithium |
| Major Mix IMS/Tof Calibration Kit | Waters Corp., Wilmslow, UK | 186008113 | Calibration solution for MS and IMS |
| MassLynx 4.2 SCN1016 Release 6 (Waters Embedded Analyser Platform for Cyclic IMS 2.9.1 Release 9) | Waters Corp., Wilmslow, UK | 721022377 | Cyclic IMS vendor software for instrument control and data processing |
| Methanol for HPLC PLUS Gradient grade | Carlo-Erba Reagents, Val de Reuil, France | 412383 | High-purity solvent |
| MS Leucine Enkephaline Kit | Waters Corp., Wilmslow, UK | 700002456 | Reference compound used for tuning of the mass spectrometer |
| SCHOTT DURAN 100 mL borosilicate glass bottle | VWR INTERNATIONAL, Radnor, Pennsylvania, US | 218012458 | Used to prepare the solution of 500 µM LiCl in 50:50 MeOH/Water |
| SELECT SERIES Cyclic IMS | Waters Corp., Wilmslow, UK | 186009432 | Ion mobility-mass spectrometer equipped with a cylic IMS cell |
| Website: http://mzmine.github.io/ | MZmine Development Team | - | Link to download the MZmine software |
| Website: https://github.com/siollivier/IM-MN | INRAE, UR BIA, BIBS Facility, Nantes, France | - | Link to an in-house R script containing a CCS calibration function |
Referanslar
- Allard, P. -. M., et al. Integration of molecular networking and in-silico MS/MS fragmentation for natural products dereplication. Analytical Chemistry. 88 (6), 3317-3323 (2016).
- Wang, M., et al. Mass spectrometry searches using MASST. Nature Biotechnology. 38 (1), 23-26 (2020).
- David, M., Fertin, G., Rogniaux, H., Tessier, D. SpecOMS: a full open modification search method performing all-to-all spectra comparisons within minutes. Journal of Proteome Research. 16 (8), 3030-3038 (2017).
- Dührkop, K., et al. SIRIUS 4: a rapid tool for turning tandem mass spectra into metabolite structure information. Nature Methods. 16 (4), 299-302 (2019).
- Wang, M., et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nature Biotechnology. 34 (8), 828-837 (2016).
- Nothias, L. -. F., et al. Feature-based molecular networking in the GNPS analysis environment. Nature Methods. 17 (9), 905-908 (2020).
- Gray, C. J., et al. Advancing solutions to the Carbohydrate Sequencing Challenge. Journal of the American Chemical Society. 141 (37), 14463-14479 (2019).
- Ropartz, D., et al. Online coupling of high-resolution chromatography with extreme UV photon activation tandem mass spectrometry: Application to the structural investigation of complex glycans by dissociative photoionization. Analytica Chimica Acta. 933, 1-9 (2016).
- Wolff, J. J., et al. Negative electron transfer dissociation of glycosaminoglycans. Analytical Chemistry. 82 (9), 3460-3466 (2010).
- Ropartz, D., et al. Charge transfer dissociation of complex oligosaccharides: comparison with collision-induced dissociation and extreme ultraviolet dissociative photoionization. Journal of the American Society for Mass Spectrometry. 27 (10), 1614-1619 (2016).
- Morelle, W., et al. Fragmentation characteristics of permethylated oligosaccharides using a matrix-assisted laser desorption/ionization two-stage time-of-flight (TOF/TOF) tandem mass spectrometer. Rapid Communications in Mass Spectrometry. 18 (22), 2637-2649 (2004).
- Gabelica, V., Marklund, E. Fundamentals of ion mobility spectrometry. Current Opinion in Chemical Biology. 42, 51-59 (2018).
- Gabelica, V., et al. Recommendations for reporting ion mobility mass spectrometry measurements. Mass Spectrometry Reviews. 38 (3), 291-320 (2019).
- Hernandez-Mesa, M., et al. Interlaboratory and interplatform study of steroids collision cross section by traveling wave ion mobility spectrometry. Analytical Chemistry. 92 (7), 5013-5022 (2020).
- Koeniger, S. L., et al. An IMS-IMS analogue of MS-MS. Analytical Chemistry. 78 (12), 4161-4174 (2006).
- Merenbloom, S. I., Koeniger, S. L., Valentine, S. J., Plasencia, M. D., Clemmer, D. E. IMS−IMS and IMS−IMS−IMS/MS for separating peptide and protein fragment ions. Analytical Chemistry. 78 (8), 2802-2809 (2006).
- Eldrid, C., Thalassinos, K. Developments in tandem ion mobility mass spectrometry. Biochemical Society Transactions. 48 (6), 2457-2466 (2020).
- Giles, K., et al. A cyclic ion mobility-mass spectrometry system. Analytical Chemistry. 91 (13), 8564-8573 (2019).
- Merenbloom, S. I., Glaskin, R. S., Henson, Z. B., Clemmer, D. E. High-resolution ion cyclotron mobility spectrometry. Analytical Chemistry. 81 (4), 1482-1487 (2009).
- Ollivier, S., et al. Anomeric retention of carbohydrates in multistage cyclic ion mobility (IMSn): de novo structural elucidation of enzymatically produced mannosides. Analytical Chemistry. 93 (15), 6254-6261 (2021).
- Ollivier, S., Fanuel, M., Rogniaux, H., Ropartz, D. Molecular networking of high-resolution tandem ion mobility spectra: a structurally relevant way of organizing data in glycomics. Analytical Chemistry. 93 (31), 10871-10878 (2021).
- Aron, A. T., et al. Reproducible molecular networking of untargeted mass spectrometry data using GNPS. Nature Protocols. 15 (6), 1954-1991 (2020).
- McKenna, K. R., Li, L., Krishnamurthy, R., Liotta, C. L., Fernández, F. M. Organic acid shift reagents for the discrimination of carbohydrate isobars by ion mobility-mass spectrometry. The Analyst. 145 (24), 8008-8015 (2021).
- Pluskal, T., Castillo, S., Villar-Briones, A., Orešič, M. MZmine 2: Modular framework for processing, visualizing, and analyzing mass spectrometry-based molecular profile data. BMC Bioinformatics. 11, 395 (2010).
- Ruotolo, B. T., Benesch, J. L. P., Sandercock, A. M., Hyung, S. -. J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Bush, M. F., Hall, Z., Giles, K., Hoyes, J., Robinson, C. V., Ruotolo, B. T. Collision cross sections of proteins and their complexes: a calibration framework and database for gas-phase structural biology. Analytical Chemistry. 82 (22), 9557-9565 (2010).
- Ropartz, D., et al. Structure determination of large isomeric oligosaccharides of natural origin through multipass and multistage cyclic traveling-wave ion mobility mass spectrometry. Analytical Chemistry. 91 (18), 12030-12037 (2019).
- Tolmachev, A. V., et al. Characterization of ion dynamics in structures for lossless ion manipulations. Analytical Chemistry. 86 (18), 9162-9168 (2014).
- Arndt, J. R., et al. High-resolution ion-mobility-enabled peptide mapping for high-throughput critical quality attribute monitoring. Journal of the American Society for Mass Spectrometry. 32 (8), 2019-2032 (2021).
- Le Fèvre, A., Dugourd, P., Chirot, F. Exploring conformational landscapes using trap and release tandem ion mobility spectrometry. Analytical Chemistry. 93 (9), 4183-4190 (2021).
- Ohshimo, K., He, X., Ito, R., Misaizu, F. Conformer separation of dibenzo-crown-ether complexes with Na+ and K+ ions studied by cryogenic ion mobility-mass spectrometry. The Journal of Physical Chemistry A. 125 (17), 3718-3725 (2021).
- Purves, R. W., Barnett, D. A., Ells, B., Guevremont, R. Gas-phase conformers of the [M + 2H]2+ ion of bradykinin investigated by combining high-field asymmetric waveform ion mobility spectrometry, hydrogen/deuterium exchange, and energy-loss measurements. Rapid Communications in Mass Spectrometry. 15 (16), 1453-1456 (2001).
- Ujma, J., et al. Cyclic ion mobility mass spectrometry distinguishes anomers and open-ring forms of pentasaccharides. Journal of the American Society for Mass Spectrometry. 30 (6), 1028-1037 (2019).
- Warnke, S., Faleh, A. B., Scutelnic, V., Rizzo, T. R. Separation and identification of glycan anomers using ultrahigh-resolution ion-mobility spectrometry and cryogenic ion spectroscopy. Journal of The American Society for Mass Spectrometry. 30 (11), 2204-2211 (2019).
- Williamson, D. L., Bergman, A. E., Nagy, G. Investigating the structure of α/β carbohydrate linkage isomers as a function of group I metal adduction and degree of polymerization as revealed by cyclic ion mobility separations. Journal of the American Society for Mass Spectrometry. 32 (10), 2573-2582 (2021).
- Myers, O. D., Sumner, S. J., Li, S., Barnes, S., Du, X. One step forward for reducing false positive and false negative compound identifications from mass spectrometry metabolomics data: new algorithms for constructing extracted ion chromatograms and detecting chromatographic peaks. Analytical Chemistry. 89 (17), 8696-8703 (2017).
- Marchand, A., Livet, S., Rosu, F., Gabelica, V. Drift tube ion mobility: how to reconstruct collision cross section distributions from arrival time distributions. Analytical Chemistry. 89 (23), 12674-12681 (2017).
- Davis, D. M., et al. Analysis of ion mobility spectra for mixed vapors using Gaussian deconvolution. Analytica Chimica Acta. 289 (3), 263-272 (1994).
- Polasky, D. A., Dixit, S. M., Fantin, S. M., Ruotolo, B. T. CIUSuite 2: next-generation software for the analysis of gas-phase protein unfolding data. Analytical Chemistry. 91 (4), 3147-3155 (2019).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Gelb, A. S., Jarratt, R. E., Huang, Y., Dodds, E. D. A study of calibrant selection in measurement of carbohydrate and peptide ion-neutral collision cross sections by traveling wave ion mobility spectrometry. Analytical Chemistry. 86 (22), 11396-11402 (2014).
- Richardson, K., Langridge, D., Dixit, S. M., Ruotolo, B. T. An improved calibration approach for traveling wave ion mobility spectrometry: robust, high-precision collision cross sections. Analytical Chemistry. 93 (7), 3542-3550 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır