A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل تفاعل البروتينات ذات العلامات الفلورية مع الحويصلات الدقيقة الفوسفاتية الاصطناعية باستخدام قياس التدفق الخلوي الكمي
In This Article
Summary
هنا ، نصف مجموعة من الطرق لتوصيف تفاعل البروتينات مع أغشية الخلايا أو الحويصلات الدقيقة.
Abstract
في جسم الإنسان ، تستمر معظم التفاعلات الفسيولوجية الرئيسية المشاركة في الاستجابة المناعية وتخثر الدم على أغشية الخلايا. الخطوة الأولى المهمة في أي تفاعل يعتمد على الغشاء هي ربط البروتين على غشاء الدهون الفوسفاتية. تم تطوير نهج لدراسة تفاعل البروتين مع الأغشية الدهنية باستخدام البروتينات ذات العلامات الفلورية وقياس التدفق الخلوي. تسمح هذه الطريقة بدراسة تفاعلات البروتين والأغشية باستخدام الخلايا الحية وحويصلات الدهون الفوسفاتية الطبيعية أو الاصطناعية. ميزة هذه الطريقة هي بساطة وتوافر الكواشف والمعدات. في هذه الطريقة ، يتم تصنيف البروتينات باستخدام أصباغ الفلورسنت. ومع ذلك ، يمكن استخدام كل من البروتينات ذاتية الصنع والمتاحة تجاريا ، والتي تحمل علامات الفلورسنت. بعد الاقتران مع صبغة الفلورسنت ، يتم تحضين البروتينات بمصدر للغشاء الفوسفوليبيد (الحويصلات الدقيقة أو الخلايا) ، ويتم تحليل العينات عن طريق قياس التدفق الخلوي. يمكن استخدام البيانات التي تم الحصول عليها لحساب الثوابت الحركية والتوازن Kd. بالإضافة إلى ذلك ، من الممكن تقدير العدد التقريبي لمواقع ربط البروتين على غشاء الدهون الفوسفاتية باستخدام حبات معايرة خاصة.
Introduction
تفصل الأغشية الحيوية المحتويات الداخلية للخلايا الحيوانية والفضاء خارج الخلية. لاحظ أن الأغشية تحيط أيضا بالحويصلات الدقيقة التي تشكلت خلال دورة حياة الخلية والعضيات. يتكون غشاء الخلية في الغالب من الدهون والبروتينات. تؤدي البروتينات الغشائية وظائف الإشارات والهيكلية والنقل والمواد اللاصقة. ومع ذلك ، فإن الطبقة الثنائية الدهنية ضرورية أيضا للترابط بين الخلية الحيوانية والفضاء خارج الخلية. تقترح هذه الورقة طريقة لدراسة التفاعل المحيطي للبروتينات الخارجية مع الغشاء الدهني.
المثال الأكثر لفتا للنظر للتفاعلات التي تحدث على طبقة الغشاء الخارجي للخلية الحيوانية هو تفاعل تخثر الدم. من السمات المهمة لتخثر الدم أن جميع التفاعلات الرئيسية تستمر على الأغشية الفوسفاتية للخلايا والحويصلات الدقيقة الناشئة عن هذه الخلايا وليس في البلازما1،2،3. تشمل التفاعلات المعتمدة على الغشاء عملية بدء التخثر (على أغشية الخلايا في البطانة السفلية ، أو البطانة الملتهبة ، أو الخلايا المناعية المنشطة ، بمشاركة عامل أنسجة) ، وجميع تفاعلات التنشيط المتتالي الرئيسي للعوامل التاسع والعاشر والبروثرومبين. تنشيط العامل الحادي عشر عن طريق الثرومبين (على أغشية الصفائح الدموية المنشطة ، كريات الدم الحمراء ، البروتينات الدهنية ، والحويصلات الدقيقة) ؛ ردود فعل مسار البروتين C ؛ تعطيل إنزيمات التخثر (على أغشية الخلايا البطانية بمشاركة العوامل المساعدة للثرومبومودولين ، مستقبلات البروتين البطاني C ، كبريتات الهيباران) ؛ وتفاعلات مسار الاتصال (على أغشية الصفائح الدموية وبعض الحويصلات الدقيقة بمشاركة عوامل مساعدة غير معروفة). وبالتالي ، من المستحيل التحقيق في تخثر الدم دون دراسة تفاعل بروتينات البلازما المختلفة مع غشاء خلايا الدم.
تصف هذه الورقة طريقة قائمة على قياس التدفق الخلوي لتوصيف تفاعل البروتينات مع الأغشية الدهنية للخلايا أو الحويصلات الدقيقة. تم اقتراح هذا النهج في البداية لدراسة تفاعل بلازما الدم مع الصفائح الدموية وحويصلات الدهون الفوسفاتية الاصطناعية. علاوة على ذلك ، تتفاعل معظم البروتينات المدروسة مباشرة مع الدهون الفوسفاتية الغشائية سالبة الشحنة ، خاصة مع فوسفاتيديل سيرين 4,5. بالإضافة إلى ذلك ، هناك بروتينات يتم التفاعل مع الغشاء بوساطة مستقبلات خاصة6.
تتمثل إحدى القدرات المهمة لقياس التدفق الخلوي في التمييز بين الأربطة الحرة والمربوطة دون فصل إضافي. تسمح هذه الميزة في قياس الخلايا بدراسة ربط توازن الرباط عند نقطة النهاية وتساعد على إجراء قياسات حركية مستمرة. هذه التقنية غير متطورة ولا تتطلب إعداد عينة معقدة. يستخدم قياس التدفق الخلوي بنشاط لدراسة ديناميات التفاعل بين الببتيدات الفلورية والمستقبلات وبروتينات G في العدلات السليمة والقابلة للنفاذ إلى المنظفات7. هذا النهج قابل للتطبيق أيضا لاستكشاف التفاعلات بين البروتين والحمض النووي وحركية نشاط endonuclease في الوقت الحقيقي8. بمرور الوقت ، تم استخدام هذه الطريقة لدراسة تفاعلات البروتين والبروتين عالية التقارب مع الحويصلات الدهنية النقية9 ، أو بشكل أعم ، مع بروتينات الغشاء المعبر عنها في نظام تعبير خلية Sf9 عالي الكفاءة10. كما تم وصف الطرق الكمية لتوصيف التفاعلات بين البروتين والجسيمات الشحمية باستخدام قياس التدفق الخلوي للبروتينات عبر الغشاء11.
تستخدم هذه التقنية حبات معايرة ذاتية الصنع لتجنب استخدام الخرز المتوفر تجاريا7. كانت خرزات المعايرة المستخدمة سابقا7 تهدف إلى العمل مع الفلوريسين ، مما قيد بشكل كبير مجموعة متنوعة من روابط الفلورسنت التي يمكن الوصول إليها على البروتينات. بالإضافة إلى ذلك ، تقدم هذه الورقة طريقة جديدة للحصول على البيانات الحركية وتحليلها للحصول على دقة زمنية معقولة. على الرغم من وصف هذه الطريقة لحويصلات الدهون الفوسفاتية الاصطناعية ، إلا أنه لا توجد قيود واضحة على قدرتها على التكيف مع الخلايا أو الحويصلات الطبيعية أو الحويصلات الفوسفاتية الاصطناعية ذات تركيبة دهنية مختلفة. تسمح الطريقة الموضحة هنا بتقدير معلمات التفاعل (kon ، koff) والتوازن (Kd) وتسهل التوصيف الكمي لعدد مواقع ربط البروتين على الغشاء. لاحظ أن هذه التقنية توفر تقديرا تقريبيا لعدد مواقع الربط. مزايا هذه الطريقة هي بساطتها النسبية ، وإمكانية الوصول إليها ، وقدرتها على التكيف مع الخلايا الأصلية والحويصلات الدقيقة الطبيعية والاصطناعية.
Protocol
1. وضع العلامات على البروتين الفلورسنت
- إعداد المواد
- تحضير 1 M بيكربونات الصوديوم العازلة، الرقم الهيدروجيني 9.0، وتخزينها في 4 درجة مئوية، واستخدامها في غضون أسبوع واحد.
- تحضير 1.5 M هيدروكسيلامين هيدروكلوريد العازل، الرقم الهيدروجيني 8.5، مباشرة قبل الاستخدام.
- تحضير محلول 10 ملغم / مل من صبغة الفلورسنت (انظر جدول المواد) في ثنائي ميثيل سلفوكسيد.
ملاحظة: يمكن تخزين هذا الحل لمدة شهر عند -20 درجة مئوية في الظلام. - تحضير محاليل من الأجسام المضادة النقية أو البروتينات الأخرى في 1-10 ملغ / مل.
ملاحظة: تجنب المخازن المؤقتة التي تحتوي على أيونات الأمونيوم أو الأمينات الأولية. استبدل المخازن المؤقتة التي تحتوي على تريس أو الجلسرين بمحلول ملحي مخزن بالفوسفات (PBS) عن طريق غسيل الكلى. لن يؤثر أزيد الصوديوم (≤3 ملليمتر) ولا الثيميروسال (≤1 ملليمتر) بشكل كبير على تفاعل الاقتران. - احتضان وسط ترشيح الجل (انظر جدول المواد) لتنقية البروتين في PBS بين عشية وضحاها في درجة حرارة الغرفة أو لمدة 2 ساعة عند 60 درجة مئوية. ضع وسط ترشيح الجل على أعمدة الدوران ذات الأغشية 0.2 ميكرومتر.
- احسب كمية الصبغة التفاعلية التي سيتم استخدامها لكل تفاعل وفقا لتركيز البروتين المراد تصنيفه باستخدام Eq (1).
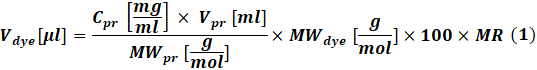
حيثصبغة V هي حجم محلول مخزون الصبغة ؛ C pr و V pr و MWpr هو تركيز البروتين وحجمه ووزنه المولي. صبغة MW هي الوزن المولي للصبغة. 100 هو عامل تحويل الوحدة. MR هي النسبة المولية للصبغة إلى البروتين في خليط التفاعل.
ملاحظة: يوصى باستخدام التصوير بالرنين المغناطيسي التالي لتفاعلات وضع العلامات على IgG: MR = 40 إذا كان الجسم المضاد عند 1-3 ملغم / مل أو MR = 30 إذا كان الجسم المضاد عند 4-10 ملغ / مل. بالنسبة لعوامل التخثر ، عادة ما يتم استخدام MR = 5. - تفاعل الاقتران
- في أنبوب التفاعل ، امزج محلول البروتين مع حجم أقل 10 مرات من محلول بيكربونات 1 M.
- أضف الكمية المطلوبة من صبغة الفلورسنت (انظر الخطوة 1.2) مع التحريك المستمر.
- احتضن خليط التفاعل في درجة حرارة الغرفة لمدة 1 ساعة تقريبا ، محميا من الضوء مع التحريك المستمر.
- لكل 200 ميكرولتر من محلول البروتين ، أضف 5 ميكرولتر من 1.5 م هيدروكسي لامين هيدروكلوريد.
- احتضن خليط التفاعل في درجة حرارة الغرفة لمدة 30 دقيقة تقريبا ، محميا من الضوء مع التحريك المستمر.
- قم بإعداد عمود الدوران.
- أضف 500 ميكرولتر من وسط ترشيح الجل لتنقية البروتين إلى عمود. قم بطرد العمود لمدة 3 دقائق عند 1000 × جم.
- تخلص من المخزن المؤقت من أنبوب التجميع. إذا لم يكن العمود ممتلئا ، فأضف المزيد من وسط ترشيح الهلام ، وقم بالطرد المركزي للعمود لمدة 3 دقائق عند 1000 × جم. كرر هذه الخطوة حتى يمتلئ العمود.
- تنقيه
- الطرد المركزي لخليط التفاعل (من الخطوة 1.3.5) لمدة 5 دقائق عند 17000 × غرام وإزالة الراسب.
- انقل السوبرناتانت إلى عمود الدوران باستخدام وسط ترشيح الهلام. اسمح للمحلول بالامتصاص في سرير الجل.
- استخدم أنبوب تجميع فارغ لعمود الدوران وقم بطرده مركزيا لمدة 5 دقائق عند 1000 × جم. بعد الطرد المركزي ، اجمع البروتين المسمى من أنبوب التجميع.
- تحديد درجة وضع العلامات
- صحيح لمساهمة الصبغة في الامتصاص عند A 280 عن طريق قياس امتصاص الصبغة الحرة عند 280 نانومتر (A 280) والحد الأقصى λ للصبغة (Amax) (انظر Eq (2)).
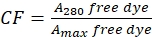 (2)
(2) - قم بقياس امتصاص مقترن صبغة البروتين عند 280 نانومتر (A 280) والحد الأقصى λ للصبغة (Amax) واحسب تأقلم البروتين باستخدام Eq (3).
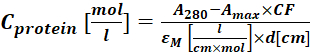 (3)
(3)
حيث εM هو معامل الانقراض المولي للبروتين عند 280 نانومتر. d هو طول المسار البصري أثناء قياس الامتصاص ؛ CF هو مساهمة الصبغة في الامتصاص عند A280 (الخطوة 1.6.1). - احسب درجة وضع العلامات (DOL) باستخدام Eq (4).
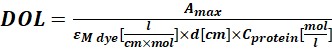 (4)
(4)
حيث εM صبغة هي معامل الانقراض المولي للصبغة عند λmax nm. d هو طول المسار البصري أثناء قياس الامتصاص ؛ بروتين C هو تركيز البروتين (الخطوة 1.6.2).
- صحيح لمساهمة الصبغة في الامتصاص عند A 280 عن طريق قياس امتصاص الصبغة الحرة عند 280 نانومتر (A 280) والحد الأقصى λ للصبغة (Amax) (انظر Eq (2)).
2. إعداد الحويصلات الفوسفاتية
- تحضير وتخزين خليط الدهون
- الجمع بين الدهون في النسبة المناسبة (فوسفاتيديل سيرين / فوسفاتيديل كولين بنسبة 20 مول٪ إلى 80 مول٪).
- جفف خليط الدهون بعد التجفيد أو التبخر وخزنه تحت جو خامل في أمبولات زجاجية.
- إنتاج أفلام الدهون
- افتح الأمبولة ، وأعد تعليق خليط الدهون بكمية صغيرة (~ 100 ميكرولتر) من الكلوروفورم.
ملاحظة: لا تستخدم الكثير من الكلوروفورم لأنه لا يتبخر تماما. - أضف DiIC16 (3) في الإيثانول عند 0.2 مول٪. انقل خليط الدهون إلى قارورة مستديرة القاع. انشر الخليط بشكل رقيق على جانبي القارورة عن طريق تدويرها. جفف مزيج الدهون لمدة 30 دقيقة تحت تيار الأرجون.
- افتح الأمبولة ، وأعد تعليق خليط الدهون بكمية صغيرة (~ 100 ميكرولتر) من الكلوروفورم.
- ترطيب خليط الدهون
- أضف عازلا مائيا دافئا بشكل مناسب (~ 55 درجة مئوية) (HEPES 20 mM ، NaCl 140 mM ، pH 7.4) في حجم يتوافق مع تركيز الدهون المتوقع إلى القارورة مع فيلم الدهون. احتضني الخليط مع الدوامة عند 55 درجة مئوية لمدة 30 دقيقة للترطيب الكامل.
- وضع أنبوب العينة في الفريزر أو منظم الحرارة الدافئ لجعل تعليق الدهون يخضع ل 3-5 دورات تجميد وإذابة.
- تشكيل الحويصلات الدهنية عن طريق البثق
- قم بإعداد الطارد وفقا لتعليمات الشركة المصنعة. قم بتسخين جميع مكونات الطارد إلى درجة حرارة انتقال الطور لخليط الدهون.
- املأ إحدى محاقن الطارد بخليط الدهون المائي. انتظر لمدة 5-10 دقائق حتى تتوازن درجة حرارة تعليق الدهون مع درجة حرارة الطارد.
- بثق خليط الدهون من خلال الغشاء 10 مرات على الأقل. بالنسبة للبثق النهائي ، ضع تعليق الدهون في المحقنة البديلة وابحث عن تغيير في المظهر من غامض قليلا إلى محلول واضح.
- تخزين الخليط الناتج من الحويصلات الدهنية في 4 درجات مئوية ، ويفضل أن يكون ذلك في جو خامل من الأرجون أو النيتروجين ، لمدة 3-4 أيام. لا تجمد.
3. عزل الصفائح الدموية عن الدم الكامل
- جمع الدم الكامل من المتبرعين الأصحاء في أنابيب تحتوي على 3.2٪ سترات الصوديوم.
- أضف البروستاجلاندين E1 (PGE1) (1 ميكرومتر) و apyrase (0.1 U / mL) إلى الدم ، متبوعا بالطرد المركزي في درجة حرارة الغرفة عند 100 × جم لمدة 8 دقائق.
- بعد الطرد المركزي ، خذ البلازما الغنية بالصفائح الدموية وأضف محلول سترات الصوديوم (106 mM ، الرقم الهيدروجيني 5.5) إلى نسبة البلازما / السترات من 3: 1. الطرد المركزي للبلازما في درجة حرارة الغرفة عند 400 × غرام لمدة 5 دقائق.
- قم بإزالة السوبرناتانت ، وأعد تعليق الكريات في 300 ميكرولتر من المخزن المؤقت ل Tyrode بدون BSA (20 mM HEPES ، 150 mM NaCl ، 2.7 mM KCl ، 1 mM MgCl 2 ، 0.4 mM NaH 2 PO 4 ، 2.5 mM CaCl 2 ، 5 mM glucose ، pH7.4). تنقية الصفائح الدموية من بروتينات البلازما عن طريق كروماتوغرافيا هلام على وسط ترشيح الجل لتنقية الصفائح الدموية (انظر جدول المواد).
4. الكشف عن البروتين - تفاعل الدهون عن طريق قياس التدفق الخلوي
- تجارب الربط الحركي
- تمييع الحويصلات الفوسفاتية (من الخطوة 2.4.4) في المخزن المؤقت ل Tyrode (20 mM HEPES ، 150 mM NaCl ، 2.7 mM KCl ، 1 mM MgCl 2 ، 0.4 mM NaH 2 PO 4 ، 2.5mM CaCl2 ، 5 mM glucose ، 0.5٪ BSA ، pH 7.4) إلى تركيز 1 μM والحجم الإجمالي 250 μL.
- امزج عامل التخثر المسمى بالفلورسنت X (fX-fd) من الخطوة 1 بتركيز 500 نانومتر مع الحويصلات الفوسفاتية من الخطوة 4.1.1 بنسبة 1:1 (تركيز الحويصلة النهائي 0.5 ميكرومتر ، تركيز fX-fd هو 250 نانومتر من fX) إلى حجم إجمالي قدره 500 ميكرولتر.
- حقن على الفور 500 ميكرولتر من التعليق المختلط (~ 20 دقيقة للتحليل بمعدل تدفق منخفض) في مقياس التدفق الخلوي. استخدم معدل تدفق منخفض وتأكد من أن عتبة القناة FL2 (exсitation 488 nm ، مرشح الانبعاثات 585/42 nm) هي كقيمة 200. قم بقياس متوسط التألق في القناة FL4 (exсitation 633 nm ، مرشح الانبعاثات 660/20) لصبغة التألق من جدول المواد.
ملاحظة: اختر مقياس خلوي بدون جهاز أخذ عينات تلقائي. سيؤدي ذلك إلى تسريع عملية حقن العينة في خلية القياس. - عندما يتم تحقيق تشبع الارتباط (لا توجد زيادة كبيرة في التألق في غضون 5 دقائق) ، قم بتخفيف العينة بسرعة 20 ضعفا باستخدام مخزن Tyrode المؤقت ، وراقب التفكك حتى يتم الوصول إلى التألق الأساسي (التفكك الكامل) أو حتى يتم الوصول إلى هضبة (لا يوجد انخفاض كبير في التألق في غضون 5 دقائق).
ملاحظة: كعنصر تحكم، أضف 10 ميكرومتر EDTA وراقب الانفصال الكامل لمدة 5 دقائق.
- تجارب ربط التوازن
ملاحظة: استخدم المنحنى الحركي للربط لتحديد وقت الوصول إلى التشبع. وقت التشبع ل fX-fd والحويصلات الاصطناعية هو 20 دقيقة.- احتضان حويصلات فوسفوليبيد اصطناعية (5 ميكرومتر) لفحص الربط بتركيزات مختلفة من fX-fd (من 0 إلى 1000 نانومتر) في مخزن Tyrode المؤقت لمدة 20 دقيقة.
- قم بتخفيف كل عينة من الخطوة 4.2.1 × 20x إلى حجم نهائي قدره 200 ميكرولتر باستخدام المخزن المؤقت ل Tyrode. قم على الفور بتحليل العينة المخففة عن طريق قياس التدفق الخلوي في غضون 30 ثانية. استخدم الإعدادات من الخطوة 4.1.3.
ملاحظة: كعنصر تحكم للربط غير المحدد ، استخدم عينات مماثلة مع EDTA (10 ميكرومتر) واحتضنها لمدة 5 دقائق.
5. تحليل بيانات قياس التدفق الخلوي
- تصدير التجارب بتنسيق FSC من برنامج الحصول على بيانات القياس الخلوي إلى برنامج قياس الخلايا لتحليل البيانات (انظر جدول المواد). اختر ملف | | التصدير ملفات FCS. افتح FSC الملفات في برنامج مقياس الخلايا لتحليل البيانات عن طريق تحديد الملفات الموجودة على الكمبيوتر وسحبها إلى مساحة عمل البرنامج.
- لبوابة الحويصلات الدقيقة ، حدد منطقة الحويصلات الدقيقة عن طريق تألق الصبغة المحبة للدهون DiIC16 (3). استخدم أوامر القائمة أو زر الرسم في ورقة العمل لإنشاء SSC مخطط نقطي من FL2 (صبغ DilC16(3)) في إحداثيات السجل. اختر زر البوابة المستطيلة لرسم منطقة بوابة بحيث لا يتم تضمين الأحداث من عينة بدون حويصلات في هذه المنطقة (الشكل 1B,C).
- تحليل التجارب الحركية.
- إنشاء مخطط نقطي باستخدام إحداثيات التألق (FL4) بمرور الوقت لمنطقة الحويصلات (انقر نقرا مزدوجا في منطقة الحويصلات في الخطوة 5.2)
- تصدير البيانات المتعلقة بالتغيير في التألق بمرور الوقت بتنسيق csv. اختر عينة | انقر بزر الماوس الأيمن فوق | | التصدير اختر FL4 والوقت في المعلمات | حدد الدليل لحفظ | حدد تنسيق CSV | التصدير.
- افتح ملف CSV في أي برنامج إحصائي (انظر جدول المواد). احسب متوسطا متحركا بسيطا للتألق والوقت لكل 1000 حدث.
- تقريب رسم بياني لاعتماد المتوسط المتحرك البسيط للتألق على الوقت تحت افتراض الاعتماد الأسي (تحليل > التركيب >ملاءمة المنحنى غير الخطي) واستخدام هذا لحساب ثابت الارتباط الحركي باستخدام Eq (5).
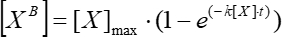 (5)
(5)
حيث [XB] هو تركيز العامل المرتبط في كل لحظة زمنية (وحدات يحددها المستخدم) وفقا للمتوسط المتحرك البسيط من الخطوة 5.3.3 ؛ [X] هو تركيز العامل المضاف. [X] الحد الأقصى هو الحد الأقصى لتركيز العامل المقيد. k هو ثابت الارتباط. ر هو الوقت. - كرر نفس مجموعة الإجراءات (5.3.1-5.3.4) لحساب ثابت التفكك الحركي باستخدام Eq (6).
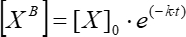 (6)
(6)
حيث [XB] هو تركيز العامل المحدد في كل لحظة من الزمن؛ [X]0 هو تركيز العامل المحدد في اللحظة الأولى من الزمن. k هو ثابت الانفصال. ر هو الوقت.
- فحص ربط التوازن
- أوجد متوسط تألق fX-fd في منطقة الحويصلات لكل تركيز محدد من fX-fd.
- تقريب اعتماد تألق العامل المرتبط من تركيز العامل المضاف في افتراض الربط البسيط في موقع واحد. احسب متوسط معلمات الربط باستخدام Eq (7) من ثلاثة تكرارات مستقلة كحد أدنى.
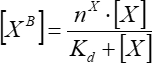 (7)
(7)
حيث [XB] هو تركيز العامل المقيد؛ [X] هو تركيز العامل المضاف. nx هو العدد الظاهري لمواقع الربط لكل حويصلة ؛ Kd هو ثابت التفكك الظاهر.
6. تحويل كثافة التألق إلى متوسط عدد مواقع الربط
- إعداد الخرز معايرة.
- احتضان الصفائح الدموية المصفاة بالهلام (انظر الخطوة 3.3) باستخدام A23187 (10 ميكرومتر) في وجود CaCl 2 (2.5 mM) لمدة 10 دقائق في درجة حرارة الغرفة.
- أضف إلى الصفائح الدموية المنشطة تركيزات مختلفة من fX-fd (0 إلى 1000 نانومتر). أضف 2٪ v / v الفورمالديهايد واحتضن لمدة 1 ساعة. أوقف التفاعل عن طريق احتضان الصفائح الدموية ب 3 M glycine و 5٪ BSA لمدة 30 دقيقة في درجة حرارة الغرفة.
- تنقية الخليط من الصبغة غير المتفاعلة. قم بالطرد المركزي للصفائح الدموية لمدة 5 دقائق عند 400 × جم ، وقم بإزالة السوبرناتانت ، وأعد تعليق الكريات في مخزن Tyrode العازل (الذي يحتوي على 0.5٪ BSA).
ملاحظة: كرر الخطوة 6.1.3 ثلاث مرات.
- قم بقياس مستوى التألق لخرز المعايرة في كل عينة أولا باستخدام مقياس الطيف الفلوري (لصبغة الفلورسنت من جدول المواد ، الإثارة 633 نانومتر ، الانبعاثات 670 نانومتر) ثم باستخدام مقياس التدفق الخلوي (في القناة FL4: الإثارة 633 نانومتر ، مرشح الانبعاثات 660/20). باستخدام عداد خلايا، حدد عدد الخرز في كل عينة.
- قم بتحويل شدة التألق لكل عينة خرزة إلى تركيز صبغة الفلورسنت القابلة للذوبان باستخدام مقياس الطيف الفلوري. أعد حساب تركيز صبغة الفلورسنت لعدد جزيئات الفلوروفور باستخدام Eq (8).
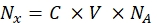 (8)
(8)
حيث Nx هو عدد جزيئات الفلوروفور. C هو تركيز صبغة الفلورسنت. NA هو ثابت أفوغادرو. NA = 6.02214076×1023 مول -1. - قم بإنشاء رسم بياني للاعتماد على متوسط تألق الخرز في مقياس التدفق الخلوي (الخطوة 6.2) على عدد جزيئات الفلوروفور (انظر الخطوة 6.3) لكل عينة باستخدام أي برنامج إحصائي (انظر جدول المواد). تقريب هذا الاعتماد حسب تناسب الخط (تحليل | | التركيب تناسب الخطية). من التقريب في Eq (9) ، احسب عامل التحويل لمتوسط التألق إلى مواقع الربط.
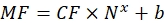 (9)
(9)
حيث MF هو متوسط تألق الخرز عن طريق قياس التدفق الخلوي ؛ Nx هو عدد جزيئات الفلوروفور لكل حبة. يمثل CF عامل تحويل متوسط التألق إلى مواقع الربط. يتم الحصول على CF و b من نتائج تركيب الرسم البياني بالتناسب الخطي. - احسب العدد الظاهري لمواقع الربط لكل حويصلة ذات أهمية باستخدام Eq (10).
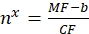 (10)
(10)
حيث nx هو العدد الظاهر لمواقع الربط لكل حويصلة ذات أهمية ؛ MF هو متوسط التألق للحويصلات ذات الأهمية عن طريق قياس التدفق الخلوي. CF و b هما عاملان تحويلان من Eq (8).
النتائج
تستخدم طريقة قياس التدفق الخلوي الموصوفة هنا لتوصيف ارتباط بروتينات تخثر البلازما بالصفائح الدموية المنشطة. بالإضافة إلى ذلك ، تم تطبيق الحويصلات الفوسفاتية PS: PC 20: 80 كنظام نموذجي. تركز هذه الورقة بشكل أساسي على الحويصلات الفوسفاتية الاصطناعية كمثال. يجب اختيار معلمات مقياس الخلايا ، على...
Discussion
يمكن تكييف الطريقة المقترحة للتوصيف التقريبي لتفاعل البروتينات مع أغشية الدهون الفوسفاتية من مصادر وتركيبات مختلفة. يعترف قياس التدفق الخلوي الكمي الموصوف هنا برنين البلازمون السطحي (SPR) في العديد من المعلمات. على وجه الخصوص ، لديها حساسية أقل ودقة زمنية وتتطلب وضع علامات الفلورسنت على ا...
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم المؤلفين بمنحة مؤسسة العلوم الروسية 20-74-00133.
Materials
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
References
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved