需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用定量流式细胞术分析荧光标记蛋白与人工磷脂微泡的相互作用
摘要
在这里,我们描述了一组表征蛋白质与细胞膜或微囊泡相互作用的方法。
摘要
在人体内,大多数涉及免疫反应和血液凝固的主要生理反应都发生在细胞膜上。在任何膜依赖性反应中,重要的第一步是蛋白质在磷脂膜上的结合。已经开发了一种研究蛋白质与脂质膜相互作用的方法,该方法使用荧光标记的蛋白质和流式细胞术。该方法允许使用活细胞和天然或人造磷脂囊泡研究蛋白质 - 膜相互作用。这种方法的优点是试剂和设备的简单性和可用性。在这种方法中,使用荧光染料标记蛋白质。然而,无论是自制的还是市售的荧光标记蛋白都可以使用。与荧光染料偶联后,将蛋白质与磷脂膜源(微泡或细胞)孵育,并通过流式细胞术分析样品。获得的数据可用于计算动力学常数和平衡Kd。此外,可以使用特殊的校准珠来估计磷脂膜上蛋白质结合位点的近似数量。
引言
生物膜将动物细胞的内部内容物和细胞外空间分开。请注意,膜也围绕着细胞生命周期和细胞器期间形成的微囊泡。细胞膜主要由脂质和蛋白质组成。膜蛋白执行信号传导、结构、转运和粘合功能。然而,脂质双层对于动物细胞与细胞外空间的相互关系也是必不可少的。本文提出了一种研究外周蛋白与脂质膜外周相互作用的方法。
在动物细胞的外膜层上发生反应的最引人注目的例子是血液凝固反应。血液凝固的一个重要特征是,所有主要反应都发生在细胞的磷脂膜和从这些细胞产生的微囊泡上,而不是在血浆1,2,3中。膜依赖性反应包括开始凝固的过程(在内皮下,发炎的内皮细胞或活化的免疫细胞的细胞膜上,在组织因子的参与下),主要级联激活因子IX,X,凝血酶原的所有反应;凝血酶激活因子XI(在活化的血小板,红细胞,脂蛋白和微囊泡的膜上);蛋白C途径的反应;凝血酶失活(在内皮细胞膜上,血栓调节素辅因子,内皮蛋白C受体,硫酸乙酰肝素的参与);和接触途径反应(在未知辅助因子的参与下的血小板膜和一些微囊泡上)。因此,如果不研究各种血浆蛋白与血细胞膜的相互作用,就不可能研究血液凝固。
本文描述了一种基于流式细胞术的方法,用于表征蛋白质与细胞或微囊泡脂质膜的相互作用。最初提出这种方法是为了研究血浆与血小板和人造磷脂囊泡的相互作用。此外,大多数研究的蛋白质直接与带负电荷的膜磷脂相互作用,特别是与磷脂酰丝氨酸4,5相互作用。此外,有些蛋白质与膜的相互作用是由特殊受体介导的6。
流式细胞术的一项重要能力是区分游离配体和结合配体,而无需额外分离。细胞术的这一特点允许研究终点处的配体平衡结合,并有助于进行连续的动力学测量。该技术并不复杂,不需要复杂的样品制备。流式细胞术被积极用于定量研究完整和洗涤剂渗透性中性粒细胞中荧光肽,受体和G蛋白之间相互作用的动力学7。该方法也适用于实时探索蛋白质 - DNA相互作用和内切酶活性的动力学8。随着时间的推移,该方法用于定量研究高亲和力蛋白与纯化的脂质囊泡9的相互作用,或者更一般地说,与在高效Sf9细胞表达系统10中表达的膜蛋白相互作用。还描述了使用流式细胞术表征跨膜蛋白11的蛋白质 - 脂质体相互作用的定量方法。
该技术使用自制的校准磁珠,以避免使用市售磁珠7。先前使用的校准微球7 旨在与荧光素一起工作,这大大限制了蛋白质上可接触的荧光配体的分类。此外,本文还提供了一种获取和分析动力学数据的新方法,以实现合理的时间分辨率。尽管该方法被描述为用于人造磷脂囊泡,但其对具有不同脂质组合物的细胞,天然囊泡或人造磷脂囊泡的适应性没有明显的限制。本文描述的方法允许估计相互作用(kon,koff)和平衡(Kd)的参数,并有助于定量表征膜上蛋白质结合位点的数量。请注意,该技术提供了结合位点数量的近似估计值。该方法的优点是其相对简单,可及性以及对天然和人造微泡的适应性。
研究方案
1. 荧光蛋白标记
- 材料准备
- 准备1M碳酸氢钠缓冲液,pH 9.0,将其储存在4°C,并在一周内使用。
- 使用前立即制备1.5M盐酸羟胺缓冲液,pH 8.5。
- 在二甲基亚砜中制备10mg / mL荧光染料溶液(见 材料表)。
注意:该溶液可以在-20°C的黑暗中储存一个月。 - 以1-10mg / mL制备纯化的抗体或其他蛋白质的溶液。
注意:避免使用含有铵离子或伯胺的缓冲液。通过透析将含有Tris或甘油的缓冲液替换为磷酸盐缓冲盐水(PBS)。叠氮化钠(≤3 mM)和硫柳汞(≤1 mM)都不会显着影响偶联反应。 - 在室温下或在PBS中孵育2小时或在60°C下孵育2小时以进行蛋白质纯化。 将凝胶过滤介质涂覆到具有0.2μm膜的离心柱上。
- 根据要标记的蛋白质浓度,使用等式(1)计算每个反应要使用的活性染料的量。
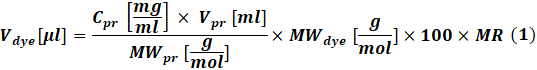
其中V染料 是染料原液的体积;Cpr,Vpr 和MWpr 是蛋白质的浓度,体积和摩尔重量;MW染料 是染料的摩尔重量;100是单位换算系数;MR是反应混合物中染料与蛋白质的摩尔比。
注意:对于IgG标记反应,建议使用以下MER:如果抗体为1-3 mg / mL,则MR = 40,如果抗体为4-10 mg / mL,则MR = 30。对于凝血因子,通常使用 MR = 5。 - 偶联反应
- 在反应管中,将蛋白质溶液与10x体积的1M碳酸氢盐溶液混合。
- 加入所需量的荧光染料(见步骤1.2),连续搅拌。
- 将反应混合物在室温下孵育约1小时,避光并连续搅拌。
- 对于每200μL蛋白质溶液,加入5μL1.5M盐酸羟胺。
- 将反应混合物在室温下孵育约30分钟,避光并连续搅拌。
- 准备离心柱。
- 向色谱柱中加入500μL凝胶过滤培养基以进行蛋白质纯化。将色谱柱以1,000× g离心3分钟。
- 丢弃收集管中的缓冲液。如果色谱柱未满,则加入更多的凝胶过滤培养基,并在1,000× g下离心色谱柱3分钟。重复此步骤,直到列已满。
- 纯化
- 将反应混合物(从步骤1.3.5开始)在17,000× g 下离心5分钟并除去沉淀物。
- 将上清液转移到带有凝胶过滤介质的离心柱中。让溶液吸收到凝胶床上。
- 使用离心柱的空收集管,并在1,000× g下离心5分钟。离心后,从收集管中收集标记的蛋白质。
- 标签程度的确定
- 通过测量游离染料在280nm处的吸光度(A 280)和染料的λ最大值(A max)来校正染料对A 280处吸光度的贡献(参见等式(2))。
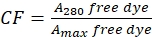 (二)
(二) - 测量蛋白质 - 染料偶联物在280nm(A280)处的吸光度和染料的 λ最大值 (Amax),并使用Eq(3)计算蛋白质浓缩。
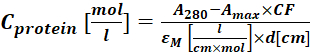 (三)
(三)
其中εM 是蛋白质在280nm处的摩尔消光系数; d 是测量吸光度期间的光程长度; CF 是染料对A280 处的吸光度的贡献(步骤1.6.1)。 - 使用等式 (4) 计算标记程度 (DOL)。
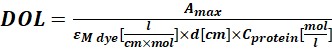 (四)
(四)
其中εM染料是染料在λmax nm处的摩尔消光系数;d是测量吸光度期间的光程长度;C蛋白是蛋白质的浓度(步骤1.6.2)。
- 通过测量游离染料在280nm处的吸光度(A 280)和染料的λ最大值(A max)来校正染料对A 280处吸光度的贡献(参见等式(2))。
2. 磷脂囊泡的制备
- 脂质混合物的制备和储存
- 以适当的比例组合脂质(磷脂酰丝氨酸/磷脂酰胆碱以20摩尔%至80摩尔的比例)。
- 冻干或蒸发后干燥脂质混合物,并将其储存在玻璃安瓿中的惰性气氛下。
- 脂质膜生产
- 打开安瓿,将脂质混合物重悬于少量(〜100μL)氯仿中。
注意:不要使用过多的氯仿,因为它不会完全蒸发。 - 在乙醇中加入二IC16(3)以0.2摩尔%的比例加入乙醇中。将脂质混合物转移到圆底烧瓶中。通过旋转将混合物薄薄地铺在烧瓶的两侧。在氩气流下干燥脂质混合物30分钟。
- 打开安瓿,将脂质混合物重悬于少量(〜100μL)氯仿中。
- 脂质混合物的水合作用
- 向烧瓶中加入适当温热(〜55°C)的水性缓冲液(HEPES 20 mM,NaCl 140 mM,pH 7.4),其体积对应于预期的脂质浓度。将混合物在55°С下涡旋孵育30分钟以完全水合。
- 将样品管置于冰箱或温控器中,使脂质悬浮液经历3-5次冻融循环。
- 通过挤压形成脂质囊泡
- 根据制造商的说明准备挤出机。将所有挤出机组分加热到脂质混合物的相变温度。
- 用水合脂质混合物填充其中一个挤出机注射器。等待5-10分钟,使脂质悬浮液的温度与挤出机的温度平衡。
- 将脂质混合物通过膜挤出至少10次。对于最终挤出,将脂质悬浮液置于备用注射器中,并寻找外观从略微模糊到透明溶液的变化。
- 将所得脂质囊泡混合物储存在4°C,优选在氩气或氮气的惰性气氛中,3-4天。不要冷冻。
3. 从全血中分离血小板
- 从含有3.2%柠檬酸钠的管中收集健康献血者的全血。
- 向血液中加入前列腺素E1(PGE1)(1μM)和吡喃酶(0.1U / mL),然后在室温下以100× g 离心8分钟。
- 离心后,取富含血小板的血浆,加入柠檬酸钠溶液(106mM,pH 5.5)至血浆/柠檬酸盐比例为3:1。在室温下以400× g 离心血浆5分钟。
- 除去上清液,并将沉淀重悬于300μL无BSA的Tyrode缓冲液中(20mMHEPES,150mM氯化钠,2.7mMKCl,1mMMgCl2,0.4mM NaH2PO4,2.5mM CaCl2,5mM葡萄糖,pH 7.4)。通过在凝胶过滤介质上进行凝胶色谱纯化血浆蛋白中的血小板以进行血小板纯化(参见 材料表)。
4. 通过流式细胞术检测蛋白质 - 脂质相互作用
- 动力学结合实验
- 将稀磷脂囊泡(从步骤2.4.4开始)在Tyrode缓冲液(20 mM HEPES,150 mM氯化钠,2.7mM氯化钾,1mMMgCl2,0.4mM NaH2PO4,2.5 mM CaCl2,5mM葡萄糖,0.5%BSA,pH 7.4)中,浓度为1μM,总体积为250μL。
- 将步骤1中的荧光标记凝血因子X(fX-fd)以500nM的浓度与步骤4.1.1中的磷脂囊泡以1:1的比例混合(最终囊泡浓度0.5μM,fX-fd浓度为fX的250nM)至总体积为500μL。
- 立即将500μL混合悬浮液(约20分钟以低流速进行分析)注入流式细胞仪。使用低流速,并确保通道FL2的阈值(激发488 nm,发射滤光片585/42 nm)为值200。从 材料表中测量荧光染料在通道FL4(激发633nm,发射滤光片660/20)中的平均荧光。
注意:选择不带自动进样器的细胞仪。这将加快将样品注入测量池的过程。 - 当达到结合饱和度(5分钟内荧光没有显着增加)时,用Tyrode缓冲液快速稀释样品20倍,并监测解离,直到达到基线荧光(完全解离)或直到达到平台(5分钟内荧光没有显着降低)。
注意:作为对照,加入10μM EDTA并监测完全解离5分钟。
- 平衡结合实验
注:使用结合的动力学曲线确定达到饱和的时间;fX-fd和人造囊泡的饱和时间为20分钟。- 在Tyrode的缓冲液中孵育具有不同浓度fX-fd(从0到1,000nM)的结合测定的人造磷脂囊泡(5μM)用于结合测定。
- 用Tyrode缓冲液将每个样品从步骤4.2.1稀释20x至最终体积200μL。立即在30秒内通过流式细胞术分析稀释的样品。使用步骤 4.1.3 中的设置。
注意:作为非特异性结合的对照,使用具有EDTA(10μM)的类似样品并将其孵育5分钟。
5. 流式细胞术数据分析
- 将FSC格式的实验从细胞仪数据采集软件导出到细胞仪软件进行数据分析(参见 材料表)。选择 文件|导出|FCS 文件。通过在计算机上选择文件并将其拖动到程序的工作区,在细胞仪软件中打开FSC文件以进行数据分析。
- 对于微囊泡的门控,通过亲脂性染料DiIC16(3)的荧光鉴定微泡泡的区域。使用工作表中的菜单命令或 绘图 按钮从对数坐标中的FL2(染料DilC16(3))创建点图SSC。选择" 矩形门 "按钮以绘制一个门控区域,以便该区域中不包含来自没有囊泡的样品的事件(图1B,C)。
- 分析动力学实验。
- 使用荧光坐标 (FL4) 创建囊泡区域随时间变化的点阵图(在步骤 5.2 中双击囊泡区域)
- 以csv格式导出荧光随时间变化的数据。 选择示例|右键单击|导出|在参数|中选择 FL4 和 时间选择要保存|的目录选择 CSV 格式|导出。
- 在任何统计软件中打开CSV文件(参见 材料表)。计算每 1,000 个事件的荧光和时间的简单移动平均值。
- 在指数依赖性假设下近似简单移动平均荧光对时间的依赖性图(分析>拟合>非线性曲线拟合),并使用它来计算使用等式(5)的动力学关联常数。
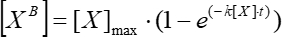 (5)
(5)
其中 [XB] 是每个时刻(用户定义的单位)的边界因子浓度,根据步骤5.3.3的简单移动平均线; [X] 是添加因子浓度; [X]最大值 是最大束缚因子浓度; k 是关联常数; t 是时间。 - 重复同一组动作 (5.3.1-5.3.4) 以使用等式 (6) 计算动能解离常数。
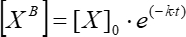 (6)
(6)
其中 [XB] 是每个时刻的束缚因子浓度; [X]0 是初始时刻的束缚因子浓度; k 是解离常数; t 是时间。
- 平衡结合试验
- 确定每个选定浓度的fX-fd在囊泡区域中fX-fd的平均荧光。
- 在简单单位点结合的假设中,从添加因子的浓度近似于结合因子荧光的依赖性。使用Eq(7)从至少三个独立的重复中计算平均结合参数。
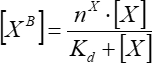 (7)
(7)
其中 [XB] 是束缚因子浓度;[X]是添加因子浓度; nx是每个囊泡的结合位点的表观数量; Kd 是明显的解离常数。
6. 将荧光强度转换为平均结合位点数
- 准备经过校准的磁珠。
- 在CaCl 2(2.5mM)存在下,将凝胶过滤的血小板(参见步骤3.3)与A23187 (10μM)在室温下孵育10分钟。
- 将各种浓度的fX-fd(0至1,000 nM)添加到活化的血小板中。加入2%v / v甲醛并孵育1小时。通过在室温下用3M甘氨酸和5%BSA孵育血小板30分钟来停止反应。
- 从未反应的染料中纯化混合物。在400× g下离心血小板5分钟,除去上清液,并将沉淀重悬于Tyrode缓冲液(含有0.5%BSA)中。
注意:重复步骤 6.1.3 三次。
- 首先使用分光荧光计测量每个样品中校准微球的荧光水平(对于 材料表中的荧光染料,激发633 nm,发射670 nm),然后使用流式细胞仪(在通道FL4中:激发633 nm,发射滤光片660/20)。使用细胞计数器,确定每个样品中的磁珠数量。
- 使用分光荧光计将每个相应磁珠样品的荧光强度转换为可溶性荧光染料的浓度。使用等式(8)重新计算荧光团分子数量的荧光染料浓度。
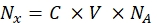 (8)
(8)
其中 Nx 是荧光团分子的数量; C 为荧光染料浓度; NA 是阿伏伽德罗常数; NA = 6.02214076×1023 摩尔 -1。 - 使用任何统计软件(参见 材料表),在流式细胞仪(步骤6.2)中创建每个样品的荧光珠平均荧光对每个样品的荧光团分子数量的依赖性图(参见步骤6.3)。通过线比例近似这种依赖性(分析|配件|拟合线性)。根据等式(9)中的近似值,计算平均荧光到结合位点的转换因子。
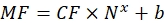 (9)
(9)
其中MF是通过流式细胞术对磁珠的平均荧光;Nx是每个磁珠的荧光团分子数;CF表示平均荧光到结合位点的转换因子。CF 和 b 是从按线性比例拟合图形的结果中获得的。 - 使用Eq(10)计算每个感兴趣囊泡的表观结合位点数。
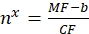 (10)
(10)
其中nx是每个感兴趣囊泡的明显结合位点数;MF是通过流式细胞术感兴趣的囊泡的平均荧光;CF 和 b 是来自等式 (8) 的转换因子。
结果
本文描述的流式细胞术方法用于表征血浆凝固蛋白与活化血小板的结合。此外,还应用磷脂囊泡PS:PC 20:80作为模型系统。本文主要以人工磷脂囊泡为例。必须为每个特定设备,研究对象(细胞,人造或天然微囊泡)和使用的染料选择细胞仪的参数,特别是光电倍增管(PMT)电压和补偿。 图1B,C 显示了用掺入的亲脂性荧光染料DiIC16(3)浇口〜1μm大小的人造磷脂?...
讨论
所提出的方法可以适用于蛋白质与来自各种来源和组合物的磷脂膜相互作用的粗略表征。这里描述的定量流式细胞术在几个参数上承认表面等离子体共振(SPR)。特别是,它具有较低的灵敏度和时间分辨率,并且需要蛋白质的荧光标记。荧光标记可导致许多蛋白质的构象变化和活性损失,因此需要仔细控制。但是,这种技术比其他技术具有显着的优势。这种方法提供了探索蛋白质与天然细胞膜相?...
披露声明
作者没有利益冲突要披露。
致谢
作者得到了俄罗斯科学基金会拨款20-74-00133的支持。
材料
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
参考文献
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。