JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
정량적 유세포 분석기를 사용하여 형광 표지 단백질과 인공 인지질 마이크로베시클의 상호작용 분석
요약
여기에서, 우리는 세포 또는 마이크로베시클의 막과 단백질의 상호작용을 특성화하기 위한 일련의 방법을 기술한다.
초록
인체에서 면역 반응 및 혈액 응고에 관여하는 대부분의 주요 생리 반응은 세포막에서 진행됩니다. 임의의 막 의존성 반응에서 중요한 첫 번째 단계는 인지질 막에 단백질의 결합이다. 지질막과의 단백질 상호작용을 연구하는 접근법은 형광 표지된 단백질과 유세포 분석기를 사용하여 개발되었다. 이 방법은 살아있는 세포와 천연 또는 인공 인지질 소포를 이용한 단백질-막 상호작용의 연구를 허용한다. 이 방법의 장점은 시약 및 장비의 단순성과 가용성입니다. 이 방법에서, 단백질은 형광 염료를 사용하여 표지된다. 그러나, 자가제조 및 상업적으로 입수가능한, 형광 표지된 단백질 둘 모두가 사용될 수 있다. 형광 염료와 컨쥬게이션 한 후, 단백질은 인지질 막 (마이크로베시클 또는 세포)의 공급원과 함께 인큐베이션되고, 샘플은 유세포 분석기에 의해 분석된다. 획득된 데이터는 운동 상수 및 평형Kd를 계산하는데 사용될 수 있다. 또한, 특수 교정 비드를 사용하여 인지질 막 상의 단백질 결합 부위의 대략적인 수를 추정할 수 있다.
서문
생물막은 동물 세포와 세포외 공간의 내부 내용물을 분리합니다. 막은 또한 세포의 수명주기와 소기관 동안 형성된 마이크로베시클을 둘러싸고 있습니다. 세포막은 주로 지질과 단백질로 구성되어 있습니다. 막 단백질은 신호전달, 구조, 수송 및 접착 기능을 수행합니다. 그러나, 지질 이중층은 또한 동물 세포와 세포외 공간의 상호관계에 필수적이다. 이 논문은 외부 단백질과 지질막의 말초 상호작용을 연구하는 방법을 제안한다.
동물 세포의 외막층에서 일어나는 반응의 가장 두드러진 예는 혈액 응고 반응이다. 혈액 응고의 중요한 특징은 모든 주요 반응이 혈장 1,2,3이 아닌 이들 세포로부터 발생하는 세포 및 마이크로베시클의 인지질 막에서 진행된다는 것입니다. 막-의존성 반응은 (조직 인자의 참여와 함께 침강하피, 염증 내피, 또는 활성화된 면역 세포의 세포막 상에서) 응고를 시작하는 과정을 포함하며, 주요 캐스케이드의 모든 반응-인자 IX, X, 프로트롬빈의 활성화; 트롬빈에 의한 인자 XI의 활성화 (활성화된 혈소판, 적혈구, 지단백질 및 마이크로베시클의 막상); 단백질 C 경로의 반응; 응고 효소의 불활성화 (트롬보모듈린 보조인자, 내피 단백질 C 수용체, 헤파란 설페이트의 참여와 함께 내피 세포의 막에); 및 접촉 경로 반응 (혈소판의 막과 알려지지 않은 보조 인자의 참여가있는 일부 미생물에). 따라서, 다양한 혈장 단백질과 혈액 세포의 막의 상호작용을 연구하지 않고서는 혈액 응고를 조사하는 것은 불가능하다.
이 논문은 세포 또는 마이크로베시클의 지질막과 단백질의 상호작용을 특성화하기 위한 유동-세포측정-기반 방법을 기술한다. 이 접근법은 혈소판 및 인공 인지질 소포와 혈장의 상호 작용을 연구하기 위해 처음에 제안되었다. 더욱이, 연구된 대부분의 단백질은 음전하를 띤 막 인지질, 특히 포스파티딜세린 4,5와 직접 상호작용한다. 추가적으로, 막과의 상호작용이 특별한 수용체6에 의해 매개되는 단백질이 있다.
유세포 분석의 중요한 능력은 추가적인 분리 없이 자유 리간드와 결합된 리간드를 구별하는 것이다. 세포측정의 이러한 특징은 종점에서 리간드 평형 결합에 대한 연구를 허용하고 지속적인 동역학적 측정을 수행하는 데 도움이 된다. 이 기술은 정교하지 않으며 복잡한 샘플 준비가 필요하지 않습니다. 유세포 분석기는 무손상 및 세제-투과성 호중구7에서 형광 펩티드, 수용체 및 G-단백질 사이의 상호작용의 역학을 정량적으로 연구하기 위해 활발히 사용된다. 이 접근법은 단백질-DNA 상호작용 및 엔도뉴클레아제 활성의 동역학을 실시간으로 탐구하는 데에도 적용 가능하다8. 시간이 지남에 따라, 이 방법은 정제된 지질 소포(9)와의 고친화성 단백질-단백질 상호작용, 또는 보다 일반적으로는 고효율Sf9 세포 발현 시스템(10)에서 발현되는 막 단백질과의 상호작용을 정량적으로 연구하는데 사용되었다. 막횡단 단백질(11)에 대한 유세포 분석기를 이용한 단백질-리포좀 상호작용을 특성화하기 위한 정량적 방법도 기술되었다.
이 기술은 상업적으로 이용가능한 비드(7)를 사용하지 않기 위해 자체 제작된 교정 비드를 사용한다. 이전에7 번 사용된 교정 비드는 플루오레세인과 함께 작동하도록 의도되었으며, 이는 단백질 상의 접근 가능한 형광 리간드의 구색을 실질적으로 제한하였다. 또한이 백서에서는 합리적인 시간 해결을 위해 운동 데이터를 수집하고 분석하는 새로운 방법을 제공합니다. 이 방법이 인공 인지질 소포에 대해 기술되어 있지만, 다른 지질 조성을 갖는 세포, 천연 소포 또는 인공 인지질 소포에 대한 그의 적응성에 대한 명백한 제한은 없다. 본원에 기재된 방법은 상호작용 파라미터 (kon,koff) 및 평형 (Kd)의 추정을 허용하고, 막 상의 단백질 결합 부위의 수의 정량적 특성화를 용이하게 한다. 이 기술은 결합 부위의 수에 대한 대략적인 추정치를 제공한다는 점에 유의한다. 이 방법의 장점은 천연 세포와 천연 및 인공 미생물에 대한 상대적 단순성, 접근성 및 적응성입니다.
프로토콜
1. 형광 단백질 표지
- 재료 준비
- 1 M 중탄산나트륨 완충액, pH 9.0을 준비하고 4°C에서 보관하고 1주일 이내에 사용한다.
- 사용 직전에 1.5 M 하이드록실아민 염산염 완충액, pH 8.5를 준비하십시오.
- 디메틸설폭사이드에 형광염료 10mg/mL 용액( 물질표 참조)을 준비한다.
참고 :이 용액은 어둠 속에서 -20 ° C에서 한 달 동안 저장할 수 있습니다. - 정제 된 항체 또는 다른 단백질의 용액을 1-10 mg / mL로 준비하십시오.
참고: 암모늄 이온 또는 일차 아민을 포함하는 완충제는 피하십시오. 트리스 또는 글리세롤을 함유하는 완충제를 투석에 의해 포스페이트 완충 식염수 (PBS)로 대체한다. 아지드 나트륨 (≤3 mM) 또는 티메로살 (≤1 mM)은 접합 반응에 유의하게 영향을 미치지 않습니다. - 단백질 정제를 위해 겔 여과 배지 ( 물질의 표 참조)를 실온에서 하룻밤 동안 또는 60°C에서 2시간 동안 PBS에서 인큐베이션한다. 겔 여과 배지를 0.2 μm 멤브레인이 있는 스핀 컬럼 상에 적용한다.
- Eq (1)을 사용하여 표지되는 단백질의 농도에 따라 각 반응에 사용되는 반응성 염료의 양을 계산한다.
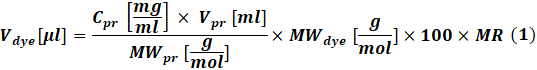
여기서 V 염료는염료 원액의 부피이고; Cpr, Vpr 및MWpr은 단백질의 농도, 부피 및 몰 중량이고; MW염료는 염료 몰 중량이고; 100은 단위 변환 인자이고; 100 is a unit conversion factor; MR은 반응 혼합물 중의 염료 대 단백질의 몰비이다.
참고: IgG 표지 반응에는 다음 MR이 권장됩니다: 항체가 1-3 mg/mL인 경우 MR = 40, 항체가 4-10 mg/mL인 경우 MR = 30. 응고 인자의 경우 일반적으로 MR = 5가 사용됩니다. - 접합 반응
- 반응 튜브에서, 단백질 용액을 10x 더 낮은 부피의 1 M 중탄산염 용액과 혼합한다.
- 필요한 양의 형광 염료를 첨가하고(단계 1.2 참조) 연속 교반한다.
- 반응 혼합물을 실온에서 약 1시간 동안 인큐베이션하고, 빛으로부터 보호하고, 연속 교반한다.
- 각 200 μL의 단백질 용액에 대해, 5 μL의 1.5 M 히드록실아민 히드로클로라이드를 첨가한다.
- 반응 혼합물을 실온에서 약 30분 동안 인큐베이션하고, 빛으로부터 보호하고, 연속 교반한다.
- 스핀 컬럼을 준비합니다.
- 단백질 정제를 위해 500 μL의 겔 여과 배지를 컬럼에 첨가한다. 컬럼을 1,000 × g에서 3분 동안 원심분리한다.
- 수집 튜브에서 버퍼를 버립니다. 컬럼이 가득 차 있지 않으면, 겔 여과 배지를 더 첨가하고, 컬럼을 1,000 × g에서 3분 동안 원심분리한다. 열이 꽉 찰 때까지 이 단계를 반복합니다.
- 정화
- 반응 혼합물을 17,000 × g 에서 5분 동안 원심분리하고(단계 1.3.5로부터) 침전물을 제거하였다.
- 상청액을 겔 여과 배지로 스핀 컬럼으로 옮긴다. 용액이 겔 베드에 흡수되도록 허용하십시오.
- 스핀 컬럼에 빈 수집 튜브를 사용하고 1,000 × g에서 5 분 동안 원심 분리하십시오. 원심분리 후, 표지된 단백질을 수집 튜브로부터 수집한다.
- 라벨링 정도에 대한 결정
- 280 nm에서 자유 염료의 흡광도 (A280) 및 염료 (Amax)에 대한 λmax (Amax)를 측정함으로써 A280에서의 흡광도에 대한 염료의 기여도를 정확하게한다 (Eq (2) 참조).
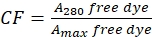 (2)
(2) - 280 nm에서 단백질-염료 접합체의 흡광도 (A280) 및 염료에 대한 λmax (Amax)를 측정하고 Eq (3)를 사용하여 단백질 컨세레이션을 계산한다.
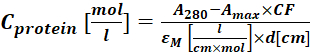 (3)
(3)
여기서 εM 은 280 nm에서의 단백질의 몰 흡광 계수이고; d 는 흡광도의 측정 동안의 광 경로 길이이고; CF 는A280 에서의 흡광도에 대한 염료의 기여도이다(단계 1.6.1). - Eq (4)를 사용하여 라벨링 정도 (DOL)를 계산하십시오.
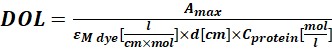 (4)
(4)
여기서 εM 염료는λmax nm에서의 염료의 몰 흡광 계수이고; d는 흡광도의 측정 동안의 광 경로 길이이고; C단백질은 단백질의 농도이다(단계 1.6.2).
- 280 nm에서 자유 염료의 흡광도 (A280) 및 염료 (Amax)에 대한 λmax (Amax)를 측정함으로써 A280에서의 흡광도에 대한 염료의 기여도를 정확하게한다 (Eq (2) 참조).
2. 인지질 소포의 제조
- 지질 혼합물의 제조 및 저장
- 지질을 적절한 비율 (포스파티딜세린/포스파티딜콜린을 20몰% 내지 80몰%의 비율로 결합한다).
- 동결건조 또는 증발 후 지질 혼합물을 건조시키고 유리 앰플에 불활성 분위기 하에 보관한다.
- 지질 필름 생산
- 앰플을 열고, 지질 혼합물을 소량의 클로로포름(∼100 μL)으로 재현탁시킨다.
참고: 클로로포름이 완전히 증발하지 않으므로 너무 많이 사용하지 마십시오. - DiIC16(3)을 0.2몰%의 에탄올에 첨가한다. 지질 혼합물을 둥근 바닥 플라스크로 옮긴다. 혼합물을 회전시켜 플라스크의 측면 위로 얇게 퍼뜨립니다. 지질 믹스를 아르곤 스트림 하에서 30분 동안 건조시킨다.
- 앰플을 열고, 지질 혼합물을 소량의 클로로포름(∼100 μL)으로 재현탁시킨다.
- 지질 혼합물의 수화
- 지질 막이 있는 플라스크에 예상된 지질 농도에 상응하는 부피의 적절하게 가온된(∼55°C) 수성 완충액(HEPES 20 mM, NaCl 140 mM, pH 7.4)을 첨가한다. 혼합물을 완전한 수화를 위해 30분 동안 55°C에서 볼텍싱하면서 인큐베이션한다.
- 샘플 튜브를 냉동고 또는 따뜻한 온도 조절기에 배치하여 지질 현탁액을 3-5 동결-해동 사이클을 거치게 한다.
- 압출에 의한 지질 소포의 형성
- 제조업체의 지침에 따라 압출기를 준비하십시오. 모든 압출기 성분을 지질 혼합물의 상전이 온도로 예열한다.
- 압출기 주사기 주사기 중 하나를 수화된 지질 혼합물로 채운다. 지질 현탁액의 온도가 압출기의 온도와 평형화될 때까지 5-10분 동안 기다린다.
- 지질 혼합물을 멤브레인을 통해 적어도 10 번 압출하십시오. 최종 압출을 위해, 지질 현탁액을 대체 주사기에 놓고 약간 성운에서 명확한 용액으로 외관의 변화를 찾으십시오.
- 생성된 지질 소포의 혼합물을 4°C, 바람직하게는 아르곤 또는 질소의 불활성 분위기에서, 3-4일 동안 저장한다. 얼지 마십시오.
3. 전혈에서 혈소판의 분리
- 3.2 % 구연산 나트륨을 함유 한 튜브의 건강한 기증자로부터 전혈을 수집하십시오.
- 프로스타글란딘 E1 (PGE1) (1 μM) 및 아피라제 (0.1 U / mL)를 혈액에 첨가 한 다음 실온에서 100 × g 에서 8 분 동안 원심분리하십시오.
- 원심분리 후, 혈소판이 풍부한 혈장을 취하여 구연산나트륨 용액 (106 mM, pH 5.5)을 3:1의 혈장 / 시트레이트 비율로 첨가하십시오. 플라즈마를 실온에서 400 × g 에서 5분 동안 원심분리한다.
- 상청액을 제거하고, 펠렛을 BSA 없이 300 μL의 티로데스 완충액에 재현탁시켰다 (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl2, 0.4 mM NaH2PO4, 2.5 mM CaCl2, 5 mM 글루코스, pH 7.4). 혈소판 정제를 위한 겔 여과 배지 상의 겔 크로마토그래피에 의해 혈장 단백질로부터 혈소판을 정제한다(물질의 표 참조).
4. 단백질의 검출 - 유세포 분석기에 의한 지질 상호 작용
- 운동 결합 실험
- 인지질 소포를 티로데스 완충액 (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl2, 0.4 mM NaH2PO4,2.5mM CaCl2, 5 mM 글루코스, 0.5% BSA, pH 7.4)에 희석하여 1 μM의 농도 및 250 μL의 총 부피를 가한다.
- 단계 1로부터의 형광 표지된 응고 인자 X(fX-fd)를 단계 4.1.1로부터의 인지질 소포와 함께 500 nM의 농도에서 1:1의 비(최종 소포 농도 0.5 μM, fX-fd 농도는 fX의 fX-fd 농도 250 nM)로 총 부피 500 μL로 혼합한다.
- 500 μL의 혼합 현탁액을 즉시 주입하고(낮은 유동 속도로 분석을 위해 ∼20분) 유동 세포계에 주입한다. 낮은 유량을 사용하고 채널 FL2(exсitation 488nm, 방출 필터 585/42nm)의 임계값이 값 200인지 확인합니다. 표 물질로부터 형광 염료에 대한 채널 FL4 (exсitation 633 nm, 방출 필터 660/20)에서 평균 형광을 측정하였다.
참고: 자동 시료 주입기가 없는 세포계를 선택하십시오. 이렇게하면 측정 셀에 샘플을 주입하는 과정이 빨라집니다. - 결합의 포화가 달성되면(5분 이내에 형광의 유의한 증가 없음), 샘플을 Tyrode의 완충액으로 20배 빠르게 희석하고, 기준선 형광에 도달할 때까지(완전한 해리) 또는 고원에 도달할 때까지(5분 이내에 형광의 현저한 감소 없음) 해리를 모니터링한다.
참고: 대조군으로 10μM EDTA를 추가하고 5분 동안 완전한 해리를 모니터링합니다.
- 평형 결합 실험
참고: 채도에 도달하는 시간을 결정하기 위해 결합의 운동 곡선을 사용하십시오. fX-fd 및 인공 소포의 포화 시간은 20 분입니다.- 결합 분석을 위해 인공 인지질 소포 (5 μM)를 20분 동안 티로데의 완충액에서 fX-fd (0 내지 1,000 nM)의 상이한 농도로 인큐베이션한다.
- 단계 4.2.1의 각 샘플을 Tyrode's 완충액으로 200 μL의 최종 부피로 20x씩 희석한다. 희석된 샘플을 30초 이내에 유세포 분석기로 즉시 분석한다. 4.1.3단계의 설정을 사용합니다.
참고: 비특이적 결합에 대한 대조군으로서 EDTA(10μM)와 유사한 샘플을 사용하고 5분 동안 배양하십시오.
5. 유세포 분석 데이터 분석
- FSC 형식의 실험을 세포측정 데이터 수집 소프트웨어에서 데이터 분석을 위한 세포계 소프트웨어로 내보냅니다( 자료표 참조). 파일 | 선택 | 내보내기 FCS 파일. 컴퓨터에서 파일을 선택하고 프로그램의 작업 공간으로 드래그하여 데이터 분석을 위해 세포계 소프트웨어에서 FSC 파일을 엽니 다.
- 마이크로베시클의 게이팅을 위해, 친유성 염료 DiIC16(3)의 형광에 의해 마이크로베시클의 영역을 확인한다. 워크시트의 메뉴 명령이나 플롯 단추를 사용하여 로그 좌표의 FL2(염료 DilC16(3))에서 점도표 SSC를 만듭니다. 직사각형 게이트(Rectangular Gate) 단추를 선택하여 소포가 없는 샘플의 이벤트가 이 영역에 포함되지 않도록 게이팅 영역을 그립니다(그림 1B,C).
- 운동 실험을 분석합니다.
- 소포의 영역에 대해 시간에 따른 형광 좌표(FL4)를 사용하여 점도표 만들기(단계 5.2에서 소포 영역을 두 번 클릭)
- 시간에 따른 형광 변화에 대한 데이터를 csv 형식으로 내보냅니다. 샘플 | 선택 마우스 오른쪽 버튼으로 클릭하| | 내보내기 FL4 및 매개 변수에서 시간을 선택하| |를 저장할 디렉토리 선택 CSV 형식 선택 | 내보내기.
- 통계 소프트웨어에서 CSV 파일을 엽니다( 자료 표 참조). 1,000개의 사건마다 형광과 시간의 간단한 이동 평균을 계산합니다.
- 지수 의존성 (분석 > 피팅 >비선형 곡선 적합)의 가정하에 시간에 대한 단순 이동 평균 형광의 의존성에 대한 그래프를 근사화하고 이것을 사용하여 Eq (5)를 사용하여 운동 연관 상수를 계산합니다.
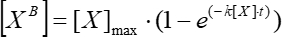 (5)
(5)
여기서 [VB]는 단계 5.3.3으로부터의 단순 이동 평균에 따른 각 시점(사용자 정의 단위)에서의 결합인자 농도이고; [X]는 첨가된 인자 농도이고; [X]max는 최대 결합 인자 농도이고; k는 연관 상수이고; t는 시간입니다. - 동일한 작업 집합(5.3.1-5.3.4)을 반복하여 Eq(6)를 사용하여 운동 해리 상수를 계산합니다.
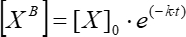 (6)
(6)
여기서 [VB]는 각 순간의 결합 인자 농도이고; [X]0은 초기 시점에서의 결합 인자 농도이고; k는 해리 상수이고; t는 시간입니다.
- 평형 결합 분석
- fX-fd의 각 선택된 농도에 대한 소포의 영역에서 fX-fd의 평균 형광을 결정한다.
- 단순한 단일 부위 결합의 가정하에 첨가된 인자의 농도로부터 형광 결합 인자의 의존성을 근사화한다. 최소한 세 개의 독립적인 반복으로부터 Eq(7)를 사용하여 평균 결합 파라미터를 계산한다.
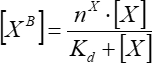 (7)
(7)
여기서 [VB]는 결합 인자 농도이고; [X]는 첨가된 인자 농도이고; nx는 소포 당 결합 부위의 겉보기 수이고; Kd는 겉보기 해리 상수이다.
6. 형광 강도를 평균 결합 부위 수로 변환
- 보정된 비드를 준비합니다.
- 겔-여과된 혈소판(단계 3.3 참조)을 실온에서 10분 동안 CaCl2(2.5 mM)의 존재 하에 A23187(10 μM)과 함께 인큐베이션한다.
- 활성화된 혈소판에 다양한 농도의 fX-fd (0 내지 1,000 nM)를 첨가한다. 2% v/v 포름알데히드를 첨가하고 1시간 동안 배양한다. 혈소판을 실온에서 30분 동안 3 M 글리신 및 5% BSA로 인큐베이션함으로써 반응을 중지시킨다.
- 미반응 염료로부터 혼합물을 정제한다. 혈소판을 400 × g에서 5분 동안 원심분리하고, 상청액을 제거하고, 펠렛을 티로데스 완충액 (0.5% BSA 함유)에 재현탁시켰다.
참고: 6.1.3단계를 세 번 반복하십시오.
- 각 샘플에서 교정 비드의 형광 수준을 먼저 분광형광계( 표 재료의 형광 염료, 여기 633 nm, 방출 670 nm)를 사용한 다음 유세포 분석기(채널 FL4: 여기 633 nm, 방출 필터 660/20)를 사용하여 측정한다. 세포 계수기를 사용하여 각 샘플에서 비드의 수를 결정합니다.
- 분광형광계를 이용하여 각 비드 시료의 형광 강도를 가용성 형광염료의 농도로 변환한다. Eq (8)를 사용하여 형광단 분자의 수에 대한 형광 염료 농도를 재계산하십시오.
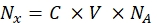 (8)
(8)
여기서 Nx는 형광단 분자의 수이고; C는 형광염료 농도이고; NA는 아보가드로 상수이고; NA = 6.02214076×1023 몰-1. - 임의의 통계적 소프트웨어를 사용하여 각 샘플에 대한 형광단 분자의 수(단계 6.3 참조)에 대한 유동 세포계(단계 6.2)에서 비드의 평균 형광에 대한 의존성 그래프를 생성 한다(물질의 표 참조). 이 의존성을 선 비례성으로 근사화(분석 | 피팅 | 선형으로 맞춥니다). Eq (9)에서의 근사치로부터, 평균 형광의 결합 부위로의 전환 인자를 계산한다.
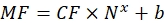 (9)
(9)
여기서 MF는 유세포 분석기에 의한 비드의 평균 형광이고; Nx는 비드 당 형광단 분자의 수이고; CF는 결합 부위로의 평균 형광의 전환인자를 나타낸다. CF 및 b는 선형 비례에 의해 그래프를 피팅한 결과로부터 얻어진다. - Eq(10)를 사용하여 관심 소포당 결합 부위의 겉보기 수를 계산한다.
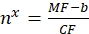 (10)
(10)
여기서 nx는 관심 소포 당 결합 부위의 겉보기 수이고; MF는 유세포 분석기에 의한 관심있는 소포의 평균 형광이고; CF 및 b는 Eq(8)로부터의 변환 인자이다.
결과
본원에 기재된 유세포 분석 방법은 활성화된 혈소판에 대한 혈장 응고 단백질의 결합을 특성화하기 위해 사용된다. 또한, 인지질 소포 PS:PC 20:80을 모델 시스템으로 적용하였다. 이 논문은 주로 인공 인지질 소포를 예로 들어 초점을 맞춥니다. 세포계의 파라미터, 특히, 광승수 튜브 (PMT) 전압 및 보상은 각각의 특정 장치, 연구 목적 (세포, 인공 또는 천연 마이크로베시클) 및 사용된 염료에 대해 선?...
토론
제안된 방법은 다양한 공급원 및 조성물로부터의 단백질과 인지질 막의 상호작용의 대략적인 특성화를 위해 적응될 수 있다. 여기에 설명된 정량적 유세포 분석기는 몇 가지 파라미터에서 표면 플라즈몬 공명(SPR)을 인정합니다. 특히, 낮은 감도 및 시간 분해능을 가지며 단백질의 형광 표지가 필요하다. 형광 표지는 많은 단백질에 대한 입체 형태의 변화 및 활성의 손실을 초래할 수 있으므로 신?...
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
저자는 러시아 과학 재단 보조금 20-74-00133의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
참고문헌
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유