Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floresan Etiketli Proteinlerin Yapay Fosfolipid Mikrovezikülleri ile Etkileşiminin Kantitatif Akış Sitometrisi Kullanılarak Analiz Edilmesi
Bu Makalede
Özet
Burada, proteinlerin hücre zarları veya mikro-parçacıklarla etkileşimini karakterize etmek için bir dizi yöntem açıklıyoruz.
Özet
İnsan vücudunda, bağışıklık tepkisi ve kan pıhtılaşmasında rol oynayan başlıca fizyolojik reaksiyonların çoğu, hücrelerin zarları üzerinde ilerler. Herhangi bir membrana bağımlı reaksiyonda önemli bir ilk adım, proteinin fosfolipit membranına bağlanmasıdır. Lipid membranları ile protein etkileşimini incelemek için floresan olarak etiketlenmiş proteinler ve akış sitometrisi kullanılarak bir yaklaşım geliştirilmiştir. Bu yöntem, canlı hücreler ve doğal veya yapay fosfolipid vezikülleri kullanarak protein-membran etkileşimlerinin incelenmesine izin verir. Bu yöntemin avantajı, reaktiflerin ve ekipmanların basitliği ve kullanılabilirliğidir. Bu yöntemde, proteinler floresan boyalar kullanılarak etiketlenir. Bununla birlikte, hem kendi kendine yapılan hem de ticari olarak temin edilebilen, floresan etiketli proteinler kullanılabilir. Bir floresan boya ile konjugasyondan sonra, proteinler bir fosfolipid membran kaynağı (mikro-parçacıklar veya hücreler) ile inkübe edilir ve örnekler akış sitometrisi ile analiz edilir. Elde edilen veriler kinetik sabitleri ve denge Kd'yi hesaplamak için kullanılabilir. Ek olarak, fosfolipit membranındaki protein bağlanma bölgelerinin yaklaşık sayısını özel kalibrasyon boncukları kullanarak tahmin etmek mümkündür.
Giriş
Biyomembranlar, hayvan hücrelerinin iç içeriğini ve hücre dışı alanı ayırır. Membranların ayrıca hücrenin yaşam döngüsü ve organelleri sırasında oluşan mikro-parçacıkları çevrelediğini unutmayın. Hücre zarı ağırlıklı olarak lipitlerden ve proteinlerden oluşur. Membran proteinleri sinyalizasyon, yapısal, taşıma ve yapışkan fonksiyonları yerine getirir. Bununla birlikte, lipit çift katmanı, hayvan hücresinin hücre dışı boşlukla olan ilişkisi için de gereklidir. Bu makale, dış proteinlerin lipit membranı ile periferik etkileşimini incelemek için bir yöntem önermektedir.
Bir hayvan hücresinin dış zar tabakasında meydana gelen reaksiyonların en çarpıcı örneği, kan pıhtılaşma reaksiyonudur. Kan pıhtılaşmasının önemli bir özelliği, tüm ana reaksiyonların plazmada değilhücrelerin fosfolipid membranlarında ve bu hücrelerden kaynaklanan mikro-parçacıklarda ilerlemesidir 1,2,3. Membrana bağımlı reaksiyonlar, pıhtılaşmaya başlama sürecini (subendotelin hücre zarlarında, iltihaplı endotel veya aktive olmuş bağışıklık hücrelerinde, bir doku faktörünün katılımıyla), IX, X, protrombin faktörlerinin ana kaskad aktivasyonunun tüm reaksiyonlarını; faktör XI'nin trombin ile aktivasyonu (aktif trombositlerin, eritrositlerin, lipoproteinlerin ve mikro-parçacıkların zarlarında); protein C yolunun reaksiyonları; pıhtılaşma enzimlerinin inaktivasyonu (trombomodülin kofaktörlerinin, endotel protein C reseptörünün, heparan sülfatın katılımıyla endotel hücrelerinin zarlarında); ve temas yolu reaksiyonları (trombosit zarları ve bilinmeyen kofaktörlerin katılımıyla bazı mikro-parçacıklar üzerinde). Bu nedenle, çeşitli plazma proteinlerinin kan hücrelerinin zarı ile etkileşimini incelemeden kan pıhtılaşmasını araştırmak imkansızdır.
Bu yazıda, proteinlerin hücrelerin veya mikro-parçacıkların lipit membranları ile etkileşimini karakterize etmek için akış sitometrisine dayalı bir yöntem açıklanmaktadır. Bu yaklaşım başlangıçta kan plazmasının trombositler ve yapay fosfolipid vezikülleri ile etkileşimini incelemek için önerilmiştir. Ayrıca, incelenen proteinlerin çoğu, negatif yüklü membran fosfolipitleriyle, özellikle fosfatidilserin 4,5 ile doğrudan etkileşime girer. Ek olarak, membranla etkileşimi özelreseptörler 6 tarafından aracılık edilen proteinler vardır.
Akış sitometrisinin önemli bir yeteneği, ek bir ayrım olmaksızın serbest ve bağlı ligandlar arasında ayrım yapmaktır. Sitometrinin bu özelliği, son noktada ligand dengesi bağlanmasının incelenmesine izin verir ve sürekli kinetik ölçümlerin yapılmasına yardımcı olur. Teknik karmaşık değildir ve karmaşık numune hazırlama gerektirmez. Akış sitometrisi, bozulmamış ve deterjan geçirgen nötrofillerde floresan peptitler, reseptörler ve G-proteinleri arasındaki etkileşim dinamiklerini kantitatif olarak incelemek için aktif olarak kullanılır7. Bu yaklaşım, protein-DNA etkileşimlerini ve endonükleaz aktivitesinin kinetiğini gerçek zamanlı olarak araştırmak için de geçerlidir8. Zamanla, bu yöntem, saflaştırılmış lipit vezikülleri 9 ile veya daha genel olarak, yüksek verimli birSf9 hücre ekspresyon sistemi10'da eksprese edilen membran proteinleri ile yüksek afiniteli protein-protein etkileşimlerini nicel olarak incelemek için kullanılmıştır. Transmembran proteinleri için akış sitometrisi kullanılarak protein-lipozom etkileşimlerini karakterize etmek için kantitatif yöntemler de tanımlanmıştır11.
Bu teknik, piyasada satılan boncukları kullanmaktan kaçınmak için kendi kendine yapılan kalibrasyon boncuklarını kullanır7. Daha önce7 kullanılan kalibrasyon boncuklarının, proteinler üzerindeki erişilebilir floresan ligandlarının çeşitliliğini önemli ölçüde kısıtlayan floresein ile çalışması amaçlanmıştır. Ek olarak, bu makale makul bir zaman çözünürlüğü için kinetik verileri elde etmek ve analiz etmek için yeni bir yol sunmaktadır. Bu yöntem yapay fosfolipid vezikülleri için tanımlanmış olmasına rağmen, hücrelere, doğal veziküllere veya farklı bir lipit bileşimine sahip yapay fosfolipid veziküllerine adaptasyonu için belirgin bir sınırlama yoktur. Burada açıklanan yöntem, etkileşim (kaçık, kkapalı) ve denge (Kd) parametrelerinin tahmin edilmesine izin verir ve membran üzerindeki protein bağlanma bölgelerinin sayısının kantitatif karakterizasyonunu kolaylaştırır. Bu tekniğin, bağlama bölgelerinin sayısının yaklaşık bir tahminini sağladığını unutmayın. Yöntemin avantajları, göreceli basitliği, erişilebilirliği ve doğal hücrelere ve doğal ve yapay mikro-parçacıklara uyarlanabilirliğidir.
Protokol
1. Floresan protein etiketleme
- Malzeme hazırlama
- 1 M Sodyum bikarbonat tamponu, pH 9.0 hazırlayın, 4 °C'de saklayın ve bir hafta içinde kullanın.
- Kullanımdan hemen önce 1,5 M hidroksilamin hidroklorür tamponu, pH 8,5 hazırlayın.
- Dimetilsülfoksit içinde 10 mg/mL'lik bir floresan boya çözeltisi hazırlayın ( Malzeme Tablosuna bakınız).
NOT: Bu çözelti karanlıkta -20 °C'de bir ay boyunca saklanabilir. - Saflaştırılmış antikorların veya diğer proteinlerin çözeltilerini 1-10 mg / mL'de hazırlayın.
NOT: Amonyum iyonları veya birincil aminler içeren tamponlardan kaçının. Tris veya gliserol içeren tamponları diyaliz yoluyla fosfat tamponlu salin (PBS) ile değiştirin. Ne sodyum azid (≤3 mM) ne de thimerosal (≤1 mM) konjugasyon reaksiyonunu önemli ölçüde etkilemez. - PBS'de protein saflaştırması için jel filtrasyon ortamını oda sıcaklığında gece boyunca veya 60 °C'de 2 saat boyunca inkübe edin. Jel filtrasyon ortamını 0,2 μm membranlı spin kolonlarına uygulayın.
- Eq (1) kullanarak etiketlenecek protein konsantrasyonuna göre her reaksiyon için kullanılacak reaktif boya miktarını hesaplayın.
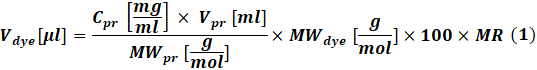
Vboyanın boya stok çözeltisinin hacmi olduğu yerlerde; C pr, V pr ve MWpr, proteinin konsantrasyonu, hacmi ve molar ağırlığıdır; MWboya, boya molar ağırlığıdır; 100 bir birim dönüşüm faktörüdür; MR, reaksiyon karışımındaki boyanın proteine molar oranıdır.
NOT: IgG etiketleme reaksiyonları için aşağıdaki MR'lar önerilir: Antikor 1-3 mg / mL'de ise MR = 40 veya antikor 4-10 mg / mL'de ise MR = 30. Pıhtılaşma faktörleri için genellikle MR = 5 kullanılır. - Konjugasyon reaksiyonu
- Bir reaksiyon tüpünde, protein çözeltisini 10 kat daha düşük hacimli 1 M bikarbonat çözeltisi ile karıştırın.
- Sürekli karıştırarak gerekli miktarda floresan boya ekleyin (bkz. adım 1.2).
- Reaksiyon karışımını oda sıcaklığında yaklaşık 1 saat boyunca inkübe edin, ışıktan koruyun ve sürekli karıştırın.
- Her 200 μL protein çözeltisi için, 5 μL 1.5 M hidroksilamin hidroklorür ekleyin.
- Reaksiyon karışımını oda sıcaklığında yaklaşık 30 dakika boyunca inkübe edin, ışıktan koruyun ve sürekli karıştırın.
- Döndürme sütununu hazırlayın.
- Bir kolona protein saflaştırması için 500 μL jel filtrasyon ortamı ekleyin. Kolonu 1.000 × g'da 3 dakika boyunca santrifüj yapın.
- Arabelleği toplama tüpünden atın. Sütun dolu değilse, daha fazla jel filtrasyon ortamı ekleyin ve sütunu 1.000 × g'da 3 dakika boyunca santrifüj edin. Sütun dolana kadar bu adımı yineleyin.
- Arıtma
- Reaksiyon karışımını (adım 1.3.5'ten) 17.000 × g'da 5 dakika boyunca santrifüj yapın ve çökeltiyi çıkarın.
- Süpernatantı jel filtrasyon ortamı ile spin kolonuna aktarın. Çözeltinin jel yatağına emilmesine izin verin.
- Spin sütunu için boş bir toplama tüpü kullanın ve 1.000 × g'da 5 dakika boyunca santrifüj yapın. Santrifüjlemeden sonra, etiketli proteini toplama tüpünden toplayın.
- Etiketleme derecesinin belirlenmesi
- Serbest boyanın 280 nm'de (A 280) absorbansını ve boya için λmax'ı (A max) ölçerek boyanın A280'deki absorbansa katkısı için doğru (bkz.
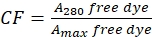 (2)
(2) - Protein-boya konjugatının 280 nm'de (A 280) ve boya için λ max'ta (Amax) absorbansını ölçün ve Eq (3) kullanarak protein konsetrasyonunu hesaplayın.
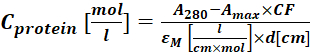 (3)
(3)
Mε, proteinin 280 nm'deki azı dişi yok olma katsayısıdır; d , absorbans ölçümü sırasında optik yol uzunluğudur; CF , boyanın A280'deki emilime katkısıdır (adım 1.6.1). - Eq (4) kullanarak etiketleme derecesini (DOL) hesaplayın.
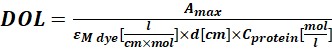 (4)
(4)
M boyasının ε λmax nm'deki boyanın molar yok olma katsayısı olduğu yerde; d, absorbans ölçümü sırasında optik yol uzunluğudur; C proteini,proteinin konsantrasyonudur (adım 1.6.2).
- Serbest boyanın 280 nm'de (A 280) absorbansını ve boya için λmax'ı (A max) ölçerek boyanın A280'deki absorbansa katkısı için doğru (bkz.
2. Fosfolipid veziküllerinin hazırlanması
- Lipid karışımının hazırlanması ve depolanması
- Lipitleri uygun oranda birleştirin (fosfatidilserin/fosfatidilkolin% 20 mol ila% 80 mol oranında).
- Liyofilizasyon veya buharlaştırmadan sonra lipit karışımını kurutun ve cam ampullerde inert bir atmosfer altında saklayın.
- Lipid film üretimi
- Ampulü açın ve lipit karışımını az miktarda (~ 100 μL) kloroform içinde yeniden askıya alın.
NOT: Tamamen buharlaşmadığı için çok fazla kloroform kullanmayın. - DiIC16(3) etanol içine %0,2 mol oranında ilave edin. Lipit karışımını yuvarlak tabanlı bir şişeye aktarın. Karışımı şişenin kenarlarına döndürerek ince bir şekilde yayın. Lipit karışımını bir argon akışı altında 30 dakika kurutun.
- Ampulü açın ve lipit karışımını az miktarda (~ 100 μL) kloroform içinde yeniden askıya alın.
- Lipid karışımının hidrasyonu
- Beklenen lipit konsantrasyonuna karşılık gelen bir hacimde uygun derecede sıcak (~ 55 °C) sulu bir tampon (HEPES 20 mM, NaCl 140 mM, pH 7.4) ekleyin. Tam hidrasyon için karışımı 55 ° C'de vorteksleme ile 30 dakika boyunca inkübe edin.
- Lipit süspansiyonunun 3-5 donma-çözülme döngüsüne maruz kalmasını sağlamak için numune tüpünün bir dondurucuya veya ılık termostata yerleştirilmesi.
- Ekstrüzyon ile lipid veziküllerinin oluşumu
- Ekstrüderi üreticinin talimatlarına göre hazırlayın. Tüm ekstruder bileşenlerini lipit karışımının faz geçiş sıcaklığına ısıtın.
- Ekstrüder şırıngalarından birini hidratlanmış lipit karışımı ile doldurun. Lipit süspansiyonunun sıcaklığının ekstrüderin sıcaklığıyla dengelenmesi için 5-10 dakika bekleyin.
- Lipit karışımını membrandan en az 10 kez ekstrüzyon yapın. Son ekstrüzyon için, lipit süspansiyonunu alternatif şırıngaya yerleştirin ve görünüşte hafif bulanık bir çözeltiden berrak bir çözeltiye doğru bir değişiklik arayın.
- Elde edilen lipit vezikül karışımını 4 ° C'de, tercihen inert bir argon veya azot atmosferinde 3-4 gün boyunca saklayın. Donmayın.
3. Trombositlerin tam kandan izolasyonu
- Sağlıklı donörlerden tam kanı% 3.2 sodyum sitrat içeren tüplerde toplayın.
- Kana prostaglandin E1 (PGE1) (1 μM) ve apiraz (0.1 U / mL) ekleyin, ardından 8 dakika boyunca 100 × g'da oda sıcaklığında santrifüjleme yapın.
- Santrifüjlemeden sonra, trombosit bakımından zengin plazmayı alın ve 3: 1'lik bir plazma / sitrat oranına sodyum sitrat çözeltisi (106 mM, pH 5.5) ekleyin. Plazmayı oda sıcaklığında 400 × g'da 5 dakika boyunca santrifüj edin.
- Süpernatanı çıkarın ve peleti BSA olmadan 300 μL Tyrode tamponunda yeniden askıya alın (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl 2, 0.4 mM NaH 2 PO 4, 2.5 mM CaCl 2, 5 mM glikoz, pH7.4). Trombosit saflaştırması için jel filtrasyon ortamı üzerindeki jel kromatografisi ile trombositleri plazma proteinlerinden arındırın (bkz.
4. Akım sitometrisi ile protein - lipid etkileşiminin tespiti
- Kinetik bağlama deneyleri
- Tyrode tamponundaki fosfolipid vezikülleri (adım 2.4.4'ten itibaren) (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl 2, 0.4 mM NaH 2 PO 4, 2.5mM CaCl2, 5 mM glikoz,% 0.5 BSA, pH7.4) 1 μM konsantrasyona ve toplam hacim 250 μL'ye kadar seyreltin.
- Floresan etiketli pıhtılaşma faktörü X'i (fX-fd) 500 nM'lik bir konsantrasyonda adım 4.1.1'den fosfolipid vezikülleri ile 1: 1 oranında (nihai vezikül konsantrasyonu 0.5 μM, fX-fd konsantrasyonu 250 nM fX'tir) toplam 500 μL'lik bir hacme karıştırın.
- Hemen karışık süspansiyonun 500 μL'sini (düşük akış hızıyla analiz için ~ 20 dakika) akış sitometresine enjekte edin. Düşük bir akış hızı kullanın ve FL2 kanalı eşiğinin (ör. 488 nm, emisyon filtresi 585/42 nm) 200 değeri olduğundan emin olun. Malzeme Tablosundaki floresan boya için FL4 kanalındaki (ör. 633 nm, emisyon filtresi 660/20) ortalama floresansı ölçün.
NOT: Otomatik numune alma cihazı olmayan bir sitometre seçin. Bu, numunenin ölçüm hücresine enjeksiyon işlemini hızlandıracaktır. - Bağlanmanın doygunluğu sağlandığında (5 dakika içinde floresanda önemli bir artış olmadığında), numuneyi Tyrode tamponu ile 20 kat hızla seyreltin ve taban çizgisi floresansına ulaşılana kadar (tam ayrışma) veya bir platoya ulaşılana kadar (5 dakika içinde floresanda önemli bir azalma yok) ayrışmayı izleyin.
NOT: Kontrol olarak, 10 μM EDTA ekleyin ve 5 dakika boyunca tam ayrışmayı izleyin.
- Denge bağlama deneyleri
NOT: Doygunluğa ulaşma süresini belirlemek için bağlanmanın kinetik eğrisini kullanın; fX-fd ve yapay veziküller için doygunluk süresi 20 dakikadır.- Tyrode'un tamponunda 20 dakika boyunca farklı konsantrasyonlarda fX-fd (0 ila 1.000 nM) ile bağlanma testi için yapay fosfolipid veziküllerini (5 μM) inkübe edin.
- Her numuneyi adım 4.2.1'den 20x'e kadar Tyrode tamponu ile 200 μL'lik son hacme kadar seyreltin. Seyreltilmiş numuneyi derhal 30 saniye içinde akış sitometrisi ile analiz edin. Adım 4.1.3'teki ayarları kullanın.
NOT: Spesifik olmayan bağlanma için bir kontrol olarak, EDTA (10 μM) ile benzer numuneler kullanın ve bunları 5 dakika boyunca inkübe edin.
5. Akış sitometrisi verilerinin analizi
- FSC formatında deneyleri, sitometri veri toplama yazılımından veri analizi için sitometre yazılımına aktarın (bkz. Dosya |'ni seçin İhracat | FCS dosyaları. FSC dosyalarını, bilgisayardaki dosyaları seçip programın çalışma alanına sürükleyerek veri analizi için sitometre yazılımında açın.
- Mikro-parçacıkların geçişi için, lipofilik boya DiIC16(3)'ün floresansı ile mikro-parçacıkların bölgesini tanımlayın. Günlük koordinatlarında FL2'den (boya DilC16(3)) nokta grafiği SSC oluşturmak için çalışma sayfasındaki menü komutlarını veya çizim düğmesini kullanın. Vezikülsüz bir örneklemden gelen olayların bu bölgeye dahil edilmemesi için bir geçit bölgesi çizmek üzere Dikdörtgen Kapı düğmesini seçin (Şekil 1B, C).
- Kinetik deneyleri analiz edin.
- Veziküllerin bölgesi için zaman içinde floresan koordinatlarını (FL4) kullanarak bir nokta grafiği oluşturun (adım 5.2'de veziküller bölgesine çift tıklayın)
- Floresandaki zaman içindeki değişimle ilgili verileri csv formatında dışa aktarın. Örnek | Seçin | sağ tıklayın İhracat | Parametreler | FL4 ve Saat'i seçin | kaydetmek için dizin seçin CSV formatını seçin | İhracat.
- CSV dosyasını herhangi bir istatistik yazılımında açın (bkz. Malzeme Tablosu). Her 1.000 olay için basit bir floresan ve zaman hareketli ortalamasını hesaplayın.
- Üstel bağımlılık varsayımı altında basit hareketli ortalama floresanın zamana bağımlılığının bir grafiğini yaklaşık olarak belirleyin (Uydurma > Analizi >Doğrusal Olmayan Eğri Uyumu) ve bunu Eq (5) kullanarak kinetik ilişki sabitini hesaplamak için kullanın.
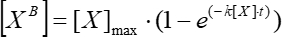 (5)
(5)
Burada [XB] , adım 5.3.3'teki basit hareketli ortalamaya göre zamanın her anındaki (kullanıcı tanımlı birimler) bağlı faktör konsantrasyonudur; [X] eklenen faktör konsantrasyonudur; [X]max , maksimum bağlı faktör konsantrasyonudur; k ilişkilendirme sabitidir; t zamanıdır. - Eq (6) kullanarak kinetik ayrışma sabitini hesaplamak için aynı eylem kümesini (5.3.1-5.3.4) tekrarlayın.
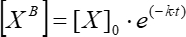 (6)
(6)
Burada [XB] , zamanın her anındaki bağlı faktör konsantrasyonudur; [X]0 , zamanın ilk anındaki bağlı faktör konsantrasyonudur; k , ayrışma sabitidir; t zamanıdır.
- Denge bağlayıcı tahlil
- Seçilen her fX-fd konsantrasyonu için veziküller bölgesinde fX-fd'nin ortalama floresansını belirleyin.
- Basit tek bölgeli bağlanma varsayımında eklenen faktörün konsantrasyonundan bağlı faktör floresansının bağımlılığını yaklaşık olarak belirleyin. En az üç bağımsız tekrardan Eq (7) kullanarak ortalama bağlama parametrelerini hesaplayın.
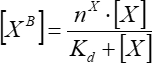 (7)
(7)
[XB] bağlı faktör konsantrasyonu olduğunda; [X] eklenen faktör konsantrasyonudur; nx, vezikül başına görünür bağlanma bölgesi sayısıdır; Kd, görünür ayrışma sabitidir.
6. Floresan yoğunluğunu ortalama bağlanma bölgesi sayısına dönüştürme
- Kalibre edilmiş boncuklar hazırlayın.
- Jel filtrelenmiş trombositleri (bkz. adım 3.3) CaCl 2 (2,5 mM) varlığında A23187 (10 μM) ile oda sıcaklığında 10 dakika boyunca inkübe edin.
- Aktif trombositlere çeşitli fX-fd konsantrasyonlarını (0 ila 1.000 nM) ekleyin. % 2 v / v formaldehit ekleyin ve 1 saat boyunca inkübe edin. Trombositleri oda sıcaklığında 30 dakika boyunca 3 M glisin ve% 5 BSA ile inkübe ederek reaksiyonu durdurun.
- Karışımı reaksiyona girmemiş boyadan arındırın. Trombositleri 400 × g'da 5 dakika boyunca santrifüj edin, süpernatanı çıkarın ve peleti Tyrode tamponunda (% 0.5 BSA içeren) yeniden askıya alın.
Not: adım 6.1.3 üç kez yineleyin.
- Her numunedeki kalibrasyon boncuklarının floresan seviyesini önce bir spektroflorometre ( Malzeme Tablosundan floresan boya için, uyarma 633 nm, emisyon 670 nm) ve ardından akış sitometresini kullanarak (FL4 kanalında: uyarma 633 nm, emisyon filtresi 660/20) ölçün. Bir hücre sayacı kullanarak, her örnekteki boncuk sayısını belirleyin.
- Her bir boncuk örneğinin floresan yoğunluğunu, bir spektroflorometre kullanarak çözünür floresan boya konsantrasyonuna dönüştürün. Eq (8) kullanarak florofor moleküllerinin sayısı için floresan boya konsantrasyonunu yeniden hesaplayın.
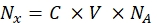 (8)
(8)
Burada Nx, florofor moleküllerinin sayısıdır; C, floresan boya konsantrasyonudur; NA, Avogadro sabitidir; NA = 6.02214076×1023 mol -1. - Herhangi bir istatistiksel yazılım kullanarak her numune için florofor moleküllerinin sayısına (bkz. adım 6.3) bir akış sitometresinde (adım 6.2) boncukların ortalama floresansının bir bağımlılık grafiğini oluşturun (bkz. Bu bağımlılığı satır orantılılığına göre yaklaştırın (Analiz | Montaj | Doğrusala uyun). Eq (9) içindeki yaklaşımdan, ortalama floresanın bağlanma bölgelerine dönüşüm faktörünü hesaplayın.
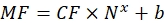 (9)
(9)
MF'nin akış sitometrisi ile boncukların ortalama floresansı olduğu yerlerde; Nx, boncuk başına florofor moleküllerinin sayısıdır; KF, ortalama floresanın bağlanma bölgelerine dönüşüm faktörünü temsil eder. CF ve b, grafiğin doğrusal orantılılık ile sığdırılmasının sonuçlarından elde edilir. - Eq (10) kullanarak ilgilenilen vezikül başına görünür bağlama bölgesi sayısını hesaplayın.
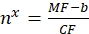 (10)
(10)
Nx'in, ilgilenilen vezikül başına görünür bağlanma bölgesi sayısı olduğu durumlarda; MF, akım sitometrisi ile ilgilenilen veziküllerin ortalama floresansıdır; CF ve b, Eq'dan dönüşüm faktörleridir (8).
Sonuçlar
Burada tarif edilen akım sitometri yöntemi, plazma pıhtılaşma proteinlerinin aktive trombositlere bağlanmasını karakterize etmek için kullanılır. Ayrıca fosfolipid veziküller PS:PC 20:80 model sistem olarak uygulanmıştır. Bu yazıda örnek olarak yapay fosfolipid veziküller üzerinde durulmuştur. Sitometrenin parametreleri, özellikle fotoçarpan tüpü (PMT) voltajı ve kompanzasyonu, her bir spesifik cihaz, çalışmanın amacı (hücreler, yapay veya doğal mikro-parçacıklar) ve kullanılan boyalar...
Tartışmalar
Önerilen yöntem, proteinlerin çeşitli kaynaklardan ve bileşimlerden fosfolipid membranlarla etkileşiminin kabaca karakterize edilmesi için uyarlanabilir. Burada tarif edilen kantitatif akım sitometrisi, çeşitli parametrelerde yüzey plazmon rezonansını (SPR) kabul eder. Özellikle, daha düşük bir hassasiyete ve zaman çözünürlüğüne sahiptir ve proteinlerin floresan etiketini gerektirir. Floresan etiketleme, birçok protein için konformasyonda bir değişikliğe ve aktivite kaybına neden olabilir ve...
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Rus Bilim Vakfı'nın 20-74-00133 hibesiyle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
Referanslar
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır