Method Article
المجهر الإلكتروني لكسر التجميد لتحليل الحويصلة خارج الخلية
In This Article
Summary
نقدم بروتوكولا لعزل وتكسير الحويصلات خارج الخلية (EVs) الناشئة عن الخلايا البولية اللثولية السرطانية. كشفت تقنية كسر التجميد عن قطر المركبات الكهربائية وشكلها - وكميزة فريدة من نوعها - التنظيم الداخلي لأغشية المركبات الكهربائية. هذه لها أهمية كبيرة في فهم كيفية تفاعل المركبات الكهربائية مع الأغشية المتلقية.
Abstract
الحويصلات خارج الخلية (EVs) هي هياكل محدودة الغشاء تطلق من الخلايا إلى الفضاء خارج الخلية وتشارك في الاتصال بين الخلايا. تتكون المركبات الكهربائية من ثلاث مجموعات من الحويصلات ، وهي الحويصلات الدقيقة (MVs) ، والإكسوسومات ، والأجسام المستنفدة. يشارك الغشاء المحدد للمركبات الكهربائية بشكل حاسم في التفاعلات مع الخلايا المتلقية ، مما قد يؤدي إلى نقل الجزيئات النشطة بيولوجيا إلى الخلايا المتلقية ، وبالتالي يؤثر على سلوكها. تستخدم تقنية المجهر الإلكتروني لكسر التجميد لدراسة التنظيم الداخلي للأغشية البيولوجية. هنا ، نقدم بروتوكولا لعزل MV من الخلايا البولية الظهارية السرطانية المستزرعة وكسر التجميد ل MVs في خطوات التجميد السريع والتكسير وصنع وتنظيف النسخ المتماثلة ، وتحليلها باستخدام المجهر الإلكتروني الناقل. تظهر النتائج أن بروتوكول العزل ينتج عنه مجموعة متجانسة من المركبات الكهربائية ، والتي تتوافق مع شكل وحجم MVs. توجد الجسيمات داخل الغشاء بشكل رئيسي في الوجه البروتوبلازمي للغشاء المحدد. وبالتالي ، فإن كسر التجميد هو التقنية المفضلة لتوصيف قطر MVs وشكلها وتوزيع بروتينات الغشاء. ينطبق البروتوكول المقدم على مجموعات أخرى من المركبات الكهربائية.
Introduction
الحويصلات خارج الخلية (EVs) هي حويصلات محدودة الغشاء يتم إطلاقها من الخلايا إلى الفضاء خارج الخلية. المجموعات الثلاث الرئيسية للمركبات الكهربائية هي الإكسوسومات والحويصلات الدقيقة (MVs) والأجسام الماصة ، والتي تختلف في أصلها وحجمها وتركيبها الجزيئي1،2،3. يعكس تكوين المركبات الكهربائية الملامح الجزيئية للخلية المانحة وحالتها الفسيولوجية (أي صحية أو مريضة)4,5. هذا يعطي EVs إمكانات هائلة في تشخيص الأمراض البشرية وتشخيصها وعلاجها ، ولها تطبيقات طبية واعدة لاستخدامها في الطب الشخصي6،7،8.
EVs هي وسطاء الاتصالات بين الخلايا. أنها تحتوي على البروتينات النشطة بيولوجيا والدهون والحمض النووي الريبي ، والتي تتداخل مع العمليات البيولوجية في الخلية المتلقية ويمكن أن تغير سلوكها 9,10. ومع ذلك ، فإن تكوين غشاء الحد من EV أمر بالغ الأهمية للتفاعل مع غشاء الخلية المتلقية.
مصادر المركبات الكهربائية هي سوائل الجسم ووسائط الثقافة المكيفة. لعزل سكان EV ، يجب استخدام تقنية عزل مناسبة. على سبيل المثال، ينتج عن الطرد المركزي عند 10,000 × g جزءا مخصب في MVs، في حين أن قوى الطرد المركزي التي تبلغ ≥100,000 × g تنتج جزءا مخصب في الإكسوسومات11,12. يجب التحقق من صحة الجزء المعزول من المركبات الكهربائية من حيث النقاء والحجم والشكل. ولهذا الغرض، أوصت الجمعية الدولية للحويصلات خارج الخلية 2018 بثلاث فئات من تقنيات التصوير عالية الدقة: المجهر الإلكتروني، ومجهر القوة الذرية، والمجهر فائق الدقة القائم على المجهر الضوئي13. لا يمكن لأي من هذه التقنيات توفير معلومات عن غشاء EV الداخلي.
المجهر الإلكتروني لكسر التجميد هو تقنية لكسر العينات المجمدة للكشف عن هياكلها الداخلية ، وخاصة إعطاء نظرة على الغشاء الداخلي. خطوات تحضير العينة هي (1) التجميد السريع ، (2) التكسير ، (3) صنع النسخة المتماثلة ، و (4) تنظيف النسخة المتماثلة14. في الخطوة 1 ، تكون العينة (اختياريا) ثابتة كيميائيا ، محمية بالتبريد مع الجلسرين ، ومجمدة في الفريون السائل. في الخطوة 2 ، يتم كسر العينة المجمدة في وحدة كسر التجميد ، والتي تكشف عن الجزء الداخلي من الطبقة الثنائية للغشاء. في الخطوة 3 ، يتم تظليل الوجوه المكسورة المكشوفة بالبلاتين (Pt) والكربون (C) لإنتاج نسخ متماثلة. في الخطوة 4 ، تتم إزالة المواد العضوية. يتم تحليل النسخة المتماثلة في المجهر الإلكتروني الناقل (TEM). للحصول على تفسير دقيق للرسوم البيانية المجهرية ، يجب على المرء اتباع الإرشادات الخاصة بتوجهها الصحيح14,15. باختصار ، اتجاه الظلال في المجهر هو مرجع لتوجيه المجهر (أي لتحديد اتجاه تظليل Pt) ، وبالتالي تحديد الأشكال المحدبة والمقعرة (الشكل 1). يمكن رؤية وجهين داخليين يطلق عليهما الوجوه المكسورة للطبقة الثنائية الغشائية نتيجة لتقسيم الغشاء عن طريق التكسير بالتجميد: الوجه البروتوبلازمي (P-face) والوجه الخارجي (E-face). يمثل الوجه P نشرة الغشاء المجاورة لبروتوبلازم الخلية ، بينما يمثل الوجه E نشرة الغشاء المجاورة للفضاء خارج الخلية. ينظر إلى بروتينات الغشاء المتكاملة وارتباطاتها على أنها جزيئات بارزة داخل الغشاء14,15.
هنا ، الهدف هو تطبيق تقنية كسر التجميد لتوصيف MVs من حيث الحجم والشكل وبنية غشاء الحد منها. هنا ، نقدم بروتوكولا لعزل وتكسير التجميد ل MVs الناشئة عن الخلايا البولية اللثولية السرطانية الغازية للمثانة البشرية.
Protocol
1. زراعة الخلايا البولية السرطانية وعزل المركبات الكهربائية
ملاحظة: يتم تقديم بروتوكول للحصول على EVs من خط خلية عظمية لسرطان المثانة الغازية البشرية (T24). ومع ذلك ، يجب تحسين ظروف الزراعة لاستخدام أنواع الخلايا الأخرى.
- خلايا اللوحة T24 بكثافة 3 × 104 خلايا / سم 2 في ثلاث قوارير (سطح ينمو 75 سم 2) وتبدأ بزراعة الخلايا في حاضنة CO 2 لمدة 3 أيام عند 37 درجة مئوية و 5٪ CO 2 (الشكل 2A).
- استخدم وسيطا مزروعا لخلايا T24 في خليط 1: 1 (v / v) من A-DMEM و F12 مع 5٪ من مصل البقر الجنيني (FBS) ، و 4 mM Glutamax ، و 100 mg / mL streptomycin ، و 100 U / mL penicillin.
ملاحظة: ينتج عن العزل التالي مركبات كهربائية غنية بمركبات MVs. قبل البدء في العزل ، افحص الخلايا باستخدام مجهر ضوئي للتأكد من الجدوى والالتقاء (الشكل 2B). ابدأ في جمع المركبات الكهربائية من وسائط الثقافة المشروطة عندما تكون خلايا T24 عند التقاء 70٪.
- استخدم وسيطا مزروعا لخلايا T24 في خليط 1: 1 (v / v) من A-DMEM و F12 مع 5٪ من مصل البقر الجنيني (FBS) ، و 4 mM Glutamax ، و 100 mg / mL streptomycin ، و 100 U / mL penicillin.
- اجمع وسط الاستزراع باستخدام MVs مع ماصة من القوارير (T75) في أنابيب أجهزة طرد مركزي مخروطية (الشكل 2C). جهاز طرد مركزي عند 300 × غرام لمدة 10 دقائق عند 4 درجات مئوية (الشكل 2D).
- اجمع المادة الفائقة بعناية في أنبوب طرد مركزي جديد باستخدام الماصة (الشكل 2E).
- جهاز الطرد المركزي الفائق عند 2000 × غرام لمدة 20 دقيقة عند 4 درجات مئوية.
- جمع بعناية supernatant مع ماصة في أنبوب الطرد المركزي الجديد.
- جهاز طرد مركزي عند 10000 × غرام لمدة 40 دقيقة عند 4 درجات مئوية. ابحث عن وجود حبيبة بيضاء في أسفل الأنبوب.
ملاحظة: إذا لزم الأمر، قم بتغيير دوار جهاز الطرد المركزي للوصول إلى قوة G المطلوبة. وينظر إلى بيليه EV على أنه بيليه أبيض في الجزء السفلي من أنبوب جهاز الطرد المركزي (الشكل 2F)؛ حدد موقعه لتجنب فقدان الكريات أثناء السحب (الشكل 2G). - تخلص بعناية من supernatant مع ماصة. إلى الكريات ، أضف 1.5 مل من PBS وأعد تعليق الكريات التي تحتوي على MVs. ضع التعليق في أنبوب طرد مركزي جديد.
- جهاز طرد مركزي عند 10000 × غرام لمدة 40 دقيقة عند 4 درجات مئوية وابحث عن وجود حبيبة بيضاء في أسفل الأنبوب.
ملاحظة: ينظر إلى بيليه EV على أنه رقعة بيضاء في الجزء السفلي من أنبوب جهاز الطرد المركزي. حدد موقعه لتجنب فقدان الكريات أثناء السحب. - تخلص بعناية من supernatant مع ماصة. أضف بلطف المثبت ، 2.5 ٪ غلوتارالدهيد في 0.1 M الصوديوم كاكوديليت المخزن المؤقت (الرقم الهيدروجيني 7.2). اتركيه لمدة 20 دقيقة عند 4 درجات مئوية (الشكل 2H).
تحذير: الجلوتارالدهيد وكاكوديلات الصوديوم سامة. اعمل في غطاء دخان ، وارتد قفازات واقية ، وتخلص منها بشكل مناسب. - قم بإزالة المثبت بعناية باستخدام ماصة. أضف مخزن الغسيل المؤقت (0.1 M مخزن مؤقت كاكوديليات الصوديوم) إلى الكرية. اتركيه لمدة 10 دقائق عند 4 درجات مئوية دون تعليق الكرية.
2. تجميد المركبات الكهربائية
ملاحظة: قبل التجميد، قم أولا بحماية العينات بالجلسرين بالبريد.
- تحضير 0.1 M الصوديوم كاكوديلات المخزن المؤقت. قم بإزالة المخزن المؤقت للغسيل وإضافة 50 ميكرولتر من الجلسرين بنسبة 30٪ في مخزن مؤقت 0.1 M cacodylate. أعد تعليق المركبات الكهربائية بلطف لجعل الحل متجانسا. احتضان لمدة 30 دقيقة في 4 درجات مئوية.
- تنظيف ناقلات النحاس مع حفرة مركزية في حمام الموجات فوق الصوتية مع الكلوروفورم لمدة 5 دقائق (الشكل 3A). قم بتجفيفها جوا ووضع علامة عليها بالألوان إذا كنت تستخدم عينات متعددة (الشكل 3B). حتى الاستخدام، احتفظ بالحاملات في مكان جاف ونظيف (على سبيل المثال، على ورق العدسة في طبق بتري). لا تلمس الناقلات بأيدي عارية.
- قم بإعداد الماصات والمحاليل وورق الترشيح والملقط والمجهر المجسم وقارورة ديوار مع الفريون والنيتروجين السائل (LN2) وقضيب معدني و cryovials. قم بتبريده باستخدام LN2.
تنبيه: ارتد معدات الحماية واعمل وفقا لذلك عند التعامل مع LN2 والفريون المبرد.
- قم بإعداد الماصات والمحاليل وورق الترشيح والملقط والمجهر المجسم وقارورة ديوار مع الفريون والنيتروجين السائل (LN2) وقضيب معدني و cryovials. قم بتبريده باستخدام LN2.
- أعد تعليق المركبات الكهربائية مرة أخرى قبل التجميد. تجنب تشكيل فقاعات الهواء.
ملاحظة: تنفيذ الخطوات 2.4-2.7 بسرعة. - العمل تحت المجهر المجسم (الشكل 3C). انقل 1.5-1.7 ميكرولتر من العينة إلى الحفرة المركزية لحامل النحاس لجعل قطرة محدبة تصل إلى أعلى من حافة حامل النحاس مع عدم انسكاب العينة فوق الحافة (الشكل 3D). في حالة الانسكاب الزائد، استخدم ورق الترشيح لتجفيف الحلقة الخارجية للحامل.
- امزج الفريون الصلب مع قضيب معدني لتسييله مرة أخرى (الشكل 3E).
- أمسك الحلقة الخارجية للحامل النحاسي بملاقط واغمرها في الفريون المبرد مع اهتزاز لطيف للملقط لمدة 8 ثوان (الشكل 3F). بعد 8 ثوان ، انقل الناقل بسرعة إلى قارورة ديوار أخرى مليئة ب LN2.
- تابع على الفور تكسير العينات أو تخزينها في LN2. في الحالة الأخيرة ، ضع علامة على الثلاجة وقم بتبريد أطراف القارورة والملقط عن طريق غمرها في LN2 (الشكل 3G). تحت LN 2 ، قم بجمع ناقلات النحاس المجمدة في القارورة ، وأغلقها ، وتخزينها في حاوية LN2 (الشكل 3H) حتى تجميد التكسير.
3. تكسير المركبات الكهربائية وصنع النسخ المتماثلة
ملاحظة: قم بإعداد وحدة تكسير التجميد وفقا لتعليمات التشغيل الخاصة بالشركة المصنعة. (الشكل 4 ألف). تنظيف غرفة الوحدة. ضع البنادق البلاتينية (Pt/C) والكربون (C) بزوايا 45 درجة و90 درجة على التوالي (الشكل 4B).
- بدء تشغيل نظام فراغ الوحدة. عند الوصول إلى ضغط 6.6 × 10−2 باسكال (5 × 10−4 تور)، قم بتبريد غرفة الوحدة إلى -150 درجة مئوية.
- انقل حاملات النحاس مع العينات المجمدة إلى وحدة تكسير التجميد باستخدام ملاقط جافة (الشكل 4C). استخدم النقل بالتبريد أو اعمل بسرعة لتجنب إذابة العينة وترسب بلورات الجليد. قم بتأمين شركات النقل على طاولة العينة.
- انتظر حتى يصل الفراغ مرة أخرى إلى 6.6 × 10-2 باسكال (5 × 10-4 تور) ، ثم اضبط درجة حرارة السكين على -100 درجة مئوية (الشكل 4D).
- انتظر حتى يصل الفراغ إلى 1.0 × 10-3 باسكال (8 × 10-6 تور).
- راقب العينة باستخدام المناظير واقترب بعناية من السكين (الشكل 4E).
- ابدأ في تقسيم العينة عن طريق تشغيل الحركة الآلية للسكين (الشكل 4F) والتقسيم حتى يصبح سطح العينة أملسا (الشكل 4G).
- بالنسبة للتكسير ، قم بإيقاف تشغيل الحركة الآلية للسكين والمضي قدما في التحكم اليدوي البطيء في السكين ، وبالتالي تكسير العينة (الشكل 4H). من أجل حماية السطح المكسور من تشكيل بلورات الجليد والحطام حتى التظليل ، حرك السكين فوق العينة المكسورة.
- تابع تظليل Pt عند 45 درجة (الشكل 4I ، J).
- قم بإعداد ساعة توقيت و / أو قم بتشغيل شاشة كريستال الكوارتز على وحدة تكسير التجميد ، مما سيسمح بالإشراف على سمك Pt على العينة. السماكة الموصى بها لطبقة Pt كما تم قياسها على شاشة بلورات الكوارتز هي 2.5 نانومتر ، وهو ما يتوافق مع 4 s من التظليل عند توتر عال وتيار معين (أي أن سرعة تظليل Pt هي 0.63 نانومتر / ثانية).
- قبل البدء في التظليل ، حرك السكين بعيدا عن العينة. قم بتطبيق توتر عال على مسدس Pt / C (1600 فولت) ، وقم بزيادة التيار إلى 60 مللي أمبير. يجب أن تظهر شرارات Pt ويجب أن تبدأ في تظليل العينة. عند هذه النقطة ، ابدأ العد التنازلي لمدة 4 ثوان و / أو راقب وحدد موقع Pt على شاشة كريستال الكوارتز.
ملاحظة: السماكة الموصى بها للطبقة C هي 2.5 نانومتر ، والتي تتوافق مع 10 ثانية من التظليل عند توتر عال وتيار معينين. - قم بإيقاف تشغيل التيار والتوتر العالي عند الحصول على سمك Pt المطلوب.
- تابع التظليل C عند 90 درجة (أي أن سرعة التظليل C هي 0.25 نانومتر / ثانية).
- تطبيق توتر عال على مسدس C (1900 فولت) ، وزيادة التيار إلى 90 مللي أمبير ، ويجب أن تظهر شرارات C وتبدأ في تظليل العينة ؛ في تلك اللحظة ، ابدأ العد التنازلي لمدة 10 ثوان. قم بإيقاف تشغيل التيار والتوتر العالي عند الحصول على سمك C المطلوب.
4. تنظيف النسخ المتماثلة وتحليل النسخ المتماثلة
- استخدم الناقلات النحاسية من طاولة العينات وانقلها باستخدام ملاقط إلى الماء المقطر في درجة حرارة الغرفة في صفيحة خزفية من 12 بئرا (الشكل 4K). سوف تطفو النسخ المتماثلة على سطح الماء ، بينما تغرق الناقلات (الشكل 4L).
- انقل النسخ المتماثلة باستخدام حلقة سلكية من الماء المقطر إلى بئر به هيبوكلوريت الصوديوم. يغطى ويترك طوال الليل في درجة حرارة الغرفة في غطاء الدخان.
تحذير: هيبوكلوريت الصوديوم سام. اعمل في غطاء دخان ، وارتد قفازات واقية ، وتخلص منها بشكل مناسب. - انقل النسخ المتماثلة إلى ddH2O واغسلها لمدة 30 دقيقة. كرر 3 مرات.
- انقل النسخ المتماثلة باستخدام حلقة سلكية إلى شبكة TEM نحاسية شبكية (على سبيل المثال ، شبكة مربعة أو قرص العسل 100+ شبكة). قم بتجفيف الشبكات في الهواء لمدة 2 ساعة ، ثم قم بتخزينها في صندوق تخزين الشبكة حتى الفحص المجهري.
ملاحظة: بشكل عام ، يمكن تخزين الشبكات لعدة أشهر في ظروف مظلمة وجافة ودرجة حرارة الغرفة. - استخدم مجهر TEM لتصوير النسخ المتماثلة والحصول على صور مجهرية.
- للقيام بذلك ، أدخل شبكة TEM مع نسخة طبق الأصل وابدأ تصوير TEM وفقا لأدلة التشغيل الخاصة بالشركة المصنعة. العمل في 80 كيلو فولت أو 100 كيلو فولت.
- افحص العينة واحصل على صور مجهرية عند تكبيرات أقل وأعلى باستخدام كاميرا على TEM.
- تحليل الصور المجهرية ل MVs. للحصول على قياسات لأقطار MV ، استخدم برنامج Fiji / ImageJ16. قطر MVs هو 4/π أضعاف القياس على الصور المجهرية وفقا ل Hallett et al.17.
النتائج
تم عزل MVs من الوسط المشروط لخلايا T24 البولية السرطانية بعد عمليات الطرد المركزي التفاضلية. بعد البروتوكول ، تم اكتشاف جزء EV لأول مرة بعد الطرد المركزي عند 10000 × g عندما كان ينظر إليه على أنه بيليه أبيض (الشكل 2G).
بعد ذلك ، تمت معالجة EVs وفقا للبروتوكول أعلاه وفحصها بموجب TEM. أنتجت تظليل PT / C (الشكل 4L) نسخا متماثلة كبيرة نسبيا والتي غالبا ما تنقسم إلى شظايا أصغر أثناء خطوة التنظيف. تم التقاط النسخ المتماثلة الكبيرة وشظاياها الأصغر على شبكة TEM ومقارنتها تحت المجهر. لم تظهر النتائج أي اختلافات في جودة الأسطح المقلدة بغض النظر عن حجمها ، وبالتالي يمكن استخدامها جميعا. أظهرت فحوصات التكبير المنخفض مناطق من النسخة المتماثلة مع i) سطح متجانس (خلفية) ، ii) ملامح كروية مقعرة ومحدبة (حويصلات) ، و iii) مناطق من السطح التالف (القطع الأثرية; الشكل 5 ألف). كان ينظر إلى القطع الأثرية النموذجية على أنها تمزقات وطيات وظلال باهتة غير منتظمة (أي نسخ طبق الأصل من رواسب بلورات الجليد على العينة). من المهم أيضا ملاحظة أنه لم يتم رؤية أي حطام خلوي أو عضيات خلوية ، مما يؤكد نقاء العينة (الشكل 5B).
وعادة ما يتم جمع الحويصلات المعزولة إما في مجموعات من ثلاثة أو أكثر أو تم توزيعها بشكل فردي (الشكل 5B). كانت الحويصلات كروية ، مما يشير إلى الحفاظ الجيد على البنية الفائقة أثناء العزل والتثبيت والتجميد (الشكل 5C). ومن المفترض أن تكون "الكرة المسطحة" والحويصلات الممدودة (الشكل 5C)، التي شوهدت من حين لآخر، من القطع الأثرية للتحضير ولم تدرج في القياسات اللاحقة لقطر الحويصلة. وكان قطر الملامح المرئية 238.5 نانومتر (±8.0 نانومتر، ن = 190)، وهو ما يقابل، مع مراعاة عامل التصحيح الذي اقترحه هاليت وآخرون.17، متوسط قطر الحويصلة البالغ 304 نانومتر (±10 نانومتر؛ الشكل 5 دال). يرتبط الحجم بنطاق قطر MVs بين 100 نانومتر و 1000 نانومتر ويثبت فعالية بروتوكول العزل المستخدم. أكدت صور الحويصلات جنبا إلى جنب مع تحديد القطر بشكل لا لبس فيه أن المركبات الكهربائية في العزل تم إثراؤها ب MVs.
كشف تحليل النسخ المتماثلة عن تنظيم P-face و E-face للأغشية المحدودة MV. وقد لوحظت MVs كأشكال دائرية مقعرة ومحدبة (الشكل 5C و E و F) ، مما يعكس مستوى الكسر. تمثل الأشكال المحدبة الوجوه الإلكترونية (أي النشرة الخارجية المكسورة للأغشية. الشكل 5 هاء). كان للوجوه الخارجية للمركبات الكهربائية مظهر سلس وموحد. تتوافق الأشكال المقعرة مع الوجوه P (الشكل 5F). في الوجوه P ، شوهدت بعض الجسيمات البارزة داخل الغشاء داخل الأغشية الملساء (الشكل 5C ، F). وهذا يعني أن MVs المعزولة من خلايا T24 البولية السرطانية تحتوي فقط على كمية منخفضة من بروتينات الغشاء.
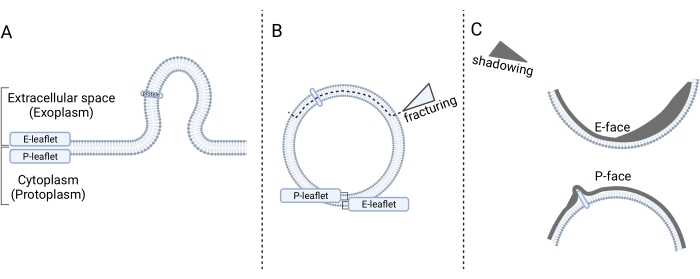
الشكل 1: عرض تخطيطي لتحديد الغشاء بعد تكسير التجميد . (أ) برعم الحويصلات الدقيقة من غشاء البلازما إلى الفضاء خارج الخلية. (ب) تقتصر الحويصلات الدقيقة على نشرة الغشاء P و E حتى تجزئ التجميد ، مما يقسم المنشورات ويكشف عن المناظر الداخلية للمنشورات ، وتسمى الوجوه المكسورة. (C) بعد تظليل Pt / C ، يمكن تمييز وجهين مكسورين: الوجه البروتوبلازمي (P-face) ذو الشكل المحدب الذي يواجه السيتوبلازم (البروتوبلازم) والوجه الخارجي (E-face) مع شكل مقعر يواجه الفضاء خارج الخلية. تم إنشاء الشكل 1 باستخدام Biorender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
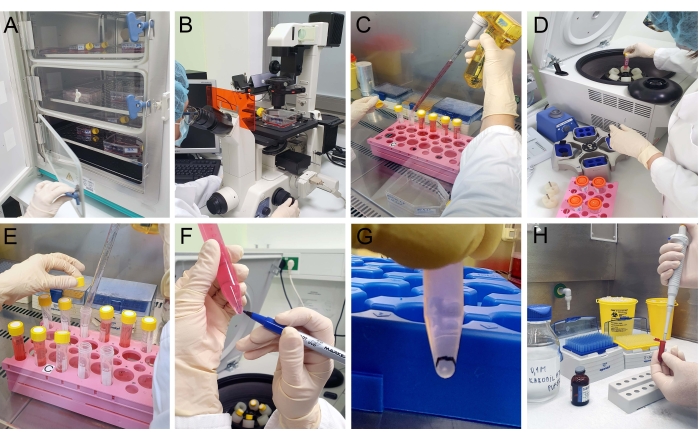
الشكل 2: عزل المركبات الكهربائية. (أ) يتم فحص خلايا T24 المزروعة في حاضنة CO2 باستخدام (B) مجهر ضوئي للتأكد من صلاحيتها والتقائها قبل عزل MV. (ج) يتم جمع وسط زراعة الخلايا و (د) يتم طرده مركزيا على التوالي عند 300 × جم وعند 2000 × جم (E) في كل مرة يتم فيها جمع المادة الفائقة. (F,G) بعد الطرد المركزي عند 10000 × جم ، تظهر رقعة بيضاء تشير إلى حبيبة ومعلمة. تتم إزالة supernatant ويضاف (H) المثبت بعناية إلى الكريات دون تعليقها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تجميد المركبات الكهربائية . (أ) يتم وضع علامة (ب) على حاملات النحاس النظيفة المجففة بالهواء مع حفرة مركزية قبل المعالجة. يتم إعادة تعليق الحويصلات الدقيقة في الجلسرين للحصول على عينة متجانسة و (C) تضاف إلى حفرة مركزية لحامل كوبر تحت المجهر المجسم. (د) يتعين على المرء أن يضيف حجما من العينة بحيث يشكل قطرة محدبة في الحفرة المركزية. (ه) قبل التجميد مباشرة ، امزج الفريون المبرد LN2 مع قضيب معدني لتسييل الفريون. (F) قم بتجميد العينة عن طريق غمرها في الفريون ، ثم (G) نقلها إلى LN2. (ح) يمكن جمع الناقلات التي تحتوي على العينة المجمدة في كريوفيالات وتخزينها في حاوية LN2 Dewar. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تكسير التجميد وصنع نسخة طبق الأصل. (أ) وحدة تكسير التجميد. يوجد داخل غرفة الوحدة (B) مسدس إلكترون من البلاتين (Pt) والكربون (C) وسكين وطاولة العينة. (ج) لبدء التكسير ، يتم نقل الناقلات مع العينة إلى جدول العينة ، (د) يتم تبريد وحدة تكسير التجميد ، ويتم إنشاء فراغ. (ه) يتم التقسيم عن طريق حركة السكين الآلية (F) ، ولكن يفضل أن يتم التكسير يدويا. (ز) عينة قبل التقسيم و (ح) بعد التكسير. (I) مباشرة بعد التكسير ، يتم صنع النسخة المتماثلة. (ي) أثناء هذه العملية، يتم تظليل Pt على العينة. ينظر إلى التظليل البلاتيني على أنه ضوء ساطع (شرر) في الغرفة. (ك) تجمع حاملات العينات في بئر خزفية مملوءة بالماء. (L) نسخة طبق الأصل (سهم) تطفو في محلول هيبوكلوريت الصوديوم أثناء خطوة التنظيف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: المجهر الإلكتروني ل MVs المكسورة بالتجميد و Pt / C المظللة. (A) نظرة عامة على بيليه EV المكسور بالتجميد والمظلل (i) عند التكبير الأدنى. السطح المتجانس هو الخلفية (ii) ، والمناطق الساطعة هي تمزق في النسخ المتماثلة (iii) ، والمناطق الداكنة هي طيات من النسخ المتماثلة (العلامة النجمية) ، والظلال الباهتة غير المنتظمة ناتجة عن بلورات الجليد (نجمتان). (ب) مجموعة من المركبات الكهربائية المستديرة الشكل ذات الأسطح المقعرة والمحدبة. (ج) التكبير العالي للمركبات الكهربائية. في الكسور المحدبة ، التي تظهر P-face لأغشية EV ، يتم رؤية جزيئات داخل الغشاء (أسهم) وبقع من سطح أملس (رؤوس الأسهم). تم العثور على حويصلات خارج الخلية ذات أشكال ممدودة (نجمة) وكرات مسطحة (نجمتان). (د) يبلغ متوسط قطر MVs البولية المعزولة 304 نانومتر ± 10 نانومتر وفقا لقياسات الحجم على النحو الذي اقترحه هاليت وآخرون 17. يتم تقديم البيانات كمتوسط ± SEM. (E ، F) E-face و P-face of MVs. Legend: الأسهم = جزيئات داخل الغشاء في P-face ، الأسهم المطوقة = اتجاه تظليل Pt / C. أشرطة المقياس: A = 10 ميكرومتر ، B-F = 400 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
إن توصيف MVs ، أو أي مجموعة أخرى من المركبات الكهربائية المعزولة ، له أهمية قصوى للبدء به قبل البدء في التحليلات النهائية مثل دراسات "omics" أو الدراسات الوظيفية11,18. هنا ، تم عزل EVs من خلايا T24 البولية الغازية لسرطان المثانة البشرية عن طريق الطرد المركزي ، وبعد البروتوكول المقدم للتحليل بواسطة المجهر الإلكتروني لكسر التجميد ، أثبتنا أن الجزء المعزول تم إثراؤه في MVs11,13. كان عزل MVs خاليا من حطام الخلايا أو العضيات ، مما يؤكد نجاح بروتوكول العزل والتنقية.
واحتفظ الجمع بين التثبيت الكيميائي والتجميد، وهما خطوتان حاسمتان في البروتوكول، بالشكل الكروي للمركبات الكهربائية12. ومع ذلك ، هناك حاجة إلى احتياطات عند تقييم قطر EV عن طريق تكسير التجميد17. نظرا لأن الكسر يمر عبر العينة بشكل عشوائي ، يتم تقسيم أغشية MV إلى مستوياتها الاستوائية وغير الاستوائية. لتوفير طريقة صارمة لتحليل صور العينات المكسورة والمظللة بالتجميد ، أظهر Hallett et al. أن متوسط قطر الحويصلة هو 4/π أضعاف الحجم الفعلي للقطر الحويصلي على الصورة17. مع الأخذ في الاعتبار ذلك ، تم حساب EVs من خلايا T24 على أن قطرها 304 نانومتر ، وهو ما يتناسب مع نطاق توزيع الحجم النظري ل MV من 100-1000 نانومتر19.
يمكن أن يكمل تكسير التجميد التلطيخ السلبي ، وهي تقنية TEM الأكثر استخداما على نطاق واسع لتصور المركبات الكهربائية. عن طريق التلطيخ السلبي ، عادة ما تكون العينة ثابتة كيميائيا ومجففة ومتصلة بشبكة TEM ، وتتناقض مع محلول اليورانيل. بدون دعم الوسائط ، تميل المركبات الكهربائية إلى الانهيار ، مما يمنحها مظهرا على شكل كوب. من خلال تكسير التجميد ، نظهر أن MVs عبارة عن كرات ، والتي تعكس شكلها في المساحات خارج الخلية وسوائل الجسم12. وبذلك، تتفق نتائجنا أيضا مع ملاحظات المركبات الكهربائية في الأقسام الرقيقة جدا المبردة20.
تتمثل إحدى المزايا الحاسمة لتقنية كسر التجميد في قدرتها على حل التنظيم الداخلي للغشاء المحدد ، وهو عامل رئيسي في فهم كيفية استهداف المركبات الكهربائية للأغشية المتلقية وتفاعلها معها. هنا ، قمنا بتحليل أغشية MVs ، ومع ذلك يمكن أن يكشف تكسير التجميد عن تنظيم الغشاء لأي مجموعة أخرى من المركبات الكهربائية. يتم تشكيل MVs عن طريق تبرعم غشاء البلازما. لذلك ، من المتوقع أن توجد بروتينات غشاء البلازما ومجموعات البروتين في غشاء MV. دعمت نتائجنا أن MVs من خلايا T24 تحتوي على جزيئات داخل الغشاء ، وتقدم بروتينات غشاء متكاملة. استنادا إلى توزيع الجسيمات بين E-face و P-face ، من المعقول أن نتوقع أن الجسيمات التي لوحظت في MVs هي بروتينات عبر الغشاء uroplakins ، وهي خلية عظمية خاصة21,24. كانت الجسيمات المرصودة متناثرة ، وهو ما يتوافق مع الدراسات السابقة التي أبلغت عن انخفاض في uroplakins أثناء التسرطن البولي 21،22،23. ومع ذلك ، لمزيد من التحقيق في تكوين البروتين لأغشية MV ، يوصى باستخدام تقنية وضع العلامات المناعية المقلدة لكسر التجميد (FRIL). FRIL هو ترقية لتقنية كسر التجميد المقدمة وهو مكرس للكشف عن هوية البروتينات في النسخ المتماثلة عن طريق التعرف على الأجسام المضادة24,25. باختصار ، فإن تقنية كسر التجميد هي تقنية مجهر إلكتروني مناسبة لتوصيف الغشاء المحدد لل EV ، وكذلك شكل وحجم ونقاء أجزاء EV المعزولة. ويمكن استخدام البروتوكول المقدم أيضا لتقييم المجموعات السكانية الأخرى من المركبات الكهربائية المعزولة؛ لذلك ، فإن تقنية تكسير التجميد تستحق إدراجها في إرشادات الجمعية الدولية للحويصلات خارج الخلية للدراسات التي تستكشف تنظيم أغشية الحد من EV.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا البحث من قبل وكالة البحوث السلوفينية (رقم التمويل الأساسي للبحوث. P3-0108 والمشروع J7-2594) وبرنامج البنية التحتية MRIC UL IP-0510. يساهم هذا العمل في الشبكة الدولية COST Action CA17116 لترجمة البحوث المتعلقة بمشتقات الفترة المحيطة بالولادة إلى نهج علاجية (SPRINT) ، بدعم من COST (التعاون الأوروبي في العلوم والتكنولوجيا). يود المؤلفون أن يشكروا ليندا ستروس وسانيا تشابراجا وندى بافليكا دوباريتش وسابينا زيليزنيك على المساعدة التقنية في زراعة الخلايا وإعداد العينات وماركو فوغرينك وأوتا سيركا روس ديبيفيك للمساعدة التقنية في إعداد الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| A-DMEM | ThermoFisher Scientific, USA | 12491015 | |
| Balzers freeze-fracture device | Balzers AG, Liechtenstein | Balzers BAF 200 | |
| Centrifuge | Eppendorf, Germany | model 5810R | |
| CO2 incubator HeraCell | Heraues, Germany | ||
| Copper carriers | Balzers | BB 113 142-2 | 100+ mesh |
| Copper grids | SPI, United States | 2010C | |
| Culture flask T75 | TPP, Switzerland | growing surface 75 cm2 | |
| F12 (HAM) | Sigma-Aldrich, Germany | 21765029 | |
| FBS | Gibco, Life Technologies, USA | 10500064 | |
| Glazed Porcelain Plate 6 Well | Fischer Sientific, United States | 50-949-072 | |
| Glycerol | Kemika, Croatia | 711901 | final concentration 30 % (v/v) |
| Glutaradehyde | Serva, Germany | 23114.01 | final concentration 2.5 % (v/v) |
| GlutaMAX | Gibco, Life Technologies | 35050-079 | final concentration 4 mM |
| Penicillin | Gibco, Life Technologies | 15140163 | final concentration 100 U/ml |
| Phase-contast inverted microscope | Nikon, Japan | model Eclipse | |
| Rotor | Eppendorf, Germany | A 4-44 | |
| Rotor | Eppendorf, Germany | F-34-6-38 | |
| Serological pipetts | TPP, Switzerland | 50mL volume | |
| Sodium hypochloride solution in water | Carlo Erba, Italy | 481181 | |
| Stereomicroscope | Leica, Germany | ||
| Streptomycin | Gibco, Life Technologies | 35050038 | final concentration 100 mg/mL |
| Transmission electron microscope | Philips, The Netherlands | model CM100 | working at 80 kV |
| Tweezers | SPI, United States |
References
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. The Journal of Cell Biology. 200 (4), 373-383 (2013).
- Willms, E., Cabanas, C., Mager, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: Subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers in Immunology. 9, 738(2018).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19, 213-228 (2018).
- Cocucci, E., Racchetti, G., Meldolesi, J. Shedding microvesicles: Artefacts no more. Trends in Cell Biology. 19 (2), 43-51 (2009).
- Urabe, F., et al. Extracellular vesicles as biomarkers and therapeutic targets for cancer. American Journal of Physiology-Cell Physiology. 318 (1), 29-39 (2020).
- Tricarico, C., Clancy, J., D'Souza-Schorey, C. Biology and biogenesis of shed microvesicles. Small GTPases. 8 (4), 220-232 (2017).
- Georgantzoglou, N., Pergaris, A., Masaoutis, C., Theocharis, S. Extracellular vesicles as biomarkers carriers in bladder cancer: Diagnosis, surveillance, and treatment. International Journal of Molecular Sciences. 22 (5), 2744(2021).
- Słomka, A., Urban, S. K., Lukacs-Kornek, V., Żekanowska, E., Kornek, M. Large extracellular vesicles: Have we found the holy grail of inflammation. Frontiers in Immunology. 9, 2723(2018).
- Han, L., Lam, E. W. F., Sun, Y. Extracellular vesicles in the tumor microenvironment: Old stories, but new tales. Molecular Cancer. 18 (1), 59(2019).
- Muralidharan-Chari, V., Clancy, J. W., Sedgwick, A., D'Souza-Schorey, C. Microvesicles: Mediators of extracellular communication during cancer progression. Journal of Cell Science. 123, 1603-1611 (2010).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences of the United States of America. 113 (8), 968-977 (2016).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3, Unit 3.22 (2006).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Severs, N. J. Freeze-fracture electron microscopy. Nature Protocols. 2 (3), 547-576 (2007).
- Severs, N. J., Robenek, H. Freeze-fracture cytochemistry in cell biology. Methods in Cell Biology. 88, 181-186 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Hallett, F. R., Nickel, B., Samuels, C., Krygsman, P. H. Determination of vesicle size distributions by freeze-fracture electron microscopy. Journal of Electron Microscopy Technique. 17 (4), 459-466 (1991).
- Nigro, A., et al. Selective loss of microvesicles is a major issue of the differential centrifugation isolation protocols. Scientific Reports. 11, 3589(2021).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18 (6), 1153(2017).
- Iliev, D., et al. Stimulation of exosome release by extracellular DNA is conserved across multiple cell types. The FEBS Journal. 285 (16), 3114-3133 (2018).
- Zupančič, D., Zakrajšek, M., Zhou, G., Romih, R. Expression and localization of four uroplakins in urothelial preneoplastic lesions. Histochemistry and Cell Biology. 136 (4), 491-500 (2011).
- Wu, X. R., Manabe, M., Yu, J., Sun, T. T. Large scale purification and immunolocalization of bovine uroplakins I, II, and III. Molecular markers of urothelial differentiation. The Journal of Biological Chemistry. 265 (31), 19170-19179 (1990).
- Kreft, M. E., Hudoklin, S., Jezernik, K., Romih, R. Formation and maintenance of blood-urine barrier in urothelium. Protoplasma. 246 (1-4), 3-14 (2010).
- Kreft, M. E., Robenek, H. Freeze-fracture replica immunolabelling reveals urothelial plaques in cultured urothelial cells. PLoS One. 7 (6), 38509(2012).
- Robenek, H., et al. Topography of lipid droplet-associated proteins: Insights from freeze-fracture replica immunogold labeling. Journal of Lipids. 2011, 409371(2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved