Method Article
Microscopia elettronica a frattura da congelamento per l'analisi delle vescicole extracellulari
In questo articolo
Riepilogo
Presentiamo un protocollo per l'isolamento e la congelamento-fratturazione di vescicole extracellulari (EV) provenienti da cellule uroteliali cancerose. La tecnica di congelamento-frattura ha rivelato il diametro e la forma dei veicoli elettrici e, come caratteristica unica, l'organizzazione interna delle membrane EV. Questi sono di immensa importanza per capire come i veicoli elettrici interagiscono con le membrane riceventi.
Abstract
Le vescicole extracellulari (EV) sono strutture limitate dalla membrana rilasciate dalle cellule nello spazio extracellulare e sono implicate nella comunicazione intercellulare. I veicoli elettrici sono costituiti da tre popolazioni di vescicole, vale a dire microvescicole (MV), esosomi e corpi apoptotici. La membrana limitante degli EV è coinvolta in modo cruciale nelle interazioni con le cellule riceventi, che potrebbero portare al trasferimento di molecole biologicamente attive alle cellule riceventi e, di conseguenza, influenzare il loro comportamento. La tecnica di microscopia elettronica a frattura da congelamento viene utilizzata per studiare l'organizzazione interna delle membrane biologiche. Qui, presentiamo un protocollo per l'isolamento MV da cellule uroteliali cancerose in coltura e la frattura da congelamento dei MV nelle fasi di congelamento rapido, fratturazione, produzione e pulizia delle repliche e analizzandole con microscopia elettronica a trasmissione. I risultati mostrano che il protocollo per l'isolamento produce una popolazione omogenea di veicoli elettrici, che corrispondono alla forma e alle dimensioni dei veicoli commerciali leggeri. Le particelle intramembrana si trovano principalmente nella faccia protoplasmatica della membrana limitante. Quindi, la frattura da congelamento è la tecnica di scelta per caratterizzare il diametro, la forma e la distribuzione delle proteine di membrana dei MV. Il protocollo presentato è applicabile ad altre popolazioni di veicoli elettrici.
Introduzione
Le vescicole extracellulari (EV) sono vescicole limitate alla membrana rilasciate dalle cellule nello spazio extracellulare. Le tre principali popolazioni di veicoli elettrici sono esosomi, microvescicole (MV) e corpi apoptotici, che differiscono per origine, dimensioni e composizione molecolare 1,2,3. La composizione dei veicoli elettrici riflette il profilo molecolare della cellula donatrice e il suo stato fisiologico (cioè sano o malato)4,5. Ciò offre ai veicoli elettrici un immenso potenziale nella diagnosi, nella prognosi e nella terapia delle malattie umane e hanno promettenti applicazioni mediche per l'uso nella medicina personalizzata 6,7,8.
I veicoli elettrici sono mediatori della comunicazione intercellulare. Contengono proteine biologicamente attive, lipidi e RNA, che interferiscono con i processi biologici nella cellula ricevente e possono modificarne il comportamento 9,10. Tuttavia, la composizione della membrana limitante EV è cruciale per l'interazione con la membrana cellulare ricevente.
Le fonti di veicoli elettrici sono fluidi corporei e terreni di coltura condizionati. Per isolare una popolazione EV, è necessario utilizzare una tecnica di isolamento adeguata. Ad esempio, la centrifugazione a 10.000 × g produce una frazione arricchita in MV, mentre forze centrifughe di ≥ 100.000 × g producono una frazione arricchita in esosomi11,12. La frazione isolata di veicoli elettrici deve essere convalidata in termini di purezza, dimensioni e forma. A tal fine, l'International Society for Extracellular Vesicles 2018 ha raccomandato tre classi di tecniche di imaging ad alta risoluzione: microscopia elettronica, microscopia a forza atomica e microscopia a super-risoluzione basata sulla microscopia ottica13. Nessuna di queste tecniche può fornire informazioni sull'interno della membrana EV.
La microscopia elettronica a frattura da congelamento è una tecnica di rottura di campioni congelati per rivelare le loro strutture interne, in particolare dando una visione dell'interno della membrana. Le fasi di preparazione del campione sono (1) congelamento rapido, (2) fratturazione, (3) realizzazione della replica e (4) pulizia della replica14. Nella fase 1, il campione è (facoltativamente) fissato chimicamente, crioprotetto con glicerolo e congelato in freon liquido. Nella fase 2, il campione congelato viene fratturato in un'unità di congelamento-frattura, che espone l'interno del doppio strato di membrana. Nella fase 3, le facce fratturate esposte sono ombreggiate con platino (Pt) e carbonio (C) per produrre repliche. Nel passaggio 4, il materiale organico viene rimosso. La replica viene analizzata al microscopio elettronico a trasmissione (TEM). Per un'interpretazione accurata delle micrografie, è necessario seguire le linee guida per il loro corretto orientamento14,15. In breve, la direzione delle ombre nella micrografia è un riferimento per orientare la micrografia (cioè per determinare la direzione dell'ombreggiatura pt) e, di conseguenza, per determinare forme convesse e concave (Figura 1). Due viste interne chiamate facce fratturate del doppio strato di membrana possono essere viste come risultato della scissione della membrana mediante fratturazione del congelamento: la faccia protoplasmatica (P-face) e la faccia esoplasmatica (E-face). La faccia P rappresenta il foglietto di membrana adiacente al protoplasma cellulare, mentre la faccia E rappresenta il foglietto di membrana adiacente allo spazio extracellulare. Le proteine di membrana integrali e le loro associazioni sono viste come particelle intramembrana sporgenti14,15.
Qui, l'obiettivo è applicare la tecnica della frattura da congelamento per caratterizzare i MV in termini di dimensioni, forma e struttura della loro membrana limitante. Qui presentiamo un protocollo per l'isolamento e la congelamento-fratturazione di CV provenienti da cellule uroteliali cancerose della vescica invasive umane.
Protocollo
1. Coltivazione di cellule uroteliali cancerose e isolamento dei veicoli elettrici
NOTA: Viene presentato un protocollo per ottenere EV da una linea cellulare uroteliale (T24) invasiva del cancro della vescica umana. Tuttavia, le condizioni di coltura devono essere ottimizzate per utilizzare altri tipi di cellule.
- Cellule T24 a piastra con una densità di 3 × 104 celle/cm2 in tre palloni (superficie di crescita di 75 cm2) e iniziano con la coltura delle cellule in un incubatore a CO2 per 3 giorni a 37 °C e un CO2 al 5% (Figura 2A).
- Utilizzare un terreno di coltura per le cellule T24 in una miscela 1:1 (v/v) di A-DMEM e F12 integrata con il 5% di siero bovino fetale (FBS), 4 mM Glutamax, 100 mg/mL di streptomicina e 100 U/mL di penicillina.
NOTA: il seguente isolamento produce veicoli elettrici arricchiti in CV. Prima di iniziare l'isolamento, ispezionare le cellule con un microscopio ottico per confermare la vitalità e la confluenza (Figura 2B). Inizia a raccogliere i veicoli elettrici dai terreni di coltura condizionati quando le cellule T24 sono al 70% di confluenza.
- Utilizzare un terreno di coltura per le cellule T24 in una miscela 1:1 (v/v) di A-DMEM e F12 integrata con il 5% di siero bovino fetale (FBS), 4 mM Glutamax, 100 mg/mL di streptomicina e 100 U/mL di penicillina.
- Raccogliere il terreno di coltura con MV con una pipetta da palloni (T75) in tubi conici per centrifughe (Figura 2C). Centrifugare a 300 × g per 10 min a 4 °C (Figura 2D).
- Raccogliere con cura il surnatante in un nuovo tubo centrifugo con la pipetta (Figura 2E).
- Centrifugare il surnatante a 2.000 × g per 20 min a 4 °C.
- Raccogliere con cura il surnatante con la pipetta in un nuovo tubo centrifugo.
- Centrifugare a 10.000 × g per 40 min a 4 °C. Cerca la presenza di un pellet biancastro nella parte inferiore del tubo.
NOTA: se necessario, cambiare il rotore della centrifuga per raggiungere la forza g richiesta. Il pellet EV è visto come un pellet bianco sul fondo del tubo della centrifuga (Figura 2F); contrassegnare la sua posizione per evitare di perdere il pellet durante il pipettaggio (Figura 2G). - Scartare con attenzione il surnatante con una pipetta. Al pellet, aggiungere 1,5 ml di PBS e risospesciare il pellet contenente CV. Inserire la sospensione in un nuovo tubo di centrifuga.
- Centrifugare a 10.000 × g per 40 min a 4 °C e cercare la presenza di un pellet bianco sul fondo del tubo.
NOTA: Il pellet EV è visto come una macchia bianca nella parte inferiore del tubo della centrifuga; segnare la sua posizione per evitare di perdere il pellet durante il pipettaggio. - Scartare con attenzione il surnatante con una pipetta. Aggiungere delicatamente il fissativo glutaraldeide al 2,5% in tampone cacodilato di sodio 0,1 M (pH 7,2). Lasciare agire per 20 minuti a 4 °C (Figura 2H).
ATTENZIONE: La glutaraldeide e il cacodilato di sodio sono tossici. Lavora in una cappa aspirante, indossa guanti protettivi e scartali in modo appropriato. - Rimuovere con attenzione il fissativo con una pipetta. Aggiungere il tampone di lavaggio (tampone cacodilato di sodio 0,1 M) al pellet. Lasciare agire per 10 minuti a 4 °C senza riutilizzare il pellet.
2. Congelamento dei veicoli elettrici
NOTA: Prima del congelamento, prima crioproteggere i campioni con glicerolo.
- Preparare il tampone di cacodilato di sodio 0,1 M. Rimuovere il tampone di lavaggio e aggiungere 50 μL di glicerolo al 30% in tampone cacodilato da 0,1 M. Risospese delicatamente i veicoli elettrici per rendere omogenea la soluzione. Incubare per 30 minuti a 4 °C.
- Pulire i supporti di rame con una fossa centrale nel bagno ad ultrasuoni con cloroformio per 5 minuti (Figura 3A). Asciugarli all'aria e contrassegnarli con colori se si utilizzano più campioni (Figura 3B). Fino all'uso, tenere i supporti in un luogo asciutto e pulito (ad esempio, su carta per lenti in una capsula di Petri). Non toccare i supporti a mani nude.
- Preparare pipette, soluzioni, carta da filtro, pinzette, uno stereomicroscopio, un pallone Dewar con freon e azoto liquido (LN2), un'asta metallica e crioviali. Raffreddarlo con LN2.
ATTENZIONE: Indossare dispositivi di protezione e lavorare di conseguenza quando si maneggia LN2 e freon raffreddato.
- Preparare pipette, soluzioni, carta da filtro, pinzette, uno stereomicroscopio, un pallone Dewar con freon e azoto liquido (LN2), un'asta metallica e crioviali. Raffreddarlo con LN2.
- Risospendare nuovamente i veicoli elettrici prima di congelare. Evitare la formazione di bolle d'aria.
NOTA: eseguire rapidamente i passaggi da 2.4 a 2.7. - Lavorare sotto uno stereomicroscopio (Figura 3C). Trasferire 1,5-1,7 μL del campione nella fossa centrale del supporto di rame per ottenere una goccia convessa che raggiunge più in alto del bordo portante in rame senza versare il campione sul bordo (Figura 3D). In caso di sovrasalvazione, utilizzare carta da filtro per asciugare l'anello esterno del supporto.
- Mescolare il freon solidificato con un'asta metallica per liquefarlo di nuovo (Figura 3E).
- Afferrare l'anello esterno del supporto di rame con una pinzetta e immergerlo nel freon raffreddato con un delicato scuotimento di pinzette per 8 s (Figura 3F). Dopo 8 s, trasferire rapidamente il vettore in un altro pallone Dewar riempito con LN2.
- Procedere immediatamente con la fratturazione o la conservazione dei campioni in LN2. In quest'ultimo caso, contrassegnare una crioviale e raffreddare le punte del flaconcino e della pinzetta immergendole in LN2 (Figura 3G). Sotto LN2, raccogliere i supporti di rame congelati nel flaconcino, chiuderlo e conservarli nel contenitore LN2 (Figura 3H) fino a quando non si congela la fratturazione.
3. Fratturazione dei veicoli elettrici e realizzazione delle repliche
NOTA: Preparare l'unità di congelamento-fratturazione secondo le istruzioni per l'uso del produttore. (Figura 4A). Pulire la camera dell'unità. Posizionare le pistole in platino (Pt/C) e carbonio (C) ad angoli rispettivamente di 45° e 90° (Figura 4B).
- Avviare il sistema di aspirazione dell'unità. Quando viene raggiunta una pressione di 6,6 × 10−2 Pa (5 × 10−4 Torr), raffreddare la camera unitaria a -150 °C.
- Trasferire i supporti di rame con campioni congelati in un'unità di congelamento-fratturazione utilizzando pinzette a secco (Figura 4C). Utilizzare il criotransfer o lavorare velocemente per evitare lo scongelamento del campione e la deposizione dei cristalli di ghiaccio. Fissare i supporti sul tavolo del campione.
- Attendere che il vuoto raggiunga nuovamente 6,6 × 10−2 Pa (5 × 10−4 Torr), quindi impostare la temperatura del coltello a -100 °C (Figura 4D).
- Attendere che il vuoto raggiunga 1,0 × 10−3 Pa (8 × 10−6 Torr).
- Osservare il campione con un binocolo e avvicinarsi attentamente al coltello (Figura 4E).
- Iniziare a sezionare il campione attivando il movimento motorizzato del coltello (Figura 4F) e sezionare fino a quando la superficie del campione è liscia (Figura 4G).
- Per la fratturazione, spegnere il movimento motorizzato del coltello e procedere con un lento controllo manuale del coltello, fratturando così il campione (Figura 4H). Per proteggere la superficie fratturata dalla formazione di cristalli di ghiaccio e detriti fino all'ombreggiatura, spostare il coltello sopra il campione fratturato.
- Procedere con l'ombreggiatura Pt a 45° (Figura 4I, J).
- Preparare un cronometro e/o accendere il monitor in cristallo di quarzo sull'unità di congelamento-fratturazione, che consentirà la supervisione dello spessore del Pt sul campione. Lo spessore consigliato dello strato di Pt misurato sul monitor di cristallo di quarzo è di 2,5 nm, che corrisponde a 4 s di ombreggiatura a una data alta tensione e corrente (cioè, la velocità di ombreggiatura Pt è 0,63 nm / s).
- Prima di iniziare l'ombreggiatura, allontanare il coltello dal campione. Applicare un'alta tensione sulla pistola Pt/C (1.600 V) e aumentare la corrente a 60 mA. Dovrebbero apparire scintille di Pt e dovrebbero iniziare a ombreggiare il campione. A questo punto, avviare il conto alla rovescia dei 4 s e/o osservare e localizzare la posizione del Pt sul monitor a cristallo di quarzo.
NOTA: lo spessore consigliato dello strato C è di 2,5 nm, che corrisponde a 10 s di ombreggiatura ad una data alta tensione e corrente. - Spegnere la corrente e l'alta tensione quando si ottiene lo spessore desiderato di Pt.
- Procedere con l'ombreggiatura C a 90° (cioè, la velocità dell'ombreggiatura C è 0,25 nm/s).
- Applicare alta tensione sulla pistola C (1.900 V), aumentare la corrente a 90 mA e dovrebbero apparire scintille di C e iniziare a ombreggiare il campione; in quel momento, inizia il conto alla rovescia di 10 s. Spegnere la corrente e l'alta tensione quando si ottiene lo spessore desiderato di C.
4. Pulizia delle repliche e analisi delle repliche
- Utilizzare i supporti di rame dal tavolo dei campioni e trasferirli con una pinzetta in acqua distillata a temperatura ambiente in una piastra di porcellana a 12 pozzetti (Figura 4K). Le repliche galleggieranno sulla superficie dell'acqua, mentre i vettori affonderanno (Figura 4L).
- Trasferire le repliche con un anello di filo dall'acqua distillata in un pozzo con ipoclorito di sodio. Coprire e lasciare per una notte a temperatura ambiente in una cappa aspirante.
ATTENZIONE: L'ipoclorito di sodio è tossico. Lavora in una cappa aspirante, indossa guanti protettivi e scartali in modo appropriato. - Trasferire le repliche a ddH2O e lavare per 30 min. Ripeti 3 volte.
- Trasferire le repliche con un anello di filo su una griglia TEM in rame a rete (ad esempio, mesh quadrata o a nido d'ape 100+). Asciugare all'aria le griglie per 2 ore, quindi conservarle in una scatola di stoccaggio della griglia fino al microscopio.
NOTA: Generalmente, le griglie possono essere conservate per mesi in condizioni di temperatura ambiente buie, asciutte. - Utilizzare un microscopio TEM per visualizzare le repliche e ottenere micrografie.
- Per fare ciò, inserire una griglia TEM con una replica e avviare l'imaging TEM in base ai manuali operativi del produttore. Lavorare a 80 kV o 100 kV.
- Ispezionare il campione e acquisire micrografie a ingrandimenti sempre più bassi con una telecamera su TEM.
- Analizza le micrografie dei MV. Per le misurazioni dei diametri MV, utilizzare il software Fiji/ImageJ16. Il diametro dei MV è 4/π volte la misurazione sulle micrografie secondo Hallett et al.17.
Risultati
I MV sono stati isolati dal mezzo condizionato delle cellule T24 uroteliali tumorali dopo centrifugazioni differenziali. Seguendo il protocollo, la frazione EV è stata rilevata per la prima volta dopo la centrifugazione a 10.000 × g quando è stata vista come un pellet bianco (Figura 2G).
Successivamente, i veicoli elettrici sono stati elaborati secondo il protocollo di cui sopra ed esaminati nell'ambito del TEM. L'ombreggiatura Pt/C ha prodotto (Figura 4L) repliche relativamente grandi che spesso si sono suddivise in frammenti più piccoli durante la fase di pulizia. Grandi repliche e i loro frammenti più piccoli sono stati raccolti sulla griglia TEM e confrontati al microscopio. I risultati non hanno mostrato differenze nella qualità delle superfici di replica indipendentemente dalle loro dimensioni e possono, quindi, essere utilizzate tutte. Gli esami a basso ingrandimento hanno mostrato regioni della replica con i) una superficie omogenea (sfondo), ii) profili sferici concavi e convessi (vescicole) e iii) regioni di superficie danneggiata (artefatti; Figura 5A). I manufatti tipici sono stati visti come rotture, pieghe e ombre dimmer irregolari (cioè repliche di depositi di cristalli di ghiaccio sull'esemplare). È anche importante notare che non sono stati osservati detriti cellulari o organelli cellulari, confermando la purezza del campione (Figura 5B).
Le vescicole isolate sono state comunemente raccolte in gruppi di tre o più o sono state distribuite individualmente (Figura 5B). Le vescicole erano sferiche, il che indica una buona conservazione dell'ultrastruttura durante l'isolamento, la fissazione e il congelamento (Figura 5C). "Flat-ball" e vescicole allungate (Figura 5C), che sono state viste occasionalmente, erano presumibilmente artefatti di preparazione e non sono state incluse nelle successive misurazioni del diametro delle vescicole. Il diametro dei profili visibili era di 238,5 nm (±8,0 nm, n = 190), che, tenendo conto del fattore di correzione proposto da Hallett et al.17, corrisponde al diametro medio della vescicola di 304 nm (±10 nm; Figura 5D). La dimensione è correlata a un intervallo di diametri di MV tra 100 nm e 1000 nm e dimostra l'efficacia del protocollo di isolamento utilizzato. Le immagini delle vescicole insieme alla determinazione del diametro hanno confermato inequivocabilmente che i veicoli elettrici nell'isolato erano arricchiti con CV.
L'analisi delle repliche ha rivelato l'organizzazione di P-face ed E-face delle membrane limitanti MV. I MV sono stati osservati come forme rotonde concave e convesse (Figura 5C, E, F), che riflettono il piano di frattura. Le forme convesse rappresentano E-facce (cioè foglie esoplasmatiche fratturate delle membrane; Figura 5E). Le facce esoplasmatiche dei veicoli elettrici avevano un aspetto liscio e uniforme. Le forme concave corrispondono alle facce P (Figura 5F). Nelle facce P, alcune particelle intramembrana sporgenti sono state osservate all'interno di membrane lisce (Figura 5C, F). Ciò implica che i MV isolati dalle cellule T24 uroteliali tumorali contengono solo una bassa quantità di proteine di membrana.
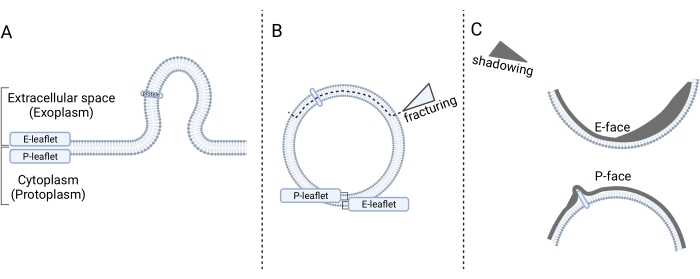
Figura 1: Presentazione schematica della determinazione della membrana dopo la fratturazione del congelamento. (A) Le microvescicole germogliano dalla membrana plasmatica nello spazio extracellulare. (B) La microvescicola è limitata con il foglietto della membrana P ed E fino al frazionamento congelante, che divide i foglietti ed espone le viste interne dei volantini, chiamati facce fratturate. (C) Dopo l'ombreggiatura pt/C, si distinguono due facce fratturate: la faccia protoplasmatica (faccia P) con una forma convessa rivolta verso il citoplasma (protoplasma) e una faccia esoplasmatica (E-face) con una forma concava rivolta verso lo spazio extracellulare. La Figura 1 è stata creata utilizzando Biorender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
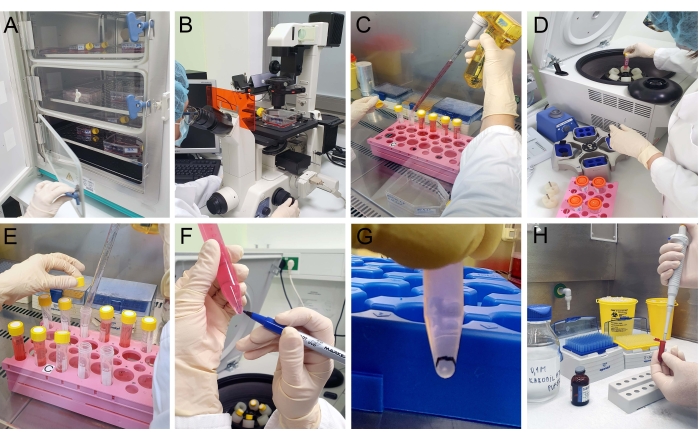
Figura 2: Isolamento dei veicoli elettrici. (A) Le cellule T24 cresciute in un incubatore a CO2 vengono esaminate con (B) un microscopio ottico per confermare la loro vitalità e confluenza prima dell'isolamento MV. (C) Il terreno di coltura cellulare viene raccolto e (D) centrifugato consecutivamente a 300 × g e a 2.000 × g (E) ogni volta che il surnatante viene raccolto. (F,G) Dopo la centrifugazione a 10.000 × g, una macchia bianca che indica un pellet è visibile e contrassegnata. Il surnatante viene rimosso e (H) il fissativo viene accuratamente aggiunto al pellet senza risospenderlo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Congelamento dei veicoli elettrici. (A) I supporti in rame pulito essiccati all'aria con una fossa centrale sono (B) contrassegnati prima della lavorazione. Le microvescicole vengono risospese in glicerolo per ottenere un campione omogeneo e (C) aggiunte a una fossa centrale di un vettore di bottaio sotto uno stereomicroscopio. (D) Si deve aggiungere un volume del campione in modo tale che formi una goccia convessa nella fossa centrale. (E) Immediatamente prima del congelamento, mescolare il freon raffreddato A LN2 con un'asta metallica per liquefare il freon. (F) Congelare il campione immergendolo nel freon, quindi (G) trasferirlo in LN2. (H) I vettori con il campione congelato possono essere raccolti in crioviali e conservati in un contenitore Dewar LN2 . Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Congelamento e creazione di una replica. (A) Unità di congelamento-fratturazione. All'interno della camera unitaria (B) c'è una pistola elettronica in platino (Pt) e carbonio (C), un coltello e la tabella dei campioni. (C) Per iniziare la fratturazione, i vettori con il campione vengono trasferiti alla tabella del campione, (D) l'unità di congelamento-fratturazione viene raffreddata e viene stabilito un vuoto. (E) Il sezionamento avviene mediante movimento motorizzato (F) del coltello, ma la fratturazione viene preferibilmente eseguita manualmente. (G) Campione prima del sezionamento e (H) dopo la fratturazione. (I) Immediatamente dopo la fratturazione, viene realizzata la replica. (J) Durante questo processo, il Pt viene ombreggiato sul campione. L'ombreggiatura in platino è vista come una luce brillante (scintille) nella camera. (K) I supporti del campione vengono raccolti in un pozzo di porcellana riempito d'acqua. (L) Replica (freccia) che galleggia nella soluzione di ipoclorito di sodio durante la fase di pulizia. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Micrografie elettroniche di MV con frattura da congelamento e con ombra Pt/C. (A) Una panoramica del pellet EV fratturato da congelamento e in ombra (i) a basso ingrandimento. La superficie omogenea è di sfondo (ii), le aree luminose sono rotture nelle repliche (iii), le aree più scure sono pieghe di repliche (asterisco) e ombre irregolari più deboli sono dovute a cristalli di ghiaccio (due asterischi). (B) Cluster di veicoli elettrici di forma rotonda con superfici concave e convesse. (C) Elevato ingrandimento dei veicoli elettrici. Nelle fratture convesse, che presentano la faccia P delle membrane EV, si osservano particelle intramembrana (frecce) e macchie di una superficie liscia (punte di freccia). Si trovano vescicole extracellulari con forme allungate (stella) e a sfera piatta (due stelle). (D) Il diametro medio dei MV uroteliali isolati è di 304 nm ± 10 nm secondo le misurazioni dimensionali proposte da Hallett et al.17. I dati sono presentati come ± SEM. (E,F) E-face e P-face dei MV. Legenda: frecce = particelle intramembrana in P-face, frecce circondate = la direzione dell'ombreggiatura Pt/C. Barre di scala: A = 10 μm, B-F = 400 nm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La caratterizzazione dei MV, o di qualsiasi altra popolazione di veicoli elettrici isolati, è di primaria importanza per iniziare prima di iniziare analisi a valle come studi "omici" o studi funzionali11,18. Qui, i veicoli elettrici di cellule T24 uroteliali invasive del cancro della vescica umano sono stati isolati mediante centrifugazione e, seguendo il protocollo fornito per l'analisi mediante microscopia elettronica a frattura da congelamento, abbiamo dimostrato che la frazione isolata è stata arricchita in ML11,13. L'isolato dei MV era privo di detriti cellulari o organelli, confermando un protocollo di isolamento e purificazione di successo.
La combinazione di fissazione chimica e congelamento, che sono passaggi critici del protocollo, ha mantenuto la forma sferica dei veicoli elettrici12. Tuttavia, sono necessarie precauzioni quando si valuta il diametro ev mediante congelamento-fratturazione17. Poiché la frattura passa attraverso il campione in modo casuale, le membrane MV sono divise nei loro piani equatoriale e non equatoriale. Per fornire un metodo rigoroso per analizzare le immagini di campioni fratturati da congelamento e in ombra, Hallett et al. hanno dimostrato che il diametro medio delle vescicole è 4/π volte la dimensione effettiva del diametro vescicolare sull'immagine17. Tenendo conto di ciò, i veicoli elettrici delle celle T24 sono stati calcolati per avere un diametro di 304 nm, che si adatta all'intervallo di distribuzione teorica delle dimensioni della MV di 100-1000 nm19.
La fratturazione del congelamento può integrare la colorazione negativa, la tecnica TEM più ampiamente utilizzata per visualizzare i veicoli elettrici. Con la colorazione negativa, il campione viene comunemente fissato chimicamente, essiccato e attaccato a una griglia TEM e contrastato con la soluzione di uranile. Senza supporti multimediali, i veicoli elettrici tendono a collassare, il che conferisce loro un aspetto a forma di coppa. Con la fratturazione del congelamento, mostriamo che i MV sono sfere, che riflettono la loro forma negli spazi extracellulari e nei fluidi corporei12. Con ciò, i nostri risultati sono anche in accordo con le osservazioni dei veicoli elettrici nelle sezioni crio-ultrasottili20.
Un vantaggio cruciale della tecnica di congelamento-frattura è il suo potere di risolvere l'organizzazione interna della membrana limitante, che è un fattore chiave per capire come i veicoli elettrici sono mirati e interagiscono con le membrane riceventi. Qui, abbiamo analizzato le membrane dei veicoli commerciali leggeri, ma la fratturazione del congelamento potrebbe rivelare l'organizzazione della membrana di qualsiasi altra popolazione di veicoli elettrici. I MV sono formati dal germogliamento della membrana plasmatica; pertanto, si prevede che le proteine della membrana plasmatica e i cluster proteici si trovino nella membrana MV. I nostri risultati hanno supportato che i MV delle cellule T24 contenevano particelle intramembrana, presentando proteine di membrana integrali. Sulla base della distribuzione delle particelle tra la faccia E e la faccia P, è ragionevole aspettarsi che le particelle osservate nei MV siano uroplakins delle proteine transmembrana, che sono specifiche delle cellule uroteliali21,24. Le particelle osservate erano sparse, il che è in accordo con studi precedenti che riportavano una riduzione delle uroplachine durante la carcinogenesi uroteliale 21,22,23. Tuttavia, per studiare ulteriormente la composizione proteica delle membrane MV, si raccomanda l'uso della tecnica di immunodepurazione replica (FRIL) con frattura da congelamento. FRIL è un aggiornamento della tecnica di congelamento-frattura presentata ed è dedicato a rivelare l'identità delle proteine nelle repliche mediante riconoscimento anticorpale24,25. Per riassumere, la tecnica di congelamento-frattura è una tecnica di microscopia elettronica adatta alla caratterizzazione della membrana limitante EV, nonché alla forma, alle dimensioni e alla purezza delle frazioni EV isolate. Il protocollo presentato può essere utilizzato anche per la valutazione di altre popolazioni di veicoli elettrici isolati; pertanto, la tecnica di congelamento-fratturazione merita l'inclusione nelle linee guida della International Society for Extracellular Vesicles per gli studi che esplorano l'organizzazione delle membrane limitanti EV.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questa ricerca è stata finanziata dall'Agenzia di ricerca slovena (finanziamento di base della ricerca n. P3-0108 e progetto J7-2594) e il programma MRIC UL IP-0510 Infrastructure. Questo lavoro contribuisce all'azione COST CA17116 International Network for Translating Research on Perinatal Derivatives into Therapeutic Approaches (SPRINT), sostenuta da COST (European Cooperation in Science and Technology). Gli autori desiderano ringraziare Linda Štrus, Sanja Čabraja, Nada Pavlica Dubarič e Sabina Železnik per l'aiuto tecnico nella coltivazione cellulare e nella preparazione dei campioni e Marko Vogrinc, Ota Širca Roš e Nejc Debevec per l'aiuto tecnico nella preparazione del video.
Materiali
| Name | Company | Catalog Number | Comments |
| A-DMEM | ThermoFisher Scientific, USA | 12491015 | |
| Balzers freeze-fracture device | Balzers AG, Liechtenstein | Balzers BAF 200 | |
| Centrifuge | Eppendorf, Germany | model 5810R | |
| CO2 incubator HeraCell | Heraues, Germany | ||
| Copper carriers | Balzers | BB 113 142-2 | 100+ mesh |
| Copper grids | SPI, United States | 2010C | |
| Culture flask T75 | TPP, Switzerland | growing surface 75 cm2 | |
| F12 (HAM) | Sigma-Aldrich, Germany | 21765029 | |
| FBS | Gibco, Life Technologies, USA | 10500064 | |
| Glazed Porcelain Plate 6 Well | Fischer Sientific, United States | 50-949-072 | |
| Glycerol | Kemika, Croatia | 711901 | final concentration 30 % (v/v) |
| Glutaradehyde | Serva, Germany | 23114.01 | final concentration 2.5 % (v/v) |
| GlutaMAX | Gibco, Life Technologies | 35050-079 | final concentration 4 mM |
| Penicillin | Gibco, Life Technologies | 15140163 | final concentration 100 U/ml |
| Phase-contast inverted microscope | Nikon, Japan | model Eclipse | |
| Rotor | Eppendorf, Germany | A 4-44 | |
| Rotor | Eppendorf, Germany | F-34-6-38 | |
| Serological pipetts | TPP, Switzerland | 50mL volume | |
| Sodium hypochloride solution in water | Carlo Erba, Italy | 481181 | |
| Stereomicroscope | Leica, Germany | ||
| Streptomycin | Gibco, Life Technologies | 35050038 | final concentration 100 mg/mL |
| Transmission electron microscope | Philips, The Netherlands | model CM100 | working at 80 kV |
| Tweezers | SPI, United States |
Riferimenti
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. The Journal of Cell Biology. 200 (4), 373-383 (2013).
- Willms, E., Cabanas, C., Mager, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: Subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers in Immunology. 9, 738(2018).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19, 213-228 (2018).
- Cocucci, E., Racchetti, G., Meldolesi, J. Shedding microvesicles: Artefacts no more. Trends in Cell Biology. 19 (2), 43-51 (2009).
- Urabe, F., et al. Extracellular vesicles as biomarkers and therapeutic targets for cancer. American Journal of Physiology-Cell Physiology. 318 (1), 29-39 (2020).
- Tricarico, C., Clancy, J., D'Souza-Schorey, C. Biology and biogenesis of shed microvesicles. Small GTPases. 8 (4), 220-232 (2017).
- Georgantzoglou, N., Pergaris, A., Masaoutis, C., Theocharis, S. Extracellular vesicles as biomarkers carriers in bladder cancer: Diagnosis, surveillance, and treatment. International Journal of Molecular Sciences. 22 (5), 2744(2021).
- Słomka, A., Urban, S. K., Lukacs-Kornek, V., Żekanowska, E., Kornek, M. Large extracellular vesicles: Have we found the holy grail of inflammation. Frontiers in Immunology. 9, 2723(2018).
- Han, L., Lam, E. W. F., Sun, Y. Extracellular vesicles in the tumor microenvironment: Old stories, but new tales. Molecular Cancer. 18 (1), 59(2019).
- Muralidharan-Chari, V., Clancy, J. W., Sedgwick, A., D'Souza-Schorey, C. Microvesicles: Mediators of extracellular communication during cancer progression. Journal of Cell Science. 123, 1603-1611 (2010).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences of the United States of America. 113 (8), 968-977 (2016).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3, Unit 3.22 (2006).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Severs, N. J. Freeze-fracture electron microscopy. Nature Protocols. 2 (3), 547-576 (2007).
- Severs, N. J., Robenek, H. Freeze-fracture cytochemistry in cell biology. Methods in Cell Biology. 88, 181-186 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Hallett, F. R., Nickel, B., Samuels, C., Krygsman, P. H. Determination of vesicle size distributions by freeze-fracture electron microscopy. Journal of Electron Microscopy Technique. 17 (4), 459-466 (1991).
- Nigro, A., et al. Selective loss of microvesicles is a major issue of the differential centrifugation isolation protocols. Scientific Reports. 11, 3589(2021).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18 (6), 1153(2017).
- Iliev, D., et al. Stimulation of exosome release by extracellular DNA is conserved across multiple cell types. The FEBS Journal. 285 (16), 3114-3133 (2018).
- Zupančič, D., Zakrajšek, M., Zhou, G., Romih, R. Expression and localization of four uroplakins in urothelial preneoplastic lesions. Histochemistry and Cell Biology. 136 (4), 491-500 (2011).
- Wu, X. R., Manabe, M., Yu, J., Sun, T. T. Large scale purification and immunolocalization of bovine uroplakins I, II, and III. Molecular markers of urothelial differentiation. The Journal of Biological Chemistry. 265 (31), 19170-19179 (1990).
- Kreft, M. E., Hudoklin, S., Jezernik, K., Romih, R. Formation and maintenance of blood-urine barrier in urothelium. Protoplasma. 246 (1-4), 3-14 (2010).
- Kreft, M. E., Robenek, H. Freeze-fracture replica immunolabelling reveals urothelial plaques in cultured urothelial cells. PLoS One. 7 (6), 38509(2012).
- Robenek, H., et al. Topography of lipid droplet-associated proteins: Insights from freeze-fracture replica immunogold labeling. Journal of Lipids. 2011, 409371(2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon