Method Article
Microscopia eletrônica de fratura congelante para análise de vesícula extracelular
Neste Artigo
Resumo
Apresentamos um protocolo para o isolamento e fratura de congelamento de vesículas extracelulares (EVs) originárias de células cancerígenas uroteliais. A técnica de fratura congelante revelou o diâmetro e a forma dos EVs e como uma característica única- a organização interna das membranas EV. Estes são de imensa importância na compreensão de como os EVs interagem com as membranas receptoras.
Resumo
Vesículas extracelulares (EVs) são estruturas limitadas à membrana liberadas das células para o espaço extracelular e estão implicadas na comunicação intercelular. Os EVs consistem em três populações de vesículas, ou seja, microvesículos (MVs), exosóis e corpos apoptóticos. A membrana limitante dos EVs está crucialmente envolvida nas interações com as células receptoras, o que poderia levar à transferência de moléculas biologicamente ativas para as células receptoras e, consequentemente, afetar seu comportamento. A técnica de microscopia eletrônica de fratura congelante é usada para estudar a organização interna de membranas biológicas. Aqui, apresentamos um protocolo para o isolamento mv de células cancerígenas cultivadas e a fratura congelante de MVs nas etapas de congelamento rápido, fratura, fabricação e limpeza das réplicas, e analisá-las com microscopia eletrônica de transmissão. Os resultados mostram que o protocolo de isolamento produz uma população homogênea de EVs, que correspondem à forma e tamanho dos MVs. Partículas intramembranas são encontradas principalmente na face protoplasmática da membrana limitante. Assim, a fratura congelante é a técnica escolhida para caracterizar o diâmetro, a forma e a distribuição das proteínas da membrana. O protocolo apresentado é aplicável a outras populações de EVs.
Introdução
Vesículas extracelulares (EVs) são vesículas limitadas por membrana liberadas das células para o espaço extracelular. As três principais populações de EVs são exosóis, microvesículos (MVs) e corpos apoptóticos, que diferem em sua origem, tamanho e composição molecular 1,2,3. A composição dos EVs reflete o perfil molecular da célula doadora e seu estado fisiológico (ou seja, saudável ou doente)4,5. Isso dá aos EVs imenso potencial no diagnóstico, prognóstico e terapia de doenças humanas, e eles têm aplicações médicas promissoras para o uso em medicina personalizada 6,7,8.
EVs são mediadores de comunicação intercelular. Eles contêm proteínas biologicamente ativas, lipídios e RNAs, que interferem nos processos biológicos na célula receptora e podem mudar seu comportamento 9,10. No entanto, a composição da membrana limitante de EV é crucial para a interação com a membrana celular receptora.
As fontes de EVs são fluidos corporais e mídia cultural condicionada. Para isolar uma população de EV, deve-se utilizar uma técnica de isolamento adequada. Por exemplo, a centrifugação a 10.000 × g produz uma fração enriquecida em MVs, enquanto as forças centrífugas de ≥ 100.000 × g produzem uma fração enriquecida em exosóis11,12. A fração isolada de EVs deve ser validada em termos de pureza, tamanho e forma. Para isso, a Sociedade Internacional de Vesículas Extracelulares 2018 recomendou três classes de técnicas de imagem de alta resolução: microscopia eletrônica, microscopia de força atômica e microscopia de super-resolução à base de microscopialeve 13. Nenhuma dessas técnicas pode fornecer informações sobre o interior da membrana EV.
Microscopia eletrônica de fratura congelada é uma técnica de quebrar espécimes congelados para revelar suas estruturas internas, particularmente dando uma visão do interior da membrana. As etapas de preparação da amostra são (1) congelamento rápido, (2) fratura, (3) fazer a réplica e (4) limpar a réplica14. Na etapa 1, a amostra é (opcionalmente) quimicamente fixa, crioprotegida com glicerol e congelada em freon líquido. Na etapa 2, a amostra congelada é fraturada em uma unidade de fratura congelante, que expõe o interior da bicamadas de membrana. Na etapa 3, os rostos fraturados expostos são sombreados com platina (Pt) e carbono (C) para produzir réplicas. Na etapa 4, o material orgânico é removido. A réplica é analisada no microscópio eletrônico de transmissão (TEM). Para uma interpretação precisa dos micrografos, deve-se seguir as diretrizes para sua orientação adequada14,15. Resumidamente, a direção das sombras no micrografo é uma referência para orientar o micrografo (ou seja, determinar a direção da sombra do Pt) e, consequentemente, determinar formas convexas e côncavas (Figura 1). Duas visões interiores chamadas de rostos fraturados da bicamada de membrana podem ser vistas como resultado da divisão da membrana por fraturacongelante: a face protoplasmática (P-face) e a face exoplasmática (Face E). A face P representa o folheto de membrana adjacente ao protoplasma celular, enquanto o E-face representa o folheto de membrana adjacente ao espaço extracelular. Proteínas de membrana integral e suas associações são vistas como partículas intramembranassalientes 14,15.
Aqui, o objetivo é aplicar a técnica de fratura congelante para caracterizar MVs em termos de tamanho, forma e estrutura de sua membrana limitante. Aqui, apresentamos um protocolo para o isolamento e fratura de MVs originários de células cancerígenas de bexiga invasivas humanas.
Protocolo
1. Culturando células cancerígenas urotelial e isolamento de EVs
NOTA: É apresentado um protocolo para obter EVs de uma linha celular urotelial invasiva de câncer de bexiga (T24). No entanto, as condições de cultivo devem ser otimizadas para usar outros tipos de células.
- Placa T24 células com densidade de 3 × 104 células/cm2 em três frascos (superfície crescente de 75 cm2) e começam com a colheita das células em uma incubadora de CO2 por 3 dias a 37 °C e 5% de CO2 (Figura 2A).
- Use um meio de cultura para células T24 em uma mistura de 1:1 (v/v) de A-DMEM e F12 complementado com 5% de soro bovino fetal (FBS), 4 mM Glutamax, 100 mg/mL estreptomicina e penicilina de 100 U/mL.
NOTA: O seguinte isolamento rende EVs enriquecidos em MVs. Antes de iniciar o isolamento, inspecione as células com um microscópio leve para confirmar a viabilidade e a confluência (Figura 2B). Comece a coletar os EVs da mídia cultural condicionada quando as células T24 estiverem em 70% de confluência.
- Use um meio de cultura para células T24 em uma mistura de 1:1 (v/v) de A-DMEM e F12 complementado com 5% de soro bovino fetal (FBS), 4 mM Glutamax, 100 mg/mL estreptomicina e penicilina de 100 U/mL.
- Colete o meio de cultura com MVs com uma pipeta de frascos (T75) em tubos cônicos de centrífugas (Figura 2C). Centrifugar a 300 × g por 10 min a 4 °C (Figura 2D).
- Colete cuidadosamente o supernatante em um novo tubo de centrífuga com a pipeta (Figura 2E).
- Centrifugar o supernante a 2.000 × g por 20 min a 4 °C.
- Colete cuidadosamente o supernatante com a pipeta em um novo tubo de centrífuga.
- Centrifugar a 10.000 × g para 40 min a 4 °C. Procure a presença de uma pelota esbranquiçada na parte inferior do tubo.
NOTA: Se necessário, troque o rotor centrífuga para atingir a força G necessária. A pelota EV é vista como uma pelota branca na parte inferior do tubo de centrífuga (Figura 2F); marcar sua localização para evitar perder a pelota durante a pipetação (Figura 2G). - Descarte cuidadosamente o supernatante com uma pipeta. À pelota, adicione 1,5 mL de PBS e resuspenha a pelota contendo MVs. Coloque a suspensão em um novo tubo de centrífuga.
- Centrifugar a 10.000 × g por 40 min a 4 °C e procurar a presença de uma pelota branca na parte inferior do tubo.
NOTA: A pelota EV é vista como uma mancha branca na parte inferior do tubo de centrífuga; marcar sua localização para evitar perder a pelota durante a pipetação. - Descarte cuidadosamente o supernatante com uma pipeta. Adicione suavemente o fixador, 2,5% glutaraldeído em 0,1 M tampão de cacodilato de sódio (pH 7.2). Deixe por 20 min a 4 °C (Figura 2H).
ATENÇÃO: Glutaraldeído e cacodilato de sódio são tóxicos. Trabalhe em um capuz de fumaça, use luvas de proteção e descarte-as adequadamente. - Remova cuidadosamente o fixador com uma pipeta. Adicione o tampão de lavagem (tampão de cacodilato de sódio de 0,1 M) à pelota. Deixe por 10 min a 4 °C sem reutilizar a pelota.
2. Congelamento de EVs
NOTA: Antes de congelar, primeiro crioprotetor as amostras com glicerol.
- Prepare 0,1 M tampão de cacodilato de sódio. Remova o tampão de lavagem e adicione 50 μL de 30% de glicerol em 0,1 M de tampão de cacodilato. Levemente resuspensar os EVs para tornar a solução homogênea. Incubar por 30 min a 4 °C.
- Limpe os porta-cobres com um poço central no banho ultrassônico com clorofórmio por 5 min (Figura 3A). O ar os seca e marca com cores se usar várias amostras (Figura 3B). Até usar, mantenha os portadores em um lugar seco e limpo (por exemplo, em papel de lente em uma placa de Petri). Não toque nos porta-aviões com as próprias mãos.
- Prepare pipetas, soluções, papel filtro, pinças, um estereóquico, um frasco de Dewar com freon e nitrogênio líquido (LN2), uma haste de metal e criovials. Esfrie com LN2.
ATENÇÃO: Use equipamentos de proteção e trabalhe de acordo ao manusear LN2 e freon resfriado.
- Prepare pipetas, soluções, papel filtro, pinças, um estereóquico, um frasco de Dewar com freon e nitrogênio líquido (LN2), uma haste de metal e criovials. Esfrie com LN2.
- Resuspenda os EVs novamente antes de congelar. Evite a formação de bolhas de ar.
NOTA: Execute as etapas 2.4-2.7 rapidamente. - Trabalhe sob um estereótipo (Figura 3C). Transfira 1,5-1,7 μL da amostra para o poço central do transportador de cobre para fazer uma queda convexa atingindo uma gota convexa que atinge mais alto que a borda do transportador de cobre enquanto não derrama a amostra sobre a borda (Figura 3D). Em caso de sobrespilação, use papel filtro para secar o anel externo do portador.
- Misture o freon solidificado com uma haste de metal para liquefazer novamente (Figura 3E).
- Segure o anel externo do porta-cobre com pinças e mergulhe-o em freon resfriado com um suave tremor de pinças para 8 s (Figura 3F). Depois dos 8 s, transfira rapidamente a transportadora para outro frasco de Dewar cheio de LN2.
- Proceda imediatamente com fratura ou armazenamento das amostras na LN2. Neste último caso, marque um criovial e esfrie as pontas do frasco e da pinça submergindo-as na LN2 (Figura 3G). Sob ln2, colete os transportadores de cobre congelados no frasco, feche-o e armazene-os no recipiente LN2 (Figura 3H) até congelar a fratura.
3. Fratura de EVs e fabricação das réplicas
NOTA: Prepare a unidade de fraturamento de congelamento de acordo com as instruções de funcionamento do fabricante. (Figura 4A). Limpe a câmara da unidade. Posição de platina (Pt/C) e armas de carbono (C) em ângulos de 45° e 90°, respectivamente (Figura 4B).
- Inicie o sistema de vácuo da unidade. Quando a pressão de 6,6 × 10-2 Pa (5 × 10-4 Torr) for atingida, esfrie a câmara da unidade para -150 °C.
- Transfira os transportadores de cobre com amostras congeladas para uma unidade de fraturamento congelante usando pinças secas (Figura 4C). Use criotransferir ou trabalhe rápido para evitar descongelar a amostra e depor os cristais de gelo. Fixar os porta-aviões na mesa de amostra.
- Aguarde até que o vácuo atinja novamente 6,6 × 10-2 Pa (5 × 10-4 Torr), e então coloque a temperatura da faca para −100 °C (Figura 4D).
- Aguarde até que o vácuo atinja 1,0 × 10-3 Pa (8 × 10-6 Torr).
- Observe a amostra com binóculos e aproxime-se cuidadosamente da faca (Figura 4E).
- Comece a seccionar a amostra ligando o movimento motorizado da faca (Figura 4F) e seção até que a superfície da amostra esteja lisa (Figura 4G).
- Para fraturar, desligue o movimento motorizado da faca e prossiga com o controle manual lento da faca, fraturando assim a amostra (Figura 4H). A fim de proteger a superfície fraturada de formar cristais de gelo e detritos até sombra, mova a faca acima da amostra fraturada.
- Prossiga com a sombra do PT em 45° (Figura 4I, J).
- Prepare um cronômetro e/ou ligue o monitor de cristal de quartzo na unidade de fraturamento congelante, o que permitirá a supervisão da espessura do Pt na amostra. A espessura recomendada da camada Pt medida no monitor de cristal de quartzo é de 2,5 nm, o que corresponde a 4 s de sombra em uma dada alta tensão e corrente (ou seja, a velocidade da sombra pt é de 0,63 nm/s).
- Antes de começar a sombra, mova a faca para longe da amostra. Aplique alta tensão na arma Pt/C (1.600 V), e aumente a corrente para 60 mA. Faíscas de Pt devem aparecer e devem começar a sombrear a amostra. Neste ponto, inicie a contagem regressiva de 4 s e/ou observe e localize a posição de Pt no monitor de cristal de quartzo.
NOTA: A espessura recomendada da camada C é de 2,5 nm, o que corresponde a 10 s de sombra em uma dada alta tensão e corrente. - Desligue a corrente e a alta tensão quando a espessura desejada do Pt for obtida.
- Prossiga com a sombra C a 90° (ou seja, a velocidade da sombra C é de 0,25 nm/s).
- Aplique alta tensão na arma C (1.900 V), aumente a corrente para 90 mA, e faíscas de C devem aparecer e começar a sombra da amostra; nesse momento, inicie a contagem regressiva dos anos 10. Desligue a corrente e a alta tensão quando a espessura desejada de C for obtida.
4. Limpeza das réplicas e análise de réplicas
- Use os carregadores de cobre da mesa de amostra e transfira-os com pinças para água destilada à temperatura ambiente em uma placa de 12 poços de porcelana (Figura 4K). As réplicas flutuarão na superfície da água, enquanto os portadores afundarão (Figura 4L).
- Transfira as réplicas com um laço de arame da água destilada para um poço com hipoclorito de sódio. Cubra e deixe durante a noite em temperatura ambiente em um capô de fumaça.
ATENÇÃO: A hipoclorito de sódio é tóxica. Trabalhe em um capuz de fumaça, use luvas de proteção e descarte-as adequadamente. - Transfira as réplicas para ddH2O e lave por 30 min. Repita 3 vezes.
- Transfira as réplicas com um laço de fio para uma grade TEM de cobre de malha (por exemplo, tela quadrada ou favo de mel 100+). Aerrem as grades por 2h e, em seguida, armazená-las em uma caixa de armazenamento de grade até microscopia.
NOTA: Geralmente, as grades podem ser armazenadas por meses em condições escuras, secas e de temperatura ambiente. - Use um microscópio TEM para imagem das réplicas e obter micrografias.
- Para isso, insira uma grade TEM com uma réplica e inicie a imagem TEM de acordo com os manuais de operação do fabricante. Trabalhe a 80 kV ou 100 kV.
- Inspecione a amostra e adquira micrografias em ampliações cada vez mais altas com uma câmera no TEM.
- Analise os micrografos dos MVs. Para medições dos diâmetros MV, use o software Fiji/ImageJ16. O diâmetro dos MVs é de 4/π vezes a medição nos micrografos de acordo com Hallett et al.17.
Resultados
Os MVs foram isolados do meio condicionado de células T24 urotelial de câncer após centrífugas diferenciais. Seguindo o protocolo, a fração EV foi detectada pela primeira vez após centrifugação a 10.000 × g quando era vista como uma pelota branca (Figura 2G).
Em seguida, os EVs foram processados de acordo com o protocolo acima e examinados sob TEM. Sombreamento pt/C produzido (Figura 4L) réplicas relativamente grandes que frequentemente se dividiam em fragmentos menores durante a etapa de limpeza. Grandes réplicas e seus fragmentos menores foram colhidos na grade TEM e comparados sob o microscópio. Os resultados não mostraram diferenças na qualidade das superfícies da réplica, independentemente do seu tamanho, e podem, portanto, todos serem utilizados. Exames de baixa ampliação mostraram regiões da réplica com i) uma superfície homogênea (fundo), ii) perfis côncavos e cônvexos (vesículos) e iii) de superfície danificada (artefatos; Figura 5A). Artefatos típicos eram vistos como rupturas, dobras e sombras irregulares (ou seja, réplicas de depósitos de cristal de gelo no espécime). Também é importante notar que não foram vistos detritos celulares ou organelas celulares, confirmando a pureza da amostra (Figura 5B).
As vesículas isoladas foram comumente recolhidas em aglomerados de três ou mais ou foram distribuídas individualmente (Figura 5B). As vesículas eram esféricas, o que aponta para a boa preservação da ultraestrutura durante o isolamento, fixação e congelamento (Figura 5C). "Bola plana" e vesículas alongadas (Figura 5C), que eram vistas ocasionalmente, eram presumivelmente artefatos de preparação e não foram incluídas nas medições subsequentes de diâmetro vesícula. O diâmetro dos perfis visíveis foi de 238,5 nm (±8,0 nm, n = 190), o que, levando-se em conta o fator de correção proposto por Hallett et al.17, corresponde ao diâmetro médio da vesícula de 304 nm (±10 nm; Figura 5D). O tamanho se correlaciona com uma faixa de diâmetro de MVs entre 100 nm e 1000 nm e comprova a eficácia do protocolo de isolamento usado. As imagens das vesículas, juntamente com a determinação do diâmetro, confirmaram inequivocamente que os EVs no isolado foram enriquecidos com MVs.
A análise das réplicas revelou a organização do P-face e E-face das membranas limitantes do MV. Os MVs foram observados como formas redondas côncavas e convexas (Figura 5C,E,F), refletindo o plano de fratura. As formas convexas representam faces E (ou seja, folheto exoplasmado fraturado das membranas; Figura 5E). Os rostos exoplasmados dos EVs tinham uma aparência suave e uniforme. As formas côncavas correspondem a P-faces (Figura 5F). Nas faces P, algumas partículas de intramembrano salientes foram vistas dentro de membranas lisas (Figura 5C,F). Isso implica que os MVs isolados das células T24 do câncer contêm apenas uma baixa quantidade de proteínas de membrana.
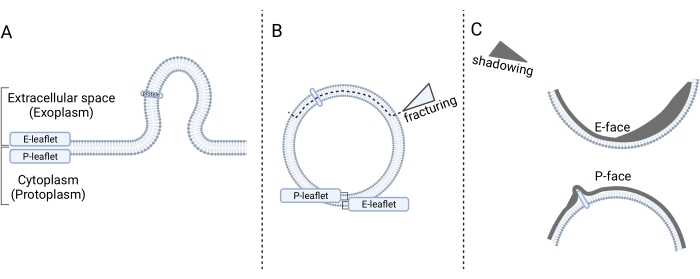
Figura 1: Apresentação esquemática da determinação da membrana após fratura de congelamento. (A) Broto de microvesculas da membrana plasmática para o espaço extracelular. (B) A microvescula é limitada com folheto de membrana P e E até o congelamento fracionado, que divide os folhetos e expõe as vistas interiores dos folhetos, denominados rostos fraturados. (C) Após a sombra de Pt/C, duas faces fraturadas são perceptíveis: a face protoplasmática (P-face) com uma forma convexa voltada para o citoplasma (protoplasma) e uma face exoplasmática (E-face) com uma forma côncava voltada para o espaço extracelular. A Figura 1 foi criada usando Biorender.com. Clique aqui para ver uma versão maior desta figura.
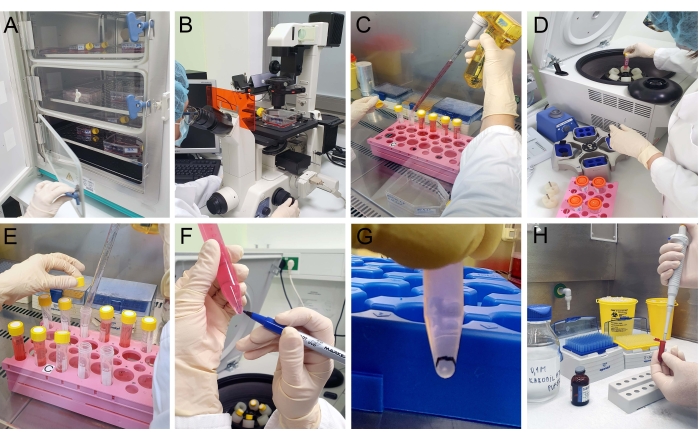
Figura 2: Isolamento de EVs. (A) Células T24 cultivadas em uma incubadora de CO2 são examinadas com (B) um microscópio leve para confirmar sua viabilidade e confluência antes do isolamento mv. (C) O meio de cultura celular é coletado e (D) consecutivamente centrifuga a 300 × g e a 2.000 × g (E) cada vez que o sobrenante é coletado. (F,G) Após a centrifugação a 10.000 × g, um patch branco indicando uma pelota é visível e marcado. O supernasce é removido e (H) fixador é cuidadosamente adicionado à pelota sem resusumá-lo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Congelamento de EVs. (A) Os porta-aviões de cobre limpo secos a ar com um poço central são (B) marcados antes do processamento. Microvesculos são resuspendidos em glicerol para obter uma amostra homogênea e (C) adicionado a um poço central de um portador de cooper sob um estereómico. (D) É preciso adicionar um volume da amostra de tal forma uma queda convexa no poço central. (E) Imediatamente antes de congelar, misture o freon de2 refrescos LN com uma haste de metal para liquefazer o freon. (F) Congele a amostra submergindo-a no freon e, em seguida, (G) transfira-a para a LN2. (H) Os transportadores com a amostra congelada podem ser coletados em criovias e armazenados em um recipiente LN2 Dewar. Clique aqui para ver uma versão maior desta figura.

Figura 4: Fraturar o congelamento e fazer uma réplica. (A) Unidade de fraturamento congelante. Dentro da câmara unitária (B) há uma pistola de elétrons de platina (Pt) e carbono (C), uma faca e a mesa de amostra. (C) Para iniciar a fratura, os portadores com a amostra são transferidos para a tabela de amostra, (D) a unidade de fraturamento congelante é resfriada e um vácuo é estabelecido. (E) A secção é feita pelo movimento motorizado (F) da faca, mas a fratura é feita de preferência manualmente. (G) Amostra antes da secção e (H) após fratura. (I) Imediatamente após a fratura, a réplica é feita. (J) Durante este processo, pt é sombreado na amostra. A sombra de platina é vista como uma luz brilhante (faíscas) na câmara. (K) Os portadores de amostras são coletados em um poço de porcelana cheio de água. (L) Réplica (seta) flutuando na solução de hipoclorito de sódio durante a etapa de limpeza. Clique aqui para ver uma versão maior desta figura.

Figura 5: Micrografias eletrônicas de MVs congelados e com sombra de Pt/C. (A) Uma visão geral da pelota EV fraturada e sombreada (i) em menor ampliação. A superfície homogênea é de fundo (ii), áreas brilhantes são rupturas nas réplicas (iii), áreas mais escuras são dobras de réplicas (asterisco) e sombras irregulares de dimmer são devido a cristais de gelo (dois asteriscos). (B) Cluster de EVs em forma redonda com superfícies côncavas e cônvexas. (C) Alta ampliação dos EVs. Em fraturas convexas, que exibem a face P das membranas EV, são vistas partículas intramembranas (setas) e manchas de uma superfície lisa (pontas de flecha). Vesículas extracelulares com formas alongadas (estrela) e de bola plana (duas estrelas). (D) O diâmetro médio dos MVs urotelial isolados é de 304 nm ± 10 nm de acordo com as medidas de tamanho propostas por Hallett et al.17. Os dados são apresentados como médias ± SEM. (E,F) E-face e P-face de MVs. Legenda: setas = partículas intramembranas em P-face, setas encircladas = a direção de sombra pt/c. Barras de escala: A = 10 μm, B-F = 400 nm. Clique aqui para ver uma versão maior desta figura.
Discussão
A caracterização de MVs, ou qualquer outra população de EVs isolados, é de grande importância para começar antes de iniciar análises a jusante como estudos de "omics" ou estudos funcionais11,18. Nesse meio, os EVs das células T24 de câncer de bexiga invasivas humanas foram isolados por centrifugação, e seguindo o protocolo fornecido para análise por microscopia eletrônica de fratura congelante, demonstramos que a fração isolada foi enriquecida em MVs11,13. O isolado de MVs foi desprovido de detritos celulares ou organelas, confirmando um protocolo de isolamento e purificação bem sucedido.
A combinação de fixação química e congelamento, que são passos críticos do protocolo, manteve a forma esférica dos EVs12. No entanto, são necessárias precauções ao avaliar o diâmetro do EV por fraturamento congelado17. Uma vez que a fratura passa pela amostra aleatoriamente, as membranas MV são divididas em seus planos equatoriais e não-equatoriais. Para fornecer um método rigoroso para analisar as imagens de espécimes congelados e sombreados, Hallett et al. mostraram que o diâmetro médio da vesícula é de 4/π vezes o tamanho real do diâmetro vesicular na imagem17. Contabilizando isso, os EVs das células T24 foram calculados com um diâmetro de 304 nm, o que se encaixa na faixa de distribuição de tamanho teórico do MV de 100-1000 nm19.
A fratura por congelamento pode complementar a coloração negativa, a técnica TEM mais utilizada para visualizar EVs. Por coloração negativa, a amostra é comumente quimicamente fixa, seca e anexada a uma grade TEM, e contrasta com a solução de urânio. Sem suportar a mídia, os EVs tendem a entrar em colapso, o que lhes dá uma aparência em forma de copo. Por meio da fratura congelante, mostramos que os MVs são esferas, o que reflete sua forma em espaços extracelulares e fluidos corporais12. Com isso, nossos resultados também estão de acordo com observações de EVs nas seções crio-ultrathin20.
Uma vantagem crucial da técnica de fratura congelante é seu poder para resolver a organização interna da membrana limitante, que é um fator-chave para entender como os EVs são direcionados e interagir com as membranas receptoras. Aqui, analisamos as membranas dos MVs, mas a fratura congelante poderia revelar a organização da membrana de qualquer outra população de EVs. Os MVs são formados por membrana de plasma brotando; portanto, espera-se que proteínas de membrana plasmática e aglomerados de proteínas sejam encontrados na membrana MV. Nossos resultados apoiaram que os MVs das células T24 continham partículas intramembranas, apresentando proteínas de membrana integral. Com base na distribuição de partículas entre o E-face e o P-face, é razoável esperar que as partículas observadas em MVs sejam proteínas transmembranas uroplakins, que são células uroteliais específicas21,24. As partículas observadas foram esparsas, o que está de acordo com estudos anteriores relatando uma redução de uroplacinas durante a carcinogênese urotelial 21,22,23. No entanto, para investigar melhor a composição proteica das membranas MV, recomenda-se o uso da técnica de rotulagem imunológica (FRIL) da réplica de fratura congelante (FRIL). O FRIL é um upgrade da técnica de fratura congelante apresentada e dedica-se a revelar a identidade das proteínas em réplicas por reconhecimento de anticorpos24,25. Resumindo, a técnica de fratura congelante é uma técnica de microscopia eletrônica adequada para a caracterização da membrana limitante de EV, bem como a forma, tamanho e pureza das frações isoladas de EV. O protocolo apresentado pode ser utilizado também para avaliação de outras populações de EVs isolados; portanto, a técnica de congelamento-fraturando merece a inclusão nas diretrizes da Sociedade Internacional para Vesículas Extracelulares para estudos que exploram a organização das membranas limitantes de EV.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Esta pesquisa foi financiada pela Agência de Pesquisa eslovena (pesquisa core funding no. P3-0108 e projeto J7-2594) e o programa de infraestrutura MRIC UL IP-0510. Este trabalho contribui para a COST Action CA17116 International Network for Transling Research on Perinatal Derivatives into Therapeutic Approaches (SPRINT), apoiada pela COST (European Cooperation in Science and Technology). Os autores gostariam de agradecer a Linda Štrus, Sanja Čabraja, Nada Pavlica Dubarič e Sabina Železnik por ajuda técnica com a cultura celular e preparação das amostras e Marko Vogrinc, Ota Širca Roš e Nejc Debevec por ajuda técnica na preparação do vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| A-DMEM | ThermoFisher Scientific, USA | 12491015 | |
| Balzers freeze-fracture device | Balzers AG, Liechtenstein | Balzers BAF 200 | |
| Centrifuge | Eppendorf, Germany | model 5810R | |
| CO2 incubator HeraCell | Heraues, Germany | ||
| Copper carriers | Balzers | BB 113 142-2 | 100+ mesh |
| Copper grids | SPI, United States | 2010C | |
| Culture flask T75 | TPP, Switzerland | growing surface 75 cm2 | |
| F12 (HAM) | Sigma-Aldrich, Germany | 21765029 | |
| FBS | Gibco, Life Technologies, USA | 10500064 | |
| Glazed Porcelain Plate 6 Well | Fischer Sientific, United States | 50-949-072 | |
| Glycerol | Kemika, Croatia | 711901 | final concentration 30 % (v/v) |
| Glutaradehyde | Serva, Germany | 23114.01 | final concentration 2.5 % (v/v) |
| GlutaMAX | Gibco, Life Technologies | 35050-079 | final concentration 4 mM |
| Penicillin | Gibco, Life Technologies | 15140163 | final concentration 100 U/ml |
| Phase-contast inverted microscope | Nikon, Japan | model Eclipse | |
| Rotor | Eppendorf, Germany | A 4-44 | |
| Rotor | Eppendorf, Germany | F-34-6-38 | |
| Serological pipetts | TPP, Switzerland | 50mL volume | |
| Sodium hypochloride solution in water | Carlo Erba, Italy | 481181 | |
| Stereomicroscope | Leica, Germany | ||
| Streptomycin | Gibco, Life Technologies | 35050038 | final concentration 100 mg/mL |
| Transmission electron microscope | Philips, The Netherlands | model CM100 | working at 80 kV |
| Tweezers | SPI, United States |
Referências
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. The Journal of Cell Biology. 200 (4), 373-383 (2013).
- Willms, E., Cabanas, C., Mager, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: Subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers in Immunology. 9, 738(2018).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19, 213-228 (2018).
- Cocucci, E., Racchetti, G., Meldolesi, J. Shedding microvesicles: Artefacts no more. Trends in Cell Biology. 19 (2), 43-51 (2009).
- Urabe, F., et al. Extracellular vesicles as biomarkers and therapeutic targets for cancer. American Journal of Physiology-Cell Physiology. 318 (1), 29-39 (2020).
- Tricarico, C., Clancy, J., D'Souza-Schorey, C. Biology and biogenesis of shed microvesicles. Small GTPases. 8 (4), 220-232 (2017).
- Georgantzoglou, N., Pergaris, A., Masaoutis, C., Theocharis, S. Extracellular vesicles as biomarkers carriers in bladder cancer: Diagnosis, surveillance, and treatment. International Journal of Molecular Sciences. 22 (5), 2744(2021).
- Słomka, A., Urban, S. K., Lukacs-Kornek, V., Żekanowska, E., Kornek, M. Large extracellular vesicles: Have we found the holy grail of inflammation. Frontiers in Immunology. 9, 2723(2018).
- Han, L., Lam, E. W. F., Sun, Y. Extracellular vesicles in the tumor microenvironment: Old stories, but new tales. Molecular Cancer. 18 (1), 59(2019).
- Muralidharan-Chari, V., Clancy, J. W., Sedgwick, A., D'Souza-Schorey, C. Microvesicles: Mediators of extracellular communication during cancer progression. Journal of Cell Science. 123, 1603-1611 (2010).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences of the United States of America. 113 (8), 968-977 (2016).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3, Unit 3.22 (2006).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Severs, N. J. Freeze-fracture electron microscopy. Nature Protocols. 2 (3), 547-576 (2007).
- Severs, N. J., Robenek, H. Freeze-fracture cytochemistry in cell biology. Methods in Cell Biology. 88, 181-186 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Hallett, F. R., Nickel, B., Samuels, C., Krygsman, P. H. Determination of vesicle size distributions by freeze-fracture electron microscopy. Journal of Electron Microscopy Technique. 17 (4), 459-466 (1991).
- Nigro, A., et al. Selective loss of microvesicles is a major issue of the differential centrifugation isolation protocols. Scientific Reports. 11, 3589(2021).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18 (6), 1153(2017).
- Iliev, D., et al. Stimulation of exosome release by extracellular DNA is conserved across multiple cell types. The FEBS Journal. 285 (16), 3114-3133 (2018).
- Zupančič, D., Zakrajšek, M., Zhou, G., Romih, R. Expression and localization of four uroplakins in urothelial preneoplastic lesions. Histochemistry and Cell Biology. 136 (4), 491-500 (2011).
- Wu, X. R., Manabe, M., Yu, J., Sun, T. T. Large scale purification and immunolocalization of bovine uroplakins I, II, and III. Molecular markers of urothelial differentiation. The Journal of Biological Chemistry. 265 (31), 19170-19179 (1990).
- Kreft, M. E., Hudoklin, S., Jezernik, K., Romih, R. Formation and maintenance of blood-urine barrier in urothelium. Protoplasma. 246 (1-4), 3-14 (2010).
- Kreft, M. E., Robenek, H. Freeze-fracture replica immunolabelling reveals urothelial plaques in cultured urothelial cells. PLoS One. 7 (6), 38509(2012).
- Robenek, H., et al. Topography of lipid droplet-associated proteins: Insights from freeze-fracture replica immunogold labeling. Journal of Lipids. 2011, 409371(2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados