A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعادة تنشيط نماذج الخلايا المخروطنة في الكلاميدوموناس reinhardtii
In This Article
Summary
إعادة تنشيط الخلايا المتحركة في المختبر هي تجربة حاسمة في فهم آليات حركة الخلايا. يصف البروتوكول إعادة تنشيط نماذج الخلايا المخروطنة من Chlamydomonas reinhardtii ، وهو كائن حي نموذجي لدراسة الأهداب / السوط.
Abstract
منذ التجربة التاريخية على تقلص العضلات المغلورة عن طريق إضافة ATP ، والتي أظهرها Szent-Györgyi في منتصف القرن 20th ، في المختبر إعادة تنشيط الخلايا المخربة كانت طريقة تقليدية وقوية لفحص حركة الخلية. الميزة الأساسية لهذه الطريقة التجريبية هي أن تكوين حل إعادة التنشيط يمكن تغييره بسهولة. على سبيل المثال ، يمكن تكرار بيئة تركيز Ca2+ عالية المستوى تحدث مؤقتا فقط بسبب إثارة الغشاء في الجسم الحي في المختبر. الأهداب حقيقية النواة (المعروفة أيضا باسم السوط) هي آلية حركية معقدة لا يزال يتعين توضيح آلياتها التنظيمية. الطحالب الخضراء أحادية الخلية Chlamydomonas reinhardtii هي كائن حي نموذجي ممتاز في مجال أبحاث الأهداب. وقد ساهمت تجارب إعادة التنشيط باستخدام نماذج الخلايا غير المخربة من C. reinhardtii ومشتقاتها ، مثل axonemes deembranated من الأهداب المعزولة ، بشكل كبير في فهم الآليات الجزيئية للحركة الهدبية. أوضحت تلك التجارب أن ATP ينشط الحركة الهدبية وأن الإشارات الخلوية المختلفة ، بما في ذلك Ca2 + و cAMP وأنواع الأكسجين التفاعلية ، تعدل الحركات الهدبية. يتم وصف الطريقة الدقيقة لإزالة الترشيح لخلايا C. reinhardtii وإعادة تنشيط نماذج الخلايا هنا.
Introduction
تعد إعادة تنشيط الخلايا المتحركة المزخرفة في المختبر أداة قيمة لدراسة الأساس الجزيئي للآلية التنظيمية لحركية الخلية. أظهر Szent-Györgyi لأول مرة في المختبر تقلص ألياف العضلات الهيكلية للأرانب المستخرجة من الجلسرين بنسبة 50٪ عن طريق إضافة الأدينوسين ثلاثي الفوسفات (ATP)1. كانت هذه التجربة هي الأولى التي تثبت أن ATP ينشط تقلص العضلات. وسرعان ما طبقت المنهجية على دراسة الحركة الهدبية/السوطية المنشطة من قبل ATP، مثل سوط الحيوانات المنوية2، وأهداب باراميسيوم 3، وأهداب الكلاميدوموناس رينهاردتي (وتسمى أيضا السوط)4 باستخدام منظفات غير أيونية لإزالة الثقب.
الطحالب الخضراء أحادية الخلية C. reinhardtii هي كائن حي نموذجي لدراسة الأهداب: فهي تسبح مع اثنين من الأهداب عن طريق ضربها مثل ضربة صدر الإنسان5. يتم تشغيل الحركة الهودية بواسطة الداينين ، وهو بروتين حركي قائم على الأنابيب الدقيقة موجه في النهاية 6,7. يمكن تصنيف الداينات الهدبية إلى داينيات خارجية الذراع وداينات داخل الذراع. تم عزل المتحورات التي تفتقر إلى كل نوع من أنواع الداينين كمتحولات بطيئة السباحة مع تشوهات حركية مختلفة. وقد أدى التحليل الحركي المفصل في المختبر لهذه الطفرات إلى تقدم كبير في أبحاث الداينين8.
تم التوصل إلى العديد من النتائج الهامة باستخدام هذه الطريقة ومشتقاتها منذ إنشاء تجربة إعادة التنشيط في المختبر لخلايا C. reinhardtii (نماذج الخلايا). على سبيل المثال ، أظهرت إعادة تنشيط نماذج الخلايا في سلسلة من المخازن المؤقتة Ca 2 +9 أن اثنين من الأهداب يتم تنظيمهما بشكل مختلف بواسطة ca2 + تحت micromolar ، وهذا التحكم غير المتماثل في الأهداب يمكن من التوجيه الضوئي ل C. reinhardtii10. علاوة على ذلك، تظهر كل من الأهداب تحويل الشكل الموجي من وضع السباحة الأمامي (يسمى الشكل الموجي غير المتماثل) إلى وضع السباحة الخلفي (يسمى الشكل الموجي المتماثل الذي يظهر لفترة قصيرة عندما تكون الخلايا مصدومة) 11،12. يتم تنظيم هذا التحويل الموجي بواسطة Ca2+ تحت الملليمولي ، والذي ظهر من خلال إعادة تنشيط ما يسمى بجهاز السوط النووي (وهو مجمع يحتوي على أهداب ، والأجسام القاعدية ، والهياكل التي تربط الأجسام القاعدية بالنواة ، وبقايا النواة)11 أو المحاور غير المخروطنة للأهداب المعزولة13. بخلاف Ca2+ ، فإن اتزان الأكسدة والاختزال (الحد من الأكسدة) هو إشارة تنظم تردد الضرب الهدبي ، والذي تم إظهاره من خلال إعادة تنشيط نماذج الخلايا في مخازن الأكسدة والاختزال التي تحتوي على نسب مختلفة من الجلوتاثيون المنخفض مقابل الجلوتاثيون المؤكسد14. بالإضافة إلى ذلك ، ينظم أحادي فوسفات الأدينوسين الدوري (cAMP) بشكل غير متماثل اثنين من الأهداب ، والتي ظهرت من خلال إعادة تنشيط axonemes مع cAMP15 المحبوس القابل للانقسام الضوئي. وقد أدت هذه النتائج في المختبر ، جنبا إلى جنب مع النتائج الجينية ، إلى فهم أعمق للآليات الجزيئية لتنظيم الأهداب في C. reinhardtii.
يتم وصف بروتوكول لإعادة تنشيط نماذج الخلايا هنا. هذه الطريقة بسيطة ، وتسمح بإجراء تعديلات مختلفة ، ويمكن تطبيقها على كائنات حية متعددة تتحرك مع الأهداب. ومع ذلك ، نظرا لأن الخلايا المزروعة هشة ، فإنها تتطلب بعض النصائح لإعادة تنشيط حركة نماذج الخلايا بكفاءة جيدة مع منع الإهلاك.
Protocol
تم استخدام سلالة من النوع البري من Chlamydomonas reinhardtii ، CC-125 ، لهذه الدراسة. تم الحصول على CC-125 من مركز موارد الكلاميدوموناس (انظر جدول المواد) واحتفظ به على ترايس أسيتات فوسفات (TAP) 16 ، 1.5٪ من وسط الأغاروز عند 20-25 درجة مئوية.
1. زراعة الخلايا
- ثقافة Chlamydomonas reinhardtii (CC-125) في TAP متوسطة16 في فترة 12 ساعة / 12 ساعة من الضوء والظلام (ظروف الضوء لفترة الضوء: ~ 50 ميكرومول فوتونات m−2 s−1 ضوء أبيض) عند 20-25 درجة مئوية لمدة يومين (الشكل 1).
ملاحظة: يجب أن تكون الخلايا في مرحلة نمو لوغاريتمية متوسطة (الفيلم 1). يقلل الزرع الطويل (>4 أيام ، في النمو اللوغاريتمي المتأخر أو المرحلة الثابتة) من كفاءة إعادة تنشيط نماذج الخلايا المنزوعة.

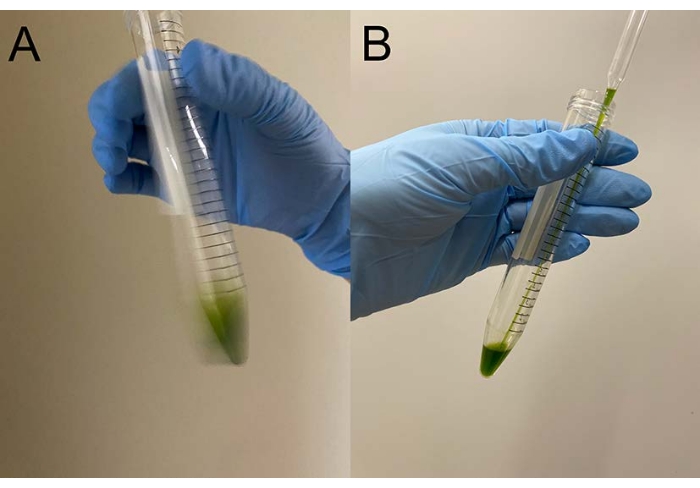
الشكل 1: الثقافة السائلة بعد زراعة لمدة يومين. من صفيحة أجار TAP-1.5٪ ، تم تلقيح جزء من الخلايا البرية لملء حلقة البلاتين إلى ~ 150 مل من وسط سائل TAP في قارورة. كانت كثافة الخلايا بعد زراعة يومين 2.3 × 106 خلايا / مل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 1: سباحة الخلايا الحية. لوحظت الخلايا تحت المجهر باستخدام عدسة موضوعية 10x ومكثف المجال المظلم لغمر الزيت. شريط المقياس = 100 ميكرومتر .
2. إعداد نماذج الخلايا المخروطنة
ملاحظة: قبل بدء التجربة، احتفظ بمخزن الغسيل المؤقت في درجة حرارة الغرفة وإزالة التخمير، والتخفيف، وإعادة التنشيط، ومحلول ATP على الجليد. ويرد تكوين هذه المخازن المؤقتة في الجدول التكميلي 1.
- جهاز طرد مركزي ~ 10 مل من الثقافة السائلة عند 1000 × جم عند 20 درجة مئوية لمدة 3 دقائق.
ملاحظة: طوال البروتوكول من هذه الخطوة ، لا تستخدم الأدوات البلاستيكية المعقمة (الأنابيب ، نصائح الماصة ، إلخ) ، مما يقلل من كفاءة إعادة التنشيط. بالنسبة للأنابيب المخروطية ، يفضل استخدام الأنابيب المعاد استخدامها. قد تكون كثافة الخلايا بعد زراعة يومين عادة 1.0-5.0 × 106 خلايا / مل. عندما تكون كثافة الخلية أقل من ذلك ، خذ حجم ثقافة كاف لاحتواء ~ 5 × 107 خلايا. - تخلص من السوبرناتانت ، أولا عن طريق الصب ثم بواسطة ماصة باستور ، وأعد تعليق الرواسب في ~ 5 مل من المخزن المؤقت للغسيل.
- خلايا الطرد المركزي في مخزن الغسيل العازل عند 1000 × غرام لمدة 3 دقائق عند 20 درجة مئوية.
- تخلص من السوبرناتانت بعناية باستخدام ماصة (الشكل 2).
ملاحظة: ماصات باستور هي الأفضل. عند استخدام الماصات الدقيقة، تجنب استخدام أطراف الماصة التي تم تعقيمها. - تراكب ~ 0.5 مل من المخزن المؤقت للإزالة على حبيبات الخلية ، وهز الأنبوب بلطف باليد لتعليق الخلايا في المخزن المؤقت تقريبا ، ووضع الأنبوب على الجليد (الشكل 3A).
ملاحظة: ليس من الضروري تعليق الكريات بالكامل في هذه اللحظة. ارفع تركيز MgSO من4 إلى 15 مللي متر في المخازن المؤقتة لإعادة الترشيح وإعادة التنشيط عند إعادة تنشيط نماذج الخلايا ، مع تركيز ATP نهائي >1 mM لإعادة تنشيط مستقرة17. - حبيبات الخلايا المتبقية بلطف باستخدام ماصة ، وضع الأنبوب على الجليد مرة أخرى (الشكل 3B).
- خذ 5-10 ميكرولتر من نماذج الخلايا ، وقم بتخفيف 10 أضعاف باستخدام المخزن المؤقت للتخفيف ، وراقب تحت المجهر (الفيلم 2) للتأكد من أن جميع نماذج الخلايا غير متجعدة ولا تسبح (الشكل 4).
ملاحظة: إذا كانت بعض الخلايا لا تزال تسبح (على قيد الحياة) ، أضف المنظف غير الأيوني المستخدم في المخزن المؤقت لإزالة الترشيح مباشرة إلى محلول نموذج الخلية إلى التركيز النهائي البالغ ~ 0.15٪. بدلا من ذلك ، كرر الخطوات 2.1-2.5 مع محلول إزالة الترشيح الذي يحتوي على 0.15٪ من المنظفات.
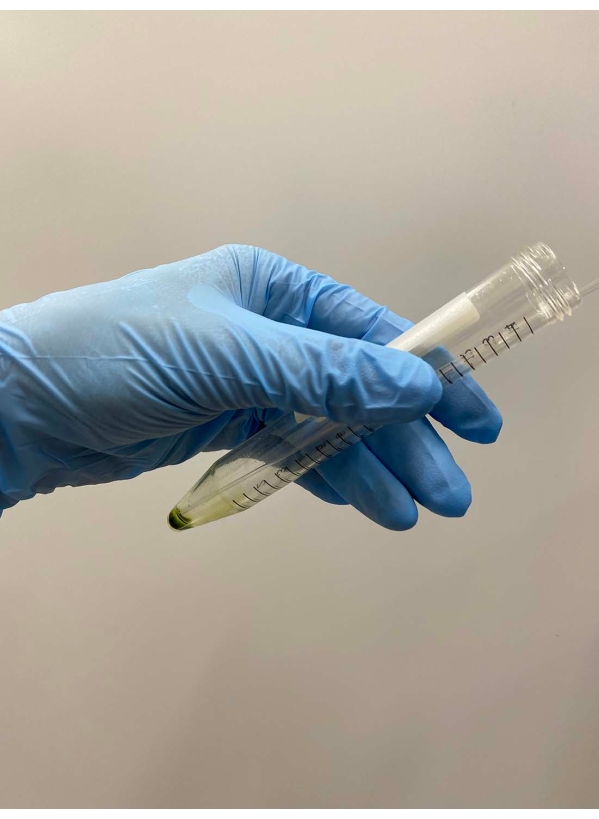
الشكل 2: التخلص من السوبرناتانت. تمت إزالة بقية السوبرناتانت بعناية باستخدام ماصة باستور بعد إزالة السوبرناتانت عن طريق صب الأنبوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: إزالة الترسب . (أ) بعد تراكب 0.5 مل من محلول الإزالة على حبيبات الخلية ، تم خلط المحلول بيد لتعليق الخلايا تقريبا. (ب) بعد الخلط ، تم تعليق بقية بيليه الخلية بالكامل في المحلول بواسطة ماصة باستور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
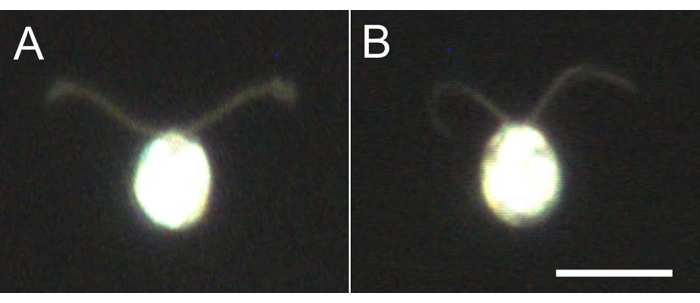
الشكل 4: آثار التفكيك . (أ) خلية حية عالقة على شريحة زجاجية. (ب) نموذج خلية عالق على شريحة زجاجية. لاحظ أنه في نموذج الخلية ، أصبحت الأهداب أرق قليلا. وقد لوحظت الصور تحت المجهر باستخدام عدسة موضوعية 20x ومكثف المجال المظلم لغمر الزيت. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 2: تأكيد التفكيك. وقد لوحظ تعليق نموذج الخلية تحت المجهر باستخدام عدسة موضوعية 10x ومكثف المجال المظلم لغمر الزيت. لم تكن هناك زنزانة تسبح. شريط المقياس = 100 ميكرومتر .
3. إعادة تنشيط نماذج الخلايا المخروطنة
- امزج 80 ميكرولتر من محلول إعادة التنشيط ، و 10 ميكرولتر من محلول ATP ، و 10 ميكرولتر من نماذج الخلايا في أنبوب 0.5 مل عن طريق النقر على الأنبوب (الشكل 5).
ملاحظة: يجب أن يكون تركيز ATP النهائي <3 mM لأن تردد الضرب الهدبي ، وهو معلمة للحركة الهدبية ، يزداد مع تركيز ATP ويتشبع عند 2-3 mM من ATP17.
تنبيه: يؤدي الخلط عن طريق السحب أو الدوامة إلى التدهور ويقلل من كفاءة إعادة التنشيط.- لإعادة التنشيط باستخدام <0.2 ملليمتر من ATP ، أضف نظام تجديد ATP ، مثل 70 U / mL من كيناز الكرياتين و 5 mM من فوسفات الكرياتين (انظر جدول المواد).
ملاحظة: يتم تحضير محلول إعادة التنشيط بتركيز أعلى (1.125x، الجدول التكميلي 1) من محلول التخفيف بحيث بعد خلط ATP المذاب في الماء، تصل المحتويات إلى التركيزات النهائية التالية: 30 ملليمتر من Hepes (الرقم الهيدروجيني 7.4)، و 5 mM من MgSO4، و 1 mM من ثنائي ثيوثريتول (DTT)، و 1 mM من EGTA، و 50 mM من خلات البوتاسيوم (انظر جدول المواد).
- لإعادة التنشيط باستخدام <0.2 ملليمتر من ATP ، أضف نظام تجديد ATP ، مثل 70 U / mL من كيناز الكرياتين و 5 mM من فوسفات الكرياتين (انظر جدول المواد).
- ضع ~ 30 ميكرولتر من المحلول المختلط على شريحة زجاجية وضع غطاء عليه بلطف مع فواصل لتجنب الصدمة الميكانيكية لنماذج الخلايا (الشكل 6).
ملاحظة: يمكن استخدام البترول الأبيض أو الأشرطة اللاصقة على الوجهين لصنع الفواصل. - راقب نماذج الخلايا المعاد تنشيطها تحت المجهر (الفيلم 3).

الشكل 5: محلول الخلط عن طريق النقر على الأنبوب . (A) إلى 80 ميكرولتر من محلول إعادة التنشيط ، تمت إضافة 10 ميكرولتر من محلول ATP ، و 10 ميكرولتر من نماذج الخلايا بترتيب تسلسلي. (ب) تم خلط المحلول عن طريق النقر على الأنبوب بإصبع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: صنع الفواصل على حواف الغطاء (أ) تم تطبيق طبقة رقيقة من البترول الأبيض على الجزء الخلفي من اليد. (ب) تم كشط كمية صغيرة من البترول الأبيض بحافة من الغطاء. (ج) تم عمل فاصل على حافة الغطاء. (د) تم عمل فاصل آخر على الحافة المقابلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 3: السباحة في نماذج الخلايا المعاد تنشيطها. أعيد تنشيط حركة نماذج الخلايا عن طريق إضافة ATP بتركيز نهائي قدره 1 mM ، وتمت ملاحظته تحت المجهر باستخدام عدسة موضوعية 10x ومكثف المجال المظلم لغمر الزيت. شريط المقياس = 100 ميكرومتر .
النتائج
تظهر هنا عملية إزالة الترشيح وإعادة التنشيط في سلالة C. reinhardtii البرية (CC-125). أصبحت الثقافة بعد يومين من التلقيح لونا أخضر فاتحا (الخطوة 1.1) (الشكل 1). تم جمع الخلايا (الخطوة 2.1) ، وغسلها (الخطوة 2.2) ، وإزالة الترسبات (الخطوة 2.5). بعد إزالة الترسبات ، أصبحت جميع نماذج الخلايا غي?...
Discussion
هناك خطوتان حاسمتان في هذا البروتوكول. الأول هو عملية تعرف باسم إزالة النخاع ، والتي يجب تنفيذها بلطف ولكن بدقة. يحدث التفكيك (أي فصل الأهداب عن جسم الخلية) عن طريق السحب القوي أو الدوامة ، مما يجعل نماذج الخلايا غير متحركة حتى بعد إضافة ATP. عادة ، يتم تعليق 5 × 107 خلايا في ~ 0.5 مل من المخز?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال منح من الجمعية اليابانية لتعزيز العلوم KAKENHI (https://www.jsps.go.jp/english/index.html) إلى جامعة الأمم المتحدة (19K23758 ، 21K06295) و K.W. (19H03242 ، 20K21420 ، 21H00420) ، من مؤسسة Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) إلى K.W. ، ومن التحالف الديناميكي للابتكار المفتوح الذي يربط بين الإنسان والبيئة والمواد (http://alliance.tagen.tohoku.ac.jp/english/) إلى N.U. و K.W. ونشكر السيدة ميوكي شينوهارا (جامعة هوسي) على مساعدتها في إعداد الأرقام.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
References
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved