Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Réactivation de modèles cellulaires démonembranés chez Chlamydomonas reinhardtii
Dans cet article
Résumé
La réactivation in vitro des cellules mobiles est une expérience cruciale pour comprendre les mécanismes de la motilité cellulaire. Le protocole décrit la réactivation des modèles cellulaires démembranés de Chlamydomonas reinhardtii, un organisme modèle pour étudier les cils et les flagelles.
Résumé
Depuis l’expérience historique sur la contraction du muscle glycéronique par ajout d’ATP, que Szent-Györgyi a démontrée au milieu du 20ème siècle, la réactivation in vitro des cellules démembranées a été un moyen traditionnel et puissant d’examiner la motilité cellulaire. L’avantage fondamental de cette méthode expérimentale est que la composition de la solution de réactivation peut être facilement modifiée. Par exemple, un environnement à forte concentration de Ca2+ qui ne se produit que temporairement en raison de l’excitation de la membrane in vivo peut être reproduit en laboratoire. Les cils eucaryotes (alias flagelles) sont des mécanismes de motilité élaborés dont les mécanismes de régulation doivent encore être clarifiés. L’algue verte unicellulaire Chlamydomonas reinhardtii est un excellent organisme modèle dans le domaine de la recherche des cils. Les expériences de réactivation utilisant des modèles cellulaires démembranés de C. reinhardtii et de leurs dérivés, tels que les axonèmes démembranés de cils isolés, ont contribué de manière significative à la compréhension des mécanismes moléculaires de la motilité ciliaire. Ces expériences ont précisé que l’ATP dynamise la motilité ciliaire et que divers signaux cellulaires, y compris ca2+, cAMP et les espèces réactives de l’oxygène, modulent les mouvements ciliaires. La méthode précise de démembranation des cellules de C. reinhardtii et de réactivation des modèles cellulaires est décrite ici.
Introduction
La réactivation in vitro des cellules mobiles démembranées est un outil précieux pour étudier la base moléculaire du mécanisme de régulation de la motilité cellulaire. Szent-Györgyi a d’abord démontré une contraction in vitro de fibres musculaires squelettiques de lapin extraites avec 50% de glycérol en ajoutant de l’adénosine triphosphate (ATP)1. Cette expérience a été la première à prouver que l’ATP dynamise la contraction musculaire. La méthodologie a rapidement été appliquée à l’étude de la motilité ciliaire/flagellaire énergisée par l’ATP, comme lesflagelles de sperme 2, Paramecium cilia3 et Chlamydomonas reinhardtii cilia (également appelé flagelles)4 en utilisant des détergents non ioniques pour la démembranation.
L’algue verte unicellulaire C. reinhardtii est un organisme modèle pour l’étude des cils : elle nage avec deux cils en les battant comme la brasse5 d’un humain. Le mouvement ciliaire est entraîné par la dynéine, une protéine motrice dirigée à base de microtubules à extrémité négative 6,7. Les dynéines ciliaires peuvent être classées en dynéines du bras externe et dynéines du bras interne. Les mutants dépourvus de chaque type de dynéine ont été isolés en tant que mutants à nage lente avec différentes anomalies de motilité. L’analyse détaillée de la motilité in vitro de ces mutants a considérablement fait progresser la recherche sur la dynéine8.
De nombreux résultats importants ont été obtenus en utilisant cette méthode et ses dérivés depuis l’expérience de réactivation in vitro de cellules de C. reinhardtii démembranées (modèles cellulaires) a été établie. La réactivation de modèles cellulaires dans une série de tampons Ca2+, par exemple, a montré9 que deux cils sont régulés différemment par le Ca2+ submicromolaire, et ce contrôle asymétrique des cils permet l’orientation phototactique de C. reinhardtii10. De plus, les deux cils montrent une conversion de la forme d’onde du mode de nage vers l’avant (appelé forme d’onde asymétrique) vers l’arrière (appelé forme d’onde symétrique qui apparaît pendant une courte période lorsque les cellules sont photo- ou mécano-choquées)11,12. Cette conversion de forme d’onde est régulée par le Ca2+ submillimolaire, ce qui a été démontré par la réactivation de l’appareil dit nucléoflagulien (un complexe contenant deux cils, les corps basaux, les structures reliant les corps basaux au noyau, et le reste du noyau)11 ou des axonèmes démembranés de cils isolés13. Outre le Ca2+, l’équilibre redox (réduction-oxydation) est un signal qui régule la fréquence de battement ciliaire, ce qui a été démontré par la réactivation de modèles cellulaires dans des tampons redox contenant différents ratios de glutathion réduit par rapport au glutathion oxydé14. De plus, l’adénosine monophosphate cyclique (AMPc) régule de manière asymétrique deux cils, ce qui a été démontré par la réactivation des axonèmes avec l’AMPc15 en cage photocléavable. Ces résultats in vitro, combinés à des résultats génétiques, ont conduit à une compréhension plus approfondie des mécanismes moléculaires de la régulation des cils chez C. reinhardtii.
Un protocole de réactivation des modèles cellulaires est décrit ici. La méthode est simple, permet diverses modifications et peut être appliquée à plusieurs organismes qui se déplacent avec des cils. Cependant, comme les cellules démembranées sont fragiles, il faut quelques conseils pour réactiver la motilité des modèles cellulaires avec une bonne efficacité tout en prévenant la déciliation.
Protocole
Une souche de type sauvage de Chlamydomonas reinhardtii, CC-125, a été utilisée pour la présente étude. Cc-125 a été obtenu du Centre de ressources Chlamydomonas (voir tableau des matériaux) et maintenu sur un milieu d’agarose Tris-acétate-phosphate (TAP)16, 1,5% à 20-25 °C.
1. Culture cellulaire
- Culture de Chlamydomonas reinhardtii (CC-125) en milieu TAP16 dans une période clair-sombre de 12 h/12 h (conditions de lumière pour la période de lumière : ~50 photons μmol m−2 s−1 lumière blanche) à 20-25 °C pendant 2 jours (Figure 1).
REMARQUE: Les cellules doivent être dans une phase de croissance mi-logarithmique (film 1). Une culture longue (>4 jours, en phase de croissance logarithmique tardive ou stationnaire) diminue l’efficacité de réactivation des modèles cellulaires démembranés.

Figure 1 : Culture liquide après 2 jours de culture. À partir d’une plaque de gélose TAP-1,5%, un morceau de cellules de type sauvage pour remplir la boucle de platine a été inoculé à environ 150 mL de milieu liquide TAP dans une fiole. La densité cellulaire après culture de 2 jours était de 2,3 × 106 cellules/mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Film 1: Natation des cellules vivantes. Les cellules ont été observées au microscope avec une lentille d’objectif 10x et un condensateur de champ sombre à immersion dans l’huile. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
2. Préparation de modèles cellulaires démembranés
REMARQUE: Avant de commencer l’expérience, gardez le tampon de lavage à température ambiante et la démembranation, la dilution, les tampons de réactivation et la solution d’ATP sur de la glace. La composition de ces tampons est fournie dans le tableau supplémentaire 1.
- Centrifuger ~10 mL de culture liquide à 1000 × g à 20 °C pendant 3 min.
REMARQUE: Tout au long du protocole à partir de cette étape, n’utilisez pas de plastique autoclavé (tubes, embouts de pipette, etc.), ce qui diminue l’efficacité de la réactivation. Pour les tubes coniques, les tubes réutilisés sont préférables. La densité cellulaire après une culture de 2 jours peut être généralement de 1,0 à 5,0 × 106 cellules / mL. Lorsque la densité cellulaire est inférieure à cela, prenez suffisamment de volume de culture pour contenir ~ 5 × 107 cellules. - Jeter le surnageant, d’abord par décantation puis par une pipette Pasteur, et remettre en suspension les précipités dans ~5 mL de tampon de lavage.
- Cellules centrifuges dans le tampon de lavage à 1000 × g pendant 3 min à 20 °C.
- Jeter soigneusement le surnageant à l’aide d’une pipette (Figure 2).
NOTE: Les pipettes pasteures sont préférables. Lorsque vous utilisez des micropipettes, évitez d’utiliser des embouts de pipette qui ont été autoclavés. - Superposez environ 0,5 mL de tampon de démembranation sur une pastille de cellule, secouez doucement le tube à la main pour suspendre grossièrement les cellules dans le tampon et mettez le tube sur de la glace (Figure 3A).
REMARQUE: Il n’est pas nécessaire de suspendre entièrement la pastille pour le moment. Augmenter la concentration de MgSO4 à 15 mM dans les tampons de démembranation et de réactivation lorsque les modèles cellulaires sont réactivés, avec une concentration finale d’ATP >1 mM pour une réactivation stable17. - Suspendez doucement la pastille de cellule restante à l’aide d’une pipette et replacez le tube sur de la glace (figure 3B).
- Prendre 5 à 10 μL des modèles cellulaires, diluer 10 fois avec le tampon de dilution et observer au microscope (film 2) pour confirmer que tous les modèles cellulaires sont démembranés et ne nagent pas (Figure 4).
REMARQUE: Si certaines cellules nagent encore (vivantes), ajoutez le détergent non ionique utilisé dans le tampon de démembranation directement à la solution du modèle cellulaire à la concentration finale d’environ 0,15%. Alternativement, répétez les étapes 2.1-2.5 avec la solution de démolition contenant 0,15% de détergent.
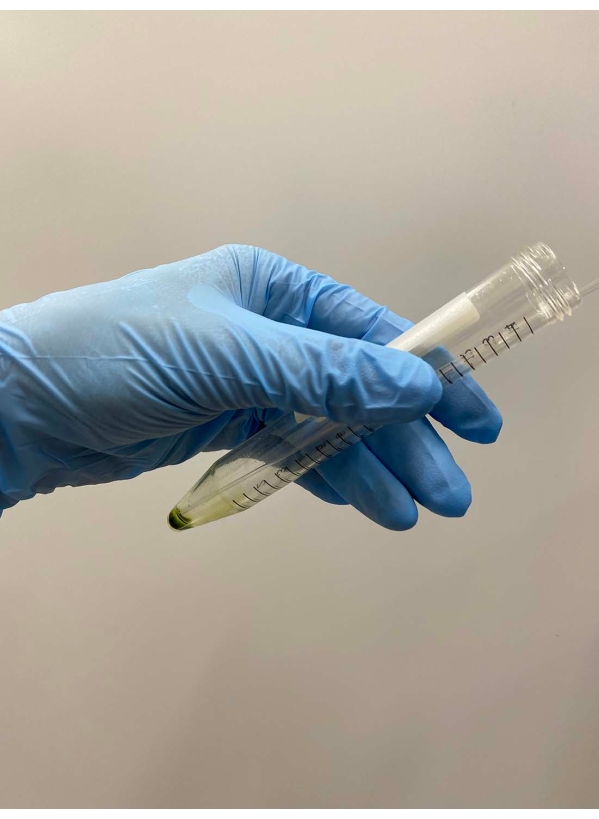
Figure 2 : Rejet du surnageant. Le reste du surnageant a été soigneusement retiré avec une pipette Pasteur après que le surnageant a été retiré par décantation du tube. Veuillez cliquer ici pour voir une version agrandie de cette figure.
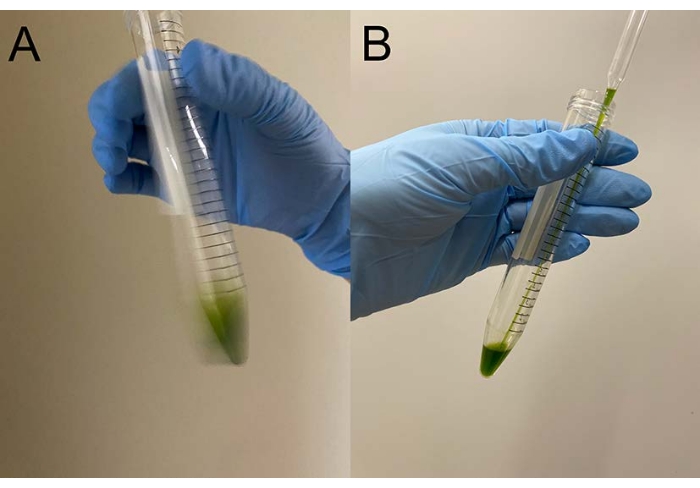
Figure 3: Démembranation. (A) Après avoir superposé 0,5 mL de solution de démembranation sur la pastille cellulaire, la solution a été mélangée à la main pour suspendre grossièrement les cellules. (B) Après mélange, le reste de la pastille cellulaire a été entièrement suspendu dans la solution par une pipette Pasteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
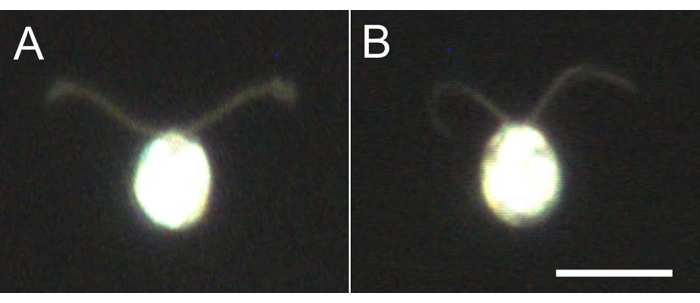
Figure 4: Effets de la démonembranation. (A) Cellule vivante collée sur une lame de verre. (B) Un modèle de cellule collé sur une lame de verre. Notez que dans le modèle cellulaire, les cils sont devenus légèrement plus minces. Les images ont été observées au microscope avec un objectif 20x et un condensateur de champ sombre à immersion dans l’huile. Barre d’échelle = 10 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Film 2 : Confirmation de la démonembranation. La suspension du modèle cellulaire a été observée au microscope avec une lentille d’objectif 10x et un condenseur de champ sombre à immersion dans l’huile. Aucune cellule ne nageait. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
3. Réactivation des modèles cellulaires démembranés
- Mélanger 80 μL de solution de réactivation, 10 μL de solution d’ATP et 10 μL de modèles cellulaires dans un tube de 0,5 mL en tapotant le tube (Figure 5).
REMARQUE: La concentration finale d’ATP doit être de <3 mM car la fréquence de battement ciliaire, un paramètre du mouvement ciliaire, augmente avec la concentration d’ATP et sature à 2-3 mM d’ATP17.
ATTENTION : Le mélange par pipetage ou vortex provoque la déciliation et diminue l’efficacité de la réactivation.- Pour réactiver avec <0,2 mM d’ATP, ajoutez un système de régénération de l’ATP, tel que 70 U/mL de créatine kinase et 5 mM de phosphate de créatine (voir tableau des matériaux).
REMARQUE: La solution de réactivation est préparée à une concentration plus élevée (1,125x, tableau supplémentaire 1) que la solution de dilution de sorte qu’après avoir mélangé l’ATP dissous dans l’eau, le contenu atteint les concentrations finales suivantes: 30 mM d’hepes (pH 7,4), 5 mM de MgSO4, 1 mM de dithiothréitol (TNT), 1 mM d’EGTA et 50 mM d’acétate de potassium (voir tableau des matériaux).
- Pour réactiver avec <0,2 mM d’ATP, ajoutez un système de régénération de l’ATP, tel que 70 U/mL de créatine kinase et 5 mM de phosphate de créatine (voir tableau des matériaux).
- Placez environ 30 μL de la solution mélangée sur une lame de verre et placez doucement un couvercle dessus avec des entretoises pour éviter un choc mécanique sur les modèles de cellules (Figure 6).
REMARQUE: Des rubans adhésifs blancs à base de pétrole ou à double face peuvent être utilisés pour fabriquer les entretoises. - Observez les modèles de cellules réactivées au microscope (film 3).

Figure 5: Solution de mélange par taraudage du tube. (A) Jusqu’à 80 μL de la solution de réactivation, 10 μL de solution d’ATP et 10 μL de modèles cellulaires ont été ajoutés dans l’ordre séquentiel. (B) La solution a été mélangée en tapotant le tube avec un doigt. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6: Fabrication d’entretoises sur les bords de couverture. (A) Une fine couche de pétrole blanc a été appliquée sur le dos d’une main. (B) Une petite quantité de pétrole blanc a été grattée avec le bord d’une glissière de couverture. (C) Une entretoise a été fabriquée sur le bord d’un couvercle. (D) Une autre entretoise a été fabriquée sur le bord opposé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Film 3: Natation des modèles de cellules réactivées. La motilité des modèles cellulaires a été réactivée en ajoutant de l’ATP à une concentration finale de 1 mM, et observée au microscope avec une lentille d’objectif 10x et un condensateur de champ sombre à immersion dans l’huile. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
Résultats
Le processus de démembranation et de réactivation dans la souche de type sauvage C. reinhardtii (CC-125) est montré ici. La culture 2 jours après l’inoculation est devenue une couleur vert clair (étape 1.1) (Figure 1). Les cellules ont été prélevées (étape 2.1), lavées (étape 2.2) et démembranées (étape 2.5). Après la démonembranation, tous les modèles cellulaires sont devenus immotiles (étape 2.7). Les cils démembranés (appelés axonèmes) restent attachés ...
Discussion
Ce protocole comporte deux étapes critiques. Le premier est un processus connu sous le nom de démembranation, qui doit être effectué doucement mais en profondeur. La déciliation (c’est-à-dire le détachement des cils du corps cellulaire) est induite par un pipetage ou un vortex vigoureux, rendant les modèles cellulaires immobiles même après l’ajout d’ATP. Typiquement, 5 × 107 cellules sont suspendues dans ~0,5 mL de tampon de démembranation (densité cellulaire finale: 1 × 108 cell...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par des subventions de la Japan Society for the Promotion of Science KAKENHI (https://www.jsps.go.jp/english/index.html) à N.U. (19K23758, 21K06295) et K.W. (19H03242, 20K21420, 21H00420), de l’Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) à K.W., et de la Dynamic Alliance for Open Innovation Bridging Human, Environment and Materials (http://alliance.tagen.tohoku.ac.jp/english/) à N.U. et K.W. Nous remercions Mme Miyuki Shinohara (Hosei Univ.) pour son aide dans la préparation des chiffres.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
Références
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon