Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Chlamydomonas reinhardtii'de Demembrane Hücre Modellerinin Reaktivasyonu
Bu Makalede
Özet
Hareketli hücrelerin in vitro reaktivasyonu, hücre hareketliliğinin mekanizmalarını anlamada çok önemli bir deneydir. Protokol, kirpikler / flagella'yı incelemek için bir model organizma olan Chlamydomonas reinhardtii'nin demembrane edilmiş hücre modellerinin yeniden aktive edilmesini açıklar.
Özet
Szent-Györgyi'nin 20. yüzyılın ortalarında gösterdiği ATP eklenerek gliserinli kasın kasılmasına ilişkin tarihsel deneyden bu yana, demembrane hücrelerin in vitro reaktivasyonu, hücre hareketliliğini incelemek için geleneksel ve güçlü bir yol olmuştur. Bu deneysel yöntemin temel avantajı, reaktivasyon çözeltisinin bileşiminin kolayca değiştirilebilmesidir. Örneğin, in vivo membran uyarımı nedeniyle sadece geçici olarak meydana gelen yüksek Ca2+ konsantrasyon ortamı laboratuvarda çoğaltılabilir. Ökaryotik kirpikler (diğer adıyla flagella), düzenleyici mekanizmaları hala açıklığa kavuşturulması gereken ayrıntılı hareketlilik makineleridir. Tek hücreli yeşil alg Chlamydomonas reinhardtii, kirpiklerin araştırma alanında mükemmel bir model organizmadır. C. reinhardtii'nin demembrane hücre modellerini ve izole kirpiklerin demembrane aksonemleri gibi türevlerini kullanan reaktivasyon deneyleri, siliyer motilitenin moleküler mekanizmalarının anlaşılmasına önemli ölçüde katkıda bulunmuştur. Bu deneyler, ATP'nin siliyer hareketliliğe enerji verdiğini ve Ca2 +, cAMP ve reaktif oksijen türleri de dahil olmak üzere çeşitli hücresel sinyallerin siliyer hareketleri modüle ettiğini açıklığa kavuşturdu. C. reinhardtii hücrelerinin demembranasyonu ve hücre modellerinin reaktivasyonu için kesin yöntem burada açıklanmıştır.
Giriş
Hatırlanan hareketli hücrelerin in vitro reaktivasyonu, hücre hareketliliğinin düzenleyici mekanizmasının moleküler temelini incelemek için değerli bir araçtır. Szent-Györgyi ilk olarak adenozin trifosfat (ATP) ekleyerek %50 gliserol ile ekstrakte edilen tavşan iskelet kası liflerinin in vitro kasılmasını gösterdi1. Bu deney, ATP'nin kas kasılmasına enerji verdiğini kanıtlayan ilk deneydi. Metodoloji kısa bir süre sonra, sperm flagella2, Paramecium cilia3 ve Chlamydomonas reinhardtii cilia (flagella olarak da adlandırılır)4 gibi ATP enerjili siliyer / flagellar motilitenin incelenmesine, demembranasyon için iyonik olmayan deterjanlar kullanılarak uygulandı.
Tek hücreli yeşil alg C. reinhardtii, kirpikleri incelemek için model bir organizmadır: iki kirpikle yüzerek onları bir insanın kurbağalaması gibi döver5. Siliyer hareket, eksi uçlu yönlendirilmiş mikrotübül bazlı bir motor protein 6,7 olan dynein tarafından tahrik edilir. Siliyer dinyenler dış kol dineinleri ve iç kol dineinleri olarak sınıflandırılabilir. Her türlü dineinden yoksun mutantlar, farklı hareketlilik anormalliklerine sahip yavaş yüzen mutantlar olarak izole edilmiştir. Bu mutantların ayrıntılı in vitro motilite analizi, dinein araştırmalarını önemli ölçüde ilerletmiştir8.
Hatırlanan C. reinhardtii hücrelerinin (hücre modelleri) in vitro reaktivasyon deneyi kurulduğundan beri bu yöntem ve türevleri kullanılarak birçok önemli bulguya ulaşılmıştır. Örneğin, bir dizi Ca 2 + tamponunda hücre modellerinin reaktivasyonu,9'a iki kirpiklerin submikromolar Ca2 + tarafından farklı şekilde düzenlendiğini gösterdi ve bu asimetrik kirpik kontrolü, C. reinhardtii10'un fototaktik yönelimini sağlar. Ayrıca, her iki kirpik de ileri yüzme modundan (asimetrik dalga formu olarak adlandırılır) geriye doğru yüzme moduna (hücreler foto veya mekano-şok edildiğinde kısa bir süre için ortaya çıkan simetrik dalga formu olarak adlandırılır) dalga formu dönüşümü gösterir11,12. Bu dalga formu dönüşümü, nükleoflagellar aparatın (iki kirpik, bazal cisimler, bazal cisimleri çekirdeğe bağlayan yapılar ve çekirdeğin kalıntılarını içeren bir kompleks)11 veya izole kirpiklerin demembrane edilmiş aksonemlerinin reaktivasyonu ile gösterilen submilimolar Ca2 + ile düzenlenir13. Ca2+ dışında, redoks (indirgeme-oksidasyon) duruşu, indirgenmiş glutatyon ve oksitlenmiş glutatyon14'ün farklı oranlarını içeren redoks tamponlarındaki hücre modellerinin reaktivasyonu ile gösterilen siliyer atma frekansını düzenleyen bir sinyaldir. Ek olarak, siklik adenozin monofosfat (cAMP), fotobölünebilir kafesli cAMP15 ile aksonemlerin reaktivasyonu ile gösterilen iki kirpikleri asimetrik olarak düzenler. Bu in vitro bulgular, genetik bulgularla birleştiğinde, C. reinhardtii'deki kirpik regülasyonunun moleküler mekanizmalarının daha derin bir şekilde anlaşılmasını sağlamıştır.
Hücre modellerini yeniden etkinleştirmek için bir protokol burada açıklanmıştır. Yöntem basittir, çeşitli modifikasyonlara izin verir ve kirpiklerle hareket eden birden fazla organizmaya uygulanabilir. Bununla birlikte, demembrane edilmiş hücreler kırılgan olduğundan, hücre modellerinin hareketliliğini iyi bir verimlilikle yeniden etkinleştirmek için bazı ipuçları gerektirir.
Protokol
Bu çalışmada Chlamydomonas reinhardtii'nin vahşi tip bir suşu olan CC-125 kullanılmıştır. CC-125, Chlamydomonas Kaynak Merkezi'nden elde edildi ( bakınız Malzeme Tablosu) ve 20-25 ° C'de bir Tris-asetat-fosfat (TAP)16,% 1.5 agaroz ortamında tutuldu.
1. Hücre kültürü
- Kültür Chlamydomonas reinhardtii (CC-125) TAP orta16'da 12 saat / 12 saat açık-karanlık dönemde (ışık periyodu için ışık koşulları: ~50 μmol fotonlar m−2 s−1 beyaz ışık) 2 gün boyunca 20-25 °C'de (Şekil 1).
NOT: Hücreler orta logaritmik büyüme aşamasında olmalıdır (Film 1). Uzun kültür (>4 gün, geç logaritmik büyüme veya durağan fazda), hatırlanan hücre modellerinin reaktivasyon verimliliğini azaltır.

Resim 1: 2 günlük kültürlemeden sonra sıvı kültür. Bir TAP-1.5% agar plakasından, platin döngüsünü doldurmak için bir parça vahşi tip hücre, bir şişede ~ 150 mL TAP sıvı ortamına aşılandı. 2 günlük kültürden sonra hücre yoğunluğu 2.3 × 106 hücre / mL idi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Film 1: Canlı hücrelerin yüzdürülmesi. Hücreler, 10x objektif lens ve yağ daldırma karanlık alan kondenseri ile mikroskop altında gözlendi. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
2. Hatırlanmış hücre modellerinin hazırlanması
NOT: Deneye başlamadan önce, yıkama tamponunu oda sıcaklığında ve buz üzerindeki demembranasyon, seyreltme, reaktivasyon tamponları ve ATP çözeltisini tutun. Bu tamponların bileşimi Ek Tablo 1'de verilmiştir.
- 3 dakika boyunca 1000 × g'de 20 °C'de ~10 mL sıvı kültür santrifüjü yapın.
NOT: Bu adımdaki protokol boyunca, otoklavlanmış plastik eşyalar (tüpler, pipet uçları vb.) kullanmayın, bu da reaktivasyon verimliliğini azaltır. Konik tüpler için yeniden kullanılanlar tercih edilir. 2 günlük kültürden sonra hücre yoğunluğu tipik olarak 1.0-5.0 × 106 hücre / mL olabilir. Hücre yoğunluğu bundan daha düşük olduğunda, ~ 5 × 107 hücre içerecek kadar kültür hacmi alın. - Süper nantantı önce dekantasyonla, sonra bir Pasteur pipetle atın ve çökeltileri ~5 mL yıkama tamponunda yeniden askıya alın.
- Yıkama tamponundaki hücreleri 1000 × g'da 20 °C'de 3 dakika boyunca santrifüj yapın.
- Süpernatantı bir pipetle dikkatlice atın (Şekil 2).
NOT: Pasteur pipetler tercih edilir. Mikropipet kullanırken, otoklavlanmış pipet uçlarını kullanmaktan kaçının. - Bir hücre peleti üzerine ~ 0.5 mL demembranasyon tamponu yerleştirin, tampondaki hücreleri kabaca askıya almak için tüpü elle hafifçe sallayın ve tüpü buz üzerine koyun (Şekil 3A).
NOT: Şu anda peleti tamamen askıya almak gerekli değildir. Hücre modelleri yeniden aktive edildiğinde demembranasyon ve reaktivasyon tamponlarında MgSO4 konsantrasyonunu 15 mM'ye yükseltin, stabil reaktivasyon için son ATP konsantrasyonu >1 mM17. - Kalan hücre peletini bir pipetle nazikçe askıya alın ve tüpü tekrar buzun üzerine yerleştirin (Şekil 3B).
- Hücre modellerinden 5-10 μL alın, seyreltme tamponu ile 10 kat seyreltin ve tüm hücre modellerinin hatırlandığını ve yüzmediğini doğrulamak için mikroskop altında gözlemleyin (Film 2) (Şekil 4).
NOT: Bazı hücreler hala yüzüyorsa (canlı), demembranasyon tamponunda kullanılan iyonik olmayan deterjanı doğrudan hücre modeli çözeltisine ~% 0.15'lik son konsantrasyona ekleyin. Alternatif olarak, 2.1-2.5 arasındaki adımları %0,15 deterjan içeren demembranasyon çözeltisi ile tekrarlayın.
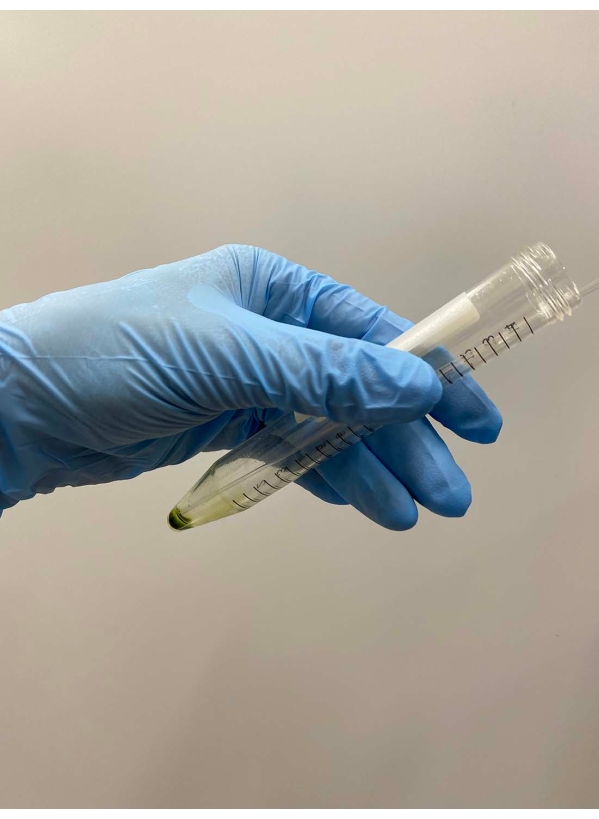
Resim 2: Süpernatanın atılması. Süpernatantın geri kalanı, süpernatant tüpün dekantasyonu ile çıkarıldıktan sonra bir Pasteur pipet ile dikkatlice çıkarıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
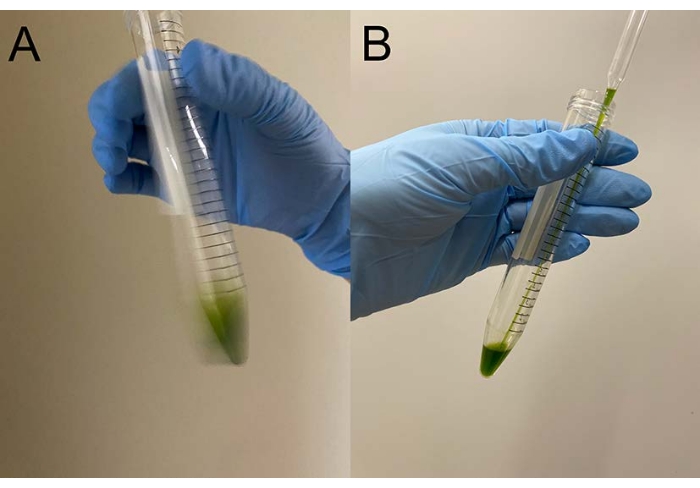
Şekil 3: Demembranasyon. (A) Hücre peleti üzerine 0.5 mL demembranasyon çözeltisi yerleştirildikten sonra, çözelti hücreleri kabaca askıya almak için bir el ile karıştırıldı. (B) Karıştırdıktan sonra, hücre peletinin geri kalanı bir Pasteur pipeti ile çözelti içinde tamamen askıya alındı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
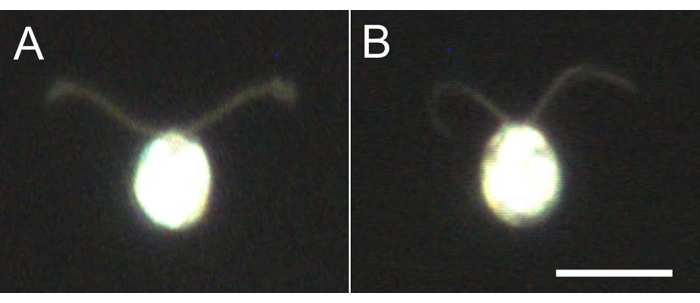
Şekil 4: Hatırlamanın etkileri . (A) Cam bir slayta sıkışmış canlı bir hücre. (B) Cam slayta sıkışmış bir hücre modeli. Hücre modelinde, kirpiklerin biraz daha inceldiğini unutmayın. Görüntüler, 20x objektif lens ve yağ daldırma karanlık alan kondenseri ile mikroskop altında gözlemlendi. Ölçek çubuğu = 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Film 2: Hatırlamanın doğrulanması. Hücre modeli süspansiyonu, 10x objektif lens ve yağ daldırma karanlık alan kondenseri ile mikroskop altında gözlendi. Hiçbir hücre yüzmüyordu. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
3. Hatırlanan hücre modellerinin yeniden etkinleştirilmesi
- 80 μL reaktivasyon çözeltisini, 10 μL ATP çözeltisini ve 10 μL hücre modellerini tüpe dokunarak 0,5 mL'lik bir tüpte karıştırın (Şekil 5).
NOT: Son ATP konsantrasyonu <3 mM olmalıdır, çünkü siliyer hareket için bir parametre olan siliyer atma frekansı, ATP konsantrasyonu ile artar ve ATP17'nin 2-3 mM'sinde doyurulur.
DİKKAT: Pipetleme veya vorteks ile karıştırma işlemi azalmaya neden olur ve reaktivasyon verimliliğini azaltır.- <0,2 mM ATP ile yeniden aktive etmek için, 70 U/mL kreatin kinaz ve 5 mM kreatin fosfat gibi bir ATP rejenerasyon sistemi ekleyin (bkz.
NOT: Reaktivasyon çözeltisi, seyreltme çözeltisinden daha yüksek bir konsantrasyonda (1.125x, Ek Tablo 1) hazırlanır, böylece suda çözünmüş ATP'yi karıştırdıktan sonra, içerikler aşağıdaki nihai konsantrasyonlara ulaşır: 30 mM Hepes (pH 7.4), 5 mM MgSO4, 1 mM ditiyotreitol (DTT), 1 mM EGTA ve 50 mM potasyum asetat (bkz.
- <0,2 mM ATP ile yeniden aktive etmek için, 70 U/mL kreatin kinaz ve 5 mM kreatin fosfat gibi bir ATP rejenerasyon sistemi ekleyin (bkz.
- Karışık çözeltinin ~ 30 μL'sini bir cam slayt üzerine koyun ve hücre modellerine mekanik şoku önlemek için ara parçalarla üzerine yavaşça bir kapak kayması yerleştirin (Şekil 6).
NOT: Ara parçaları yapmak için beyaz petrol veya çift taraflı yapışkan bantlar kullanılabilir. - Yeniden aktive edilmiş hücre modellerini mikroskop altında gözlemleyin (Film 3).

Şekil 5: Tüpe dokunarak karıştırma çözeltisi. (A) Reaktivasyon çözeltisinin 80 μL'sine, 10 μL'ye ATP çözeltisi ve 10 μL'ye kadar hücre modelleri sıralı sırayla eklendi. (B) Çözelti, tüpe parmağınızla dokunularak karıştırıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Kapak kayma kenarlarında ara parçalar yapılması . (A) Bir elin arkasına ince bir beyaz petrol tabakası uygulandı. (B) Az miktarda beyaz petrol, bir kapak kapağının kenarı ile kazındı. (C) Bir kapak kaymasının kenarına bir ara parça yapılmıştır. (D) Karşı kenarda başka bir ara parça yapılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Film 3: Yeniden aktive edilmiş hücre modellerinin yüzmesi. Hücre modellerinin hareketliliği, 1 mM'lik son konsantrasyonda ATP eklenerek yeniden aktive edildi ve 10x objektif lens ve bir yağ daldırma karanlık alan kondenseri ile mikroskop altında gözlendi. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Sonuçlar
C. reinhardtii vahşi tip suşunda (CC-125) demembranasyon ve reaktivasyon süreci burada gösterilmiştir. Aşılamadan 2 gün sonra kültür açık yeşil bir renk haline geldi (adım 1.1) (Şekil 1). Hücreler toplandı (adım 2.1), yıkandı (adım 2.2) ve demembrane edildi (adım 2.5). Demembranasyondan sonra, tüm hücre modelleri hareketsiz hale geldi (adım 2.7). Membrane edilmiş kirpikler (aksonemler olarak adlandırılır) hücre gövdesine bağlı kalır, bu da hücre m...
Tartışmalar
Bu protokolde iki kritik adım vardır. Birincisi, nazikçe ama iyice yapılması gereken demembranasyon olarak bilinen bir işlemdir. Dekiliasyon (yani, kirpiklerin hücre gövdesinden ayrılması), güçlü pipetleme veya vorteks ile indüklenir ve hücre modellerini ATP'nin eklenmesinden sonra bile hareketsiz hale getirir. Tipik olarak, 5 × 107 hücre, ~ 0.5 mL demembranasyon tamponunda askıya alınır (son hücre yoğunluğu: 1 × 108 hücre / mL). Hücre modeli yoğunluğu bundan çok daha d?...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Japonya Bilimi Geliştirme Derneği KAKENHI'den (https://www.jsps.go.jp/english/index.html) N.U. (19K23758, 21K06295) ve K.W.'ye (19H03242, 20K21420, 21H00420), Ohsumi Frontier Science Foundation'dan (https://www.ofsf.or.jp/en/) K.W.'ye ve İnsan, Çevre ve Malzeme Köprüsü için Dinamik İttifak'tan (http://alliance.tagen.tohoku.ac.jp/english/) N.U. ve K.W.'ye hibelerle desteklenmiştir. Bayan Miyuki Shinohara'ya (Hosei Univ.) figürlerin hazırlanmasındaki yardımı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
Referanslar
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır