Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Reaktivierung demembranierter Zellmodelle in Chlamydomonas reinhardtii
In diesem Artikel
Zusammenfassung
Die In-vitro-Reaktivierung beweglicher Zellen ist ein entscheidendes Experiment zum Verständnis der Mechanismen der Zellmotilität. Das Protokoll beschreibt die Reaktivierung der demembranierten Zellmodelle von Chlamydomonas reinhardtii, einem Modellorganismus zur Untersuchung von Zilien / Flagellen.
Zusammenfassung
Seit dem historischen Experiment zur Kontraktion glykerinierter Muskeln durch Zugabe von ATP, das Szent-Györgyi Mitte des 20. Jahrhunderts demonstrierte, ist die In-vitro-Reaktivierung demembranierter Zellen ein traditioneller und wirksamer Weg, um die Zellmotilität zu untersuchen. Der grundlegende Vorteil dieser experimentellen Methode besteht darin, dass die Zusammensetzung der Reaktivierungslösung leicht verändert werden kann. Zum Beispiel kann eine Umgebung mit hoher Ca2 + - Konzentration, die aufgrund der Membrananregung in vivo nur vorübergehend auftritt, im Labor repliziert werden. Eukaryotische Zilien (auch bekannt als Flagellen) sind ausgeklügelte Motilitätsmechanismen, deren Regulationsmechanismen noch geklärt werden müssen. Die einzellige Grünalge Chlamydomonas reinhardtii ist ein hervorragender Modellorganismus im Forschungsgebiet der Zilien. Die Reaktivierungsexperimente mit demembranierten Zellmodellen von C. reinhardtii und ihren Derivaten, wie demembranierten Axonemen isolierter Zilien, haben wesentlich zum Verständnis der molekularen Mechanismen der Ziliarmotilität beigetragen. Diese Experimente stellten klar, dass ATP die Ziliarmotilität anregt und dass verschiedene zelluläre Signale, einschließlich Ca2 +, cAMP und reaktive Sauerstoffspezies, Ziliarbewegungen modulieren. Die genaue Methode zur Demembranation von C. reinhardtii-Zellen und zur Reaktivierung der Zellmodelle wird hier beschrieben.
Einleitung
Die In-vitro-Reaktivierung demembranierter beweglicher Zellen ist ein wertvolles Werkzeug, um die molekularen Grundlagen für den Regulationsmechanismus der Zellmotilität zu untersuchen. Szent-Györgyi zeigte erstmals eine In-vitro-Kontraktion von Kaninchenskelettmuskelfasern, die mit 50% Glycerin extrahiert wurden, durch Zugabe von Adenosintriphosphat (ATP)1. Dieses Experiment war das erste, das bewies, dass ATP die Muskelkontraktion mit Energie versorgt. Die Methodik wurde bald auf die Untersuchung von ATP-energetisierter Ziliar- / Flagellenmotilität angewendet, wie Spermienflagellen2, Paramecium cilia 3 und Chlamydomonas reinhardtii cilia (auch Flagellen genannt)4 unter Verwendung von nichtionischen Reinigungsmitteln zur Demembranation.
Die einzellige Grünalge C. reinhardtii ist ein Modellorganismus für die Erforschung von Zilien: Sie schwimmt mit zwei Zilien, indem sie sie wie die Brust eines Menschen schlägt5. Die Ziliarbewegung wird durch Dynein angetrieben, ein minus-end-gerichtetes Mikrotubuli-basiertes Motorprotein 6,7. Ziliare Dyneine können in Außenarm-Dynes und Innenarm-Dynein eingeteilt werden. Mutanten, denen jede Art von Dynein fehlt, wurden als langsam schwimmende Mutanten mit unterschiedlichen Motilitätsanomalien isoliert. Die detaillierte In-vitro-Motilitätsanalyse dieser Mutanten hat die Dynein-Forschung erheblich vorangebracht8.
Seit der Etablierung des In-vitro-Reaktivierungsexperiments von demembranierten C. reinhardtii-Zellen (Zellmodelle) wurden mit dieser Methode und ihren Derivaten viele wichtige Erkenntnisse erzielt. Die Reaktivierung von Zellmodellen in einer Reihe von Ca2+-Puffern zeigtebeispielsweise 9, dass zwei Zilien durch submikromolare Ca2+ unterschiedlich reguliert werden, und diese asymmetrische Zilienkontrolle ermöglicht die phototaktische Orientierung von C. reinhardtii10. Darüber hinaus zeigen beide Zilien eine Wellenformkonvertierung vom Vorwärtsschwimmmodus (asymmetrische Wellenform genannt) in den Rückwärtsschwimmmodus (symmetrische Wellenform genannt, die für einen kurzen Zeitraum auftritt, wenn Zellen photo- oder mechanoschockiert sind)11,12. Diese Wellenformumwandlung wird durch submillimolare Ca2+ reguliert, was durch die Reaktivierung des sogenannten Nukleoflagellarapparates (ein Komplex mit zwei Zilien, den Basalkörpern, den Strukturen, die die Basalkörper mit dem Kern verbinden, und dem Rest des Kerns)11 oder demembranierten Axonemen isolierter Zilien13 gezeigt wurde. Abgesehen von Ca2 + ist die Redox-Haltung (Reduktions-Oxidation) ein Signal, das die Ziliarschlagfrequenz reguliert, was durch die Reaktivierung von Zellmodellen in Redoxpuffern gezeigt wurde, die unterschiedliche Verhältnisse von reduziertem Glutathion zu oxidiertem Glutathion 14 enthalten. Darüber hinaus reguliert cyclisches Adenosinmonophosphat (cAMP) asymmetrisch zwei Zilien, was durch die Reaktivierung von Axonemen mit photoklavierbarem cAMP15 gezeigt wurde. Diese In-vitro-Befunde, kombiniert mit genetischen Befunden, haben zu einem tieferen Verständnis der molekularen Mechanismen der Zilienregulation bei C. reinhardtii geführt.
Ein Protokoll zur Reaktivierung der Zellmodelle wird hier beschrieben. Die Methode ist einfach, ermöglicht verschiedene Modifikationen und kann auf mehrere Organismen angewendet werden, die sich mit Zilien bewegen. Da demembranierte Zellen jedoch zerbrechlich sind, sind einige Tipps erforderlich, um die Motilität von Zellmodellen mit guter Effizienz zu reaktivieren und gleichzeitig eine Dezitilisierung zu verhindern.
Protokoll
Ein Wildtypstamm von Chlamydomonas reinhardtii, CC-125, wurde für die vorliegende Studie verwendet. CC-125 wurde vom Chlamydomonas Resource Center (siehe Tabelle der Materialien) gewonnen und auf einem Tris-Acetat-Phosphat (TAP)16, 1,5% Agarosemedium bei 20-25 °C gehalten.
1. Zellkultur
- Kultur Chlamydomonas reinhardtii (CC-125) in TAP medium 16 in einer 12 h/12 h Hell-Dunkel-Periode (Lichtverhältnisse für die Lichtperiode: ~50 μmol Photonen m−2 s−1 Weißlicht) bei 20-25 °C für 2 Tage (Abbildung 1).
HINWEIS: Die Zellen müssen sich in einer mittleren logarithmischen Wachstumsphase befinden (Film 1). Lange Kultur (>4 Tage, in der spätlogarithmischen Wachstums- oder stationären Phase) verringert die Reaktivierungseffizienz demembranierter Zellmodelle.

Abbildung 1: Flüssigkultur nach 2-tägiger Kultivierung. Von einer TAP-1,5% Agarplatte wurde ein Stück Wildtypzellen zum Füllen der Platinschleife in einem Kolben auf ~ 150 ml TAP-Flüssigmedium geimpft. Die Zelldichte nach 2-Tages-Kultur betrug 2,3 × 106 Zellen/ml. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Film 1: Schwimmen lebender Zellen. Die Zellen wurden unter einem Mikroskop mit einer 10-fachen Objektivlinse und einem Öl-Tauch-Dunkelfeldkondensator beobachtet. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um diesen Film herunterzuladen.
2. Erstellung demembranierter Zellmodelle
HINWEIS: Bevor Sie mit dem Experiment beginnen, bewahren Sie den Waschpuffer bei Raumtemperatur und die Demembranierungs-, Verdünnungs-, Reaktivierungspuffer und die ATP-Lösung auf Eis auf. Die Zusammensetzung dieser Puffer ist in der Ergänzenden Tabelle 1 aufgeführt.
- Zentrifuge ~10 mL Flüssigkultur bei 1000 × g bei 20 °C für 3 min.
HINWEIS: Verwenden Sie im gesamten Protokoll dieses Schritts keine autoklavierten Kunststoffwaren (Röhrchen, Pipettenspitzen usw.), wodurch die Reaktivierungseffizienz verringert wird. Für konische Rohre sind wiederverwendete bevorzugt. Die Zelldichte nach 2-Tage-Kultur kann typischerweise 1,0-5,0 × 106 Zellen / ml betragen. Wenn die Zelldichte niedriger ist, nehmen Sie genug Kulturvolumen, um ~ 5 × 107 Zellen zu enthalten. - Entsorgen Sie den Überstand, zuerst durch Dekantieren und dann durch eine Pasteur-Pipette, und suspendieren Sie die Ausscheidungen in ~ 5 ml Waschpuffer.
- Zentrifugenzellen im Waschpuffer bei 1000 × g für 3 min bei 20 °C.
- Verwerfen Sie den Überstand vorsichtig mit einer Pipette (Abbildung 2).
HINWEIS: Pasteur-Pipetten sind vorzuziehen. Vermeiden Sie bei der Verwendung von Mikropipetten die Verwendung von Pipettenspitzen, die autoklaviert wurden. - Überlagern Sie ~ 0,5 ml Demembranationspuffer auf ein Zellpellet, schütteln Sie das Röhrchen vorsichtig von Hand, um die Zellen im Puffer grob zu suspendieren, und legen Sie das Rohr auf Eis (Abbildung 3A).
HINWEIS: Es ist nicht notwendig, das Pellet in diesem Moment vollständig auszusetzen. Erhöhen Sie die Konzentration von MgSO4 auf 15 mM in den Demembranations- und Reaktivierungspuffern, wenn Zellmodelle reaktiviert werden, mit einer endgültigen ATP-Konzentration >1 mM für eine stabile Reaktivierung17. - Suspendieren Sie das verbleibende Zellpellet vorsichtig mit einer Pipette und legen Sie das Rohr erneut auf Eis (Abbildung 3B).
- Nehmen Sie 5-10 μL der Zellmodelle, verdünnen Sie 10-fach mit dem Verdünnungspuffer und beobachten Sie unter dem Mikroskop (Film 2), um zu bestätigen, dass alle Zellmodelle demembraniert sind und nicht schwimmen (Abbildung 4).
HINWEIS: Wenn einige Zellen noch schwimmen (lebendig), fügen Sie das im Demembranationspuffer verwendete nichtionische Reinigungsmittel direkt in die Zellmodelllösung bis zur Endkonzentration von ~ 0,15% hinzu. Alternativ können Sie die Schritte 2.1-2.5 mit der Demembranierungslösung wiederholen, die 0,15% Reinigungsmittel enthält.
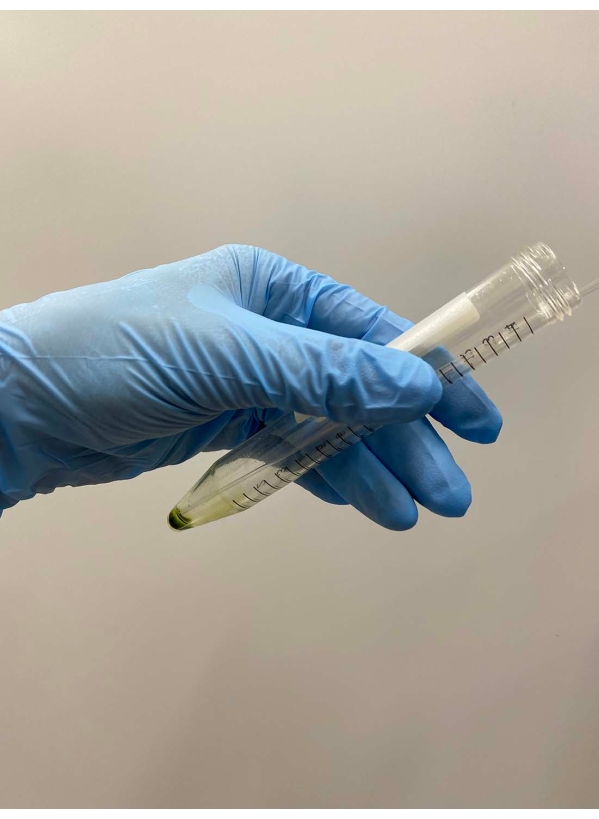
Abbildung 2: Verwerfen des Überstandes. Der Rest des Überstands wurde vorsichtig mit einer Pasteur-Pipette entfernt, nachdem der Überstand durch Dekantieren des Röhrchens entfernt worden war. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 3: Demembranation . (A) Nach dem Überlagern von 0,5 ml Demembranierungslösung auf das Zellpellet wurde die Lösung von einer Hand gemischt, um die Zellen grob zu suspendieren. (B) Nach dem Mischen wurde der Rest des Zellpellets durch eine Pasteurpipette vollständig in der Lösung suspendiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
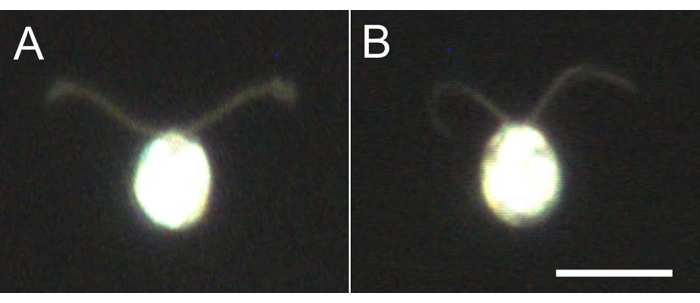
Abbildung 4: Auswirkungen der Demembranation . (A) Eine lebende Zelle, die auf einem Glasobjektträger steckt. (B) Ein Zellmodell, das auf einem Glasobjektträger klebt. Beachten Sie, dass im Zellmodell die Zilien etwas dünner wurden. Die Bilder wurden unter einem Mikroskop mit einer 20-fachen Objektivlinse und einem Öl-Tauch-Dunkelfeldkondensator beobachtet. Maßstabsleiste = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Film 2: Bestätigung der Demembranation. Die Zellmodellsuspension wurde unter einem Mikroskop mit einer 10-fachen Objektivlinse und einem Öl-Tauch-Dunkelfeldkondensator beobachtet. Keine Zelle schwamm. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um diesen Film herunterzuladen.
3. Reaktivierung demembranierter Zellmodelle
- Mischen Sie 80 μL Reaktivierungslösung, 10 μL ATP-Lösung und 10 μL Zellmodelle in einer 0,5 ml Röhre durch Klopfen des Röhrchens (Abbildung 5).
HINWEIS: Die endgültige ATP-Konzentration muss <3 mM betragen, da die Ziliarschlagfrequenz, ein Parameter für die Ziliarbewegung, mit der ATP-Konzentration zunimmt und bei 2-3 mM von ATP17 gesättigt ist.
ACHTUNG: Das Mischen durch Pipettieren oder Vortexen verursacht eine Deziliation und verringert die Reaktivierungseffizienz.- Zur Reaktivierung mit <0,2 mM ATP fügen Sie ein ATP-Regenerationssystem hinzu, z. B. 70 E/ml Kreatinkinase und 5 mM Kreatinphosphat (siehe Materialtabelle).
HINWEIS: Die Reaktivierungslösung wird in einer höheren Konzentration (1.125x, Ergänzende Tabelle 1) als die Verdünnungslösung hergestellt, so dass nach dem Mischen des in Wasser gelösten ATP der Inhalt die folgenden Endkonzentrationen erreicht: 30 mM Hepes (pH 7,4), 5 mM MgSO4, 1 mM Dithiothreitol (DTT), 1 mM EGTA und 50 mM Kaliumacetat (siehe Materialtabelle).
- Zur Reaktivierung mit <0,2 mM ATP fügen Sie ein ATP-Regenerationssystem hinzu, z. B. 70 E/ml Kreatinkinase und 5 mM Kreatinphosphat (siehe Materialtabelle).
- Geben Sie ~ 30 μL der gemischten Lösung auf einen Glasobjektträger und legen Sie vorsichtig ein Deckglas mit Abstandshaltern darauf, um mechanische Stöße auf die Zellmodelle zu vermeiden (Abbildung 6).
HINWEIS: Weißes Erdöl oder doppelseitige Klebebänder können verwendet werden, um die Abstandshalter herzustellen. - Beobachten Sie die reaktivierten Zellmodelle unter dem Mikroskop (Film 3).

Abbildung 5: Mischlösung durch Klopfen des Rohres . (A) Zu 80 μL der Reaktivierungslösung wurden 10 μL ATP-Lösung und 10 μL Zellmodelle in sequenzieller Reihenfolge zugegeben. (B) Die Lösung wurde durch Klopfen des Röhrchens mit einem Finger gemischt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Herstellen von Abstandshaltern an Deckglaskanten . (A) Eine dünne Schicht aus weißem Erdöl wurde auf den Handrücken aufgetragen. (B) Eine kleine Menge Weißöl wurde mit einem Rand eines Deckglases abgekratzt. (C) Am Rand eines Deckglases wurde ein Abstandshalter hergestellt. (D) Ein weiterer Abstandshalter wurde an der gegenüberliegenden Kante hergestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Film 3: Schwimmen reaktivierter Zellmodelle. Die Motilität der Zellmodelle wurde durch Zugabe von ATP in einer Endkonzentration von 1 mM reaktiviert und unter einem Mikroskop mit einer 10-fachen Objektivlinse und einem Öl-Tauch-Dunkelfeldkondensator beobachtet. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Ergebnisse
Der Demembranations- und Reaktivierungsprozess in C. reinhardtii Wildtypstamm (CC-125) ist hier dargestellt. Die Kultur wurde 2 Tage nach der Impfung hellgrün (Schritt 1.1) (Abbildung 1). Die Zellen wurden gesammelt (Schritt 2.1), gewaschen (Schritt 2.2) und demembraniert (Schritt 2.5). Nach der Demembranation wurden alle Zellmodelle unbeweglich (Schritt 2.7). Die demembranierten Zilien (Axoneme genannt) bleiben am Zellkörper haften, was zeigt, dass die Unbeweglichkeit der Zellmo...
Diskussion
Es gibt zwei kritische Schritte in diesem Protokoll. Der erste ist ein Prozess, der als Demembranation bekannt ist und sanft, aber gründlich durchgeführt werden muss. Die Deziliation (d.h. das Ablösen von Zilien vom Zellkörper) wird durch kräftiges Pipettieren oder Wirbeln induziert, wodurch die Zellmodelle auch nach der Zugabe von ATP unbeweglich werden. Typischerweise sind 5 × 107 Zellen in ~0,5 ml Demembranationspuffer suspendiert (Endzelldichte: 1 × 108 Zellen/ml). Die Reaktivierungsrate ...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde durch Zuschüsse der Japan Society for the Promotion of Science KAKENHI (https://www.jsps.go.jp/english/index.html) an N.U. (19K23758, 21K06295) und K.W. (19H03242, 20K21420, 21H00420), von der Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) an K.W. und von der Dynamic Alliance for Open Innovation Bridging Human, Environment and Materials (http://alliance.tagen.tohoku.ac.jp/english/) an N.U. und K.W. unterstützt. Wir danken Frau Miyuki Shinohara (Hosei Univ.) für ihre Hilfe bei der Vorbereitung der Figuren.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
Referenzen
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten