A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد تقارب الارتباط (KD) للأجسام المضادة ذات العلامات المشعة للمستضدات المجمدة
In This Article
Summary
هنا ، يتم وصف طريقة لتحديد تقارب الارتباط (KD) للأجسام المضادة ذات العلامات المشعة للمستضدات المجمدة. KD هو ثابت تفكك التوازن الذي يمكن تحديده من تجربة ربط التشبع عن طريق قياس الارتباط الكلي والمحدد وغير المحدد لجسم مضاد يحمل علامة إشعاعية بتركيزات مختلفة لمستضدها.
Abstract
يعد تحديد تقارب الارتباط (KD) جانبا مهما من جوانب توصيف الأجسام المضادة ذات العلامات الإشعاعية (rAb). عادة ، يتم تمثيل تقارب الارتباط بثابت تفكك التوازن ، KD ، ويمكن حسابه على أنه تركيز الأجسام المضادة التي يتم فيها شغل نصف مواقع ربط الأجسام المضادة عند التوازن. يمكن تعميم هذه الطريقة على أي جسم مضاد يحمل علامة إشعاعية أو سقالات أخرى من البروتين والببتيد. وعلى النقيض من الطرق القائمة على الخلايا، فإن اختيار المستضدات المجمدة مفيد بشكل خاص للتحقق من صحة تقاربات الارتباط بعد التخزين طويل الأجل للأجسام المضادة، والتمييز بين التقاربات الملزمة لأذرع منطقة ربط المستضدات الشظايا (Fab) في تركيبات الأجسام المضادة ثنائية النوعية، وتحديد ما إذا كان هناك تباين في التعبير عن المستضد بين خطوط الخلايا المختلفة. تتضمن هذه الطريقة شل حركة كمية ثابتة من المستضد إلى آبار محددة على صفيحة قابلة للكسر من 96 بئرا. ثم ، تم حظر الربط غير المحدد في جميع الآبار مع ألبومين مصل البقر (BSA). في وقت لاحق ، تمت إضافة rAb في تدرج تركيز لجميع الآبار. تم اختيار مجموعة من التركيزات للسماح ل rAb بالوصول إلى التشبع ، أي تركيز الأجسام المضادة التي ترتبط فيها جميع المستضدات باستمرار ب rAb. في الآبار المعينة بدون مستضد مشدود ، يمكن تحديد الربط غير المحدد ل rAb. من خلال طرح الربط غير المحدد من الربط الكلي في الآبار باستخدام مستضد مجمد ، يمكن تحديد ربط محدد ل rAb بالمستضد. تم حساب KD من rAb من منحنى ربط التشبع الناتج. على سبيل المثال ، تم تحديد تقارب الارتباط باستخدام amivantamab المسمى إشعاعيا ، وهو جسم مضاد ثنائي النوعية لمستقبلات عامل نمو البشرة (EGFR) وبروتينات الانتقال الوسيط الوسيط الظهاري (cMET).
Introduction
الأجسام المضادة ذات العلامات الإشعاعية (rAb) لها مجموعة متنوعة من الاستخدامات في الطب. في حين يتم استخدام الغالبية العظمى في علم الأورام كعوامل تصوير وعلاجية ، هناك تطبيقات تصوير للالتهابات المرتبطة بالروماتيزم وأمراض القلب والأعصاب1. التصوير rAbs لديه حساسية عالية للكشف عن الآفات ولديه القدرة على المساعدة في اختيار المريض للعلاج2،3،4،5. كما أنها تستخدم للعلاج بسبب خصوصيتها لمستضداتها الخاصة. في استراتيجية تعرف باسم theranostics ، يتم استخدام نفس rAb لكل من التصوير والعلاج6.
من الناحية المثالية ، فإن الجسم المضاد المختار لوضع العلامات الإشعاعية هو واحد ثبت بالفعل أن لديه تقارب وخصوصية ربط عالية باستخدام طرق غير موسومة إشعاعيا. يمكن تحقيق وضع العلامات الإشعاعية للأجسام المضادة عن طريق التعديل الكيميائي المباشر للأجسام المضادة مع النويدات المشعة التي تشكل روابط تساهمية مستقرة (مثل اليود المشع) ، أو بشكل غير مباشر عن طريق الاقتران مع المخلبات التي تنسق لاحقا مع المعادن المشعة 7,8. وضع العلامات الإشعاعية المباشرة مثل اليود المشع يعدل على وجه التحديد التيروزين وبقايا الهيستيدين على الجسم المضاد. إذا كانت هذه المخلفات مهمة لربط المستضدات ، فإن هذا الاقتران الإشعاعي سيغير تقارب الربط. وعلى العكس من ذلك، هناك العديد من البروتوكولات المعمول بها للاقتران ووضع العلامات الإشعاعية غير المباشرة للأجسام المضادة. على سبيل المثال ، المخلب الشائع المستخدم لربط الزركونيوم-89 (89Zr) لتصوير PET للأجسام المضادة هو p-isothiocyanatobenzyl-desferrioxamine (DFO) ، والذي يقترن عشوائيا ببقايا ليسين من الجسم المضاد 9,10. إذا كانت هناك بقايا ليسين في منطقة ربط المستضدات ، فإن الاقتران في هذه المواقع يمكن أن يعيق ارتباطا بالمستضد بشكل معقم وبالتالي يعرض ربط الأجسام المضادة بالمستضدات للخطر. وبالتالي ، فإن طرق الاقتران الإشعاعي المختلفة المستخدمة في وضع العلامات الإشعاعية غير المباشرة أو المباشرة للأجسام المضادة يمكن أن تؤثر على التفاعل المناعي ، والذي يعرف بأنه قدرة الاقتران الإشعاعي للأجسام المضادة على الارتباط بمستضده 7,11. يمكن لطرق الاقتران الخاصة بالموقع التحايل على هذا القيد ، ولكن هذه التقنيات تتطلب هندسة الأجسام المضادة لدمج بقايا السيستين الإضافية أو الخبرة في التفاعلات الأنزيمية على بقايا الكربوهيدرات12،13،14،15،16. بمجرد وضع علامة إشعاعية على الجسم المضاد ، من المهم اختبار ما إذا كان يتم الاحتفاظ بالتفاعل المناعي كجزء من توصيف rAb. تتمثل إحدى طرق قياس التفاعل المناعي في تحديد التقارب الملزم ل rAb.
الغرض من هذا البروتوكول هو وصف عملية لتحديد التقارب الملزم ل rAbs باستخدام اختبار تشبع راديوي ثابت لتحديد ارتباط مستضد rAb. ويرد في الشكل 1 بيان بالاتجاه الملزم. ستزداد كمية المستضد المرتبط مع إضافة المزيد من rAb إلى كمية ثابتة من المستضد المجمد. بمجرد تشبع جميع مواقع ربط المستضدات ، سيتم الوصول إلى هضبة ، ولن يكون لإضافة المزيد من rAbs أي تأثير على كمية المستضد المرتبط. في هذا النموذج ، ثابت تفكك التوازن (KD) هو تركيز الجسم المضاد الذي يشغل نصف مستقبلات المستضد17. يمثل K D مدى ارتباط الجسم المضاد بهدفه مع KD أقل يتوافق مع تقارب ربط أعلى. وقد أفيد سابقا أن rAb المثالي يجب أن يكون KD من 1 نانومولار أو أقلمن 18. ومع ذلك ، تم تطوير rAbs أحدث مع KD في نطاق نانومولار منخفض ، وتعتبر مناسبة لتطبيقات التصوير غير الباضعة19،20،21،22. معلمة أخرى يمكن تحديدها في اختبار التشبع الإشعاعي ل rAbs هي Bmax ، والتي تتوافق مع الحد الأقصى لكمية ربط المستضدات. يمكن استخدام Bmax لحساب عدد جزيئات المستضد إذا لزم الأمر.

الشكل 1: منحنى ربط التشبع التمثيلي. يتم رسم النسبة المئوية للمستضد المرتبط مقابل زيادة تركيزات الأجسام المضادة المضافة إلى كمية ثابتة من المستضد. تظهر النوافذ المنبثقة أنها ملزمة في نقاط مختلفة. يتم عرض التركيز والربط المقابل ل KD و Bmax ، على التوالي. تم إنشاء هذا الرقم مع BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هذا الفحص مهم بشكل خاص لبنى الأجسام المضادة ثنائية النوعية ذات العلامات الإشعاعية لتحديد KD لكل ذراع منطقة ربط مستضد شظايا (Fab) من الجسم المضاد ثنائي النوعية الموسوم إشعاعيا مع المستضدات الخاصة به. يمكن استخدام هذا البروتوكول لتحديد KD لكل ذراع Fab على حدة على المستضدات المجمدة لتحديد ما إذا كان التقارب الملزم لكل ذراع Fab للمستضد الخاص به قد تأثر بشكل مستقل بعد الاقتران الإشعاعي. ويتضح هذا البروتوكول من خلال استخدام أميفانتاماب المسمى إشعاعيا، وهو جسم مضاد ثنائي النوعية لمستقبلات عامل نمو البشرة (EGFR) وبروتينات الانتقال الوسيط الظهاري السيتوبلازمي (cMET)19. كما استخدمت كأمثلة19 الأجسام المضادة أحادية الذراع المصنفة إشعاعيا، حيث يرتبط أحد أذرع Fab ب EGFR (α-EGFR) أو ب cMET (α-cMET) وذراع Fab الآخر هو عنصر تحكم متساوي النوع. هذا البروتوكول مناسب أيضا لأي جسم مضاد يحمل علامة إشعاعية مع مستضد معروف يمكن شل حركته. في هذا البروتوكول ، تتم إضافة سلسلة تخفيف من rAb إلى كمية ثابتة من المستضد المثبت في آبار معينة محددة لكل ذراع Fab من rAb. يضاف rAb أيضا إلى الآبار التي تم حظرها فقط باستخدام ألبومين مصل البقر (BSA) ، بدون مستضد ، لتحديد الارتباط غير المحدد. لتحديد الربط المحدد ، يتم طرح الربط غير المحدد للمستضد المعطل من إجمالي ربط rAb. ثم يتم استخدام منحنى ربط التشبع الناتج لتحديد KD ، كما هو موضح أعلاه.
تتمثل إحدى مزايا هذه الطريقة في زيادة قابلية التكرار عند استخدام المستضدات النقية مقارنة باستخدام خطوط الخلايا كمصدر للمستضدات ، بالنظر إلى أن مستويات التعبير عن المستضدات يمكن أن تتأثر أثناء زراعة الخلايا وأن خطوط الخلايا المختلفة لها مستويات متغيرة من تعبير المستضد. في حالة الأجسام المضادة ثنائية النوعية ذات العلامات المشعة ، قد لا تتوفر خطوط الخلايا التي تعبر فقط عن أحد المستضدات دون الآخر ، مما يجعل توصيف التقارب الملزم لأذرع Fab الفردية أمرا صعبا للغاية. ومن الجدير بالذكر أن الميزة الرئيسية لطريقة فحص التشبع الإشعاعي على الطرق غير الموسومة إشعاعيا هي التوصيف المحدد لتقارب ربط rAb دون مساهمة الجزء غير المقترن من rAb. على حد علم المؤلفين ، لا توجد حاليا تقنيات تنقية لفصل rAb عن الجسم المضاد الأم غير المقترن. وبالنظر إلى الحجم الصغير نسبيا للمخلب والنويدات المشعة، فإن مساهمتهما في الوزن الجزيئي الكلي لل rAb ضئيلة في كروماتوغرافيا استبعاد الحجم. وبالتالي ، فإن المنتج الناتج عن أي تقنية لوضع العلامات الإشعاعية هو دائما تقريبا خليط من rAb والجسم المضاد الأم غير المقترن. إن توصيف تقارب الربط باستخدام اختبار التشبع الموسوم إشعاعيا يضمن أن المنتج الذي يتم اختباره هو rAb فقط.
Protocol
ملاحظة: ارجع إلى الشكل 2 للحصول على تمثيل بياني للبروتوكول.
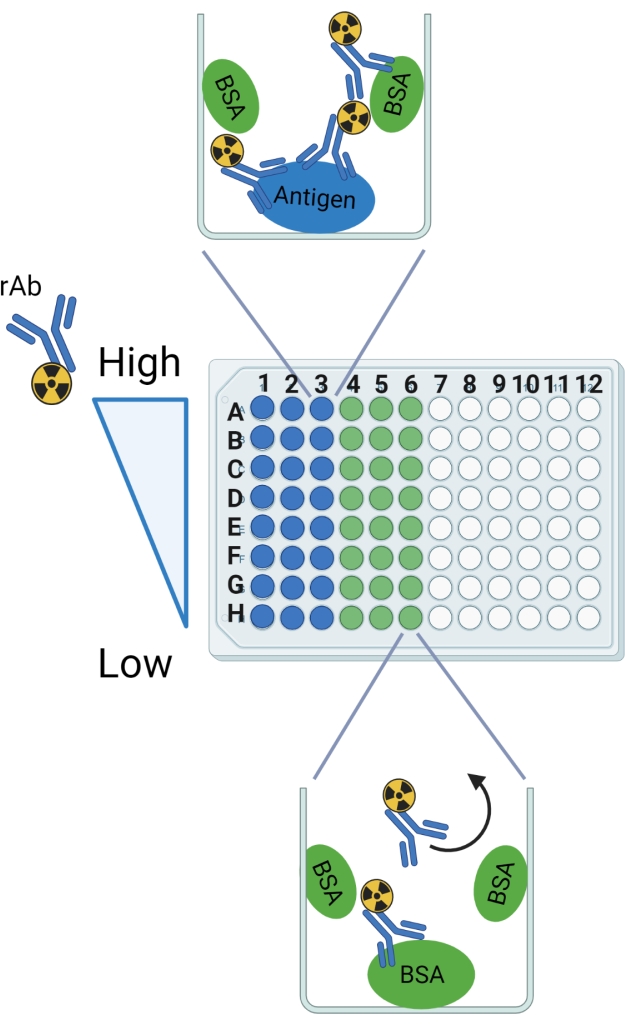
الشكل 2: مخطط البروتوكول. يشار إلى تسميات الصفوف والأعمدة كدليل لإعداد لوحة 96 بئرا القابلة للكسر. يظهر الربط المتوقع في مثال جيد للمستضد و BSA. يحدد السهم المنحني rAb الذي من المتوقع أن يتم غسله من الآبار باستخدام BSA فقط. تم إنشاء هذا الرقم مع BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد المخزن المؤقت
- تحضير 50 مل من المخزن المؤقت لتثبيت الحركة (محلول مائي من 50 mM Na2CO3 ؛ الرقم الهيدروجيني = 9.0).
- يزن 191 ملغ من NaHCO 3 و 23.9 ملغ من Na2CO3 على ورق الوزن وينقل إلى أنبوب مخروطي 50 مل. أضف 40 مل من 18 MΩ من الماء والدوامة للذوبان. اضبط الرقم الهيدروجيني إلى 9.0 إذا لزم الأمر قبل أن يصل الحجم الإجمالي إلى 50 مل مع 18 MΩ ماء.
- قم بإعداد ما يقرب من 200 مل من الغسيل العازل (محلول ملحي مخزن بالفوسفات (PBS) يحتوي على 0.05٪ Tween-20) عن طريق إضافة 200 مل من PBS ثم 100 ميكرولتر من Tween-20 إلى زجاجة سعة 250 مل.
- قم بإعداد 50 مل من المخزن المؤقت للربط (PBS يحتوي على 0.05٪ Tween-20 ، و 0.1٪ ألبومين مصل البقر (BSA)).
- يزن 50 ملغ من BSA على ورق الوزن وينقل إلى أنبوب مخروطي 50 مل. أضف 50 مل من PBS ثم 25 ميكرولتر من Tween-20 إلى الأنبوب. دوامة بلطف للخلط.
- قم بإعداد 50 مل من المخزن المؤقت للحظر (3٪ BSA في PBS).
- يزن 1.5 جم من BSA على ورق الوزن وينقل إلى أنبوب مخروطي سعة 50 مل. أضف 50 مل من PBS ، ودوامة بلطف للخلط.
ملاحظة: يوصى بتخزين جميع المخازن المؤقتة لمدة تصل إلى 1 أسبوع عند 4 درجات مئوية للحصول على أفضل النتائج.
- يزن 1.5 جم من BSA على ورق الوزن وينقل إلى أنبوب مخروطي سعة 50 مل. أضف 50 مل من PBS ، ودوامة بلطف للخلط.
2. شل حركة المستضدات
- قم بتخفيف المستضد في المخزن المؤقت للتجميد للوصول إلى تركيز 5 ميكروغرام / مل.
- أضف 100 ميكرولتر لكل بئر من المستضد إلى قاع 24 بئرا من لوحة قابلة للكسر ذات قاع مسطح 96 بئرا في صفيف 8 × 3 (الأعمدة 1-3 للصفوف من A إلى H). قم بتغطية اللوحة بشريط مانع للتسرب.
ملاحظة: تأكد من معالجة سطح صفيحة البئر لتحقيق أقصى قدر من الامتزاز للمجالات المختلطة الكارهة للماء والمحبة للماء. هذه اللوحات المعالجة مسبقا متاحة تجاريا. - احتضان في 4 درجة مئوية بين عشية وضحاها.
- في اليوم التالي ، اغسل اللوحة 3x باستخدام مخزن مؤقت للغسيل.
- اقلب اللوحة بسرعة في الحوض للتخلص من السائل واضغط على اللوحة على كومة من المناشف الورقية لإزالة السائل الزائد.
- باستخدام ماصة متعددة القنوات ، أضف 300 ميكرولتر لكل بئر من مخزن الغسيل العازل إلى الآبار التي تحتوي على المستضد. قم بإزالة السائل كما هو موضح في 2.4.1. كرر خطوة الغسيل ما مجموعه ثلاث مرات.
3. حجب المواقع غير المحددة باستخدام BSA
- باستخدام ماصة متعددة القنوات ، أضف 300 ميكرولتر لكل بئر من المخزن المؤقت المانع إلى 24 بئرا مغلفة بالمستضدات و 24 بئرا فارغة من لوحة 96 بئرا (الأعمدة 1-6 للصفوف من A إلى H).
- احتضان اللوحة لمدة 1 ساعة في درجة الحرارة المحيطة.
- اغسل اللوحة ب 300 ميكرولتر لكل بئر من الغسيل المخزن المؤقت ما مجموعه ثلاث مرات. ارجع إلى الخطوة 2.4 للحصول على وصف مفصل لغسل اللوحة.
4. التخفيفات التسلسلية وإضافة حل rAb
تنبيه: تتضمن الخطوات التالية نشاطا إشعاعيا. وينبغي ألا يقوم بالخطوات إلا الحاصلون على تدريب على السلامة الإشعاعية. يجب على الباحثين مضاعفة القفازات وتنفيذ الخطوات مع التدريع الكافي.
- توليف rAb قيد التحقيق باستخدام الطريقة التي تختارها. تم تجميع rAbs المستخدمة كمثال كما هو موضح سابقا19.
ملاحظة: يركز هذا البروتوكول على توصيف rAb بمجرد وضع علامة إرشادية. - قم بعمل 8 × 3 أضعاف التخفيفات التسلسلية (المخصصة للصفوف A-H على اللوحة) من rAb في المخزن المؤقت للربط.
ملاحظة: تختلف تركيزات التخفيفات التسلسلية لكل rAb. تتم مناقشة التفاصيل في قسم المناقشة. إذا تغير عامل التخفيف ، فيجب إعادة حساب الحجم اللازم لكل تخفيف لضمان حجم كاف ل 1) ربط rAb في كل بئر ، 2) بذر التخفيف التالي ، و 3) اقتباس محلول قياسي rAb لعد غاما لقياس النشاط الإشعاعي لإجمالي rAb المضاف إلى كل بئر.- احسب حجم المخزون rAb اللازم لصنع محلول 1.2 مل للتركيز الأول (التسمية باسم A).
- أضف 800 ميكرولتر من المخزن المؤقت الملزم إلى أنابيب أجهزة الطرد المركزي الدقيقة التي تحمل علامة B و C و D و ... إلى ح. أضف 1.2 مل مطروحا منه الحجم المحسوب في الخطوة 4.2.1 من المخزن المؤقت للربط إلى أنبوب جهاز طرد مركزي صغير يحمل علامة A.
- أضف حجم المخزون rAb المحسوب في 4.2.1 إلى الأنبوب A. دوامة بلطف لخلط ثم تدور لأسفل باستخدام جهاز طرد مركزي صغير لجمع كل السائل في الجزء السفلي من الأنبوب.
- أضف 400 ميكرولتر من الأنبوب A إلى الأنبوب B. دوامة للخلط ثم تدور لأسفل باستخدام جهاز طرد مركزي صغير صغير. كرر الإضافة من B إلى C ، C إلى D ، ...، G إلى H.
- أضف 100 ميكرولتر لكل بئر من كل تخفيف إلى ثلاثة آبار مثبتة بمستضد وثلاثة آبار مسدودة ب BSA فقط. على سبيل المثال ، أضف التخفيف A إلى الآبار A1-A3 (المستضد) و A4-A6 (BSA).
- أضف 100 ميكرولتر من كل تخفيف إلى أنابيب الطرد المركزي الدقيقة المسماة A std - H std. احفظ هذه الأنابيب كمعايير rAb ليتم فحصها في عداد غاما.
- احتضن اللوحة لمدة 1 ساعة عند 37 درجة مئوية مع هزاز لطيف.
5. غسل لوحات وفحص النشاط الإشعاعي
- تسمية أنابيب الطرد المركزي الدقيق لكل بئر (A1 إلى A6 ، B1 إلى B6 ... من خلال H1-H6). استخدم علامتين لونيتين مختلفتين لعينات رمز اللون إذا رغبت في ذلك - واحدة للآبار المطلية بالمستضد وواحدة للآبار التي تحتوي على BSA فقط.
- شفط rAb من كل بئر باستخدام شفاط فراغ.
- باستخدام ماصة متعددة القنوات ، أضف 300 ميكرولتر من مخزن الغسيل المؤقت إلى كل بئر. شفط المخزن المؤقت للغسيل. كرر الغسيل ما مجموعه خمس مرات.
- قم بتقسيم الآبار إلى أنابيب الطرد المركزي الدقيقة المناسبة.
- عد النشاط الإشعاعي في الأنابيب باستخدام عداد غاما. عد أولا الأنابيب التي تحتوي على المستضد (H1 ، H2 ، H3 إلى A1 ، A2 ، A3) ، ثم تلك التي تحتوي على BSA فقط (H4 ، H5 ، H6 إلى A4 ، A5 ، A6). لتقليل التداخل، قم بحساب معايير كل تخفيف بشكل منفصل (H std إلى A std) في وقت مختلف.
6. تحليل البيانات
ملاحظة: تحتوي الملفات التكميلية على جداول بيانات مقابلة وقوالب تحليل إحصائي لتحليل البيانات وتخطيطها.
- في جدول بيانات، احسب الربط الإجمالي والمحدد وغير المحدد لكل عينة (راجع قالب جدول البيانات المرفق كملف تكميلي).
- احسب "النشاط المقيد" كعدد في الدقيقة (CPM) للعينة (تم الحصول عليه من عداد غاما) مقسوما على CPM للمعيار المناسب. احسب "النسبة المئوية للحد" كنشاط مقيد مضروبا في 100.
- احسب "إجمالي الحد، مول/لتر" بضرب "٪ مرتبط" مع التركيز (مول/لتر) للراب المضاف. احسب "إجمالي الحد، مول" بضرب "إجمالي الحد، مول/لتر" مع حجم rAb المضاف باللتر (0.0001 لتر).
- احسب "الربط النوعي ، مول" عن طريق طرح "إجمالي الربط ، مول" من تخفيفات BSA من تخفيفات المستضدات بحيث يقترن A1 مع A4 ، A2 مع A5 ، A3 مع A6 ، B1 مع B4 ، إلخ.
- احسب "الربط غير المحدد ، مول" عن طريق طرح "الربط النوعي ، مول" من "الربط الكلي ، مول" لكل بئر.
- في برنامج رسم التحليل الإحصائي ، ارسم تركيز rAb المضاف (nmol / L) على المحور x مقابل الربط (mol) على المحور y. قم بإنشاء مجموعات منفصلة للرسم في الربط الكلي الثلاثي والربط المحدد والربط غير المحدد. قم بإجراء تحليل ملاءمة غير خطي عن طريق تحديد المعلمات التالية في البرنامج المستخدم (جدول المواد؛ انظر قالب التحليل الإحصائي المرفق كملف تكميلي).
- حدد تحليل جديد. ضمن تحليلات XY، حدد الانحدار غير الخطي (ملائمة المنحنى). تأكد من تحديد كافة البيانات ضمن تحليل مجموعات البيانات؟ ثم حدد موافق.
- على علامة التبويب نموذج ، ضمن ربط - تشبع، حدد موقع واحد - ربط محدد. في علامة التبويب الثقة ، حدد تحديد الملاءمة "الغامضة". اترك جميع المعلمات الأخرى افتراضية وحدد موافق.
ملاحظة: سيؤدي ذلك إلى حساب KD و Bmax للربط الإجمالي والمحدد وغير المحدد. K D للربط المحدد هو KD في nmol / L من rAb المرتبط بالمستضد.
النتائج
تحسب هذه الطريقة تقارب الربط (KD) ل rAb بناء على فحص ربط التشبع حيث تمت إضافة تركيزات مختلفة من rAb إلى كمية ثابتة من المستضد المجمد. يجب أن يتبع منحنى الربط النمو اللوغاريتمي حيث يكون حادا في البداية ثم الهضاب عندما يكون المستضد مشبعا. لضمان دقة KD المحددة ، يجب أن تكون تركيزات rAb عال?...
Discussion
كجزء من تطوير rAbs ، من المهم التأكد من ارتباط rAb على وجه التحديد بهدفه بتقارب ربط عال. يمكن أن يفيد تحديد تقارب الارتباط ما إذا كان التفاعل المناعي ل rAb يتأثر بالاقتران الإشعاعي من خلال اختبار التشبع الإشعاعي باستخدام مستضد مجمد. يمكن استخدام تحديد ارتباط rAb ب BSA لتحديد الارتباط غير المحدد لق?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
يشكر المؤلفون 3D Imaging على إنتاج [89Zr] Zr-oxalate والدكتورة شيري مورس في Janssen Pharmaceuticals لتوفير الأجسام المضادة.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved