JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
고정화된항원에 대한 방사성 표지된 항체의 결합 친화도 (KD) 결정
요약
여기에서, 고정화된 항원에 대한 방사성 표지된 항체의 결합 친화도(KD)를 결정하는 방법이 기재되어 있다. KD 는 다양한 농도에서 그의 항원에 대한 방사성 표지된 항체의 전체적, 특이적, 및 비특이적 결합을 측정함으로써 포화 결합 실험으로부터 결정될 수 있는 평형 해리 상수이다.
초록
결합 친화도(KD)를 결정하는 것은 방사성 표지된 항체 (rAb)의 특성화의 중요한 측면이다. 전형적으로, 결합 친화도는 평형 해리 상수, KD로 표시되고, 항체 결합 부위의 절반이 평형에서 점유되는 항체의 농도로서 계산될 수 있다. 이러한 방법은 임의의 방사성 표지된 항체 또는 다른 단백질 및 펩티드 스캐폴드로 일반화될 수 있다. 세포-기반 방법과 대조적으로, 고정화된 항원의 선택은 항체의 장기간 저장 후 결합 친화도를 검증하고, 이중특이적 항체 구축물에서 단편 항원 결합 영역 (Fab) 암의 결합 친화도를 구별하고, 상이한 세포주 사이의 항원 발현에 가변성이 있는지를 결정하는데 특히 유용하다. 이 방법은 고정된 양의 항원을 파손가능한 96-웰 플레이트 상의 지정된 웰에 고정시키는 것을 포함한다. 이어서, 비특이적 결합은 소 혈청 알부민(BSA)으로 모든 웰에서 차단되었다. 이어서, rAb를 모든 웰에 농도 구배로 첨가하였다. rAb가 포화에 도달할 수 있도록 농도의 범위, 즉 모든 항원이 rAb에 의해 연속적으로 결합되는 항체의 농도를 선택하였다. 항원이 고정화되지 않은 지정된 웰에서, rAb의 비특이적 결합이 결정될 수 있다. 고정화된 항원을 갖는 웰에서의 총 결합으로부터 비특이적 결합을 뺀 것으로써, 항원에 대한 rAb의 특이적 결합이 결정될 수 있다. rAb의 KD를 생성된 포화 결합 곡선으로부터 계산하였다. 예로서, 결합 친화도는 표피 성장 인자 수용체 (EGFR) 및 세포질 중간엽-상피 전이 (cMET) 단백질에 대한 이중특이적 항체인 방사성 표지된 아미반타맙을 사용하여 결정되었다.
서문
방사성 표지 항체 (rAb)는 의학에서 다양한 용도를 갖는다. 대다수가 종양학에서 이미징 및 치료제로 활용되지만, 류마티스학 관련 염증, 심장학 및 신경학에 대한 이미징 응용 프로그램이있습니다 1. 이미징 rAbs는 병변을 감지하는 데 높은 민감도를 가지며 치료 2,3,4,5에 대한 환자 선택을 도울 가능성이 있습니다. 그들은 또한 각각의 항원에 대한 특이성 때문에 치료에 사용됩니다. 테라노스틱스(theranostics)로 알려진 전략에서, 동일한 rAb가 이미징 및 치료6 둘 다에 사용된다.
이상적으로는, 방사성 표지를 위해 선택된 항체는 비방사성 표지 방법을 사용하여 높은 결합 친화도 및 특이성을 갖는 것으로 이미 입증된 것이다. 항체의 방사성 표지는 안정한 공유 결합 (예를 들어, 방사성 요오드)을 형성하는 방사성 핵종을 갖는 항체의 직접적인 화학적 변형을 통해 또는 후속적으로 방사성 금속 7,8에 배위되는 킬레이터와의 접합을 통해 간접적으로 달성 될 수 있습니다. 방사성 요오드와 같은 직접 방사성 표지는 항체 상의 티로신 및 히스티딘 잔기를 특이적으로 변형시킨다. 이들 잔기가 항원 결합에 중요하다면, 이 방사성 접합은 결합 친화도를 변화시킬 것이다. 반대로, 항체의 접합 및 간접 방사성 표지를 위한 다수의 확립된 프로토콜이 있다. 예를 들어, 항체의 PET 영상화를 위해 지르코늄-89 (89Zr)에 결합하는데 사용되는 일반적인 킬레이터는 p-이소티오시아네이토벤질-데스페리옥사민 (DFO)이며, 이는 항체 9,10의 리신 잔기에 랜덤하게 접합된다. 항원 결합 영역에 리신 잔기가 있는 경우, 이들 부위에서의 컨쥬게이션은 항원 결합을 입체적으로 방해할 수 있고, 따라서 항체-항원 결합을 손상시킬 수 있다. 따라서, 항체의 간접적 또는 직접 방사성 표지에 사용되는 상이한 방사성접합 방법은 잠재적으로 면역반응성에 영향을 미칠 수 있으며, 이는 항체 방사성접합체가 그의 항원(7,11)에 결합하는 능력으로 정의된다. 부위-특이적 컨쥬게이션 방법은 이러한 제한을 회피할 수 있지만, 이들 기술은 추가적인 시스테인 잔기 또는 탄수화물 잔기 12,13,14,15,16에 대한 효소 반응에 대한 전문 지식을 통합하기 위해 항체 공학을 필요로 한다. 일단 항체가 방사성 표지되면, 면역반응성이 rAb의 특성화의 일부로서 유지되는지를 시험하는 것이 중요하다. 면역반응성을 측정하는 한 가지 방법은 rAb의 결합 친화도를 결정하는 것이다.
이 프로토콜의 목적은 rAb-항원 결합을 정량화하기 위해 확립된 방사성리간드 포화 검정을 사용하여 rAbs에 대한 결합 친화도를 결정하는 과정을 기술하는 것이다. 결합 추세는 그림 1에 요약되어 있습니다. 결합된 항원의 양은 고정화된 항원의 고정된 양에 더 많은 rAb가 첨가됨에 따라 증가할 것이다. 일단 모든 항원-결합 부위가 포화되면, 고원에 도달할 것이고, 더 많은 rAbs를 첨가하는 것은 결합된 항원의 양에 아무런 영향을 미치지 않을 것이다. 이 모델에서, 평형 해리 상수(KD)는 항원 수용체17의 절반을 차지하는 항체의 농도이다. KD는 항체가 더 높은 결합 친화도에 상응하는 더 낮은 KD를 갖는 그의 표적에 얼마나 잘 결합하는지를 나타낸다. 이상적인 rAb는 18 나노몰이하의 KD를 가져야 한다는 것이 이전에 보고되었다. 그러나, 보다 최근의 rAbs는 낮은 나노몰범위의 KD와 함께 개발되었으며, 비침습적 이미징 응용(19,20,21,22)에 적합한 것으로 간주된다. rAbs의 방사성 리간드 포화 분석에서 결정될 수 있는 또 다른 파라미터는 항원 결합의 최대량에 상응하는Bmax이다. Bmax는 필요한 경우 항원 분자의 수를 계산하는데 사용될 수 있다.

그림 1: 대표적인 포화 결합 곡선. 결합된 항원의 백분율은 고정된 양의 항원에 첨가된 항체의 농도 증가에 대해 플롯팅된다. 팝 아웃은 다양한 지점에서 바인딩을 보여줍니다. KD 및Bmax에 상응하는농도 및 결합이 각각 도시되어 있다. 이 그림은 BioRender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이러한 분석은 방사성 표지된 이중특이적 항체 구축물이 그들의 각각의 항원과 결합하는 방사성 표지된 이중특이적 항체의 각각의 단편 항원 결합 영역 (Fab) 암에 대한 KD를 결정하기 위해 특히 중요하다. 이 프로토콜은 각각의 항원에 대한 각각의 Fab 아암의 결합 친화도가 방사성접합 후에 영향을 받았는지 여부를 독립적으로 특성화하기 위해 고정화된 항원 상에서 개별적으로 각각의 Fab 아암의 KD를 결정하는데 사용될 수 있다. 이 프로토콜은 표피 성장 인자 수용체 (EGFR) 및 세포질 중간엽 상피 전이 (cMET) 단백질19에 대한 이중특이적 항체인 방사성 표지된 아미반타맙의 사용에 의해 입증된다. 방사성 표지된 단일-아암 항체, 여기서 하나의 Fab 아암은 EGFR (α-EGFR) 또는 cMET (α-cMET)에 결합하고, 다른 Fab 아암은 이소형인 대조군이고, 또한 실시예19로서 사용되었다. 이 프로토콜은 또한 고정화될 수 있는 공지된 항원을 갖는 임의의 방사성 표지된 항체에 적합하다. 이 프로토콜에서, rAb의 희석 시리즈는 rAb의 각 Fab 암에 특이적인 지정된 웰 내의 고정화된 항원의 고정된 양에 첨가된다. rAb는 또한 항원 없이 소 혈청 알부민(BSA)으로만 차단된 웰에 첨가되어, 비특이적 결합을 결정한다. 특이적 결합을 결정하기 위해, 고정화된 항원에 대한 비특이적 결합은 총 rAb 결합에서 뺍니다. 이어서, 생성된 포화 결합 곡선은 전술한 바와 같이 KD를 결정하는데 사용된다.
이 방법의 한 가지 장점은 세포주를 항원의 공급원으로 사용하는 것에 비해 정제된 항원을 사용할 때 항원 발현 수준이 세포 배양 중에 영향을 받을 수 있고 상이한 세포주가 항원 발현의 가변 수준을 갖는다는 점을 고려할 때 재현성이 더 높다는 것이다. 방사성 표지된 이중특이적 항체의 경우에, 다른 항원 중 하나만을 발현하지 않고 단지 하나의 항원을 발현하는 세포주는 이용가능하지 않을 수 있고, 이는 개별 Fab 아암의 결합 친화도를 특성화하는 것을 매우 어렵게 만들 것이다. 주목할 만하게, 비방사성 표지된 방법에 비해 방사성 리간드 포화 분석 방법의 주요 이점은 rAb의 비접합 분획의 기여 없이 rAb의 결합 친화도의 특이적 특성화이다. 저자가 아는 한, 현재 rAb를 그의 모 접합되지 않은 항체로부터 분리하는 정제 기술은 없다. 킬레이터 및 방사성핵종의 비교적 작은 크기를 감안할 때, rAb의 전체 분자량에 대한 이들의 기여는 크기 배제 크로마토그래피에서 중요하지 않다. 따라서, 임의의 방사성 표지 기술로부터 생성된 생성물은 거의 항상 rAb 및 그의 모 접합되지 않은 항체의 혼합물이다. 방사성 표지된 포화 검정을 사용하여 결합 친화도를 특성화하면 테스트 중인 제품이 전적으로 rAb임을 확인할 수 있습니다.
프로토콜
참고: 프로토콜의 그래픽 표현은 그림 2 를 참조하십시오.
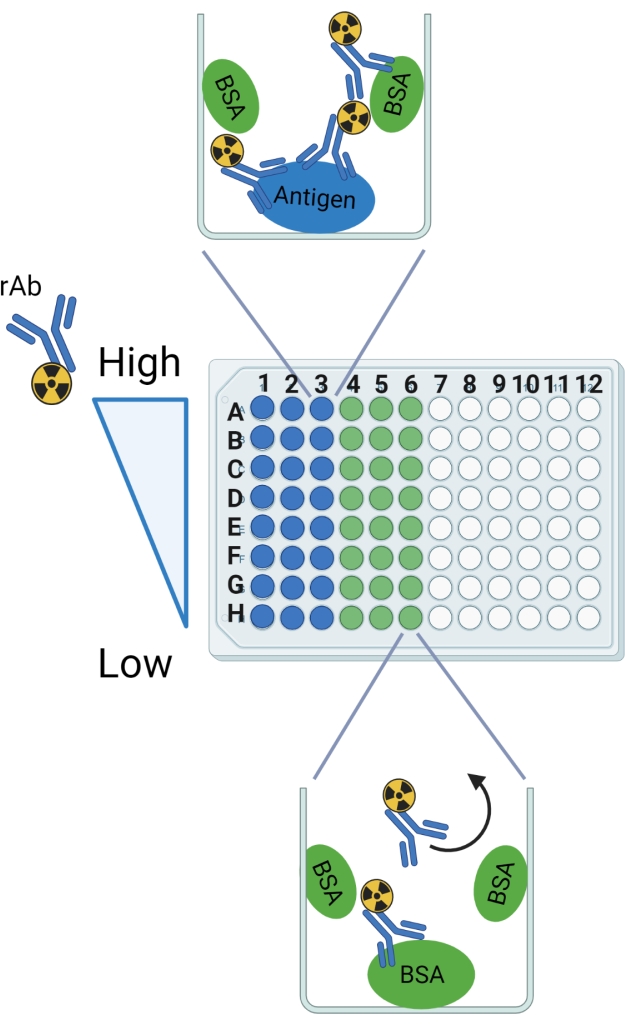
그림 2: 프로토콜의 회로도. 행 및 열 레이블은 파손 가능한 96웰 플레이트를 설정하기 위한 지침으로 표시됩니다. 예상되는 결합은 항원 및 BSA에 대한 예에서 잘 도시되어 있다. 곡선 화살표는 BSA로만 웰에서 세척될 것으로 예상되는 rAb를 나타냅니다. 이 그림은 BioRender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 완충액 준비
- 50 mL의 고정화 완충액(50 mMNa2CO3의 수용액; pH = 9.0)을 준비한다.
- 191 mg의 NaHCO3 및 23.9 mg의Na2CO3를 칭량 용지에 계량하고 50 mL 코니컬 튜브로 옮긴다. 40 mL의 18 MΩ 물과 와류를 첨가하여 용해시킨다. 18 MΩ 물로 총 부피를 50 mL로 가져오기 전에 필요한 경우 pH를 9.0으로 조정하십시오.
- 약 200 mL의 세척 완충액(0.05% Tween-20을 함유하는 인산완충식염수(PBS))을 200 mL의 PBS를 첨가한 다음 100 μL의 Tween-20을 250 mL 병에 첨가하여 제조하였다.
- 50 mL의 결합 완충액(0.05% Tween-20 및 0.1% 소 혈청 알부민(BSA)을 함유하는 PBS)을 준비한다.
- 칭량 용지에 BSA 50mg을 계량하고 50mL 코니컬 튜브로 옮깁니다. 50 mL의 PBS를 첨가한 다음 25 μL의 Tween-20을 튜브에 첨가한다. 부드럽게 혼합하기 위해 소용돌이.
- 블로킹 버퍼 50 mL(PBS 중 3% BSA)를 준비한다.
- 칭량 용지에 BSA 1.5g을 달아 50mL 코니컬 튜브로 옮깁니다. PBS 50 mL를 첨가하고, 부드럽게 와류하여 혼합한다.
참고: 최상의 결과를 위해 모든 버퍼는 4°C에서 최대 1주일 동안 보관하는 것이 좋습니다.
- 칭량 용지에 BSA 1.5g을 달아 50mL 코니컬 튜브로 옮깁니다. PBS 50 mL를 첨가하고, 부드럽게 와류하여 혼합한다.
2. 항원 고정화
- 고정화 완충액에 항원을 희석하여 5 μg/mL의 농도에 도달하십시오.
- 항원 웰당 100 μL를 8 x 3 어레이(A-H 행의 경우 1-3열)의 깨지기 쉬운 96웰, 평평한 바닥 플레이트의 24웰 바닥에 첨가한다. 씰링 테이프로 플레이트를 덮으십시오.
참고: 웰 플레이트의 표면이 혼합 소수성 및 친수성 도메인의 흡착을 최대화하기 위해 처리되었는지 확인하십시오. 이들 전처리된 플레이트는 상업적으로 입수가능하다. - 4°C에서 하룻밤 동안 인큐베이션한다.
- 다음날, 플레이트를 세척 완충액으로 3x 세척한다.
- 싱크대에서 플레이트를 활발하게 뒤집어 액체를 처분하고 종이 타월 더미에 접시를 두드려 과도한 액체를 제거하십시오.
- 다채널 피펫을 사용하여, 세척 완충액의 웰당 300 μL를 항원을 함유하는 웰에 첨가한다. 2.4.1에 설명 된대로 액체를 제거하십시오. 세척 단계를 총 세 번 반복하십시오.
3. BSA를 통한 비특정 사이트 차단
- 다중 채널 피펫을 사용하여, 웰당 300 μL의 블로킹 버퍼를 96-웰 플레이트의 24개의 항원 코팅 웰 및 24개의 빈 웰에 첨가한다(행 A-H의 경우 컬럼 1-6).
- 플레이트를 주변 온도에서 1시간 동안 인큐베이션한다.
- 플레이트를 웰 당 300 μL의 세척 완충액으로 총 3회 세척한다. 플레이트 세척에 대한 자세한 설명은 단계 2.4를 참조한다.
4. 연속 희석 및 rAb 용액의 첨가
주의: 다음 단계는 방사능과 관련이 있습니다. 단계는 방사선 안전 교육을받은 사람들 만 수행해야합니다. 연구원은 장갑을 두 배로 착용하고 적절한 차폐로 단계를 수행해야합니다.
- 선택의 방법을 사용하여 조사중인 rAb를 합성하십시오. 예로서 사용된 rAbs는 앞서19에 기재된 바와 같이 합성되었다.
참고: 이 프로토콜은 일단 방사성 표지된 rAb의 특성화에 초점을 맞춥니다. - 결합 완충액에서 rAb의 8 x 3배 연속 희석액(플레이트 상의 행 A-H에 대해 지정됨)을 만든다.
참고: 직렬 희석의 농도는 각 rAb에 따라 달라질 것이다. 자세한 내용은 토론 섹션에서 설명합니다. 희석 인자가 변하는 경우, 각 희석에 필요한 부피는 1) 각 웰에서 rAb의 결합, 2) 다음 희석을 시딩하고, 3) 감마 카운팅을 위한 rAb 표준 용액을 분취하여 각 웰에 첨가된 총 rAb의 방사능을 측정하기에 충분한 부피를 보장하기 위해 재계산되어야 한다.- 첫 번째 농도의 1.2 mL 용액을 만드는 데 필요한 스톡 rAb의 부피를 계산하십시오 ( A로 라벨).
- 800 μL의 결합 완충액을 B, C, D, ... H. 결합 완충액의 단계 4.2.1에서 계산된 부피를 뺀 1.2 mL를 A로 표지된 마이크로원심분리 튜브에 첨가한다.
- 4.2.1에서 계산된 스톡 rAb의 부피를 튜브 A에 첨가 한다. 소용돌이를 부드럽게 혼합한 다음 미니 마이크로 원심분리기를 사용하여 아래로 스핀다운하여 튜브 바닥의 모든 액체를 수집합니다.
- 튜브 A에서 튜브 B에 400μL를 첨가한다. 소용돌이를 섞은 다음 미니 마이크로 원심분리기를 사용하여 스핀 다운합니다. B에서 C로, C에서 D로, ..., G에서 H로 추가를 반복하십시오.
- 각 희석액의 웰당 100 μL를 항원으로 고정화된 세 개의 웰에 첨가하고, BSA로만 차단된 세 개의 웰에 첨가한다. 예를 들어, 희석 A 를 웰 A1-A3(항원) 및 A4-A6(BSA)에 첨가한다.
- 각 희석액의 100 μL를 A std - H std로 표지된 마이크로원심분리 튜브에 첨가한다. 이들 튜브를 감마 카운터에서 분석될 rAb 표준으로 저장하십시오.
- 플레이트를 부드럽게 흔들면서 37°C에서 1시간 동안 인큐베이션한다.
5. 세척판 및 방사능 분석
- 각 웰에 대한 마이크로 원심 분리기 튜브 라벨 (A1 ~ A6, B1 ~ B6 ... H1-H6을 통해). 원하는 경우 두 개의 서로 다른 컬러 마커를 사용하여 샘플을 색칠하십시오 - 하나는 항원으로 코팅 된 웰이고 다른 하나는 BSA가있는 웰에만 사용됩니다.
- 진공 흡인기기를 사용하여 각 웰로부터 rAb를 흡인한다.
- 다채널 피펫을 사용하여 300 μL의 세척 완충액을 각 웰에 첨가한다. 세척 완충액을 흡인한다. 세척을 총 다섯 번 반복하십시오.
- 웰을 적절한 마이크로 원심분리 튜브로 분해하십시오.
- 감마 카운터를 사용하여 튜브의 방사능을 계산합니다. 먼저 항원 (H1, H2, H3 내지 A1, A2, A3)을 가진 튜브를 카운트 한 다음 BSA 만 가진 튜브 (H4, H5, H6 내지 A4, A5, A6)를 계수하십시오. 간섭을 최소화하려면 서로 다른 시간에 각 희석(H std ~ A std)에 대한 표준을 별도로 계산합니다.
6. 데이터 분석
참고: 보충 파일에는 데이터를 분석하고 플로팅하기 위한 해당 스프레드시트 및 통계 분석 템플릿이 포함되어 있습니다.
- 스프레드시트에서 각 샘플에 대한 전체, 특정 및 비특이적 바인딩을 계산합니다(보충 파일로 첨부된 스프레드시트 템플릿 참조).
- "바운드 활성"을 샘플(감마 카운터로부터 얻음)의 분당 카운트(CPM)를 적절한 표준의 CPM으로 나눈 값으로 계산합니다. "% 바운드"를 바운드 활동 시간 100으로 계산합니다.
- "% Bound"에 첨가된 rAb의 농도(mol/L)를 곱하여 "Total Bound, mol/L"을 계산합니다. "총 경계, mol / L"에 리터 (0.0001 L)에 첨가 된 rAb의 부피를 곱하여 "총 경계, mol"을 계산하십시오.
- 항원 희석액에서 BSA 희석액의 "Total Bound, mol"을 빼서 A1이 A4, A2와 A5, A3과 A6, B1과 B4 등이 되도록 계산하십시오.
- 각 웰에 대한 "총 결합, mol"에서 "특정 결합, mol"을 빼서 "비특이적 결합, mol"을 계산하십시오.
- 통계 분석 플로팅 소프트웨어에서 x축에 추가된 rAb(nmol/L)의 농도와 y축의 결합(mol)을 플로팅합니다. 개별 그룹을 만들어 총 바인딩, 특정 바인딩 및 비특이적 바인딩을 세 배로 플롯합니다. 사용된 소프트웨어에서 다음 파라미터를 선택하여 비선형 적합도 분석을 수행합니다(표 자료; 보충 파일로 첨부된 통계 분석 템플릿 참조).
- 새 분석을 선택합니다. XY 분석에서 비선형 회귀(곡선 맞춤)를 선택합니다. 어떤 데이터 집합 분석에서 모든 데이터가 선택되어 있는지 확인한 다음 확인을 선택합니다.
- 모델 탭의 바인딩 - 채도에서 하나의 사이트 - 특정 바인딩을 선택합니다. 신뢰도 탭에서 '모호한' 적합도 식별을 선택합니다. 다른 모든 매개 변수를 기본값으로 두고 확인을 선택합니다.
참고: 이렇게 하면 전체, 특정 및 비특이적 바인딩에 대한KD 및 Bmax가 계산됩니다. 특이적 결합의 KD는항원에 결합된 rAb의 nmol/L 내의 KD이다.
결과
이 방법은 고정화된 항원의 고정된 양에 상이한 농도의 rAb가 첨가된 포화 결합 검정에 기초하여 rAb에 대한 결합 친화도(KD)를 계산한다. 결합 곡선은 처음에는 가파른 대수 성장을 따라야하며 항원이 포화됨에 따라 고원화되어야합니다. 결정된 KD가 정확하다는것을 보장하기 위해, rAb의 농도는 포화에 도달하기에 충분히 높아야 한다. 이 검정을 위해, 방사성 표지된 항체를 DFO에 접...
토론
rAbs 개발의 일부로서, rAb가 높은 결합 친화도로 그의 표적에 특이적으로 결합하도록 보장하는 것이 중요하다. 결합 친화도를 결정하는 것은 rAb의 면역반응성이 고정화된 항원을 사용하는 방사성리간드 포화 분석을 통한 방사성접합에 의해 영향을 받는지 여부를 알릴 수 있다. BSA에 대한 rAb 결합을 결정하는 것은 고정화된 항원에 대한 특이적 결합을 보다 정확하게 측정하기 위해 비특이적 결합을...
공개
저자는 이해 상충이 없습니다.
감사의 말
저자들은 [89Zr]Zr-oxalate의 생산에 대한 3D Imaging 및 Janssen Pharmaceuticals의 Sheri Moores 박사에게 항체를 제공 한 것에 대해 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
참고문헌
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유